烟酸诺氟沙星可溶性粉工艺验证实施记录
QY·--诺氟沙星胶囊工艺验证方案

XX制药有限公司技术标准分发单位经理办[]财务部[]质量部[]物质部[]人力资源部[]生产部[]设备动力部[]保卫·办公室[]总工办[]漯河南街村全威制药有限公司技术标准分发单位经理办[]财务部[]质量部[]物质部[]人力资源部[]生产部[]设备动力部[]保卫·办公室[]总工办[]目录1 主题内容 (1)2 适用范围 (1)3 职责 (1)4 内容 (1)4.1 背景 (1)4.2 相关文件 (2)4.2.1 生产及质量管理文件 (2)4.2.2 工艺验证相关清洁文件 (2)4.2.3 工艺验证相关设备文件 (2)4.3 术语与定义 (2)4.3.1 工艺过程验证 (2)4.3.2 验证方案 (2)4.3.3 生产系统要素 (2)4.3.4 生产工艺变量 (2)4.3.5 法定标准 (2)4.3.6 最差状态 (2)4.4 方案目标 (3)4.5 方案概要 (3)4.6 生产处方 (3)4.7 工艺流程图 (4)4.8 工艺验证 (5)4.8.1 工艺验证目标 (5)4.8.2 工艺验证方法 (5)4.8.3 生产系统要素的验证 (5)4.8.4 混合过程 (5)4.8.5 充填过程 (6)4.8.6 包装 (9)附表1感谢分享,浏览看了一下,总体来说还可以,但为了持续改进工艺验证方案的完整性,提以下几个建议:1、作为工艺验证方案,应当列入原辅料包材的质量标准和检验规程;2、标准一定要清楚写明,不能写符合规定,到底规定是什么?3、验证时间表以及支持的验证主计划;4、取样的描述,取样的频率必须要比正常商业化生产的时候高;5、验证应该包括模拟工艺中断,就类似于你模拟的最差条件;6、容器盖完整性,运输验证等都列入工艺验证方案临时想到这么多,想到了再继续补充有以下建议:1、没有确定验证周期2、没有最终评价报告3、没有对验证结果的评审一般应包括:1验证试验是否有遗漏2验证实施过程中对验证方案有无修改,修改原因,依据以及是否经过批准3验证记录是否完整4验证试验结果是否符合标准。
诺氟沙星胶囊生产工艺验证方案及报告

诺氟沙星胶囊生产工艺验证方案及报
告
1
2
工艺验证报告
3
* * * *制药厂
4
1概述
* * * *胶囊的工艺验证是在厂房、设备、公用设施的验证合格后,按既定的验证方案,分别在011001、011101、011102连续生产的三批产品中进行。
现将验证工作情况作以下报告。
2验证结果
2.1收料
2.1.1目的:确认该过程不影响原、辅料的质量。
2.1.2环境检查:
(1)生产场所的洁净级别,温、湿度符合有关要求。
(2)设备及场所具有清场合格证。
2.1.3结论:经验证该过程可保证物料的质量不受影响,验证记录见附件1。
2.2粉碎、过筛工序
2.2.1目的:确认该工序能够得到细度合格的物料。
2.2.2环境检查:
(1)生产场所的洁净级别,温、湿度符合有关要求。
(2)设备及场所具有清场合格证。
2.2.3结论:按方案进行验证,其结果表明该工序能够得到细度达140
目的原料细粉,验证记录见附件2。
5。
盐酸诺氟沙星生产工艺规程

题目盐酸诺氟沙星生产工艺规程编码:SC-GYGC-002-00起草人审核人批准人起草日期审核日期批准日期颁发部门质量部颁发数量4份生效日期接收部门质量部、生产部、生产车间、档案室共15页一、目的:建立盐酸诺氟沙星生产工艺规程,使生产规范化、标准化。
二、适用范围:适用于盐酸诺氟沙星的生产全过程。
三、责任者:车间生产人员负责实施,生产部、质量部负责监督。
四、正文:1.产品简介1.1产品名称:通用名:盐酸诺氟沙星汉语拼音名:Yansuan nuofushaxing化学名:1-乙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸盐酸盐。
•C6H5NO2分子式:C16H18FN3O3·C6H5NO2分子量:442.451.2理化性质:1.2.1性状:本品为类白色至淡黄色结晶性粉末;无臭,味微苦;在空气中能吸收水分,遇光色渐变深。
本品在水中易溶,在甲醇、二甲基甲酰胺中极微溶解,在乙醇中几乎不溶;在氢氧化钠试液中易溶,在冰醋酸中极微溶解。
1.2.2含量:按干燥品计算,含C16H18FN3O3·HCl不得少于98.1%。
1.3作用与用途:抗菌药。
用于革兰氏阴性和阳性细菌感染。
1.4贮藏:遮光,密闭,在干燥处保存。
1.5标准来源:《中国药典》2015年版、《中国兽药典》2015年版2. 生产工艺流程图及生产环境洁净区域划分图3. 操作过程及工艺条件其工艺路线为:75%乙醇 95%乙醇诺氟沙星+盐酸盐酸诺氟沙星粗品盐酸诺氟沙星成品3.1.合成3.1.1物料配比3.1.2质量监控员、岗位人员检查反应罐上各种阀门是否关好,设备是否正常、是否已清洁。
检查合格方可准备生产。
3.1.3合成岗位人员根据生产指令填写领料单领取物料,注意核对物料的品名、批号、数量等。
确认无误后,进行称量配料,处方计算和称量必须双人操作,一人称量、一人复核,并由质量监控员监督。
操作过程中,操作人员应及时填写记录。
诺氟沙星胶囊生产工艺验证方案及报告

01
确保原材料的纯度和粒度符合要求,是保证产品质量
的关键。
混合和压制过程
02 混合和压制过程需要严格控制温度、压力和时间等参
数,以确保获得均匀、稳定的胶囊产品。
Hale Waihona Puke 填充和包装过程03
填充和包装过程需要保证准确性和一致性,确保每个
胶囊都符合标准要求。
工艺流程图与SOP
工艺流程图
详细的工艺流程图应包括每个步骤的操作流程、参数标准和注意事项等。
。
时间表
02
根据计划,安排各个阶段的验证时间,确保按时完成。
实施步骤
03
包括文件准备、设备确认、模拟生产、数据收集与分析等环节
。
02
生产工艺流程梳理
工艺流程详细描述
1 2
原材料准备
采购合格的原材料,如诺氟沙星、淀粉、赋形剂 等。
粉碎与过筛
将原材料进行粉碎和过筛处理,以获得合适的粒 度和纯度。
3
混合
报告修订与改进
根据审核意见,对验证报告进行修订和完善 ,持续改进生产工艺。
05
支持材料与附件
工艺流程图
总结词
详细描述了诺氟沙星胶囊的生产工艺流 程,包括各个关键步骤和所需设备。
VS
详细描述
诺氟沙星胶囊的生产工艺流程包括原料验 收、配料、混合、制粒、干燥、整粒、总 混、包装等步骤。每个步骤都有详细的操 作说明和注意事项,并附有流程图和设备 清单。
目标
通过验证,证明生产工艺能够持续地生产出符合规格和质量标准的产品。
验证范围
生产工艺流程
从原料投入、混合、制粒、干燥到填充等各个 环节。
关键控制点
涉及工艺参数、设备运行状况、原辅料质量等 方面的监控。
烟酸诺氟沙星工艺验证方案范文

烟酸诺氟沙星工艺验证方案编号:TS-53-起草人:起草日期:审核人:审核日期:批准人:批准日期:药业有限公司目录一、目的 2二、范围 2三、验证小组的建立及职责 2四、验证计划与进度 3五、方案说明 3六、验证相关文件 4七、工艺流程图 5八、验证相关设备 6九、验证内容、评价方法及标准 6十、批量要求与进度要求 8十一、再验证周期 9十二、验证结论与建议 9十三、附件 10一、目的为评价烟酸诺氟沙星生产工艺规程的可行性和重现性,以及生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素,特根据GMP要求制定本验证方案,对其生产过程进行验证,以保证在正常的生产条件下,生产出质量合格、均一、稳定的烟酸诺氟沙星。
验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案变更申请及批准书(附件1),报验证小组批准。
二、范围本验证方案适用于本公司原料药烟酸诺氟沙星生产工艺的验证,适用于在本方案指定的厂房、设施、设备、工艺条件下乳酸环丙沙星的生产,当上述条件改变时,应重新验证。
三、验证小组的建立及职责本公司工艺的验证小组由以下人员组成:姓名验证职务公司职务职责总负责人总经理批准方案实施组长质量保证部部长审核方案成员化验主任负责样品测试付组长生产技术部部长制定验证方案并负责验证方案实施成员供销部部长负责物料采购成员设备管理员负责验证过程中的水电气的供应,以及设备的维护、保养。
成员车间质监员负责监督工作成员车间主任配合本实施方案成员操作工配合本实施方案成员操作工配合本实施方案成员操作工配合本实施方案四、验证计划及进度1、本验证方案对烟酸诺氟沙星生产工艺中有可能影响产品质量的关键工序进行验证,以证明在规定的工艺条件下,能始终如一生产出合格的产品。
由公司派相关部门人员与生产技术人员共同对本工艺进行连续三批产品验证。
具体时间如下:工艺验证时间:年月日至年月日五、方案说明1、所有对生产工艺有影响的关键仪器仪表装置、用于测量的仪表装置都是否经过校正。
2恩诺沙星可溶性粉生产工艺规程

目录1、产品概述2、处方依据3、工艺流程4、主要生产操作过程及工艺条件5、工艺卫生6、质量监控要点7、原辅材料、中间产品、包装材料、成品质量标准8、技术安全及劳动保护9、技术经济指标、消耗定额及计算公式10、主要设备及生产能力11、劳动组织、岗位定员与生产周期12、各工序物料平衡及计算方法13、常用理化常数、换算表14、附页目的:建立恩诺沙星可溶性粉工艺规程,保证其产品生产工艺符合标准要求。
范围:适用于恩诺沙星可溶性粉生产工艺管理。
职责:生产管理部负责人、质量管理部负责人、车间主任、工艺员、质监员。
1产品概述1.1 产品名称:恩诺沙星可溶性粉1.2 剂型:西药粉剂1.3规格:产品规格: 100g:恩诺沙星5g包装规格:200g/包×20包/箱1.4 说明:恩诺沙星可溶性粉为抗菌药,主要用于畜禽细菌和支原体感染。
2 处方及依据2.1处方:2.2依据:标准:农业部《兽药质量标准》二00三版批准文号:粤兽药字3. 生产工艺流程示意图3.1 恩诺沙星可溶性粉生产工艺流程一般生产区Array4 操作过程及工艺要求4.1领料4.1.1 车间生产技术员,根据生产指令的要求填写“生产领料单”,交领料人到仓库领取物料。
4.1.2 对所领的原辅料在车间脱外包间进行清洁,用吸尘机清洁外包装的粉尘后再进行脱外包装,不能脱外包装的进行必要的外包清洁方可进入车间物料传递处至车间物料暂存间。
4.1.3 对领取的原辅料进行核查。
核查所领的原辅料与本批次生产技术要求是否相符,要求详细复核原辅料名称、生产厂家、批号、规格、数量及原辅料是否有检验合格证并进行物理外观的检查(主要是检查是否有受潮、变色、黑点、杂质、异味等)。
4.1.4 填写领料记录。
4.2 粉碎4.2.1 粉碎前应先核对药材标签的品名、规格、数量。
4.2.2 开机前先对各部件进行检查,注意检查筛网有无破损。
再开机空转1~2分钟检查设备仪器、仪表操作情况。
4.2.3 操作时,注意进料量和进料速度要均匀,不宜太多或太少,太快或太慢,保证粉碎的正常连续进行。
烟酸诺氟沙星注射液配方和工艺的初步研究

G 如金 黄葡 萄 球 菌 也 有 好 的 疗效 , 抗 菌 活 性优 其
于萘 啶酸 和 吡哌 酸 , 要用 于 敏感 菌 引 起 的猪 、 主 鸡 肠道 和 泌 尿道 感 染 , 仔猪 黄 痢 、 如 白痢 及鸡 大 肠 杆 菌病 、 白痢 等 … 。 鸡 目前 , 酸诺 氟沙 星的上 市销 售制 剂 包括 注 射 烟
氏菌 、 氏杆 菌 及绿 脓 杆菌 的抗 菌 活性 均 较 强 , 巴 对
浴锅 ( 北京 中兴伟业仪器有 限公 司) P S C型 , H 一3
精密酸度计 ( 海理 达 仪器 厂 )Y Ⅱ 澄 明度检 上 ,B一 型
测仪 ( 天津光学仪器 厂 )Y Q—L 5 SI ,X S一 0 I 立式 压力 蒸汽灭菌器 ( 上海博 迅实业 有限公 司医疗设备 厂) 。 12 试 药 . 烟 酸 诺 氟 沙 星对 照 品 ( 量 9 . % , 含 90 批 号 H 9 5 3 中 国兽 医药 品监察 所 ) 烟 酸诺 氟 沙 000 , ;
[ 键词 ] 烟 酸诺 氟沙星注 射液 ; 关 配方 ; 工艺
Pr l i a y St y o t e c i in n o c in c noo y ei n r ud n he Pr s rpto a d Pr du to Te h l g m
o r o a i c t aeIjcin f No f x cnNioi t net l n o
2 Z eghuC lg nn ubn r E gnei Z egh u40 1 ; hn ) . hnzo oeefA i H sa d n i r g,hnzo 50 C ia l o ml y e n 1
Absr c :I r e o o ti h p i m r s rp in a d p o cin t c n lg t a t n o d rt b an t e o tmu p e ci to n r du to e h o o y,t e p e a a in o ofo a i h r p r t f n r x cn o l
乳酸诺氟沙星可溶性粉(成品)检验记录
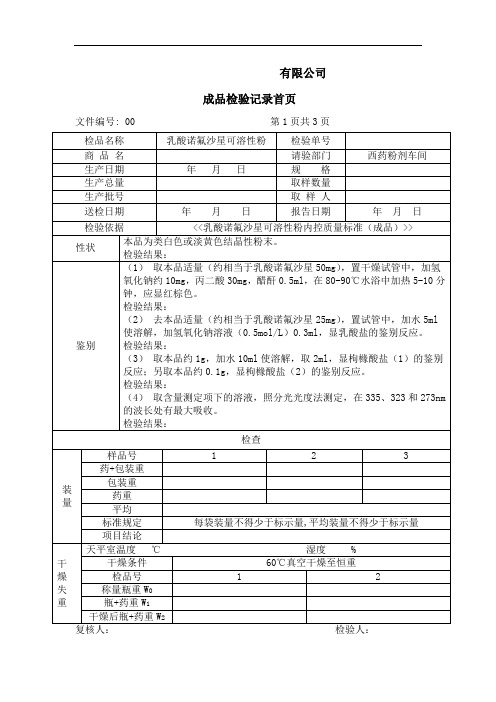
取诺氟沙星对照品约50mg,精密称定,同上法制得。
计算结果:根据二者吸收度的比值计算,并将计算结果乘以1.28,即得.
样品编号
内容
1
2
样品取量VS(g)
样品吸收度AS
对照品取量Wc
对照品吸收度Ac
计算公式: X= AS*Wc*N*1.28/VS*S*Ac
N(对照品含量)= S=5%
样品百分含量
检验结论:
本品按<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>检验,结果规定。
备注:
负责人: 复核人: 检验人:
有限公司
成品检验报告单
文件编号:00第3页共3页
检品名称
乳酸诺氟沙星可溶性粉
检验单号
商 品 名
请验部门
西药粉剂车间
生产日期
年 月 日
规 格
生产总量
取样数量
生产批号
取 样 人
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>
检验项目 标准规定 检验结果 项目结论
(4)在335、323、273nm
波长处有最大吸收规定
(3)、检查
1.干燥失重 不得过10.0%规定
2.装量 应符合规定规定
3. 含量测定:
含乳酸诺氟沙星应为
标示量的92.0%~108.0% 规定
检验结论:
本品按<<乳酸诺氟沙星可溶性粉内控质量标准(成品)>>检验,结果规定。
备注:
负责人: 复核人: 检验人:
年 月 日
规 格
生产总量
恩诺沙星粉验证方案

1.目的:为评价恩诺沙星可溶性粉生产系统要素和生产过程中可能影响产品质量的各种生产工艺变量,特根据GMP要求制定本验证方案,对其整个生产过程进行验证,以保证在正常的生产条件下,连续3批(至少)生产出质量合格、均一、稳定的产品。
2.范围:本验证方案适用于在新厂房、新设施、设备,新工艺条件投入使用前的恩诺沙星可溶性粉工艺验证。
3.职责:生产技术部负责验证方案的具体实施。
物资供应部负责验证所需物料的供应。
工程设备部负责保证设备处于完好状态,负责组织试验所需仪器、设备的验证,负责仪器、仪表、量具等的校正,负责设备的维护保养。
质量管理部QC负责各项目检测。
质量管理部QA负责协调组织各项验证工作。
工艺验证小组负责审阅验证记录,进行分析、评价。
验证领导小组组长负责验证方案的批准。
4.有关背景材料4.1.产品概况:恩诺沙星可溶性粉为抗菌药,主要用于畜禽细菌和支原体感染。
性状:本品为类白色或淡黄色结晶性粉末。
规格: 100g: 恩诺沙星2.5g包装规格: 100g/包×100包/箱类别:氟喹诺酮药用法与用量:每1L水鸡25~75 mg(以恩诺沙星计)一日2次连用3~5天贮藏:遮光,密封,在干燥处保存。
有效期:二年生产工艺流程图4.2.生产厂房(一般生产区)恩诺沙星可溶性粉生产厂房按一般生产区设置,但厂房设施的要求应参照洁净生产区的标准,现场检查确认粉剂车间生产厂房应符合下列标准。
检查记录4.3.设备生产用的主要设备均经安装、运行和性能确认,符合生产工艺的要求。
4.4.相关文件、规程检查并确认下述文件已制订完毕,且签字下发:5.验证项目、评价方法及标准5.1.人员列出参加验证的生产操作及检验的所有人员名单,评价其培训及健康检查情况是否符合GMP 及操作的要求。
(列出所有生产操作人员和检验人员的名单,并注明体检和培训情况)5.1.1.培训查阅培训档案,确认是否对有关操作者进行了相关培训,包括:—兽药GMP及管理法规培训—安全防护规程—所在岗位相关设备的操作、清洁、维修保养规程—恩诺沙星可溶性粉生产工艺规程培训—岗位标准操作规程培训5.1.2.健康检查查阅生产操作人员健康档案,考察参加生产操作的所有人员是否进行了体检,各项指标正常,身体健康,体检检查结果在有效期内。
诺氟沙星胶囊生产工艺规程
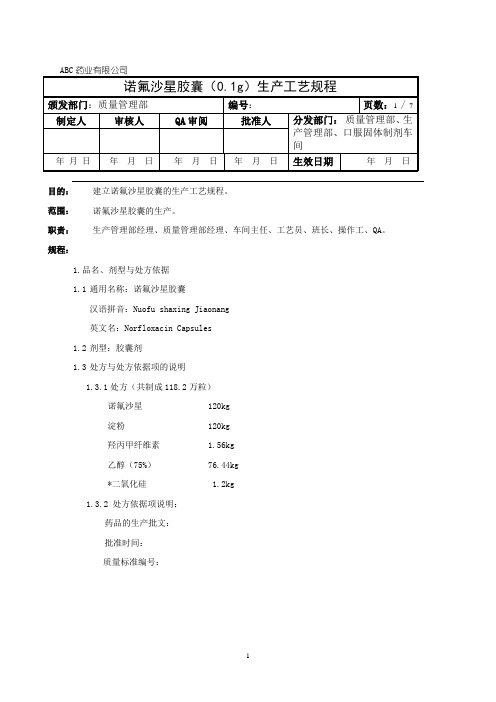
目的:建立诺氟沙星胶囊的生产工艺规程。
范围:诺氟沙星胶囊的生产。
职责:生产管理部经理、质量管理部经理、车间主任、工艺员、班长、操作工、QA。
规程:1.品名、剂型与处方依据1.1通用名称:诺氟沙星胶囊汉语拼音:Nuofu shaxing Jiaonang英文名:Norfloxacin Capsules1.2剂型:胶囊剂1.3处方与处方依据项的说明1.3.1处方(共制成118.2万粒)诺氟沙星 120kg淀粉 120kg羟丙甲纤维素 1.56kg乙醇(75%) 76.44kg*二氧化硅 1.2kg1.3.2 处方依据项说明:药品的生产批文:批准时间:质量标准编号:2.生产工艺流程:←→ ↓→↓←↓ ←→← →↓←→一般生产区 三十万级生产区3.生产工艺操作与工艺技术参数中关键的注意事项: 3.1操作过程与生产过程质量控制: 3.1.1配料工序:● 按SOP-MN/G-001-00原辅料处理岗位标准操作规程要求对主药、淀粉分别进行过60筛粉碎处理,二氧化硅过80目筛,放备料间备用。
● 按SOP-MN/G-003-00粘合剂配制岗位标准操作规程制备粘合剂(2%羟丙甲纤维素液):取处方量羟丙甲纤维素,加入75%的乙醇到规定量,浸泡约12-16小时,过胶体磨,即得。
● 将处理好的主药、淀粉准确称量,按SOP-MN/G-004-00湿法制粒岗位标准操作规程,分9料分别置于湿法混合制粒机的搅拌锅中,按SOP- EQ/G-005-00 HLSG110型湿法混合颗粒机标准操作规程开动搅拌桨和切碎刀运作两分钟后加入适量粘合剂,将软材切割成均匀的湿颗粒(约七分钟)。
●按SOP-MN/G-005-00干燥岗位标准操作规程,湿颗粒置于热风循环干燥柜,按SOP-EQ/G-006-00 FL-IIIA热风循环干燥柜标准操作规程,开启蒸汽阀、风机,箱内温度控制在60-70℃之间,约为4.5小时。
干燥过程中每两小时翻粉一次,收粒时水份应控制小于3%。
乳酸诺氟沙星可溶性粉检验记录

######制药有限公司批检验记录品名规格批号审核人批准人年月日半成品检验记录【性状】本品为粉末。
【检查】外观均匀度取供试品适量,置光滑纸上,平铺约5cm2,将其表面压平,在亮处观察,结果:。
干燥失重取本品,在60℃真空干燥至恒重,减失重量不得过8.0%(附录78页)。
结果见附页。
溶解性取供试品适量,置纳氏比色管中,加水制成50ml的溶液(浓度为临床使用时高剂量浓度的2倍),在25℃+2℃上下翻转10次,供试品,静置30分钟,结果:。
检验人:复核人:干燥失重检验记录检验人:复核人:成品检验记录【性状】本品为粉末。
【鉴别】(l)取本品适量(约相当于乳酸诺氟沙星50mg ),置干燥试管中加氢氧化钠约10mg,丙二酸30mg,醋酐0.5ml,在80~90℃水浴中加热5~10 分钟,应显红棕色。
(2)取本品适量(约相当于乳酸诺氟沙星25mg),置试管中,加水5ml使溶解,加氢氧化钠液〔0.5mol/L )0.3ml,显乳酸盐的鉴别反应(附录23页)。
(3)取本品约lg,加水10ml,使溶解,取2ml,显枸橼酸盐(l)的鉴别反应(附录23页);另取本品约0.1g,显枸橼酸盐(2)的鉴别反应(附录23页)。
(4)取含量测定项下的溶液,照紫外-可见分光光度法(附录26页)测定。
在335、323和 273nm的波长处有最大吸收。
【检查】外观均匀度取供试品适量,置光滑纸上,平铺约5cm2,将其表面压平,在亮处观察,结果:。
干燥失重取本品,在60℃真空干燥至恒重,减失重量不得过8.0%(附录78页)。
结果见附页。
溶解性取供试品适量,置纳氏比色管中,加水制成50ml的溶液(浓度为临床使用时高剂量浓度的2倍),在25℃+2℃上下翻转10次,供试品,静置30分钟,结果:。
装量按最低装量检查法(附录119页)检查,应符合规定。
(袋+样)重(g)空袋重(g)样重(g)平均装量(g)(规定平均装量不少于标示装量,每袋装量不少于标示装量的97%)【含最测定】取本品适量(约相当于乳酸诺氟沙星64mg) ,精密称定,置200ml量瓶中,加0.1mol/L氢氧化钠液振摇使溶解并稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用0.1mol/l氢氧化钠液稀释至刻度,摇匀。
诺氟沙星检验标准操作规程
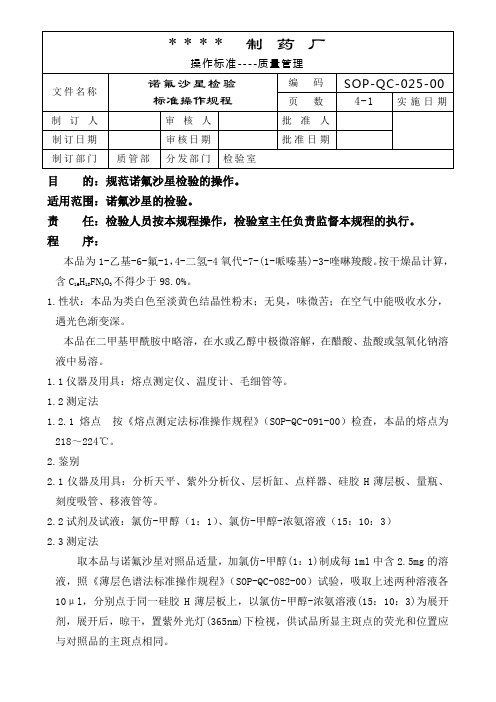
目的:规范诺氟沙星检验的操作。
适用范围:诺氟沙星的检验。
责任:检验人员按本规程操作,检验室主任负责监督本规程的执行。
程序:本品为1-乙基-6-氟-1,4-二氢-4氧代-7-(1-哌嗪基)-3-喹啉羧酸。
按干燥品计算,含C16H18FN3O3不得少于98.0%。
1.性状:本品为类白色至淡黄色结晶性粉末;无臭,味微苦;在空气中能吸收水分,遇光色渐变深。
本品在二甲基甲酰胺中略溶,在水或乙醇中极微溶解,在醋酸、盐酸或氢氧化钠溶液中易溶。
1.1仪器及用具:熔点测定仪、温度计、毛细管等。
1.2测定法1.2.1熔点按《熔点测定法标准操作规程》(SOP-QC-091-00)检查,本品的熔点为218~224℃。
2.鉴别2.1仪器及用具:分析天平、紫外分析仪、层析缸、点样器、硅胶H薄层板、量瓶、刻度吸管、移液管等。
2.2试剂及试液:氯仿-甲醇(1:1)、氯仿-甲醇-浓氨溶液(15:10:3)2.3测定法取本品与诺氟沙星对照品适量,加氯仿-甲醇(1:1)制成每1ml中含2.5mg的溶液,照《薄层色谱法标准操作规程》(SOP-QC-082-00)试验,吸取上述两种溶液各10μl,分别点于同一硅胶H薄层板上,以氯仿-甲醇-浓氨溶液(15:10:3)为展开剂,展开后,晾干,置紫外光灯(365nm)下检视,供试品所显主斑点的荧光和位置应与对照品的主斑点相同。
3.检查3.1仪器及用具:分析天平、高效液相色谱仪、C 色谱柱、数据处理机、进样器、量瓶、移液管、刻度吸管、过滤器、锥形瓶、量筒、干燥箱、马弗炉、坩埚、称量瓶、纳氏比色管、干燥器等。
3.2试剂及试液:氢氧化钠试液、2号浊度标准液、0.1mol/L 盐酸溶液、纯化水、0.025mol/L 磷酸溶液-乙腈(87:13)、醋酸盐缓冲液(PH3.5)、硫代乙酰胺试液、标准铅溶液。
3.3测定法3.3.1溶液的澄清度 取本品0.5g ,加氢氯化钠试液10ml 溶解后,溶液应澄清:如显浑浊,与2号浊度标准液,按《澄清度检查法标准操作规程》(SOP-QC-090-00)比较,不得更浓。
烟酸诺氟沙星溶液工艺规程

烟酸诺氟沙星溶液工艺规程XXXX有限公司目录1、产品概述2、处方和依据3、工艺流程图4、常用原辅料质量标准及依据5、操作过程及工艺条件6、质量控制要点及成品质量标准7、设备一览表8、技术经济指标计算9、技术安全、劳动保护和工艺卫生10、半成品检验方法及控制11、劳动组织与岗位定员12、储存13、综合利用和环境保护1 产品概述1.1 产品名称、剂型及规格1.1.1 产品名称:烟酸诺氟沙星溶液1.1.2 剂型:口服溶液剂1.1.3 规格:100ml/瓶1.2 作用与用途:用于治疗鸡的细菌性疾病和支原体感染。
1.3 用法与用量:混饮:预防,每1L水鸡10ml,连用3~5日;治疗,每1L水,鸡50ml,一日1次,连用3~5日。
1.4 批准文号:2 处方和依据产品处方:烟酸诺氟沙星 2 kg纯化水加至100L依据:《兽药国家标准(化学药品、中药卷)第一册》3 工艺流程图配料:主要成分:计划生产量×配方含量÷干燥品物质含量生产总量=烟酸诺氟沙星+纯化水量4 常用原辅料质量标准及依据4.1 原料质量标准、内控质量标准及依据4.1.1 烟酸诺氟沙星质量标准、内控质量标准及依据4.1.1.1 烟酸诺氟沙星质量标准依据:《兽药国家标准(化学药品、中药卷)第一册》正文:名称:烟酸诺氟沙星代号:规格:25kg/桶分子式:C16H18FN3O3·G6H5NO2分子量:442.45本品为1-乙基-6-氟-4氧代-1,4二氢-7-(1-哌嗪基)-3-喹啉羧酸烟酸盐。
按干燥品计算,含C16H18FN3O3·C6H5NO2不得少于98.0%。
【性状】本品为类白色或淡黄色结晶性粉末;无臭,味微苦,遇光色变深。
本品在水中溶解,在乙醇中微溶,在乙醚中不溶。
熔点本品的熔点(附录51页)为220~227℃。
【鉴别】(1)取本品约50mg,置干燥试管中,加丙二酸约30mg,醋酐0.5ml,在80~90℃水浴中加热5~10分钟,即显红棕色。
烟酸诺氟沙星注射液配方和工艺的初步研究

烟酸诺氟沙星是诺氟沙星的烟酸盐, 属于第三 代氟喹诺酮类广谱抗菌药, 对 G - 如大肠杆菌、沙门 氏菌、巴氏杆菌及绿脓杆菌的抗菌活性均较强, 对 G+ 如金黄葡萄球菌也有好的 疗效, 其抗菌活性优 于萘啶酸和吡哌酸, 主要用于敏感菌引起的猪、鸡 肠道和泌尿道感染, 如仔猪黄痢、白痢及鸡大肠杆 菌病、鸡白痢等 [ 1 ] 。
作者简介: 杨灵杰 ( 1982年 - ) , 从事药物新制剂的研究与开发。 E- ma i:l yang ling jie@ 126. com 通讯作者: 张国祖, 教授。 E- m ai:l zhangguozu@ 126. com
2010, 44( 12): 20~ 22, 38 /杨灵杰, 等
Abstract: In order to obta in the optim um prescription and production technology, the preparat ion of norfloxac in nico tinate in jection w as investigated by orthogonal experim en.t T he opt imum cond itions for norfloxacin nico tinate in ject ion w ere as fo llow ing: 0. 15% NaH SO3, 0. 05% EDTA - 2Na, 0. 05% act ive carbon, pH value o f 6. 0, sterilized for 30 m inutes at 115 . K ey w ord s: norfloxacin n icot inate injection; prescript ion; product ion techno logy
SOP-QC 诺氟沙星检验操作规程

诺氟沙星检验操作规程1. 目的建立诺氟沙星检验标准操作规程,使诺氟沙星检验操作规范化。
2. 范围适用于诺氟沙星的质量检验。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(第1431页)。
5.1.2 诺氟沙星质量标准(质量标准编号:)。
5.1.3 《中国药典》2020年版四部。
5.2 性状本品为类白色至淡黄色结晶性粉末;无臭;有引湿性。
本品在N,N-二甲基甲酰胺中略溶,在水或乙醇中极微溶解;在醋酸、盐酸或氢氧化钠溶液中易溶。
5.3 熔点仪器与器具:熔点测定仪、毛细管。
取干燥失重项下的本品适量,置熔点测定用毛细管中,轻击管壁或借助长短适宜的洁净玻璃管,垂直放在表面皿或其他适宜的硬质物体上,将毛细管自上口放入使自由落下,反复数次,使粉末紧密集结在毛细管的熔封端。
装入供试品的高度约为3mm。
依熔点测定操作规程操作,记录供试品在初熔至终熔时的温度,重复测定三次,取其平均值,既得。
本品的熔点应为218~224℃。
5.3 鉴别在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.4 检查5.4.1溶液的澄清度仪器与试剂:电子天平、氢氧化钠试液、2号浊度标准液。
取本品5份,各0.50g,分别加氢氧化钠试液10ml溶解后,溶液应澄清;如显浑浊,与2号浊度标准液(澄清度检查法标准操作规程第一法)比较,均不得更浓。
5.4.2有关物质仪器与试剂:高效液相色谱仪、电子天平、杂质A对照品、诺氟沙星对照品、环丙沙星对照品、依诺沙星对照品、乙腈、0.1mol/L盐酸溶液、0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0±0.1)。
照高效液相色谱法(高效液相色谱法标准操作规程)测定。
供试品溶液取本品适量,精密称定,加0.1mol/L盐酸溶液适量(每12.5mg诺氟沙星加0.1mol/L盐酸溶液1ml)使溶解,用流动相A定量稀释制成每1ml中约含0.15mg的溶液。
烟酸诺氟沙星可溶性粉水溶液稳定性试验

烟酸诺氟沙星可溶性粉水溶液稳定性试验
许世富;朱良强
【期刊名称】《中国兽药杂志》
【年(卷),期】2000(034)001
【摘要】观察烟酸诺氟沙星可溶性粉水溶液放置在不同的条件下40d,对其进行紫外吸收峰鉴别及含量测定,同时用高效液相法作对比试验,结果发现,40d中在271、323、335nm处均有最大吸收,无杂质峰出现含量没有变化。
【总页数】3页(P27-29)
【作者】许世富;朱良强
【作者单位】安徽省兽药饲料监察所;安徽省兽药饲料监察所
【正文语种】中文
【中图分类】S859.79
【相关文献】
1.乳酸环丙沙星可溶性粉水溶液稳定性试验 [J], 孙聪;韩业超;冯泽;胡硕宗;吴彤;唐守贤
2.阿莫西林可溶性粉在水溶液中的稳定性试验 [J], 张传斌;赖红玲;王佳宁;冉顶诗
3.兽用烟酸阿莫西林可溶性粉的安全性试验 [J], 孟冬霞;武果桃;任杰;卫顺生;孟帆;赵娟;马政禹;刘晓东;夏艳婷
4.兽用烟酸阿莫西林可溶性粉对副猪嗜血杆菌病的治疗试验 [J], 孟冬霞;刘晓东;武果桃;任杰;卫顺生;马政禹;赵娟;夏艳婷
5.烟酸阿莫西林可溶性粉在猪体内血药浓度测定和药代动力学试验 [J], 武晋孝;刘晓东;孟冬霞;武果桃;任杰;卫顺生;赵娟;孟帆;闫益波
因版权原因,仅展示原文概要,查看原文内容请购买。
烟酸诺氟沙星注射液配方和工艺的初步研究

烟酸诺氟沙星注射液配方和工艺的初步研究
杨灵杰;张国祖;李荣誉;王海蓝
【期刊名称】《中国兽药杂志》
【年(卷),期】2010(044)012
【摘要】通过正交试验设计,研究确定烟酸诺氟沙星注射液的最佳配方和生产工艺.结果表明,最佳配方为NaHSO3 0.15%、EDTA-2Na 0.05%、活性炭0.05%、pH 值调节在6.0,灭菌温度控制在115℃、时间30 min,制备的烟酸诺氟沙星注射液产品符合标准规定.
【总页数】4页(P20-22,38)
【作者】杨灵杰;张国祖;李荣誉;王海蓝
【作者单位】河南省康星药业有限公司,河南,中牟,451464;郑州牧业工程高等专科学校,郑州,450011;郑州牧业工程高等专科学校,郑州,450011;河南省康星药业有限公司,河南,中牟,451464
【正文语种】中文
【中图分类】S859.796
【相关文献】
1.两广二号小蚕用人工饲料配方及制作工艺的初步研究 [J], 崔萍;安慧;谢成荣
2.复方烟酸诺氟沙星注射液的体外抗菌活性研究 [J], 严其顺;王慧;尹德明;李耀;孙志良
3.复方烟酸诺氟沙星注射液体外抑菌作用及对仔猪黄白痢疗效研究 [J], 江超;匡光伟;孙志良;文扬;蒋能辉;董燕德
4.虾片饲料双滚筒干燥生产工艺及初步配方筛选的研究 [J], 吴格天;徐子伟;许梓荣
5.生产堆乏燃料后处理厂高放废液铸石固化工艺及配方的初步研究 [J], 程理;杜大海;龚立;张英萍;张吉富;赵湘林;孙先荣
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1
5%烟酸诺氟沙星可溶性粉工艺验证实施记录
一、验证进度安排:
本验证试验连续进行3批,将具体的生产周期及生产日期确定为:
第一批年月日
第二批年月日
第三批年月日
二、参加工艺验证人员分工确认:
人员分工:本次验证由生产管理部经理组织实施,车间主任、设备管理员及质量部QA、QC一起参与,车间操作工协助。
所有参与人员签名如下:
组织者:
参与人员:
三、有关背景材料确认(符合要求在□内划“√”,不符合规定划“×”):(一)、人员培训情况确认:
查阅所有参加验证人员的培训档案,确定以下内容:
1、参加验证人员是否参加了再验证方案所规定的所有培训□
2、所有人员的所有培训课目是否合格□
3、考试试题上的分数与考核结果统计表上的分数是否一致□
确认人:日期:复核人:日期:
(二)、人员健康检查情况确认:
1、参加验证人员是否都参加了所规定项目的健康检查□
2、所有参加验证人员体检结果是否合格□
确认人:日期:复核人:日期:
(三)生产环境及设备清洁情况确认(三批都需确认):
1、所有的操作间是否没有与此次验证生产无关的物料及文件□□□
2、所有的操作间是否已清洁合格,并签发相应的状态牌及清场合格证□□□
3、所有的设备是否已清洁合格,并挂有相应的状态牌□□□
4、所有的容器工具是否已清洁合格,并挂有相应的状态牌□□□
确认人:日期:复核人:日期:
(四)原辅料、包装材料质量状况确认:
1、所用原料、辅料、包装材料名称及检验(合格)报告单号:
烟酸诺氟沙星:
无水葡萄糖:
纯铝袋:
2、所有的物料贮存条件是否符合要求□
确认人:日期:复核人:日期:
(五)相关文件确认:
1、方案中规定的所有文件是否齐全□
2、方案中规定的所有文件是否为现行文本,并已正确签发□
确认人:日期:复核人:日期:
(六)其他再验证情况确认:
1、方案中规定的再验证项目是否已实施□
2、方案中规定的再验证项目的验证结果是否合格□
确认人:日期:复核人:日期:
四、生产工艺过程再验证
(一)粉筛工艺过程验证
1、粉碎机生产能力确认:(以无水葡萄糖的粉碎计算,每批粉碎量: kg)批号:开始时间:结束时间:测定人:
批号:开始时间:结束时间:测定人:
批号:开始时间:结束时间:测定人:
平均生产能力: kg/h 是否符合要求?□
2、粉筛物料粒度检查记录:(全部能通过80目筛)
(1)品名:5%烟酸诺氟沙星可溶性粉批号:日期:
(2)品名:5%烟酸诺氟沙星可溶性粉批号:日期:
(3)品名:5%烟酸诺氟沙星可溶性粉批号:日期:
3、粉碎、过筛工序物料平衡(物料平衡范围:98%-100% ):
4、验证分析与建议:
车间主任:分析与建议日期:
5、验证评价与结论:
生产技术部经理:评价与结论日期:
(二)称量配料工艺过程验证(三批):
1、记录是否有双人复核签名□□□
2、物料的名称、规格、批号、数量及标签是否正确无误□□□
3、物料平衡是否为100%(是否100%投料)□□□
4、验证分析与建议:
车间主任:分析与建议日期:
5、验证评价与结论:
生产技术部经理:评价与结论日期:
(三)混合工艺过程验证
1、中间产品含量及含量均匀度检测记录:(附含量均匀度检测记录)
标准:含烟酸诺氟沙星应为标示量的92.0%~108.0%。
(1)品名:5%烟酸诺氟沙星可溶性粉批号:日期:测定人:
测定人:
测定人:2、混合工序物料平衡(物料平衡范围: 98%-100% ):
3、验证分析与建议:
车间主任:分析与建议日期:
4、验证评价与结论:
生产技术部经理:评价与结论日期:
(四)分装封口工艺过程验证
1、装量及封口气密性检查记录(平均装量不少于250g,装量范围250g±5g)(1)品名:5%烟酸诺氟沙星可溶性批号:日期:测定人:
2、分装工序物料平衡(物料平衡范围: 99%-100% ):
3、验证分析与建议:
车间主任:分析与建议日期:
4、验证评价与结论:
生产技术部经理:评价与结论日期:
(五)外包装工艺过程验证:
1、查批包装记录, QA在外包岗位进行抽查产品外观是否合格格□□□
2、每批产品成品质量检验是否合格(附三批产品检验报告)□□□
3、三批外包装的产品物料平衡及标签物料平衡是否为100%。
□□□
4、验证分析与建议:
车间主任:分析与建议日期:
5、验证评价与结论:
生产技术部经理:评价与结论日期:五、批质量评价(验证总结论):
质量保证部经理:评价日期:
六、再验证周期确认:
生产技术部经理:确认日期:。
