10 常见的物质
【初中化学】常见物质的颜色

22、蓝色:铜离子
(五)、沉淀的颜色
23、白色沉淀:氢氧化镁,氢氧化铝,硫酸钡,碳酸钡,碳酸钙,氯化银。
24、蓝色沉淀:氢氧化铜。
25、红褐色沉淀:氢氧化铁。
(二)、液体的颜色
11、无色液体:水,双氧水,酒精,食盐水,蔗糖水,各种盐溶液(除铜盐、亚铁盐、铁盐),酚酞试液,氨水(有挥发性),硫酸,硫酸溶液,盐酸,碳酸(受热易分解),硝酸等
12、蓝色溶液:铜盐溶液,如硫酸铜溶液,硝酸铜溶液氯化铜溶液(稀溶液蓝色,浓溶液绿色)
13、浅绿色溶液:亚铁盐溶液,如硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
5、淡黄色固体:硫磺(S单质)
6、无色固体:冰(H2O),干冰(CO2),金刚石
7、银白色固体:银,铁,镁,铝,锌,钠,铂等金属
8、黑色固体:铁粉,木炭(炭黑,活性炭),氧化铜CuO,二氧化锰(MnO2),四氧化三铁(Fe3O4)。
9、红褐色固体:氢氧化铁[Fe(OH)3]
10、白色固体:氯化钠(NaCl),碳酸钠(Na2CO3),氢氧化钠(NaOH),氢氧化钙[Ca(OH)2],碳酸钙(CaCO3),氧化钙(CaO),五氧化二磷(P2O5),氧化镁(MgO),氯化银(AgCl),硫酸钡(BaSO等
14、黄色溶液:铁盐溶液,如硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液,碘酒
16、紫色溶液:石蕊试液
(三)、气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
(四)、离子的颜色
20、黄色:铁离子
【初中化学】常见物质的颜色
常见挥发性有机物(VOCs)
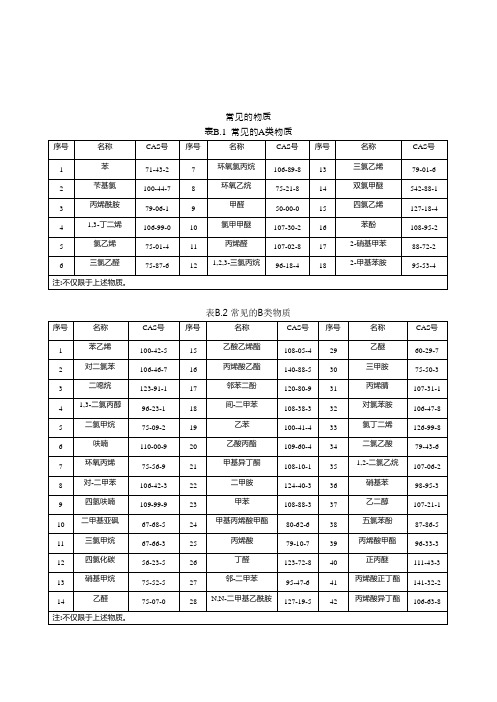
常见的物质表B.1 常见的A类物质序号名称CAS号序号名称CAS号序号名称CAS号苯71-43-27环氧氯丙烷106-89-813三氯乙烯79-01-6 1苄基氯100-44-78环氧乙烷75-21-814双氯甲醚542-88-1 2丙烯酰胺79-06-19甲醛50-00-015四氯乙烯127-18-4 3氯甲甲醚107-30-216苯酚108-95-2 41,3-丁二烯106-99-010氯乙烯75-01-411丙烯醛107-02-8172-硝基甲苯88-72-2 5三氯乙醛75-87-6121,2,3-三氯丙烷96-18-4182-甲基苯胺95-53-4 6注:不仅限于上述物质。
表B.2 常见的B类物质序号名称CAS号序号名称CAS号序号名称CAS号苯乙烯100-42-515乙酸乙烯酯108-05-429乙醚60-29-7 1对二氯苯106-46-716丙烯酸乙酯140-88-530三甲胺75-50-3 2二噁烷123-91-117邻苯二酚120-80-931丙烯腈107-31-1 3间-二甲苯108-38-332对氯苯胺106-47-8 41,3-二氯丙醇96-23-118二氯甲烷75-09-219乙苯100-41-433氯丁二烯126-99-8 5呋喃110-00-920乙酸丙酯109-60-434二氯乙酸79-43-6 6环氧丙烯75-56-921甲基异丁酮108-10-1351,2-二氯乙烷107-06-2 7对-二甲苯106-42-322二甲胺124-40-336硝基苯98-95-3 8四氢呋喃109-99-923甲苯108-88-337乙二醇107-21-1 9二甲基亚砜67-68-524甲基丙烯酸甲酯80-62-638五氯苯酚87-86-5 10三氯甲烷67-66-325丙烯酸79-10-739丙烯酸甲酯96-33-3 11四氯化碳56-23-526丁醛123-72-840正丙醚111-43-3 12硝基甲烷75-52-527邻-二甲苯95-47-641丙烯酸正丁酯141-32-2 13乙醛75-07-028N,N-二甲基乙酰胺127-19-542丙烯酸异丁酯106-63-8 14注:不仅限于上述物质。
初中化学之常见物质的颜色知识点

初中化学之常见物质的颜色知识点
(一)固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
(完整)初中化学常见物质颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮 18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2. 铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中燃烧: 4Al + 3O2 点燃 2Al2O3★5. 氢气中空气中燃烧: 2H2 + O2 点燃 2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧: C + O2 点燃 CO29. 碳在氧气中不充分燃烧: 2C + O2 点燃 2CO10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃 2CO211.玻义耳研究空气的成分实验 2HgO △ 2Hg+ O2 ↑★12.加热高锰酸钾: 2KMnO4 △ K2MnO4 + MnO2 +O2↑★13.氯酸钾和二氧化锰共热制取氧气 2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验): 2H2O 通电 2H2↑+ O2 ↑2.生石灰溶于水: CaO + H2O = Ca(OH)23.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO★2.铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu★3.氢气还原氧化铜: H2 + CuO △ Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧: C + O2 点燃 CO2★2.木炭还原氧化铜: C+ 2CuO 高温 2Cu + CO2↑3.焦炭还原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃 CO25.煤炉的中层: CO2 + C 高温 2CO6.煤炉的上部蓝色火焰的产生: 2CO + O2 点燃 2CO2★7.大理石与稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O +CO2↑8.碳酸不稳定而分解: H2CO3 = H2O + CO2↑ 9.二氧化碳可溶于水: H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温 CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜: CO+ CuO △ Cu + CO2★13.一氧化碳的可燃性: 2CO + O2 点燃 2CO2★14.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧: CH4 + 2O2 点燃 CO2 + 2H2O★2.酒精在空气中燃烧: C2H5OH + 3O2 点燃 2CO2 +3H2O★3.氢气中空气中燃烧: 2H2 + O2 点燃 2H2O六、金属1.镁在空气中燃烧: 2Mg + O2 点燃 2MgO2.铁在氧气中燃烧: 3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热: 2Cu + O2 △ 2CuO4. 铝在空气中形成氧化膜: 4Al + 3O2 = 2Al2O3★5. 锌和稀硫酸(实验室制取氢气) Zn + H2SO4 = ZnSO4 + H2↑★6. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑7. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸 Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸 Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸 Mg+ 2HCl = MgCl2 + H2↑12.铝和稀盐酸 2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu14. 锌和硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu15. 铜和硝酸汞溶液反应: Cu + Hg(NO3)2= Cu(NO3)2 + Hg★16.金属铁的治炼原理: 3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐★1. 氧化铁和稀盐酸反应: Fe2O3 + 6HCl =2FeCl3 + 3H2O★2. 氧化铁和稀硫酸反应: Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3. 氧化铜和稀盐酸反应: CuO + 2HCl =CuCl2 + H2O4. 氧化铜和稀硫酸反应: CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应: HCl + NaOH = NaCl +H2O★6. 盐酸和氢氧化钙反应: 2HCl + Ca(OH)2 = CaCl2 + 2H2O7. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O8. 硫酸和烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl=CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑11.碳酸氢钠与稀盐酸反应: NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应: H2SO4 + BaCl2 == BaSO4 ↓+2HCl常见的化学式一、常见单质氢气 H2 氮气 N2 氯气 Cl2 氧气 O2 臭氧 O3 氦气He 氖气 Ne 氩气 Ar 碳 C 硅 Si 硫 S 磷 P 碘 I2 钾 K 钙 Ca 钠Na 镁 Mg 铝 Al 锌 Zn 铁 Fe 铜 Cu 汞 Hg 银 Ag二、化合物1、氧化物水 H2O 三氧化硫 SO3 一氧化碳 CO 二氧化碳 CO2 五氧化二磷 P2O5 过氧化氢 H2O2 二氧化氮 NO2 二氧化硫 SO2 氧化钙 CaO 氧化亚铁 FeO 氧化铁 Fe2O3 四氧化三铁 Fe3O4 氧化镁 MgO 氧化锌 ZnO 二氧化锰 MnO2 氧化汞 HgO 氧化铝 Al2O3 氧化铜 CuO 22、其他化合物硝酸 HNO3 硫酸 H2SO4 盐酸 HCl 碳酸 H2CO3 硫化氢 H2S 氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2 氢氧化铝 Al(OH)3 氢氧化锌 Zn(OH)2 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2 氢氧化钡 Ba(OH)2 氨水 NH3·H2O 氯化钠 NaCl 氯化铜 CuCl2 氯化铝 AlCl3 氯化钾 KCl 氯化亚铁 FeCl2 氯化铁 FeCl3 氯化银 AgCl 氯化钙 CaCl2 氯化镁 MgCl2 氯化钡 BaCl2 氯化锌 ZnCl2 硫酸铜 CuSO4 高锰酸钾 KMnO4 锰酸钾 K2MnO4 氯酸钾 KClO3 碳酸钙 CaCO3 硝酸钾 KNO3 硝酸钠 NaNO3 硝酸铁 Fe(NO3)3 硝酸亚铁 Fe(NO3)2 硝酸铝 Al(NO3)3 碳酸钠 Na2CO3 碳酸钙 CaCO3 碳酸铵 (NH4)2CO3 碳酸氢钠 NaHCO3 硫酸铁 Fe2(SO4)3 硫酸亚铁 FeSO4 硝酸银 AgNO3 硝酸钡 Ba(NO3)2 硝酸铵NH4NO3 硫酸钡 BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
Rohs10项有害物质常见于的产品

常见化学物质

初中常见物质的化学式氢气碳氮气氧气磷硫氯气(非金属单质)H2 C N2 O2 P S Cl2钠镁铝钾钙铁锌铜钡钨汞(金属单质)Na Mg Al K Ga Fe Zn Cu Ba W Hg水一氧化碳二氧化碳五氧化二磷氧化钠二氧化氮二氧化硅H2O CO CO2 P2O5 Na2O NO2 SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2 SO3 NO MgO CuO BaO Cu2O氧化亚铁三氧化二铁(铁红)四氧化三铁三氧化二铝三氧化钨FeO Fe2O3 Fe3O4 Al2O3 WO3氧化银氧化铅二氧化锰(常见氧化物)Ag2O PbO MnO2氯化钾氯化钠(食盐) 氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KCl NaCl MgCl2 CaCl2 CuCl2 ZnCl2 BaCl2 AlCl3氯化亚铁氯化铁氯化银(氯化物/盐酸盐)FeCl2 FeCl3 AgCl硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸(常见的酸)H2SO4 HCl HNO3 H3PO4 H2S HBr H2CO3硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4 BaSO4 CaSO4 KSO4 MgSO4 FeSO4 Fe2 (SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3 NaHSO4 KHSO4 NaSO3 NaNO3 KNO3 AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁MgNO3 Cu(NO3)2 Ca(NO3)2 NaNO3 Na2CO3 CaCO3 MgCO3碳酸钾(常见的盐)K2CO3氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 KOH Al(OH)3氢氧化铁氢氧化亚铁(常见的碱)Fe(OH)3 Fe(OH)2甲烷乙炔甲醇乙醇乙酸(常见有机物)CH4 C2H2 CH3OH C2H5OH CH3COOH碱式碳酸铜石膏熟石膏明矾绿矾Cu2(OH)2CO3 CaSO4?2H2O 2 CaSO4?H2O KAl(SO4)2?12H2O FeSO4?7H2O 蓝矾碳酸钠晶体(常见结晶水合物)CuSO4?5H2O Na2CO3?10H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾(常见化肥)CO(NH2)2 NH4NO3 (NH4)2SO4 NH4HCO3 KH2PO4沉淀:红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀------------Fe(OH)2蓝色絮状沉淀----------Cu(OH)2白色沉淀--------------CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3 的白色沉淀),Mg(OH)2.淡黄色沉淀(水溶液中)----S微溶于水------------Ca(OH)2,CaSO4初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg (3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2(5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3?10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4?5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO-醋酸根离子)具有酸的通性(17)氨气:NH3 (碱性气体)(18)氨水、一水合氨:NH3?H2O (为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2 (工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。
中考初中化学常见物质的颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于 HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO★2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热: 2Cu + O2 △2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O3★5. 氢气中空气中燃烧: 2H2 + O2 点燃2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧: C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO10. 一氧化碳在氧气中燃烧: 2CO + O2 点燃2CO2 11.玻义耳研究空气的成分: 2HgO △2Hg+ O2 ↑★12.加热高锰酸钾:2KMnO4 △K2MnO4 + MnO2 + O2↑★13.氯酸钾和二氧化锰共热制取氧气:2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+ O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验)2H2O 通电2H2↑+ O2 ↑2.生石灰溶于水:CaO + H2O = Ca(OH)23.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧:2Mg + O2 点燃2MgO★2.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu★3.氢气还原氧化铜:H2 + CuO △Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧:C + O2 点燃CO2★2.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃CO25.煤炉的中层:CO2 + C 高温2CO6.煤炉的上部蓝色火焰的产生2CO + O2 点燃2CO2★7.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑8.碳酸不稳定而分解:H2CO3 = H2O + CO2↑9.二氧化碳可溶于水:H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜:CO+ CuO △Cu + CO2★13.一氧化碳的可燃性:2CO + O2 点燃2CO2★14.碳酸钠与稀盐酸(灭火器的原理):Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧CH4 + 2O2 点燃CO2 + 2H2O★2.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 +3H2O★3.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属1.镁在空气中燃烧:2Mg + O2 点燃2MgO2.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热: 2Cu + O2 △2CuO4. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3★5. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★6. 铁和稀硫酸:Fe + H2SO4 = FeSO4 + H2↑7. 镁和稀硫酸:Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑12.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu14.锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu15.铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg★16.金属铁的治炼原理:3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐★1. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O★2. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3.氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O4.氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O★6. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O 7.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 8.硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl =CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑10.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl常见的化学式一、常见单质氢气H2 氮气N2 氯气Cl2 氧气O2 臭氧O3 氦气He 氖气Ne 氩气Ar 碳 C 硅Si 硫S 磷P 碘I2 钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 铜Cu汞Hg 银Ag二、化合物1、氧化物水H2O 三氧化硫SO3 一氧化碳CO 二氧化碳CO2 五氧化二磷P2O5 过氧化氢H2O2 二氧化氮NO2 二氧化硫SO2 氧化钙CaO 氧化亚铁FeO 氧化铁Fe2O3 四氧化三铁Fe3O4 氧化镁MgO 氧化锌ZnO 二氧化锰MnO2 氧化汞HgO 氧化铝Al2O3 氧化铜CuO 22、其他化合物硝酸HNO3 硫酸H2SO4 盐酸HCl 碳酸H2CO3 硫化氢H2S 氢氧化钠NaOH 氢氧化钾KOH 氢氧化钙Ca(OH)2 氢氧化镁Mg(OH)2 氢氧化铝Al(OH)3 氢氧化锌Zn(OH)2 氢氧化铁Fe(OH)3 氢氧化亚铁Fe(OH)2 氢氧化铜Cu(OH)2 氢氧化钡Ba(OH)2 氨水NH3·H2O 氯化钠NaCl 氯化铜CuCl2 氯化铝AlCl3 氯化钾KCl 氯化亚铁FeCl2 氯化铁FeCl3 氯化银AgCl 氯化钙CaCl2 氯化镁MgCl2 氯化钡BaCl2 氯化锌ZnCl2 硫酸铜CuSO4 高锰酸钾KMnO4 锰酸钾K2MnO4 氯酸钾KClO3 碳酸钙CaCO3 硝酸钾KNO3 硝酸钠NaNO3 硝酸铁Fe(NO3)3 硝酸亚铁Fe(NO3)2 硝酸铝Al(NO3)3 碳酸钠Na2CO3 碳酸钙CaCO3 碳酸铵(NH4)2CO3 碳酸氢钠NaHCO3 硫酸铁Fe2(SO4)3 硫酸亚铁FeSO4 硝酸银AgNO3 硝酸钡Ba(NO3)2 硝酸铵 NH4NO3 硫酸钡BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖 C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
常见化学物质名称

常见化学物质名称work Information Technology Company.2020YEAR
1、食盐:主要成分:氯化钠,化学式NaCl
2、二氧化碳固体:化学式CO2,俗称干冰
3、氧化钙:化学式CaO,俗称生石灰
4、氢氧化钙:化学式Ca(OH)2,俗称熟石灰、消石灰、石灰浆、石灰乳
氢氧化钙溶液(aq):俗称石灰水,主要成分Ca(OH)2
5、大理石、石灰石、水垢、锅垢的主要成分:CaCO3
6、甲烷:化学式CH4,俗称天然气,瓦斯气、坑气、沼气的主要成分
7、乙醇:化学式C2H5OH ,俗称酒精
8、汞:化学式Hg,俗称水银
9、过氧化氢:化学式H2O2,俗称双氧水
10、硫酸铜晶体:化学式CuSO4·5H2O,俗称胆矾、蓝矾
11、明矾:KAl(SO4)2·12H2O
12:碱式碳酸铜:Cu2(OH)2CO3俗称孔雀石、铜绿加热的化学方程式{
13、氢氧化钠:化学式NaOH,俗称火碱、烧碱、苛性钠
14、氢氯酸(HCl):盐酸(氯化氢气体溶于水所得的溶液),学名:氢氯酸
15、碳酸钠:化学式:Na2CO3,俗称纯碱、苏打
16、碳酸氢钠:化学式:NaHCO3,俗称小苏打
17、生石膏:CaSO4.2H2O 熟石膏:2CaSO4.H2O
18、波尔多液(农药):CuSO4+Ca(OH)2
19、铁锈,赤铁矿,氧化铁:Fe2O3;磁铁矿 Fe3O4;菱铁矿FeCO3颜色{
2。
常见的化学物质,原子团,化合价

一、物质的学名、俗名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl (6)亚硫酸:H2SO3(7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2(9)苛性钠、火碱、烧碱:NaOH(10)纯碱:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3⋅10H2O(11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4⋅5H2O(13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡 (15)酒精、乙醇:C2H5OH(16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3(碱性气体) (19)亚硝酸钠:NaNO2(工业用盐、有毒)(18)氨水、一水合氨:NH3⋅H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+ 的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸) AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余碱。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
初中化学常见物质的颜色和沉淀

(一)、固体的颜色1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉2、红色固体:铜——紫红色,氧化铁Fe2O3——红(棕)色3、蓝色晶体:硫酸铜晶体CuSO4·5H2O4、蓝色沉淀:氢氧化铜5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液8、绿色固体:碱式碳酸铜9、紫黑色固体:高锰酸钾(二)、液体的颜色10、紫红色溶液:高锰酸钾溶液11、紫色溶液:石蕊溶液12、黄色溶液:含有Fe3+的溶液—硫酸铁溶液,氯化铁溶液,硝酸铁溶液13、浅绿色溶液:含有Fe2+的溶液—硫酸亚铁溶液14、无色液体:水,稀盐酸,稀硫酸,酚酞试液15、红褐色沉淀:氢氧化铁(三)、常见气体16、无色气体:单质——氧气,氢气,氮气。
化合物—二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。
初中化学常见沉淀物质红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀--------------Fe(OH)2蓝色絮状沉淀-----------Cu(OH)2白色沉淀-----------------CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4(其中BaSO4、AgCl是不溶于 HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。
(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体初中常见的化学方程式一、氧气的性质:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO★ 2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 △2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O3★ 5. 氢气中空气中燃烧:2H2 + O2 点燃2H2O★6. 红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧: C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO2 11.玻义耳研究空气的成分实验2HgO △2Hg+ O2 ↑★12.加热高锰酸钾:2KMnO4 △K2 MnO4 + MnO2 +O2↑★13.氯酸钾和二氧化锰共热制取氧气2KClO3 +MnO2 △2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2H2O+O2 ↑二、自然界中的水:★1.电解水(探究水的组成实验):2H2O 通电2H2↑+ O2 ↑2.生石灰溶于水:CaO + H2O = Ca(OH)23.二氧化碳可溶于水:H2O + CO2=H2CO3三、质量守恒定律:1.镁在空气中燃烧:2Mg + O2 点燃2MgO★2.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + C u★3.氢气还原氧化铜:H2 + CuO △Cu + H2O四、碳和碳的氧化物:1. 碳在氧气中充分燃烧: C + O2 点燃CO2★2.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑3.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑4.煤炉的底层: C + O2 点燃CO25.煤炉的中层:CO2 + C高温2CO6.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2★7.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H 2O +CO2↑8.碳酸不稳定而分解:H2CO3 = H2O + CO2↑9.二氧化碳可溶于水:H2O + CO2=H2CO3★10.高温煅烧石灰石(工业制CO2):CaCO3 高温CaO + CO2↑★11.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3 ↓+ H2O★12.一氧化碳还原氧化铜:CO+ CuO △Cu + CO2★13.一氧化碳的可燃性:2CO + O2 点燃2CO2★14.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O+CO2↑五、燃料及其利用:★1.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O★2.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 +3H2O★3.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属1.镁在空气中燃烧:2Mg + O2 点燃2MgO2.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 △2CuO4. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3★ 5. 锌和稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★ 6. 铁和稀硫酸Fe + H2S O4 = FeSO4 + H2↑7. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑8. 铝和稀硫酸2Al + 3H2SO4 = Al2(SO4)3 +3H2↑9. 锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑10. 铁和稀盐酸Fe + 2HCl =FeCl2 + H2↑11. 镁和稀盐酸Mg+ 2 HCl = MgCl2 + H2↑12.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★13. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + C u14. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu15. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3 )2 + Hg★16.金属铁的治炼原理:3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐★ 1. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O★ 2. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O3. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O4. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O★5.盐酸和烧碱起反应:HCl + NaOH = NaCl + H2O★ 6. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O7. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O8. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O★9.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl =CaCl2+H2O+CO2↑★10.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O +CO2↑11.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O +CO2↑★12. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl常见的化学式一、常见单质氢气H2 氮气N2 氯气Cl2 氧气O2 臭氧O3 氦气He 氖气Ne 氩气Ar 碳 C 硅Si 硫S 磷P 碘I2 钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 铜Cu 汞Hg 银Ag二、化合物1、氧化物水H2O 三氧化硫SO3 一氧化碳CO 二氧化碳CO2 五氧化二磷P2O5 过氧化氢H2O2 二氧化氮NO2 二氧化硫SO2 氧化钙CaO 氧化亚铁FeO 氧化铁Fe2O3 四氧化三铁Fe3O4 氧化镁MgO 氧化锌ZnO 二氧化锰MnO2 氧化汞HgO 氧化铝Al2O3 氧化铜CuO 22、其他化合物硝酸HNO3 硫酸H2SO4 盐酸HCl 碳酸H2CO3 硫化氢H2S 氢氧化钠NaOH 氢氧化钾KOH 氢氧化钙Ca(OH)2 氢氧化镁Mg(OH)2 氢氧化铝Al(OH)3 氢氧化锌Zn(OH)2 氢氧化铁Fe(OH)3 氢氧化亚铁Fe(OH)2 氢氧化铜Cu(OH)2 氢氧化钡Ba(OH)2 氨水NH3·H2O 氯化钠NaCl 氯化铜CuCl2 氯化铝AlCl3 氯化钾KCl 氯化亚铁FeCl2 氯化铁FeCl3 氯化银AgCl 氯化钙CaCl2 氯化镁MgCl2 氯化钡BaCl2 氯化锌ZnCl2 硫酸铜CuSO4 高锰酸钾KMnO4 锰酸钾K2MnO4 氯酸钾KClO3 碳酸钙CaCO3 硝酸钾KNO3 硝酸钠NaNO3 硝酸铁Fe(NO3)3 硝酸亚铁Fe(NO3)2 硝酸铝Al(NO3)3 碳酸钠Na2CO3 碳酸钙CaCO3 碳酸铵(NH4)2CO3 碳酸氢钠NaHCO3 硫酸铁Fe2(SO4)3 硫酸亚铁FeSO4 硝酸银AgNO3 硝酸钡Ba(NO3)2 硝酸铵 NH4NO3 硫酸钡BaSO43、常见有机化合物甲烷CH4 乙醇C2H5OH 葡萄糖 C6H12O6九年级化学知识点归纳一、概念剖析:1、酸定义:电离时产生的阳离子全部是H+的化合物。
初中化学十个常见的识别物质方法与五类常见的化学方程式

初中化学⼗个常见的识别物质⽅法与五类常见的化学⽅程式 对物质的识别是中考化学的必考题,我们需要拿下,⽅程式也是必考的,我们也尽量拿下,那么具体有哪些是常考的呢?你想了解吗?⼩编整理了相关资料,希望能帮助到您。
初中化学⼗个常见的识别物质⽅法 ⼀、初中化学常见物质的颜⾊ (⼀)、固体的颜⾊ 1、红⾊固体:铜,氧化铁 2、绿⾊固体:碱式碳酸铜 3、蓝⾊固体:氢氧化铜,硫酸铜晶体 4、紫⿊⾊固体:⾼锰酸钾 5、淡黄⾊固体:硫磺 6、⽆⾊固体:冰,⼲冰,⾦刚⽯ 7、银⽩⾊固体:银,铁,镁,铝,汞等⾦属 8、⿊⾊固体:铁粉,⽊炭,氧化铜,⼆氧化锰,四氧化三铁,(碳⿊,活性炭) 9、红褐⾊固体:氢氧化铁 10、⽩⾊固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化⼆磷,氧化镁 (⼆)、液体的颜⾊ 11、⽆⾊液体:⽔,双氧⽔ 12、蓝⾊溶液:硫酸铜溶液,氯化铜溶液,◇◇铜溶液 13、浅绿⾊溶液:硫酸亚铁溶液,氯化亚铁溶液,◇◇亚铁溶液 14、黄⾊溶液:硫酸铁溶液,氯化铁溶液,◇◇铁溶液 15、紫红⾊溶液:⾼锰酸钾溶液 16、紫⾊溶液:⽯蕊溶液 (三)、⽓体的颜⾊ 17、红棕⾊⽓体:⼆氧化氮 18、黄绿⾊⽓体:lv⽓ 19、⽆⾊⽓体:氧⽓,氮⽓,氢⽓,⼆氧化碳,⼀氧化碳,⼆氧化硫,氯化氢⽓体等⼤多数⽓体。
⼆、初中化学之三 1、我国古代三⼤化学⼯艺:造纸,制◇◇,烧瓷器。
2、氧化反应的三种类型:爆炸,燃烧,缓慢氧化。
3、构成物质的三种微粒:分⼦,原⼦,离⼦。
4、不带电的三种微粒:分⼦,原⼦,中⼦。
5、物质组成与构成的三种说法: (1)、⼆氧化碳是由碳元素和氧元素组成的; (2)、⼆氧化碳是由⼆氧化碳分⼦构成的; (3)、⼀个⼆氧化碳分⼦是由⼀个碳原⼦和⼀个氧原⼦构成的。
6、构成原⼦的三种微粒:质⼦,中⼦,电⼦。
7、造成⽔污染的三种原因: (1)⼯业“三废”任意排放, (2)⽣活污⽔任意排放 (3)农药化肥任意施放 8、收集⽅法的三种⽅法:排⽔法(不容于⽔的⽓体),向上排空⽓法(密度⽐空⽓⼤的⽓体),向下排空⽓法(密度⽐空⽓⼩的⽓体)。
常见化学物质名称

1、食盐:主要成分:氯化钠,化学式NaCl
2、二氧化碳固体:化学式CO2,俗称干冰
3、氧化钙:化学式CaO,俗称生石灰
4、氢氧化钙:化学式Ca(OH)2,俗称熟石灰、消石灰、石灰浆、石灰乳
氢氧化钙溶液(aq):俗称石灰水,主要成分Ca(OH)2
5、大理石、石灰石、水垢、锅垢的主要成分:CaCO3
6、甲烷:化学式CH4,俗称天然气,瓦斯气、坑气、沼气的主要成分
7、乙醇:化学式C2H5OH ,俗称酒精
8、汞:化学式Hg,俗称水银
9、过氧化氢:化学式H2O2,俗称双氧水
10、硫酸铜晶体:化学式CuSO4·5H2O,俗称胆矾、蓝矾
11、明矾:KAl(SO4)2·12H2O
12:碱式碳酸铜:Cu2(OH)2CO3俗称孔雀石、铜绿加热的化学方程式{
13、氢氧化钠:化学式NaOH,俗称火碱、烧碱、苛性钠
14、氢氯酸(HCl):盐酸(氯化氢气体溶于水所得的溶液),学名:氢氯酸
15、碳酸钠:化学式:Na2CO3,俗称纯碱、苏打
16、碳酸氢钠:化学式:NaHCO3,俗称小苏打
17、生石膏:CaSO4.2H2O 熟石膏:2CaSO4.H2O
18、波尔多液(农药):CuSO4+Ca(OH)2
19、铁锈,赤铁矿,氧化铁:Fe2O3;磁铁矿Fe3O4;菱铁矿FeCO3颜色{。
常见化学物质颜色

NOTHING IS IMPOSSIBLE ! 陶守龍 ^-^常见化学物质颜色1、黑色固体:石墨、炭粉、铁粉、FeS 、CuS 、CuO 、MnO2、Fe3O4、FeO2、红色固体:Cu (紫红色)、Cu2O 、Fe2O3 (红棕色)、HgO 、红磷3、黄色固体:AgI 、Ag3PO44、淡黄色固体:S 、Na2O2、AgBr5、深紫色固体:KMnO4、(溶液,红紫色)6、绿色固体:Cu2(OH)2CO37、蓝色晶体:CuSO4•5H2O8、蓝色沉淀:Cu(OH)29、红褐色沉淀:Fe(OH)3 10、白色固体:MgO 、P2O5、CaO 、NaOH 、Na2O 、Ca(OH)2、KClO3、KCl 、Na2CO3、NaCl 、无水CuSO4;Mg(OH)2铁、镁为银白色(汞为银白色液态);Al 银色11、溶液的颜色:Cu2+的溶液呈蓝色;Fe2+的溶液呈浅绿色;Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4 、AgCl13、不溶于水的白色沉淀:CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl 、Cl2、H2S (皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO (剧毒)(3)红棕色气体:NO2(4)黄绿色气体:Cl2、F2(淡)固体:I2(紫黑)(5)臭鸡蛋气味气体:H2S(6)深红棕色液体:Br215、具有刺激性气味的液体:盐酸(浓·挥)、硝酸(浓·挥)、醋酸、酒精16、有毒的:气体:CO 、NO 、SO2、H2S 、Cl2、液体:CH3OH (甲醇)易挥发、苯固体:NaNO2、CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质—波尔多液)17、赤铁矿:Fe2O3。
生活中常见的碱性物质

生活中常见的碱性物质
生活中,我们经常接触到各种各样的碱性物质,它们在我们的日常生活中扮演
着重要的角色。
碱性物质是指PH值大于7的物质,它们具有中和酸性物质、清洁
和消毒等作用,为我们的生活带来了诸多便利。
首先,我们来谈谈最常见的碱性物质之一——肥皂。
肥皂是一种碱性物质,它
由碱性的碱液和动植物油脂混合而成。
肥皂在清洁和消毒方面发挥着重要作用,它能够去除手上的污垢和细菌,让我们保持身体清洁和健康。
此外,肥皂还可以用来清洁衣物、餐具等,是我们日常生活中不可或缺的清洁用品。
除了肥皂,碱性物质还包括氢氧化钠、氢氧化钾等化学物质。
氢氧化钠是一种
强碱,常用于清洁剂、肥皂和纸浆生产中。
氢氧化钠具有腐蚀性,需要小心使用,但它在工业生产中发挥着重要作用。
氢氧化钾也是一种碱性物质,常用于肥料生产和碱性电池中,它对植物生长和电池性能起着重要作用。
此外,生活中还有一些食品和饮料属于碱性物质,例如蔬菜、水果、碱性水等。
这些碱性食品和饮料有助于维持人体内酸碱平衡,对我们的健康有着重要的影响。
适当摄入碱性食品和饮料可以帮助我们减少酸性物质对身体的损害,保持身体健康。
总之,生活中常见的碱性物质在我们的日常生活中发挥着重要作用,它们为我
们的生活带来了诸多便利。
我们应该正确使用和理解碱性物质,使其发挥最大的作用,同时注意保护环境和身体健康。
希望大家能够在日常生活中更加重视碱性物质的重要性,让它们成为我们生活的有益伙伴。
高中化学俗称大全-常见物质的性质与颜色-化学之最

常见化学物质俗称大全一、硫酸盐类:1、皓矾:ZnSO4·7H2O2、钡餐,重晶石:BaSO43、绿矾,皂矾,青矾:FeSO4·7H2O4、芒硝,朴硝,皮硝:Na2SO4·10H2O5、明矾:KAl(SO4)2·12H2O 6、生石膏:CaSO4·2H2O 熟石膏:2CaSO4·H2O7、胆矾、蓝矾:CuSO4·5H2O 8、莫尔盐:(NH4)2SO4·FeSO4·6H2O二、矿石类:1、莹石:CaF22、光卤石:KCl·MgCl2·6H2O3、黄铜矿:CuFeS24、矾土:Al2O3·H2O·Al2O3·3H2O和少量Fe2O3·SiO2 5、磁铁矿石:Fe3O46、赤铁矿石:Fe2O37、褐铁矿石:2Fe2O3、3H2O 8、菱铁矿石:Fe2CO39、镁铁矿石:Mg2SiO410、苏口铁:碳以片状石墨形式存在11、白口铁:碳以FeC3形式存在12、高岭石:Al2(Si2O5)(OH)4或(Al2O3·2SiO2·2H2O)13、正长石:KAlSi3O814、石英:SiO215、硼砂:Na2B4O7·10H2O16、脉石:SiO217、刚玉(蓝宝石、红宝石):天然产的无色氧化铝晶体18、黄铁矿(愚人金):FeS219、炉甘石:ZnCO320、智利硝石:NaNO321、滑石:3MgO·4SiO2·H2O22、大理石(方解石、石灰石):CaCO323、孔雀石:CuCO3·Cu(OH)224、白云石:MgCO3·CaCO325、冰晶石:Na3AlF626、高岭土:Al2O3·2SiO2·2H2O27、锡石:SnO228、辉铜矿:Cu2S三、气体类:1、高炉煤气:CO,CO2等混合气体2、水煤气CO,H23、天然气(沼气):CH44、液化石油气:C3H8,C4H10为主5、焦炉气:CH4,CO,H2,C2H4为主6、裂解气:C2H4为主7、爆鸣气:H2和O28、笑气:N2O9、裂化气:C1~C4的烷烃、烯烃10、电石气:C2H2(通常含H2S、PH3等)四、有机类:1、福尔马林(蚁醛):HCHO2、蚁酸:HCOOH3、尿素: (NH4CNO)或CO(NH2)24、氯仿:CCl45、木精(工业酒精):CH3OH6、甘油:CH2OH-CHOH- CH2OH 7、硬脂酸:C17H35COOH 8、软脂酸:C15H31COOH9、油酸:C17H33OH 10、肥皂:C17H35COONa11、银氨溶液:[Ag(NH3)2]+12、乳酸:CH3-CHOH-COOH13、葡萄糖:C6H12O614、蔗糖:C12H22O1115、核糖:CH2OH-(CHOH)3CHO 16、脱氧核糖:CH2OH-(CHOH)2CH2-CH317、淀粉:(C6H10O5) n18、火棉,胶棉:主要成份都是[(C6H7O2)- (ONO2)3] n只是前者含N量高19、尿素:CO(NH2)2NH4CNO为氰酸铵(互为同分异构体)20、氯仿:CHCl321、油酸:C17H33COOH22、银氨溶液:[Ag(NH3)2]OH23、脱氧核糖:CH2OH-(CHOH)2CH2-CHO五、其他类:1、大理石、石灰石:CaCO32、石灰乳:Ca(OH)23、熟石灰:2CaSO4·H2O 4、足球烯:C605、铜绿:Cu2(OH)2CO36、纯碱(碱面): Na2CO37、王水:HCl,HNO3(3:1) 8、水玻璃(泡火碱) :Na2SiO39、小苏打:NaHCO310、苏打:Na2CO311、大苏打(海波):Na2S2O312、盐卤:MgCl2·6H2O13、雌黄:As2S314、雄黄:As4S415、朱砂:HgS 16、石棉:CaO· 3MgO· 4SiO217、砒霜:As2O318、泻盐:MgSO4· 7H2O19、波尔多液:CuSO4+Ca(OH)220、钛白粉:TiO2盐卤MgCl2· 6H2O碳酸钠:苏打、纯碱、Na2CO3碳酸氢钠:小苏打、NaHCO3氢氧化钠:烧碱、苛性钠、NaOH氢氧化钾:苛性钾、KOH氢氧化钙:熟石灰、Ca(OH)2高锰酸钾:灰锰氧、KMnO4氟化钙:萤石、氟石、CaF2二硫化亚铁:黄铁矿、硫铁矿、FeS2硫酸铜晶体:胆矾、蓝矾、CuSO4·5H2O 硫酸锌晶体:皓矾、ZnSO4·7H2O硫酸亚铁晶体:绿矾、FeSO4·7H2O硫酸铝钾晶体:明矾、kAl(SO4)2· 12H2O硫酸钙晶体:(生)石膏、CaSO4· 2H2O硫酸钙晶体:熟石膏、烧石膏、(CaSO4)2· H2O 硫酸钡晶体:重晶体、BaSO4硫酸钠晶体:芒硝、NaSO4· 10H2O硫酸镁晶体:泻盐、MgSO4· 7H2O硫代硫酸钠:大苏打、海波、Na2S2O3硝酸钾:智利硝石、火硝、KNO3过磷酸钙(普钙):硫酸钙和硫酸二氢钙、Ca(H2PO4)2和2CaSO4重过磷酸钙:磷酸二氢钙、重钙、Ca(H2PO4)2一氧化碳和氢气:水煤气、CO和H2一氧化碳和二氧化碳:发生炉煤气、CO和CO2二氧化碳(固体):干冰、CO2碳酸钙:石灰石、方解石、大理石、白垩、CaCO3氧化钙:生石灰、CaO 碳化钙:电石、CaC2碳化硅:金刚砂、SiC 二氧化硅:石英、水晶、SiO2硅酸钠溶液:水玻璃、泡花碱、Na2SiO3氧化铝:刚玉、AL2O3亚铁青化钾:黄血盐、K4 (Fe(CN)6) 铁氢化钾:赤血盐、k3 (Fe(CN)6)3亚铁氢化钾:普鲁士蓝、K4Fe(CN)6碱式碳酸铜:铜绿、Cu2(OH)2CO3漂白粉:Ca(ClO)2和CaCl2 王水:浓HNO3和浓HCl (1:3 )氧化砷:砒霜、As2O3 硫化砷:雄黄、As2S3氯化汞:升汞、HgCl2氯化亚汞:三仙丹、HgCl硫化汞:辰砂、HgS物质俗称性质用途S硫磺淡黄色粉末、易燃、于空气中燃烧火焰为淡蓝色、纯氧为蓝紫色,并伴有刺鼻气体产生(SO2)P 赤磷白磷燃烧时产生大量的烟(P2O5固体)用物制烟雾弹C金刚石、石墨、活性炭金刚石是最硬物质;石墨具有导电性、润滑性、质软;活性炭用于吸附剂金刚石用于制钻头,切割物质。
10个单质

10个单质1.氢(H)氢是最简单的单质,它是宇宙中最丰富的元素。
它的原子序数为1,原子量为1。
它是一种无色、无味、无臭的气体,非常轻,在常温常压下是一种气态物质。
氢是常见的化学反应中的原料,也被广泛用于合成氨、氯化氢和其他化学品的生产。
此外,氢还可以作为燃料供应能量。
2.氮(N)氮是地壳中较为丰富的元素之一,它的原子序数为7,原子量为14。
氮是一种无色、无味的气体,在常温常压下也是一种气态物质。
它在空气中占据了很大的比例。
氮主要用于制造氨和其他化学品的生产。
此外,氮也用于食品加工和冷冻保存。
3.氧(O)氧是地壳中最丰富的元素之一,它的原子序数为8,原子量为16。
氧是一种无色、无味的气体,在常温常压下也是一种气态物质。
氧是生物体内必不可少的元素,它参与了呼吸作用和其他许多化学反应。
氧还用于氧气供应和水处理。
4.硫(S)硫是一种常见的元素,它的原子序数为16,原子量为32。
硫以黄色固体的形式存在,在常温常压下是不溶于水的。
硫在化学工业中被广泛使用,主要用于制造硫酸、硫酸盐和其他硫化合物。
此外,硫还用于制造化学肥料和农药。
5.铁(Fe)铁是地壳中最丰富的金属元素之一,它的原子序数为26,原子量为56。
铁是一种有色金属,它具有良好的导电和导热性能。
铁在工业中被广泛应用,主要用于制造钢铁和其他合金。
此外,铁还被用于建筑、汽车制造和机械工程。
6.锌(Zn)锌是一种常见的金属元素,它的原子序数为30,原子量为65。
锌是一种有色金属,它具有良好的耐腐蚀性能。
锌在工业中被广泛使用,主要用于镀锌、制造铜合金和其他锌合金。
此外,锌还在电池制造、化妆品和医药领域有重要应用。
7.银(Ag)银是一种贵金属元素,它的原子序数为47,原子量为107。
银是一种有色金属,具有良好的导电和导热性能。
银在珠宝制造、餐具制造和货币制造中被广泛使用。
此外,银还在光学领域有重要应用,如镜子和照相机胶片。
8.金(Au)金是一种贵金属元素,它的原子序数为79,原子量为197。
化学常见物质俗称和颜色

俗名主要成分化学名称化学式水银汞Hg白金铂Pt硫磺硫S金刚石、石墨、木炭碳 C白磷、红磷、黄磷磷P盐酸、盐镪水氢氯酸HCl硝镪水硝酸HNO3硫镪水硫酸H2SO4王水浓硝酸、浓盐酸(1:3)HNO3,HCl双氧水过氧化氢H2O2铅丹、红丹、红铅四氧化三铅Pb3O4砒霜、信石、白砒、砷华三氧化二砷As2O3升汞、高汞氯化汞HgCl2朱砂、辰砂、丹砂、银朱硫化汞HgS烧碱、火碱、苛性钠氢氧化钠NaOH苛性钾氢氧化钾KOH消石灰、熟石灰氢氧化钙Ca(OH)2苛性镁氢氧化镁Mg(OH)2碱石灰、钠碱石灰氢氧化钠、氧化钙混合NaOH,CaO 碳铵碳酸氢铵NH4HCO3磷矿粉磷酸钙Ca3(PO4)2碳酸气、干冰二氧化碳CO2硅石、石英、水晶、玛瑙砂子二氧化硅SiO2矾土、刚玉氧化铝Al2O3生石灰、煅烧石灰氧化钙CaO苏打、纯碱碳酸铵Na2SO4小苏打、重碱碳酸氢钠NaHCO3大苏打、海波硫代硫酸钠Na2S2O3.5H2O褐铁矿2Fe2O3.3H2O铁锈氧化铁Fe2O3铜绿碱式碳酸铜Cu2(OH)2CO3泻盐、苦盐硫酸镁MgSO4.7H2O口碱结晶碳酸钠Na2CO3.10H2O明矾硫酸铝钾KAl(SO4)2.12H2O胆矾硫酸铜CuSO4.5H2O红矾重铬酸钾K2Cr2O7无水芒硝、元明粉硫酸钠Na2SO4水玻璃、泡花碱硅酸钠Na2SiO3硫化碱、臭碱硫化钠Na2S钾碱、草碱、草木灰碳酸钾K2CO3硝石、火硝、土硝硝酸钾KNO3高锰酸钾KMnO4大理石、方解石、石灰石白垩碳酸钙CaCO3铜绿、孔雀石碱式碳酸铜CU2(OH)2CO3重晶石、钡白硫酸钡BaSO4生石膏、石膏硫酸钙CaSO4.2H2O熟石膏、烧石膏硫酸钙2CaSO4.H2O漂白粉次氯酸钙Ca(ClO)2氯仿、绿仿三氯甲烷CHCl3甘油丙三醇C2H5(OH)3蚁酸甲酸HCOOH草酸乙二酸HOOC-COOH福尔马林甲醛溶液(30%~40%) HCHO尿素碳酰胺CO(NH2)赤铜矿氧化亚铜Cu2O软锰矿二氧化锰MnO2铁丹、铁红、赭石、赤铁矿三氧化二铁Fe2O3磁铁矿、铁黑四氧化三铁Fe3O4绿矾七水合硫酸亚铁FeSO4.7H2O醋酸乙酸CH3COOH(一)、固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(二)、液体的颜色11、无色液体:水,双氧水12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液15、紫红色溶液:高锰酸钾溶液16、紫色溶液:石蕊溶液(三)、气体的颜色17、红棕色气体:二氧化氮18、黄绿色气体:氯气19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气。
8.常见的“10电子”、“18电子”的微粒[整理]
![8.常见的“10电子”、“18电子”的微粒[整理]](https://img.taocdn.com/s3/m/db9e4a63777f5acfa1c7aa00b52acfc789eb9fe7.png)
8.常见的“10电子”、“18电子”的微粒[整理]
10电子
10电子是指元素物质的电子数只有10个,它们是:磷、氯、氟、氖、氧、氮、硫、氨、水、碳,他们是最常见的电子,可以在元素表中找到。
10电子微粒包括:膦酸钠、苯酚、脂类、苯乙酸、碳酸钠、氢氧化铵、水杨酸、氢氧化钙、硝酸钡、多巴酚、柠檬酸、硼酸、硫酸铜、氯化镁、氟化物及其他。
这些10电子微粒因其一般色泽、易溶于水等特点受到了广泛的研究,它们可以用于
医学检测、制药等行业,也可以作为染料、香料、催化剂等使用。
18电子
18电子是指元素物质的电子数有18个,它们是:氯、氟、氖、氧、氮、硫、氨、水、磷、氢、氯醛、乙二醇、乳酸、硝酸、氯化钠、硫酔酸盐、硫酸和硫酸钙。
这些18电子微粒成分复杂,拥有许多不同的活性反应,它们可以在制药和材料工程
中应用,为制造具有独特功能的新型材料提供便利。
此外,18电子微粒亦可以用于清洁、净化等工业,以达到室内空气净化的目的。
常见化学物质俗称大全

常见化学物质俗称大全常见化学物质俗称大全杜雨洁一轮复习一、硫酸盐类:1、皓矾:ZnSO4·7H2O2、钡餐,重晶石:BaSO43、绿矾,皂矾,青矾:FeSO4·7H2O4、芒硝,朴硝,皮硝:Na2SO4·10H2O5、明矾:KAl(SO4)2·12H2O6、生石膏:CaSO4·2H2O 熟石膏:2CaSO4·H2O7、胆矾、蓝矾:CuSO4·5H2O8、莫尔盐:(NH4)2SO4·FeSO4·6H2O二、矿石类:1、莹石:CaF22、光卤石:KCl·MgCl2·6H2O3、黄铜矿:CuFeS24、矾土:Al2O3·H2O·Al2O3·3H2O和少量Fe2O3·SiO25、磁铁矿石:Fe3O46、赤铁矿石:Fe2O37、褐铁矿石:2Fe2O3、3H2O 8、菱铁矿石:FeCO39、镁铁矿石:Mg2SiO4 10、苏口铁:碳以片状石墨形式存在11、白口铁:碳以FeC3形式存在12、高岭石:Al2(Si2O5)(OH)4或(Al2O3·2SiO2·2H2O) 13、正长石:KAlSi3O8 14、石英:SiO215、硼砂:Na2B4O7·10H2O 16、脉石:SiO217、刚玉(蓝宝石、红宝石):天然产的无色氧化铝晶体18、黄铁矿(愚人金):FeS2 19、炉甘石:ZnCO320、智利硝石:NaNO3 21、滑石:3MgO·4SiO2·H2O22、大理石(方解石、石灰石):CaCO3 23、孔雀石:CuCO3·Cu(OH)224、白云石:MgCO3·CaCO3 25、冰晶石:Na3AlF626、高岭土:Al2O3·2SiO2·2H2O 27、锡石:SnO228、辉铜矿:Cu2S三、气体类:1、高炉煤气:CO,CO2等混合气体2、水煤气CO,H23、天然气(沼气):CH44、液化石油气:C3H8,C4H10为主5、焦炉气:CH4,CO,H2,C2H4为主6、裂解气:C2H4为主7、爆鸣气:H2和O2 8、笑气:N2O9、裂化气:C1~C4的烷烃、烯烃10、电石气:C2H2(通常含H2S、PH3等)四、有机类:1、福尔马林(蚁醛): HCHO2、蚁酸:HCOOH3、尿素: (NH4CNO) 或 CO(NH2)24、氯仿:CCl45、木精(工业酒精):CH3OH6、甘油:CH2OH-CHOH- CH2OH7、硬脂酸:C17H35COOH 8、软脂酸:C15H31COOH9、油酸:C17H33OH 10、肥皂:C17H35COONa11、银氨溶液:[Ag(NH3)2]+ 12、乳酸:CH3-CHOH-COOH13、葡萄糖:C6H12O6 14、蔗糖:C12H22O1115、核糖:CH2OH-(CHOH)3CHO 16、脱氧核糖:CH2OH-(CHOH)2CH2-CH317、淀粉:(C6H10O5) n18、火棉,胶棉:主要成份都是[(C6H7O2)- (ONO2)3] n只是前者含N量高19、尿素:CO(NH2)2 NH4CNO为氰酸铵(互为同分异构体)20、氯仿:CHCl3 21、油酸:C17H33COOH22、银氨溶液:[Ag(NH3)2]OH 23、脱氧核糖:CH2OH-(CHOH)2CH2-CHO五、其他类:1、白垩:CaCO32、石灰乳:Ca(OH)23、熟石灰:2CaSO4·H2O4、足球烯:C605、铜绿:Cu2(OH)2CO36、纯碱(碱面): Na2CO37、王水:HCl,HNO3 (3:1) 8、水玻璃(泡火碱) :Na2SiO39、小苏打:NaHCO3 10、苏打:Na2CO311、大苏打(海波):Na2S2O3 12、盐卤:MgCl2· 6H2O13、雌黄:As2S3 14、雄黄:As4S415、朱砂:HgS 16、石棉:CaO· 3MgO· 4SiO217、砒霜:As2O3 18、泻盐:MgSO4、7H2O19、波尔多液:CuSO4+Ca(OH)2 20、钛白粉:TiO2盐卤MgCl2· 6H2O碳酸钠:苏打、纯碱、Na2CO3碳酸氢钠:小苏打、NaHCO3氢氧化钠:烧碱、苛性钠、NaOH 氢氧化钾:苛性钾、KOH氢氧化钙:熟石灰、Ca(OH)2高锰酸钾:灰锰氧、KMnO4氟化钙:萤石、氟石、CaF2二硫化亚铁:黄铁矿、硫铁矿、FeS2 硫酸铜晶体:胆矾、蓝矾、CuSO4· 5H2O 硫酸锌晶体:皓矾、ZnSO4· 7H2O硫酸亚铁晶体:绿矾、FeSO4·7H2O 硫酸铝钾晶体:明矾、kAl(SO4)2· 12H2O硫酸钙晶体:(生)石膏、CaSO4· 2H2O 硫酸钙晶体:熟石膏、烧石膏、(CaSO4)2· H2O 硫酸钡晶体:重晶体、BaSO4硫酸钠晶体:芒硝、NaSO4· 10H2O硫酸镁晶体:泻盐、MgSO4· 7H2O 硫代硫酸钠:大苏打、海波、Na2S2O3硝酸钾:智利硝石、火硝、KNO3过磷酸钙(普钙):硫酸钙和硫酸二氢钙、Ca (H2PO4)2和2CaSO4重过磷酸钙:磷酸二氢钙、重钙、Ca(H2PO4)2一氧化碳和氢气:水煤气、CO和H2一氧化碳和二氧化碳:发生炉煤气、CO和CO2二氧化碳(固体):干冰、CO2碳酸钙:石灰石、方解石、大理石、白垩、CaCO3氧化钙:生石灰、CaO 碳化钙:电石、CaC2碳化硅:金刚砂、SiC 二氧化硅:石英、水晶、SiO2硅酸钠溶液:水玻璃、泡花碱、Na2SiO3氧化铝:刚玉、AL2O3 亚铁青化钾:黄血盐、K4 (Fe(CN)6) 铁氢化钾:赤血盐、k3 (Fe (CN)6)3亚铁氢化钾:普鲁士蓝、K4Fe(CN)6碱式碳酸铜:铜绿、Cu2 (OH)2CO3漂白粉:Ca(ClO)2 和CaCl2 王水:浓HNO3和浓HCl (1:3 )氧化砷:砒霜、As2O3 硫化砷:雄黄、As2S3氯化汞:升汞、HgCl2氯化亚汞:三仙丹、HgCl硫化汞:辰砂、HgS物质俗称性质用途S 硫磺淡黄色粉末、易燃、于空气中燃烧火焰为淡蓝色、纯氧为蓝紫色,并伴有刺鼻气体产生(SO2)P 赤磷白磷燃烧时产生大量的烟(P2O5固体)用物制烟雾弹C 金刚石、石墨、活性炭金刚石是最硬物质;石墨具有导电性、润滑性、质软;活性炭用于吸附剂金刚石用于制钻头,切割物质。
2022年中考化学复习应知应会:十、生活中常见的无机物

10.生活中常见的无机物【应知知识】一、溶液的酸碱性1.溶液的酸碱性检验:能用于溶液酸碱性检验的试剂(用品)有_________________________ ___________。
描述这些用品在酸性、碱性、中性溶液中的变化情况。
2.溶液的酸碱度(pH)pH越小酸性越强p H越大碱性越强pH:0————————————7————————————140≤pH<7 pH=7 7<pH≤14酸性中性碱性3.pH试纸的使用:用玻璃棒蘸取(或用胶头滴管吸取)少量试样溶液滴在pH试纸上,把试纸呈现的颜色与标准比色卡对比,读出溶液的酸碱度。
pH试纸测定的pH一般是整数。
(1)pH<7的溶液呈酸性。
pH越小,溶液酸性越强;当酸性溶液加水稀释时,溶液的酸性减弱,pH变大逐渐接近7,但不会≥7。
(2)pH>7的溶液呈碱性。
pH越大,溶液碱性越强;当碱性溶液加水稀释时,溶液的碱性减弱,pH变小逐渐接近7,但不会≤7。
(3)使用pH试纸简则溶液的酸碱度时,不能先用水润湿pH试纸,因为试纸上的水将会稀释溶液,时溶液的酸碱度发生变化。
4.健康人的体液pH必须维持在一定的范围内;大多数农作物适宜在接近中性的土壤中生长;正常雨水的pH≈5.6,pH<5.6的降水称为酸雨。
二、常见的酸1浓硫酸浓盐酸溶质的化学式H2SO4HCl颜色、状态无色,粘稠、油状、液态无色,液态气味无气味有刺激性气味密度(与水比较)比水大比水大敞开试剂瓶口发生的现象无明显现象(久置后液面上升)瓶口有白雾其他有吸水性,溶解时放热有挥发性2.盐酸、稀硫酸的化学性质(1)与酸碱指示剂的作用酸溶液都是酸性溶液,就能使紫色石蕊试液变红,能使蓝色石蕊试纸比那红,pH小于7,但酚酞试液遇酸溶液不会变色。
(2金属酸化学方程式现象Mg稀盐酸Mg + 2HCl == MgCl2+ H2↑金属表面有气泡产生Zn Zn + 2HCl == ZnCl2 + H2↑(铁反应能看到溶液变成浅绿色)Fe Fe + 2HCl == FeCl2 + H2↑Al Al + 6HCl == 2AlCl3 + 3H2↑Mg稀硫酸Mg + H2SO4 == MgSO4+ H2↑Zn Zn + H2SO4 == ZnSO4+ H2↑Fe Fe + H2SO4 == FeSO4+ H2↑Al2Al + 3H2SO4 == 2Al(SO4)3 + 3H2↑(3反应的化学方程式反应现象Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O溶液变成黄色Fe2O3 + 6HCl == 2FeCl3 + 3H2O(4)稀盐酸与石灰石(碳酸钙)作用(具体反应的现象参照“二氧化碳的实验室制法”)反应的化学方程式为:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑(5)酸与碱发生中和反应中和反应是指酸和碱发生的复分解反应,反应生成盐和水,同时放出热量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十讲 常见的物质姓名: 学校: 年级:【课标要求】1.区别金属和非金属,举例说明常见金属的用途与性质的对应关系;2.通过典型的金属和酸以及某些盐的反应,认识金属活动性顺序及其简单、典型的运用;3.铁、铜生锈的条件及防止方法。
4.说出废弃金属对环境的影响,形成自觉回收金属的意识。
5.能够设计实验探究金属的活动性顺序6.区别典型的单质、化合物;7.知道典型金属(镁、铁等)和非金属(碳、硫、磷、氢气等)在空气中或氧气中燃烧的现象及产物;8.识别无机物和有机物;9.列举生活中一些常见的有机物(甲醇、乙醇、醋酸); 10.列举对生命活动具有重要意义的有机物【知识要点】一、材料的种类 1.材料的分类2.材料的组成材料的种类有几十万种,这些材料是由100多种按元素不同的排列组合而成的。
二、金属材料1.金属材料的范围金属用品是由金属材料制成的,日常生活中用到的锄、刀等都是由金属材料制成的,金属材料包括纯金属和它们的合金。
2.合金合金是在金属中加热熔合某些金属或非金属形成的具有金属特性的物质。
3.合金与组成它们的纯金属的性质比较黄铜和铜、焊锡和锡、铝合金和铝的有关性质的比较:性质比较 黄铜 铜 焊锡 锡 铝合金 铝 颜色与光泽 黄色有光泽 紫红色有光泽 深灰色金属光泽 银白色有光泽 银白色有光泽 银白色有光泽 硬度 比铜大 坚韧 硬度大 质软 坚硬 质软 熔点比铜低较高比锡低较低比铝低较高材料 金属材料(合金材料) 无机非金属材料 有机合成材料4.铁合金铁合金主要包括生铁和钢,它们的区别是含碳量不同,生铁含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
钢与生铁相比具有更多的优良性能,如有弹性和延展性,易于加工成形,用途更为广泛。
三、金属防护的方法根据铁生锈的条件,我们应该采取措施防止钢铁生锈,防止铁生锈的基本思路是破坏铁制品锈蚀的条件,使铁制品隔绝空气或水。
具体方法:(1)保持铁制品的洁净和干燥;(2)在铁制品表面制成保护膜。
物理方法:涂油、刷油漆,如在暖气片上刷一层“银粉”,既防锈又美观。
化学方法:电镀其他金属,如镀锌、镀铬等或通过化学反应在铁制品的表面生成致密的氧化膜,如烤蓝。
四、无机非金属材料1.分类2.水泥(1)制造:由石灰石黏土混在一起在炉中煅烧成熟料后加石膏磨细而成. (2)应用:水泥与钢筋、沙、搅拌在一志形成坚固的钢筋混凝土,用于各种建筑. (3)种类:①水怕海水侵蚀的矾土水泥;②掺入高炉矿渣的矿渣水泥;③膨胀水泥等. 3.玻璃(1)制造:将石英砂、苏打(Na 2CO 3)和石灰石等经过配料、熔化、成型、退火等工序制成的. (2)种类 4.陶瓷(1)制造:天然的硅酸盐和其他矿物原料(如重晶石BaSO 4)制成的. (2)特点:耐水,耐酸碱腐蚀,绝缘性好.常见无机非金属材料 水泥 玻璃 陶瓷玻璃激光玻璃磁性玻璃 抗辐射玻璃 半导体玻璃 防弹玻璃 玻璃纤维五、有机合成材料 1.分类 2.塑料塑料的品种很多,用途也各不相同,下表列出几种塑料的性能和用途. 六、一些简单的有机物1.有机物是一类含碳化合物(除碳的氧化物、碳酸、碳酸盐等以餐),大多含有C 、H 、O 、N 等元素.2.沼气的产生及成分(1)沼气的产生:稻草及动物粪便经过发酵会产生大量的沼气 (2)沼气的主要成分:甲烷(CH 4) 3.简单的有机物(1)甲烷实验:点燃甲烷气体,在火焰上方罩一个内壁蘸有澄清石灰水质 烧杯(如图所示),观察对象:烧杯内壁有水珠生成,澄清石灰水变浑浊.(2)丁烷除了甲气体外,打火机内液体的主要成分丁烷气体也是一种简单有机物,其化学式为C 4H 10(家用液化气的主要成分也是丁烷气体,气态的丁烷经压缩后变成液态,灌装在容器中贮存,使用时经减压,使液态丁烷气化成气体).(3)乙炔乙炔气体(C 2H 2)也是一种简单有机物,它在氧气中燃烧可产生3000℃以上的高温,生产中可利用这个反应进行金属的焊接和切割. 七、对生命活动具有重大意主的有机物 1.糖类糖类是人体消耗能量的主要业源,也是合成人体的许多重要化合物的原料. 2.蛋白质蛋白质是构成生物体的基本物质,蛋白质是细胞结构里最复杂多变的一类大分 子,相对分子质量约在1.2万至100万之间.有机合成材料 合成塑料合成纤维合成橡胶3.脂肪脂肪主要以贮存能量的形式存在于体内,它从外界进入体内,经过酶的作用,一部分通过氧化转化为生命活动所需同的能量,另外一部分被人体吸收后又转化为脂肪贮存在皮下,随时供人体代谢的需要.【典型例题】例1、考古发现,早在一万多年前我国已经开始制造和使用陶器,现在人们已能生产出新型陶瓷材料,如用氧化铝等为原料生产发动机零件。
下列有关氧化铝陶瓷的说法正确的是()A、该陶瓷属于有机合成材料 B、该陶瓷中的原料氧化铝属于非金属氧化物C、该陶瓷耐高温、强度高D、该陶瓷耐酸、碱等化学物质的腐蚀例2、下列关于环境保护问题的叙述,错误的是()A、“绿色化学”是指对环境无害的化学B、“白色污染”主要是指白色粉尘等对环境造成的污染C、“温室气体”主要是指二氧化碳、甲烷等气体D、大气中的二氧化硫、氮氧化物是导致“酸雨”的主要原因例3、许多资源都是不可再生的,每个公民都应树立保护资源的观念,下列做法不利于保护金属资源的是()A、采取各种防锈方法避免金属锈蚀B、用塑料代替合金制造管道C、私挖、滥采矿物D、回收利用铝制饮料罐例4、下列物质的主要成分是有机物的是()A.石灰石 B.干冰 C.天然气 D.木炭粉例5、为了减少大气污染,北京市积极推广使用清洁燃料,目前汽车使用的清洁燃料有两类,一类是液化石油气(LPG),另一类是压缩天然气(CNG).压缩天然气主要成分的化学式是( )A.CH3COOHB.C2H5OHC.CH3OHD.CH4点燃例6、某化合物(用X表示其化学式)燃烧时发生的反应为2X+5O2 4CO2+2H2O,根据质量守恒定律,可判断X为( )A. C2H2B.C2H5OHC.CH3OHD.CH3COOH例7、最近,新华社的一条消息披露:我国南海海底发现了巨大的”可燃冰”分布带,其能源总量估计相当于我国石油总量的一半.”可燃冰”的主要成分是一水合甲烷晶体(CH4·H2O).请结合初中所学化学知识判断,下列说法正确的是( )A.“能燃烧,说明水具有可燃性B.“可燃冰”的发现为我国在新世纪使用高效新能源开辟了广阔的前景C.“可燃冰”由四种元素组成D.“可燃冰”的主要成分是固态水例8、某有机物在空气中完全燃烧时生成CO2和H2O的质量比为11:9则该有机物可能是( )①CH4②C2H2; ③C2H5OH; ④CH3OHA.①④B.②③C.①②D.①③【经典练习】1. 有机高分子合成材料的出现是材料发展史上的一次重大突破,下列属于有机高分子合成材料的一组是()①家用保鲜袋②不锈钢③淀粉④尼龙布⑤汽车轮胎A.①④⑤B.②③④C.②③⑤D.①⑤2.食品安全与人类的健康密切相关.下列做法不会危害人体健康的是()A.食用加碘盐和加铁酱油B.常吃加入明矾[KAl(SO4)2·12H2O]炸制的油条C.用胆矾对饮用水杀菌消毒D.用工业用盐(NaNO2)腌制咸菜3.为了加大环保力度,许多城市的地方法规规定,不准销售和使用的物质是()A.合成纤维B.含磷洗衣粉C.合成橡胶D.玻璃钢4.保护人类赖以生存的家园,以下做法不利于环境保护的是()A.分类回收垃圾B.天然气代替煤作燃料C.污水处理后排放D.焚烧废旧塑料袋5.硬铝的下列性质中,与制造飞机外壳无关的是()A.导电性较好B.密度较小C.耐腐蚀性较强D.焚烧废旧塑料袋6.化学使世界变得更加绚丽多彩,社会的文明和进步离不开化学.下列事实中与化学无关的是()A.食物、衣料和日常用品的丰富B.指南针的发明与应用C.新型高分子化合物的合成D.药物和保健品的研制7.下列关于化学的看法错误..的是( )A.化学可以为人类研制新材料B.化学正在环境保护中发挥重要作用C.化学可以为人类提供新能源D.化学的发展必然导致生态环境的恶化8.下列各物质中,属于合成材料的是A.陶瓷B.聚乙烯塑料C.生铁D.钢筋混凝上9.聚乳酸[(C3H4O2)n]是一种对人体无毒无害且可生物降解的理想的高分子环保材料,合成聚乳酸的原料是乳酸(C3H6O3)。
下列说法正确的是A聚乳酸的相对分子质量是72 B.聚乳酸的合成过程属于物理变化C.乳酸的相对分子质量等于90 D.乳酸充分燃烧的生成物只有CO210.“春蚕到死丝方尽”,这里“丝”的主要成分是()A.维生素B.蛋白质C.纤维素D.油脂11.为了加大环保力度,许多城市的地方法规规定,不准销售和使用的物质是()A.合成纤维 B.含磷洗衣粉 C.合成橡胶 D.玻璃钢12.有关机构于2005年2月18日发出警告:“苏丹红一号”可能致癌。
已知“苏丹红一号”是系列染料之一,其化学式为C16H12N2O 。
下列关于“苏丹红一号”的说法中,正确的是A.它是一种氧化物B.其组成中含有氮分子C.它的分子里C、H、N、O四种元素的原子个数比是8:6:1:1D.“苏丹红一号”中C、H、N、O四种元素的质量比是48:3:7:413.人体中生命必需元素含量的多少直接影响人的健康。
缺少某种元素可能导致骨质疏松,该元素是A. 碘B. 铁C. 钙D. 锌14.下列对塑料的认识正确的是A. 塑料属于天然有机高分子材料B. 废弃塑料是造成“白色污染”的主要物质C. 所有塑料都容易燃烧并产生有毒气体D. 塑料给人类带来了污染,因此要禁止生产和使用15.科学家发现半胱氨酸(一种氨基酸)能增强艾滋病毒感染者的免疫能力,半胱氨酸的化学式为C3H7NSO2。
下列说法正确的是A.半胱氨酸属于无机物B.半胱氨酸属于氧化物C.半胱氨酸属于化合物D.半胱氨酸由5个原子组成16.胃酸的主要成分是盐酸,胃酸过多的病人需用药物治疗,下列药物(主要成分)不能用于治疗胃酸过多是A.N a C lB.A l(O H)3C.CaCO3D.M g(O H)217.下列常见材料中,属于有机合成材料的是A.水泥B.塑料C.棉布D.不锈钢18.长期吸食或注射毒品会危及人体健康,以下各组中不属于...毒品的是A.冰毒、杜冷丁B.毒鼠强、敌敌畏C.吗啡、摇头丸D.海洛因、大麻19.下列说法不正确...的是A.厨房洗涤剂清洗油污后形成溶液B.用硬水洗衣服不如用软水洗得干净C.硝酸铵溶于水制得的冰袋可用于给高烧病人降温D.冬季向公路上的积雪撒盐,可使冰雪快速融化20.下列叙述不科学...的是A.含氟牙膏可预防龋齿B.误食重金属盐后,可喝鲜牛奶急救C.维生素可以调节人体的新陈代谢D.可用聚乙烯或聚氯乙烯塑料包装食品21 在下列情况下,埋在地下的铸铁管道腐蚀最快的是()A、在潮湿、致密的土壤中B、在干燥、疏松的土壤中C、在潮湿、疏松的土壤中D、在干燥、疏松的土壤中22 下列对金属及金属资源的认识中,正确的是()A、废弃易拉罐无回收价值B、用水冲洗自行车可防止生锈C、生铁是纯净的铁D、赤铁矿的主要成分是Fe2O323.下列有关金属和金属材料的说法不正确的是()A、铁有良好的导热性,常用来制作炊具B、废旧电池中汞的回收可减少对环境的污染C、铜的化学性质不活泼,在潮湿的空气中不会生锈D、铝表面易形成致密的氧化膜可阻止铝进一步被氧化24.某新型“防盗玻璃”有多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,与金属线相连的警报系统就会立刻报警.“防盗玻璃”能报警,这利用了金属的()A.延展性B.导电性C.弹性D.导热性25.有下列六种物质:①纯净的空气②氮气③硫磺④矿泉水⑤氯酸钾⑥黄酒,其中属于混合物的有;属于纯净物的有26.据有关资料报道,现在世界上每年因腐蚀而报废的金属材料相当于其年产量的20%~40%。
