葱兰和韭兰花色色素种类和质量分数的研究_董博
花色色素分析实习

实习“花色”第八学期园艺学对于花色色谱来说有三类结构完全不同的物质:类黄酮、类胡萝卜素和甜菜碱。
其中类黄酮特别是花青素是最重要的花色素。
关于类黄酮生化和遗传学方面的细节在附件一中集中列举。
I.萃取和鉴定花青素苷、花青素和其他类黄酮花青素和其他类黄酮可以利用1%的甲醇盐酸(1%MeOH/HCl=97ml Methanol + 3 ml 36% HCl)从花瓣或者其他植物部位萃取出来。
为了防止花青素降解,萃取最好在暗处和4°C 条件下进行。
盐酸能够使花青素稳定。
根据需要和可支配时间不同可以选择主动和被动萃取方法。
(1)主动(快速)萃取:将部分含有花青素的植物组织和少量1%的MeOH/HCl一块在离心管里面弄碎(用小铲子)或者在研钵里面捣碎,组织残渣可以选择离心去掉。
优点:-快速萃取-得到浓缩的花青素萃取物,可以立即用来进行分光光度计检测或者色谱检测缺点:-对于定量分析来说不是十分精确,或许不是所有的色素能够被同时萃取出来-对于大量样本的试验来说,消耗大量的操作时间(2)被动(慢速)萃取:将含有花青素的组织放在密封良好的器皿里面(离心管、烧瓶等)用1%的MeOH/HCl 淹没,然后放在4度暗处(冰箱里面)几天甚至几周萃取优点:-大量样本时减少萃取操作时间-可以进行定性分析,例如1克花放在20-40ml 1%的MeOH/HCl里面萃取大约40个小时,随后可以用分光光度计来测量其含量缺点:-萃取时间长-萃取物需要一般情况下需要在旋转蒸发仪里面浓缩后才能用来进行色谱分析。
被动萃取同样对于其他类黄酮(例如黄酮醇、黄酮、黄烷酮、二轻黄酮醇)的提取具有优势。
尽管他们的萃取液不是1%的MeOH/HCl而是乙酸乙酯(Ethylacetat-EtoAc).这样的话在其他类黄酮被萃取出的时候,花青素就能保留在水相里面。
不管哪种萃取方法,萃取物都可以在4度暗处超过一个月甚至一年保存。
被萃取的植物组织应该在保存前去掉(离心、过滤)。
园林地被植物

观赏特性:多年生草本。鳞茎卵球形 ,直径2-3厘米。基生叶常数枚簇生, 线形,扁平,长15-30厘米,宽6-8毫 米。花单生于花茎顶端,下有佛焰苞 状总苞,总苞片常带淡紫红色,长4-5 厘米,下部合生成管;花梗长2-3厘米 ;花玫瑰红色或粉红色;花被管长12.5厘米,花被裂片6,裂片倒卵形, 顶端略尖,长3-6厘米;雄蕊6,长约 为花被的2/3-4/5,花药丁字形着生; 子房下位,3室,胚珠多数,花柱细长 ,柱头深3裂。蒴果近球形;种子黑色 。花期夏秋。
观赏特性:茎匍匐、无毛 ,叶具 3小叶 ;小叶
倒卵形至近心脏形 ,长 1.2~ 2cm ,宽 1~1.5 cm ,先端圆或凹陷 ,基部楔形 ,边缘具细锯齿 , 上面无毛 ,下面微有毛 ;几无小叶柄 ;托叶椭圆 形 ,抱茎。花序呈头状 ,有长总花梗 ;萼筒状 ,萼 齿三角形 ,较萼筒短 ,均有微毛 ;花冠白色或淡红 色。荚果倒卵状矩形 ,长约 3mm ,包被于膜质 , 膨大 ,长约 1cm的萼内 ,含种子 2~ 4粒 ;种子 褐色 ,近圆形。
白车轴草
白车轴草(Trifolium repens L)又名白三叶、白花 三叶草、白三草、车轴草、荷兰翘摇等,多年生草 本;短期多年生草本,为栽培植物,有时逸生为杂 草,侵入旱作物田,危害不重,对局部地区的蔬菜、 幼林有危害。生长期达6年,高10-30厘米。 主根短,侧根和须根发达,茎匍匐蔓生,上部稍上 升,节上生根,全株无毛。掌状三出复叶;托叶卵 状披针形,膜质,基部抱茎成鞘状,离生部分锐尖。 其适应性广,抗热抗寒性强,可在酸性土壤中旺盛 生长,也可在砂质土中生长,有一定的观赏价值, 是世界各国主要栽培牧草之一,在中国主要用于草 地建设,具有良好的生态和经济价值。
观赏特性: 鳞茎肥厚,呈球形,直径达2厘米, 具白色膜质叶鞘。叶多为半圆柱形, 中央稍空,长约30厘米,宽约5毫米,叶 鞘长5-20厘米。花茎直立,高30-60厘米 ,伞形花序球形,具多数花,径2-5厘米 ,花被粉红色,花被片卵状长圆形,长 4-5毫米,基部稍结合,先端钝或锐尖, 背脊紫红色;雄蕊较花被长,着生于花 被基部,花丝下部扁而阔,基部略连合 ;花柱外露;柱头小,不分裂。花期5-7 月。球根花卉,株高30~50公分,具圆 柱形小鳞茎,成株丛生状。茎叶均含有 韭味。顶生聚伞花序开紫粉色小花。
不同施肥处理对长白山区林下仿生栽培茖葱物质积累与产量的影响

中国瓜菜2023,36(4):113-117收稿日期:2022-08-08;修回日期:2022-11-24基金项目:吉林省财政公益项目(GY-2020-09)作者简介:徐光花,女,高级工程师,主要从事林业档案管理与林业科普工作。
E-mail :****************通信作者:冯博,男,助理研究员,主要从事珍贵树种与林下经济植物栽培研究。
E-mail :******************茖葱(Allium victoralis L.)属百合科(Liliaceae )葱属(Allium ),是一种历史悠久、开发潜力较大的药食同源植物,并以其营养保健功效与独特口感而逐渐受到人们关注[1]。
据史料记载,茖葱在我国黑龙江、吉林、辽宁、河北、山西、陕西等多地均有分布,但目前在吉林省,野生茖葱仅在东部长白山区有少量分布。
近年来,环境的剧烈变化与连年过度采挖使野生茖葱种质资源受到了严重威胁[2]。
此外,由不同施肥处理对长白山区林下仿生栽培茖葱物质积累与产量的影响徐光花1,刘佳艺2,李成龙3,冯博1(1.吉林省林业科学研究院长春130033;2.长春市净月设计集团有限公司长春130118;3.长春市净月潭实验林场长春130118)摘要:为探究施肥处理对长白山区林下仿生栽培茖葱(Allium victoralis L.)物质积累与产量变化的影响,以长白山区敦化宽叶型茖葱植株为试验材料,对林下仿生栽培茖葱在不同氮磷钾施肥处理组合下的生物量、营养物质含量与产量差异进行了分析。
结果表明,施肥处理能够在一定程度上促进林下仿生栽培茖葱植株各部分的生物量与营养物质积累。
T4处理(即N 150kg ∙hm -2,P 2O 575kg ∙hm -2,K 2O 150kg ∙hm -2)有效地促进了林下仿生栽培茖葱植株各部分生物量,尤其是叶片生物量的积累,其叶片干质量最终比CK 处理增加了28.57%。
此外,T4处理下的维生素C 、可溶性糖、可溶性蛋白含量与产量均高于其他处理,分别比CK 处理增加了26.91%、40.47%、18.56%与42.82%。
两种葱属植物柱头可授性检测

i 荧 光 显 微 镜 330 ~ 380 波 段 下 ,用 10 倍 镜 进 行
柱头可授性百分率 = 具可授性的柱头数/观察
总柱头数 × 100%
1.5
(1)
数据处理
试验数据处理采用Excel软件,图片整理采用
透 ,放 在 避 光 的 处 反 应 10 min,若 柱 头 具 有 可 授
Photoshop CC软件。
比较[J]. 西北园艺,2019(4):52-53.
2022·01
61
实验技术 SHIYANJISHU
知母薤(Allium cernuumSchrenk.)为百合科葱属
植物,花序半球形至球形,花天蓝色,具深色的脉,
花丝长为花被片3/4的长度,花期为5 ~ 6月,生于荒
时期,知母薤分为7个时期,分别取各时期的柱头进
闭合
Ⅵ
花被片即将完全闭合
Ⅶ
花被片完全闭合
Ⅱ
Ⅳ
Ⅷ
Ⅸ
Ⅹ
5 枚花药已散粉
6 枚花药已散粉,柱头等于花丝
花被片完全闭合、略萎蔫,花丝、柱头开始萎蔫
花被片萎蔫略干枯、柱头萎蔫
花被片完全干枯,柱头、花丝干枯,子房膨大
通过田间定株观察,当棱叶韭和知母薤处于盛
花期时,根据单花的开花动态,将棱叶韭分为10个
62
2022·01
深 ,柱 头 可 授 性 由 弱 变 强 。 若 没 有 可 授 性 ,则 柱
2.1
性 ,则 柱 头 被 染 成 深 蓝 色 或 深 紫 色 ,颜 色 由 浅 变
2
结果与分析
棱叶韭柱头可授性
头没有颜色反应。
1.4.2
由表3和图1可知,采用MTT法,第Ⅲ时期及之前
几种花叶线艺兰叶片色斑色素组成和叶绿体超微结构研究

F N Y npn ,IH i n ,IH oj n A a —ig L u— g L a -a h i
( o eeo ot ut eSuhC iaA r .U i. G agh u50 4 ,hn ) C l g f rc u ,ot hn g c nv , un zo 16 2 C ia l H il r i Ab ta tT ev r t su e n ti rs ac ee C mbd u ¥r rec .Jn z i C mb im ies V sr c : h ai i sd i s e e rh w r y iim ie v i —u , y i u sn neC . ee h t ̄ d
Pim e tCo p sto nd Ulr s r c u a fe e c f Ch o o a t g n m o ii n a t a t u t r lDi r n e o l r pls i n Thr e K i dso re a in a fC m bdi m i n e e n fVa i g to Le fo y i u sne s
而在叶片黄斑部分的 细胞 中 , 基本上看不到完整 叶绿体 , 淀粉粒逐 渐消失 , 基质 中存 在很多嗜锇滴. 关键词 : 线艺 兰 ; 素;叶绿体 ; 色 超微结 构 ; 墨兰 中图分类号 :6 2 ¥8 文献标识码 : A 文章编号 :0 14 1 20 ) 2 0O —5 10 — 1X( 0 6 0 —0 80
ae i n o psinadut s utr f hool t ees c t ntegenae f i— rai pg t m oio lat c eo clrpa r i n me c t n r r u sw  ̄ a .I re rao n n h J
菠菜色素的提取与分离 小论文

菠菜色素的提取与分离作者 xxx 指导老师 xxx摘要用3:2的石油醚—乙醇多次研磨菠菜叶,经抽滤、浸泡提取其中的色素成分,使用薄层析法、柱层析法对胡萝卜素、叶绿素和叶黄素进行了分离。
展开剂为3:2的石油醚—乙酸乙酯、3:1的石油醚—乙酸乙酯,洗脱剂为3:1的石油醚—乙酸乙酯、3:2的石油醚—乙酸乙酯。
前言天然色素有高梁红、从姜黄素、柿子红色素、番茄红素、黄色素、花青素,辣椒红素[1]焦糖色素(即糖色)、栀子黄、栀子蓝、红花黄色素、苋菜红、叶绿素、类胡萝卜素、茶色素,等等[2]。
其中叶绿素a和叶绿素b为吡咯衍生物与金属镁的配合物,其差别仅是叶绿素a中一个甲基被叶绿素b中的甲酰基所取代。
胡萝卜素是一种橙色天然色素,属于四萜类,为一长链共轭多烯,有α、β、γ三种异构体,其中,β异构体含量最多。
叶黄素为一种黄色色素,与叶绿素同存在于植物体中,是胡萝卜素的羟基衍生物,较易溶于乙醇。
发展至今,天然色素的提取方法常见的有有机溶剂提取法、碱液提取法、超临界提取法、微波萃取法等几种方法,常用的提取剂有甲醇、乙醇、丙酮、乙酸乙酯、氯仿、三氯乙烷等。
[2]常用的分离方法有薄层色谱法、柱层色谱法。
[3]其中柱中填料可为硅胶、氧化铝,洗脱剂有石油醚—丙酮、丁醇—乙醇—水、环己烷、二氯甲烷、醋酸乙酯、丙酮、甲醇等极性不同的有机溶剂或其混合溶剂。
[4]一般用硅胶G与蒸馏水按一定比例溶解后涂板,展开剂为氯仿、石油醚、丙酮、苯、石油醚—乙酸乙酯。
[3]开发天然色素是世界食用色素业和医药等行业的发展趋势之一。
我国目前还处在合成色素与天然色素并存及同时发展的状态。
由于合成色素的安全性问题,少合成色素在各国允许使用的程度被大大限制,尤其是在食品、医药和化妆品行业,所以,天然色素的提取和应用是现在和未来发展的主要方向。
[1]1 实验部分1.1仪器与试剂仪器:布氏漏斗、研钵、分液漏斗、毛细管、层析柱、展板试剂:石油醚、乙醇、菠菜叶、乙酸乙酯、无水硫酸钠、饱和盐水、硅胶G 1.2 提取与分离1.2.1 抽滤与浸泡法提取菠菜色素取20g 洗净且用滤纸吸干的新鲜菠菜叶, 用剪刀剪碎并与20mL 乙醇拌匀, 在研钵中研磨约5min, 然后用布氏漏斗轻微抽滤, 弃去滤液. 将菠菜汁放回研钵, 加10mL3:2的石油醚—乙醇适当研磨,抽滤,重复二次, 将每次的提取液转移到分液漏斗, 然后用10mL 盐水洗涤两次, 以除去萃取液中的乙醇(洗涤时轻轻振荡, 以防止乳化), 弃去水—乙醇层,石油醚层用无水硫酸钠干燥后体积约为2mL.1.2.2薄层析法分离菠菜色素在制好的薄层析板上用毛细管在距一端1cm 画线处点样,将已点好样品的薄层板分别放入装有20mL3:2的石油醚—乙酸乙酯、3:1的石油醚—乙酸乙酯展开剂的大烧杯中, 浸入展开液展开, 待溶剂到达距薄板的另一端2cm 左右时, 取出薄板计算各组分Rf 值:前沿的距离离至原点至溶剂斑点的距原点 f R 1.2.3 柱层析法分离菠菜色素① 湿法装柱:在20cm*10cm 的底部带有脱脂棉的层析柱中,将10g 层析用的硅胶80目溶于30mL 的石油醚后,缓缓加入其中,小心打开柱下活塞,流下的硅胶在柱子中堆积。
【精品中考化学】北京市2020届初三专题二模化学试题分类汇编—科普阅读理解 +答案

北京市2019届初三专题复习—2019年各城区二模化学试题分类汇编科普阅读理解(海淀二模)16.(5分)阅读下面科普短文。
花青素是广泛存在于植物中的水溶性天然色素。
自然界中现已知的花青素有20多种,植物中的花青素主要包括飞燕草、矢车菊、矮牵牛、天竺葵、芍药、锦葵色素等6种。
水果、蔬菜、花卉中的主要呈色物质大部分与花青素有关。
花青素类物质的颜色会随着植物液泡中pH的不同而变化。
花青素具有抗氧化性,能够与多种对人体有害的自由基反应,保护人体免受自由基损伤。
例如,蓝莓中的花青素是迄今发现的最高效的抗氧化剂, 它的抗氧化性比维生素E高出50倍, 比维生素C高出20倍。
由于花青素的营养和药理作用, 其保健功效已经得到广泛认可。
研究人员选取部分植物对上述6种花青素的含量进行测定,研究结果如表1。
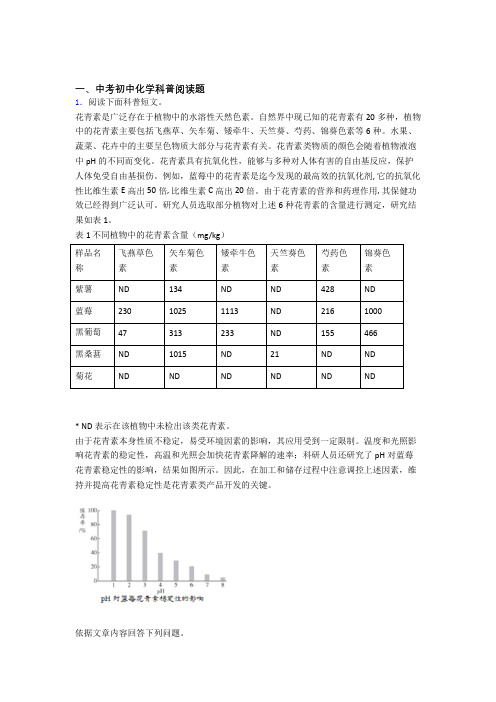
表1 不同植物中的花青素含量(mg/kg)名称色素色素色素色素色素色素紫薯ND 134 ND ND 428 ND蓝莓230 1025 1113 ND 216 1000黑葡萄47 313 233 ND 155 466黑桑葚ND 1015 ND 21 ND ND* ND表示在该植物中未检出该类花青素。
其应用受到一定限制。
温度和光照影响花青素的稳定性,高温和光照会加快花青素降解的速率;科研人员还研究了pH对蓝莓花青素稳定性的影响,结果如图1所示。
因此,在加工和储存过程中注意调控上述因素,维持并提高花青素稳定性是花青素类产品开发的关键。
图1 pH对蓝莓花青素稳定性的影响依据文章内容回答下列问题。
(1)矢车菊色素(C15H11O6)中碳、氢、氧原子的个数比为:。
(2)文中提到花青素的化学性质有(写出一条即可)。
(3)根据表1,若要补充花青素,首选的食物是。
(4)由图1得出的结论为。
(5)下列说法正确的是(填字母序号)。
A. 花青素有可能用于制作酸碱指示剂B. 菊花不适合提取花青素C. 富含花青素的食品尽量避光、避免高温保存D. 只有富含花青素的食物才具有抗氧化性(朝阳二模)16.(5分)阅读下面科普短文。
小苍兰花瓣花黄色素组成和含量分析

热带作物学报2021, 42(4): 1136 1144Chinese Journal of Tropical Crops小苍兰花瓣花黄色素组成和含量分析朱佳意1,唐东芹1*,李欣21. 上海交通大学设计学院,上海 200240;2. 上海交通大学分析测试中心,上海 200240摘要:以6个不同花色的小苍兰品种为实验材料,在量化小苍兰花色表型和初步确定花瓣色素类型的基础上,利用UPLC-Q-TOF-MS技术鉴定花瓣中的花黄色素组成并比较分析各组分含量。
结果表明:在小苍兰花瓣中鉴定到13种黄酮及黄酮醇物质,分别为槲皮素、山萘酚、异鼠李素、柚皮素、黄芩素及其糖苷;槲皮素及其糖苷是小苍兰花瓣中重要的黄酮醇物质;随着小苍兰的花朵开放,花黄色素含量多呈下降趋势;在不同小苍兰品种中,花黄色素含量存在明显差异,其中,红、紫色系品种含量显著高于黄、白色系品种,尤其是‘上农红台阁’‘Red Passion’和‘Castor’,其含量在各发育阶段均表现为较高水平的积累。
此外,花色表型为复色的‘Red Passion’和‘Castor’中上部与基部花瓣的花黄色素含量存在显著差异。
相关分析表明,各花黄色素组分的积累与小苍兰花色明度均呈极显著负相关;槲皮素、异鼠李素及其糖苷含量与花色红度呈极显著正相关,柚皮素、山萘酚及其糖苷与花色红度呈显著正相关;山萘酚及其糖苷含量与花色鲜艳程度呈显著正相关。
可见,花黄色素影响小苍兰的花色呈现。
关键词:小苍兰;花黄色素;黄酮;黄酮醇;四级杆飞行时间串联质谱;花色中图分类号:Q946 文献标识码:AAnalysis of Composition and Content of Anthoxanthins in Petals of Freesia hybridaZHU Jiayi1, TANG Dongqin1*, LI Xin21. School of Design, Shanghai Jiao Tong University, Shanghai 200240, China;2. Instrumental Analysis Center, Shanghai Jiao Tong University, Shanghai 200240, ChinaAbstract: In this study, the petal color of Freesia hybrida was measured by the colorimetric card and color meter, then the composition and content of anthoxanthins in petals were analyzed using UPLC-Q-TOF-MS in order to explore the relationship between petal color and the anthoxanthins content. The results showed that 5 flavonoid aglycones, up to 13 flavones and flavonols, were detected in the petals of F. hybrida for the first time. Quercetin and its glycosides proved to be an important flavonol in the petals. During flowering stages, the content of anthoxanthins decreased in general. There were significant differences in the content and components of anthoxanthins among cultivars, namely the content in red and purple cultivars, especially in ‘SN Hongtaige’, ‘Red Passion’ and ‘Castor’, were significantly higher than that in yellow and white cultivars. Significant difference in the content of anthoxanthins between the top and the base petals of ‘Red Passion’ and ‘Castor’ was reported. Correlation analysis showed a significant negative correlation between the accumulation of anthoxanthins and the brightness of the petals. The redness of petals showed a significantly positive correlation with quercetin and isorhamnetin glycosides, and a positive correlation with naringenin and kaempferol gly-cosides. The saturation of petals was positively correlated with kaempferol glycosides. Anthoxanthins proved to be closely related to flower color.Keywords: Freesia hybrida; anthoxanthin; flavone; flavonol; UPLC-Q-TOF-MS; flower colorDOI: 10.3969/j.issn.1000-2561.2021.04.033收稿日期 2020-04-24;修回日期 2020-05-20基金项目 上海市农委科技兴农重点攻关项目(No. G2*******)。
中考化学专题训练---科普阅读题的综合题分类及答案
一、中考初中化学科普阅读题1.阅读下面科普短文。
花青素是广泛存在于植物中的水溶性天然色素。
自然界中现已知的花青素有20多种,植物中的花青素主要包括飞燕草、矢车菊、矮牵牛、天竺葵、芍药、锦葵色素等6种。
水果、蔬菜、花卉中的主要呈色物质大部分与花青素有关。
花青素类物质的颜色会随着植物液泡中pH的不同而变化。
花青素具有抗氧化性,能够与多种对人体有害的自由基反应,保护人体免受自由基损伤。
例如,蓝莓中的花青素是迄今发现的最高效的抗氧化剂, 它的抗氧化性比维生素E高出50倍, 比维生素C高出20倍。
由于花青素的营养和药理作用, 其保健功效已经得到广泛认可。
研究人员选取部分植物对上述6种花青素的含量进行测定,研究结果如表1。
表1 不同植物中的花青素含量(mg/kg)样品名称飞燕草色素矢车菊色素矮牵牛色素天竺葵色素芍药色素锦葵色素紫薯ND134ND ND428ND蓝莓23010251113ND2161000黑葡萄47313233ND155466黑桑葚ND1015ND21ND ND菊花ND ND ND ND ND ND* ND表示在该植物中未检出该类花青素。
由于花青素本身性质不稳定,易受环境因素的影响,其应用受到一定限制。
温度和光照影响花青素的稳定性,高温和光照会加快花青素降解的速率;科研人员还研究了pH对蓝莓花青素稳定性的影响,结果如图所示。
因此,在加工和储存过程中注意调控上述因素,维持并提高花青素稳定性是花青素类产品开发的关键。
依据文章内容回答下列问题。
(1)矢车菊色素(C15H11O6)中碳、氢、氧原子的个数比为:_________。
(2)文中提到花青素的化学性质有(写出一条即可)_________。
(3)根据表1,若要补充花青素,首选的食物是_________。
(4)由图1得出的结论为_________。
(5)下列说法正确的是(填字母序号)_________。
A 花青素有可能用于制作酸碱指示剂B 菊花不适合提取花青素C 富含花青素的食品尽量避光、避免高温保存D 只有富含花青素的食物才具有抗氧化性【答案】15:11:6 与自由基反应(或颜色随pH值不同而改变、抗氧化性、受热易分解等)蓝莓在pH1~8范围内,随着pH增大,花青素稳定性变差(或保存率变低) ABC 【解析】【分析】化学性质是通过化学变化表现出来的,物理性质是不通过化学变化就有的性质。
葱兰花解剖实验报告

一、实验目的1. 了解葱兰花的结构特点,熟悉其器官组成。
2. 掌握植物解剖实验的基本方法。
3. 培养观察和描述植物器官的能力。
二、实验材料1. 葱兰花(Lycoris squamigera)新鲜植株2. 解剖刀3. 滑石粉4. 显微镜5. 实验记录本三、实验步骤1. 观察葱兰花整体形态,记录花色、花径、花瓣数等特征。
2. 取葱兰花一朵,用解剖刀沿花梗中部将其切开,观察花梗的横切面,记录其结构特点。
3. 取葱兰花花瓣一片,用解剖刀沿花瓣边缘切开,观察花瓣的横切面,记录其结构特点。
4. 取葱兰花雄蕊一朵,用解剖刀沿雄蕊中部切开,观察雄蕊的横切面,记录其结构特点。
5. 取葱兰花雌蕊一朵,用解剖刀沿雌蕊中部切开,观察雌蕊的横切面,记录其结构特点。
6. 将切下的器官放在显微镜下观察,记录其细胞结构。
7. 对实验过程中观察到的现象进行描述和分析。
四、实验结果与分析1. 葱兰花整体形态:葱兰花为多年生草本植物,花色洁白,花径约5-8厘米,花瓣数6-8朵,呈轮状排列。
2. 花梗:花梗横切面呈圆形,直径约2-3毫米,表面光滑。
内部结构由韧皮部、形成层、木质部和髓组成。
3. 花瓣:花瓣横切面呈椭圆形,边缘整齐,厚度约1毫米。
内部结构由表皮、薄壁组织、维管束组成。
维管束呈环状排列,直径约0.5毫米。
4. 雄蕊:雄蕊横切面呈圆形,直径约1毫米。
内部结构由花丝和花药组成。
花丝为圆柱形,表面光滑,直径约0.2毫米。
花药呈长圆形,直径约0.5毫米,内含花粉。
5. 雌蕊:雌蕊横切面呈圆形,直径约2毫米。
内部结构由柱头、花柱和子房组成。
柱头呈圆形,直径约0.5毫米,表面粗糙。
花柱呈圆柱形,直径约0.2毫米,表面光滑。
子房呈椭圆形,直径约1毫米,内含胚珠。
6. 显微镜观察结果:在显微镜下观察,葱兰花的细胞结构清晰可见。
表皮细胞呈长方形,排列紧密。
薄壁组织细胞呈多边形,细胞壁较薄。
维管束细胞呈长方形,排列整齐。
五、实验结论通过本次实验,我们了解了葱兰花的结构特点,掌握了植物解剖实验的基本方法。
红花葱兰的养殖技巧

红花葱兰的养殖技巧红花葱兰为石蒜科葱莲属的植物,花单生于花茎顶端,花玫瑰红色或粉红色,接下来让我们一起去看看红花葱兰的繁殖方法。
红花葱兰也叫韭莲、韭菜兰、韭菜莲、风雨花等,原产墨西哥现世界各地广泛栽培,适合花坛、花径和草地中成丛栽植,也可盆栽供室内观赏,是园林中广泛应用的半阴性地被花卉。
红花葱兰喜温暖、湿润和充足阳光,亦耐半阴和潮湿。
耐寒半阴和潮湿。
耐寒性稍差。
宜排水良好、富腐烈士质的沙壤土。
红花葱兰生长健壮,养护管理简便。
在园林中地栽,选择向阳、温暖、避风场所,生长开花期施3-4次追肥,就能叶茂花盛。
长江中下游地区露地栽培,严冬重霜后,老叶枯萎,鳞茎可留地越冬,翌年照常开花,红花葱兰株丛低矮,花朵繁多,花期6-9月。
盆栽用土以壤土2份、腐叶土和泥炭1份加少量细砂混合,并加少量骨粉和腐熟堆肥。
生育期要有充分的阳光和水分,一批花凋谢后,暂停浇水7-8周后再恢复浇水,如此干湿间隔,一年内可开花2-3茬。
红花葱兰株丛低矮,花朵繁多,花期6-9月。
除花之外,其外观特像韭菜,油绿色的叶片,呈扁线形,弯曲地悬空低垂,几乎贴到地面。
春夏问开花,花粉红色,适合花坛、花径和草地中成丛栽植,也可盆栽供室内观赏,是园林中广泛应用的半阴性地被花卉。
同品种还有白花葱兰等。
红花葱兰以种子繁殖,可用分株法或鳞茎栽植,全年均能进行,但以春季最佳。
只要将球根掘起,每处植3-5个球,浇水保持适当的湿度,极易成活。
掘取球根时,注意勿使球根受伤。
若带有太多叶片及花茎,将上部剪除,保留完整的球根及6-8厘米的叶片种植即可。
若球根已萌发花蕾,分枝后充分浇水,红花葱兰仍能开花。
红花葱兰在园林中种植,选择向阳、温暖、避风场所,生长开花期施3-4次追肥,就能叶茂花盛。
长江中下游地区露地栽培,严冬重霜后,老叶枯萎,鳞茎可留地越冬,翌年照常开花。
盆栽用土以壤土2份、腐叶土和泥炭1份加少量细砂混合,并加少量骨粉和腐熟堆肥。
红花葱兰生育期要有充分的阳光和水分,一批花凋谢后,暂停浇水7-8周后再恢复浇水,如此干湿间隔,一年内可开花2-3茬。
7_种独蒜兰属植物光合特性比较研究

2210㊀㊀2023年第64卷第9期收稿日期:2022-08-15基金项目:杭州市科技发展计划项目(20201203B114)作者简介:赵博(1989 ),男,河北唐山人,助理研究员,博士,主要从事草莓新品种选育及分子生物学工作,E-mail:1074854034@㊂通信作者:柴伟国(1970 ),男,浙江杭州人,研究员,学士,主要从事蔬菜㊁中药材育种与栽培技术研究工作,E-mail:kuni@㊂文献著录格式:赵博,裘劼人,柴伟国.7种独蒜兰属植物光合特性比较研究[J].浙江农业科学,2023,64(9):2210-2213.DOI:10.16178/j.issn.0528-9017.202208727种独蒜兰属植物光合特性比较研究赵博,裘劼人,柴伟国∗(杭州市农业科学研究院,浙江杭州㊀310024)㊀㊀摘㊀要:以台湾独蒜兰㊁秋花独蒜兰㊁独蒜兰㊁云南独蒜兰㊁大理独蒜兰㊁四川独蒜兰和美丽独蒜兰7个独蒜兰品种为试验材料,采用LI-6400便携式光合作用测定仪对其光合特性(光响应曲线和叶绿素含量)进行了测定分析,旨在探究各个独蒜兰品种的光合生理特性及差异,为探究独蒜兰的栽培条件提供理论基础㊂结果表明,在7种独蒜兰中,美丽独蒜兰具有最高的最大净光合速率,光合能力最强㊂台湾独蒜兰对光的适应范围较广㊂秋花独蒜兰㊁四川独蒜兰和独蒜兰对栽培环境的光条件要求较高,要注意避免光强过剩造成的光抑制现象㊂大理独蒜兰和云南独蒜兰的光补偿点最低,利用弱光的能力强,同时叶绿素含量较高,适合阴生环境㊂基于本研究结果,对独蒜兰的科学栽培管理进而提高独蒜兰属植物的栽培质量具有一定指导意义㊂关键词:独蒜兰;叶绿素;光合参数;光合特性中图分类号:S682㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:0528-9017(2023)09-2210-04㊀㊀独蒜兰属(Pleione D.Don )隶属于兰科(Orchidaceae)树兰族(Trib.Epidendreae Humb.,Bonpl.et Kunth),独蒜兰的褶片是区分独蒜兰属不同种的主要特性㊂我国独蒜兰主要分布在长江流域及以南的各省深山中高海拔的溪谷石壁和灌丛中,生于海拔900~3600m 的密林下腐殖质丰富的土壤或沟谷旁有苔藓覆盖的石壁上㊁裸露的树干上或灌木丛下有腐殖土的地上㊂独蒜兰属多年生草本植物,半附生,分布于我国四川㊁云南㊁贵州㊁广西㊁广东㊁江西㊁湖南㊁湖北㊁陕西㊁甘肃等省区,资源稀少,其对环境的要求较高,喜凉爽㊁湿润的半阴环境㊂全球约有独蒜兰属植物27种和9个天然杂交种,独蒜兰属仅在欧美㊁日本及中国台湾有较广泛的栽培应用,英国已培育出445个品种,中国仅见中国科学院昆明植物研究所培育出17个新品种[1]㊂独蒜兰花型奇特㊁花色艳丽,直立花序高15~25cm,适合作小型盆栽花卉,具有较高的观赏价值㊂同时,独蒜兰还具有较高的药用价值,如独蒜兰球茎可入药,有清热解毒㊁化痰散结的功能㊂据‘本草纲目“记载:主治疔肿,可攻毒破皮,解诸毒㊁蛇虫㊁狂犬伤;治痈疽恶疮,可与文蛤㊁麝香㊁干金子霜㊁红牙大戟等配伍;治恶疮及黄疸,可与苍耳草等同用;治牙龈肿痛,用山慈菇的枝和根煎汤随时漱口,漱后吐出㊂独蒜兰属植物遭到过度采挖与不合理开发,资源流失非常严重㊂同时,独蒜兰属因其特殊的生长环境,使得目前中国大陆地区的栽培和育种技术无法满足其资源保护及市场需求[2]㊂发展人工栽培和育种技术来满足市场需求,对杜绝野生资源的破坏及加强保护具有重要意义㊂光合作用是植物最重要的生理功能,是植物合成有机物质㊁获得能量的根本源泉㊂光合作用作为一个易受环境影响的重要生理过程,决定了不同生长环境的植物具有不同的光合特性[3]㊂因此,可通过研究植物的光合特性来探究植物在引种栽培时环境变化中的光合生理[4-5]㊂目前关于独蒜兰属植物的光饱和点㊁光补偿点㊁暗呼吸速率和最大净光合速率等光合特性的报道还不全面,因此,加强对独蒜兰属光合特性的研究是很有必要的㊂鉴于此,本研究通过测定台湾独蒜兰㊁秋花独蒜兰㊁独蒜兰㊁云南独蒜兰㊁大理独蒜兰㊁四川独蒜兰和美丽独蒜兰叶片光响应曲线及叶绿素含量的相关参数,来探究其光合特性,旨在为7种独蒜兰的生产栽培提供一定的理论依据,同时通过进一步探明独蒜兰属植物在光合生理方面的差异,为该属植物的引种栽培及良种培育提供一定参考㊂1㊀材料与方法1.1㊀试验材料㊀㊀项目组引进种植的台湾独蒜兰㊁秋花独蒜兰㊁独蒜兰㊁云南独蒜兰㊁大理独蒜兰㊁四川独蒜兰和美丽独蒜兰7个独蒜兰品种㊂试验在杭州市农业科学研究院的基地进行,每个品种定植于花盆中,常规田间管理,测定所用植株生长健壮,长势一致,选取叶位㊁叶龄一致的叶片进行各项指标的测定, 3次重复㊂1.2㊀试验方法1.2.1㊀光合参数的测定㊀㊀每个品种选取长势一致㊁无病虫害的独蒜兰3株,于晴朗上午9:00用Li-6400光合仪对功能叶进行光合参数指标测定㊂在温度(25ʃ1)ħ㊁相对湿度50%的条件下,利用LED红蓝光源,将光照强度(photosynthetically active radiation,PAR)从0~600μmol㊃m-2㊃s-1分13个梯度(600㊁550㊁500㊁450㊁400㊁350㊁300㊁250㊁200㊁150㊁100㊁50㊁0)进行光合(P n-PAR)响应曲线测定㊂每一光强下适应2min后记录数值[1-2]㊂1.2.2㊀光合色素含量的测定㊀㊀采用95%乙醇浸提法测定[6]㊂称取新鲜样品约0.2g,擦净组织表面污物,剪碎(去掉中脉),研磨成匀浆,过滤,随即浸入盛有95%乙醇的10mL具塞试管中,叶片发白后,将叶绿素提取液倒入光径1cm的比色皿中,以95%乙醇为空白,分别在紫外分光光度计在665㊁649㊁470nm波长下测定吸光度值,计算叶绿素a㊁叶绿素b以及类胡萝卜素的浓度㊂y(mg㊃g-1)=CVN/(mˑ1000)㊂式中:y叶绿素色素的含量;C为色素含量(mg㊃L-1);V为提取液体积(mL);N为稀释倍数; m为样品质量(g);1000是表示1L=1000mL㊂1.2.3㊀数据分析㊀㊀采用植物光合作用对光响应的直角双曲线修正模型[7],利用Excel2010㊁SPSS软件对试验数据进行统计分析及图表制作㊂计算得到暗呼吸速率㊁最大净光合速率(P n)㊁光饱和点(LSP)和光补偿点(LCP)㊂实验各项指标均为3个重复,对结果存在的差异进行显著性分析㊂2㊀结果与分析2.1㊀7个独蒜兰品种光响应曲线及光合参数比较㊀㊀光响应曲线描述的是光强与植物净光合速率间的关系,通过光响应曲线可以求出各种光合生理参数,从而比较不同独蒜兰品种之间光合作用能力的大小㊂对其光响应曲线进行拟合发现,7个独蒜兰品种光饱和点为217~320μmol㊃m-2㊃s-1,光补偿点为5~10μmol㊃m-2㊃s-1㊂暗呼吸速率为0.2~0.3μmol㊃m-2㊃s-1,最大净光合速率为1.2~2.9μmol㊃m-2㊃s-1(表1)㊂整体上来说,独蒜兰各项光合参数值相对较小,弱于其他植物的光合参数值,这也与独蒜兰生长缓慢,阴生的特性一致㊂台湾独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为10.0㊁0.3㊁320.0㊁1.6μmol㊃m-2㊃s-1,秋花独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为7.7㊁0.2㊁224.0㊁1.2μmol㊃m-2㊃s-1,独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为7.3㊁0.2㊁239.0㊁2.5μmol㊃m-2㊃s-1,云南独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为5.0㊁0.2㊁284.0㊁ 2.7μmol㊃m-2㊃s-1,大理独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为5.0㊁0.2㊁267.0㊁1.8μmol㊃m-2㊃s-1,四川独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为8.5㊁0.3㊁217.0㊁2.7μmol㊃m-2㊃s-1,美丽独蒜兰的光补偿点㊁暗呼吸速率㊁光饱和点㊁最大净光合速率分别为7.9㊁0.2㊁299.0㊁ 2.9μmol㊃m-2㊃s-1㊂在7种独蒜兰品种中,秋花独蒜兰的最大净光合速率最弱,表明秋花独蒜兰的光合生产力较弱,从而导致植株生长缓慢(图1)㊂PAR在0~100μmol㊃m-2㊃s-1时,7种独蒜兰的净光合速率值P n都随着PAR的增强而基本呈线性上升趋势,且独蒜兰㊁云南独蒜兰㊁四川独蒜兰和美丽独蒜兰P n的上升趋势要高于台湾独蒜兰㊁秋花独蒜兰和大理独蒜兰㊂当PAR在100~200μmol㊃m-2㊃s-1时,7个独蒜兰品种的P n值增长速率持续减慢㊂当PAR在200~500μmol㊃m-2㊃s-1时,大部分独蒜兰品种P n逐渐趋于平缓;而台湾独蒜兰的P n仍在缓慢增长㊂当PAR到达500μmol㊃m-2㊃s-1以上时,独蒜兰的P n值出现下降趋势,2212㊀㊀2023年第64卷第9期㊀㊀表1㊀7种独蒜兰的光饱和点㊁光补偿点㊁暗呼吸速率和最大净光合速率品种光饱和点/(μmol㊃m-2㊃s -1)光补偿点/(μmol㊃m-2㊃s -1)暗呼吸速率(CO 2)/(μmol㊃m -2㊃s -1)最大净光合速率(CO 2)/(μmol㊃m -2㊃s -1)台湾独蒜兰320ʃ0.26a 10.0ʃ0.09a 0.3ʃ0.06a 1.6ʃ0.02e 秋花独蒜兰224ʃ0.11f 7.7ʃ0.08c 0.2ʃ0.01b 1.2ʃ0.01f 独蒜兰239ʃ0.17e 7.3ʃ0.05d 0.2ʃ0.02b 2.5ʃ0.05c 云南独蒜兰284ʃ0.15c 5.0ʃ0.03e 0.2ʃ0.03b 2.7ʃ0.05b 大理独蒜兰267ʃ0.11d 5.0ʃ0.02e 0.2ʃ0.02b 1.8ʃ0.06d 四川独蒜兰217ʃ0.12f 8.5ʃ0.10b 0.3ʃ0.05a 2.7ʃ0.03b 美丽独蒜兰299ʃ0.25b7.9ʃ0.06c0.2ʃ0.01b2.9ʃ0.07a㊀㊀注:同列数据后无相同小写字母表示不同品种间差异显著(P <0.05)㊂表2同㊂图1㊀7种独蒜兰的光响应曲线可能因为光照过强发生了光抑制(图1)㊂综合来看,独蒜兰㊁云南独蒜兰㊁四川独蒜兰和美丽独蒜兰净光合速率值P n 要高于台湾独蒜兰㊁秋花独蒜兰和大理独蒜兰,表明这4种独蒜兰品种光合能力相对较强㊂2.2㊀7种独蒜兰品种叶绿素含量的比较㊀㊀叶绿素含量的高低是反映植物光合能力的重要指标之一,而叶绿素a 为叶绿素的主要组分[8]㊂由表2可知,在7种独蒜兰品种中,秋花独蒜兰㊁云南独蒜兰以及独蒜兰叶片的叶绿素a 和总叶绿素含量较高,而台湾独蒜兰和四川独蒜兰叶片的叶绿素a 和总叶绿素含量较低㊂表2㊀7种独蒜兰的叶绿素含量单位:mg㊃g-1品种叶绿素a 含量叶绿素b 含量总叶绿素含量台湾独蒜兰0.978ʃ0.003d 0.453ʃ0.011c 1.431ʃ0.014d 秋花独蒜兰 1.255ʃ0.013a 0.592ʃ0.020a 1.847ʃ0.033a 独蒜兰1.250ʃ0.023a 0.488ʃ0.012b 1.739ʃ0.032b 云南独蒜兰 1.304ʃ0.020a 0.510ʃ0.039b 1.814ʃ0.019a 大理独蒜兰 1.099ʃ0.007b 0.456ʃ0.001c 1.555ʃ0.008c 四川独蒜兰 1.048ʃ0.012c 0.436ʃ0.011c 1.484ʃ0.023d 美丽独蒜兰1.108ʃ0.009b0.435ʃ0.019c1.543ʃ0.029c3㊀讨论㊀㊀光合作用是植物最基本的生命活动,是植物合成有机物质㊁获得能量的根本源泉[5-6]㊂LSP㊁LCP 分别代表植物可利用的光合有效辐射的上限与下限,体现植物对强光和弱光的利用能力和对光照条件的要求,较低的光补偿点反映出植物利用弱光的能力较强,较高的光饱和点表明植物能高效利用强光[9-10]㊂本研究中,台湾独蒜兰的LSP 最高,表明台湾独蒜兰对光环境的适应性更广㊂而秋花独蒜兰㊁四川独蒜兰和独蒜兰的LSP 较低,对栽培环境的光条件要求较高,要注意避免光强过剩造成的光抑制现象㊂云南独蒜兰和大理独蒜兰的LCP 最低,表明这两种独蒜兰能更好地适应弱光环境㊂在实际栽培中,可以此为依据进行栽培光环境的调控,以保证栽培品质㊂暗呼吸速率反映植物消耗有机物的能力[6],秋花独蒜兰㊁独蒜兰㊁云南独蒜兰㊁大理独蒜兰㊁美丽独蒜兰的暗呼吸速率低于台湾独蒜兰和四川独蒜兰,表明这5种独蒜兰的呼吸消耗较少㊂在最大净光合速率方面,美丽独蒜兰的数值最高,表现出较高的光合潜能(图1和表1)㊂叶绿素是植物进行光合作用的主要色素,也是影响着光合作用的直接因素,从而影响产量[11]㊂叶绿素的含量和比例是影响叶片光合作用的重要指标,叶绿素a是参与光合作用的主要色素,叶绿素b是辅助色素[12]㊂在本研究中,秋花独蒜兰㊁独蒜兰㊁云南独蒜兰叶片的叶绿素a和总叶绿素含量均显著高于台湾独蒜兰㊁大理独蒜兰㊁四川独蒜兰和美丽独蒜兰,同时独蒜兰㊁云南独蒜兰的最大净光合速率值也比较高(表1和表2),反映了独蒜兰㊁云南独蒜兰的光合速率与叶绿素含量存在一定程度的相关性㊂综上,在7种独蒜兰中,美丽独蒜兰具有最高的最大净光合速率,光合能力最强㊂台湾独蒜兰对光的适应范围较广㊂秋花独蒜兰㊁四川独蒜兰和独蒜兰对栽培环境的光条件要求较高,要注意避免光强过剩造成的光抑制现象㊂大理独蒜兰和云南独蒜兰的光补偿点最低,利用弱光的能力强,同时叶绿素含量较高,适合阴生环境㊂进行独蒜兰属植物光合生理的研究,对独蒜兰属植物的生产栽培及引种育种具有重要意义㊂参考文献:[1]㊀沈立明,戴中武,钟惠,等.3种独蒜兰属植物的光合特性[J].热带作物学报,2021,42(5):1355-1360.[2]㊀李云霞,张艺祎,郭艳珊,等.4种独蒜兰属植物光合特性比较研究[J].云南农业大学学报(自然科学),2018,33(5):891-897.[3]㊀尚海琳,李方民,林玥,等.桃儿七光合生理特性的地理差异研究[J].西北植物学报,2008,28(7):1440-1447.[4]㊀XIA J B.Critical responses of photosynthetic efficiency inCampsis radicans(L.)Seem to soil water and light intensities[J].African Journal of Biotechnology,2011,10(77):17748-17754.[5]㊀鲁肃,张宇清,吴斌,等.水分胁迫下油蒿光合光响应过程及其模拟[J].北京林业大学学报,2014,36(1):55-61.[6]㊀张其德.测定叶绿素的几种方法[J].植物学通报,1985,20(5):60-64.[7]㊀叶子飘.光合作用对光和CO2响应模型的研究进展[J].植物生态学报,2010,34(6):727-740.[8]㊀杨文,于泽源,李兴国.三个草莓品种光合特性的研究[J].北方园艺,2015(10):50-53.[9]㊀马丽,郭学良,齐红志,等.生物炭对连作草莓光合特性及光响应的影响[J].西北林学院学报,2020,35(2):72-78.[10]㊀BOARDMAN N parative photosynthesis of Sun andshade plants[J].Annual Review of Plant Physiology,1977,28:355-377.[11]㊀徐苏婷,陈露茜,李钧敏.二倍体与四倍体黄毛草莓的光合特性[J].江苏农业科学,2018,46(5):110-112.[12]㊀宫兆宁,赵雅莉,赵文吉,等.基于光谱指数的植物叶片叶绿素含量的估算模型[J].生态学报,2014,34(20):5736-5745.(责任编辑:董宇飞)。
葱兰与韭兰一样吗?葱兰与韭兰的区别.doc

葱兰与韭兰一样吗?葱兰与韭兰的区别葱兰和韭兰很相识,生活我们看到葱兰和韭兰大家不仔细分辨大家就会以为是同一种植物,大家还可能会认为葱兰是韭兰的别称吧,不是这样的,今天就给大家介绍一下葱兰与韭兰一样吗?葱兰与韭兰的区别。
葱兰与韭兰的形态区别:葱兰是多年生草本。
鳞茎卵形,直径约2.5厘米,具有明显的颈部,颈长2.5-5厘米。
叶狭线形,肥厚,亮绿色,长20-30厘米,宽2-4毫米。
花茎中空;花单生于花茎顶端,下有带褐红色的佛焰苞状总苞,总苞片顶端2裂;花梗长约1厘米;花白色,外面常带淡红色;几无花被管,花被片6,长3-5厘米,顶端钝或具短尖头,宽约1厘米,近喉部常有很小的鳞片;雄蕊6,长约为花被的1/2;花柱细长,柱头不明显3裂。
蒴果近球形,直径约1.2厘米,3瓣开裂;种子黑色,扁平。
花期秋季。
韭兰是多年生草本。
鳞茎卵球形,直径2-3厘米。
基生叶常数枚簇生,线形,扁平,长15-30厘米,宽6-8毫米。
花单生于花茎顶端,下有佛焰苞状总苞,总苞片常带淡紫红色,长4-5厘米,下部合生成管;花梗长2-3厘米;花玫瑰红色或粉红色;花被管长1-2.5厘米,花被裂片6,裂片倒卵形,顶端略尖,长3-6厘米;雄蕊6,长约为花被的2/3-4/5,花药丁字形着生;子房下位,3室,胚珠多数,花柱细长,柱头深3裂。
蒴果近球形;种子黑色。
花期夏秋。
韭兰株高约15-30厘米,成株丛生状。
叶片线形,极似韭菜。
花茎自叶丛中抽出,花瓣多数为6枚,有时开出8枚。
韭兰花形较大,呈粉红色,花瓣略弯垂;小韭兰呈浓桃红色,成株每个鳞茎都能开花,丛生的花团,在艳阳下大放异彩,千娇百媚,人见人爱。
韭兰花期4-9月;小韭兰花期夏季约5-8月。
适合庭园花坛缘栽或盆栽。
葱兰与韭兰的形态生长习性区别:葱兰的习性有点特殊,虽然喜光,但却耐半阴。
如果光线太强,很容易将其晒坏,不利于其生长发育,在半阴的环境下却能生长良好,如在高大的树阴下或者在高墙的阴面种植较好。
葱兰和韭兰的区别

葱兰和韭兰的区别
叶片:葱兰为狭线形,较肥厚。
而韭兰叶片呈线形,扁平类似韭菜,比前者宽大花:葱兰有佛焰苞状的总苞,总苞片会带有褐红色,花为白色,外面经常会带点淡红色。
而韭兰总苞带有淡紫红色,花颜色为玫瑰红或者粉红色。
一、叶片区别
葱兰叶片为狭线形,较肥厚,颜色为亮绿色,长约20-30厘米,宽约2-4毫米。
韭兰基生叶片通常数枚簇生,呈线形,较扁平,较似韭菜,长约15-30厘米,要比前者宽,约6-8毫米。
二、花的区别
葱兰花单生于茎的顶端,有佛焰苞状的总苞,总苞片会带有褐红色,花为白色,外面经常会带点淡红色,几乎无花被管。
韭兰也是花单生于茎的顶端,有佛焰苞状的总苞,总苞带有淡紫红色,花颜色为玫瑰红或者粉红色,花被管长约1-2.5厘米。
花被6枚裂片,呈倒卵形。
葱兰与韭兰的区别,4大区别判断两者

葱兰与韭兰的区别,4大区别判断两者
葱兰的叶片挺拔并且圆润,花朵为洁白颜色,花期是在秋季的时候盛开,花瓣为6片左右,其耐阴能力比较强,韭兰的叶子比较宽大,呈现扁状,植株高度是在15~30厘米之间,花期时间是在夏季6~9月份。
葱兰和韭兰的区别
1、叶片区别
葱兰
葱兰与韭兰都是石蒜科葱兰属,在外形特征上也十分相似,但是葱兰与韭兰的区别也有很多,葱兰的叶片呈现圆润形状,并且叶片挺拔不容易出现弯曲现象,韭兰的叶片呈现扁状,相比葱兰植株韭兰的叶片会更加宽大。
2、花朵
韭兰
葱兰与韭兰的花色上也是有很大的区别,葱兰的花色一般是洁白颜色,并且花朵比较小巧,韭兰的花色是粉红颜色,并且花朵也比较大一些,所以日常判断两者可以根据花的颜色,可以清楚的进行区分。
3、形状特征
葱兰
葱兰植株的颈长一般是在5厘米左右,叶子细长可达到30厘米左右,花瓣一般是在6片左右,结出的种子呈现黑色,韭兰植株高大
15~30厘米之间,叶片形状与韭菜相似,花期时间是在4~9月份。
4、生长习性
韭兰
葱兰多在凉爽的秋季盛开,喜欢充足的光照,其耐半阴能力也是十分的强,韭兰生命力要比葱兰的要强一些,植株也比较抗旱,喜欢在22℃~30℃之间,花期时间则是在夏季,所以两者的生长习性也十分的不同。
容易混淆的花草(13):葱兰、韭兰、小韭兰、花韭与韭菜花

容易混淆的花草(13):葱兰、韭兰、小韭兰、花韭与韭菜花作者:kylelong 于 2011-4-6 04:43 发表于最热闹的华人社交网络--贝壳村葱兰,英文Zephyr lily;拉丁名:Zephyranthes grandiflora;别名:葱莲、(白)玉帘、风雨花、肝风草、白花菖蒲莲。
石蒜科葱兰属,为多年生草本植物。
原产墨西哥。
喜温暖、湿润和充足阳光,亦耐半阴和潮湿。
耐寒半阴和潮湿。
耐寒性稍差。
宜排水良好、富腐烈士质的沙壤土。
常用分球繁殖。
鳞茎分生能力强,一个成年鳞茎可从基盘上产生10多个小鳞茎。
春季掘起老株,将小鳞茎绿下分开栽种,每穴2-3个,栽种浓度深度以鳞茎不露土为准,一次分球后再隔2-3年再行繁殖。
白色花为主,也有粉色花(红花葱兰)和黄色花(黄葱兰)。
韭兰,英文:Rosepink Zephyr lily;拉丁文:Zephyranthes carinata (Spreng.) Herbert,Zephyranthes grandiflora Lindl.;别名:红花葱兰、韭莲、韭菜兰、红菖蒲莲、红菖蒲、假番红花、赛番红花、红玉帘、旱水仙、赛番红花、韭叶水仙、风雨花、风雨兰、红菖蒲、菖蒲莲。
石蒜科葱兰属。
原产地:南美古巴、墨西哥、危地马拉、西印度牙买加。
观赏用:韭兰的花型艳丽,适合花坛丛植、列植美化或盆栽。
药用:性味:全草及鳞茎:苦、寒。
效用:全草:散热解毒,活血凉血。
治吐血、血崩、跌打红肿、毒蛇咬伤;外用捣敷乳痈,疮毒。
茎:草本,鳞茎卵状球形如薤,表皮膜质褐色,下面着生多数细根。
叶:每株有叶 5-7 枚,成簇生状,叶片宽线形如韭菜叶,柔软,长 15-45 cm,宽 0.3-0.7 cm,微凹,全缘。
葱兰与韭兰:均属石蒜科,统称风雨兰(Rainlily),多年生球根植物,品种众多。
韭兰与葱兰虽同属石蒜科多年生的常绿植物,地下都有鳞茎小球、花梗自叶丛抽出直立顶端开一花、有六瓣、每逢下雨就开花、花期又都在夏秋季节。
采后花色生理

(2) 细胞内pH值对花色的影响 细胞内pH值是影响花色变化的重要因素之一。 花色素苷通常在酸性环境下呈现红色,在碱性环境 下呈现蓝色。因此,花瓣细胞液内pH值的变化可以 导致花瓣的颜色发生变化。 花瓣在自然衰老进程中细胞内不断地进行着物 质的合成与分解,使得细胞液内pH发生改变,从而 导致花色的深浅变化。
1.7.3 花朵衰老进程中的颜色调节
在体花朵的开花衰老进程通常是在光照、水分、 养分等供给相对充足的条件下进行的自然的衰老过程, 其体内物质运输,新陈代谢也都是自然的调节过程, 其特有的花色能够充分呈现出来。 而离体的花朵如切花,脱离了原来的自然生长状 态,所接受的光照、温度、水分以及其它养分条件均 发生了改变,往往这些环境条件不利于花色的保持。 因此,如何通过人工措施来最大限度的护色是极 其重要的。
百合 金鱼草
天竺葵,一串红 郁金香 Chasmanthe及Lapeyrousa 桂竹香,蔷薇,西洋樱草 山茶,秋海棠 牡丹,蔷薇(rugosa) 南美马鞭草,大鸳鸯茉莉 藿香叶绿绒蒿 矢车菊 蓝茉莉 飞燕草,多叶羽扇豆 藏报春 郁金香,三色堇
蓝色
黑色
代表性花色的色素组成花色色素组成植物种类奶油色及象牙色黄酮黄酮醇金鱼草大丽花黄色类胡萝卜素和黄酮醇或查耳酮黄色蔷薇樱草类金鱼草牛角花荆豆橙色百合金鱼草绯红色类黄酮天竺葵一串红郁金香chasmanthelapeyrousa褐色花青素类胡萝卜素桂竹香蔷薇西洋樱草品红或深红色纯花青素山茶秋海棠粉红色纯甲基花青素牡丹蔷薇rugosa南美马鞭草大鸳鸯茉莉蓝色藿香叶绿绒蒿矢车菊蓝茉莉飞燕草多叶羽扇豆藏报春黑色
2、温度
不同种类的切花对温度的要求差异很大,原 产于热带、亚热带地区的花卉对温度的要求较高, 贮藏运输等温度低时会影响与色素有关的生理合 成和分解,原产于温带、寒温带地区的花卉,高 温对于有机物的合成不利,甚至还会抑制花色素 苷的形成。 因此在切花的流通过程中,应了解和掌握各 种花卉种类的最佳温度,尽量减少由于温度不适 对花色所带来的不利影响
花色形成机理

花色形成机理
夏春森;夏文斐;夏志卉
【期刊名称】《花卉》
【年(卷),期】2006(000)002
【摘要】一、花卉的色素类型花卉的色素是由叶绿素、类胡萝卜、素类,类黄酮类及花色甙组成。
叶绿素形成绿色,类黄酮类、类胡萝卜素形成黄色或红色,花色甙形成红色、紫色、黑紫色。
【总页数】1页(P8)
【作者】夏春森;夏文斐;夏志卉
【作者单位】江苏淮安
【正文语种】中文
【中图分类】S68
【相关文献】
1.不同花色荷花色素成分及稳定性分析 [J], 徐君;李欣;江君;李静会;姜红卫
2.HPLC-MS/MS法测定甜樱桃花色苷与非花色苷酚的组成与含量 [J], 孙丹;陈为凯;何非;王军;谷会岩
3.草原龙胆花瓣花色素苷组成及与其花色的关系 [J], 高嵩;李天来
4.疏果可调节葡萄中的花色苷和原花色素成分 [J],
5.矮牵牛新种质的花色表型及花色素分析 [J], 李雅琪;刘心怡;过雪莹;潘俊松;唐东芹
因版权原因,仅展示原文概要,查看原文内容请购买。
风雨花的品种种类——风雨花的四姐妹

风雨花的品种种类——风雨花的四姐妹风雨花的品种种类——风雨花的四姐妹风雨花的品种种类风雨花的四姐妹石蒜科玉帘属里有这么四种花,据说它们能感知气象的变化,通常在夏、秋雷电交加、风雨来临前夕群花勃发,能预报风雨将至的信息,民问誉之为;风雨花(或风雨草)。
风雨花是韭兰、小韭兰、葱兰和黄花葱兰四种植物的总称,笔者种养风雨花20多年,现特意向大众介绍如下。
1、韭兰韭兰在四姐妹的株高、叶长、叶宽、花和鳞茎大小方面排首位。
花色粉红,花瓣6、雄蕊6,花药、花粉金黄,雌蕊洁白,花径4cm~5cm,朝开傍晚凋谢,甚少结实。
花期初夏到秋季,鳞茎繁殖。
别名红玉帘、红菖蒲莲、假番红花。
原产于美洲热带和南非。
性喜温暖、湿润、日光充足气候,不耐寒。
南方地区可以露天越冬;北方只能温室栽培。
生性粗放,栽培容易,对土壤要求不严,唯需避免土壤积水,以免引起鳞茎腐烂。
盆栽两年后应换盆、分株,否则鳞茎、根系盘结拥挤,妨碍植株正常生长。
2、小韭兰较韭兰矮小,叶片也较细短。
叶丛中抽出花茎,花深绯红色,比韭兰之花鲜艳、娇小,更富有观赏魅力。
花期8~9月间(广州地区),花朵朝开暮谢,遇阴天次日还可延续一日,但观赏性稍逊。
花瓣数通常为6,雄蕊6、雌蕊1。
据对其连续几年的观察记录,多次发现有花瓣、雄蕊数分别为5、7、8的自然变异花朵。
小韭兰未见结实,靠鳞茎无性繁殖,它发生自然变异的原因有待深入研究,如能破译其中的奥秘,培育小韭兰的新品种就易如反掌了。
3、葱兰株高15cm~25cm,基生叶圆线形似葱故名。
鳞茎卵形、颈部细长。
外皮棕褐色。
夏秋时节叶丛中抽出花茎,顶端着生半透明总苞,绽裂后开出洁白的花朵,花瓣6,雄蕊6,花药花粉金黄色,雌蕊1。
花朵直径3cm~5cm,白黄相间素雅高洁。
单花盛开1日,阴天次日虽仍可放但花姿大减,未见结实。
鳞茎分株繁殖。
原产于南非、南美洲阿根廷、秘鲁、古巴一带。
性喜温暖、湿润、日光充沛环境,有~定耐寒性,据试验在华东地区可以露地越冬,在华北及东北地区可作春植球根栽培,当年生长开花后,可在入冬前将露地鳞茎挖出,室内贮藏到次年备用或作温室盆栽。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第36卷第3期 西南大学学报(自然科学版) 2014年3月Vol.36 No.3Journal of Southwest University(Natural Science Edition)Mar. 2014文章编号:1673-9868(2014)3-0034-08葱兰和韭兰花色色素种类和质量分数的研究①董 博, 刘 雪, 付 春,陆俊杏, 王通明, 柴友荣西南大学农学与生物科技学院;南方山地农业教育部工程研究中心;重庆市作物品质改良重点实验室;重庆400715摘要:葱兰和韭兰背景性状相似,但花色一白一红,是园林绿化常用的一对姊妹花,有必要对其花色成分类型和色差原因进行研究.该研究提取了葱兰和韭兰的花瓣色素,用特征颜色反应法、紫外-可见分光光度计法和薄层色谱法进行了鉴定.结果表明:葱兰花瓣色素主要为黄酮类的木犀草素,不含花青素;韭兰花瓣色素既含有黄酮类的木犀草素和另一种迁移率大的未知黄酮类成分,还含有花青素类的锦葵色素.韭兰花瓣中总类黄酮质量分数为9.505mg/g,其中花青素(苷)的质量分数为1.375mg/g,葱兰花瓣总类黄酮质量分数为5.21mg/g.韭兰的红色花色源于其比葱兰多出的锦葵色素或其糖苷.该结果将深入解析韭兰和葱兰花色物质的结构和生物合成途径、克隆其相关功能基因和开展花色分子育种.关 键 词:葱兰;韭兰;花色色素;种类;含量中图分类号:Q949.71+8.25文献标志码:A葱兰Zephyranthes candida别名葱莲、玉帘、白花菖蒲莲、韭菜莲、肝风草,韭兰Zephyranthesgrandiflora别名韭菜兰、红菖蒲莲、红菖蒲、假番红花、赛番红花,二者都原产南美洲,都是石蒜科Ama-ryllidaceae葱帘属Zephyranthes Herb多年生球茎草本花卉.它们呈鳞茎卵状,叶数枚,线形,簇生,花茎纤细,中空,花单生于花茎顶端,花漏斗状,花被片6,各片近等长,雄蕊6,花柱细长[1].葱兰和韭兰因为花大(花被直径7.5~9.0cm),色泽艳丽,花期长,是受人喜爱的观赏植物,世界各国均引种栽培.二者叶丛碧绿,闪烁着洁白和粉红色的花朵,美丽幽雅,适用于林下、边缘或半荫处作园林地被植物,也可作花坛、花径的镶边材料,在草坪中成丛散植,可组成缀花草坪,饶有野趣,也可盆栽供室内观赏[2].作为园林应用广泛的两种花卉,二者具亲缘关系,形态习性相近,栽培方法相同,是不折不扣的姐妹花[3].自然界花卉颜色种类繁多,但葱兰和韭兰却分别只有乳白色和粉红色,颜色过于单调.目前国内外对葱兰和韭兰的研究主要集中在药理学[4-5]、病虫害防治[6-8]、繁殖技术[9]及园林应用[10]等方面,对其花色成色机理的研究未见报道,其花色分子育种更是无从开展.为了使葱兰和韭兰在园林景观中得到更好的应用,本文首次以葱兰和韭兰的花瓣为研究材料,对其花色成色色素进行分析,确定决定其花色的因素,为深入解析葱兰和韭兰花色的机理,进行分子育种提供参考.①收稿日期:2013-03-06基金项目:重庆市科技攻关计划资助项目(CSTC2009AB1030);国家863计划专题课题资助项目(2006AA10Z110).作者简介:董 博(1987-),男,陕西渭南人,硕士研究生,主要从事植物转基因工程研究.通信作者:柴友荣,研究员,博士生导师.1 材料与方法1.1 试验材料西南大学北区花园内种植的乳白色葱兰和粉红色韭兰,在盛花期,于晴天早晨露水刚干时取花瓣用于试验.槲皮素、山柰酚、木犀草素、柚皮素和异鼠李素标准品购自上海华壹生物科技有限公司;锦葵色素、矢车菊素和飞燕草素购自Sigma公司;1.2 葱兰和韭兰花色色素的定性鉴定和定量测定1.2.1 色素化学成分的系统预试:特征颜色反应称取0.100g花瓣,迅速用液氮研磨至粉末,分别加石油醚、10%盐酸和30%氨水约5mL提取,过滤,观察滤液颜色并进行记录[11].各取葱兰和韭兰花瓣0.100g,迅速用液氮研磨至粉末,分别用甲醇和盐酸化甲醇溶液(HCL∶MeOH=1∶99,V/V)提取24h[12-13],过滤,定容至25mL,各取2mL提取液,进行下列显色反应[14-16].1)浓盐酸-镁粉反应:加入镁粉少量,然后加入浓盐酸5滴,摇匀,静置1h.2)浓盐酸-锌粉反应:加入锌粉少量,然后加入浓盐酸10滴,摇匀,静置1h.3)醋酸铅反应:加1.0%Pb(CH3COO)·3H2O 2mL,摇匀,静置2h.4)三氯化铁反应:加5.0%FeCl3·6H2O 2mL.5)三氯化铝反应:加1.0%AlC13·6H2O甲醇溶液1mL.6)浓硫酸反应:加1.5mL浓H2SO4,摇匀,再置沸水浴5min.7)四氢硼钠反应:加NaBH48mg,再加1.0%盐酸2mL,摇匀,静置2h.8)碱性试剂反应:加5%Na2CO33mL,摇匀,密闭静置30min,通空气10min.9)氨性氯化锶反应:取甲醇10mL,加氨水定容至25mL,成为被氨气饱和的甲醇液;向样品液中加入0.01mol/L SrC12.6H2O甲醇液10滴,再加被氨气饱和的甲醇液10滴,摇匀,静置1h.10)硼酸反应:加1.0%H2C2O4·2H20 10滴,再加2.0%H3BO33mL.1.2.2 花色素成分的紫外-可见光谱分析(1)花瓣中的叶绿素检测取花瓣0.100g,迅速用液氮研磨至粉末,用90%的丙酮∶乙醇(4∶1,v/v)提取,定容至10mL,用紫外-可见分光光度计在200~700nm范围内扫描,比色皿光径为1cm[17].(2)花瓣中的类胡萝卜素检测取花瓣0.100g,迅速用液氮研磨至粉末,用石油醚∶丙酮(1∶1,V/V)提取,定容至10mL,在200~700nm范围内扫描.(3)花瓣中的类黄酮检测取花瓣0.100g,迅速用液氮研磨至粉末,葱兰加盐酸化甲醇(pH=3)2mL置于4℃冰箱中提取24h;韭兰加盐酸∶甲醇(1∶99,v/v)放在常温下避光提取24h,然后定容至10mL,在220~600nm范围内扫描[12,18].(4)色素的紫外-可见光谱分析取花瓣0.100g,迅速用液氮研磨至粉末,葱兰用盐酸化的甲醇提取,韭兰用含1%浓盐酸的甲醇提取,定容至50mL,立刻在200~700nm范围内扫描.1.2.3 葱兰和韭兰花色色素的薄层色谱(1)色素萃取53第3期 董 博,等:葱兰和韭兰花色色素种类和质量分数的研究称量1.000g葱兰和韭兰花瓣,葱兰用40mL的甲醇萃取,韭兰分别用40mL 1%的甲醇盐酸(97mL甲醇+3mL 36%盐酸)和甲醇萃取,4℃条件下萃取24h(2)萃取物浓缩与水解将萃取液过滤,放在100mL的异形瓶里,用旋转蒸发仪在真空条件下将萃取液蒸发,然后用1mL甲醇溶解浓缩物,获得浓缩的萃取液.萃取物的水解:取300μL浓缩萃取液,加300μL 2mol/L盐酸,90℃水解45min,冷却后加100μL异戊醇,14 000r/min下离心3min后,上相中含有浓缩状态的花青素和其他类黄酮.(3)薄层色谱法鉴定色素①色素分离.用玻璃毛细管线性点滴测试物质和标样到同一块硅胶G薄层板上,在薄层层析槽里进行色谱分离.甲醇盐酸萃取物的展开剂为正丁醇∶醋酸∶水(4∶1∶2);甲醇萃取物的展开剂为甲苯∶甲酸乙酯∶甲酸(10∶8∶1).②色素鉴定.展开,取出,晾干,在正常光照条件下,通过薄层色谱分离后的距离和标样进行对照,确定化合物种类.喷以1%三氯化铝乙醇溶液,在105℃加热5min,然后将层析后的硅胶G薄层板置紫外光灯(365nm),观察类黄酮的颜色变化,通过对比标样并参考Harborne的方法[19]进行鉴定.1.2.4 葱兰和韭兰花色色素质量分数的检测(1)韭兰花青素苷的测定取花瓣0.100g,迅速用液氮研磨至粉末,用含1.0%浓盐酸的甲醇溶液(V浓盐酸∶V甲醇=1∶99)提取12h,定容至50mL,立刻在波长200~700nm范围内扫描[19-20],每次测量设置3个重复.采用改进的Fuleki方法[21]计算花青素苷的质量分数(mg/g).花青素苷质量分数/=A535nm×V×n98.2×m式中:A535nm为色素在535nm波长处的吸光度,V为一定质量的花瓣提取色素时的定容体积mL;n为比色时稀释的倍数,98.2为花青素苷色素在535nm波长处的平均消光系数,m为花瓣的质量g.(2)花色色素的总类黄酮质量分数的测定称取花瓣0.100g放入具塞试管中,迅速用液氮研磨至粉末,加入提取剂为1%浓盐酸的甲醇溶液10mL浸提48h,将浸提液定容至10mL,每次测量设置3个重复.根据氯化铝显色法[22],黄酮类化合物与AlC13形成黄色的黄酮铝配合物.将标样芦丁于102℃烘干1h,准确称取20.3mg用少量甲醇溶解,用浓盐酸∶甲醇(1∶99,v/v)定容至25mL,配成0.812mg/mL标准样品溶液.分别取0,0.2,0.4,0.6,0.8,1.0mL标准样品溶液,加浓盐酸∶甲醇(1∶99,v/v)至4mL,再分别加入1%AlC13·6H2O甲醇溶液6mL平衡10min.在220~700nm范围内,采样间隔1nm慢速扫描,发现在401nm和268nm处各有一吸收峰,以401nm为检测波长测定标准样品的吸光值,根据标样芦丁溶液体积质量分数和A401吸光值绘制标准曲线,求出线性回归方程.芦丁标准曲线方程分别为C=0.052 7×A401nm+0.001 3 R2=0.999 9C=0.033 7×A268nm+0.004 0 R2=0.981 8式中:c为芦丁体积质量分数(mg/mL);Aλmax为吸光度.经实验后得出,λmax=268nm波长处得到的工作曲线,线性关系及精密度数据均不佳,故本实验选取λmax=401nm为测定波长.取2mL提取液加入3mL 1%AlC13·6H2O甲醇溶液平衡10min,测定A401利用标准曲线线性回归63西南大学学报(自然科学版) http://xbbjb.swu.cn 第36卷方程计算样品溶液体积质量分数,并计算冷冻样品总类黄酮质量分数,单位为mg/g.2 结果与分析2.1 葱兰和韭兰花色色素的特征颜色反应葱兰和韭兰花色色素特征颜色反应见表1.葱兰花瓣色素主要是类黄酮,不含花青素,类黄酮化合物则主要是黄酮,可能也含有异黄酮,不含有黄酮醇、查尔酮、橙酮、二氢黄酮和二氢异黄酮,色素可能具备3′,4′,5′-三羟基,所有色素的C3位无游离羟基.韭兰花瓣色素主要是花青素和类黄酮,类黄酮化合物也主要是黄酮,可能含有二氢黄酮和二氢异黄酮,不含黄酮醇,色素具有邻二酚羟基结构.表1 葱兰和韭兰花色色素的颜色反应和结果韭兰葱兰测 试 结 果石油醚测试无色无色均表现出无色,说明两种花色色素均不含类胡萝卜素[9,12-13].盐酸测试红色微黄色韭兰显示出红色,说明含有花青素,葱兰出现黄色则说明可能是黄酮类化合物.氨水测试黄绿色亮黄色韭兰色素表现的黄绿色是由花青素苷呈现的蓝色和类黄酮呈现的黄色混合而成.浓盐酸-镁粉反应红色退为粉红色微紫红韭兰由红色退为粉红色,说明含有花青素苷.葱兰显示出的微紫红,意味着葱兰可能含有黄酮,可能也含异黄酮(isofla-vone)[14,23].浓盐酸-锌粉反应微紫红淡紫红均呈现出不同程度的紫红,意味着这两种花花色色素不含黄酮醇,可能含二氢黄酮醇[15,24-25].醋酸铅反应白色沉淀黄色沉淀韭兰产生白色沉淀,葱兰产生黄色沉淀,表明这两种花色色素具备酚羟基,而且不含查尔酮、橙酮,可能具邻二酚羟基或者兼有4-酮基、3-OH或者4-酮基、5-OH结构[14-15,23].三氯化铁反应墨绿色深黄色韭兰和葱兰分别呈现出墨绿色和深褐色,表明这两种花的花色素必然具备酚羟基.并且葱兰的花色色素可能具备3′,4′,5′-三羟基,所有色素的C3位无游离羟基[14-15,23].三氯化铝反应黄橙色黄橙色韭兰和葱兰均呈现出黄橙色,证实这两种花花色色素属于黄酮类[14-15,23].浓硫酸反应深黄色深黄色韭兰和葱兰均呈现出深黄色,再次证实这两种花花色素属于黄酮类[14-15,23].四氢硼钠反应洋红色无色韭兰呈现出洋红色,证明其含有二氢黄酮和二氢异黄酮.葱兰呈现出无色,证明其不含二氢黄酮和二氢异黄酮[14-15,23].碱性试剂反应绿色淡黄色韭兰呈现出绿色,证明其含有二氢黄酮;葱兰呈现出淡黄色,通空气后颜色不变,说明其不含二氢黄酮醇[14-15,23].氨性氯化铯反应黑色沉淀白色沉定意味着两种花花色色素中具有邻二酚羟基结构的黄酮类化合物[14-15,23].硼酸反应无色无色韭兰和葱兰均未发生反应,说明两者花色色素的黄酮可能不含C5-OH[14-15,23].73第3期 董 博,等:葱兰和韭兰花色色素种类和质量分数的研究2.2 花色素成分的紫外-可见光谱分析2.2.1 花瓣中的叶绿素检测葱兰和韭兰花色色素的丙酮∶乙醇溶液在662nm和644nm处均无吸收峰(表2),这意味着葱兰和韭兰花色色素可能不含叶绿素[17].2.2.2 花瓣中的类胡萝卜素检测葱兰和韭兰花色色素的石油醚∶丙酮溶液在440nm和470nm附近均无吸收(表2),说明葱兰和韭兰中不含有类胡萝卜素[16].2.2.3 色素的紫外-可见光谱分析韭兰花色色素的1%浓盐酸的甲醇溶液中,在530nm处有一个吸收峰,这为花青素苷的特征峰.在352nm和265nm处的吸收峰为韭兰和葱兰所具备(表2,图1),这表明韭兰与葱兰的花色色素含有相同的非红色黄酮类化合物,韭兰的红色是源于花色色素或其苷,即确证韭兰的花色色素为花青素苷和黄酮类,葱兰花色色素仅为黄酮类;带Ⅰ吸收峰352nm、带Ⅱ吸收峰264或266nm,再次证实葱兰色素含黄酮,不含黄酮醇和二氢黄酮[26],264或266nm处吸收峰的非低强度再次说明韭兰和葱兰色素不含查尔酮、橙酮.表2 葱兰和韭兰用不同溶剂提取的花色色素的紫外-可见光最大吸收峰品 种溶 剂90%的丙酮∶乙醇石油醚∶丙酮1%浓盐酸的甲醇盐酸化甲醇韭兰无最大吸收峰342 532,350,266葱兰无最大吸收峰339 353,264图1 葱兰和韭兰花色色素的紫外-可见光谱(左:葱兰右:韭兰)2.2.4 薄层层析色谱检测实验中分别考察了乙酸乙酯-丁酮-甲酸-水(5∶3∶1∶1)、甲苯-甲酸乙酯-甲酸(10∶8∶1)、甲苯乙酸乙酯-甲酸(5∶2∶1)、正丁醇∶醋酸∶水(4∶1∶2)等多个展开系统.结果表明甲醇盐酸萃取物以正丁醇∶醋酸∶水(4∶1∶2),甲醇萃取物以甲苯∶甲酸乙酯∶甲酸(10∶8∶1)系统分离和展开效果最佳.薄层色谱检测结果表明,葱兰和韭兰含有相同的非红色黄酮类化合物;葱兰花主要成色色素为木犀草素(图2A),韭兰花的主要成色色素为锦葵色素和木犀草素,还含有一种迁移快的待定黄酮类化合物(图2B).2.3 葱兰和韭兰花色色素质量分数的检测根据Fuleki方法计算得出粉红色韭兰色素中花青素苷质量分数为1.375mg/g.本次实验中测得1.000g葱兰花中含有的总类黄酮质量为5.21mg.1.000g韭兰花中含有的总类黄酮质量为9.505mg.83西南大学学报(自然科学版) http://xbbjb.swu.cn 第36卷1.槲皮素,2.山柰素,3.木犀草素,4.韭兰,5.葱兰.a.锦葵色素,b.矢车菊素,c.飞燕草素,d.韭兰.图2 薄层层析色谱检测结果3 讨 论花色是光线照射到花瓣上穿透色素层时部分被吸收,部分被海绵组织反射折回,再通过色素层而进入我们眼帘所产生的色彩,因此它与花瓣细胞中的色素种类、色素质量分数(包括多种色素的相对质量分数)、花瓣内部或表面构造引起的物理性状等多种因素有关,但花色色素起主要作用[27].与花成色有关的色素包括叶绿素、类胡萝卜素、类黄酮、水溶性生物碱及其生物4大类群[28].花的颜色主要由类黄酮类色素决定,其中花青素是影响花色的主要因素[29-30].花青素应为花色素及其与糖形成的苷(即花青素苷)[22],花青素主要分为3类:花葵素苷(橘黄→砖红色)、矢车菊素苷(红色→粉红)、飞燕草素苷(紫色→蓝色)[24].而花青素本身为花色色素之一[31-33],即花青素属于类黄酮.因此,葱兰和韭兰色素均属类黄酮化合物,不含有类胡萝卜素.韭兰显示出粉红色,葱兰为白色,从紫外可见光谱扫描的曲线可以看出,两者只在530nm处(花色苷特征吸收峰)有差异,由薄层色谱检测出韭兰含有锦葵色素,故目前推测韭兰粉红色的色素为锦葵色素或其苷,而葱兰白色花色的色素则为黄色或无色的黄酮类或其苷.特征显色反应,紫外-可见光谱和薄层色谱都是色素成分初步分析常用的方法,具有简单易行、结果直观的特点.在本试验中,葱兰和韭兰色素的特征显色反应,紫外-可见光谱和薄层色谱都出现了相应的结果,但是由于葱兰和韭兰色素成分的复杂性以及该方法的直观性较强,尤其是特征显色反应,使色素成分的判断和鉴定更为困难.所以,在特征显色反应,紫外-可见光谱和薄层色谱试验结果的基础上,结合其他鉴定方法更为必要,比如核磁共振、高效液相色谱和质谱等方法.葱兰和韭兰是很受人们喜爱的两种观赏植物,但对于其花色的育种未见报道.蓝色系是自然界较少的花卉色系,世界上许多园艺育种家都将蓝色花卉的培育作为研究重点.飞燕草素衍生而来的花青素苷,包括矮牵牛素是蓝色花必不可少的色素,飞燕草素的缺乏是自然界缺少蓝色葱莲的重要原因.这些色素的生93第3期 董 博,等:葱兰和韭兰花色色素种类和质量分数的研究物合成途径成为蓝色花分子育种的突破口.目前已经将类黄酮生物合成途径研究得相当清楚.类黄酮-3′,5′-羟基化酶基因(F3′5′H)是合成飞燕草素的关键酶基因,利用基因工程手段将编码F3′5′H或调节其活性的基因导入,并促使其在花瓣中表达将为蓝色葱莲的生成提供重要的技术支持.目前已经从矮牵牛、茄子、长春花、马鞭草、龙胆等植物中成功分离出编码F3′5′H基因.该结果将深入解析韭兰和葱兰花色物质的结构和生物合成途径、克隆其相关功能基因和开展花色分子育种.此外,本研究结果还为同科或相近的单子叶植物花卉如兰花、水仙等花色物质的研究提供了参考.参考文献:[1]中国科学院中国植物志编辑委员会.中国植物志:第16卷第1分册[M].北京:科学出版社,1979:5-7.[2] 邱国金.园林植物[M].北京:中国农业出版社,2006:243-245.[3] 李万方,杨勤槐.姐妹花葱兰与韭兰[J].中国花卉盆景,2006,(1):10.[4] WU Z P,CHEN Y,XIA B,et al.Two Novel Ceramides with a Phytosphingolipid and a Tertiary Amide Structure fromZephyranthes Candida[J].Lipids,2009,44(1):63-70.[5] 冯 巍,谈 锋,韭莲组培快繁及其石蒜碱和加兰他敏积累的研究[J].西南大学学报:自然科学版,2008,30(12):134-138.[6] 周庆椿,卿 励.葱兰菌核病在三峡库区的发生及药剂防治研究[J].中国农学通报,2011,27(3):247-250.[7] 李 腾.葱兰炭疽病发生及其防治初报[J].广东园林,2006,28(4):49-50[8] 刘起丽,李春民,张定法,等.优良园林植物葱兰的叶部病害识别及防治[J].资源开发与市场,2009,25(12):1072-1073.[9] 陈 祥,包 兵.三种污水污泥对两种地被植物和土壤的影响[J].西南大学学报:自然科学版,2009,31(5):130-133.[10]陈海云,戴益源.韭兰的繁殖技术与园林应用[J].现代园艺,2007,4:38-39.[11]安田齐.花色之谜[M].张承志,佟 丽,译.北京:中国林业出版社,1989:1-149.[12]雷 明.桂花果类黄酮分离纯化工艺及其抗氧化研究[J].西南大学学报:自然科学版,2011,33(4):77-82.[13]K R马卡姆.黄酮类化合物结构鉴定技术[M].北京:科学出版社,1990:19-57.[14]陈孝泉.植物化学分类学[M].北京:高等教育出版社,1990:55-63.[15]赵昶灵,郭维明,陈俊愉.梅花花色色素种类和含量的初步研究[J].北京林业大学学报:自然科学版,2004,26(2):68-73.[16]北京医学院,北京中医学院.中草药化学成分[M].北京:人民卫生出版社,1980:288-292.[17]X H波钦诺克.植物生物化学分析方法[M].北京:科学出版社,1981:255-259.[18]哈本.黄酮类化合物[M].北京:科学出版社,1983:51-88.[19]HARBORNE J B,BAXTER H.The Handbook of Natural Flavonoids[M].New York:Wiley Press,1999.[20]罗向东,吴丽媛.杜鹃花色素的分离和鉴定分析[J].食品科学,2011,32(13):19-22.[21]FULEKI T.Quantitative Methods for Anthocyanins.I.Extraction and Determination of Total Anthocyanins in Cranber-ries[J].Journal of Food Science,1968,33(1):72-77.[22]刈米达夫.植物化学[M].北京:科学出版社,1985:112-133.[23]高锦明.植物化学[M].北京:科学出版社,2003:166-169.[24]安银岭.植物化学[M].哈尔滨:东北林业大学出版社,1996:178-188.[25]林启寿.中草药成分化学[M].北京:科学出版社,1977:305-311.[26]谭任祥,孟军才,陈道峰,等.植物成分分析[M].北京:科学出版社,2002:498-500.[27]赵云鹏,陈发棣,郭维明.观赏植物花色基因工程研究进展[J].植物学通报,2003,20(1):51-58.[28]郑志亮.花卉作物的花色基因工程[J].福建农业科技,1996,1:23-24.[29]夏玉凤.植物花色素代谢途径改变机理及应用[J].生物技术通报,2009,10:26-30.04西南大学学报(自然科学版) http://xbbjb.swu.cn 第36卷[30]徐祖元,周玲革,姜金波,等.新型小麦胞质不育系花粉败育的细胞学观察[J].武汉植物学研究,1998,16(3):193-196.[31]何奕昆,胡瑞娟,奚 惕.花色素的译名分析[J].植物生理学通讯,1989,25(4):75-77.[32]HUGO K D,TINOTHY P R.Genetic and Developmental Control of Anthocyanin Biosynthesis[J].Ann Rev Genet,1991,25(5):173-199.[33]邱辉龙,范明仁.花青素与花色之表现[J].中国园艺(台湾),1998,44(2):102-115.Study on the Categories and Contents of the Flower ColorPigments of Zephyranthes candida and Zephyranthes grandifloraDONG Bo, LIU Xue, FU Chun,LU Jun-xing, WANG Tong-ming, CHAI You-rongChongqing Key Laboratory of Crop Quality Improvement;Engineering Research Center of South Upland Agriculture,Ministry of Education;School of Agronomy and Biotechnology,Southwest University,Chongqing 400715,ChinaAbstract:Sharing similar background traits,Zephyranthes candida and Z.grandiflora have quite dis-tinct flower colors.With white and red petals respectively,these sister-flower-color species are widely cul-tivated in horticulture.It is necessary to dissect the flower color pigment types and the reason causingtheir flower color difference.In this study,their petal pigments were extracted and identified with specificcolor reactions,ultraviolet and visible spectrophotometry(UV-Vis)and thin layer chromatography.Theresults showed that the petal pigment of Z.candida was primarily constituted by luteolin,which is a fla-vone pigment,and no anthocyanin was detected,and that the petal pigments of Z.grandifloracontainedluteolin and an unknown flavone with a high shift rate,and malvidin,which is an anthocyanidin pigment.Z.grandifloraflower petal contained 9.505mg/g FW of total flavonoids,of which anthocyanidin/antho-cyanin was 1.375mg/gFW.Z.candida petal contained 5.21mg/g FW of total flavonoids.The red flow-er color of Z.grandiflora was conferred by malvidin or its glycoside,which was not present in Z.candi-daflower.These results will promote further dissection of the structure and biosynthesis pathway,clo-ning of related functional genes and molecular breeding of flower colors of Z.candida and Z.grandiflo-ra.Key words:Zephyranthes candida;Zephyranthes grandiflora;flower color pigment;category;content责任编辑 夏 娟 14第3期 董 博,等:葱兰和韭兰花色色素种类和质量分数的研究。
