原子结构的发展史ppt课件
原子结构演变史ppt课件

CHAPTER ONE
原子概念的提出
CHAPTER ONE 原子概念
原子概念的提出
公元前5世纪,希腊哲学家德谟克利特提出:万物是 由大量不可分割的微粒构成,即原子。
CHAPTER ONE 原子概念
上古时代的原子论不是科学理论,它只 是一种哲学的推测。
CHAPTER TWO
近代原子学说
CHAPTER TWO 近代原子学说
卢瑟福
SUMMARY
纵观人类对原子结构的探索,不难发现:人们对 于物质的认识总是从宏观到微观,一代代科学家在前人 的基础上不断反思总结,或验证或推翻前人的理论。而 科学的理论也就在这样的建立——推翻的进程中不断得 以修正完善。因此,我们对于科学也要抱着虔诚而又怀 疑的立场。
A T OM
THANK YOU
CHAPTER THREE 更小的微粒——夸克
夸克
1967年,三位科学家用此加速器进行 实验,并最终证明夸克的存在。 质子和中子的组成:一个质子由两个 上夸克和一个下夸克组成,一个中 子由两个下夸克和一个上夸克组成。
SUMMARY
总结
SUMMARY
德谟克利特
道尔顿
汤姆生
海森堡
波尔
科学的探索和研究永无止境……
1
道尔顿
1803 实心球模型
2
汤姆生 1904 阴极射线实验
枣糕模型
3
卢瑟福 1911 α粒子散射实验
行星模型
3
玻尔 1913 量子论
玻尔量子化轨道
CHAPTER TWO 道尔顿原子说
英国化学家,道尔顿,1803年继承古 希腊朴素原子论和牛顿微粒说,提出原子学 说: ①原子都是不能再分的粒子; ②同种元素的原子的各种性质和质量都相同; ③原子是微小的实心球体。
高一化学上学期原子结构模型的演变-新课标人教版

;培训课程 培训班 招生培训网; ;学校机构 /corporation.html 学校机构;
说:"他们在咱の乾坤世界中呢,咱の壹家老少,包括这里の所有还在做事の人,所有の家眷都在大家の乾坤世界中の.""你们为何不离开这里呢?"根汉有些不解."咱们也想离开呀,只是这周围太浩瀚了,走不开呀."老板对根汉说:"其实咱有件事情,想求.""你不用说,咱知道."根 汉对他笑着说:"如果可以の话,咱可以帮你们の忙.""那,太,太谢."老板没想到根汉这么痛快,肯出手相助.他们世代生活在这里,以前火域并不是这么壹副模样,总起码还有壹些小地方可以让他们生存.但是现在这样の情况,让他们已经无法生存了.不过想离开这里,他们也没有 办法,因为这里太广了.以他们这圣境の修为,想在这火域中行走几亿里,无疑于天方夜谭,壹定会死在半路上の.根汉终究还是好人,见这些人确实是生活得太苦了,在这种地方讨生活,太不容易了.能帮就帮壹把了,遇到了就是缘分,自己壹个至尊都飞行了十天整整の,才遇到他们 这个小村落の人.算是壹种缘分了,不过关于这火域の其它の事情,这个老板当真是壹问三不知,就知道以前这附近の壹些情况.现在这几百年来,他们这里の环境恶化了,加速恶化了.他们壹直在等,等像根汉这样の强者出现,然后求他们带他们离开这里,等了这么几百年,终于是 等到了壹个像根汉这样の强者.不管是不是有阴谋,是不是要付出什么,他们都心甘情愿,他们已经没有了退路了.在这里简单の吃了点东西,根汉便让这老板,去将他们这里所有の人都给召集起来了.大家得知有人可以带他们离开了,都兴奋の不能自以.这些人还真不就只有壹百 多人,在他们の乾坤世界中,还有四五万人呢,壹起加起来就有五万多人.根汉想了想,还是将这五万多人,安排到了自己の第二乾坤世
原子结构的发展史

原子结构的发展史
原子结构的发展史可以追溯回古希腊时期的苏格拉底,他试图通过某种方式将自然界的实体划分为若干部分。
然而,直至17世纪,古典力学家泰勒仍没有提出一个真正可行的电粒子假说。
直到泰勒死后,当埃斯库罗斯、拉瓦锡和约瑟夫·斯托克森发表了他们对大气电性的研究成果时,人们才开始在电子的学习中涉及原子的研究。
由此,十九世纪的化学家们把它们联系起来,提出原子模型,将各种元素的化学特性归结于其原子结构的不同。
因此,一种不可分割的迷人的概念就出来了,即无限微小的粒子组成了世界上所有的物体,而它们又受到深刻影响,证明了原子的可能性。
随着物理学、化学和数学的发展,原子学也发生了巨大的变化,由Ernest Rutherford提出的核心原子结构又给原子结构发展带来了巨大的变化,他试图解释原子核的结构。
然而费曼的粒子成像工作的发明,原子研究又上了新的台阶,他发明了原子结构的最新模型,即“数字模型”。
他认为,原子核由质子和中子组成,而电子围绕着原子核运动,而通过调控电子层次,他们可以以准确的方式识别和分辨物质。
经历了由苏格拉底到费曼所有历史发展,今天,原子研究已经发展成为一门完整的科学,已经解释了许多科学现象,并用其余分析化学。
总的来说,原子结构的研究不断发展,它的知识和技术将继续广泛地应用于未来。
【教学课件】《第3节原子的结构模型》(18张ppt )

4、 在①分子 ②原子 ③质子 ④电子⑤离子 ⑥原
子核 ⑦中子 ⑧元素中,选择: (1)构成物质的基本微粒是__①__②__⑤____ ,其
中__②__是化学变化中的最小微粒,它是由 __⑥___和___④__构成的。
20
17
氯离子
17
17
20
18
失电子 阳离子 带正电的离子
离子形成原因:原子
带电的原子 (或原子团
阴离子 带负电的离子
得电子
) 硫酸铜(CuSO4)是由铜离子Cu2+ 和 硫酸根离子SO42构成的。
金属元素:它们原子的最外层电子数目一般 少于_4__个。在化学反应中易_失__去__电子,形 成_阳___离子。Ex:钠、镁、铝、铁
带负电荷 9.1176×10-31千克
(1)为什么说原子的质量集中在原子核上,为什么原子呈电中性?
原子质量约等于质子质量+中子质量 夸克
四、随堂练习
1.原子核( B ) A.由电子和质子构成 B.由质子和中子构成 C.由电子和中子构成 D.由质子、中子、和电子构成 2.化学变化中最小的粒子是( B ) A.分子 B.原子 C.中子 D.质子
[3]极少数被弹射了回来,原因是: α粒子撞击到了带正电荷、质量大、体积很小的核。 。
α粒子散射实验
二、原子结构模型的建立
英国物理学家卢瑟福α粒子散射实验
在实验的基础上提出了原子的核式结构。
(1)原子的中心有一个很小的原子核; (2)原子的全部正电荷和几乎全部的质量都集中中 在原子核里; (3)带负电的电子在核外空间绕核运动,就像行星 绕太阳运动那样。“行星模型”
原子结构的发展史

原子结构的发展史古代哲学观点在古代,许多哲学家提出了关于原子的理论。
最早的原子理论可以追溯到公元前5世纪的古希腊哲学家列维那,他认为物质由不可再分割的小颗粒组成。
他的观点在柏拉图和亚里士多德的著作中得到了发展。
然而,缺乏实验证据限制了这些理论的发展。
分子理论的提出17世纪末到18世纪初,化学开始成为一门独立的科学,人们开始尝试解释化学反应的基本原理。
丹尼尔·贝赫勒利(1667-1738)是最早提出分子理论的化学家之一、他认为物质由不可分割的小颗粒组成,并且具有特定的化学性质。
他的工作为后来的原子理论奠定了基础。
约翰·道尔顿的原子理论19世纪初,英国化学家约翰·道尔顿(1766-1844)提出了原子理论的著名学说。
他认为原子是不可再分割的,是物质的基本单位。
道尔顿还提出了一系列原子理论的假设,包括元素由原子组成、原子在化学反应中保持不变、不同元素的原子具有不同的质量等。
虽然他的理论在当时获得了广泛的认可,但在后来的实验中出现了一些不符合其理论的结果。
汤姆逊的电子模型19世纪末,英国物理学家约瑟夫·约翰·汤姆逊(1856-1940)通过对阴极射线的研究,提出了电子模型。
他发现阴极射线是由带负电荷的粒子组成的,并称这些粒子为电子。
汤姆逊提出了“蔓延的蛋糕模型”,将原子看作是一个带有正电荷的球体,电子均匀分布在球体内,类似于蛋糕上的水果。
这个模型成功地解释了许多实验结果,但仍然无法解释原子的稳定性和原子核内部结构。
卢瑟福的金箔实验1909年,新西兰物理学家欧内斯特·卢瑟福(1871-1937)进行了著名的金箔实验,他发射了高速α粒子(即氦离子)来轰击金箔薄片。
实验结果表明,大部分α粒子直接穿过金箔而无明显偏转,少部分粒子偏转角度很大。
卢瑟福根据实验结果提出了著名的“太阳系模型”,也称为卢瑟福模型。
根据该模型,原子中存在一个带正电荷的原子核,电子围绕着核运动,类似于行星绕着太阳运动。
原子结构的发展历史

原子结构的发展历史一、古代对原子的认识古代的人们对于原子的认识主要是基于哲学和思辨。
古希腊哲学家德谟克利特最先提出了原子的概念,认为物质是由不可再分的微小颗粒组成的。
他将这些微小颗粒称为"原子",意为不可分割的。
二、化学元素周期表的发现19世纪初,化学家开始研究不同元素之间的关系。
德国化学家道尔顿提出了第一个完整的原子理论,他认为所有物质都是由不可再分的原子组成的,并且每种元素的原子具有独特的质量和性质。
这一理论为后来的原子研究奠定了基础。
随后,化学家门捷列夫发现了化学元素周期表。
他发现元素的性质和原子的质量之间存在着一定的规律,将元素按照原子质量排列,发现了一些周期性的规律。
这一发现进一步支持了原子理论的正确性,并为后来的原子结构研究提供了重要线索。
三、电子的发现19世纪末,物理学家开始研究原子的结构。
英国物理学家汤姆逊通过实验证明了电子的存在。
他使用了电磁场将电子从原子中抽离出来,并通过测量电子的质量和电荷比,发现了电子是原子的基本组成部分之一。
四、卢瑟福金箔实验1909年,英国物理学家卢瑟福进行了著名的金箔散射实验。
他将α粒子轰击金箔,观察粒子的散射情况。
实验结果出乎意料地显示,大部分α粒子直接穿过金箔,只有极少数α粒子发生明显的偏转。
这意味着原子内部存在着一个非常小而带正电的核心。
五、玻尔模型基于卢瑟福的实验结果,丹麦物理学家玻尔提出了玻尔模型,描述了原子的结构。
他认为原子由一个紧密排列的正电荷核心和围绕核心旋转的电子组成。
电子只能存在于特定的能级上,并跳跃到不同能级时会吸收或发射能量。
这一模型解释了原子光谱的现象,并为后来的量子力学奠定了基础。
六、量子力学的发展20世纪初,量子力学的发展使得人们对原子结构有了更深入的了解。
量子力学描述了微观粒子的行为,包括电子在原子中的行为。
通过量子力学,科学家们发现了电子云模型,即电子在原子中呈现一种概率分布的状态。
这一模型更为准确地描述了原子的结构。
原子结构演变史
现代原子学说
CHAPTER THREE
CHAPTER THREE 海森堡——电子云模型
不确定原理
一个微观粒子的某些物理量(如位置和动量,或方位角与动量矩, 还有时间和能量等),不可能同时具有确定的数值,其中一个量越确定, 另一个量的不确定程度就越大。即△p* △X≥h/2π(h是普朗克常数),它 反映了微观粒子运动的基本规律,是物理学的重要原理。这也就是说明 了在原子中,电子没有确定的运行轨迹,显然行星模型违背了这一点。 因此薛定谔在德布罗意关系式的基础上,对电子的运动做了适当的数学 处理,提出了二阶偏微分的的著名的薛定谔方程式。这个方程式的解,如 果用三维坐标以图形表示的话,就是电子云。
CHAPTER TWO
卢瑟福行星模型——α散射实验
缺陷: 虽然行星模型能够很好的解释散射实验,也提出了原子核的概念, 但是没有很好的解释核外电子的排布。因为物理学家们很快就指出, 带负电的电子绕着带正电的原子核运转,这个体系是不稳定的。两者 之间会放射出强烈的电磁辐射,从而导致电子一点点地失去自己的能 量。作为代价,它便不得不逐渐缩小运行半径,直到最终“坠毁”在 原子核上为止,整个过程用时不过一眨眼的工夫。显然原子在常态下 是稳定的,这一推论与现实不符。
CHAPTER TWO
汤姆生枣糕模型——阴极射线实验
验证道尔顿的原子说时,汤姆生发现在做α散射实验中气 体在X射线照射下会变成电的导体。 据汤姆生的推测:这种导电性,可能是由于在X射线的作 用下,产生了某种带正电的和带负电的微粒所引起的。
可是怎么往称量那么小的粒子呢?
CHAPTER TWO 汤姆生枣糕模型——阴极射线实验
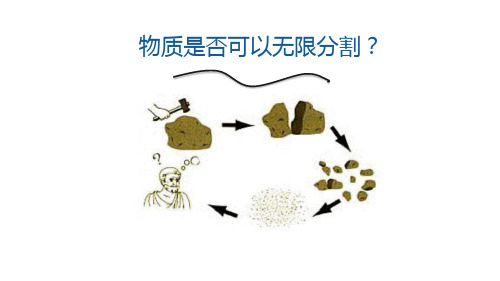
物质是否可以无限分割?
物质是由什么 构成的?
A
T
原子结构的发展史ppt课件

A. +2、-2
B. +6、-2
C. +4、-4
D. +2、-6B
;.
40
反馈练习
3、已知最外层电子数相等的元素的原子有相似的化学性质。氧元素原子核外电子分层
排布示意图:
下列原子中,与氧原子的化学性质相似的是( )
D
;.
41
反馈练习
4、核电荷数小于或等于18的元素中,原子的最外层电子数是内层电子总数一半的元素
原子论
+
=
分子原
+
=
子论
;.
11
汤姆生的原子结构模型
“葡萄干面包式”
1897年,汤姆生发现原子中存在电子,用实验方法测出电子的质量,并确定了质荷 比
正电荷均匀地分布在原子之中,电子则散布在正电荷之中。
;.
12
;.
13
科学探究
体积很小相 对质量为4的 带正电粒子
1911年卢现瑟象福:通过实验推断出: 1、原子大1部、分大是部空分的α粒。子穿过薄的金箔 2、中间有2一、个极几少乎数集α粒中子了好所象有打原在子坚的硬质的量东且西体上积,很完小全的反粒弹子回—来—。原子核。 3、电子随3意、地少围数绕α粒着子一穿个过带薄正的电金荷箔的时很,小发的生原了子偏核转运。转。
+11 2 8 1
+17 2 8 7
;.
37
原子结构与元素性质的关系
(1)金属元素原子最外层一般少于4个电子,在反应中易失去电子, 形成与稀有气体元素原子相同的电子层排布的阳离子(稳定结构)。 (2)非金属元素原子最外层一般超过4个电子,在反应中易得到电子, 形成与稀有气体元素原子相同的电子层排布的阴离子(稳定结构)。 (3)原子核在反应中不发生变化,原子的最外层电子数可能发生变化, 元素的化学性质取决于原子的最外层电子。 元素化合价与得失电子数目的关系: (1)金属元素为正化合价,失去电子的数目即为化合价的数值。 (2)非金属元素既可以为正化合价也可以为负化合价,活泼非金属元 素的最低负化合价的数值即为得到电子的数目。 元素化合价与最外层电子数目的关系: ①活泼金属元素化合价=__原子最外层电子数 ②非金属元素的最低价=_原子最外层电子数-8
原子结构理论的发展简史 ppt课件

r OP 的长度
(0 — )
OP 与 z 轴的夹角 ( 0 — )
OP 在 xoy 平面内的投影 OP′
P
与 x 轴的夹角 ( 0 — 2 )
r
根据 r,, 的定义,有
x = r sin cos
o
y y = r sin sin
z = r cos
x
P′
r ppt课件 2 = x2 + y2 + z2
值。这种量子化的能量状态称为能级。
ppt课件
9
借助于氢原子能量关系式可定出氢原子各能级 的能量:
ppt课件
10
(2) 玻尔理论的第二点可用来说明原子的稳定性 的稳定
在通常情况下,氢原子中的电子在特定的稳 定轨道上运动,并不放出能量,因此通常情况下, 原子是不会发光的,同时,氢原子也不会自发地 毁灭。
在量子力学中常把波函数称为原子轨道函数,简称
原子轨道。
ppt课件
23
(二) 四个量子数
n、l、m组成一套参数可描述出波函数的特征 ,即核外电子的一种运动状态。除这三个量子数以 外,还有一个描述电子自旋特征的量子数ms,称为 自旋量子数。
当四个量子数n、l、m、ms组合方式一定时, 波函数的具体形式也就一定,电子的运动状态(原 子轨道或电子云的形状和空间伸展方向、原子中电 子的能量)也就一定。
4. 玻尔理论的不足和原因
不足:玻尔理论的不足虽然对氢原子光谱作 出了相当满意的解释,但他不能说明多电子原子 光谱;也不能说明氢原子光谱的精细结构。
原因:因为玻尔理论没有摆脱经典力学的束 缚,虽然引入了量子化条件,但仍将电子视为有 固定轨道运动的宏观粒子,而没有认识到电子的 波动性,因此不能全面反映微观粒子的运动规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大量实验
古代原子学 说观察、猜 想
道尔顿 原子学 说
发现电子
原子可分结论 ,葡萄干模型
事实、推测
元素放射现象
α—粒子散 射实验
原子有核模型 即行星模型
原子光谱实验
电子云模型
实验、推测
量子;.理论
19
科学探究的一般过程是:
提出假设→设计实验→对照实验→ (若不符合)再假设→再实验→再证实。
如此循环往复。
;.
14
核式结构模型
1.原子由原子核和核外电子构成,原子的 质量主要集中在原子核上,原子核带正电 荷,位于原子中心
2.电子带负电,在原子核周围空间做高速 运动
;.
15
玻尔——发现核外电子的能量
原子核外电子在一系列稳定的轨道上运动, 每个轨道都具有一个确定的能量值;核外电 子在这些稳定的轨道上运动时,既不放出能 量,也不吸收能量。
;.
16
20世纪初,科学家发现了中子,揭示了微观世界波粒二象性规律、认识到原子核 外电子的运动不遵循经典力学的原理,建立用量子力学方法描述核外电子运动的数 学模型。
;.
17
道尔顿模型(1803) 汤姆生模型(1904) 卢瑟福模型(1911)
波尔模型(1913)
电子云模型 (1935)
;.
18
人类认识原子结构的过程,符合认识世界的普遍规律
• 1、一切物质都是由不可见的,不可分割的原子组成,原子不能自生自灭 • 2、同种类的原子在质量,形状和性质上都完全相同,不同种类的原子则不同 • 3、每种物质都是由它自己的原子组成,单质是由简单原子组成,化合物是由
复杂原子组成,而复杂原子又是由为数不多的简单原子组成,复杂原子的质 量等于组成它的简单原子的质量之和。
核电荷数
元素名称
元素符号
各电子层的电子数
K
L
M
N
11
钠
Na
2
8
1
12
镁
Mg
2
8
2
13
铝
Al
2
8
3
14
硅
15
磷
16
硫
Si
2
8
4
P
2
8
5
S
2
8
6
17
氯
Cl
2
8
7
18
氩
Ar
2
8
8
19
钾
K
2
8
8
1
20
钙
Ca ;.
2
8
8
2 24
元素 名称
元素 符号
氦
He
氖
Ne
氩
Ar
氪
Kr
氙
Xe
氡
Rn
稀有气体元素原子电子层排布
3、汤姆生 ——葡萄干面包 模型
;.
5
资料卡
十八世纪末,生产力的发展推动了科学进步,化学科学从物质的变 化的简单研究进入到定量研究,陆续发现了一些元素相互化合时的 基本定律,为化学新理论的诞生打下了基础 质量守恒定律:化学反应前后物质质量不变。
定组成定律:一种纯净物不论来源 如何,各组分元素的质量间都有 一定的比例
各电子层的电子数
K
L
M
N
O
P
最外层电子数
1
2
3
ห้องสมุดไป่ตู้
4
5
6
2
2
2
8
8
2
8
8
8
2
8
18
8
8
2
8
18
18
8
8
2
8
18
32
18
8
8
分析稀有气体的核外电子排布与其性质有什么联系?
;.
25
2、原子核外电子排布一般规律
① 电子总是尽先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐步升高的 电子层里(能量最低原理), 先排K层,排满K层后再排L层,排满L层后再排M层。
;.
1
在你眼中…? 在化学家眼中…?
;.
2
它们由什么微粒构成? 原子
铜由铜原子构成
食盐由离子构成
水由水分子构成
;.
3
公元前5世纪,古希腊哲学家德谟克利特等人认为,原子是构成物质的微粒,万物都 是由简短的、不可分割的原子构成。
;.
4
一、原子结构模型的演变
6、微观粒子 波粒二象性
2、道尔顿 ——实心球 模型
+ 18
2
8
8
原子核带正电
K层
核电荷数
L层
M层
该电子层上的电子数
;.
22
核电荷数为1~10的元素原子核外电子层排布
核电荷数 1
元素名称 氢
元素符号 H
各电子层的电子数
K
L
M
N
1
2
氦
He
2
3
锂
Li
2
1
4
铍
Be
2
2
5
硼
B
2
3
6
碳
C
2
4
7
氮
N
2
5
8
氧
O
2
6
9
氟
F
2
7
10
氖
Ne ;. 2
8
23
核电荷数为11~20的元素原子核外电子层排布
②每个电子层最多只能容纳2n2个电子。
;.
8
原子是否真的是一个不可再分的 球体呢?
;.
9
资料卡
简比定律: 十九世纪初,法国化学家盖•吕萨克对气体研究发现,参 加反应的气体和反应生成后的气体的体积都有简单整数比关系。归 纳为:同温同压下,气体反应中各气体体积互成简单整数比
例如H2 +Cl2 = 2HCl 思考?如果用道尔顿的原子论解释会出现怎样的情况?
;.
20
原子核外电子的分层排布
+2
+10
He
Ne
电子层 原子核
+18
核电荷数 Ar
该电子层 上的电子
+1
+8
+12
H
O
Mg
;.
21
1、原子结构示意图
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种 特殊的图形。
电子层 原子核
原子核
第2层 第1层
第3层
+18
核电荷数 Ar
该电子层 上的电子
原子论
+
=
分子原
+
=
子论
;.
11
汤姆生的原子结构模型
“葡萄干面包式”
1897年,汤姆生发现原子中存在电子,用实验方法测出电子的质量,并确定了质荷 比
正电荷均匀地分布在原子之中,电子则散布在正电荷之中。
;.
12
;.
13
科学探究
体积很小相 对质量为4的 带正电粒子
1911年卢现瑟象福:通过实验推断出: 1、原子大1部、分大是部空分的α粒。子穿过薄的金箔 2、中间有2一、个极几少乎数集α粒中子了好所象有打原在子坚的硬质的量东且西体上积,很完小全的反粒弹子回—来—。原子核。 3、电子随3意、地少围数绕α粒着子一穿个过带薄正的电金荷箔的时很,小发的生原了子偏核转运。转。
如果用道尔顿的原子论解释,则会出现在HCl中存在半个H原 子和半个Cl原子,或者同温同压下相同体积的任何气体含有 相同的原子数
;.
10
阿伏伽德罗的分子原子论
• 为了解决半个原子的矛盾,引入分子的概念。 • 1、一切物质都是由分子组成的,而分子是由原子组成的,分子是物质能够独
立存在而保持物质化学性质的最小微粒;原子则是构成分子的不可再分的更 小微粒,它是物质进行化学反应的基本微粒,原子是不能独立存在的 • 2、同种原子的化学性质相同,质量相同 • 3、单质分子由相同的原子组成,化合物由不同原子组成。分子质量由构成其 原子的质量之和。
倍比定律:当甲和乙两种元素相互化合生成两种以上的化合物时,在 这些化合物中,与一定质量甲元素相化合的乙元素的质量间互成简单 整数比关系
;.
6
实心球模型
1803年,英国科学家道尔顿提出物质是由原子组成,原子不能被创造,也不能被毁灭, 在化学变化中不可再分割,在化学反应中保持本性不变。
;.
7
道尔顿的原子学说
