2008级食品科学与工程本科《普通化学》2008-2009学年第1学期期末试题B卷
2008年4月-食品化学与分析

2008年4月高等教育自学考试全国统一命题考试食品化学与分析试卷(课程代码5753)试卷满分l00分,考试时间l50分钟。
一、单项选择题(本大题共20小题。
每小题l分,共20分)在每小题列出的四个备选项中只有一个是符合题目要求的。
请将其代码填写在题后的括号内。
错选、多选或未选均无分。
1.新鲜的水果、蔬菜中含有的水主要是【】 A.自由水 B.结合水C.单分子层水 D.多分子层水2.等温吸湿曲线中区域Ⅰ水的Aw值范围是【】 A.0~0.25 B.0~0.50C.0.25~0.80 D.0.50~0.803.下列糖类化合物中属于单糖的是【】 A.乳糖 B.蔗糖C.葡萄糖 D.果胶4.α-环状糊精均葡萄糖单元聚合度是【】 A.5 B.6C.7 D.85.两种具有相同味感的物质进入口腔时,其味觉强度超过两者单独使用之和的现象称之为【】 A.昧的对比现象 B.味的相乘作用C.昧的变调作用 D.味的消杀作用6.下列不适合保存油脂样品的是【】 A.玻璃容器 B.不锈钢容器C.塑料容器 D.铝制容器7.利用电解过程中所得的电流-电位(电压)曲线进行测定的方法,称为【】 A.伏安法 B.库仑分析法C.电导分析法 D.电位分析法8.湿法消化的优点是【】 A.没有外环境因素污染样品B.试剂消耗量小C.微量金属不会从容器(玻璃)中渗出D.成本低廉9.蜂蜜应采用的干燥方法是【】 A. 直接干燥法 B.蒸馏法C.减压干燥法 D.卡尔费休氏法10.食品中脂肪酸的测定方法中比较常用的是【】 A.气相色谱法 B. 双缩脲法C.碱性滴定法 D.乙酸铜比色法11.食品中还原糖的测定方法是【】 A.双缩脲法 B.硝酸银络合法C.酶法 D.斐林试剂比色法12.硫胺素在光照射下产生的荧光的颜色为【】 A.蓝色 B.蓝绿色C.黄色 D.黄绿色13.食品中常用的维生素B2.的测定方法是【】A.动物试验法 B.荧光法C.放射免疫法 D.酶法14.滴定法测定食品中的钙时,常用的氨羧络合剂是【】 A.硝酸锻 B.亚硫酸钠C. 高锰酸钾 D.乙二胺四乙酸二钠(EDTA)15.检测食品中黄酮类物质常用的方法是【】 A.高效滚相色谱法 B.阳极溶出伏安法C. 索氏提取法 D.荧光法16.在肉类腌制过程中加入亚硝酸盐赋予肉制品鲜艳红色的作用机制是【】 A.亚硝酸盐本身产生的颜色B. 形成亚硝基血红蛋白和亚硝基肌红蛋白C.亚硝酸盐的抗氧化作用D.亚硝酸盐的还原作用17.下列属于抗氧化剂的物质是【】 A.苯甲酸 B.丁基羟基茴香醚(BHA)C.胭胃旨红 D.亚硝酸盐18.检测食品中黄曲霉毒素B1,常用的方法是【】A.气相色谱法 B.分光光度计C.薄层层析法 D.荧光分光光度法19.冷原子吸收光谱法测定食品中的汞所使用的仪器是【】 A.分光光度计 B.原子吸收光谱仪C.测汞仪 D.气相色谱仪20.测定酒中杂醇油的方法中,分离各组分较好,且灵敏、重复性良好的方法是【】 A.分光光度法 B.滴定法C. 紫外分光光度法 D.气相色谱法二、多项选择题(本大题共l0小题,每小题2分,共∞分)在每小题列出的五个备选项中至少有两个是符合题目要求的,请将其代码填写在题后的括号内。
2008-2009(2008秋)期末生化试题参考答案
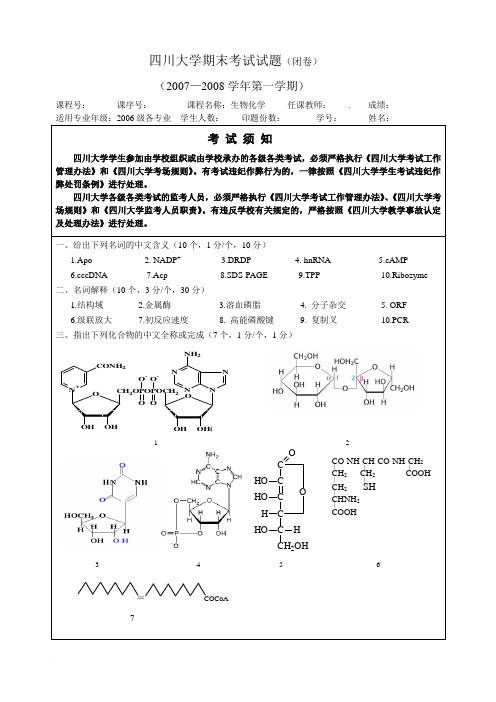
四川大学期末考试试题(闭卷)(2007—2008学年第一学期)课程号: 课序号: 课程名称:生物化学 任课教师: . 成绩:适用专业年级:2006级各专业 学生人数: 印题份数: 学号: 姓名:C C C C C CH 2OH O HO HO H HO H O O C C O O O H HO H CH 2OH C C C CO-NH-CH-CO-NH-CH 2 CH 2 CH 2 COOH CH 2 SH CHNH 2 COOH O CH 2OPOPOCH 2O O O -O-N +CONH 2O N N NH 2N N ∣ ∣ ∣ ∣ ∣ ∣ ∣注:1试题字迹务必清晰,书写工整。
本题2 页,本页为第2 页2 题间不留空,一般应题卷分开教务处试题编号:3务必用A4纸打印参考答案:一、给出下列名词的中文含义(10个,1分/个,共10分)1.ACP酰基载体蛋白2. FAD黄素腺嘌呤二核苷酸3.DDDP依赖于DNA的DNA聚合酶,DNA聚合酶 4. hnRNA不均一核RNA 5. UDPG鸟嘧啶二核苷酸葡萄糖cDNA共价闭合环DNA7.Bccp生物素羧基载体蛋白8.SDS-PAGE十二烷基硫酸钠-聚丙烯酰胺凝胶电泳9.TPP焦磷酸硫胺素10.Coenzyme辅酶二、名词解释(10个,2分/个,共20分)1.超二级结构:指蛋白质分子中相邻的二级结构单位组合在一起所形成的有规则的、在空间上能辨认的二级结构组合体。
2.还原糖:羰基碳(异头碳)没有参与形成糖苷键,因此可被氧化充当还原剂的糖。
3.溶血磷脂:磷脂分子中C1和C2上的2个脂肪酸其中之一被酶水解后的产物。
4. Northern blot:将电泳分离后的RNA吸印到纤维素膜上再进行分子杂交的方法。
5. 内含子:在转录后的加工中,从最初的转录产物除去的内部的核苷酸序列。
术语内含子也指编码相应RNA内含子的DNA中的区域。
6. 同工酶:指存在于同一个体的不同组织、不同亚细胞部位,能够催化同一种化学反应,但其酶蛋白本身的分子结构组成和动力学行为等却有所不同的一组酶。
2008~2009学年度第一学期应化、化教专业《物理化学》期未试卷(B)答案

2008 —2009 学年 第 一 学期化学与材料学院2006级应化、化教(本科)专业《物理化学》期末试卷(B )题号 分数 一二三四(1) 四(2) 五(1) 五(2)五(3)五(4)五(5)总分 评卷人 复核人息 考 生 信 栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………注意事项1、学生的院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定的位置。
2、学生在考试之前必须填写考试时间和地点。
3、答题字迹要清楚,并保持卷面清洁。
试卷类别: 开卷( )闭卷(√) 考试用时: 120 分钟考试时间: 2009 年 01 月 14 日 上 午 考试地点:考生考试诚信承诺书在我填写考生信息后,表示我已阅读和理解《龙岩学院考试纪律与违纪处分办法》的有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供的个人信息是真实、准确的。
考生签名:一、选择题(每题1分,共10分,填上正确答案)1. 某实际气体反应在温度为500K ,压力为202.6×102kPa 下的平衡常数K f ө=2,则该反应在500K ,20.26kPa 下反应的平衡常数K f ө为(A )。
A. 2B.>2C. <2D. ≥22. 在410 K ,Ag 2O(s)部分分解成Ag(s)和O 2(g), 此平衡体系的自由度为(A )。
A. 0B. 1C. 2D. -13. 下列理想气体分子中,哪个分子的转动配分函数q r =(A )。
A. N 2B. HeC. HClD. NH 34. Boltzmann 统计对于定位系统分布x 所拥有的微观状态t x 为(B )。
A.B.C.D.5. 1 mol A 与n mol B 组成的溶液,体积为0.76dm 3,当x B = 0.80时,A 的偏摩尔体积V A,m = 0.120dm 3·mol -1,那么B 的偏摩尔体积V B,m为(A )。
试卷B及答案

试卷B及答案武汉工业学院2007–2008学年第1学期期末考试试卷(B卷)一、填空题(计30分,每小题2分)1、食品分析的一般程序为()。
2、粮食的伪劣表现在哪些方面()。
3、采样一般分三个步骤进行,分别得到的样品为()。
4、分析柑橘类果实及其制品时,用()酸表示,K=0.064,K是换算为主要酸的系数,即指()。
5、在进行比色分析中,为了减少误差,样品的量应该控制适宜的范围,使吸光度在()范围内较为合适。
6、评分检验法是指()。
7、感官分析按方法性质可分为()三类?8、食品中的总酸度是指()。
9、对于颜色深的食品,测定其酸度的方法有()。
10、对于含磷脂较多的鱼、贝、肉、蛋等,测定其脂肪含量可采用的方法是()。
11、测定痕量水分的食品中的水分含量的方法是()。
12、在测定磷酸盐含量比较高的食品的灰分时,为了使灰化完全,可采取的措施有()。
13、测定液状乳、乳制品的脂肪含量的测定方法名称有()。
14、已知有完整包装的样品128件,采样的件数应为()件。
15、测定黄曲霉毒素B1可以使用的方法有()。
二、是非题(计10分,每小题1分,对了打√,错了打×)1、已知测定面粉样品中蛋白质含量的数据如下:12.56%、12.62%、11.32%、12.64%、12.65%。
取置信度90%,Q0.90=0.64,则11.32%不是离群值,应该保留。
()2、在测定冰淇淋膨胀率时,加入乙醚的体积为2.0ml,滴加蒸馏水的体积为22.0ml,则冰淇淋膨胀率为92.3%。
()3、测定食品中的钾、钠含量时,不能用原子发射光谱法测定。
()4、有机氯农药残留量的测定可用高效液相色谱法。
()5、感觉相乘现象是当两种或两种以上刺激同时作用于感官时,而降低了其中一种刺激的强度或使该刺激发生改变的现象。
()6、用原子吸收分光光度法可以测定有机磷农药残留量。
()7、用高效液相色谱法测定食品中的VA、VD、VE时,根据色谱图以保留时间定性,以峰高、峰面积定量。
2008《食品分析》试卷—A

3.挥发酸不包括可用水蒸气蒸馏的乳酸、CO2、SO2等。()
4.用乙醚提取糖精,可消除脂肪的干扰。()
5.食品中的矿物质组成就是灰分,所以可以用灰分来表示矿物质的含量。()
四、简答题(共24分,每小题6分)
1.用你学过的知识,设计一种测定即食鱼片水分活度的简便方法。(可用流程图表示)。
A、BHC对光稳定B、BHC对碱稳定
C、BHC对酸稳定D、BHC对紫外线稳定
4.以下哪种样品比较适合用索氏提取法测定脂肪含量()
A、烤面包B、鸡肉C、花生粉D、牛奶
5.测量瓶装啤酒的pH值时,为使测量准确些,样品应如何处理()
A、冷却至5℃取样即刻测量;B、室温下取样即刻测量;
C、取样后40℃加热30min;D、取样后100℃加热30min
1.下列哪些方法不属于样品处理中破坏有机物的方法()
A、干法灰化;B、紫外光分解法;C、微波消解法;D、蒸馏法
2.测定样品灰分时常加入碳酸铵与样品一起灰化,则碳酸铵的作用是()
A、增加灰分重量B、使样品充分灰化
C、包裹样品的碳粒D、减少样品挥发逸失
3.以下对残留的有机氯农药(BHC)描述不正确的是()
六、实验设计:(16分)
颜色新鲜的草莓、绿意盎然的海带、个大色黄的香蕉、色彩缤纷的果汁……这些让人垂涎欲滴的食品竟然都不乏色素之功。然而,有些生产厂家和经营者漠视国家相关法规,不顾消费者的健康,超标准添加色素甚至滥用非食用色素。现就某果汁产品色素的含量测定问题,请你设计一套检测产品中色素的组成及其相对含量的实验方案。(包括:测定原理、主要实验步骤)
3.用盐酸萘乙二胺法测定肉制品中的亚硝酸盐时,常在样品制备时加入饱和硼砂溶液,其作用是。
《食品化学》期末试卷及答案1

《食品化学》期末试卷一一、名词解释(每小题3分,共15分)1.水分活度2.蛋白质的变性3.焦糖化反应4.胶凝作用5.调温二、填空题(每空1分,共20分)1.一般来说,食品中的水可分为结合水和[1] 两大类。
其中,前者可根据被结合的牢固程度细分为[2] 、[3] 和[4] 。
2.抗氧化剂的作用机理是[5] 或[6] 。
3.乳浊液失稳表现为___[7]___、___[8]___和___[9]___。
加入两亲性乳化剂使乳浊液稳定的机理是___[10]___。
4.每个水分子最多能够与__[11]__个水分子通过__[12]___结合,每个水分子在__[13]__维空间有相等数目的氢键给体和受体。
5.发生美拉德反应的三大底物是[14] 、[15] 和[16] 。
6.脂肪自动氧化是典型的___[17]___反应历程,分为链引发、链传递和链终止三步。
油脂氧化主要的初级产物是___[18]__。
7.氨基酸根据R基团的极性可分为[19] 和[20] 。
三、单项选择题(每小题1分,共10分)1.关于水分吸湿等温线划分区间内水的主要特性描述,正确的是。
A.等温线区间Ⅲ中的水,是食品中吸附最牢固和最不容易移动的水。
B.等温线区间Ⅱ中的水可靠氢键键合作用形成多分子层水。
C.等温线区间Ⅰ中的水,是食品中吸附最不牢固和最容易流动的水。
D.食品的稳定性主要与区间Ⅰ中的水有着密切的关系。
2.一次摄入大量苦杏仁易引起中毒,是由于苦杏仁苷在体内彻底水解产生,导致中毒。
A.D-葡萄糖B.氢氰酸C.苯甲醛D.硫氰酸3.环糊精由于内部呈非极性环境,能有效截留非极性的和其他小分子化合物。
A.有色成分B.无色成分C.挥发性成分D.风味成分4.人造奶油要有良好的涂抹性和口感,这就要求人造奶油的晶型为细腻的型。
A.β, B.β C.α D.α,5.在有亚硝酸盐存在时,腌肉制品生成的亚硝酰基肌红蛋白为。
A.绿色B.黄色C.褐色D.鲜红色6.下列氨基酸属于非极性氨基酸的是。
2008~2009学年度第一学期应化、化教专业《物理化学》期未试卷(A)

2008 —2009 学年 第 一 学期化学与材料学院2006级应化、化教(本科)专业《物理化学》期末试卷(A )考生考试诚信承诺书在我填写考生信息后,表示我已阅读和理解《龙岩学院考试纪律与违纪处分办法》的有关规定,承诺在考试中自觉遵规守纪,如有违反将接受处理;我保证在本科目考试中,本人所提供的个人信息是真实、准确的。
考生签名:题号 分数 一 二 三 四(1) 四(2) 四(3) 四(4) 四(5) 四(6) 五 总分 评卷人 复核人注意事项1、学生的院(系)别、专业、班级、姓名、学号必须填写在考生信息栏内指定的位置。
2、学生在考试之前必须填写考试时间和地点。
3、答题字迹要清楚,并保持卷面清洁。
试卷类别: 开卷( )闭卷(√) 考试用时: 120 分钟考试时间: 2009 年 01 月 14 日 上 午 考试地点:息 考 生信栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………一、选择题(每题1分,共10分,填上正确答案)1. 对于气相反应,当体系总压力p 变化时,哪个说法正确 ( )(A )对K f ө无影响 (B )对K r 无影响(C )对K p ө无影响 (D )对K f ө、K r 、K p ө均无影响 2. 对于理想气体间的反应,以各种形式表示的平衡常数中,其值与温度和压力皆有关系的是 ( ) (A )K a (B )K c (C )K p (D )K x 3. 下列理想气体分子中,哪个分子的转动配分函数q r =( )(A )N 2 (B )He (C )HCl (D )NH 3 4. Boltzmann 统计中对于非定位系统分布x 所拥有的微观状态t x 为 ( ) (A ) (B )(C ) (D )5. CuSO 4 与水可生成CuSO 4·H 2O ,CuSO 4·3H 2O ,CuSO 4·5H 2O 三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为 ( ) (A )3种 (B )2种 (C )1种 (D ) 不可能有共存的含水盐6. 组分A(高沸点)与组分B(低沸点)形成完全互溶的二组分系统,在一定温度下,向纯B 中加入少量A ,系统蒸气压力增大,则此系统为 ( ) (A ) 有最高恒沸点的系统 (B ) 不具有恒沸点的系统 (C ) 具有最低恒沸点的系统7. 对于一个N 、U 、V 确定的体系,沟通宏观和微观、热力学与统计力学的桥梁公式是 ( ) (A )A = -kT ln q (B )S = k ln Ω (C )配分函数q(D ) (E )8. H 2O-NaCl-Na 2SO 4的三元体系中,Na 2SO 4 和 H 2O 能形成水合物 Na 2SO 4·10H 2O(D),在BGD 区中存在的是 ( )(A )水合物D 和溶液G (B )水合物D 和Na 2SO 4 及NaCl 三相共存 (C )水合物D 、NaCl 和溶液G (D )NaCl ,Na 2SO 4和溶液G9. 系统按图中的路线循环一周,哪种情况所做的功最多 ( )10. 对于同一粒子,各运动能级的大小次序是 ( )(A )εt >εr >εv >εe >εn (B )ε t <εr <εv <εe < εn (C )εe <εt <εn <εr <εv (D )εn <εt <εe <εr <εv (E )εv <εr <εt <εe <εn二、判断题(每题1分,共10分,对打“√”,错打“×”)1. 两种不同的理想气体,如果它们的平均平动能相同,密度也相同,则它们的压力一定也相同。
(整理)08级食品分析试卷.

考生姓名:___________学号层次专业一、选择题(每题1分,共10分)1、从大批食品中以一定的方法抽取少量部分供检验用的过程称为。
A. 取样B. 选样C. 称样D. 采样2、用乙醚抽取测定脂肪含量时,要求样品()。
A、含有一定量水分;B、尽量少含有蛋白质;C、颗粒较大以防被氧化;D、经低温脱水干燥。
3、测定鲜杏的总酸度时,宜选用_______ (有机酸)的百分含量来表示。
A、酒石酸B、柠檬酸C、草酸D、苹果酸4、水分测定时,水分是否排除完全,可以根据____来进行判定。
A、经验B、专家规定的时间C、样品是否已达到恒重D、烘干后样品的颜色5、用NaOH标准溶液滴定测定的食品的酸度,称为____。
A、总酸度B、有效酸度C、挥发酸D、有效酸度与挥发酸之和。
6、提高消化速度的方法为加入少量的()。
A. H2O2B.CaCO3C. MgCO3D. Na2SO47、食品分析中配制微量物质的标准溶液时,试剂应在()以上。
A、优级纯;B、分析纯;C、化学纯;D、实验试剂。
8、测定乳品样品中的糖类时,需在样品提取液中加入醋酸铅溶液,其作用是。
A、沉淀蛋白质B、脱脂C、沉淀糖类D、除矿物质9、通常液—液萃取使用的仪器是。
A.容量漏斗B.分液漏斗C.布氏漏斗D.垂融漏斗10、过氧化值是富含食品卫生指标。
A.糖B.蛋白质C.氨基酸D. 脂肪二、填空题(每空1分,共10分)1、根据水在食品中所处的状态不同以及与非水组分结合强弱的不同,可把食品中的水划分为以下三类:、亲和水和。
2、采样是指在产品中抽取具有的样品,根据采样的过程有不同阶段,样品可分为、和平均样品三种。
3、采用常量凯氏定氮法测定食品中蛋白质,计算时含氮量乘以得出蛋白质的含量。
4、分析食品中无机成分时,一般须破坏有机物质,破坏有机物质常用的方法有和湿法消化法。
测定灰分时,灰化温度的范围一般是,一般可根据灰分颜色呈来判断样品灰化是否完全。
5、食品中的有效酸度大小可以用来测定。
2008~2009学年度第一学期期末考试试卷参考答案及评分标准

△
2008~2009学年度第一学期期末考试试卷参考答案及评分标准
高 二
化 学
三、填空题(35分,共4小题)
26.(5分)(CH 3)2CHC(CH 3)=CHCH 3 (3分) 3,4—二甲基—2—戊烯 (2分) 27.(6分)(1)HOCH 2CHO (3分) ⑵ CO(NH 2)2 (3分) 28.(11分) (1)(CH 3)3CCH 2CH 3(3分)
(2)(CH 3)3CCH 2CHO+2Ag(NH 3)2OH → (CH 3)3CCH 2COONH 4+2Ag↓+3NH 3+H 2O (4分) (3)取代(或水解) (2分) (4)消去 (2分)
29.(13分)(1)氯气(C12)、光照;NaOH 水溶液,加热 (每空1分、共4分)
(2)
(4)
(5)H 2O 2 (2分)
四、计算题(共1小题,10分) 30.
(1)m(H)= =0.6(g) m(C)= =3.6(g) m(O)=5.8-0.6-3.6=1.6(g)(3分)
n(C):n(H):n(O)= : : = 0.3:0.6:0.1=3:6:1
则该物质的实验式为C 3H 6O (2分)
又根据质谱图中的质荷比得知该物质的相对分子质量为58
设其分子式为(C 3H 6O )n 则(C 3H 6O )n =58 n=1 该物质的分子式为C 3H 6O (2分)
(2)根据核磁共振氢谱有3个峰,且面积比为2:1:3 则该物质的结构简式为 CH 3CH 2CHO (3分)
(其他合理结构也给分) (2分)。
2008-2009学年第一学期期末高中学业质量监测高二化学

2008-2009学年第一学期期末高中学业质量监测高二化学试卷可能用到的相对原子质量:H—1 C—12 O—16一、选择题(本题包括16小题,每小题3 分,共48分。
每小题只有1个选项符合题意)1. 区分强弱电解质的标准是A. 化合物在溶液中或熔融状态时能否导电B. 化合物在溶液中或熔融状态时能否电离C. 化合物在溶液中的电离程度D. 化合物中化学键的类型2. 下列化学用语表达正确的是A. 碳酸氢钠的电离方程式:NaHCO3==Na++H++CO32-B. 亚硫酸的电离方程式:H 2SO32H++SO32-C. 氯化铝发生水解的离子方程式:Al3++3H2O == Al(OH)3+3H+D. 碳酸钙的沉淀溶解平衡表达式:CaCO 3(s)Ca2+(aq)+CO32-(aq)3. 下列有关能量转换的说法,正确的是A. 干电池工作时是将化学能转化为电能B. 化石燃料燃烧是热能转化为化学能的过程C. 动物体内葡萄糖被氧化成CO2是热能转化为化学能的过程D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转化为热能的过程4. 下列四种溶液:①0.1mol/L 盐酸溶液;②0.1mol/L硫酸溶液;③0.1mol/L氯化铵溶液;④0.1mol/L醋酸溶液。
pH由小到大的排列顺序是A. ①②④③B. ④③②①C. ②①④③D.③④①②5. 下列粒子中不能..破坏水的电离平衡的是A. H+B. OH-C. Fe3+D. Na+6. 在密闭容器中充入N2和H2,合成NH3,测得前2秒H2的浓度减少了0.90 mol·L-1,则此段时间内用NH3的浓度变化表示反应速率为A. 0.15 mol·L-1·s-1B. 0.30 mol·L-1·s-1C. 0.45 mol·L-1·s-1D. 0.60mol·L-1·s-17. 下列关于催化剂的说法,正确的是A. 催化剂没有参加化学反应B. 温度越高,催化剂的催化作用越强C. 催化剂可以使反应所需的活化能降低D. 催化剂能使不发生反应的物质发生化学反应8. 下列热化学方程式中,△H能正确表示物质的燃烧热的是A. CO(g) +1/2O2(g) ==CO2(g) △H=-283.0 kJ/molB. C(s) +1/2O2(g) ==CO(g) △H=-110.5 kJ/molC. H2(g) +1/2O2(g)==H2O(g) △H=-241.8 kJ/molD. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) △H=-11036 kJ/mol2NO2达平衡后,通入18O2气体,再次达平衡后,18O原子存9. 当可逆反应2NO+O在于A. 一氧化氮B. 二氧化氮和氧气C. 一氧化氮和二氧化氮D. 三种物质中都有10. 体积相同,pH相同的盐酸溶液和醋酸溶液,与氢氧化钠溶液中和时两者消耗氢氧化钠的物质的量A. 中和醋酸的多B. 中和盐酸的多C. 相同D. 无法比较11. 室温下,往0.1 mol·L-1 的氨水中滴入酚酞,溶液呈粉红色,再加入少量氯化氨固体,则溶液的颜色A. 变深B. 变浅C. 不变D. 无法确定12.13. 氯化铵溶液中离子浓度大小关系正确的是A. c ( NH4+ ) > c (OH- ) > c (Cl- ) > c (H+)B. c (Cl- ) >c ( NH4+ ) > c (H+) > c (OH- )C. c (NH4+ ) > c (Cl-) > c (OH- ) > c (H+)D. c ( NH4+ ) > c (Cl- ) > c (H+)> c (OH- )14. 某苹果汁的pH是4,其中的c(OH-)是A. 0.1mol/LB. 1×10-10 mol/LC. 1×10- 7mol/LD. 1×10-4mol/L15. 在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液,则灯泡由亮变暗,几乎熄灭后,又逐渐变亮的是A. 盐酸中逐滴加入食盐溶液B. 硫酸中逐滴加入氢氧化钠溶液C. 硫酸中逐滴加入氢氧化钡溶液D. 醋酸中逐滴加入氨水16. 氯化银在水中存在沉淀溶解平衡, 25℃时,氯化银的Ksp=1.8 x 10-10。
食品2008级有机化学测验题答案与解题

食品2008级有机化学测验题答案与解题以上四种类型的命名,期末考试都有类似的题出现。
三、完成反应式答案:( )1CH 3C=CH 2 ;CH 3C ≡CH ;CH 3CH=CH 2 ;CH 3CH 2CH 2BH 2 ;CH 3CH 2CH 2OH( )2CH 3CH -CH 2 ;CH 3CH -CH 2O( ) CH 2=CH -CH=CH 2 ;CH 2=CH -CN ; 3CN O( )4CH 2CCH 2C O OO 或 HOOCCH 2CH 2COOH ;CH 2CH 2CH 2COOH C O ;;( )5-CHCH 2CH=CH 2-CHCH 2CH=CH 2; ( )6Br CH 2CH 3 ( )7CH 2Cl -CH 2--CH 3-CH -Cl -CH 3;; (第二步产物中,亚甲基上的氢因同时受两个苯环致活而比甲基氢更加容易被卤代)( )8-CCH 2CH 3 (仲碳正离子经重排成叔碳正离子再进攻苯环)CH 33( )9Cl(反应物中,氯原子使芳环电子密度降低为主——钝化芳环为主 , 使芳环邻、对位电子密度得到补充为次)四、鉴别题解题:CH 2ClCH 2OHAgNO 3乙醇溶液有不溶于乙醇的AgCl 沉淀物生成的为苄基氯无现象 HCl ZnCl/(无水)或:CH 2ClCH 2OH不溶于酸,成白色沉淀。
CH 2Cl ( )无现象五、改错题答案:( )1产物错,产物应为-CH=CHCH 2CH=CH 2 。
(消去溴的左边氢得到的产物比消去溴的右边氢得到的产物更稳定。
) ( )2产物错,产物应为-CH=CH 2 。
( )3错,该反应不能发生。
苯环上有强吸电子基时不能进行烷基化反应。
六、合成题解答:( )1CH 3CHBr 2NaNH 2HC ≡CH NaHC ≡CNa CH 3CH 2CH 2BrCH 3CH 2CH 2C ≡CHH 2/ Pd CaCO 3喹啉CH 3CH 2CH 2CH=CH HBr CH 3CH 2CH 2CH 2CH 2Br △110℃( )2CH 3Br AlBr 3 /CH 3 KMnO 4H 2SO 4 /COOH 3--O CH 3说明两点:1、掌握有机测验题的解题方法对期末有机考试有很大的帮助作用。
《食品化学》期末试卷及答案3

《食品化学》期末试卷三一、名词解释(每小题3分,共15分)1.滞后现象2.D值3.酸败4.氨基酸等电点5.酶二、填空题(每空1分,共20分)1.水在食品中的存在状态主要取决于[1] 、[2] 、[3] 。
水与不同类型溶质之间的相互作用主要表现在[4] 、[5] 、[6] 等方面。
2.食品中通常所说的水分含量,一般是指___[7]___。
3.碳水化合物根据其组成中单糖的数量可分为___[8]___、___[9]___和___[10]___。
4.牛奶是典型的__[11]__型乳化剂,奶油是__[12]___型乳化剂。
5.蛋白质按照氨基酸的种类和数量可分为__[13]__、[14] 、[15] 。
6.酶与其他催化剂相比具有显著的特性:[16] 、___[17]___、___[18]__。
7.花青素是[19] 溶性的,胡萝卜素是[20] 溶性的。
三、单项选择题(每小题1分,共10分)1.水分子通过的作用可与另4个水分子配位结合形成正四面体结构。
A.范德华力B.氢键C.盐键D.二硫键2.根据化学结构和化学性质,碳水化合物是属于一类的化合物。
A.多羟基酸B.多羟基醛或酮C.多羟基醚D.多羧基醛或酮3.脂肪酸是指天然脂肪水解得到的脂肪族羧酸。
A.一元B.二元C.三元D.多元4.人造奶油要有良好的涂抹性和口感,这就要求人造奶油的晶型为细腻的型。
A.β, B.β C.α D.α,5.下列蛋白质变性现象中不属于物理变性的是。
A.黏度的增加B.紫外、荧光光谱发生变化C.分子内部基团暴露D.凝集、沉淀6.下列哪种食品一般可称为碱性食品?。
A.蔬菜B.肉C.鱼D.蛋7.天然色素按照溶解性分类,下列色素属于水溶性的是。
A.叶绿素a B.花色苷 C.辣椒红素 D.虾青素8.卵磷脂是典型的乳化剂,其在烘烤面包、饼干和蛋糕中的作用不包括。
A.乳化剂B.润湿剂C.分离剂D.发泡剂9.下列哪一项不是蛋白质的性质之一?A.处于等电状态时溶解度最小B.加入少量中性盐溶解度增加C.变性蛋白质的溶解度增加D.有紫外吸收特性10.焙烤食品表面颜色反应的形成主要是由于食品化学反应中的引起的。
2008~2009第二学期第一次质量调研化学试题

2008~2009第二学期第一次质量调研化学试卷本试卷分第Ⅰ卷(选择题)和第Ⅱ卷两部分。
第Ⅰ卷1至4页,第Ⅱ卷5至8页。
共100分。
考试时间100分钟。
考试结束,将答题卡交回。
可能用到的相对原子质量 C 12 H 1 O 16 Ca 40 Cl 35.5第Ⅰ卷(选择题 共40分)一.选择题(本题包括15小题,每小题2分,共30分。
每小题只有一个....选项符合题意)1.下列变化一定属于化学变化的是A 、潮解B 、除锈C 、吸附D 、金属生锈2.“春蚕到死丝方尽、蜡烛成灰泪始干”中蕴含着许多化学含义,下列说法错误的是 A.诗句寓意着发生了化学变化 B.诗句中“丝”含有的物质是蛋白质 C. 诗句中“泪”是指蜡烛燃烧产生的水D. 诗句中“灰”是指蜡烛燃烧产生的二氧化碳、一氧化碳以及少量炭粒 3、下列物质的用途中,主要是利用其化学性质的是A .用石墨做干电池的电极B .用氢气做高能燃料C .用金刚石刀划破玻璃D .用大理石做天安门的华表 4、下列对相关实验现象的描述错误..的是 A .在淀粉溶液中滴加碘酒后溶液变蓝 B .在稀硫酸中滴加紫色石蕊试液后溶液变蓝 C .硫在空气中燃烧产生淡蓝色火焰 D .聚氯乙烯在空气中灼烧有刺激性气味5、下列实验能利用厨房中的食盐、食醋、纯碱三种物质基础做成功的是①检验自来水中是否含有氯离子;②检验鸡蛋壳能否溶于酸;③除去热水瓶中的水垢。
A 、①②③ B 、②③ C 、①③ D 、①② 6、下列观点中,你不赞同...的是 A .钢筋混凝土是复合材料B .肥皂水可以区别硬水和软水C .生铁和钢都是铁的合金D .淀粉没有甜味,因此不属于糖类7、在生活、生产和科学实验中,要除去混合物中的杂质,通常有两种思路:①将杂质班 级: 姓 名: 学 号: 考号:从混合物中除去;②将有用物质从混合物中取出。
以下除去混合物中杂质的方法中,与②的思路一致的是( )(1)已知液态氧和液态氮的沸点分别是-183℃和-195.8℃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生命科学系食品科学与工程专业2008级本科《普通化学》2008-2009学年第1学期期末试题B 卷
本试卷需:答题纸 4 页 草稿纸 2 页
第 1 页 共 3 页 课程考核试卷
考试时间:120分钟 考试方式:闭卷
(提示:答案必须依试题顺序做在答题册上,并标明大、小题号,否则不予计分)
一、选择题(1~5,8~13题为单选题,6、7题为多选题,每小题2分,共26分)
1、同一原子中,可能存在下列量子数的两个电子( )
A 、(1,1,0,+1/2)和(1,0,0,-1/2)
B 、(2,0,1,+1/2 )和(2,0,0,-1/2)
C 、(3,2,0,-1/2)和(3,2,1,-1/2)
D 、(1,0,0,-1/2 )和(1,0,0,-1/2) 2、ClO 3-的几何构型是( )
A 、三角锥形
B 、V 形
C 、四面体形
D 、平面三角形
3、为防止配制的SnCl 2溶液中Sn 2+ 被完全氧化,最好的方法是( )
A 、加入Sn 粒
B 、加Fe 屑
C 、通入H 2
D 、均可
4、已知Mg(OH)2的K sp θ = 1.8×10-11,则Mg(OH)2饱和溶液中的pH 是( )
A 、3.59
B 、10.43
C 、4.5
D 、9.41
5、能共存于酸性溶液中的一组离子是( )
A 、K +,I -,SO 42-,MnO 4-
B 、Na +,Zn 2+,SO 42-,NO 3-
C 、Ag +,AgO 43-,S 2-,SO 32- C 、K +,S 2-,SO 42-,Cr 2O 2-
6、下列关于熵的表述中正确的是 ( )
A. 熵是体系混乱度的量度;
B. 熵是体系微观状态数目的量度;
C. 理想晶体的熵与温度无关;
D. 熵增加的过程是热力学自发过程;
E. 冰在室温下自动熔化成水是熵增起了主要作用的结果。
7、下列关于化学动力学原理的表述中正确的是 ( )
A. 化学反应的半衰期与反应速率常数成正比;
B. 反应速率常数的大小即反应速率的大小;
C. 催化剂可以改变反应历程但不会影响化学平衡;
D. 活化能是指反应过渡态与反应物之间的能量差;
E. 在反应历程中,定速步骤是反应最慢的一步。
8、若两个液态组分混合形成理想溶液,则混合过程的 ( )
A 、ΔU = 0,ΔH = 0,ΔS = 0,ΔG = 0
B 、ΔU = 0,ΔH < 0,ΔS < 0,ΔG > 0
C 、ΔH = 0,ΔU = 0,ΔS > 0,ΔG < 0
D 、ΔH > 0,ΔU < 0,ΔS > 0,ΔG < 0
9、下列反应中,Δr S m θ 值最大的 ( )
A 、C (s) + O 2 (g) → CO 2 (g)
B 、2SO 2 (g) + O 2 (g) →2SO 3 (g)
C 、CaSO 4 (s) + 2H 2O (l) → CaSO4·2H2O (s)
D 、3H 2 (g) + N 2 (g) → 2NH 3 (g)
10、已知下列反应的平衡常数
H 2 (g) + S (s) = H 2S (g) K 1θ
S (s) + O 2 (g) = SO 2 (g) K 2θ
则反应H 2 (g) + SO 2 (g)
O 2 (g) + H 2S (g) 的平衡常数是( )
A 、K 1θ− K 2θ
B 、K 1θ•K 2θ
C 、K 2θ/ K 1θ
D 、K 1θ/K 2θ
11、要降低反应的活化能,可以采取的手段是( )
长江师范学院课程考核试卷
A、升高温度
B、降低温度
C、移去产物
D、使用催化剂
12、某反应物在一定条件下的平衡转化率为35 %,当加入催化剂时,若反应条件不变,此时它的平衡转化率是()
A、大于35 %
B、等于35 %
C、小于35 %
D、无法知道
13、下列关于电子性质的表述中正确的是()
A、原子中的电子具有明确的运动轨迹;
B、核外电子的运动范围局限在有限的空间内;
C、一个原子轨道最多只能容纳两个自旋相反的电子;
D、测不准原理只适用于微观领域。
二、判断题(每小题1分共10分)
1、SnF4,XeF4,CCl4,SnCl4分子的几何构型均为正四面体。
()
2、将固体NH4NO3溶于水中,溶液变冷,则该过程的ΔG,ΔH,ΔS 的符号依次为+、-、-。
()
3、一个化学反应的Δr G mθ的值越负,其自发进行的倾向越大,反应速率越快。
()
4、平衡常数的数值是反应进行程度的标志,所以对某反应不管是正反应还是逆反应其平衡常数均相同。
()
5、氢的电极电势是零。
()
6、主量子数n为3时有3s,3p,3d,3f 四条轨道。
()
7、所有微粒都既有粒子性又有波动性。
()
8、几率径向分布图中出现电子几率最大的球壳处,电子出现的几率密度也最大。
()
6、元素所处的族数与其原子最外层的电子数相同。
()
10、金属和非金属原子化合物必形成离子键化合物。
()
三、填空题(每空1分共24分)
1、如果发现了第121 号元素M 时,则其所在周期数为,所在列为;其金属活泼性较同列其他元素要。
2、原子轨道线性组合成分子轨道的三条原则是:a .;b. ;c. 。
3、沉淀滴定法中一般加过量沉淀剂,利用效应,可使沉淀溶解度;但若沉淀剂过多,反而由于或其他副反应而沉淀溶解度。
4、[Ni(CN)4]2-的空间构型为,它具有磁性,其Ni2+采用杂化轨道与CN-成键,配位原子是。
5、下列过程的熵变的正负号分别是:
a. 溶解少量盐于水中,Δr S mθ是号;
b. 纯碳和氧气反应生成CO(g),Δr S mθ是号;
c. 液态水蒸发变成H2O(g),Δr S mθ是号;
d. CaCO3(s)加热分解为CaO(s)和CO2(g),Δr S mθ是号。
6、理想气体的两点假设是:
①;
②。
7、原子序数为33的元素其核外电子排布为:;此元素的周期和族分别为。
8、HF、HCl、HBr和HI中酸性最强的是;HOCl、HOBr和HOI中酸性最强的是。
四、
四、简答题(每小题5分共10分)
1、海水中有取之不尽的NaCl,而Na2CO3是重要的化工原料,如何由NaCl制备Na2CO3?写出相应的方程式。
2、判断XeF4分子的基本形状。
五、计算题(每小题10分共30分)
1、用陆续通H2S至饱和(H2S浓度为0.10 mol/dm3) 的办法,使溶液中0.50 mol/dm的Ni2+沉淀99 %,问应控制pH等于多少?为了控制所需的pH,在沉淀过程中应向溶液中外加酸还是外加碱来加以调节?为什化学及环境科学系命题教师:徐伯华命题时间:2008年12月15日
第 2 页共 3 页
生命科学系食品科学与工程专业2008级本科《普通化学》2008-2009学年第1学期期末试题B 卷
本试卷需:答题纸 4 页 草稿纸 2 页
第 3 页 共 3 页 么?(K sp (NiS) = 1.07 × 10-21, H 2S :K 1= 9.1 × 10-8,K 2 = 1.1 × 10-12) 2、欲配制pH = 4.70的缓冲溶液500 cm 3,问应用50 cm 3 1.0 mol/dm NaOH 和多少cm 3 1.0 mol/dm
HAc 溶液混合并需加多少水(K a ,HAC = 1.76×10-5)
3、Ag 不能置换1.00 mol •dm -3 HCl 里的氢,但Ag 可以和1.00 mol •dm -3 HI 起反应产生氢气。
适用电极电势解释上述现象。
(E Θ(Ag+/Ag) =0.80,K sp(AgCl) =1.77×10-10,K sp(AgI) =8.52×10-17)。
