生物化学 第4章 白质共价结构
第四章蛋白质的共价结构

• 一级结构的全部内容包括: 多肽链数目、氨基酸组成、氨基酸顺序、连接方式、 二硫键的数目和位置、非氨基酸成分等
自1953年Sanger F.报道了牛胰岛素两条多肽链 的氨基酸序列以来,已有100,000多个不同蛋白质 的氨基酸序列被测定(简称蛋白质测序)。
蛋白质的一级结构研究
研究一级结构需要阐明的内容: • 1)蛋白质分子的多肽链数目。 • 2)每条肽链的末端残基种类。 • 3)每条肽链的氨基酸顺序。 • 4)链内或链间二硫键的配置等。
测定蛋白质的一级结构的主要意义: • 一级结构是研究高级结构的基础。 • 可以从分子水平阐明蛋白质的结构与功能的关系。 • 可以为生物进化理论提供依据。 • 可以为人工合成蛋白质提供参考顺序。
CH C
N
CH COO -
O
Peptide bond
* 两分子氨基酸缩合形成二肽,三分子氨基酸 缩合则形成三肽……
* 由二十个以内氨基酸相连而成的肽称为寡肽 (oligopeptide),由更多的氨基酸相连形成的 肽称多肽(polypeptide)。
* 肽链中的氨基酸分子因为脱水缩合而基团不全, 被称为氨基酸残基(residue)。
R2 O
R3 O
H2N CH C HN CH C HN CH C
N端
氨基酸残基 氨基酸残基
肽链书写方式:N端→C端 肽链有链状、环状和分支状。
Rn O HN CH COH
C端
命名:根据氨基酸组成,由N端→C端命名
O
O
H3C CH C HN CH2 C HN CH COOH
NH2
CH2
CH H3C CH3
蛋白质的一级结构是指蛋 白质多肽链中氨基酸的排 列顺序,包括二硫键的位 置。其中最重要的是多肽 链的氨基酸顺序,它是蛋 白质生物功能的基础。
《生物化学》蛋白质的共价结构

(1)酸水解
常用HCl 或H2SO4进行水解。 方法:一般用6mol/L HCl,或4mol/L H2SO4 ,105oC
回流煮沸24h左右可使蛋白质完全水解。 优点:
不引起消旋作用,得到的是L-氨基酸。 缺点:
色氨酸完全被沸酸所破坏。羟基氨基酸有一小部分被分解, 天冬酰氨,谷氨酰胺的酰胺基被水解下来。
HO
CH3
NH2 C C OH + NH2 C C OH
H
HO
- H2O
Peptide (Amide) Bonds
Condensation reactions between the carboxyl group of one amino acid and the amino group of a second amino acid result in C-N bond formation.
(一)肽和肽键的结构(P163)
肽键是一种共价键,它是由两个氨基酸脱水缩合形成的, 蛋白质是由许多氨基酸通过肽键连结形成的生物大分子。
HO
肽键
HO
+
H3N C C N
C C O-
R
H R'
英文
Peptide Bond
Peptide Bond is the covalent(共价) bond that is formed when 2 amino acids are joined together to form the polymer of protein.
催产素 加压素
催产素简式 具有催产等作用
加压素简式
具有升高血压等作用
三、蛋白质一级结构的测定(P168)
(一) 蛋白质一级结构 (二)N-末端和C-末端氨基酸残基的鉴定 (三)二硫桥的断裂 (四)氨基酸组成的分析 (五)多肽链的部分裂解和肽段混合物分离纯化.
【生物课件】第四章 蛋白质的共价结构

NCC
N-端 CH2
H CH
OH
CH3CH3
肽键
生物Ty化r 学 A主sp 讲 吴Gl石n 金
H
H
H
O
O
N C C N C C N C COO-
H CH2
H CH2
H CH2 C-端
CO2H
CH2
OH
CONH2
在多肽链中,氨基酸残基按一定的顺序排列,这种排列顺序称 为氨基酸顺序
通常在多肽链的一端含有一个游离的-氨基,称为氨基端或 N-端;在另一端含有一个游离的-羧基,称为羧基端或C端。
三、多肽链(polypeptide chain) 1、氨基末段(-NH2)和羧基末端(-COOH) 2、命名:“某氨基酰某氨基酰• • • • • •某氨基酸” 3、肽链和肽键;主链和侧链;氨基酸残基 4、二硫键、链内二硫键和链间二硫键
生物与环境工程学院 2003/2004学年第1学期
肽和肽键的结构
生物化学 主讲 吴石金
一个氨基酸的氨基与另一个氨基酸的羧基之间失水形成的酰 胺键称为肽键,所形成的化合物称为肽。
由两个氨基酸组 成的肽称为二肽, 由多个氨基酸组 成的肽则称为多 肽。组成多肽的 氨基酸单元称为 氨基酸残基。
生物与环境工程学院 2003/2004学年第1学期
H3N+
Ser H
O
CC
Val H
【生物课件】第四章 蛋白质的共价结构
Chapter4 Pr生ot物e化in学的主共讲价吴结石金构
第一节 蛋白质通论
蛋白质存在于所有的生 物细胞中,是构成生 物体最基本的结构物 质和功能物质。
蛋白质是生命活动的物 质基础,它参与了几 乎所有的生命活动过 程。
生物化学 第4章 白质共价结构
计算:蛋白质含量 = 蛋白氮 × 6.25 优点:对原料无选择性,仪器简单,方法也简单 缺点:易将无机氮(如核酸中的氮)都归入蛋白质中 测定蛋白质含量的其他方法:紫外比色法、双缩脲法、
Folin-酚法、考马斯亮兰比色法
• 第一,蛋白体是生命的物质基础; • 第二,生命是物质运动的特殊形式,是蛋白体的存在方式; • 第三,这种存在方式的本质就是蛋白体与其外部自然界不
断的新陈代谢。 • 现代生物化学的实践完全证实并发展了恩格斯的论断。
蛋白质的概况
蛋白质是由19种氨基酸和1种亚氨基酸组成的 具有复杂的结构和特定功能的大分子物质
+2H
SH
Glu-Cys-Gly
| S | S | Glu-Cys-Gly
谷胱甘肽的生理功用
解毒作用:与毒物或药物结合,消除其毒性 作用;
参与氧化还原反应:作为重要的还原剂,参 与体内多种氧化还原反应;
保护巯基酶的活性:使巯基酶的活性基团-SH 维持还原状态;
维持红细胞膜结构的稳定:消除氧化剂对红 细胞膜结构的破坏作用。
除
去
N-
异
末
硫 氰 酸苯 酯
端 氨 基 酸剩下来自的N-肽
末 端 分 析
链 仍 然
完
整
C、Edman降解法
点击此处视频 演示
N-
末
D、氨肽酶法
端 分
析
氨肽酶是一种肽链外切酶,它能从多肽链的 N-端逐个的向里水解。根据不同的反应时间 测出酶水解所释放出的氨基酸种类和数量, 按反应时间和氨基酸残基释放量作动力学曲 线,从而知道蛋白质的N-末端残基顺序。最 常用的氨肽酶是亮氨酸氨肽酶,水解以亮氨 酸残基为N-末端的肽键速度最大。
第4章 蛋白质的共价结构01
质谱法(MS)其特点灵敏度高 所需样品少、 灵敏度高、 (2)质谱法(MS)其特点灵敏度高、所需样品少、测定速度快
8)确定肽段在多肽链中的次序 8)确定肽段在多肽链中的次序
方法:利用两/多套肽段的AA顺序彼此间的交错重叠, 方法:利用两/多套肽段的AA顺序彼此间的交错重叠,拼凑出整条多肽 AA顺序彼此间的交错重叠 链的AA顺序 链的AA顺序 AA
非常遗憾的与诺奖擦肩而过
8、蛋白质的一级结构的测定步骤 、
1) 测定蛋白质分子中多肽链的数目
方法:通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间的关系, 方法:通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间的关系,即可 确定多肽链的数目。 确定多肽链的数目。
2) 多肽链的拆分
多肽链以非共价键连接在一起。 多肽链以非共价键连接在一起。如:血红蛋白为四聚体,烯醇化酶为二聚体 非共价键连接在一起 血红蛋白为四聚体, 方法: 8mol/L尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基) 方法:用8mol/L尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基) 尿素或 盐酸胍处理
肽段的分离纯化:凝胶过滤、凝胶电泳和HPLC法 肽段的分离纯化:凝胶过滤、凝胶电泳和HPLC法 HPLC
7)测定每个肽段的氨基酸顺序
Edman法 年首先提出) (1)Edman法(Edman于1950年首先提出) 苯异硫氰酸酯法) 于 年首先提出 (苯异硫氰酸酯法)
特点: 特点: 1)N-端分析法 2)能够不断重复循环,将肽链N-端氨基酸残基逐一进行标记和解离 能够不断重复循环,将肽链N
O NH CH C R1 R2
O NH CH C R3
O NH CH C R4
O NH CH C
胃蛋白酶
第四章 蛋白质共价结构

3.活性肽 具有天然生物活性的肽。
(1)谷胱甘肽(GSH)
SH
COOH
CH2
H2N-CHCH2CH2CO—NHCHCO— NHCH2COOH
γ-Glu
Cys
Gly
2GSH
GSSG
(2)催产素和升压素均为9肽,第2位和 第7位氨基酸不同。催产素使子宫和乳腺 平滑肌收缩,具有催产和促使乳腺排乳 作用。升压素促进血管平滑肌收缩,升 高血压,减少排尿。
多个氨基酸通过肽键连接起来的链状物 称肽链。根据肽链的长短分寡肽 (oligopeptide)、多肽Polypeptide) 。 蛋白质就是由一条或多条多肽链构成的大分 子。
❖ 蛋白质和肽以肽键方式连接有以下依据: 1.蛋白质中游离的α-羧基和α-氨基很少。 2.人工多肽能被蛋白酶水解。 3.蛋白质也有双缩尿反应。 4.人工多肽与蛋白质光谱一致。 5.人工合成蛋白质—牛胰岛素。
肽键将氨基酸与氨基酸头尾相连
当两个氨基酸通过肽键相互连接形成二 肽,在一端仍然有游离的氨基和另一端有游 离的羧基,每一端可连接更多的氨基酸。氨 基酸能以肽键相互连接形成长的、不带支链 的寡肽(25个氨基酸残基以下)和多肽(多 于25个氨基酸残基)。多肽仍然有游离的 α-氨基和α-羧基。肽链表示法:游离α氨基在左,游离α-羧基在右,氨基酸之间 用“-”表示肽键。
硬蛋白包括角蛋白、胶原蛋白、丝蛋白、 弹性蛋白等。
五、蛋白质的功能
1. 生物催化剂 2. 调节 3. 转运 4. 储藏 5. 运动 6. 结构物质 7. 保护 8. 特殊功能
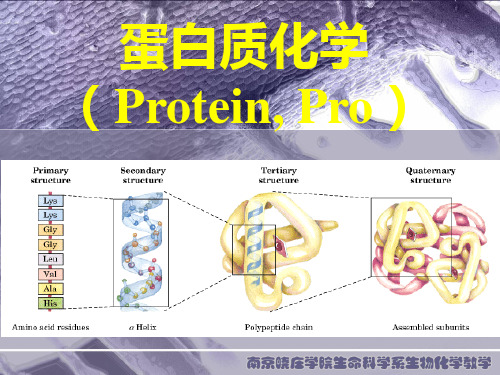
六、蛋白质结构的组织层次
❖ 1952年丹麦人Linderstrom-Lang最早提出 蛋白质的结构可以分成四个层次: 一级结构 primary structure :指的是多肽
生化第三版考研课件第4章蛋白质的共价结构

端
NO2
NO2
分
DNFB
N-端氨基酸
DNP衍生物
析
H+ O2N
RO HN CH C OH +
氨基酸
H2O
NO2
黄色 DNP-氨基酸
(二)、末端氨基酸残基的鉴定
丹磺酰氯(DNS)法
• 二甲氨基萘磺酰-AA有强荧光,检测灵敏度高
1
、N
N(CH3)2
RO
N(CH3)2
末
+ H2N CH C
端
多 肽 N-端
(二)、末端氨基酸残基测定
• 两类多肽链末端氨基酸残基: N-端氨基酸 C-端氨基酸
• 在肽链氨基酸顺序分析中,最重要的是 N-端氨基酸分析法。
(二)、末端氨基酸残基的鉴定
二硝基氟苯(DNFB)法
• Sanger法
二硝基苯衍生物
1
、N 末 O2N
R O 碱性条件
F + H2N CH C
O2N
RO HN CH C
N-端 CH2
H CH
H CH2
H CH2
H CH2 C-端
OH
CH3 CH3
CO2H
CH2
肽键 OH
CONH2
• 多肽链中AA残基按一定顺序排列:氨基酸顺序 • 含游离-氨基的一端:氨基端或N-端
含游离-羧基的一端:羧基端或C-端 • AA顺序是从N-端开始以C-端氨基酸残基为终点
如上述五肽:Ser-Val-Tyr-Asp-Gln
PITC PTC-肽
2、氨肽酶法或羧肽酶法
3、质谱法(MS)
灵敏度高、所需样品少、测定速度快
4.根据核苷酸序列的推定法 蛋白质链
生物化学蛋白质共价结构

生物化学蛋白质共价结构
1. 蛋白质的一级结构测定策略
生物化学蛋白质共价结构
1. 蛋白质的一级结构测定步骤
测定末端氨基酸残基的摩尔数与蛋白质的相对分子量比较
生物化学蛋白质共价结构
8mol/L尿素或者 6mol/L盐酸胍或者高盐处理
生物化学蛋白质共价结构
天然存在的重要多肽-谷胱甘肽
谷胱甘肽是属于含有巯基的、小分子肽类物质,具有重要的抗氧化作用和整合解毒 作用。谷胱甘肽有还原型(G-SH)和氧化型(G-S-S-G)两种形式,在生理条件下以 还原型谷胱甘肽占绝大多数。谷胱甘肽还原酶催化两型间的互变。 半胱氨酸上的巯基为其活性基团(故谷胱甘肽常简写为G-SH),易与碘乙酸、芥子 气、铅、汞、砷等重金属盐络合,而具有了整合解毒作用。 参与细胞内氧化还原过程,作为某些氧化还原酶的辅因子,清除内源性过氧化物和 自由基,防止过氧化物积累,维护巯基酶活性中心的巯基处于还原状态。
➢二硫键: 链内二硫键和链间二硫键
H3N+ N-端
Ser H
O CC
CH2
Val H
O NCC
H CH
Tyr H
O NCC
H CH2
Asp H
O NCC
H CH2
Gln H
N C COOH CH2 C-端
OH
CH3 CH3
CO2H
CH2
肽键
OH
X Ser-Val-Tyr-Asp-Gln
Gln-Asp-Tyr-Val-Ser
生物化学蛋白质共价结构
C-末端氨基酸鉴定——还原法
肽链C末端AA
第四章蛋白质的共价结构-王镜岩版《生物化学》参考笔记

第四章蛋白质的共价结构-王镜岩版《生物化学》参考笔记第四章蛋白质的共价结构1.6 肽:P162肽为氨基酸的线性聚合物,蛋白质是由一条或多条多肽链构成。
(一)肽和肽键结构肽的命名从N端开始到COOH端,氨基酸残基按顺序从左向右写,-NH2末端在左,-COOH端在右。
如Ser-Gly-Phe,称为:丝氨酰甘氨酰苯丙氨酸。
一般氨基酸数目<12~20的肽为寡肽(小肽);>20的肽为多肽。
(二)肽的物理化学性质(1)与氨基酸同,为离子晶格,熔点高,在水溶液中以偶极离子存在。
多肽中酰胺的氢不易解离,肽的酸碱性质主要取决于游离末端的α-氨基和α-羧基,以及侧链R基上的可解离基团,如Glu的γ-COOH、Lys的ε-NH2。
(2)滴定曲线:也有等电点,为多价离子等电点。
以Gly-Glu-Lys-Ala四肽为例(P166表4-6):①当pH <3.5,末端可解离基团全部质子化,2个+NH3、2个COOH,净电荷+2;②pH 3.5-4.5,C-末端COOH解离(pK a=3.7),为2个+NH3、一个COOH、一个COO-,净电荷+1;③pH 4.5~7.5,Glu的γ-COOH解离,2个+NH3、2个COO-(pK a=4.6),为等电点,净电荷为0;④pH7.8~10.2,N末端-+NH3解离(pK a=7.8),一个+NH3、一个NH2 、2个COO-、净电荷-1;⑤pH>10.2,ε-+NH3解离,2个NH2、2个COO-,净电荷-2。
pH在等电点以上(碱性),多肽带负电荷。
pH在等电点以下(酸性),多肽带正电荷。
蛋白质滴定曲线更加复杂。
(3)化学反应①与茚三酮在弱酸性溶液中共热显紫色,为α-NH2反应(注意:伯胺也可使茚三酮显紫色),氨基酸、多肽均有此反应。
Pro为仲胺(亚氨基氨基酸),与茚三酮生成黄色物质。
茚三酮反应可用于定性、定量测定氨基酸和多肽。
②肽键的双缩脲反应:多肽,蛋白质中有肽键,有此反应,氨基酸没有此反应。
生物化学第4章 蛋白质的共价结构

二、肽
(一)肽和肽键的结构
肽(peptide)是氨基酸的线性聚合物,因此也 称肽链(peptide chain)。蛋白质中氨基酸的基本 连 接方式是肽键(peptide bond)。
N端
C端
肽单位
肽键
(酰胺基、肽基)
共价主链
最简单的肽为二肽(dipeptide),含一个肽键; 一般把不多于12个残基的肽叫二肽、三肽……
的
测
定
C-
末 肼解法
端 氨 基 酸 的 测 定
羧肽酶法
C末
端
氨
基
酸
的
羧肽酶A:Arg、Lys、Pro除外的氨基酸残基
测
羧肽酶B:仅Arg、Lys
羧肽酶C:除羟脯氨酸外的所有的氨基酸残基
定
羧肽酶Y:所有的氨基酸残基
二硫键的断裂
氨基酸组分的分析
氨基酸的薄层层析分析
多肽链的部分裂解
酶法裂解
氨肽酶
12283 = 10305
蛋白质的主要功能: 1.催化:大多数酶是蛋白质。
2.调节:如激素和反式作用因子。 3.转运:如血红蛋白、载酯蛋白、膜转运蛋白等。 4.贮存:如种子蛋白和卵清蛋白。 5.运动:如肌肉、微管蛋白等。 6.结构成分:如角蛋白、胶原蛋白等。 7.支架作用:如锚定蛋白、连接蛋白等。 8.防御和进攻:如抗体、毒蛋白等。 9.特殊功能:如甜蛋白、胶质蛋白等
蛋白质相对分子量变化很大,一般在6000-1×106
(肌联蛋白)
(三) 蛋白质结构和功能的多样性
蛋白质序列的多样性决定了其功能的多样性。
如:20种氨基酸形成的二十肽(每种氨基酸只用 1次)可以形成的异构体为: 20!= 2 ×1018
又如:相对分子质量为34000的蛋白质含12种氨基 酸,假定在肽链的任一位置, 12种氨基酸出现的概率 相等,则34000/120 = 283
第4章蛋白质的共价结构2

一、蛋白质通论 (一)什么是蛋白质
(二)蛋白质的化学组成和分类 ❖ 化学组成
❖ 蛋白质化学组成特点
❖ 分类
单纯蛋白质( simple protein)
蛋白成分仅由氨基酸构成,不含其他成分。 如清蛋白、组蛋白 结合蛋白质 (conjugated protein) 蛋白成分含有除氨基酸以外的各种化学成 分作为其结构的一部分。 如糖蛋白、金属蛋白
C末端
多肽的命名
三字母缩写:Ala-Tyr-Asp-Gly 单字母缩写:AYDG
(二)寡肽的物理和化学性质
➢ 两性解离特性
1、肽链中氨基酸残基的pK值与游离氨基酸的 pK值不同; 2、静电荷为零时溶液的pH值是该肽溶液的等 电点 (pI); 3、 环境pH >pI 该肽分子带负电荷
环境pH < pI 该肽分子带正电荷
(一)蛋白质一级结构决定了蛋白质空间构象, 而蛋白质空间构象又是功能的基础。 (二)通过比较来源不同物种间类似蛋白质一 级结构可以洞悉蛋白质的功能并揭示出这些蛋 白质以及产生他们的生物体之间的进化关系。 (三)蛋白质一级结构的分析可以进一步确定 遗传性疾病的诊断和治疗方法。
(一)蛋白质一级结构决定了蛋白质空间构象, 而蛋白质空间构象又是功能的基础。
多肽链的结构模式
氨基酸残基(residue): 肽链中氨基酸分子因脱 水缩合而不是完整的氨基酸分子,故称为氨基 酸残基。
氨基末端(amino-terminal):多肽链中自由氨基的 一端(或N末端)。
羧基末端(carboxyl-teiminal): 多肽链中自由羧 基的一端(或C末端)。
短肽: N末端
氨基酸具有两性解离的特性
R CH COOH NH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
<50 —— 多肽 稳定的空间结构 —— 蛋白质 稳定的空间结构? 不稳定的空间结构 —— 多肽
2、蛋白质分子的形状和大小
12600
单纯蛋白质的氨基酸残基数目的推测
20种氨基酸的平均分子量≈138 多数蛋白质中较小的氨基酸占优势 氨基酸平均分子量≈128 每形成一个肽键除去一分子水(18) 氨基酸残基平均相对分子量≈128-18=110 氨基酸残基数目≈蛋白质相对分子量÷110
纤维状蛋白质 (简单、规则的线性结构)
——结构蛋白,大部分不溶于水 ——胶原蛋白,弹性蛋白,角蛋白,丝蛋白
球状蛋白质
——功能蛋白,大部分溶于水 ——各种酶,血红蛋白,等
膜状蛋白质
——结构与功能蛋白,存在于膜上 ——蛋白质表面存在疏水残基,能与磷脂分子结合 ——亲水氨基酸残基比胞质蛋白质少
蛋白质与多肽的区别
一、构层次 功能
1、蛋白质的化学组成和分类
C(50%) H(7%) O(23%) N(16%) S(0~3%) 其他(微量)
O
O
NH2 CH CH2 CH2 C NH CH C NH CH2 COOH
C OOH
CH2
SH
凯氏(Kjadehl)定氮法
1、蛋白质的化学组成和分类
按组成分 ——单纯蛋白质:完全由氨基酸构成的蛋白质 ——缀合蛋白质:蛋白质部分+非蛋白质部分
辅基
蛋白质 分类
单纯蛋白质 (按溶解度)
缀合蛋白质 (按辅基)
清蛋白 球蛋白 醇溶蛋白 谷蛋白 精蛋白 组蛋白 硬蛋白
核蛋白 糖蛋白与蛋白聚糖 脂蛋白 色蛋白 磷蛋白
2、蛋白质分子的形状和大小
+2H
SH
Glu-Cys-Gly
| S | S | Glu-Cys-Gly
谷胱甘肽的生理功用
解毒作用:与毒物或药物结合,消除其毒性 作用;
原理: N含量恒定,平均16% 100克蛋白质中含16克N。 1克N=6.25克蛋白质
计算:蛋白质含量 = 蛋白氮 × 6.25 优点:对原料无选择性,仪器简单,方法也简单 缺点:易将无机氮(如核酸中的氮)都归入蛋白质中 测定蛋白质含量的其他方法:紫外比色法、双缩脲法、
Folin-酚法、考马斯亮兰比色法
3、蛋白质的结构层次
• 一级结构:多肽链的氨基酸序列(肽键) • 二级结构:多肽链的主链构象(氢键)
——α螺旋、β折叠 • 三级结构:多肽链的主链构象和侧链构象(疏水作用) • 四级结构:由多肽链亚基聚合而成的蛋白质
血 红 蛋 白 的 结 构
3、蛋白质的结构层次
一级结构决定高级结构 高级结构决定蛋白质功能
• 第一,蛋白体是生命的物质基础; • 第二,生命是物质运动的特殊形式,是蛋白体的存在方式; • 第三,这种存在方式的本质就是蛋白体与其外部自然界不
断的新陈代谢。 • 现代生物化学的实践完全证实并发展了恩格斯的论断。
第4章 蛋白质的共价结构
本章要点
蛋白质通论 肽 蛋白质的一级结构 蛋白质一级结构的测定
4、蛋白质的功能
催化——酶 调节——胰岛素调节血糖代谢 转运——直接转运蛋白、膜转运蛋白 贮存——贮氮、贮铁 运动——肌动蛋白、肌球蛋白、微管蛋白 结构——不溶性纤维状蛋白 支架——接头蛋白 防御和进攻——抗体、血液凝固蛋白、溶血蛋白 异常功能
二、肽
肽和肽键的结构 肽的理化性质(参见氨基酸的理化性
生物化学 第4章 白质共价结构
What’s Protein?
蛋白质(protein) 是由氨基酸为单位组 成的一类重要的生物 大分子,是生命的物 质基础。
蛋白质的重要性
• 早在1878年,思格斯就在《反杜林论》中指出:“生命 是蛋白体的存在方式,这种存在方式本质上就在于这些蛋 白体的化学组成部分的不断的自我更新。”
重要的生物活性肽有谷胱甘肽、神经肽、 肽类激素等。
(1)谷胱甘肽(glutathione, GSH)
谷胱甘肽是一种称为-谷氨酰半胱氨酰甘氨 酸的三肽化合物。
还原型与氧化型谷胱甘肽的相互转变
谷胱甘肽分子中的巯基可氧化或还原,故有还原 型(GSH)与氧化型(GSSG)两种存在形式。
2× Glu-Cys-Gly -2H |
质,自学)
天然存在的活性肽
1、肽和肽键的结构
Two amino acid molecules can be covalently joined through a substituted amide linkage, termed a peptide bond, to yield a dipeptide.
Three amino acids can be joined by two peptide bonds to form a tripeptide;
1、肽和肽键的结构
similarly, amino acids can be linked to form tetrapeptides and pentapeptides.
When a few amino acids are joined in this fashion, the structure is called an oligopeptide.
When many amino acids are joined, the product is called a polypeptide.
(1)脱水缩合
(2)肽与肽键
Ser
Val
T yr
Asp
Gln
H
H
H
H
H
O
O
O
O
H3N+ C C N C C N C C N C C N C COO-
N-端 CH2
H CH
H CH2
H CH2
H CH2 C-端
OH
CH3CH3
CO2H
CH2
肽键 OH
CONH2
Ser-Val-Tyr-Asp-Gln
多肽链的形成及其方向性
(2)肽与肽键
O CN
OC N+
O C
C
C N
H
(2)肽与肽键
肽 键 中 的 C-N 键 具 有部分双键性质, 不能自由旋转。
在大多数情况下, 以反式结构存在。
肽键平面示意图
2、肽的理化性质
(参见氨基酸的理化性质,自学)
3、生物活性肽
生物体内具有一定生物学活性的肽类物 质称生物活性肽。
