美国FDA批准Potiga(ezogabine)片剂治疗成人癫痫部分发作
美国FDA批准Brisdelle(帕罗西汀)治疗更年期潮热
( 来源 : 美国 F D A政府公告 , 2 0 1 3 - 0 6 — 2 8 夏训明 编译 )
第 4期
韩亮 , 等. 干姜 超临界 C O 流体萃取工艺研究
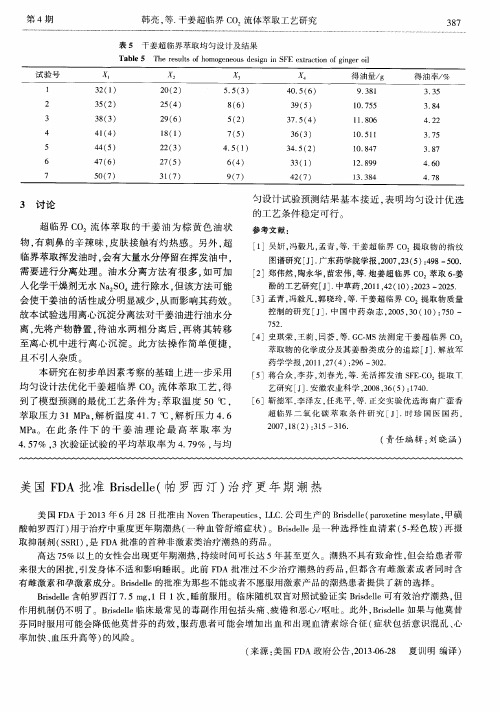
表 5 干姜 超临界萃取均匀设计及结果
T a b l e 5 T h e r e s u l t s o f h o mo g e n e o u s d e s i g n i n S F E e x t r a c t i o n o f g i n g e r o i l
3 讨 论
匀设计 试 验预 测结 果 基 本 接 近 , 表 明均匀 设 计 优 选
的工艺 条 件稳定 可 行 。
ቤተ መጻሕፍቲ ባይዱ参 考文献 :
超临界 C O , 流体萃取 的干姜油 为棕黄 色油状
物, 有 刺 鼻 的辛辣 味 , 皮 肤 接 触 有 灼 热感 。另 外 , 超
[ 1 ]吴妍 , 冯毅凡 , 孟青 , 等. 干姜超 临界 C O , 提 取物 的指纹
且 不 引入 杂质
图谱研究 [ J ] . 广东药学 院学报 , 2 0 0 7 , 2 3 ( 5 ) : 4 9 8— 5 0 0 .
[ 2 ]郑伟然 , 陶永华 , 苗宏伟 , 等. 炮姜 超 临界 C O , 萃取 6 . 姜 酚的工艺研究 [ J ] . 中草药 , 2 0 1 1 , 4 2 ( 1 0 ) : 2 0 2 3— 2 0 2 5 . [ 3 ]孟青 , 冯毅凡 , 郭晓玲 , 等. 干姜超 临界 C O , 提取 物质量 控制的研 究 [ J ] . 中 国 中药 杂 志 , 2 0 0 5 , 3 0( 1 0 ) : 7 5 0—
首个膀胱过度活动症(OAB)口服新药β3肾上腺素能受体激动剂Gemtesa获美国FDA批准

国家药监局关于修订盐酸西替利嗪口服制剂说明书的公告EMA警示氯喹和羟氯喹的精神障碍风险为进一步保障公众用药安全,国家药品监督管理局决定对盐酸西替利嗪口服制剂说明书【不良反应】、【禁忌】等项进行修订。
现将有关事项公告如下。
【不良反应】项下应包含:偶有报告患者有轻微和短暂不良反应。
如头痛、头晕、嗜睡、激动不安、口干、腹部不适。
在测定精神运动功能的客观试验中,本品的镇静作用和安慰剂相似。
罕有报道过敏反应。
【禁忌】项下应包含:①对本品成份、羟嗪或任何其他哌嗪衍生物过敏者禁用。
②严重肾功能损害(肌酐清除率低于10 ml/min )患者禁用。
【注意事项】项下应包含:①癫痫患者以及有惊厥风险的患者应慎用。
②因西替利嗪有可能增加尿潴留的风险,有尿潴留易感因素(例如脊髓损害、前列腺肥大)的患者慎用。
③抗组胺药物会降低皮肤过敏测试结果的灵敏度,所以接受这类测试前应停药3 d 。
临床医师、药师应当仔细阅读盐酸西替利嗪口服制剂说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
近日,欧洲药品监督管理局(EMA )发布消息,药物警戒风险评估委员会(PRAC )在审查了所有可用数据后,确认氯喹或羟氯喹的使用与精神障碍和自杀行为风险之间存在关联,建议更新所有含氯喹或羟氯喹药品的产品信息。
EMA 在收到西班牙药品管理局(AEMPS )就使用羟氯喹治疗COVID-19的患者中发生6例精神疾病的通报后,于2020年5月启动了此次审查,AEMPS 通报患者服用的羟氯喹剂量高于批准剂量。
氯喹和羟氯喹在欧盟被批准用于治疗某些自身免疫性疾病(如类风湿关节炎和狼疮),以及疟疾的预防和治疗。
这两种药物都没有被授权用于COVID-19治疗,但都超适应证用于COVID-19患者的治疗。
然而,大规模随机临床试验显示,氯喹和羟氯喹在治疗COVID-19方面并没有显示出任何有益作用。
鉴于氯喹和羟氯喹在COVID-19大流行期间的使用情况,EMA 曾于2020年4月和5月提醒医务人员此类药物的风险。
美国FDA批准Aimovig(erenumab-aooe)用于成人预防偏头痛

美国2007年批准的精神神经、心血管用等新药与新生物制剂

美国2007年批准的精神神经、心血管用等新药与新生物制剂2007年,美国FDA共批准了17个新分子实体。
其中除4个抗肿瘤新药、2个抗感染新药和2个抗病毒新药外(见本刊上期介绍),尚包括2个精神神经系统用新药二甲磺酸赖右他明(lisdexamfetamine dimesylate/Vyvanse。
以下简称为赖右他明)和罗替戈汀(rotigotine/Neupro)、3个心血管系统用新药半富马酸阿利克仑(aliskiren hemifumarate/Tektuma。
以下简称为阿利克仑)、安巴生坦(ambrisentan/Letairis)和奈比洛尔(nebivolol/Bystolic)及4个其它药效类别新药醋酸兰来肽(lanreotide acetate/Somatuline Depot。
以下简称为兰来肽)、二盐酸沙丙蝶呤(sapropterin dihydrochloride/Kuvan。
以下简称为沙丙蝶呤)、羟乙基淀粉(hydroxyethyl starch/V oluven)和用作放射性诊断剂的氨(N13)(ammonia N13/Ammonia N13)。
FDA还在2007年批准了2个新生物制剂依库株单抗(eculizumab/Soliris)和甲氧基聚乙二醇化倍他依泊汀(methoxy polyethylene glycol-epoetin beta/Mircera。
以下简称为MPEG-βEPO)。
1 精神神经系统用药1.1 赖右他明Shire和New River制药两公司合作开发,2007年2月23日获得FDA批准,用于治疗儿童注意力缺乏和多动症。
赖右他明是专为降低安非他明(amphetamine)的滥用倾向而设计的一个前体药物,其分子实由右安非他明(dexamphetamine)和天然氨基酸左赖氨酸(L-lysine)共价结合组成。
由于赖右他明被胃肠道吸收后才能转化为活性形式右安非他明,故可减少滥用风险。
FDA批准复方口服避孕药Beyaz片剂上市

者 卒 中 风 险 房 颤 卒 中适 应 症 使 用 这 一 新 药 ,其 有 可 能 改 变 房 颤 卒 中 预 防 的治 疗 常 规 。
勃 林 格 殷 格 翰 公 司 执 行 董 事 会 主 席 、全 球 药 品研 发 负 责 人 An r a a n r 授 说 道 , “ 次 美 国 对 达 d e s B re 教 此
获 批 的 另 一 个 适 应 证 是 : 用 于 升 高 选 择 口服 复 方 避 孕 药 避 孕 的女 性 体 内 的 叶酸 水 平 ,降 低 妇 女 用 药 期 间 怀
P a a a 能 为 广 大 患 者 所 用 , 其 1 0m g 日两 次 的 方 rd x 。 每 5 案 获 准 用 于 除 一 小部 分 重 度 肾 功 能 受 损者 ( 酐 清 除 肌
的 效 果与 治 疗 焦 虑症 一 样 好 。 当 时 ,恐 慌 症 刚 刚 被 认 定 为 一 个 医 学 诊 断 结 论 , 甚 至 有 人 认 为 该 病 对 于 类  ̄t aim 的 药 物 会 产 生 抵 抗 . l V u
治 疗 将 会 改 善 许 多 患 者 的 生 活 ,通 过 预 防 卒 中 发 生 ,
能 受 损 的 患 者 的 给 药 方 案 则 为 7 每 日两 次 。 5mg 美 国 的 医 生 和 患 者 将 率 先 在 降 低 非瓣 膜 性 房 颤 患
括 血 管 事 件 ( 栓 ) ̄ b- 疾 病 。 考 虑 到 吸 烟 会 增 加 血 uT 脏 严 重 心 血 管 事 件 的 发 生 风 险 , F A建 议 3 岁 以 上 的 吸 D 5
素 ,左 旋 叶 酸 钙 是 叶 酸 的代 谢 产 物 ,有 助 于 体 内 新 细
胞 的形 成 和 养 护 。
美国FDA批准首种发作性丛集性头痛治疗药物——Emgality(galcanezumab-gnlm)

FDA 已于 2018 年 9 月批准 Emgality 用于成人预防性治疗偏头痛,此次只是批准其增加新的适应症。 此次,FDA 在批准 Emgality 治疗发作性丛集性头痛时采用了优先审评审批程序( Priority Review) ,并授予其突 破性疗法认证( Breakthrough Therapy designation) 。
美国 FDA 于 2019 年 6 月 4 日批准礼莱公司( Eli Lilly) 的药物 Emgality( galcanezumab-gnlm) 用于成人治疗发 作性丛集性头痛( episodic cluster headache) ,可有效减少丛集性头痛发作的频率。这是 FDA 批准的首种用于治疗 发作性丛集性头痛的药物。
[7] 刘艳平.自微乳释药系统在提高中药难溶性药物生物利用度 中的应用[J].中国医药导报,2017,14( 31) : 36-39.
[8] 李华龙,尹东东,王杏林.依托泊苷长循环亚微乳的制备和理 化性质研究[J].现代药物与临床,2013,28( 2) : 164-169.
( 责任编辑: 陈翔)
美国 FDA 批准首种发作性丛集性头痛治疗药物——— Emgality( galcanezumab-gnlm)
从 本 文 结 果 可 见 ,与 多 西 他 赛 注 射 液 相 比 ,兔 单剂量注射 多 西 他 赛 长 循 环 亚 微 乳 后,显 著 改 变 了多西他赛 在 兔 体 内 的 药 动 学 行 为,其 消 除 半 衰 期( t1/2β ) 、血 药 浓 度-时 间 曲 线 下 面 积 ( AUC) 以 及 体内平均滞留时间( MRT) 比多西他赛注射液显著 提高,分别为 7. 7 倍、5. 6 倍 和 2. 5 倍,体内清除率 ( CL) 比多西他赛注射液降低了 5.8 倍,提示多西他 赛长循环亚微乳能有效延长多西他赛的体内驻留时 间,具有较好的长循环作用和较高的疗效。这可能 是由于 O /W 型亚微乳大大增加了多西他赛的溶解 度,很好地促进了药物的吸收[7],且经过 DSPE-PEG 2000 修饰后,其极性长链可增加空间位阻,减少网 状内皮组织系统的摄取,延长了药物在血液中的循 环时间[8]。
开浦兰左乙拉西坦片

版权:北京兴事堂药店网址: ★打造最全的新特药品说明书大全《兴事堂新特药典》之-----开浦兰(左乙拉西坦片)版权:北京兴事堂药店网址: ★药品找不到,就找兴事堂!商品参数:拼音码:kpl(zylxtp)规格:0.5克*30片剂型:片剂生产厂家:比利时联合化工企业有限公司单位:盒价格:290元版权:北京兴事堂药店网址: ★药品找不到,就找兴事堂!开浦兰(左乙拉西坦片)【药品名称】商品名:开浦兰通用名称:左乙拉西坦片【成份】左乙拉西坦的化学名称为(S)-α-乙基-2-氧代-1-吡咯烷乙酰胺,分子式:C8H14N2O2,★药品找不到,就找兴事堂!分子量:170.21。
【性状】开浦兰(左乙拉西坦片)为椭圆形薄膜包衣片(250mg为蓝色片,500mg为黄色片,1000mg为白色片),除去包衣后均显白色。
【适应症】开浦兰(左乙拉西坦片)用于成人及4岁以上儿童癫痫患者部分性发作的加用治疗。
版权:北京兴事堂药店网址:★药品找不到,就找兴事堂!【用法用量】(1)给药途径:口服。
需以适量的水吞服,服用不受进食影响。
(2)给药方法和剂量:成人(>18岁)和青少年(12-17岁)(体重≥(greater than or equal to)50kg者):起始治疗剂量为每次500mg,每日2次。
根据临床效果及耐受性,每日剂量可增加至每次1500mg,每日2次。
剂量的变化应每2-4周增加或减少500版权:北京兴事堂药店网址:★药品找不到,就找兴事堂!mg/次,每日2次。
老年人(≥(greater than or equal to)65岁):根据肾功能状况,调整剂量(详见下文有关肾功能受损病人描述)。
4-11岁的儿童和青少年(12-17岁)(体重≤(smaller than or equal to)50kg者):起始治疗剂量是10mg/kg,每日2次。
根据临床效果及耐受性,剂量可以增加至30mg/kg,每日2次。
剂量变化应以每2周版权:北京兴事堂药店网址:★药品找不到,就找兴事堂!增加或减少10mg/kg,每日2次。
2013-2014 年FDA批准的新药

2013年FDA批准的27个新药汇总作者:scifans来源:scifans2013-12-26 13:21:00分享到:53关键词:FDA新药今年FDA批准的新药数量上少于去年,但质量上却高于去年,其中10个有重磅潜力。
1. Nesina:苯甲酸阿格列汀片阿格列汀(alogliptin)是Takeda研发的新型DPP-4抑制剂,用于治疗II型糖尿病,已获得FDA批准的同类药物还有西他列汀(sitagliptin)、沙格列汀(saxagliptin)、利拉利汀(Linagliptin),另外维格列汀(vildagliptin)已在欧洲上市。
此外,FDA还一同批准了两个含阿格列汀的复方制剂,即Oseni(阿格列汀/吡格列酮)和Kazano (阿格列汀/二甲双胍)。
在14项涉及8500名II型糖尿病患者的临床试验中,相比于安慰剂,Nesina能额外降低糖化血红蛋白(HbA1c)0.4%-0.6%。
在4项涉及2500名II型糖尿病患者的临床试验中,相比于二甲双胍,Kazano 能额外降低HbA1c 0.5%。
在4项涉及1500名II型糖尿病患者的临床试验中,相比于吡格列酮,Kazano能额外降低HbA1c 0.4%-0.6%。
2. Kynamro:米泊美生钠注射液/industry/internation/535623.shtml米泊美生(mipomersen)是Genzyme研发的一种合成的硫代磷酸寡核苷酸,被FDA批准用于治疗纯合子型家族性高胆固醇血症(homozygous familial hypercholesterolemia,FoFH)。
作为反义核酸类药物,米泊美生通过与Apo B-100蛋白mRNA的编码区互补配对,抑制Apo B-100蛋白(LDL和VLDL的主要载脂蛋白)的翻译合成,降低FoFH患者的LDL-C、TC、Non-HDL-C水平。
在为期26周涉及56名FoFH的多国随机对照试验中,治疗组平均LDL-C、TC、Apo B、Non-HDL-C、TG水平分别降低25、21、27、25、18 mg/dL,平均HDL-C水平增加15,而安慰剂组各项指标变化均在5 mg/dL以内。
医学高级职称正高《麻醉学》(题库)模拟试卷二

医学高级职称正高《麻醉学》(题库)模拟试卷二[多选题]1.关于多器官功能障碍综合征,叙述错误的是(江南博哥)A.2个或2个以上器官同时发生不可逆性功能障碍及衰竭B.涉及多器官的病理生理变化,是一个复杂的综合征C.其病因复杂、防治困难,但死亡率较低D.慢性阻塞性肺气肿急性发作所导致的肺性脑病也属于本病E.原发致病因素可以是急性也可以是慢性的参考答案:ACDE[多选题]2.美国食品与药品监督管理局(FDA)确认的NSAIDs分类包括A.乙酰水杨酸盐类B.非乙酰水杨酸盐类C.非水杨酸盐类D.非阿片类中枢性镇痛药E.辅助性镇痛药参考答案:ABC[多选题]3.关于硝酸甘油,叙述正确的有A.分子中的亚硝基团与血管平滑肌受体结合,扩张血管B.可降低前负荷,松弛血管,使心肌耗氧量减少,但心排血量无明显改变C.可发生反射性心动过速D.长时间大剂量应用有发生正铁血红蛋白血症的可能E.对脑血流和颅内压的影响不明显,可用于颅内高压患者参考答案:BCD[多选题]4.老年人的肾功能特点有A.对血管升压素反应性差B.保钠、保水功能强C.肾小管回吸收葡萄糖差D.对肾素-醛固酮反应敏感E.排泄药物时间延长参考答案:ACE[多选题]5.抗胆碱药的促进气道松弛作用是通过抑制气道平滑肌的毒蕈碱样受体来完成,此种毒蕈碱样受体的类型是A.MB.MC.MD.ME.M参考答案:BC[多选题]6.脊髓丘脑束传导功能包括A.位置觉B.痛觉C.温度觉D.触觉E.内脏膨胀觉参考答案:BCD[多选题]7.多巴胺对受体作用的特点是A.激动心脏β1-受体B.激动血管α-受体C.激动血管多巴胺受体D.对β2-受体影响十分微弱E.作用于H-受体参考答案:ABCD[多选题]8.新生儿的循环特点是A.心室顺应性好,心肌收缩性好B.左心室循环负荷过重C.心肌耐受缺血和缺氧能力较强D.主要靠快心率维持心排血量和血压E.心功能曲线右移参考答案:BCD[多选题]9.关于混合静脉血氧饱和度(SmvO),叙述正确的是A.SmvO通常依赖于心排血量(CO)、氧耗(VO)、血红蛋白和SaOB.当SmvO下降时可能是氧供减少,也可能为氧需增加或两者并存C.在SPO无变化时,SmvO下降说明CO降低D.CPB后SmvO下降,应考虑到血液稀释带氧不足所致,应提高血红蛋白E.高热、燥动、寒战等使SmvO增高参考答案:ABCD[多选题]10.关于非住院手术麻醉患者的麻醉后恢复期处理,叙述正确的有A.非住院手术后患者均需在PACU度过恢复期B.麻醉后恢复阶段应主要考虑术后镇痛而非处理恶心和呕吐C.对于术后心率>90次/min,心电图T波低平者应考虑泵注硝酸异山梨酯(异舒吉)D.对于BMI>30的患者,如术后低氧血症,应予以叩背处理E.COX-2抑制剂如帕瑞考昔可能导致心肌缺血和轻度上消化道损伤参考答案:ADE[多选题]11.小儿术中体温升高的诱因有A.环境温度高B.应用阿托品C.手术单覆盖过密D.使用硫喷妥钠E.术前发热参考答案:ABCE[多选题]12.羊水栓塞常发生在下列哪些情况A.胎盘早剥B.剖宫产C.子宫破裂D.前置胎盘E.二卵双胎参考答案:ABCD[多选题]13.高血压病人的麻醉前准备包括A.控制舒张压,使舒张压<100mmHgB.纠正心衰C.控制收缩压,使收缩压<150mmHgD.术前停用抗高血压药E.改善心功能达最理想程度参考答案:ABCE参考解析:麻醉前将高血压患者的血压控制在一定范围,最好是收缩压控制在150mmHg以下,或舒张压控制在95mmHg以下,是保证患者在围手术期生命稳定的首要条件。
盘点2020上市的抗体新药-(1)Eptinezumab

盘点2020上市的抗体新药-(1)Eptinezumab2020年2月21日,FDA批准了Eptinezumab-jjmr (简称Eptinezumab,商品名VYEPTI ™)用于预防成人偏头痛。
这是第一个用于预防偏头痛的静脉(IV)治疗方法,也是用于预防偏头痛的新型单克隆抗体中的最新方法。
偏头痛是由三叉神经血管系统异常引起的神经血管疾病,引起疼痛和周围神经末梢释放血管活性神经肽,其中包括血管舒张剂-降钙素基因相关肽(CGRP)。
有大量有证据表明CGRP在偏头痛的病理生理过程中发挥重要作用。
Eptinezumab是一种人源化单克隆抗体,与CGRP配体结合并阻断其与内源性受体的相互作用,由Alder BioPharmaceuticals开发。
这项批准是基于两项III期临床试验(发作性偏头痛中的PROMISE-1 和慢性偏头痛中的PROMISE -2)的积极数据结果。
这些试验证明了Eptinezumab 的有效性和安全性。
主要终点是1-3个月内平均每月偏头痛天数(MMD)相对于基线的变化。
药效学与药代动力学Eptinezumab是一种人源化IgG亚型的单克隆抗体(分子量≈143 kD),通过重组DNA技术由毕赤酵母细胞表达。
在健康人和发作性偏头痛(EM)以及慢性偏头痛的患者(CM)的I期临床实验中(总n = 2123),Eptinezumab单剂量10–1000 mg药代爬坡呈线性梯度,在输注30分钟或1小时后达到Cmax。
Eptinezumab每3个月注射1次,每剂量100-300mg,在首次给药后药物血浆浓度达到稳态,Eptinezumab的中心分布量(Vc)约为3.7 L,体内的清除率约为0.0062 L/h,半衰期约为27天。
Eptinezumab可选择性地与CGRP配体的α形式和β形式结合,亲和力可达皮摩尔水平(分别为4和3 pmol/L),从而防止CGRP激活受体。
它起效快,半衰期长,可以快速地与CGRP结合,并且拥有极慢的解离速率,其确切的作用机制目前尚不清楚。
POTIGA(ezogabine)癫痫辅助用药

POTIGA(ezogabine)用于成人癫痫辅助用药商用名:Potiga通用名:Retigabine中文名:依佐加滨初次批准时间:2011年给药途径:口服活性成分:EZOGABINE分子式:C16H18FN3O2分子量:303.331 g/mol包装规格:50/200/300/400mg批准文号:NDC 0173-0812-59用药指导:好医友(Haoeyou Healthcare)概述2011年6月13日,美国FDA批准依佐加滨(ezogabine)片剂用于成人部分性癫痫发作的辅助治疗,该药是第一个治疗癫痫的神经元钾通道开放剂。
Potiga获准用于局部癫痫发作,这是一种最常见类型癫痫。
癫痫属于脑部疾病,癫痫患者大脑中的神经细胞出现异常或活动过度。
部分性发作癫痫仅影响大脑有限或局部区域,但会扩散到大脑的其它部分。
癫痫发作可引起广泛症状,包括重复的肢体运动(痉挛)、行为异常、意识丧失和抽搐。
使用现有的治疗手段约有三分之一癫痫患者病情无法获得满意控制,因此能为患者提供多种治疗选择就显得十分重要。
也就是说本品对癫痫症状未能获得控制的患者带来了希望。
Potiga是首个神经元钾通道开放制剂。
美国食品和药品监督管理局批准抗惊厥药Potiga(ezogabine)作为癫痫患者局部癫痫的辅助用药,其活性成分于今年3月份获得欧洲药品管理局的批准,将于年底进入美国市场。
癫痫患者有复发癫痫倾向,由突发脑电活动诱发,导致大脑超负荷。
脑细胞间的信息传播系统出现短暂紊乱。
局部癫痫仅影响大脑部分区域,但可传导至大脑其他部位。
适应症和用途POTIGA是一种钙通道开放剂适用在年龄18岁和以上患者作为部分发作的癫痫发作的辅助治疗剂型和规格片,50mg、200mg、300mg和400mg用法用量1.每天分3次给药,有或无食物。
2.初始剂量应是100 mg每天3次(300 mg/天)共1周。
3.通过增加剂量在每周间隔不超过150 mg/天递增调整至维持剂量。
拉莫三嗪(lamotrigine)

拉莫三嗪(lamotrigine)作者:来源:《上海医药》2020年第26期1概述拉莫三嗪在美国食品药品监督管理局(FDA)基于不良反应登记系统(FAERS)的统计报告中定义为窄治疗指数(NTI)药物,并符合窄治疗指数药物(NTIDs)的特性[1]。
医学文献中确定的拉莫三嗪治疗指数的范围为从狭窄到高出狭窄范围的10倍数值(1.3~20)[2],另有其他国外文文献报道拉莫三嗪属于NTIDs[3-4]。
拉莫三嗪是一种新型抗癫痫药物,2005年在国内上市,主要用于12岁以上青少年、成人局灶性和全面性癫痫发作的单药治疗或2岁以上儿童的添加治疗,还可作为情感稳定剂治疗双相情感障碍[5]。
拉莫三嗪既为我国医保用药,又被列入国家基本药物目录,是国内外指南一致推荐的抗癫痫药[6-9]。
2013年国际抗癫痫联盟(ILAE),2015年苏格兰校际指南网格(SIGN),2018年英国国家健康和保健医学研究所(NICE),中国《临床诊疗指南:癫痫病分册(2015修订版)》均推荐拉莫三嗪用于癫痫的治疗[6-9]。
2安全用药提示2.1替换使用拉莫三嗪仿制药替换原研药可能带来突发性癫痫发作增加、毒性和血药浓度增加、不良反应出现等潜在问题[10]。
一项病例系列分析发现,在药剂师提供的14例不良反应报告中,有11例(79%)癫痫发作失控,其中换用拉莫三嗪仿制药是最主要的原因[11]。
2010年加拿大研究人员回顾已发表的拉莫三嗪仿制药使用前后的数据,发现用仿制药后不良反应发生率显著增加[12]。
另一项来自加拿大的观察性研究发现,换用拉莫三嗪仿制药之后,与之相关的不良反应高达52%[13]。
换用拉莫三嗪仿制药将导致每日平均剂量显著增加,消耗更多其他药物,消耗更多医疗资源,增加总体医疗花费[14-15]。
在拉莫三嗪仿制药等效问题上,有其他国家药品监管部门针对拉莫三嗪仿制药等效问题建议在源头上增加管控标准。
2004年,丹麦国家药品管理局同意将抗癫痫仿制药(主要是拉莫三嗪)的90%CI生物等效性限度从传统的80%~125%限定为90%~111%,以提高仿制药标准,保证公众用药安全[16]。
美国FDA批准Doptelet(avatrombopag)片剂治疗血小板减少症

( 来源:美国 FDA 政府公告ꎬ2018 ̄05 ̄21 夏训明 编译)
第 3 期
杨超ꎬ等.束花石斛提取物对糖尿病模型大鼠血糖血脂的影响
329
对于糖尿病患者而言ꎬ血糖浓度是其临床检验 的重要指标ꎬ但其具有临时性的特点ꎮ GSP 主要是 白蛋白与葡萄糖发生糖化反应ꎬ形成果糖胺ꎬ其形成 量与血糖水平呈正相关ꎬGSP 在血中浓度稳定ꎬ不会 受到临时血糖浓度波动的干扰ꎮ 因此ꎬ联合测定空 腹血糖和 GSP 在糖尿病检测中具有重要的意义ꎬ测 定结果可以成为糖尿病患者的敏感性诊断标准ꎮ 胰 岛素由胰岛 β 细胞分泌ꎬ是机体内唯一降低血糖的 激素ꎬ同时也是唯一能促进糖原、脂肪、蛋白质合成 的激素ꎮ 测定血清胰岛素是糖尿病诊断和分型的参 考指标ꎮ 本实验结果显示束花石斛具有一定的降血 糖效果ꎬ且能改善糖尿病大鼠的胰岛素抵抗ꎬ提高糖 尿病大鼠对外源性葡萄糖的耐受能力ꎬ但具体机制 仍需进一步研究ꎮ
[10] 施红ꎬ陈玲.石斛合剂对高血糖动物模型的试验研究[ J] . 福建中医学院学报ꎬ2000ꎬ10(2) :23 ̄25.
[11] 倪俊ꎬ蔡金艳ꎬ黄楚君ꎬ等.束花石斛降血糖活性及化学成分 研究[ J] .广东药学院学报ꎬ 2015ꎬ31(1):10 ̄13.
[12] 侯少贞ꎬ李焕彬ꎬ郭建茹ꎬ等. 铁皮石斛镇痛与抗炎作用研 究[ J] . 动物医学进展ꎬ2012ꎬ33(10) :49 ̄52.
[13] 李秀芳ꎬ邓媛元ꎬ潘利华ꎬ等.霍山石斛多糖对糖尿病性白内 障大鼠眼球晶状体组织抗氧化作用的研究 [ J]. 中成药ꎬ 2012ꎬ34(3) :418 ̄421.
治疗癫痫的几种新药

对该 药 进行 了
29 7
加 的研 究 发 现
80 % 至
7 2
。
名病 人 的 癫 痛 发 作 频 率 降
巧 名 病人 出现药 物 副作
双 盲 安 慰 剂对 照 研 究 名 病人 参 加 (a P
t r
这项 多 中心 试 验有
10 %
本 项研究 发 现 了 对复 杂 的 部分 性
。
使
L
a
6
人 (
现 有 的 药 物 是通 过抑 制兴 奋性 的 神 经 介 质 活 性 或 阻 断神 经 元 膜 的 某 些通 道 而 直接 或 间 接 地 作 用 于 抑 制性 神经介 质
。
对 用 其 他抗 癫 痈 药 物 治 疗 无 效 的病
60 %
, 。
人 的 有效 率为
告
据
Brg
a
n
Ph ilb
r
o
o
k 报
.
该药 物 在控 制癫痛 发作 方 面 与氨 且 副作 用较 小
0
甲 酞氮草 或 苯妥英 同样 有 效
人
.
这些新 药 的 功 效 和 副作 用 的 描述是 美 国 癫
。
一 项有 2 6
L
a
名 病 人 的 多 中心 试 验 表 明
,
,
痛学会感兴趣的话题
医 师 评论说
, 。
纽约的 a J me s
R
o
w a n
治 疗 癫 痛 的 几 种 新 药
美 国新 奥 尔 良消 息 : 数 十年来
,
治疗癫 痛
要 是谷 氨酸 ) 过 度释放 而起 作 用
已 得 出 结论
, ,
美国FDA批准辉瑞Panzyga治疗慢性炎症性脱髓鞘性多发性神经病

百济神州百泽安获批:联合2种化疗方案一线治疗晚期鳞状非小细胞肺癌美国FDA批准辉瑞Panzyga治疗慢性炎症性脱髓鞘性多发性神经病百济神州(BeiGene )近日宣布,中国国家药品监督管理局(NMPA )已批准其抗PD-1抗体百泽安(tislelizumab ,替雷利珠单抗注射液)联合2项化疗方案用于治疗一线晚期鳞状非小细胞肺癌(NSCLC )患者。
此次新适应证批准,基于一项Ⅲ期临床试验(NCT03594747)的结果。
该试验在中国大陆既往未曾接受过治疗的ⅢB 期或Ⅳ期鳞状NSCLC 患者中开展,评估了百泽安联合紫杉醇与卡铂(A 方案)、百泽安联合白蛋白紫杉醇(ABRAXANE )与卡铂(B 方案)、仅用紫杉醇与卡铂(C 方案)的疗效和安全性。
该项试验中,共有360例患者按1∶1∶1的比例随机接受上述百泽安联合任一化疗方案或仅接受化疗治疗,直至疾病进展、或出现不可耐受的毒性反应、或医生决定停止治疗、或患者撤销知情同意。
2020年1月,该试验在计划的中期分析中,经独立评审委员会(IRC )评估达到主要终点:无进展生存期(PFS )具有统计学显著提高。
接受百泽安联合化疗的A 组与B 组中位PFS 均为7.6个月,C 组为5.5个月;A 组对比C 组的风险比(HR )为0.52,95%CI :0.4~0.7,P =0.000 1;B 组对比C 组的HR 为0.48,95%CI :0.3~0.7,P <0.000 1。
此外,客观缓解率(ORR )在接受百泽安治疗的患者中有显著提高,在A 组与B 组中ORR 分别为73%(95%CI :64%~80%)和75%(95%CI :66%~82%),C 组为50%(95%CI :40%~59%)。
百泽安联合化疗在NSCLC 患者中总体耐受,与各项疗法已知安全性相符。
辉瑞近日宣布,美国食品和药物管理局(FDA )已批准Panzyga (静脉注射用人类免疫球蛋白,10%液体制剂)的一份补充生物制品许可申请,用于治疗慢性炎性脱髓鞘性多发性神经病(CIDP )成人患者。
2020-2021第三代抗癫痫药物汇总

2020-2021第三代抗癫痫药物汇总2020-2021年第三代抗癫痫药物汇总癫痫的药物治疗是最基本和最重要的治疗方法,也是首选治疗方法。
目前,抗癫痫药物(AEDs)已经发展到第三代,主要包括拉考沙胺、XXX、瑞替加滨、布瓦沙坦、艾司利卡西平、XXX。
选择AEDs时需要考虑疗效和安全性等重要因素。
研究表明,第三代AEDs的疗效提高有限,但耐受性得到了大幅提高。
第三代AEDs具有五大特点:不良反应更轻、耐受性更佳、药代动力学更优、激素相互作用更少、药物相互作用更少。
由于第三代AEDs具有新的靶点和机制,因此更适合联合用药。
联合治疗将更有可能控制癫痫的发作。
目前,联合治疗的比例在逐渐提高,治疗效果也显著提高。
一项针对局灶性癫痫发作联合治疗的调查研究显示:联合治疗的应用比例逐渐提高,获得无发作的患者比例也有所提高。
以下是第三代AEDs的作用靶点和机制:拉考沙胺拉考沙胺是优时比(UCB)研发的第三代AED,为钠离子通道调节剂,可以选择性增强电压依赖性钠通道慢失活。
在病理状态下,神经元细胞处于高频放电时,电压门控钠离子通道(VGSC)才进入慢失活状态。
拉考沙胺能促进VGSC进入慢失活状态,阻断持续性钠电流,终止持续高频放电,减少放电的振幅和频率,而对正常脑功能的短暂放电没有影响。
适应证为美国XXX批准的癫痫局灶性发作单药治疗。
起始剂量为每天100mg,每周增加50mg,维持剂量为每天150~200mg。
欧洲EMA批准的起始剂量为每天50mg,最大剂量为每天300mg。
CFDA批准的适应证为4岁及以上癫痫患者部分性发作的联合治疗。
XXX吡仑帕奈为选择性AMPA受体拮抗剂,通过抑制突触后AMPA受体的活性,减少神经元过度兴奋而发挥抗癫痫作用。
在中国被批准用于局灶性癫痫发作的添加治疗(>12岁)。
艾司利卡西平艾司利卡西平为钠离子通道阻滞剂,是卡马西平类第3代药物S-利卡西平的前药和OXC的活性代谢物。
口服片剂布瓦西坦是一种用于治疗部分性癫痫发作的药物,于2012年获得美国XXX批准上市。
FDA批准依佐加滨用于成人部分发作性癫痫辅助治疗

FDA批准依佐加滨用于成人部分发作性癫痫辅助治疗
佚名
【期刊名称】《国际药学研究杂志》
【年(卷),期】2011(38)5
【摘要】Valeant和葛兰素史克公司宣布美国FDA已批准其依佐加滨(ezogabine,Potiga)片作为18岁以上部分发作性癫痫病患者的辅助治疗。
该药为首个神经元钾离子通道开放剂,批准基于3项对照性临床试验,共入选1239名成人患者,主终点是双盲治疗期癫痫发作频率自基线的改变百分比。
【总页数】1页(P374-374)
【关键词】辅助治疗;成人患者;发作性癫痫;FDA批准;钾离子通道开放剂;葛兰素史克公司;癫痫发作频率;美国FDA
【正文语种】中文
【中图分类】R575.7
【相关文献】
1.brivaracetam获FDA批准用于发作性癫痫辅助治疗 [J], 黄世杰
2.美国FDA批准XCOPRI(cenobamate)片剂用于治疗癫痫部分性发作 [J], 夏训明
3.美国FDA批准XCOPRI(cenobamate)片剂用于治疗癫痫部分性发作 [J], 夏训明(编译)
4.FDA批准普瑞巴林辅助治疗部分性癫痫发作 [J],
5.美国FDA批准Briviact(brivaracetam)用于治疗部分性发作型癫痫 [J], 夏训明
因版权原因,仅展示原文概要,查看原文内容请购买。
美国FDA批准戈谢病治疗药Taliglucerase Alfa上市

美国FDA批准戈谢病治疗药Taliglucerase Alfa上市
佚名
【期刊名称】《中国执业药师》
【年(卷),期】2012(9)7
【摘要】2012年5月1日,美国FDA批准ProtalixLtd公司产品TaligluceraseA1fa(商品名:ELELYSO)冻干粉针剂上市,用于1型戈谢病患者的长期酶替代治疗。
规格为200U。
戈谢病是由于第一对染色体上的葡萄糖脑苷脂酶溶酶体基因缺陷引起的疾病。
葡萄糖脑苷脂是红细胞和白细胞细胞膜的组成成分。
正常情况下,葡萄糖脑苷脂酶催化葡萄糖脑苷脂水解。
但戈谢病患者由于缺乏这种酶。
不能使葡萄糖脑苷脂水解,脂质积聚在肝脏、脾、肺、骨髓和大脑中。
【总页数】1页(P28-28)
【关键词】FDA批准;戈谢病;葡萄糖脑苷脂酶;美国;上市;治疗药;酶替代治疗;冻干粉针剂
【正文语种】中文
【中图分类】R97
【相关文献】
1.FDA 批准治疗1型戈谢病药物 Eliglus-tat上市 [J],
2.FDA批准一种新的“孤儿药”Eleyso治疗戈谢病 [J],
3.美国FDA批准勃起功能障碍治疗药阿伐那非上市 [J],
4.美国FDA批准Elelyso治疗戈谢病 [J],
5.美国FDA批准白血病治疗药Bosutinib上市 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
