物理化学7
物理化学-第7章统计热力学公式
定位系统
非定位系统 q +( N! = ) q U + N! T
Hale Waihona Puke 核自旋配 分函数q 的贡献 −NkT ln q
电子配分 函数q 的 贡献 −NkT ln q
平动配分函数q 的贡献
单原子理想气体热力学函数
转动配分函数q 的贡献
振动配分函数q 的贡献
A
−kT ln q U T
−kT ln
−NkT ln
,
=
RΘ −1
基态能量为零
U
NkT
∂ ln q ∂T
+(
,
=
)
0
0
3 NkT 2
3 NkT 2
NkT = nRT
1 Θ + 2 =
Θ −1 =
基态能量不为零
高温
−kT ln q G + NkTV ∂ ln q ∂V
,
q N! ∂ ln q + NkTV ∂V −kT ln −NkT ln +
−NkT ln q
,
−NkT ln q
−NkT ln
NkT H
∂ ln q ∂T NkT
+ NkTV
,
∂ ln q ∂V +
,
∂ ln q ∂T
0
0
NkT
+
,
ℎ CV ∂ NKT ∂T ∂ ln q ∂T 0 0 3 Nk 2 3 Nk 2
,
( )= −1 ( )=
,
Nk = nR
,
高温
p
−
∂A ∂V
= NkT
,
∂ ln q ∂V
2πmkT V + NkT ln N h − NkT q 5 + N 2
物理化学第七章

粗分散物系
>10-7m
混浊泥水,牛 奶,豆浆
3、胶体四大特征:(同溶液相比较)
①聚结不稳定性(热不稳自发聚沉)②多相不均匀性 聚结不稳定性 ②多相不均匀性(一相分散 于另一相,有相界面)③高分散性 ③高分散性(颗粒大小及胶团量不相同) 结构组成不确定性(受添加剂或添加物影响) ④结构组成不确定性 (真溶液:热稳,均相物系,组成,结构,分子量恒定) 4、胶体化学研究内容:表面现象,分散物系及高分子溶液 5、表面:物体处于真空或与本身饱和蒸气达平衡的面。 6、界面:物体与空气或其他物体相接触的面(存在于两相之间 几个nm厚度薄层) 7、表面现象(Surface phenomenon):凡物质处于凝聚状态时, 其界面上发生的一切物理化学现象。(包括s-g,s-l,l-g,ss,l-l等统称表面)严格讲为界面现象,如:毛细现象,润湿 作用,液体过热,蒸气过饱和,吸附作用等统称界面现象 AS Sο (Interface phenomenon)。
(1)按分散相和分散介质的聚集状态分类
分散相 分散介质 名称 气 泡沫 液 液 乳状液 固 悬浮体,溶液胶 气 液 固 固溶胶 固 气 液 气 气溶胶 固
实例 肥皂泡沫 牛奶 泥浆,金溶胶 浮石,泡沫玻璃 珍珠,某些矿石 某些合金 雾 烟
(2)按分散相的分散度分类
类型 低分子 分散物系 分散相粒子半 径 <10-9m 分散相 原子 离子,小分子 性质 均相,热力学稳定物 系,扩散快,能透过 半透膜,形成真溶液 均相,热力学稳定物 系,扩散慢,不能透 过半透膜,形成真溶 液 举例 NaCI、蔗糖的 水溶液,混合 气体等 聚乙烯醇水溶 液
之一):当毛细管插入润湿性液体水中时,管内液面呈凹面, △P背向 液面,使液体受到向上提升力而沿管内壁上升,当液柱产生的静压 力ρgh=△P时达平衡停止移动;反之,当毛细管插入非润湿性液体 汞中时产生管内凸液面,因△P向下,使管内液面下降至ρgh=△P 达平衡时停止,此为毛细现象。
物理化学-7公开课获奖课件

t
Q Q
u u u
t
Q Q
u u u
第14页
§7.2电解质溶液电导
(1)电导、电导率和摩尔电导率
电解质溶液和金属导体同样,有如下关系:
溶液电阻R,外加电压V和通过溶液电流I之间服从欧姆定 律,即V=IR;
溶液电阻R与两电极间距离l成正比,与浸入溶液电极面积 A成反比,
第20页
m (HAc) m (H ) m ( Ac ) m (H ) m (Cl ) m (Na ) m ( Ac ) m (Na ) m (Cl )
m (HCl) m (NaAc) m (NaCl)
m (HAc) m (H ) m ( Ac )
m
(H
)
1 2
m
E 0 rGm0 zF
E
E0
RT zF
ln Qa
E0
RT zF
ln
aGg aHh
a
a A
aBb
第41页
2.电池原则电动势E0测定和求算 a. E 0 rGm0
zF b. 假如参与反应物质均以纯态出现, 则电池电动势E=E0
Pb-PbO(s)|OH-|HgO(s)-Hg(l)
Pb(s) HgO(s) PbO(s) Hg(l)
上分别发生氧化还原作用时导致电子得失而形成。
上述两个过程缺一不可, 否则电能与化学能之间互相 转换是不也许持续进行。
第9页
本书中对电化学装置中电极命名约定: (i)电化学装置两个电极, 电势高称为正极, 电势低称为负 极; (ii)电化学装置两个电极, 发生氧化反应称为阳极, 发生 还原反应称为阴极; (iii)一般在习惯上对原电池常用下极和负极命名, 对电解 池用阴极和阳极命名。
物理化学第七章课后题答案

7.13 电池电动势与温度的关系为263)/(109.2/10881.10694.0/K T K T V E --⨯-⨯+= (1)写出电极反应和电池反应;(2)计算25℃时该反应的ΘΘΘ∆∆∆m r m r m r H S G ,,以及电池恒温可逆放电时该反应过程的。
(3)若反应在电池外在相同温度下恒压进行,计算系统与环境交换的热。
解:(1)电极反应为阳极 +-→-H e H 221阴极 --+→+Cl Hg e Cl Hg 2221电池反应为(2)25 ℃时{}VV E 3724.015.298109.215.19810881.10694.0263=⨯⨯-⨯⨯+=--1416310517.115.298108.510881.1)(-----⋅⨯=⋅⨯⨯-⨯=∂∂KV KV TE因此,1193.35)3724.0309.964851(--⋅-=⋅⨯⨯-=-=∆molkJ molkJ zEF G m r1111464.1410157.1309.964851-----⋅⋅=⋅⋅⨯⨯⨯=∂∂=∆KmolJ KmolJ TE zFS m r11357.3164.1415.2981093.35--⋅-=⋅⨯+⨯-=∆+∆=∆molkJ molkJ S T G H m r m r m r11,365.479.1615.298--⋅=⋅⨯=∆=molkJ molkJ S T Q m r m r(3)1,57.31-⋅-=∆=molkJ H Q m r m p7.14 25℃时,电池AgCl s AgCl kg mol ZnCl Zn )()555.0(1-⋅电动势E=1.015V ,已知,,7620.0)(2V Zn Zn E -=+ΘV Ag AgCl Cl E 2222.0)(=-Θ,电池电动势的温度系数141002.4)(--⋅⨯-=∂∂KV TE p(1)写出电池反应;(2)计算电池的标准平衡常数; (3)计算电池反应的可逆热;(4)求溶液中2ZnCl 的标准粒子活度因子。
物理化学-第七章-电化学

通入的总电量:Q I t 0.23060 360库仑
电极上起化学反应物质的量:
n Q 360 0 00373mol zF 196500
析出Ag的质量: m=n×MAg=0.00373×107.88=0.403g
二、电导、电导率和摩尔电导率
体积与浓度的关系如何呢?
c n V
(mol·m-3)
若n为1mol
Vm
1 c
m
Vm
c
S·m2·mol-1
注意:c的单位:mol﹒m-3
3.电导、电导率和摩尔电导率之间的关系
G 1 R
K l A
G K
m
Vm
c
例: 298K时,将0.02mol·dm-3的KCl溶液放入 电导池,测其电阻为82.4Ω,若用同一电导池充 0.0025mol.dm-3的K2SO4溶液,测其电阻为 326Ω,已知298K时,0.02mol·dm-3的KCl溶液 的电导率为0.2768S.m-1 (1)求电导池常数; (2)0.0025mol.dm-3的K2SO4溶液的电率; (3)0.0025mol.dm-3的K2SO4溶液的摩尔电 导率。
★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。
★ ⒊电分析 ★ ⒋生物电化学
§7-1 电解质溶液的导电性质 一、电解质溶液的导电机理
1.导体: 能够导电的物体叫导体。
第一类: 靠导体内部自由电子的定向运动而导电的物体
如 金属导体
石墨
性质:
A.自由电子作定向移动而导电
F:法拉第常数,即反应1mol电荷物质所需电量 1F=96500库仑/摩尔
物理化学课件7-熵变计算-A判据,G判据等(1)

p
T
S V V S
Maxwell关系式
V S
p
T p
S
S p V T T V
S p
T
V T
p
用途:(1) 以易测量 代替难测量
(2) 导出其他具 有普遍意义 的公式
四、基本关系式应用举例
➢ 解释规律(结论):基本关系式是武器
p T S V V S
S + S环 ≥ 0
S Q 0 T环
S Q T环
> 自发 =R
Clausius Inequality
➢ 展望未来 封闭系统中等温等容条件下自发过程的方向和限度; 封闭系统中等温等压条件下自发过程的方向和限度。
§Helmholtz函数判据和Gibbs函数判据
Helmholtz function criterion and Gibbs function criterion
G
S
T p
U p V S
H p
S
V
A p V T
G
p
T
V
对应系数关系式
用途:证明题 分析问题
三、Maxwell关系式 若 dZ = Mdx + Ndy 是全微分,则据Euler倒易关系:
M y
x
N x
y
dU TdS pdV dH TdS Vdp dA SdT pdV
熵增加原理(namely, entropy criterion):
由S确定方向和限度,解决问题方便
熵判据的弊端:
(1) 计算S难度大。 (2) 适用范围小:只适用于孤立系统。 (3) 关于重新划定系统的问题:
Siso = S + S环 * 所答非所问:
物理化学第7章 电化学

放置含有1 mol电解质的溶液,这时溶液所具有的
电导称为摩尔电导率 Λ m
Λ m
def
kVm
=
k c
Vm是含有1 mol电解质的溶液
的体积,单位为 m3 mol1,c 是电解
质溶液的浓度,单位为 mol m3 。
摩尔电导率的单位 S m2 mol1
注意:
Λ 在 后面要注明所取的基本单元。 m
b、强电解质: 弱电解质:
强电解质的Λ m
与
c
的关系
随着浓度下降,Λ 升高,通 m
常当浓度降至 0.001mol dm3 以下
时,Λ 与 m
c 之间呈线性关系。德
国科学家Kohlrausch总结的经验
式为:
Λ m
=Λm (1
c)
是与电解质性质有关的常数
将直线外推至 c 0
得到无限稀释摩尔电导率Λm
-
- 电源 +
e-
+
e-
阴
阳
极
极
CuCl2
电解池
阳极上发生氧化作用
2Cl aq Cl2(g) 2e
阴极上发生还原作用
Cu2 aq 2e Cu(s)
三、法拉第定律
Faraday 归纳了多次实验结果,于1833年总结出该定律
1、内容:当电流通过电解质溶液时,通过电极 的电荷量与发生电极反应的物质的量成正比;
作电解池 阴极: Zn2 2e Zn(s)
阳极 2Ag(s) 2Cl 2AgCl(s) 2e
净反应: 2Ag(s) ZnCl2 Zn(s) 2AgCl(s)
2.能量变化可逆。要求通过的电流无限小。
二、可逆电极的种类
1、第一类电极
材料物理化学7

第一节
单元系统相图的应用
4、熔融状态的SiO2由于粘度很大,冷却时往往成为过冷的液 、熔融状态的 由于粘度很大, --石英玻璃 虽然它是介稳态, 石英玻璃。 相--石英玻璃。虽然它是介稳态,由于粘度很大在常温下可 以长期不变。如果在1000℃以上持久加热,也会产生析晶。熔 以长期不变。如果在 ℃以上持久加热,也会产生析晶。 融状态的SiO2,只有极其缓慢的冷却,才会在 融状态的 ,只有极其缓慢的冷却,才会在1713℃可 ℃ 逆地转变为α-方石英。 逆地转变为α 方石英。
第一节
单元系统相图的应用
3、 α-鳞石英缓慢加热,在1470℃时转变为α-方石英,继续加 、 鳞石英缓慢加热, ℃时转变为α 方石英, 热到1713℃熔融。当缓慢冷却时,在1470℃时可逆地转变为α- 热到 ℃熔融。当缓慢冷却时, ℃时可逆地转变为α 鳞石英;当迅速冷却时, 线过冷, 鳞石英;当迅速冷却时,沿虚 线过冷,在230℃转变为介稳状态的 ℃ 方石英;当加热β 方石英仍在 β-方石英;当加热β-方石英仍在230℃迅速转变为稳定状态的α ℃迅速转变为稳定状态的α -方石英。 方石英。
第二节
二 元 凝 聚 系 统 相 图 的 基 本 类 型
二元系统相图的基本类型
四、形成固溶体的二元系统相图
第二节
二 元 凝 聚 系 统 相 图 的 基 本 类 型
二元系统相图的基本类型
有限固溶体:
有两种固溶体, SA(B)表示B组分溶 解在A晶体中所形成 的固溶体, SB (A) 表示A组分溶解在B 晶体中所形成的固 溶体。
第五节
判 读 三 元 相 图 的 几 条 重 要 规 则
三元系统相图的基本类型
第五节
判 读 三 元 相 图 的 几 条 重 要 规 则
物理化学第七章习题答案

习 题1.290K 时,在超显微镜下测得藤黄水溶胶中粒子每10秒钟在x 轴上的平均位移为6.0μm ,水的黏度为0.0011Pa·s ,求藤黄胶粒的半径。
解: 根据公式23x tL RT πηγ⋅=()m ⎥⎥⎦⎤⎢⎢⎣⎡⨯⨯⨯⨯⨯⨯⨯⨯=--26323100.6101.114.331010022.6290314.8 m 71007.1-⨯=2.某溶液中粒子的平均直径为4.2nm ,设其黏度和纯水相同,η =1.0×10 -3kg·m -1·s -1,试计算:(1)298K 时,胶体的扩散系数D 。
(2)在一秒钟里,由于布朗运动粒子沿x 轴方向的平均位移x 。
解:(1) r L RT D πη61⋅=129323101.2100.114.36110022.6298314.8---⋅⎥⎦⎤⎢⎣⎡⨯⨯⨯⨯⨯⨯⨯⨯=s m 12101004.1--⋅⨯=s m(2) 根据 tx D 22=[]mtD x 101004.10.122-⨯⨯⨯==m 51044.1-⨯=3.293K 时,砂糖(设为球形粒子)的密度为1.59×10 3kg·m -3、摩尔质量为3.42×10-1kg·mol -1,在水中的扩散系数为4.17×10-10m 2·s -1,水的黏度为1.01×10-3N·s·m -2。
求砂糖分子的半径及A vogadro 常数。
解:分子的摩尔质量为ρπL r M 334= 得 ρπ34r ML =代入Einstein 公式ηρπηM RTr r L RT D 29261⋅=⋅= 得m RTD M r ⎥⎥⎦⎤⎢⎢⎣⎡⨯⨯⨯⨯⨯⨯⨯⨯⨯⨯==---293314.81059.121017.41001.11042.392931031ρηm 101009.4-⨯=将r 代入Einstein 公式得 r D RT L πη61⋅=1103101009.41001.114.361017.4293314.8----⎥⎦⎤⎢⎣⎡⨯⨯⨯⨯⨯⨯⨯⨯=mol 1231051.7-⨯=mol4.在298K 时,某粒子半径为3.0×10-8m 的金溶胶,在地心力场中达沉降平衡后,在高度相距1.0×10-4m 的某指定体积内粒子数分别为277和166。
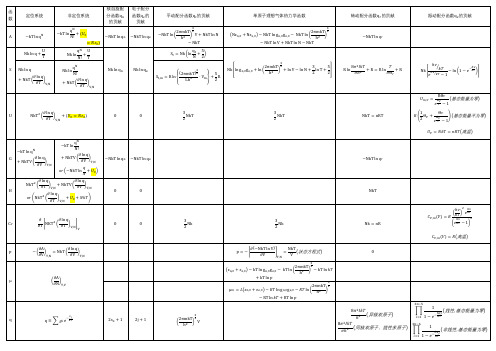
物理化学第七章统计热力学配分函数章节小结公式总结

qN 由 非定位 A kT ln N!
定位系 A kT ln q
N
可按下法推导出上表
dA SdT pdV
则 S
A T N ,V
; p
A V N ,T H Cp T N , p
Θr
4.03 10 46 h2 转动特征温度 I 8 2 Ik
对称数----分子绕对称主轴旋转 360O 出现相同几何构型的次数, 对异核双原子分子 =1 对 m m 2 1
2 r
对热力学函数贡献 对定位系和非定位系,热力学函数的表达式相同
2 ln q CV NkT T T V , N V
同左
同左
ln q p NkT V T , N
同左
对 H、U 、CV、p 定位、非定位表达式相同 (函数来自第一定律) 对 S、A、G 表达式不同 (函数来自第二定律)
CV ,m (V ) R
e
x 2e x
x
1
2
x
v h T kT
高温时: U V NkT nRT
CV ,m (V ) R
U=A+TS
H=U+pV
G=H-TS
U CV T N ,V
或由 U,S 推导出其余函数的表达式 3.各运动的配分函数及对热力学函数的贡献 平动配分函数 (重点) 三维平动子 qt 对热力学函数贡献
2mkT 2 h
3/ 2
V
q 非定位系 At kT ln t N!
非定位系 S t k ln
N
定位系
物理化学7

• 21. 溶胶的动力性质是由于粒子的不规则运动而产生, 在下列各现象中,不属于溶胶动力性质的是: • (A)渗透压;(B)扩散 ; (C)沉降平衡; (D) 电泳
• 19. 只有典型的增液溶胶才能全面地表现出胶体的三 个基本特性,但有时把大分子溶液也作为胶体化学研 究的内容,一般地说是因为他们: • ( A)具有胶体所特有的分散性,不均匀(多相)性 和聚结不稳定性 • (B)具有胶体所特有的分散性, • (C)具有胶体的不均匀(多相)性 • (D)具有胶体的聚结不稳定性
• 11. 当表面活性物质加入溶剂后,所产生的结 果是: • (A) d/da <0,正吸附 • (B) d/da <0,负吸附 • (C) d/da > 0,正吸附 • (D) d/da >0,负吸附
• 12. 已知某溶液溶于水后,溶液表面张力 与活度 a 的 关系为: = 0-Aln(1+ba),其中0为纯水表 面张力,A ,b为常数,则此溶液中溶质的表面过剩 Г与 活度a的关系为: • (A)Г=-Aa/RT(1+ba) • (B)Г=-Aba/RT(1+ba) • (C)Г=Aa/RT(1+ba) • (D)Г=-ba/RT(1+ba)
• 25. 下列四种电解质 KCl , Na2SO4 , MgSO4 , K3[Fe( C N)6],对 • Fe2O3溶胶的聚沉能力次序为: • (A)KCl > Na2SO4>MgSO4 > K3[Fe(CN)6] • (B)KCl< Na2SO4< MgSO4< K3[Fe(CN)6]
物理化学第七章电化学

第七章 《电化学》一、选择题1.用铂作电极电解一些可溶性碱的水溶液, 在阴、阳两电极上可分别获得氢气和氧气。
所得各种产物的量主要取决于( )。
A. 电解液的本性;B. 电解温度和压力;C. 电解液浓度;D. 通过电极的电量。
2.采用电导法测定HAc 的电离平衡常数时, 应用了惠斯登电桥。
作为电桥平衡点的示零仪器,不能选用( )。
A. 通用示波器;B. 耳机;C. 交流毫伏表;D. 直流检流计。
3.电解质溶液的电导率随浓度变化的规律为:( )。
A. 随浓度增大而单调地增大;B. 随浓度增大而单调地减小;C. 随浓度增大而先增大后减小;D. 随浓度增大而先减小后增大。
4.离子独立运动定律适用于( )。
A. 强电解质溶液;B. 弱电解质溶液;C. 无限稀电解质溶液;D. 理想稀溶液。
5.在论述离子的无限稀释的摩尔电导率的影响因素时,错误的讲法是( )。
A. 认为与溶剂性质有关;B. 认为与温度有关;C. 认为与共存的离子性质有关;D. 认为与离子本性有关。
6.25℃无限稀释的KCl 摩尔电导率为130 S · m 2 · mol -1,已知Cl -的迁移数为0.505,则K +离子的摩尔电导率为(单位:S · m 2 · mol -1)( )。
A. 130;B. 0.479;C. 65.7;D. 64.35。
7.已知298K 时,NaCl ,HCOONa 和HCl 无限稀释的摩尔电导率分别是1.264×102、1.046×102和4.261×102 S · m 2 · mol -1。
实验测得298 K 时,0.01 mol · dm -3HCOOH 水溶液的电导率是5.07×102 S · m -1。
298 K 时,0.01 mol · dm -3HCOOH 水溶液的解离度为( )。
物理化学第七章-2019-4-29

- zEF
第七章 电化学
如何把化学反应转变成电能?
1.该化学反应是氧化还原反应,或包含有氧化 还原的过程。
2.有适当的装置,使化学反应分别通过在电极 上的反应来完成。 3.有两个电极和与电极建立电化学反应平衡的 相应电解质。 4.有其他附属设备,组成一个完整的电路。
= (1.482×10-2 -1.5×10-4) S·m-1=1.467×10-2 S·m-1
故 c=k /Λm∞=1.467×10-2 S.m-1/(2.785×10-2S·m2·mol-1)
= 0.5268 mol.m-3
第七章 电化学
根据电导的测定得出 25℃ 时氯化银饱和水溶液 的电导率为 3.41×10-4 S·m-1。已知同温度下配制此溶 液所用的水的电导率 1.60×10-4S·m-1。试计算 25℃时 氯化银的溶解度。
查表7.3.1,得25 ℃,0.1 molkg-1 H2SO4 的 g=0.265
a g b / b 0.265 0.1587 0.0421 a a 0.04213 7.46210-5
第七章 电化学
7.3.3 德拜-休克尔极限公式 1. 电解质溶液的离子强度I定义:
b
=
(b+v+
bv-
)1/ v
m = m$ + RT lnav
a± = g±(b±/b$)
与一般活度因子定义类似!
第七章 电化学
试利用表7.3.1数据计算25℃时0.1mol kg-1 H2SO4
水溶液中b、 a、及 a。
解:b (b b-- )1/ [(2b)2 b]1/ 3 41/ 3 b 0.1587mol kg-1
= (61.92×10-4+76.34×10-4) S·m2·mol-1 = 138.26×10-4S·m2·mol-1
物理化学 第七章动力学

第十一章 化学动力学§化学反应的反应速率及速率方程1.反应速率的定义非依时计量学反应: 若某反应不存在中间物,或虽有中间物,但其浓度甚微可忽略不计,则此类反应将在整个反应过程中符合一定的计量式。
那么,这类反应就称为非依时计量学反应 某反应的化学计量式:B B0B ν=∑对非依时计量学反应,反应进度ξ定义为:B B d d /n ξν=转化速率为:B B d /d (1/)(d /d )t n t ξξν==& 反应速率为:B B /(1/)(d /d )r V V n t ξν==& 即用单位时间单位体积内化学反应的反应进度来定义反应速率。
对非依时计量学反应,此定义与用来表示速率的物质B 的选择无关,与化学计量式的写法有关。
对于恒容反应,反应速率可表示为:B B (1/)(d /d )r c t ν= 对任何反应: E F G H e f g h +=+G E F Hd d d d 1111d d d d c c c c re tf tg th t=-=-==2.基元反应 定义:如果一个化学反应,反应物分子在碰撞中相互作用直接转化为生成物分子,这种反应称为基元反应。
基元反应为组成一切化学反应的基本单元。
例如:2222C +M =2C +M C +H =HC +H H +C =HC +C 2C +M =C +Mg g化学反应方程,除非特别注明,一般都属于化学计量方程,而不代表基元反应。
反应机理:反应机理又称为反应历程。
在总反应中,连续或同时发生的所有基元反应称为反应机理,在有些情况下,反应机理还要给出所经历的每一步的立体化学结构图。
3. 基元反应的速率方程--质量作用定律、反应分子数(1)反应分子数:基元反应方程式中各反应物分子个数之和,称为反应分子数。
(2)质量作用定律:对于基元反应,反应速率与反应物浓度的幂乘积成正比。
幂指数就是基元反应方程中各反应物的系数。
这就是质量作用定律,它只适用于基元反应。
物理化学 第七章电化学总结

如果正、负离子荷电量不等,如果电极本身也发生反 应,情况就要复杂一些。
29
(2)迁移数 transfer number 某种离子运载的电流与通过溶液的总电流之比 称为该离子的迁移数, 以t 表示。
即每有1mol Ag+被还原或1molAg沉积下来,通过的 电量一定为96500C
21
2+ + 2e对于电极反应:Cu = Cu
z=2, Q=96500C 时:
Q 96500 C 0.5mol zF 2 96500 mol 1 C
n(Cu ) (Cu )
n(Cu) (Cu) 0.5mol
49
3.摩尔电导率与浓度的关系
例1例2例3例4例5
0.04 HCl 0.03 0.02 NaOH
0.01
0 0
AgNO3 CH3COOH 0.5 1.0 1.5
•随着电解质浓度c降低, 离子间引力减小, 离子 运动速度增加,故摩尔 电导率m增大。
m/(S m2 mol-1)
c , F , v , m 。
F=L· e
=6.0221367×1023 mol-1×1.6022×10-19 C =96485.309 C· -1 mol
≈96500 C· -1 mol
19
对各种电解质溶液, 每通过96485.309C的电量,
在任一电极上发生得失1mol电子的反应, 同时相
对应的电极反应的物质的量亦为1mol(所选取的 基本粒子荷一价电).
物理化学第七章 电化学

CdCl2 a Cd
Q Id t
t 电流表:指示测定时,电路中 的电流变化。
界面移动法可以较精确地测定离子迁移数,关键是如 何寻找一种指示溶液,能与被测溶液之间形成一清晰界面。 形成清晰界面的条件:
n电解后=该离子电解前的物质的量n电解前±该离子参与 电极反应的物质的量n反应±该离子迁移的物质的量n迁
移
由实验数据计算离子的迁移数时,如果所用电极也参加电极 反应时,应加以考虑。
例:用两个银电极电解AgNO3水溶液,在电解前,溶液中每1kg 水含43.50mnol AgNO3。实验后,银库仑计中有0.723mmol 的Ag 沉积。由分析知,电解后阳极区有23.14g水和1.390mmolAgNO3。 试计算t(Ag+)和t(NO3-)。 解:用银电极电解AgNO3溶液时,电极反应:
导电机理 电子导体:电子定向运动 离子导体:离子在溶液中定向迁移 电流流经导体 不发生化学变化 发生电解反应 温度升高 导电性下降 导电性上升
原电池和电解池的共同特点: 当外电路接通时在电极与溶液的界面上有电子得失的 反应发生,溶液内部有离子做定向迁移运动。
电极反应:把电极上进行的有电子得失的化学反应. 两个电极反应的总和对原电池叫电池反应,对电解池叫电解 反应。 注意:阴离子在阳极失去电子,失去电子通过外线路流向电源 正极.阳离子在阴极得到电子. 发生氧化反应的电极叫阳极,发生还原反应的电极叫阴极. 正负极依电势高低来定.
阳极:Ag→Ag++e阴极:Ag++e→Ag
电解前阳极区在23.14g水中有AgNO3为:
43.50 23.14 1.007mmol 1000
由库仑计中有0.723mmol的Ag沉积,则在电解池的阳极也有相 同数量的Ag被氧化为Ag+ 所以Ag+迁出阳极区的摩尔数为: (n电解前+n反应)-n电解后=1.007+0.723-1.390=0.340mmol
物理化学第7章-电化学参考答案

第7章 电化学 习题解答1. 将两个银电极插入AgNO 3溶液,通以0.2 A 电流共30 min ,试求阴极上析出Ag 的质量。
解:根据BItM m zF=得 Ag Ag 0.23060107.87g 0.4025 g 196500ItM m zF⨯⨯⨯===⨯2. 以1930 C 的电量通过CuSO 4溶液,在阴极有0.009 mol 的Cu 沉积出来,问阴极产生的H 2的物质的量为多少? 解:电极反应方程式为: 阴极 2Cu2e Cu(s)+-+→阳极 222H O(l)H (g)2OH 2e --→++在阴极析出0.009 mol 的Cu ,通过的电荷量为:Cu Q (0.009296500) C 1737 C nzF ==⨯⨯=根据法拉第定律,析出H 2的物质的量为2H Cu 19301737mol 0.001 mol 296500Q Q Q n zFzF --====⨯ 3. 电解食盐水溶液制取NaOH ,通电一段时间后,得到含NaOH 1 mol/dm 3的溶液0.6 dm 3,同时在与之串联的铜库仑计上析出30.4 g 铜,试问制备NaOH 的电流效率是多少? 解:根据铜库仑计中析出Cu(s)的质量可以计算通过的电荷量。
Cu Cu 30.4mol 0.957 mol 1163.52m n M ===⨯电 理论上NaOH 的产量也应该是0.957 mol 。
而实际所得NaOH 的产量为(1.0×0.6) mol = 0.6 mol所以电流效率为实际产量与理论产量之比,即0.6100%62.7%0.957η=⨯=4. 如果在10×10 cm 2的薄铜片两面镀上0.005 cm 厚的Ni 层[镀液用Ni(NO 3)2],假定镀层能均匀分布,用2.0 A 的电流强度得到上述厚度的镍层时需通电多长时间?设电流效率为96.0%。
已知金属的密度为8.9 g/cm 3,Ni(s)的摩尔质量为58.69 g/mol 。
物理化学第七章 电化学(72)

电解质溶液的电导率可以看着是相距1m的两电极间放置 体积为1m3的电解质溶液的电导。
(3)摩尔电导率m 摩尔电导率---单位浓度的电解质溶液的电导率, 单位为S· 2· -1 m mol
m c
例题:在291K时,浓度为10mol· -3 的CuSO 4 溶液的电导率为 m 0.1434 S· -1,试求CuSO4的摩尔电导率 m (CuSO4 ) 和 ( 1 CuSO4 ) m 2 1 的摩尔电导率 m ( CuSO4 ) 2 解: 0.1434S m1 m (CuSO4 ) 14.34 103 S m2 mol 1 c(CuSO4 ) 10mol m3
1 0.1434S m 1 m ( CuSO4 ) 7.17 103 S m 2 mol 1 1 2 2 10mol m 3 c( CuSO4 ) 2 注意:
1.计算时浓度c的单位应采用mol· -3表示。 m 2. 在使用摩尔电导率这个量时,应将浓度为c的物质的基本 单元置于 m 后的括号内,以免出错。
单位:m 2 · -1· -1 V s
u t u u
u t u u
已知OH-离子的迁移速度是K+离子的3倍。
通电后:
电解质溶液中各区仍保持电中性,中部溶液浓度不变,但是 阴、阳两极部的浓度互不相同,且两极部的浓度比原溶液都 有所下降,但降低程度不同。
离子电迁移过程中的规律:
2 t ( SO4 ) 1 t (Cu 2 ) 0.711
§7.3 电导、电导率和摩尔电Fra bibliotek率• 3.1 定义
(1)电导G 电导---电阻的倒数,单位为S
G 1
R
1S 11
1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013年7月26日
7-6 链反应
2 直链反应
2013年7月26日
7-6 链反应
3 支链反应
支链反应指一个活性粒子参加反应后,产生二个以上新的活性粒子的链 反应,例如:H2和O2的燃烧反应就是支链反应。
支链反应常引发爆炸,一经引发一个活性粒子可以产生两个,照此反应 下去,会产生大量的活性粒子,致使反应速度急剧上升,以至发生爆炸。 但支链反应有一特点,在一定情况下,只在一定的压力范围内发生爆炸, 在此压力范围以外,反应仍可平稳进行。 对于支链反应,我们可以利用爆炸界限的原理达到防爆目的,即控
2013年7月26日
7-2 反应物浓度对反应速率的影响
2 反应级数(order of reaction)
•(1) 反应级数α ,β ……均由实验确定,其数值可以随反应条件改变,可以是 简单的级数反应0,1,2,3级,也可以是分数级反应或负数级反应。 •(2) 反应级数是反应物浓度对反应速率影响的方次数,表示各物质浓度对反 应速率的影响程度,级数越高,则该物质的变化对反应速度的影响越重要, 零级反应说明浓度的改变对反应速率无影响。 •对于不能写成浓度幂乘积形式的速率方程,叫级数无意义
2013年7月26日
7-2 反应物浓度对反应速率的影响
3 一级反应(first order reaction)
反应速率与反应物浓度的一次方成正比的反应称为一级反应
。
2013年7月26日
7-2 反应物浓度对反应速率的影响
2013年7月26日
7-2 反应物浓度对反应速率的影响
4 二级反应(Second order reaction)
物理化学
河南师范大学
化学与环境科学学院
版权所有:河南师范大学化学与环境科学学院 Copyright © 2004 Henan Normal University. All rights reserved.
2013年7月26日
第七章 化学动力学 本章目录
2013年7月26日
7-1 反应速率及其测定 本节要目
7-5 几种典型的复杂反应 本节要目
2013年7月26日
7-5几种典型的复杂反应 1 对峙反应
2013年7月26日
7-5几种典型的复杂反应 1 对峙反应
图7-5-1 对峙反应中,正、逆反应速率对时间的关系 2013年7月26日
7-5几种典型的复杂反应
2 平行反应
2013年7月26日
7-5几种典型的复杂反应
2013年7月26日
7-1 反应速率及其测定
1.化学动力学的任务及其研究内容
1 化学动力学与化学热力学的联系与区别
研究任何一个化学反应,往往要注意两个重要方面: (1)化学反应的方向和限度问题。在指定条件(体系 及其相关的环境)下,在给定的始态(反应物)和终态 (产物)之间,反应是否能够发生?如能发生,进行到 什么程度为止?这类问题的研究,是靠化学热力学来解 决的。
2013年7月26日
7-4 基元反应、反应分子数 本节要目
2013年7月26日
7-4 基元反应、反应分子数
1 基元反应
2013年7月26日
7-4 基元反应、反应分子数
1 质量作用定律
2013年7月26日
7-4 基元反应、反应分子数
2 反应分子数
反应分子数(molecularity)是指在基元反应过程中参加反应的粒子(分 子、原子、离子、自由基等)的数目。根据反应分子数可将反应分为单分子反 应,双分子反应和三分子反应。
反应分子数具有微观意义,只有基元步骤才有,只能是1,2,3几个简单 的整数;大部分基元反应为单分子或双分子反应,三分子反应较少见。
反应分子数是人们为了说明反应机理而引出的概念,它说明基元反应过 程中参加反应的分子数目。反应分子数和反应级数有什么必然联系,提到反应 分子数注意一定与基元反应相联系。
2013年7月26日
2013年7月26日
7-1 反应速率及其测定
3 反应速率的测定
从原则上看,只要测定不同时刻反应物或产物的浓度,便可以求出反应速 率,测定方法一般有化学法和物理法。 1.化学法
在化学反应的某一时刻取出部分样品后,必须使反应停止不再继续进行, 并尽可能快地测定某物质的浓度,停止的方法有骤冷、冲稀、加阻化剂或 移走催化剂等,然后用化学方法进行分析测定。
2013年7月26日
7-1 反应速率及其测定
例如在298K时 H2 (g) + O2 (g) = H2O (l), ∆GΘm=-237.2KJ· -1 mol 根据热力学的计算,这一反应发生的趋势很大,但却不 能表明反应以多大速率进行。实际上,在一般温度下, 此反应几乎不会发生。要想解决在什么条件下才能实 现反应的问题,必需进行动力学研究。只有通过这类 研究,找到实现反应的条件以后,才能全面地解决实 际问题。例如上述反应,如果把温度升高到700K,它 便以爆炸的方式快速进行。
制反应条件,使其在非爆炸区以稳定的速率进行。
2013年7月26日
7-6 链反应
6 热爆炸区 第三界限 5
稳态区 4 第二界限 爆炸区 3 第一界限
2
600
700
800
900
由图可见,在673K以下,反应速率缓慢;在 853K 以 上 , 任 何 压 力 下 都 发 生 爆 炸 ; 而 在 673K-853K范围内,则有一个爆炸区,在这个 区内每一个温度下均有二个压力界限值,称第 一爆炸极限和第二爆炸极限。对于H2 和O2 的体 系,还存在第三爆炸界限。当压力在第一界限 以下时,反应速率缓慢而不爆炸,这是因为气 体比较稀少,活性粒子在器壁上销毁速率占优 势,使链的销毁速率大于链的发展速率,故不 爆炸。压力增加,链的发展速率急增,结果导 致爆炸。当压力增大到第二界限时,气体浓度 已相当大,气体分子之间碰撞相当频繁,因为 气体中有相当一部分惰性分子,所以这些碰撞 中相当一部分将促使链中断,结果链的销毁速 率又大于链的发展速率,又不发生爆炸。第三 界限以上的爆炸是热爆炸。为了防止热爆炸, 必须使反应热能及时散发出去,或者控制进入 反应器的原料气量,使反应以控制的速率进行 。
关键:取出样品立即冻结
优点:能直接得到不同时刻的绝对值,所用仪器简单。
缺点:分析操作繁杂。
2013年7月26日
7-1 反应速率及其测定
3 反应速率的测定
2.物理法 利用一些物理性质与浓度成单值函数的关系,测定反应体系 物理量随时间的变化,然后折算成不同时刻反应物的浓度值, 通常可利用的物理量有P,V,L,.A等。这种方法优点是迅速方 便,不终止反应。可在反应器内连续监测,便于自动记录。 所要注意的是:这种方法测的是整个反应体系的物理量,而我 们一般需要的是某一时刻某种反应物或产物的浓度,所以用 物理方法测定反应速度,首先要找出体系的物理量与某种物质 浓度的关系。
2013年7月26日
7-1 反应速率及其测定
(2)化学反应的速率和机理问题。要弄清楚化学反应体系 从始态到终态所经历过程的细节,发生这个过程所需 要的时间,以及影响这种过程的因素等等。这类问题 是靠化学动力学来解决的。化学动力学(Chemical kinetics)是研究化学反应速率及反应机理的科学,它 和化学热力学既有联系又有区别。一个化学反应,必须 通过热力学的计算,判定在给定条件、可以发生反应的 前提下再来进行化学动力学的研究,否则将是徒劳的。 化学动力学主要是研究化学反应的速率,研究各种外 在因素对反应速率的影响;研究物质的结构、性质与 反应性能的关系,探讨能够解释这种反应速率规律的 可能机理,为最优化控制反应提供理论依据 。
2013年7月26日
7-1 反应速率及其测定
化学动力学的任务及其研究内容
化学动力学的主要任务时研究反应速率及其所遵循的规律和 各种因素对反应速率的影响,从而给人们提供化学反应的条件, 揭示化学反应历程,找出决定反应速率的关键所在,使反应按照 我们所需要的方向进行,并得到人们所希望的产品。它包括以下 三个层次的研究内容:1)宏观反应动力学。它是以宏观反应动力 学实验为基础的,研究从复合反应到基元反应的动力学行为,由 于这方面的研究在化工生产中起着十分重要的作用,所以它在理 论和应用的研究上获得了很大的发展;2)基元反应动力学。它是 以大量的微观分子反应动力学行为为出发点,借助于统计力学的 方法,研究宏观反应动力学行为;3)分子反应动力学。这是近年 来新发展的一个领域,它通过分子束散射技术和远红外化学冷光, 凭借于量子力学的理论模型,研究单个分子通过碰撞发生变化的 动力学行为。
2013年7月26日
7-2 反应物浓度对反应速率的影响
2013年7月26日
7-3 反应级数的确定 本节要目
2013年7月26日
7-3反应级数的确定
1 微分法(differentiቤተ መጻሕፍቲ ባይዱl method)
2013年7月26日
7-3反应级数的确定
1 微分法(differential method)
2013年7月26日
T/K
图7-6-1爆鸣气的爆炸区间 2013年7月26日
7-7 快速反应的研究方法 本节要目
2013年7月26日
7-5几种典型的复杂反应
图7-5-2平行反应浓度时间图 k1和k2其值在定温下是个常数,代表平行反应的选择性,可以设 法改变比值,使主反应的速度常数远远大于负反应的速率常数, 以使人们可以得到更多的所需产品,改变的方法一般有两种,一 是选择催化剂,二是调节温度。
2013年7月26日
2013年7月26日
7-2 反应物浓度对反应速率的影响 本节要目
2013年7月26日
7-2 反应物浓度对反应速率的影响
1 速率方程式和速率常数
2013年7月26日
7-2 反应物浓度对反应速率的影响 速率常数(rate constant)
