2019-2020学年高中化学第三章自然界中的元素3.1碳的多样性素材1鲁科版必修1.doc
高中化学第3章自然界中的元素第1节碳的多样性第2课时课件鲁科版必修1

①原料: □08 铁矿石 (主要成分为 Fe2O3)和 □09 焦炭 。 ②铁矿石被还原: □10 3CO+Fe2O3=高==温==2Fe+3CO2 。
(2)木炭燃烧 C、CO、CO2 的转化关系如图:
用化学方程式表示为
① □11 2C+O2=点==燃==2CO
,
□ ② 12 2CO+O2=点==燃==2CO2
A.672 mL B.336 mL C.>672 mL D.<672 mL
答案 C 解析 根据化学方程式 Fe2O3+3CO=高==温==2Fe+3CO2 易知,要使 1.6 g Fe2O3 完全还原为 Fe,需要 672 mL CO,由于实际实验中需要先通入 CO, 实验结束时还要再通入一部分 CO,因此事先准备的 CO 的体积(STP)应大于 672 mL。
,
□ ③ 13 C+O2=点==燃==CO2
,
④ □14 CO2+C=高==温==2CO
。
3.含碳无机物和有机物间的转化
1828 年,德国化学家 □15 维勒 用无机物氰酸铵(NH4CNO)首次合成了
有机物尿素[分子式为 CO(NH2)2],开创了以含碳无机化合物合成有机化合物
的先河。
23
课堂探究
①植物通过光合作用吸收二氧化碳形成葡萄糖 ②植物呼吸作用消耗葡
萄糖 ③钟乳石、石笋的形成 ④煤炭转化为水煤气
A.①②④
B.①③④
C.①②③D.②③④Fra bibliotek答案 C
解析 煤炭转化为水煤气属于人工转化。
答案
解析
二、生产和生活中碳及其化合物之间的转化 [交流研讨]
烧制砖瓦时,若自然冷却,则得到红色的砖瓦;若通过从上口往下慢慢 洒水冷却,则得到青色的砖瓦,试解释其原因。
高中化学第三章自然界中的元素3.1碳的多样性素材鲁科版必修1

第3章自然界中的元素▲章节知识概说本章的核心内容是元素化合物知识,主要是应用第2章的概念和理论知识认识物质的性质,探讨物质在生产、生活中的应用,以及人类活动对生态环境的影响。
本章首先以碳元素的多样性为线索,探索了碳单质、碳的化合物以及碳元素转化的多样性;然后以硫及其化合物的转化为线索,探索了不同价态硫元素在自然界、实验室、生活、生产中的转化;紧接着以氮的循环为线索,探讨了氮在自然界中的循环、氮循环过程中的重要物质,以及人类活动对氮循环的影响;最后通过海洋这个蕴藏众多元素的领域,引入了更多的元素化合物知识,通过探讨从海洋中提取物质的途径,学习了镁、溴、碘等元素的知识。
这样,就把零散的元素化合物的知识有机地结合在了一起,充分体现了高观点、大视野和多角度的特色。
▲课标理念感悟知识与技能:根据生产、生活中的应用实例或通过实验探究,了解碳及其重要化合物的主要性质,以及它们在自然界和生活、生产中的相互转化;通过氮的循环,了解氮气、氨气、铵盐以及硝酸的主要性质,认识它们在生产中的应用;通过实验探究了解硫单质、二氧化硫等的主要性质,探讨不同价态硫元素之间的转化途径;通过了解海洋中的重要元素,认识金属镁、溴单质、碘单质和卤化物的主要性质及其在生产中的应用。
过程与方法:运用氧化还原理论研究物质的氧化性和还原性,探讨含有相同元素的物质之间的相互转化。
情感态度与价值观:通过了解人类活动对氮循环的影响、酸雨问题和海洋资源的综合利用,认识人类活动对生态环境的影响,培养与环境和平相处的情感以及运用化学知识解决环境和资源问题的兴趣和热情。
第1节碳的多样性在一百多种元素中,有一种元素组成的单质和化合物种类已经远远超过三千万种,你知道这是哪一种元素吗?对了,这种元素就是碳元素。
在初中我们接触过碳,知道碳既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。
碳以多种形态存在于自然界中。
下面,就让我们一起来感受碳的多样性吧。
高中化学第三章自然界中的元素3.1碳的多样性教案鲁科版必修1
一、教学目标
1.知识与技能
让学生掌握同素异形体的概念,掌握碳酸钠和碳酸氢钠的有关性质。
巩固离子反应和氧化还原相关知识。
2.过程与方法
通过探究碳酸钠和碳酸氢钠的主要性质,进一步熟悉研究物质的基本方法和程序,培养学生利用实验科学探究的能力,进一步体验化学研究的方法和程序
3.情感态度与价值观
通过实验探究激发学生探究化学的兴趣、发扬合作学习的精神。了解碳元素的转化,为人类服务的案例,体会化学科学的伟大,增强求知的欲望。
Na2CO3稳定,受热不分解
NaHCO3不稳定,受热易分解
做笔记,记忆
4.与酸反应剧烈程度的比较
NaHCO3反应更剧烈
解释原因:H++CO32-=HCO3-
H++HCO3-=H2O+CO2↑
观看演示实验,观察现象
培养学生观察,分析问题的能力
多媒体展示两种盐性质的比较
分析,总结,
过渡:正是由于这两种物质的性质比较广泛,导致了它们具有广泛的用途,多媒体展示
二、教学重难点:
Na2CO3与NaHCO3的性质
三、课时安排
2课时
四、教学用
教师的教学行为(提问、讲解、等内容)
学生的学习行为
设计目的
大家有遨游太空的梦想吗?在不久的将来,我们除了可以坐航天飞机去太空外,还有更便捷的方法,那就是乘坐空间电梯,展示图片
倾听
激起学生的学习兴趣
小组分工合作,实验
培养学生动手的能力
板书1.与碱的反应
实质不同,碳酸钠与碱能反应是因为满足复分解反应的条件,而碳酸氢钠是因为碳酸氢根和氢氧根的反应
认真做笔记,并思考
从离子反应的角度让学生掌握反应的实质
高中化学 3.1.1 多种多样的碳单质和广泛存在的含碳化合物 鲁科版必修1

是
,因为 。
自主阅读 自主检测
答案:(1)碳酸钠 和等量的H+反应,碳酸钠比碳酸氢钠的用量少 (2)碳酸氢钠 碳酸氢钠受热可以分解,产生CO2气体 (3)碳酸氢钠 若要产生一样多的CO2,碳酸氢钠消耗盐酸较少,且 反应较快
重难点一 重难点二
重难点一Na2CO3和NaHCO3与酸反应的区别 讨论探究
由正六边形构 成的平面层状 结构
由正五边形和正六边 形排列而成的足球状 分子
硬度 硬度很大 导电性 不导电
质软,在纸上 可留痕迹
—
良好
—
自主阅读 自主检测
3.碳的化学性质 碳在参与化学反应时,一般表现为还原性。 (1)与 O2 反应:
(2)与氧化物反应:
自主阅读 自主检测
二、广泛存在的含碳化合物 1.种类繁多的含碳化合物
第3章 自然界中的元素
第1节 碳的多样性
第1课时 多种多样的碳单质和广 泛存在的含碳化合物
学习目标
1.了解同素异形体的概 念。 2.了解碳的多种存在形 态及碳的各种同素异形 体的特点。 3.了解碳酸钠和碳酸氢 钠的主要性质,知道它们 性质的差异及其转化;能 根据它们性质的差异,鉴 别碳酸钠和碳酸氢钠。
重难点一 重难点二
情景导入 知识点拨 典例引领
例题105840138现有25 mL 2 mol·L-1的Na2CO3溶液和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓慢滴加到稀盐酸中,②将稀盐 酸缓慢滴加到Na2CO3溶液中,在标准状况下产生气体的体积情况是
钠水溶液的碱性远远强于碳酸氢钠水溶液的碱性。试从反应物的
性质或者用量角度说明在下列用途中应选用碳酸钠还是碳酸氢钠,
并说明原因。
高中化学 第3章 自然界中的元素 第1节 碳的多样性教案 鲁科版必修1

第1节碳的多样性第一课时【引入】在初中我们接触过碳,知道碳既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。
碳以多种形态存在于自然界中。
今天,我们一起来感受碳的多样性。
【指导阅读】阅读P60第一部分:多种多样的碳单质。
【展示模型】展示C60、石墨、金刚石的球棍模型【设问】通过初中的学习和刚才的阅读,你已获得了有关碳单质的哪些内容?你还有哪些疑问?(该部分内容由学生归纳,老师点评)已经了解的知识和可能提出的问题归纳如下:1、三者的结构特点(简单介绍碳原子的排列情况);2、同素异形体的概念。
(由同一种元素组成的性质不同的几种单质,叫做该元素的同素异形体)。
3、碳的各种单质的物理性质相异的主要原因是什么?(碳原子的排列不同,在这里可以采用比喻的方法,把碳原子比喻为建筑用的砖,把金刚石、石墨、C60比喻成用砖盖成的建筑物,用相同的砖但不同的方式盖成的建筑物,其外型不同,牢固程度可能会存在较大差异。
)4、碳的各种单质化学性质是否相同?为什么?(相同。
因为由同种元素组成。
)5、如何证明石墨、金刚石都是由碳元素组成?(介绍史实:1797年英国化学家钱南为了测出金刚石的成分,做了一个非常昂贵的实验。
他将金刚石放在密闭的、充满氧气的箱子里进行燃烧(箱子是纯金制的),结果却令人非常意外—箱子里的气体成分竟然是二氧化碳。
)<思考>:为了证明金刚石是由碳元素组成的,钱南测出生成气体的成分是CO2后,还需测定其他数据吗?6、了解C60、碳纳米管的相关知识。
建议课前布置任务,课堂上让学生交流。
老师做好表现性评价记录。
【过渡】尽管碳元素有多种同素异形体,但它在自然界主要是以化合物的形式存在的。
例如:蛋白质、淀粉、天然气等有机化合物;CO2、碳酸盐等无机化合物。
下面,我们一起来探讨有着重要用途的两种含碳无机化合物——碳酸钠、碳酸氢钠。
【方法导引】你已经知道了碳酸钙的化学性质,碳酸钠和碳酸氢钠是否具有类似的化学性质呢?(引导学生通过对比类似物质性质的方法来预测和设计实验方案,避免实验的盲目性。
高中化学《第三章自然界中的元素》基础知识总结鲁科版必修1.doc
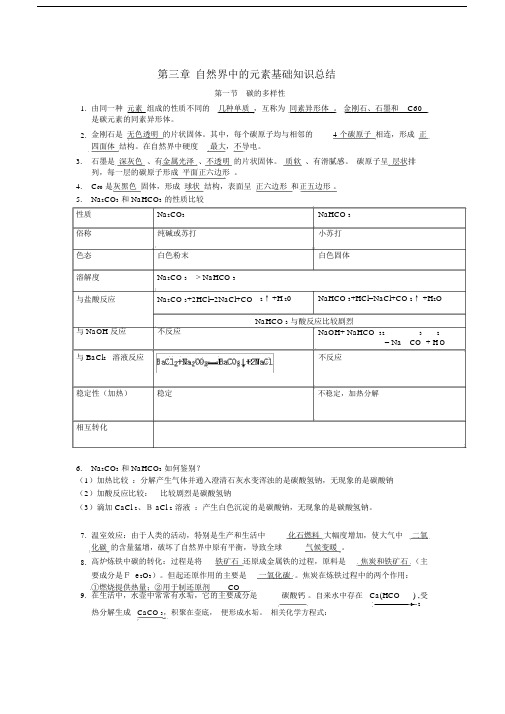
第三章自然界中的元素基础知识总结第一节碳的多样性1. 由同一种元素组成的性质不同的几种单质,互称为同素异形体。
金刚石、石墨和 C60是碳元素的同素异形体。
2. 金刚石是无色透明的片状固体。
其中,每个碳原子均与相邻的 4 个碳原子相连,形成正四面体结构。
在自然界中硬度最大,不导电。
3.石墨是深灰色、有金属光泽、不透明的片状固体。
质软、有滑腻感。
碳原子呈层状排列,每一层的碳原子形成平面正六边形。
4.C60是灰黑色固体,形成球状结构,表面呈正六边形和正五边形。
5.Na2CO3和 NaHCO3的性质比较性质Na2CO3 NaHCO 3俗称纯碱或苏打小苏打色态白色粉末白色固体溶解度Na2CO 3 > NaHCO 3与盐酸反应Na2CO 3+2HCl=2NaCl+CO 2↑+H 20 NaHCO 3+HCl=NaCl+CO 2↑ +H2ONaHCO 3与酸反应比较剧烈与 NaOH 反应不反应NaOH+ NaHCO 32 3 2O= Na CO + H 与 BaCl2 溶液反应不反应稳定性(加热)稳定不稳定,加热分解相互转化6.Na2CO3和 NaHCO3如何鉴别?(1)加热比较:分解产生气体并通入澄清石灰水变浑浊的是碳酸氢钠,无现象的是碳酸钠(2)加酸反应比较:比较剧烈是碳酸氢钠(3)滴加 CaCl 2、B aCl 2溶液:产生白色沉淀的是碳酸钠,无现象的是碳酸氢钠。
7. 温室效应:由于人类的活动,特别是生产和生活中化石燃料大幅度增加,使大气中二氧化碳的含量猛增,破坏了自然界中原有平衡,导致全球气候变暖。
8. 高炉炼铁中碳的转化:过程是将铁矿石还原成金属铁的过程,原料是焦炭和铁矿石(主要成分是F e2O3)。
但起还原作用的主要是一氧化碳。
焦炭在炼铁过程中的两个作用:①燃烧提供热量;②用于制还原剂CO9. 在生活中,水壶中常常有水垢,它的主要成分是碳酸钙。
自来水中存在 Ca(HCO ) ,受3 2热分解生成CaCO 3,积聚在壶底,便形成水垢。
2020版高考化学复习第3章自然界中的元素1第1节碳的多样性课件鲁科版

(2)热稳定性 一般来说,热稳定性顺序为碳酸的正盐>碳酸的酸式盐>碳酸, 如稳定性: Na2CO3>NaHCO3>H2CO3; 碳酸的可溶性正盐>碳酸 的难溶性正盐,如 CaCO3 高温下易分解,而 K2CO3 不易分解。 (3)水溶液酸碱性强弱 相同温度下,物质的量浓度相同时,碳酸的正盐溶液的 pH 大 于其酸式盐溶液,如 pH:Na2CO3 溶液>NaHCO3 溶液。
[答案]
(1)Na2CO3
1 120
(2)NaHCO3
2 240
(3)Na2CO3、NaHCO3
1 792
(4)1 mol· L-1
CO2 与 NaOH 溶液反应的规律 (1)反应原理
2NaOH+CO2(少量)===Na2CO3+H2O NaOH+CO2(过量)===NaHCO3 Na2CO3+CO2+H2O===2NaHCO3
2x+y=0.1 mol y,则有 -1 106 g · mol ×x+84
, g· mol ×y=7.16 g
-1
x=0.02 mol 解得 ,所以 y=0.06 mol
-
V(CO2)=(0.02+0.06)mol×
22.4 L·mol 1=1.792 L=1 792 mL。
5.碳酸的酸式盐和正盐的比较 (1)在水中的溶解性 ①含 K+、Na+、NH+ 4 的碳酸的正盐易溶于水,其余一般难溶于 水;碳酸的酸式盐均能溶于水。 ②一般来说,在相同温度下,碳酸的难溶性正盐溶解度小于其 酸式盐溶解度,如溶解度:Ca(HCO3)2>CaCO3;碳酸的可溶性 正盐溶解度大于其酸式盐溶解度, 如溶解度: Na2CO3>NaHCO3。
(2)草酸盐的性质 ①(NH4)2C2O4 易溶于水,微溶于乙醇,加热分解,由氨水与草 酸溶液作用而成。 ②CaC2O4 难溶于水和醋酸,能溶于盐酸和硝酸;灼烧时转变成 碳酸钙或氧化钙。 ③草酸镁、草酸亚铁等微溶于水,可由对应的可溶性金属盐与 草酸铵在水溶液中反应而得, 加热分解可得到对应金属氧化物。
2019-2020学年高中化学新教材鲁科版必修1课件:第三章 自然界中的元素 第一节 碳的多样性 碳

石 墨 金刚石
C60
3、碳的各种单质的物理性质相异的主要原因是什么?
335pm
核间距142pm
一、同素异形体
由同一种元素组成的性质不同的几种单质的互称。
同素 异形 体 单质同种 元素来自结构 不同性质不同
1、同素异形体之间的物理性质、化学性质是否相同或不相同?
能。互滴法:逐滴滴加
2、热稳定性
Na2CO3 NaHCO3
碳酸钠受热不分解 2NaHCO3==△== Na2CO3+H2O+CO2↑
证明:碳酸钠的热稳定性大于碳酸氢钠
【例1】下列物质中性质稳定,受热难分解的 是( B )
A CuSO4·5H2O C NaHCO3
B Na2CO3 D HClO
3、与可溶性的钙盐、钡盐反应
对NaHCO3: HCO3 - + H += H2O + CO2
思考:①分别向Na2CO3和NaHCO3的溶液中 逐滴滴加盐酸,会观察到什么现象、对应什么 反应? Na2CO3:开始无气泡,一段时间后产生气泡
先:CO32-+ H+ ==== HCO3后:HCO3-+H+ ==== H2O+CO2↑
NaHCO3:立即产生气泡 HCO3-+H+ ==== H2O+CO2↑
②将盐酸逐滴滴入到Na2CO3溶液中,与将 Na2CO3溶液逐滴滴入到盐酸中的现象是否一样?
不一样。将盐酸逐滴滴入到Na2CO3溶液中开始无现 象,后产生气泡。将Na2CO3溶液逐滴滴入到盐酸中 开始就产生气泡。
③不用其它试剂能否鉴别Na2CO3溶液与稀盐酸?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019-2020学年高中化学第三章自然界中的元素3.1碳的多样性素材1
鲁科版必修1
碳60是灰黑色的固体.除金刚石、石墨外,近年来,科学家们又发现了一些以新的单质形态存在的碳,其中比较重要的是1985年发现的C60。
C60是一种由60个碳原子构成的分子,形似足球。
目前,人们对C60的研究已经取得了很大的进展,将C60应用于超导体、材料科学等领域的探索正在不断地深入。
我国在这方面的研究也取得了重大的成果,如北京大学和中国科学院物理所合作,已成功地研制出了金属掺杂C60的超导体。
可以说,C60的发现,对于碳化学甚至整个化学领域的研究具有非常重要的意义。
碳六十的发现和结构特点
1996年10月7日,瑞典皇家科学院决定把1996年诺贝尔化学奖授予Robert FCu rl,Jr(美国)、Harold WKroto(英国)和Richard ESmalley(美国),以表彰他们发现C 60。
1995年9月初,在美国得克萨斯州Rice大学的Smalley实验室里,Kroto等为了模拟N型红巨星附近大气中的碳原子簇的形成过程,进行了石墨的激光气化实验。
他们从所得的质谱图中发现存在一系列由偶数个碳原子所形成的分子,其中有一个比其它峰强度大20~25倍的峰,此峰的质量数对应于由60个碳原子所形成的分子。
C60分子是以什么样的结构而能稳定呢?层状的石墨和四面体结构的金刚石是碳的两种稳定存在形式,当60个碳原子以它们中的任何一种形式排列时,都会存在许多悬键,就会非常活泼,就不会显示出如此稳定的质谱信号。
这就说明C60分子具有与石墨和金刚石完全不同的结构。
由于受到建筑学家Buckminster Fuller用五边形和六边形构成的拱形圆顶建筑的启发,Kroto等认为C60是由60个碳原子组成的球形32面体,即由12个五边形和20个六边形组成,只有这样C60分子才不存在双键。
在C60分子中,每个碳原子以sp2杂化轨道与相邻的三个碳原子相连,剩余的未参加杂化的一个p轨道在C60球壳的外围和内腔形成球面大∏键,从而具有芳香性。
为了纪念Fuller,他们提出用Buckminsterfullerene来命名C60,后来又将包括C60在内的所有含偶数个碳所形成的分子通称为Fuller,中译名为富勒烯。
碳六十的制备
用纯石墨作电极,在氦气氛中放电,电弧中产生的烟炱沉积在水冷反应器的内壁上,这种烟炱中存在着C60、C70等碳原子簇的混合物。
用萃取法从烟炱中分离提纯富勒烯,将烟炱放入索氏(Soxhlet)提取器中,用甲苯或苯提取,提取液中的主要成分是C60和C70,以及少量C84和C78。
再用液相色谱分离法对提取液进行分离,就能得到纯净的C60溶液。
C60溶液是紫红色的,蒸发掉溶剂就能得到深红色的C60微晶。
碳六十的用途
从C60被发现的短短的十多年以来,富勒烯已经广泛地影响到物理学、化学、材料学、电子学、生物学、医药学各个领域,极大地丰富和提高了科学理论,同时也显示出有巨大的潜在应用前景。
据报道,对C60分子进行掺杂,使C60分子在其笼内或笼外俘获其它原子或集团,形成类C60的衍生物。
例如C60F60,就是对C60分子充分氟化,给C60球面加上氟原子,把C60球壳中的所有电子“锁住”,使它们不与其它分子结合,因此C60F60表现出不容易粘在其它物质上,其润滑性比C60要好,可做超级耐高温的润滑剂,被视为“分子滚珠”。
再如,把K、Cs、Tl等金属原子掺进C60分子的笼内,就能使其具有超导性能。
用这种材料制成的电机,只要很少电量就能使转子不停地转动。
再有C60H60这些相对分子质量很大地碳氢化合物热值极高,可做火箭的燃料。
等等。
·C60分子C60分子是一种由60个碳原子构成的分子,它形似足球,是一种很稳定的分子,主要应用于材料科学,超导体等方面。
金刚石、石墨、C60分子的结构示意图.世人瞩目的足球烯-C60.C60分子是一种由60个碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形,它形似足球,因此又被称为足球烯。
足球烯是美国休斯顿赖斯大学的克罗脱(Kroto, H.W.)和史沫莱(S malley, R.E.)等人于1985年提出的,他们用大功率激光束轰击石墨使其气化,用1M Pa压强的氦气产生超声波,使被激光束气化的碳原子通过一个小喷嘴进入真空膨胀,并迅速冷却形成新的碳原子,从而得到了C60。
C60的组成及结构已经被质谱,X射线分析等实验证明。
此外,还有C70等许多类似C60分子也已被相继发现。
1991年,科学家们发现,C60中掺以少量某些金属后具有超导性,且这种材料的制作工艺比制作传统的超导材料——陶瓷要简单,质地又十分坚硬,所以人们预言C60在超导材料领域具有广阔的应用前景。
碳60分子俗称布基球,由60个碳原子构成,它们组成一个笼状结构。
这一分子于1985年被发现后因它具有特殊性质,一直是化学家们的热门研究对象。
碳-60分子是科学家发现的,它由60个碳原子组成形似足球的分子,因而又被称为“巴基球”。
在过去的实验中,它表现出与普通形态的碳元素大不相同的物理、化学性质.。
