关于无机与分析化学课件
大学课件无机及分析化学

无机及分析化学概述无机化学研究内容01分析化学研究内容02无机及分析化学的重要性03课程目标与要求课程目标课程要求熟悉无机及分析化学的基本理论和实验技能,了解相关领域的前沿动态,能够运用所学知识解决实际问题。
原子结构与元素周期律原子的核外电子排布、元素周期表的结构与性质递变规律等。
化学键与分子结构离子键、共价键、金属键的形成与特点,分子的极性与空间构型等。
化学反应基本原理化学反应的热力学与动力学基础,化学平衡与反应速率等。
分析化学基础误差与数据处理、滴定分析、重量分析等基本分析方法与原理。
基础知识回顾原子结构模型汤姆生模型卢瑟福模型波尔模型元素周期表与周期律元素周期表将化学元素按照原子序数从小至大排序的化学元素列表。
列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。
周期律元素的性质随着元素原子序数的递增而呈现周期性变化的规律。
非金属性同周期主族元素从左到右逐渐增强,同主族元素从上到下逐渐减弱。
同周期主族元素从左到右逐渐减弱,同主族元素从上到下逐渐增强。
电负性同周期主族元素从左到右逐渐增大,同主族元素从上到下逐渐减小。
原子半径同周期主族元素从左到右逐渐减小,同主族元素从上到下逐电离能原子性质及变化规律离子键的形成离子晶体的特点离子晶体的结构030201共价键的形成通过原子间共用电子对形成共价键。
分子晶体的特点低熔点、硬度小、具有挥发性、导电性差(固态和液态)、溶解性(在水中难溶解,易溶于有机溶剂)。
分子晶体的结构分子晶体中,分子间通过范德华力相互吸引,构成晶体。
金属键的形成金属晶体的特点金属晶体的结构化学反应基本类型及特点合成反应分解反应置换反应复分解反应1 2 3反应速率定义影响反应速率的因素反应速率方程化学反应速率与影响因素化学平衡及移动原理化学平衡定义影响化学平衡的因素分析化学概述及分类方法分析化学定义分析化学分类分析化学的任务滴定分析法原理01滴定分析法的应用举例02滴定分析法的优点03重量分析法原理通过化学反应将被测组分转化为一定的称量形式,然后准确称量该称量形式的重量,从而求得被测组分的含量。
《无机及分析化学》第一章--电解质溶液(比赛课件)

碱有下列电离平衡
NH3·H2O(aq)
NH4+(aq) + OH-(aq)
Kbθ
c c NH
4
OH
cNH 3 H2O
KbΘ是碱电离平衡常数。
注:a. KaΘ、 KbΘ只是温度的函数,一般为常温; b. KaΘ、 KbΘ是水溶液中酸碱强度的量度, 通常KΘ越大相应酸碱的强度越大; HAc > HClO > HCN KaΘ 1.75×10-5 3.9×10-8 6.2×10-10 c. 一般把KΘ≤10-4的电解质称为弱电解质; KΘ=10-2~10-3的电解质称为中强电解质; d. pKaΘ = - lgKaΘ pKaΘ 越大,酸越弱;
③电离平衡常数与电离度的关系
以HA表示一种弱酸,设:浓度为c 、电离度为α
HA
H+ + A-
开始时c: c
平衡时c: c – cα
0
0
cα cα
则有:
K
θ a
cH cA cHA
(cα)2 cα2 c cα 1 α
α 很小时,1 - α≈1,
∴ KaΘ≈c α2
α
K
θ a
K
θ a
aH aAc cHAc
γ c H H γ c Ac Ac cHAc
在弱电解质的溶液中,加入与弱电解质不具有相同 离子的强电解质,使弱电解质的电离度略有增大的 效应称作盐效应。
二、多元弱酸的电离
以H2S水溶液为例:
一级电离: H2S
K
θ a1
c H
cHS
lgγ 0.509 zi21 I I 0.30I
无机及分析化学新精品PPT课件

第* 页
1/1/2021
13
哈佛有一个著名的理论:人的差别在 于业余时间 ,而一个人的命运决定于 晚上8点到10点之间。每晚抽出2个小 时的时间用来阅读、进修、思考或参 加有意义的讨论,你会发现,你的人 生正在发生改变,坚持数年之后,成 功会向你招手。
2021/1/1
14
2021/1/1
15
知识是学不完的,也没 有必要学完,只有在有 意愿、有需求的时候, 真正的学习才会发生。 同时,在一段时期内, 学习的内容必须聚焦, 起码要在一个领域内成 为专家。
2021/1/1
16
学习要像蜜蜂,“采百家花,酿自 己蜜”。而不要像蚂蚁,“只会获取现 存的东西。”或是蜘蛛“只满足于自己 肚子里已有的东西”。采百家花,很重 要的一点就是要多读书。阅读成就伟大 人读生书。与学习能力有着密切的关系,越是 喜学欢习哈读能佛书力大的也学人 越文,强理掌。学握另院的外院知,长识唯W面 有•越阅C广读•K,能irb其培y: 养大凡形有象所思成维就能的力人和,逻在辑他思们维的能一力生相中结,合 的都有认一知个模贪式婪。地阅读大量书籍的时期。
1/1/2021
5
为什么需要学习 2
彼得•圣吉
你唯一持久的竞争优势,就是具备比你的竞争 对手学习得更快的能力!
为什么需 要学习
1/1/2021
韦尔奇
你可以拒绝学习,但你的竞争对手不会!
福特
任何停止学习的人都已经进入老年,无论在20 岁还是80岁;坚持学习则永葆青春。
学者 邱建卫
这个世界上最恐怖的事,就是比我们聪明的人 在比我们更努力地在学习!
植物叶子中的叶绿素有两种
成分。德国H.菲舍尔等经过
多年的努力,弄清了叶绿素
无机及分析化学课件

酸碱反应
酸碱反应是指酸和碱之间的中和 反应,生成盐和水。
沉淀反应
沉淀反应是指溶液中的离子结合 成难溶于水的沉淀,从溶液中析 出的过程。
氧化还原反应
氧化数的概念
氧化数是表示原子或分子氧化态的数 值,用于表示原子或分子在氧化还原 反应中的得失电子数。
氧化还原反应的概念
氧化还原反应是指电子转移的反应, 其中氧化剂获得电子,还原剂失去电 子。
气体为参考态。
化学反应的动力学原理
1 2
反应速率的概念
反应速率是描述化学反应快慢的物理量,单位为 摩尔每升每秒(mol/L·s)。
反应速率方程
反应速率与反应物浓度的关系可以用反应速率方 程来表示。
3
活化能的概念
活化能是表示化学反应速率快慢的物理量,单位 为焦耳每摩尔(J/mol)。
酸碱反应与沉淀反应
04 无机化合物的分类与性质
金属元素及其化合物
金属元素概述
金属元素是具有金属光泽、导电、导热性能良好 的元素,通常在周期表中占据一定的位置。
金属单质
金属单质具有金属键合,表现出良好的导电、导 热和延展性。
金属化合物
金属化合物种类繁多,包括氧化物、硫化物、卤 化物等,具有独特的物理和化学性质。
非金属元素及其化合物
杂化合物。
配合物的结构
02
配合物的结构通常由中心原子或离子和配位体组成,配位体通
过配位键与中心原子或离子结合。
簇合物的结构
03
簇合物是由多个原子或离子通过共价键结合形成的复杂化合物,
具有独特的结构和性质。
05 分析化学简介
分析化学的定义与任务
总结词
分析化学是一门研究物质组成、结构和性质的学科,其任务是通过实验手段获 取物质的化学信息。
无机及分析化学课件(第四版)第一章

根据不同的分类标准,分析化学可以分为多种类型。按分析对象可以分为无机分析和有机分析,这是根据被测物质中是否含有碳元素来划分的。按分析方式可以分为化学分析和仪器分析,前者依赖于化学反应进行定量或定性分析,后者则利用各种精密仪器对物质进行测量。另外,根据待测组分的含量,分析化学可分为常量分析、微量分析和痕量分析。
分子结构
分子由原子通过化学键连接而成,分子的几何构型和成键方式决定了分子的性质。常见的分子结构有共价键、离子键和金属键。
晶体结构
晶体是由原子或分子在空间周期性排列形成的固体,晶体的性质与原子或分子的排列方式密切相关。晶体分为金属晶体、离子晶体、共价晶体和分子晶体等。
分子结构和晶体结构
酸和碱之间的反应称为酸碱反应,反应中质子转移是酸碱反应的本质。酸和碱的相对强弱可以通过电离常数来衡量。
实验数据处理和误差分析
实验安全
01
实验安全是实验过程中的首要问题,需要遵守实验室安全规定,正确使用实验器材和防护用品。
环境保护
02
环境保护是每个实验者应尽的责任,需要合理处理实验废弃物,减少对环境的污染。
实验安全和环境保护的实验实例
03
通过具体的实验实例,如实验室安全规定、废液处理等,来掌握实验安全和环境保护的方法。
04
无机及分析化学实验基础
1
2
3
掌握实验基本操作技术是进行无机及分析化学实验的基础,包括称量、加热、冷却、萃取、蒸发、结晶等操作。
实验基本操作技术
在进行实验基本操作时,需要注意安全、准确、快速、环保等原则,避免误差和事故的发生。
实验基本操作技术的注意事项
通过具体的实验实例,如硫酸铜晶体的制备、碘的萃取等,来掌握实验基本操作技术。
无机与分析化学课件

稳定。
例外:Pt,W
三、核外电子的排布和元素周期系
➢电子的分布
按三原则,利用能级图的填充顺序,写出原子的电子排布式 能级组由低(n,l)至高(n,l)、由左至右的次序填入诸能级。 然后在各轨道符号的右上角用数字表示该轨道上的电子数,没有 填入电子的全空轨道则不必列出。 例如,基态钛原子(Z=22)的电子分布为(右上角数字为填入 的电子数):
周期
短周期(一,二,三) 长周期(四,五,六,七)
•按照各元素原子核外电子排布的顺序排列就形成了元素周期表
族
周
期 IA
0
H 1 氢 IIA
Li Be 2 锂铍
He
s区
p区
IIIA IVA VA VIAVIIA 氦
B C N O F Ne
d区
f区
硼碳 氮氧氟氖
Na Mg 3 钠 镁 IIIB IVB VB VIBVIIB VIII
0
1 ⅡA
Ⅲ A Ⅳ A ⅤA ⅥA Ⅶ A
2
3
Ⅲ B ⅣB ⅤB Ⅵ B Ⅶ B ⅦB ⅠB ⅡB
4 s区
5
ns1-ns2
6
d区 (n-1)d1-8 ns2
ds区 (n-1)d10 ns2
p区 ns2 np1-6
7
镧系
锕系
f 区 (n-2)f1-14 (n-1)d0-1 ns2
例 写出下列各原子序数的电子层构型,并指出元素所在周期 表中的周期、族、元素名称及元素符号。 (1) Z = 18;(2) Z = 24;(3) Z = 29;(4) Z = 80
24Cr:1s22s22p63s23p63d54s1,为第四周期ⅥB族、d区元 素;
29Cu:1s22s22p63s23p63d104s1,为第四周期ⅠB族、ds区元素
《无机与分析化学》课件

无机反应的理论基础
深入探究无机反应的机理和原理,了解离子间的相互作用和电荷转移过程。 掌握这些理论基础,你将能够研究和解释复杂的无机反应。
分析化学的基本概念
学习分析化学的基本原理和方法,包括样品处理、仪器分析和化学计量学。 这些知识将使你能够准确、可靠地测定和分析物质的组成和性质。
《无机与分析化学》PPT 课件
本课程将介绍无机与分析化学的重要概念和应用,包括化合物分类和性质、 反应理论基础、分析方法以及实际应用。准备好迎接化学的奇妙世界吧!
课程介绍
为什么学习无机与分析化学?无机化学是探索元素和化合物之间关系的基础, 而分析化学则让我们能够理解物质的组成与性质。这门课程将带领你进入化 学的奥秘。
常用的分析方法
探索分析化学中的一些常用方法,如光谱学、色谱法和电化学分析。了解它们的原理和应用,让你能够选择适 当的方法来解决实际问题。
无机与分析化学的应用
发现无机与分析化学在现实生活和工业领域中的广泛应用。从环境监测到新 材料研发,化学的力量无处不在。
总结和疑难解答
回顾课程内容并解答学生的疑惑。总结所学知识,帮助学生更好地理解无机与分析化学的关键概念,并准备好 未来的学习和研究。
无机化学及无机分析课件PPT

3.4 平衡状态和标准平衡常数 Equilibrium
and standard equilibrium constant
什么是化学热力学?
Chemical thermodynamics 热力学是研究各种形式能量相互转化时遵循的规律。
Df
H
θ m
(298K)
/ kJ mol1
0.000
+1.987
-17.6
0.000
-241.80
-285.84
-271
-92.31
-36.40
+25.9
-411.15
-287
多数化合物的△fHθ m值<0,说 明由参考状态单质形成化合物 时放热。
由△fHθ m值可判断化合物的相对 稳定性: △fHθ m值负值越大,化 合物越稳定。
4 热和功 (heat and work)
★ 热(Q) 体系与环境之间由于存
在温差而传递的能量。热不 是状态函数。 ★功(W )
体系与环境之间除热之 外以其他形式传递的能量。
环境 热
Q﹥
Q﹤
体系
功不是状态函数。
体积功:
W pex V2 V1
w﹥
w﹤
功
pex DV
前者是指某一具体的物理状态(例如气态、液态或某种 形式的固态),后者则指同时满足特定温度(273.15K)和特定 压力(101.325 kPa)的一种条件。
3 标准摩尔生成焓(standard molar enthalpy of formation )
指在温度T下,由参考状态 单质生成1mol物质B的标准摩 尔焓变。
无机及分析化学[全]ppt课件
![无机及分析化学[全]ppt课件](https://img.taocdn.com/s3/m/9513af63fd0a79563d1e72ad.png)
反渗透膜孔径小至纳米级,在一定的压力下,H2O分子可以通过膜,水中的无机盐、重金属离子、 有机物、胶体、细菌、病毒等杂质无法通过膜,从而使可以透过的纯水和无法透过的浓缩水严格区分
开来。
p
p >
淡水
盐水
48
反渗透法净化水
【例】海水在298K时的渗透压为1479kPa,采用反渗透法制取纯水,试确定用1000cm3的海水通 过只能使水透过的半透膜,提取100cm3的纯水,所需要的最小外加压力是多少?
溶液的凝固点Tf总是低于纯溶剂的凝固点Tf* 。 原因:溶液的蒸气压下降。
36
溶液的凝固点下降的原因:溶液的蒸气压下降。
溶剂 的凝 固点 下降 示意 图
pº (kPa)
p
0.6105
△p
纯水A'
B'溶液
A
B
△Tf
37
Tf Tf*(273K)
373K
T
小结:
溶液的沸点上升和凝固点下降的原因都是溶液的蒸气压下降。而溶液的蒸气压下降服 从拉乌尔定律,那么这两种特性也服从拉乌尔定律与溶液的质量摩尔浓度成正比: △Tb=Kb× b(B) △Tf=Kf× b(B)
38
1.3.1.4 溶液的渗透压
39
渗透作用产生的条件: •半透膜存在; •膜两侧溶液的浓度不相等。
40
半透膜的作用:只许溶剂分子通过,溶质分子不能通过。 初始:溶剂分子扩散速度 V纯水 > V糖水
渗透:溶剂分子通过半透膜自动单向扩散的过程称为渗透。当v纯水 = v糖水渗透停止。 糖水溶液增高的这部分水的静压力就是糖水溶液的渗透压。
10
1.1.9 质量分数
无机及分析化学-PPT课件精选全文

溶液的浓度 0.02080 mol/L
四位有效数字
溶液的浓度 0.10 mol/L
二位有效数字
被测物含量 56.12%
四位有效数字
平衡常数 K=1.8x10
二位有效数字
pH值(注) 12.08
二位有效数字
pH值
5.1
一位有效数字
注:
考虑pH值的有效数字时,因为pH值是氢离子浓度 的负对数,所以pH值的有效数字位数只考虑小数点后 数字个数,小数点前面的数字不是有效数字,因为它实 际上只反映了氢离子浓度的数量级。
化学是一门以实验为基础的科学:Chem-is-try
化学在21世纪焕发着新的青春
20世纪化学的标志性成果 1. 合成氨技术 2.三大合成高分子材料:塑料、橡胶、纤维。 3.药物的发明
化学发展的现状( 21世纪)
化学和其他学科交叉,形成了许多新兴学科:
如地球化学、环境化学、化学生物学、药物化学等 化学已经成为生命、农业、医学、材料、环境等学科 的基础。
(±0.2)+(±0.0002)≈±0.2
所以计算结果的正确表示应为 36.5 。有效数字36.5 正好 与0.2的绝对误差相匹配。
(2)乘除法 例如,以下三个有效数字进行乘除法运算时 0.024×8.156 12.576 =0.015564885…… 因为每个数据的最后一位数字均为可疑数字,若最后一位有1
在有效数字中,数字“0”具有双重意义:(1)作为普通 数字使用,它是有效数字;(2)只起定位作用,它不是有效 数字。
例如,测得以下数据:
试剂的体积 12mL (量筒量取)
二位有效数字
试样的质量 0.6283g (分析天平称取) 四位有效数字
滴定液体积 23.58mL (滴定管读取) 四位有效数字
无机与分析化学ppt课件 第一篇 化学反应原理

解法一:思路,
V(CH4)
n(CH4)RT, p总
需先求出n(CH4a)
19
n(CH4) = x(CH4)·n总
47.0
100m ol= 94.0m ol
47.0+ 2.0+ 0.80+ 0.20
9 4 .0 m o l 8 .3 1 4 k P aL K -1m o l-1 2 9 8 K
➢定压过程:始态、终态压力相等,并且过程中始终保 持这个压力。p1=p2
➢定容过程:始态、终态容积相等,并且过程中始终保 持这个容积。V1=V2
a
37
途径: 系统从始态变为终态所经历的过程总和,被称为途径。
状态函数的特点是: 其变化值只取决于系统的起始状态和终了状态,而与系
统变化所经历的具体途径无关。
p=98.70kPa V=2.50L
298K时,p(H2O)=3.17kPa
Mr (Zn)=6a5.39
15
(98.703.17)kPa2.50L n(H2) = 8.314JK-1mol-1298K
=0.0964mol
Zn(s) + 2HCl ZnCl2 + H2(g)
65.39g
1mol
m(Zn)=?
n =n1+ n2+
p
nRT V
a
10
分压的求解:
pB
nBRT V
p
nRT V
pB p
nB n
xB
pB
nB n
pxBp
x B B的摩尔分数
a
11
例题:某容器中含有NH3、O2 、N2等气 体的混合物。取样分析后,其中
无机及分析化学课件(第四版)

自测题:解释下列现象:
1.海鱼在淡水中会死亡。
【要点】与海水相适应,海鱼体内细胞液的渗透 压高于淡水,将海鱼臵于淡水中后,淡水就会向 海鱼的细胞内渗透,致使细胞肿胀甚至破裂(溶血
现象)。当然水压力等环境的变化,亦应是海鱼难
以在淡水中存活的原因。
2.盐碱地上植物难以生长
【要点】盐碱地中水溶液的渗透压高于植物体内 细胞汁的渗透压,将植物种植在盐碱地后,植物 不能从土壤中吸收水分,反而其细胞内的水分会 向土壤渗透,引起细胞的皱缩,并从悬浮状态中
R = 8.314 Pa· 3· -1· -1 m mol K
= 8.314 kPa· mol-1· -1 L· K
= 8.314 J· -1· -1 mol K
这部分中学计算,训练较多,在此不再赘述。
1.1.2 道尔顿理想气体分压定律
1 分压的概念
组分气体: 理想气体混合物中每一种气体叫做组分气体。
3 电学性质——电泳和电渗
电泳:
在电场中,分散质粒子作定向移动, 称为电泳。
电泳管中:
Fe(OH)3溶胶向负
极移动,说明 Fe(OH)3
溶胶中分散质粒子带
正电荷。
电渗:
胶粒设法固定不动,分散 剂在电场中作定向移动的 现象称为电渗。
电泳和电渗合称为电动现象。
作业
P16 4、5 P17 18(1)(2)(3)
利用超显微镜,可以观察到溶胶粒子的布朗运动, 即不断地作不规则运动。
2 光学性质 ————丁泽尔现象
1869 年,英国物理学家 Tyndall发现: 在暗室中让一束聚光通过溶胶,在与光束 垂直的方向上可以看到一个圆锥形光柱,这种 现象就称为 Tyndall 现象。
Tyndall 现象产生原因:
无机与分析化学 PPT课件
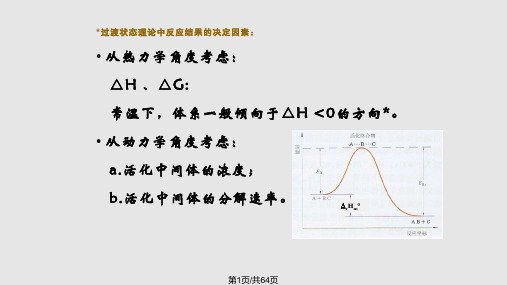
•从动力学的角度来看,决定反应速率 的一步是氮分子在催化剂表面的吸附分 解反应,这一步所需要的活化能相当高, 反应速率慢。 •而催化剂表面的氨的脱附所需要的活化能 很低,因而反应速率快。
第42页/共64页
化学吸附 表面反应
脱附
N2 2(Fe) 2N(Fe) H2 2(Fe) 2H(Fe) N(Fe) H(Fe) NH(Fe) (Fe) NH(Fe) H(Fe) NH2(Fe) (Fe) NH2(Fe) H(Fe) NH3(Fe) (Fe) NH3(Fe) NH3 (Fe)
• 焓减、熵减、体积减少的反应;
*从热力学角度考虑:应高压、低温为佳。
• 但该反应的活化能Ea=326.4kJ.mol-1,反应速率在常温下非常慢,无可操作 性;
• 高压对成本的要求较高,能耗大;
第37页/共64页
有关的热力学数据:
组分
fHm0(kJ.mol-1) 温度S与m氨o(产J率.K之-间1.的m关o系l:-1)
二氧化硫的反应等; • 多相催化:反应物与催化剂不同相,一般催化剂为固相。 *多相催化的过程较复杂,含吸附、反应、解吸等过程;与复杂的吸附机理、
传质速率、反应活性等诸多因素有关。
第30页/共64页
第31页/共64页
催化反应举例:
• 2SO2+O2
2SO3 无催化剂参加的反应,活化能较大;
• 若用NO为催化剂,则上述反应可认为分成下列两个活化能较小、反应速率 较快的反应:
15.3
81.5
86.5
89.9
95.4
98.3
2.2
52
64.2 71
84.2
92.6
0.4
25.1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基本概念
原子价和氧化数:
1. 原子价的概念:
2. 元素原子能够化合或置换1价原子(H)或1价 3. 基团(OH-)的数目。
2.氧化数的概念(Oxidation Number):
1970年,IUPAC 对氧化值作了以下定义: 氧化数是某元素一个原子的荷电数,这种荷电数由假 设把每个键中的电子指定给电负性更大的原子而求得 (电子偏移情况的“形式电荷”数)。 由于化合物中组成元素的电负性不同,原子结合时, 电子对总是要移向电负性大的一方,从而使化合物中 组成元素原子带有正或负电荷,这些所带的形式电荷 就是该原子的氧化数。 氧化数就是化合物中每元素所带的形式电荷,只说明 现象,不一定符合本质。
S2O32-
O -O S O-
S的氧化数为+2, S
+4, (+6) 0, (-2)
• 氧化数是按一定规则指定的形式电荷的数值,它可以是负 数、正数,也可以是分数或零;(原子价一般为整数)
• 在化合物中,某一元素的氧化数是该元素的平均氧化数;
• 需要指出的是氧化数的概念并非人为的形式规定,它是有 实验事实为依据的。例如:实验证实,使1 mol MnO4- 还 原为MnO2 时,需得到 3 mol 电子;而还原为 Mn2+ 时, 需5 mol 电子,它们相应的氧化数变化分别是:(+7) – (+4) = 3 及 (+7) – (+2) = 5。
2MnO4- + 5SO32- + 16H+ + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
即:2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
配平原则:氧化剂和还原剂得失电子数相等
方法要点: 1)根据实验,确定产物、反应物在溶液体系中的存在 形式,写出相应的离子反应式(弱电解质、有机物、气 体以分子式表示) 2)将反应物分成两个半反应,即氧化剂的还原反应和 还原剂的氧化反应 3)按物料、电荷平衡原则配平两个半反应 4)根据得失电子数相等的原则确定各个半反应的系数 5)根据反应条件确定反应的酸碱介质,分别加入H+、 OH-、H2O,使方程配平
运用上述定义时,须遵循以下几条规则:
在离子型化合物中,元素原子的氧化数等于该原子的 离子电荷数; 在共价型化合物中,共用电子对偏向于电负性大的元 素原子后,在两原子中留下的表观电荷数即为它们的 氧化数。 分子或离子的总电荷数等于各元素的氧化数的代数和, 分子的总电荷数为零。
氧化数与电子转移
Fe + Cu2+ = Fe2+ + Cu H2 + 0.5 O2 H 2 O
2个 “e” 的转 移
共价键
“形式电荷” +1 -2 (电子偏移情况的反映)
称为“氧化数”
规则: 化合物中各元素氧化数的代数和为零。 1)单质中,元素的氧化数等于零。(N2 、H2 、O2 等) 2)二元离子化合物中,与元素的电荷数相一致。 NaCl CaF2 +1,-1 +2,-1
3) 共价化合物中,成键电子对偏向电负性大的元素。
氧化还原作用: •氧化还原反应:使某些元素的氧化态发生改变的反应。 其本质是就是电子的得失,(氧化剂与还原剂之间的 反应) •氧化(oxidation):氧化数升高的过程 •还原(reduction):氧化数降低的过程 •氧化剂:氧化数降低的反应物 •还原剂:氧化数升高的反应物 这两种物质相互依存、这两个过程也相互依存,在同 一个反应中同时发生。
且可为分数、零,它只要求化合物的形式电荷为 零即可。
• 原子价只是用于较简单的分子,对于复杂分子,
不知道结构就无法知晓其原子价。而氧化数只是
一种形式电荷,不必知道分子结构。
氧化还原的特征
化学反应分类: 非氧化还原反应:在反应过程中,元素的氧化 数不变,如:酸碱反应、沉淀反应、配合反 应、复分解反应。 氧化还原反应:在反应过程中,反应物与生成 物中有的元素的氧化数发生变化。
O: -2 (H2O 等); -1 (H2O2); -0.5 (KO2 超氧化钾) H: +1, 一般情况; -1, CaH2 、NaH
思考题: 确定氧化数
(1)Na2S2O3
Na2S4O6
+2
+2.5
(2)K2Cr2O7 CrO5
+6
+10
(3)KO2
KO3
-0.5 -1/3
注意:1) 同种元素可有不同的氧化数; 2) 氧化数可为正、负和分数等; 3) 氧化数不一定符合实际元素的电子转移情况。
氧化态:同一元素高氧化态物质称为氧化态 还原态:同一元素低氧化态物质称为还原态
歧化反应:氧化剂与还原剂是同一种物质
同一种元素不同氧化数的两种物质构成的氧化 还原体系,称氧化还原电对。 表示形式:氧化态/还原态 如:Cu2+/Cu, Fe3+/Fe2+,MnO4-/Mn2+……
共轭关系:
氧化态 + ne = 还原态
可见:氧化态与还原态是建立在得失电子的关系上得 电子的物质:氧化数降低、是氧化剂、本身被还原失 电子的物质: 氧化数升高、是还原剂、本身被氧化 氧化还原反应是两个或两个以上氧化还原电对共同作 用的结果,所有的氧化还原反应都可以找到相应的氧 化还原电对。
氧化还原方程式的配平
氧化还原反应方程式的配平 (1)氧化数法(中学学过) (2)离子电子法--本法适用于溶液中的反应
例1:配平酸性介质下KMnO4溶液与Na2SO3的反应 [解] 先写出相应的离子反应式:
MnO4- + SO32- + H+ Mn2+ + SO42写出半反应: SO32- SO42- + 2e (反应物缺氧)
MnO4- + 5e Mn2+ (生成物缺氧) 配平半反应:
SO32- + H2O SO42- + 2H+ + 2e (1) MnO4- + 8H+ + 5e Mn2+ + 4H2O (2) 得失电子数相等:(1) 5 + (2) 2得
• 氧化数反映了元素在化合物中的氧化态,因此氧化数又往 往被称为“氧化态”。
• 引入氧化数是为了利于讨论氧化还原反应。
原子价与氧化数: • 理论基础:原子价——离子键与共价键(共享电
子对的概念、表征形成单键的能力); 氧化数——电负性和现代价键理论;
• 两者之间的联系: 原子价一般不变;而氧化数为形式电荷,可变
