2006年全国高中学生化学竞赛理论试题参考答案
2006年全国高中学生化学竞赛试题含答案及分析
第1题(4分) 2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。
按元素周期系的已知规律,该元素应位于第八周期,它未填满电子的能级应是 5g ,在该能级上有 8 个电子,而这个能级总共可填充 18 个电子。
(各1分)第2题(5分)下列反应在100o C 时能顺利进行:I II2-1 给出两种产物的系统命名。
(4分)2-2 这两种产物互为下列哪一种异构体?(1分)A 旋光异构体B 立体异构体C 非对映异构体D 几何异构体2-1 I (7S ,3Z ,5Z )-3-甲基-7-氘代-3,5-辛二烯或(7S ,3Z ,5Z )-3-甲基-3,5-辛二烯-7-d 或(7S ,3Z ,5Z )-3-甲基-7-2H-3,5-辛二烯(注:只要标出氘的位置即可)(2分)II (7R ,3E ,5Z )-3-甲基-7-氘代-3,5-辛二烯或(7R ,3E ,5Z )-3-甲基-3,5-辛二烯-7-d 或(7R ,3E ,5Z )-3-甲基-7-2H-3,5-辛二烯(注:只要标出氘的位置即可) 用cis-、trans-代替Z -、E -得分相同(下同)(2分) 2-2B (立体异构体)(1分)第3题(8分)下面四张图是用计算机制作的在密闭容器里,在不同条件下进行的异构化反应 X ⇌YX ,“”是Y 。
A B C D3-1 图中的纵坐标表示(填入物理量,下同);横坐标表示。
3-2 平衡常数K 最小的图是。
+3-3 平衡常数K最大的图是。
3-4 平衡常数K=1的图是。
答案:3-1 A和B的摩尔百分数(或答:物质的量的分数或物质的量的百分数);时间,分(或答:以分为单位的反应进程)(2分)3-2A (2分)3-3B (2分)3-4C (2分)第4题(7分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。
有人设计了把我国的菱锰矿(贫矿)转化为高品位“菱锰矿砂”的绿色工艺。
【化学奥赛】晶体结构习题new!
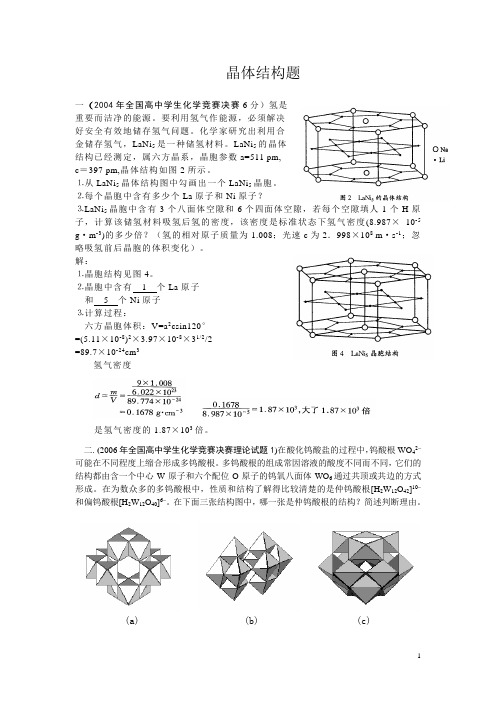
晶体结构题一(2004年全国高中学生化学竞赛决赛6分)氢是重要而洁净的能源。
要利用氢气作能源,必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气,LaNi5是一种储氢材料。
LaNi5的晶体结构已经测定,属六方晶系,晶胞参数a=511 pm,c=397 pm,晶体结构如图2所示。
⒈从LaNi5晶体结构图中勾画出一个LaNi5晶胞。
⒉每个晶胞中含有多少个La原子和Ni原子?⒊LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填人1个H原子,计算该储氢材料吸氢后氢的密度,该密度是标准状态下氢气密度(8.987×10-5 g·m-3)的多少倍?(氢的相对原子质量为1.008;光速c为2.998×108 m·s-1;忽略吸氢前后晶胞的体积变化)。
解:⒈晶胞结构见图4。
⒉晶胞中含有1个La原子和5个Ni原子⒊计算过程:六方晶胞体积:V=a2csin120°=(5.11×10-8)2×3.97×10-8×31/2/2=89.7×10-24cm3氢气密度是氢气密度的1.87×103倍。
二. (2006年全国高中学生化学竞赛决赛理论试题1)在酸化钨酸盐的过程中,钨酸根WO42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O原子的钨氧八面体WO6通过共顶或共边的方式形成。
在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2W12O40]6-。
在下面三张结构图中,哪一张是仲钨酸根的结构?简述判断理由。
(a) (b) (c)解:提示:考察八面体的投影图,可以得到更清楚地认识。
三.(2006年全国高中学生化学竞赛决赛理论试题4)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
2006-2007年度全国高中学生化学竞赛初试(河北赛区)化学试题及答案

2006-2007年度全国高中学生化学竞赛初试(河北赛区)化 学 试 题可能用到的相对原子质量:H:1 B :11 C:12 N :14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 K:39 Cu:64 Zn :65 Ba:137一、选择题(本题共10小题,每小题1分,共10分,)每小题只有一个选项符合题意,请将符合题意的选项的编号A 、B 、C 、D 填入答栏内。
1.在两种短周期元素组成的化合物中,若它们的原子个数之比为1:3,设这两种元素的原子序数分别为a 和b ,则下列对a 和b 可能的关系概括得最完全的是:①a=b+4 ②a+b=8 ③a+b=30 ④a=b+8A .只有②③B .只有②③④C .吸有③④D .①②③④2.最近,媒体报道不法商贩销售“致癌大米”,已验证这种大米中含有黄曲霉素(AFTB ),其分子结构式如图所示。
人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。
一般条件下跟1molAFTB 起反应的H 2或NaOH 的最大量分别是A .5mol ;1molB .5mol ;2molC .6mol ;1molD .6mol ;2mol3.某有机物的结构简式为:,可发生反应的类型组合:①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚 A .①②③⑤⑥ B .②③④⑥⑧ C .①②③⑤⑥⑦ D .③④⑤⑥⑦⑧4.往蓝色的CuSO 4溶液中逐滴加入KI 溶液可以观察到产生白色沉淀X 和生成含有Y 物质的棕色溶液。
再向反应后的混合物中不断通入SO 2气体,并加热,又发现白色沉淀显著增多,溶液逐渐变成无色。
则下列分析推理中错误的是 A .白色沉淀X 可能是CuI 2,Y 可能是I 2 B .白色沉淀X 可能是CuI ,Y 可能是I 2C .上述实验条件下,物质的氧化性:Cu 2+>I 2>SO 42-D .上述实验条件下,物质的还原性:SO 2 >I ->Cu +5.在一定条件下,当64gSO 2气体被氧化成SO 3气体时,共放出热量98.3kJ 。
2006年全国高中学生化学竞赛初赛模拟试卷.doc

2006年全国高中学生化学竞赛初赛模拟试卷.doc2006年全国高中学生第一题(9分):用α粒子长时间轰击镀有253Es的金箔,即可得到以化学家门捷列夫命名的元素Md的含155个中子的同位素。
它发生β衰变后的产物被检出,从而证明了它的存在。
1.写出以上两个核反应的方程式2.Md的这个同位素半衰期为76min,初始时刻如果此放射源的衰变速率为1×1010Bq,则1天之后时,放射源中Md的衰变速率为多少?第二题:(8分)单质砷曾被认为是德国的AlbertusMagnus最先制得的,而J.Schroder于1649年刊行的药典上则更详细的记述了用木炭粉和砒霜共热以及用氧化钙与雄黄共热制单质砷的两种方法。
但孙思邈的《太清丹经》中曾记载“雄黄十两,末之,锡三两,铛中合熔,出之……其色似金”,大意为,将雄黄磨成粉,和锡一起熔融,最后得到金色的物质。
孙思邈利用这一反应成功制得了砷单质,这比AlbertusMagnus早了500多年。
试写出并配平以上三个反应的化学方程式第三题:(9分)在各种元素的单质中,硼的结构的复杂性仅次于硫,已知的同素异形体有16种之多。
其中的一种同素异形体含有下图所示的结构单位:附注:图a中为变于观察,将部分硼原子涂成黑色,黑、白色的均为硼原子其中a分为内、中、外三层,外层为一个大的“削角二十面体”构成,内层为一个小的正二十面体,而中层可以看作是内层的小正二十面体的各顶点向外延伸得到的,中层的硼原子同时与构成外层的五元环相连接,将内外层连结起来。
这种硼单质的晶胞为三方晶系,中心为1个硼原子,a位于顶点,三重对称轴通过a的中心贯穿两个相对的六元环,沿着晶胞对角线的方向(即三重轴的方向)以a-b-硼原子-b-a的顺序连接。
1.以表示a,以表示b,以表示单独的硼原子,画出该此种硼单质晶胞的示意图。
2.每个晶胞中含____个硼原子3.试猜测相邻的a之间是以何种方式相连接的?第四题:(14分)冰片,结构式如右图,最初从龙脑树中提炼而成。
2006年全国高中学生化学竞赛理论试题参考答案

2006年全国高中学生化学竞赛理论试题参考答案
上海化学化工学会;复旦大学化学系
【期刊名称】《化学教育》
【年(卷),期】2006(27)4
【总页数】4页(P62-65)
【作者】上海化学化工学会;复旦大学化学系
【作者单位】上海化学化工学会;复旦大学化学系
【正文语种】中文
【中图分类】O
【相关文献】
1.中国化学会第22届全国高中学生化学竞赛(决赛)理论试题 [J],
2.中国化学会第22届全国高中学生化学竞赛(决赛)理论试题参考答案 [J],
3.2006年全国高中学生化学竞赛理论试题 [J], 上海化学化工学会;复旦大学化学系
4.2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准 [J],
5.2003年全国高中学生化学竞赛决赛理论试题参考答案 [J], 武汉大学化学学院;湖北省化学化工学会命题组
因版权原因,仅展示原文概要,查看原文内容请购买。
2006年全国高中学生化学竞赛理论试题参考答案

・62・化学教育2006年第4期2006年全国高中学生化学竞赛理论试题参考答案上海化学化工学会复旦大学化学系第1题l一1.A:Na2W()^;B:H2W04或w03・H20;C:W03(1)4FeW04(s)+8NaoH(1)+02(g)一4Na2W04(1)+2F。
203(s)+4H20(g)2MnW04(s)+4NaoH(1)+02(g)一2Na2W04(1)+2Mn02(s)+2H20(g)(产物写成Mn20。
或Mn304也可)(2)Na2W()a(aq)+2HCl(aq)——H2W04(s)+2NaCl(aq)(3)H2W04(s)一W03(s)+H20(g)1—2.[1]2w0。
(s)+3c(石墨)——2w(s)+3c02(g)[2]反应在298.15K时的标准焓变、标准熵变和标准自由能变化分别为:△H8一乏u△fH未一[2×o+3×(一393.51)一2×(一842.87)一3×o]kJ/mol一505.21l【J/mol△S9一∑uS。
一r2×32。
64+3×213。
64—2×75。
90一3×5.74]J・mol-1・K1—537.18J・m011・K1△G。
一△H。
一丁△S8一[505.21—298.15×537.18/loOo]kJ/mol一345.05kJ/mol298.15K时反应的标准自由能变化是正值,说明此反应不能在该温度下自发进行。
当温度T>[505.21×1000/537.18]K一940.49K时,反应才有可能发生。
1—3.因为钨的熔点很高。
不容易转变为液态。
如果用碳做还原剂,混杂在金属中的碳不易除去,而且碳会在高温下和金属钨反应形成碳化钨(wc,w:C),不容易获得纯的金属钨。
用氢气作还原剂就不存在这些问题。
方程式为:w03(s)+3H2(g)——w(s)+3H20(g)l一4.(a)仲钨酸根[H:w。
19098-2006年全国化学竞赛初赛模拟试卷和答案6
bb 霜|BB 霜|BB 霜排行榜|美宝莲 BB 霜|好用的 BB 霜|什么牌子的 BB 霜好|韩国 BB 霜|露韩饰 BB 霜|BB 霜 是什么|什么牌子的 BB 霜好用|BB 霜怎么用|什么是 BB 霜|pba 柔肤全效 BB 霜|BB 霜的作用|最好的 BB 霜| 谜尚 BB 霜|
O
O
O
CH3O
CHO
CH3 O
A
CH3NH
B
HOAc
O
H3C N
O C H+ D CH3NH2 E LiAlH4 O
H +/H 2 O F OH O
试写出 A-F 的结构式及最后一步所涉及的立体化学并标出 R、S 构型。
薇姿 BB 霜|迷尚 BB 霜|欧莱雅 BB 霜|哪款 BB 霜好用|男士 BB 霜|BB 霜什么牌子好|BB 霜推荐|梦妆 BB 霜| 丹姿 BB 霜|屈臣氏 BB 霜|美丽加芬 BB 霜|美宝莲 BB 霜怎么样|
2006年全国化学竞赛初赛模拟试卷和答案6竭诚为大家提供论文教育英语it建筑法律通信经济贸易财会管理人力资源机械医学心理学考试金融证券文学历史等精品资料
bb 霜|BB 霜|BB 霜排行榜|美宝莲 BB 霜|好用的 BB 霜|什么牌子的 BB 霜好|韩国 BB 霜|露韩饰 BB 霜|BB 霜 是什么|什么牌子的 BB 霜好用|BB 霜怎么用|什么是 BB 霜|pba 柔肤全效 BB 霜|BB 霜的作用|最好的 BB 霜| 谜尚 BB 霜|
第六题: (5 分) 电解熔融 KCl 易发生爆炸,其原因是在阴极生成中间产物 A,A 再与阴极另一产物反应 发生爆炸。已知 A 为红色顺磁性物质,A 与水作用有过氧化氢生成,求: 阳极反应: 阴极反应:
2006年高二化学竞赛试题

2006年高二化学竞赛试题相对原子质量:H 1 O 16 C 12 N 14 Fe 56 Cu 64 Zn 65第Ⅰ卷(共54分)一、选择题(本题包括24小题,1—12每小题2分,12—22每小题3分,共54分,每小题只有一个....选项符合题意)1、下列说法均摘自某科普杂志,你认为无科学性错误的是()A、铅笔芯的原料是金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒B、一氧化碳有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收一氧化碳,防止煤气中毒C、“汽水”浇灌植物有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用D、纯净水不含任何化学物质2、下列各组混合气体分别通如水中,其中一种气体消失另一种气体体积增大的是()A、HCl、CO2B、HCl、F2C、NO、NO2D、H2S、SO23、“绿色化学”越来越受到人们的重视,下列可以看作绿色氧化剂的是()A.浓盐酸B.双氧水C.硝酸D.氯水4、25℃时某溶液中由水电离出的c(OH-)为1×10-11mol/L,则该溶液的PH可能等于()①11 ②8 ③7 ④3A.①④B.①②C.①③D.②③5、在3NO2+H2O 2HNO3+NO平衡体系中通入O2,则化学平衡()A.不移动B.向生成HNO3的方向移动C.最终向生成NO2的方向移动D.移动方向视通入O2的量而定6、2004年美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是()A.硫化羰在氧气中完全燃烧后的产物是CO2和SO2B.硫化羰可用作灭火剂s c oC.硫化羰的电子式为:D.硫化羰是非极性分子7、据报道,科学家已成功合成了少量N4,有关的说法正确的是A N4是N2的同素异形体B N4是N2的同分异构体C 相同质量的N4和N2所含原子个数比为1∶2D N4的摩尔质量是56 g8、下列实验操作正确的是A.将氢氧化钠固体放在滤纸上称量B.用10mL量筒量取8.58mL蒸馏水C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集D.配制氯化铁溶液时,将一定量氧化铁溶解在较浓的盐酸中,再用水稀释到所需浓度H CCC C H HH 9、 Ba(OH)2溶液滴入明矾溶液中,使SO 42ˉ全部转化成BaSO 4沉淀,此时铝元素的主要存在形式是 ( ) A 、Al 3+B 、Al(OH)3C 、AlO 2ˉD 、Al 3+和Al(OH)310、有M 、R 两种主族元素,已知M 2-离子与R +离子核外电子数之和为20,则下列说法不正确的是( )A 、M 与R 的质子数之和一定等于19B 、M 、R 可能分别处于第二周期和第三周期C 、M 、R 可能分别处于第三周期和第二周期D 、M 和R 的质子数之差可能等于711、下列说法正确的是 ( )A 、难失去电子的原子,易形成阴离子B 、单质分子中不存在化学键,化合物的分子才存在化学键C 、含有金属元素的离子不一定是阳离子D 、由不同种原子所形成的纯净物一定是化合物12、对某酸性溶液(可能含有Br -,SO 42-,H 2SO 3,NH 4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl 2溶液时,产生的白色沉淀不溶于稀硝酸 对于下列物质不能确认其在溶液中是否存在的是 ( ) A 、Br -B 、SO 42-C 、H 2SO 3D 、NH 4+13、阿伏加德罗常数约为6.02×1023 mol —1,下列叙述中正确的是A .常温常压下,18.0 g 重水(D 2O)所含的电子数约为10×6.02×1023B .室温下,42.0 g 乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023C .标准状况下,22.4 L 甲苯所含的分子数约为6.02×1023D .标准状况下,a L 甲烷和乙烷混合气体中的分子数约为4.22a×6.02×1023 14、一种有机物的化学式为C 4H 4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的卤代烃的种类共有( )A .2B .4C .5D .615、叠氮酸 HN 3 与醋酸酸性相似,下列叙述中错误的是A. HN 3水溶液中微粒浓度大小顺序为:c HN 3 >c H + >c -3N >c OHB. HN 3与NH 3作用生成的叠氮酸铵是共价化合物C. NaN 3水溶液中离子浓度大小顺序为:c Na + >c -3N >c OH>c H +N与CO2含相等电子数D. -316、对于某些离子的检验及结论一定正确的是A 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有-23COB 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有-24SOC 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有D 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+17、下列离子反应方程式正确的是()A.用碳酸钠溶液吸收少量二氧化硫气体:2CO32-+SO2+H2O ==2HCO3-+SO32-B.二氧化硫气体通入到过量Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClOC.在亚硫酸氢铵稀溶液中加入足量的氢氧化钠稀溶液+H++2OH NH3·H2O+H2ONH+4D.KHS的水解:HS-+HO H3O ++S2-18、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是()A.2Na218O2 + 2H2O == 4Na l8OH + O2↑B.2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑+ 8H2OC.NH4Cl + 2H2O NH3·2H2O + HClD.K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O19、下列各组离子一定能大量共存的是()A.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN—B.在强碱溶液中:Na+、K+、AlO2—、CO32—C.在C(H+)=10—13mol/L的溶液中:NH4+、Al3+、SO42—、NO3—D.在pH=1的溶液中:K+、Fe2+、Cl—、NO3—20、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
2006全国化学竞赛初赛题

1。
化合物A含硫(每个分子只含1个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1 mol/L的试剂,现象如下:①加入硝酸和硝酸银,产生微黄色沉淀。
②加入硝酸钡,无沉淀产生。
③用氨水将溶液调至pH=7,然后加入硝酸钙,无现象发生.④溶液经酸化后加入高锰酸钾,紫色褪去,再加入硝酸钡,产生白色沉淀。
⑤加入硝酸铜,无沉淀。
1.①、②、③的目的是为了检出什么离子?试分别写出欲检出离子的化学式。
2.写出④发生的反应的离子方程式。
3.⑤的欲测物质是什么?写出欲测物质与加入试剂的离子方程式。
4.以上测试结果表明A可能是什么物质?写出A的化学式。
5.称取7。
190g A溶于水稀释至250.0cm3。
取25.00cm3溶液加入HNO3和足量的AgNO3,使沉淀完全,沉淀经洗涤、干燥后称重,为1.452g。
写出A的化学式.6.写出A与水的反应的方程式.若你未在回答以上问题时得到A的化学式,请用SO2ClF代替A.2.1998年,中国科大的化学家把CCl4(l)和Na混合放入真空容器中,再置于高压容器中逐渐加热,可得一些固体颗粒.经X-射线研究发现:该固体颗粒实际由A和B两种物质组成,其中A含量较少,B含量较多。
试回答下列问题: 1.CCl4和Na为何要放在真空容器中?随后为何要置于高压容器中?2.指出CCl4分子的结构特点和碳原子的杂化态。
3.上述实验的理论依据是什么?请从化学反应的角度加以说明。
4.试确定A、B各为何物?A、B之间有何关系?5.写出上述反应方程式,并从热力学的角度说明A为何含量较少,B为何含量较多?6.请你从纯理论的角度说明:采取什么措施后,A的含量将大幅度增多?7.请评述一下上述实验有何应用前景?3.某一简易保健用品,由一个产气瓶、A剂、B剂组成,使用时,将A剂放入产气瓶中,加入水,无明显现象发生,再加入B 剂,则产生大量的气体供保健之用。
2006年全国高中学生化学竞赛初赛模拟试卷答案

H3C CH3
O
MgBr
+
CH4
(2 分, 不必给机理)
用位阻小的 CH3Li 可以避免。 (2 分) (三) 格氏盐 ROMgX 是胶体(1 分) ,加酸聚沉(1 分) ,加入过量的酸后沉淀溶解,并 发生水解反应(1 分) 。 *E 与 DMF 的反应大纲不要求,但是从合成路线逆看 F 是羰基化合物,二 E 中已 有 2 种 H,所以 A 应该含有两个对称的 E 烷基,又根据双键的提示,可以大胆判 断 F 的结构。 九、(10 分)
O O
A
乙酰乙酸乙酯
(0.5 分)
O
H3C
O
CH3(1
分)
B C
脲 乙醛
O
(0.5 分) (0.5 分)
O
H2N
NH2(1
分)
CH 3CHO (1 分)
O O O
H3C
O
CH3
+
H3 C H
- H2O
H3C O CH3
1 ○
H3C
(脑文格反应)
O O O O O
+
H3C O CH3 H2N NH2 H3C O CH3
CH3 CH3 H3C
CH3 CH3 CH3 O
(一) A
CH3
O
B
CH3
化学岛——
第 5 页 共 6 页
2006 年全国高中学生化学竞赛初赛模拟试卷答案
命题人:刘允
CH3 CH3
CH3 CHO
CH3 PPh3
O O CH3(B、D1 分,A、
C
CH3
D
我爱奥赛网2006年第一届我爱奥赛杯高中化学网络联赛试题及答案

我爱奥赛网2006年第一届“我爱奥赛杯”高中化学竞赛试题 (2006年5月6日 9:00 - 12:00共计3小时)● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 姓名、考号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 请将答案写在指定的位置。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh P d Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir P t Au Hg Tl P b Bi P o At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt 第1题(4分) 1、23992U 经过连续衰变直到20782Pb,期间经过 次α衰变, 次β衰变。
2006全国高中学生化学竞赛(江苏省赛区)选拔赛试题及答案

2006年全国高中学生化学竞赛(江苏省赛区)夏令营选拔赛试题(2005年7月15日 8:30—11:30 共计3小时)● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 所有解答必须写在指定位置,不得用铅笔填写。
● 姓名、准考证号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
第1题(9分)1-1 元素周期表是20世纪科学技术发展的重要理论依据之一。
假设NH 4+是“元素”NH 4的阳离子,则“元素” NH 4在周期表中的位置应该是 ;“元素” NH 4的单质常温常压下应为(填“高”或“低”)熔点 (填“固”、“液”或“气”)体, (填“能”或“不能”)导电;NH 4的碳酸盐应 (填“易”或“不易”)溶于水。
1-2 放射性元素的发现19世纪末20世纪初物理学发生巨大变革的基础。
最早发现的具有放射性的元素是铀,铀也是核电厂的燃料。
U 23592是自然界存在的易于发生裂变的唯一核素。
U23592吸收一个中子发生核裂变可得到Ba 142和Kr 91,或I 135和Y 97等。
请写出上述核反应方程式:1-3 利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。
下图是国外正在研究中的一种流程(碘—硫法),其中用了过量的碘。
请写出反应①②③的化学方程式并注明条件:反应① 反应② 反应③ 上述流程中循环使用的物质是 。
第2题(12分)2-1 人的牙齿表面有一层釉质,其组成为羟基磷灰石Ca 10(OH)2(PO 4)6(K SP =3.8×10-37)。
为防止龋齿的产生,人们常常使用含氟牙膏,牙膏中的氟化钙可使羟基磷灰石转化为氟磷灰石Ca 10F 2(PO 4)6(K SP =1.0×10-37)。
写出羟基磷灰石与牙膏中的F -反应转化为氟磷灰石的离子方程式,并通过计算其转化反应的平衡常数说明哪种物质更稳定。
2006年中国化学会第20届全国高中学生化学竞赛(省级赛区)试题及答案和评分标准

中国化学会第20届全国高中学生化学竞赛(省级赛区)试题1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te IHf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po AtAc-LrHLi Be B C N O FNa Mg Al Si P ClSK Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se BrRbCsFrSrBaRaYLa Lu-6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNeArKrXeRn相对原子质量Rf Db Sg Bh Hs Mt第1题(4分)2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。
按元素周期系的已知规律,该元素应位于第周期,它未填满电子的能级应是,在该能级上有个电子,而这个能级总共可填充个电子。
(各1分)第2题(5分)下列反应在100o C时能顺利进行:DHMeHHMe EtHMe EtHHHHD Me+Et MeHHHDH MeI II2-1 给出两种产物的系统命名。
(4分)2-2 这两种产物互为下列哪一种异构体?(1分)A旋光异构体B立体异构体C非对映异构体D几何异构体第3题(8分)下面四张图是用计算机制作的在密闭容器里,在不同条件下进行的异构化反应X⇌Y 的X,“Y。
2006全国高中生化学竞赛决赛试题及答案

2006年全国高中学生化学竞赛决赛理论试题2006年1月7日上海●竞赛时间4.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试题和答卷纸装入信封,放在桌面上,听到指令后方可撤离考场。
●试卷和答卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定位置的方框内,答在试题纸上一律无效。
●用黑色墨水笔或黑色圆珠笔答题。
不得携带任何其他纸张进入考场。
需要额外的答卷纸或草稿纸时可举手向监考老师索取。
在答卷纸页眉自填总页数和页码。
●必须在试题首页左边和每页答卷纸左边指定位置填写营号及姓名,否则按废卷论。
●允许使用非编程计算器以及直尺等文具。
不得携带铅笔盒、通讯工具入场。
第1题(9分)钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨(VI)酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4。
黑钨矿传统冶炼工艺的第一阶段是碱熔法:黑钨矿A)浓盐酸(2)滤液沉淀B焙烧产品C其中A、B、C都是钨的化合物。
1-1. 写出上述流程中A、B、C的化学式,以及步骤⑴、⑵、⑶中发生反应的化学方程式。
1-2.钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。
对钨的纯度要求不高时,可用碳作还原剂。
[1] 写出用碳还原氧化钨制取金属钨的化学方程式。
[2] 用下表所给的298.15K的数据计算上述反应的标准自由能变化,推出该反应在什么温度条件下能自发进行。
(假设表中数据不随温度变化)1-3. 为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么?写出用氢气还原氧化钨的化学方程式。
1-4. 在酸化钨酸盐的过程中,钨酸根WO42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O原子的钨氧八面体WO6通过共顶或共边的方式形成。
2006年全国高中化学竞赛江苏省预赛试题及答案资料

“南京工业大学杯”2006年全国高中学生化学竞赛(江苏赛区)预赛试题相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 K:39 Ca:40 Ti:48 Cr:52 Cu:64Ag:108 I:127 Ba:137 La:139题号四五总分得分1.本试卷共26题,用2小时完成,全卷共150分;2.可使用计算器。
一、选择题(每小题有1~2个选项符合题意;每小题4分,共15题,共60分)1.化学知识广泛应用于生产、生活中,下列相关说法不正确的是 ( )A.食用松花蛋时蘸些食醋可以去除氨的气味B.棉花和木材的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质C.只用淀粉溶液即可检验食盐是否为加碘盐D.液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰2.汽车尾气是城市主要污染源之一,正在推广使用的Pt—Rh—CuO—Cr203一A1203(氧化铝为载体)是较理想的高效催化剂,用其制成的汽车尾气催化转化净化器,能将80%以上有害尾气转化为无毒气体。
下列说法错误的是 ( )A.汽车尾气中通常含烃类、CO、NO与SO2等B.此方法的缺点是由于CO:的增多,会大大地提高空气的酸度c.用CuO做催化剂时发生的反应可能为:CO+CuO=C02+Cu,2NO+2Cu=N2+2CuOD.汽油中的防震剂Pb(C2H5)。
大大降低有害气体转化速率的现象叫作催化剂中毒3.俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。
这4个原子在生成数微秒后衰变成第113号元素。
前者的一种核素为288115X。
下列有关叙述正确的是( )A.115号元素衰变成113号元素是物理变化B.核素288115X的中子数为173c.113号元素最高正价应为+3D.115号与113号元素的原子质量比为115:1134.2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。
2006年全国高中学生化学竞赛(陕西赛区)初赛试题及解答

2006年全国高中学生化学竞赛(陕西赛区)初赛试题一、(8分)1.-5℃时,高氙酸钠(Na4XeO6)能跟浓硫酸反应生成XeO4气体。
XeO4极不稳定,固体在-40℃时也可能发生爆炸生成氙气和氧气。
请分别写出这两个反应的化学方程式。
2.Xe的原子序数为54,Xe核外M层和N层的电子数分别为和。
3.高氙酸钠(Na4XeO6)用于分析锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn2+氧化成MnO4-,生成XeO3。
高氙酸钠在水溶液中已发生了如下反应:Na4XeO6 + H2O =NaOH + Na3HXeO6请写出高氙酸钠溶液和硫酸锰的硫酸溶液反应的离子方程式:,若有1mol Na4XeO6参加反应,转移电子 mol。
二、(10分)X、Y、Z三种短周期元素,它们的原子序数之和为16。
X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少一个,B、C两种分子中的电子数均为10。
1.X元素在周期表中的位置是周期族。
2.分析同主族元素性质的递变规律,发现B、C物质的沸点反常,这是因为它们的分子之间存在。
3.(1)C的电子式是,C分子的结构是型。
(2)C在一定条件下反应生成A的化学方程式是:。
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。
该盐的pH 7(填“大于”、“小于”或“等于”),其原因是(写出离子方程式):。
三、(8分)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验,以确定有乙烯和二氧化硫气体生成。
1.甲、乙、丙、丁装置盛放的试剂是(将所选的序号填入下列空格内):甲;乙;丙;丁A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性K2MnO4溶液2.能说明二氧化硫气体存在的现象是。
3.使用装置乙的目的是。
4.使用装置丙的目的是。
5.确证含有乙烯的现象是。
1993-2006年全国化学竞赛有关元素周期表的试题及答案解析

1993-2006年有关元素周期表的试题及答案解析2006年第1题(4分)2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。
按元素周期系的已知规律,该元素应位于第八周期,它未填满电子的能级应是5g ,在该能级上有6 个电子,而这个能级总共可填充18 个电子。
(各1分)2004年第1题(4分)2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X和Y。
X是用高能48Ca撞击24393Am 靶得到的。
经过100微秒,X发生α-衰变,得到Y。
然后Y连续发生4次α-衰变,转变为质量数为268的第105号元素Db的同位素。
以X和Y的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X和Y的核反应方程式。
【答案】Am24395+4820Ca=288115+3n(2分,不写3n不得分。
答291115不得分。
)288115=284113+4He(2分,质量数错误不得分。
4He也可用符号α。
(答下式不计分:284113-44He=268105或268105Db)2003第3题(5分)在正确选项上圈圈。
1.下列化学键中碳的正电性最强的是A.C-F B.C一O C.C-Si D.C-Cl2.电子构型为[Xe]4f145d76s2的元素是A.稀有气体B.过渡元素C.主族元素D.稀土元素3.下列离子中最外层电子数为8的是A.Ga3+B.Ti4+C.Cu+D.Li+1.A 2.B 3.B2003第4题(8分)在30℃以下,将过氧化氢加到硼酸和氢氧化钠的混合溶液中,析出一种无色晶体X。
组成分析证实,该晶体的质量组成为Na 14.90%,B 7.03%,H 5.24%。
加热X,得无色晶体Y。
Y含Na 23.0%,是一种温和的氧化剂,常温下在干燥空气里稳定,但在潮湿热空气中分解放氧,广泛用作洗涤剂、牙膏、织物漂白剂和美发产品,也用于有机合成。
结构分析证实X和Y的晶体中有同一种阴离子Z2-,该离子中硼原子的化学环境相同,而氧原子却有两种成健方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K
sp, Mg ( OH) 2 4 w
K K a2
3 a1
K sp, CaC O3 K
- 6 - 12
=
- 7 3 - 11
5. 50 # 10
10 - 4 # ( 0. 100 # 2) 2 # 5. 61 # 10- 11 = 0. 105 mol/ L 4. 96 # 10- 9 # 4. 30 # 10- 7 0. 105 p CO 2 % # 100= 306 kP a 故 CO2 压力 应控 制在 0. 0343 223 kPa % p C O2 % 306 kP a 4- 5. 轻质碳 酸镁的化学式 : 3M gCO3 M g ( OH ) 2 3H 2 O
O H OH
( 5) H 4 P 2 O6 + H 2 O
( 6) 2 P + 4 N aClO + 2 N aO H ( 7) 通过 H 型阳离子交换树脂 图 ( b) : 结构应含 10 个钨氧 八面 体 , 它们的 氧原 子通过 共顶共边排列成 1 ∃ 4 ∃ 9 ∃ 4 ∃ 9 ∃ 4 ∃ 1 的 层状结 构。共有 氧原子 1+ 4+ 9+ 4+ 9+ 4+ 1= 32 个。因 钨氧八 面体不足 12 个 , 图 ( b) 不会是仲钨酸根的 结构 , 而是十 钨酸根 W10 O432 的结构。
1 3 3
第1题
1- 1. A : N a2 WO 4 ; 4F eW O4 ( s) + 8N aOH ( l) + O2 ( g) + 2F e2 O 3 ( s) + 4H 2 O ( g ) 2M nWO 4 ( s) + 4N aOH ( l) + O2 ( g ) ! Na2 W O4 ( aq) + 2H Cl( aq) ( aq) ∀ H 2 W O4 ( s) WO 3 ( s) + H 2 O( g) 2W ( s) + 3CO2 ( g) 1- 2. [ 1] 2WO 3 ( s) + 3C( 石墨 ) 由能变化分别为 : H = S = # 5. 74] J G =
63
+ 6H + 4H
+
+
2M n Mn
2+
2+
+ 2CO 2 + 3H 2 O
[ CO23 ] =
24
+ 2CO2 + 2H 2 O
2+
或 M n 2 O 3 + H 2 C 2 O4 + 4H
+
2M n + 2CO2 + 3H 2 O M n 2+ + 2CO 2 + 2H 2 O 2M nSO 4 + 2CO2 + 3H 2 O M nSO4 + 2CO 2 + 2H 2 O 2M n 2+ + 10CO2 + 8H 2 O 2M n 2+ + 10CO 2 + 8H 2 O 2M nSO4 + K2 SO 4 +
f
+ 2M nO2 ( s) + 2H 2 O( g) ( 产物写 成 M n2 O3 或 M n 3 O4 也可 ) H 2 W O4 ( s) + 2NaCl
[ 2] 反应在 298. 15K 时 的标准 焓变、 标准熵 变和 标准自 H m = [ 2 # 0+ 3 # ( - 393. 51) - 2 #
解上述联立方程得 : x = 0 . 20; y = 0. 80 所以蓝 色 氧 化 钨 中 五 价 和 六 价 钨 的 原 子 数 之 比 为 : nW( V) / nW( VI) = x / y= 0. 20/ 0. 80 = 1 / 4 = 0. 25
第2题
O ( 1) H O P O P OH ( 2) H O O P H O ( 3) 或 ( 4) HO P OH O H P OH O O P OH H 3 PO 4 + H 3 P O3 N a2 H 2 P2 O 6 + 4 N aCl H O O P OH OH ( 4) 或 ( 3) O O P OH OH
62
化
学
教
育
2006 年第 4 期
化学 奥林匹克
2006 年全国高中学生化学竞赛理论试题参考答案
上海化学化工学会 复旦大学化学系
图 ( c) 图中有 12 个钨氧八面体 , 形成 了 4 个有 3 个八面 B: H 2 W O4 或 W O3 H 2 O; C: WO 3 4N a2 W O4 ( l) 2Na2 WO 4 ( l) 体共顶又共 3 条边的 W3 O 13 单元 , 每个 W3 O 13 单 元的外侧面 有 6 个氧原子 , 内侧面有 7 个氧原 子。 4 个 W3 O 13 单 元又通 过共 用内侧面周边的氧原子形成四面体结 构 , 四 面体的每条 边上共用 2 个氧原子 , 6 条边共用氧原子为 12 个。所以氧原 子总数为 4 # 13- 12= 40 个 , 图 ( c) 应当 是偏钨 酸根 [ H 2 W12 O40 ] 6- 的结构。 1- 5. [ 1] 已知蓝色氧化 钨中钨的质量分数为 0. 7985; 氧的 质量分数即为 1- 0. 7985= 0. 2015 1. 000g 化合物中含钨原子和氧原子的量分别为 : nW = 0. 7985/ 183. 84= 4. 343 # 10n O = 0. 2015/ 16. 00= 12. 59 # 10∃ 12. 59 # 10 - 3 = 1 ∃ 2. 90 即在化学式 WO 3- x 中 : 3- x = 2. 90, 所以 x 值 为 : x = 3 - 2. 90 = 0. 10 [ 2] 把 + 5 价钨的氧 化物 和 + 6 价钨 的氧化 物的 化学式 分别写成 WO 2. 5 和 W O3 , 设蓝 色氧化钨的组成为 x W O2. 5 + y = 1; 2 . 5 x + 3y= 2. 90 y W O3 = WO 2. 90 , 所以 有 x
M nO 2 + H 2 C 2 O4 + 2H + 或 M n 2 O 3 + H 2 C 2 O4 + 2H 2 SO4 M nO 2 + H 2 C 2 O4 + H 2 SO 4
2+ 2M nO4 + 5C 2 O 4 + 16H + 或 2M nO4 + 5 H 2 C 2 O 4 + 6H
0. 100 # ( 0. 100 # 2) 2 # 5. 61 # 10 - 11 = 7. 65 # 10- 2 mol/ L 6. 82 # 10- 6 # 4. 30 # 10- 7 7. 56 # 10 - 2 # 100= 223( kP a) 0. 0343 2+ 又要求 [ Ca ] 不大于 10- 4 , 则 p CO 2 & [ CO23 ] = [ CO2 ] %
( aq) [ 2] 连接关系如下图所示。
4- 2. [ 1] 1 M g , 2 Ca, 3 O , 4 C, 5 O , 6 Ca, 7 M g
第5题
CO OH 5- 1. 手性碳构型如图 H R O H OH R H CO OH 二羟基丁二酸 5- 2. L ( + ) 酒 石 酸非 对映 异 构体 的 Fischer 投 影式 , ( 非 COO H Fischer 投影式不得分 ) 。没有旋光性。 H H OH OH COO H 命名 : ( 2 R , 3 R ) 2, 3
4- 3. M g ( O H) 2 + Ca ( O H ) 2 + 3CO 2 + CaCO3 + H 2 O K= K
sp, ( OH) 2
M g 2+ + 2H CO3
解释 : 因 为分子 中有对称 面 , 为非手 性分子。或 答内消 旋体。 5- 3. a: 2EtOH / H + b: ( CH 3 ) 2 C ( OC 2 H 5 ) 2 / H + 或 + ( CH 3 ) 2 C= O / H c: LiAlH 4 / T HF d: 2 T sCl / 吡啶
2 K sp, CaC O3 [ HCO3 ] K a2 & [ CO 2 ] K a 1 [ Ca2+ ]
高锰酸钾滴定剩余还原剂的化学方程式 :
或 2K M nO4 + 5 H 2 C 2 O4 + 3H 2 SO4 10CO 2 + 8H 2 O
2 [ Ca2+ ] [ H CO 3 ] K a2 = K sp, CaC O3 K a1
第3题
3- 1. 2M nO OH 12M n2 O 3 + CH 4 3M n 2 O3 + 0. 25CH 4 M n2 O 3 + H 2 O 8M n3 O 4 + CO 2 + 2H 2 O 或 2M n 3 O4 + 0. 25 CO 2 + 0. 5 H 2 O
3- 2. [ 1] 不同价态锰的 氧化物同草 酸之间 反应的化 学方程
mol mol
3
化合物中钨和氧的 计量 比为 : n W ∃ nO = 4. 343 # 10-
( - 842. 87) - 3 # 0 ] kJ/ mol= 505. 21 kJ/ mo l S = [ 2 # 32. 64 + 3 # 213. 64 - 2 # 75. 90- 3 mol1
K- 1 = 537. 18J
第4题
4- 1. 2CaCO3 ( s) + M g2+ ( aq) Ca
