全国高考化学题分类汇编(热化学计算)
热化学方程式和盖斯定律(2013-2014高考题汇编)

热化学方程式与盖斯定律2013--2014全国高考题汇编(2014·全国卷Ⅰ)28、已知:甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol -1甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))△H3=+50.7KJ·mol -1则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=KJ·mol -1(2014·重庆卷)⒍已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-12C(s)+O2(g)=2CO(g) ΔH =-220kJ·mol-1H-H、O=O和O-H键的键能分别为436、496和462kJ·mol-1,则a为( )A.-332 B.-118 C.+350 D.+130(2014·广东卷)31.(16分)用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)(2014·江苏卷)10.已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2 2CO(g)+O2(g)=2CO2(g) △H34Fe(s)+3O3(g)=2Fe2O3(s) △H43 CO(g)+Fe 2O 3(s)=3CO 2(g)+2Fe(s) △H 5下列关于上述反应焓变的判断正确的是( )A .△H 1>0,△H 3<0B .△H 2>0,△H 4>0C .△H 1=△H 2+△H 3D .△H 3=△H 4+△H 5[2013∙海南卷∙5]已知下列反应的热化学方程式:6C(s)+5H 2(g)+3N 2(g)+9O 2(g)=2C 3H 5(ONO 2)3(l)△H 12 H 2(g)+ O 2(g)=2H 2O(g)△H 2 C(s)+ O 2(g)=CO 2(g) △H 3则反应4C 3H 5(ONO 2)3(l)=12CO 2(g)+10H 2O(g) + O 2(g) +6N 2(g)的△H 为( )A .12△H 3+5△H 2-2△H 1B .2△H 1-5△H 2-12△H 3C .12△H 3-5△H 2-2△H 1D .△H 1-5△H 2-12△H 3[2013高考∙江苏卷∙20]白磷(P 4)可由Ca 3(PO 4)2、焦炭和SiO 2 在一定条件下反应获得。
专题28 反应热计算——键能(学生版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题28反应热计算——键能1.【2022年6月浙江卷】标准状态下,下列物质气态时的相对能量如下表:物质(g)OHHOHOO2H 2O 22H O 2H O能量/-1kJ mol ⋅2492183910136-242-可根据22HO(g)+HO(g)=H O (g)计算出22H O 中氧氧单键的键能为-1214kJ mol ⋅。
下列说法不正..确.的是A .2H 的键能为-1436kJ mol ⋅B .2O 的键能大于22H O 中氧氧单键的键能的两倍C .解离氧氧单键所需能量:22HOO<H O D .-1222H O(g)+O(g)=H O (g)ΔH=-143kJ mol⋅2.(2021.1·浙江真题)已知共价键的键能与热化学方程式信息如下表:共价键H-H H-O 键能/(kJ·mol -1)436463热化学方程式2H 2(g)+O 2(g)=2H 2O(g)ΔH =-482kJ·mol -1则2O(g)=O 2(g)的ΔH 为A .428kJ·mol -1B .-428kJ·mol -1C .498kJ·mol -1D .-498kJ·mol -13.(2010·湖南高考真题)己知:HCN(aq)与NaOH(aq)反应的-1H=-12.1kJ mol ⋅ ;HCl(aq)与NaOH(aq)反应的-1H=-55.6kJ mol ⋅ 。
则HCN 在水溶液中电离的H 等于A .-1-67.7kJ mol ⋅B .-1-43.5kJ mol ⋅C .-1+43.5kJ mol ⋅D .-1+67.7kJ mol ⋅4.(2016·海南高考真题)油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C 57H 104O 6(s)+80O 2(g)=57CO 2(g)+52H 2O(l)。
已知燃烧1kg 该化合物释放出热量3.8×104kJ 。
2020年高考全国卷化学试题分类汇编

2020年高考全国卷化学试题分类汇编1.【2020年全国I卷】XXX公布的肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
下列说法错误的是:B。
NaClO通过氧化灭活病毒2.【2020年全国II卷】北宋XXX《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是:C。
“熬之则成胆矾”是浓缩结晶过程3.【2020年全国III卷】宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。
下列说法错误的是:D。
Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3改写:1.肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等可有效灭活病毒。
其中,NaClO 不能通过氧化来灭活病毒。
2.北宋XXX《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
其中,浓缩结晶过程并非“熬之则成胆矾”。
3.宋代《千里江山图》中的绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3)。
然而,Cu(OH)2·CuCO3中铜的质量分数低于Cu(OH)2·2CuCO3.1.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是:B。
不能使酸性重铬酸钾溶液变色2.吡啶是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。
下列叙述正确的是:C。
Vpy是乙烯的同系物3.金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物。
热化学方程式书写及反应热计算高考真题

1.(2021年高考河北卷)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。
已知25℃时,相关物质的燃烧热数据如表:则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________。
2.(2020年高考全国2卷)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:①ΔH=_________kJ·mol−1。
3.(2020年高考天津卷)理论研究表明,在101kPa和298K下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是A. HCN比HNC稳定ΔH=+59.3kJ molB. 该异构化反应的-1C. 正反应的活化能大于逆反应的活化能D. 使用催化剂,可以改变反应的反应热4.(2021年1月浙江选考)已知共价键的键能与热化学方程式信息如下表:则2O(g)=O2(g)的ΔH为A.428kJ·mol-1B.-428kJ·mol-1C.498kJ·mol-1D.-498kJ·mol-15.(2019年高考全国3卷)Deacon 直接氧化法可按下列催化过程进行:CuCl 2(s)=CuCl(s)+12Cl 2(g) ΔH 1=83 kJ·mol -1 CuCl(s)+12O 2(g)=CuO(s)+12Cl 2(g) ΔH 2=-20 kJ·mol -1CuO(s)+2HCl(g)=CuCl 2(s)+H 2O(g) ΔH 3=-121 kJ·mol -1 则4HCl(g)+O 2(g)=2Cl 2(g)+2H 2O(g)的ΔH =_________ kJ·mol -1。
6.(2017年高考全国1卷)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
热化学硫碘循环水分解制氢系统(Ⅰ)()()()()242221H SO aq ===SO g H O l O g 2++11327kJ mol H -∆=⋅()()()()()22224SO g I s 2H O l 2HI aq H SO aq ++===+12151kJ mol H -∆=-⋅ ()()()222HI aq H g I s ===+13110kJ mol H -∆=⋅ ()()()()()22422H S g H SO aq S s SO g 2H O l +===++1461kJ mol H -∆=⋅热化学硫碘循环硫化氢分解联产氢气、硫磺系统(Ⅱ)通过计算,可知系统(Ⅰ)和系统(Ⅱ)制备氢气的热化学方程式分别为__________________________、______________________,制得等量2H 所需能量较少的是____________。
2022-2023三年高考化学真题分类汇编 高中化学必修二

2022-2023三年高考化学真题分类汇编高中化学必修二一、物质的分类和性质1. 元素的分类和性质2. 合金的制备和应用3. 化合物的命名和表示方法4. 化合物的性质及应用5. 化学方程式的基本概念和应用二、物质的组成和结构1. 原子结构和元素周期表2. 原子的结构和性质3. 分子的结构和性质4. 离子的结构和性质5. 组成物质的微观结构和宏观性质三、化学反应1. 化学反应基本概念和基本类型2. 化学平衡及其条件3. 酸碱中和反应及其应用4. 氧化还原反应及其应用5. 电解质溶液和非电解质溶液的电离度四、化学能变化和热力学1. 化学能的概念和计算2. 化学反应的能量变化和影响因素3. 热化学方程式和反应热4. 热力学第一定律和第二定律5. 化学能转换与能源利用五、原子核化学1. 原子核的组成和结构2. 放射性及其应用3. 核反应和核能利用4. 放射性同位素的探测和应用5. 核能的环境效应和防护六、化学品及其应用1. 化学品的分类和性质2. 常见化学品的生产和应用3. 化学品的安全应用和储存4. 化学品的环境污染和防治5. 化学品的绿色生产和应用七、化学实验与化学工艺1. 常见化学实验基本操作和仪器使用2. 常见化学实验的操作步骤和注意事项3. 化学实验的定量分析和质量控制4. 化学工艺流程和技术5. 化学实验和化学工艺中的安全与环保以上是2022-2023三年高考化学真题分类汇编的内容总结,涵盖了高中化学必修二的各个知识点。
希望对你的学习有所帮助!。
高考化学计算专题试题集(含答案)

Ⅰ.有关物质的量的计算一、选择题1.质量相等的两份气体样品,一份是CO ,另一份是CO 2,这两份气体样品中,CO 与CO 2所含氧原子的原子个数之比是 ( )A .1:2B .1:4C .11:14D .1l :282.下列各组中两种气体的分子数一定相等的是 ( )A .温度相同、体积相同的O 2和N 2B .质量相等、密度不等的N 2和C 2H 4C .体积相同、密度相等的CO 和C 2H 4D .压强相同、体积相同的O 2和H 23.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O 22-)和超氧离子(O 2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为 ( )A .2:lB .1:lC .1:2D .1:34.由CO 2、H 2和CO 组成的混合气在同温同压下与氮气的密度相同。
则该混合气体中CO 2、H 2和CO 的体积比为 ( )A .29:8:13B .22:l :14C .13:8:29D .26:16:575.由X 、Y 两元素组成的气态化合物XY 4,在一定条件下完全分解为A 、B 两种气体物质,己知标准状况下20mLXY 4分解可产生标准状况下30mL A 气体(化学式为Y 2)和10mL B气体,则B 的化学式为 ( )A .X 2B .Y 2X 2C .XY 2D .X 2Y 46.将N02、NH 3、O 2混合气22.4L 通过稀硫酸后,溶液质量增加了26.7g ,气体体积缩小为4.48L .(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均分子量为 ( )A .28.1B .30.2C .33.1D .34.07.为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是 ( )A .H 2SO 4·19B .H 2SO 4 ·H 2OC .H 2SO 4·SO 3D .SO 3· 109H 2O 8.两种气态烃组成的混合气体0.1mol ,完全燃烧得O.16molCO 2 T3.6g 水。
全国通用_三年高考化学真题分项汇编专题02化学计量与化学计算

9.(2021·浙江)设 为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下, 中含有中子数为
B. (分子结构: )中的共价键数目为
C. 的 水溶液中含有氧原子数为
D. 三肽 (相对分子质量:189)中的肽键数目为
【答案】C
【解析】A.标准状况下, 的物质的量为:0.05mol,一个 中含有中子数为: 个,所以 中含有中子数为 ,A正确;
B.没有指明气体的温度和压强,无法确定 乙烷和丙烯的混合气体的物质的量是多少,因此,无法确定其中所含碳氢键的数目,B说法不正确;
C. 分子中有6个中子, 的物质的量为0.5mol,因此, 含有的中子数为 ,C说法正确;
D. 和 发生反应生成 ,该反应是可逆反应,反应物不能完全转化为生成物,因此, 和 于密闭容器中充分反应后, 分子总数小于 ,D说法不正确。
D.甲烷和氯气在光照下发生取代,1mol氯气可取代1molH,同时产生1molHCl分子,标准状况下 的物质的量为0.5mol, 的物质的量为1mol,0.5molCH4含4molH,最多可消耗4molCl2,因此CH4过量,根据1mol氯气可取代1molH,同时产生1molHCl分子可知1molCl2完全反应可得1moHCl,根据C守恒,反应后含C物质的物质的量=甲烷的物质的量=0.5mol,因此 和 (均为标准状况)在光照下充分反应后的分子数为 ,D正确;
B. 溶液中含有的 数为
C. 与 在密闭容器中充分反应后的分子数为
D. 和 (均为标准状况)在光照下充分反应后的分子数为
【答案】D
【解析】A. 的物质的量为 =0.9mol,1个 含0+(18-8)=10个中子,则 含有的中子数为 ,A错误;
B.未给溶液体积,无法计算,B错误;
专题29 反应热计算——盖斯定律学生版)十年(2013-2022)高考化学真题分项汇编(全国通用)
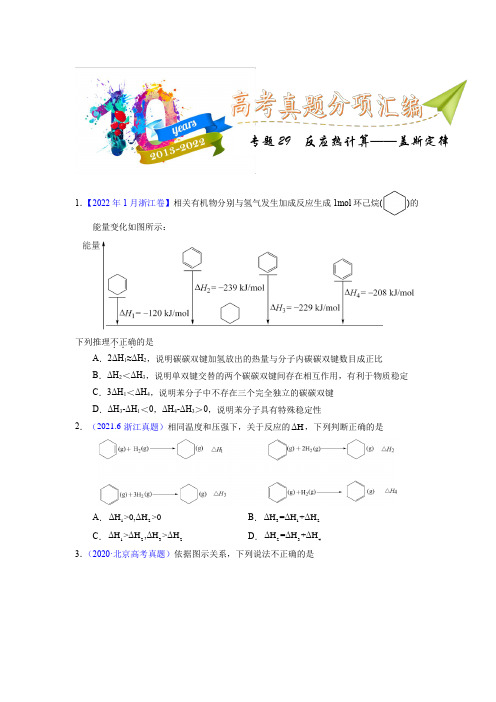
1.【2022年1月浙江卷】相关有机物分别与氢气发生加成反应生成1mol 环己烷()的能量变化如图所示:下列推理不正确...的是 A .2ΔH 1≈ΔH 2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比 B .ΔH 2<ΔH 3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定 C .3ΔH 1<ΔH 4,说明苯分子中不存在三个完全独立的碳碳双键 D .ΔH 3-ΔH 1<0,ΔH 4-ΔH 3>0,说明苯分子具有特殊稳定性2.(2021.6·浙江真题)相同温度和压强下,关于反应的ΔH ,下列判断正确的是A .12ΔH >0,ΔH >0B .312ΔH =ΔH +ΔHC .3212>ΔH ,ΔH ΔH >ΔHD .423=ΔH H +ΔΔH3.(2020·北京高考真题)依据图示关系,下列说法不正确的是专题29 反应热计算——盖斯定律A .石墨燃烧是放热反应B .1molC(石墨)和1molCO 分别在足量O 2中燃烧,全部转化为CO 2,前者放热多C .C(石墨)+CO 2(g)=2CO(g) ΔH =ΔH 1-ΔH 2D .化学反应的ΔH ,只与反应体系的始态和终态有关,与反应途径无关 4.(2018·浙江高考真题)氢卤酸的能量关系如图所示下列说法正确的是A .已知HF 气体溶于水放热,则HF 的△H 1<0B .相同条件下,HCl 的△H 2比HBr 的小C .相同条件下,HCl 的△H 3+△H 4比HI 的大D .一定条件下,气态原子生成1molH-X 键放出akJ 能量,则该条件下△H 2=+akJ/mol 5.(2020·浙江高考真题)关于下列ΔH 的判断正确的是( )CO 32−(aq )+H +(aq )=HCO 3−(aq ) ΔH 1CO 32-(aq )+H 2O (l )⇌ HCO 3−(aq )+OH −(aq ) ΔH 2OH −(aq )+H +(aq )=H 2O (l ) ΔH 3OH −(aq )+CH 3COOH (aq )=CH 3COO −(aq )+H 2O (l ) ΔH 4 A .ΔH 1<0 ΔH 2<0B .ΔH 1<ΔH 2C .ΔH 3<0 ΔH 4>0D .ΔH 3>ΔH 46.(2015·重庆高考真题)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S (s )+2KNO 3(s )+3C (s )=K 2S (s )+N 2(g )+3CO 2(g ) ΔH=x kJ·mol -1 已知碳的燃烧热ΔH 1=a kJ·mol -1S (s )+2K (s )=K 2S (s ) ΔH 2=b kJ·mol -12K (s )+N 2(g )+3O 2(g )=2KNO 3(s ) ΔH 3=c kJ·mol -1 则x 为A .3a+b -cB .c+3a -bC .a+b -cD .c+a -b7.(2017·浙江高考真题)根据2Ca(OH)/CaO 体系的能量循环图:下列说法正确的是:A .5ΔH >0B .12ΔH ΔH 0+=C .342ΔH ΔH ΔH =+D .12345ΔH ΔH ΔH ΔH ΔH 0++++=8.(2014·江苏高考真题)已知:C(s)+O 2(g)=CO 2(g) △H 1 CO 2(g)+C(s)=2CO(g) △H 2 2CO(g)+O 2(g)=2CO 2(g) △H 3 4Fe(s)+3O 3(g)=2Fe 2O 3(s) △H 43 CO(g)+Fe 2O 3(s)=3CO 2(g)+2Fe(s) △H 5 下列关于上述反应焓变的判断正确的是A .△H 1>0,△H 3<0B .△H 2>0,△H 4>0C .△H 1=△H 2+△H 3D .△H 3=△H 4+△H 59.(2008·宁夏高考真题)已知H 2(g)、C 2H 4(g)和C 2H 5OH (1)的燃烧热分别是-285.8kJ·mol -1、-1411.0kJ·mol -1和-1366.8kJ·mol -1,则由C 2H 4(g)和H 2O(l)反应生成C 2H 5OH(l)的△H 为( ) A .-44.2kJ·mol -1 B .+44.2kJ·mlo -1 C .-330kJ·mol -1D .+330kJ·mlo -110.(2013·全国高考真题)在1200℃时,天然气脱硫工艺中会发生下列反应①H 2S(g)+32O 2(g)=SO 2(g)+H 2O(g) △H 1 ②2H 2S(g)+SO 2(g)=32S 2(g)+2H 2O(g) △H 2 ③H 2S(g)+12O 2(g)=S(g)+H 2O(g) △H 3 ④2S(g) =S 2(g) △H 4则△H 4的正确表达式为( )A .△H 4=2/3(△H 1+△H 2-3△H 3)B .△H 4=2/3(3△H 3-△H 1-△H 2)C .△H 4=3/2(△H 1+△H 2-3△H 3)D .△H 4=3/2(△H 1-△H 2-3△H 3)11.(2014·全国高考真题)室温下,将1mol 的CuSO 4·5H 2O(s)溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为△H 2;CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O(s)CuSO 4(s)+5H 2O(l),热效应为△H 3。
2023年高考化学真题分类汇编—化学反应机理、原理

2023年高考化学真题分类汇编—化学反应机理、原理(真题部分)146.(2023湖南14)N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。
我国科学家合成的某Ru(Ⅱ)催化剂(用[L−Ru−NH3]+表示)能高效电催化氧化NH3合成N2H4,其反应机理如图所示。
下列说法错误的是A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强B.M中Ru的化合价为+3C.该过程有非极性键的形成D.该过程的总反应式:4NH3−2e−=N2H4+2NH4+147.(2023新课标12)“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH 与NH3转化为肼(NH2NH2),其反应历程如下所示。
下列说法错误的是A.NH2OH、NH3和H2O均为极性分子B.反应涉及N-H、N-O键断裂和N-N键生成C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+D.将NH2OH替换为ND2OD,反应可得ND2ND2148.(2023广东15)催化剂Ⅰ和Ⅱ均能催化反应R(g)⇌P(g)。
反应历程(下图)中,M为中间产物。
其它条件相同时,下列说法不正确的是A.使用Ⅰ和Ⅱ,反应历程都分4步进行B.反应达平衡时,升高温度,R的浓度增大C.使用Ⅱ时,反应体系更快达到平衡D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大149.(2023河北6)在恒温恒容密闭容器中充入一定量W(g),发生如下反应:反应②和③的速率方程分别为v2=k2c2(X)和v3=k3c(Z),其中k2、k3分别为反应②和③的速率常数,反应③的活化能大于反应②。
测得W(g)的浓度随时间的变化如下表。
下列说法正确的是A.0~2min内,X的平均反应速率为0.080mol⋅L−1⋅min−1B.若增大容器容积,平衡时Y的产率增大C.若k2=k3,平衡时c(Z)=c(X)D.若升高温度,平衡时c(Z)减小150.(2023.6浙江14)一定条件下,1-苯基丙炔(Ph-C≡C-CH)可与HCl发生催3化加成,反应如下:反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确...的是A.反应焓变:反应I>反应ⅡB.反应活化能:反应I<反应ⅡC.增加HCl浓度可增加平衡时产物Ⅱ和产物I的比例D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ三、化学反应原理151.(2023海南7)各相关物质的燃烧热数据如下表。
历年(2022-2024)全国高考化学真题分类(有机化合物)汇编(附答案)

历年(2022-2024)全国高考化学真题分类(有机化合物)汇编考法01 常见有机物的结构和性质1. (2024ꞏ浙江卷1月)关于有机物检测,下列说法正确的是 A. 用浓溴水可鉴别溴乙烷、乙醛和苯酚 B. 用红外光谱可确定有机物的元素组成C. 质谱法测得某有机物的相对分子质量为72,可推断其分子式为C 5H 12D. 麦芽糖与稀硫酸共热后加NaOH 溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水解 2. (2024ꞏ浙江卷1月)制造隐形眼镜的功能高分子材料Q 的合成路线如下:下列说法不正确...的是 A. 试剂a 为NaOH 乙醇溶液 B. Y 易溶于水C. Z 的结构简式可能为D. M 分子中有3种官能团3. (2024ꞏ安徽卷)下列资源利用中,在给定工艺条件下转化关系正确的是A. 煤−−−→干馏煤油B. 石油−−−→分馏乙烯C. 油脂−−−→皂化甘油D. 淀粉−−−→水解乙醇4. (2024ꞏ山东卷)中国美食享誉世界,东坡诗句“芽姜紫醋炙银鱼”描述了古人烹饪时对食醋的妙用。
食醋风味形成的关键是发酵,包括淀粉水解、发酵制醇和发酵制酸等三个阶段。
下列说法错误的是 A. 淀粉水解阶段有葡萄糖产生 B. 发酵制醇阶段有2CO 产生C. 发酵制酸阶段有酯类物质产生D. 上述三个阶段均应在无氧条件下进行5. (2024ꞏ河北卷)高分子材料在生产、生活中得到广泛应用。
下列说法错误的是 A. 线型聚乙烯塑料为长链高分子,受热易软化 B. 聚四氟乙烯由四氟乙烯加聚合成,受热易分解 C. 尼龙66由己二酸和己二胺缩聚合成,强度高、韧性好D. 聚甲基丙烯酸酯(有机玻璃)由甲基丙烯酸酯加聚合成,透明度高 6. (2024ꞏ江苏卷)下列有关反应描述正确的是A. 32CH CH OH 催化氧化为3CH CHO ,32CH CH OH 断裂C-O 键B. 氟氯烃破坏臭氧层,氟氯烃产生的氯自由基改变3O 分解的历程C. 丁烷催化裂化为乙烷和乙烯,丁烷断裂σ键和π键D. 石墨转化为金刚石,碳原子轨道的杂化类型由3sp 转变为2sp7. (2024ꞏ浙江卷6月)有机物A 经元素分析仪测得只含碳、氢、氧3种元素,红外光谱显示A 分子中没有醚键,质谱和核磁共振氢谱示意图如下。
高考热化学知识点及习题.doc

高考热化学知识点及习题热化学常见题型题型一:热化学方程式书写的正误判断例1.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( D )A.C(s) + 1/2O2 (g) == CO(g) ;△H =-393.5kJ/molB.2H2(g)+ O2 (g) == 2H2O(g);△H = + 571.6kJ/molC.CH4(g) + 2O2 (g) == CO2(g) + 2H2O(g);△H = -890.3kJ/molD.1/2 C6H12O6(s) + 3O2 (g) ==3CO2(g) + 3H2O(l);△H =-1400kJ/mol能力拓展:解答热化学方程式书写的正误判断问题,关键是明确其书写规则:①注明反应物和生成物的聚集状态,如气体(g)、液体(l)、固体(s)、水溶液(a.q);同素异形体要注明其名称,如金刚石、石墨;红磷、白磷等;②注明反应热:用△H表示反应热,“+”表示吸热反应,“—”表示放热反应;反应热的单位一律用“kJ/mol”来表示;③热化学方程式应配平,反应物与生成物之间一律用“==”,而不用“→”;不用注明气体“↑”与沉淀“↓”符号;④热化学方程式中的化学计量数不再表示具体的分子(或原子)个数,而是表示物质的量,可以是整数或分数,但要注意△H的大小与反应物量的关系的对应;题型二:反应热的大小比较例2.下列各组热化学方程式中,化学反应的△H前者大于后者的是(C)①C(s)+O2(g)==CO2(g);△H1C(s)+1/2O2(g)==CO (g);△H2②S(s)+ O2(g)==SO2(g);△H3S(g)+ O2(g)==SO2(g);△H4③H2(g)+1/2O2==H2O(l);△H52H2(g)+ O2==2H2O(l);△H6④CaCO3==CaO + CO2;△H7CaO + CO2==CaCO3;△H8A.① B.④ C.②③④ D.①②③。
【化学】2021全国高考化学试题分类汇编---离子共存、离子反应

2021高考考题化学试卷试题分类汇编离子共存 离子反应1.(2021全国卷1)能正确表示下列反应的离子方程式是A .将铜屑加入3+Fe 溶液中:3+2+2+2Fe +Cu=2Fe +CuB .将磁性氧化铁溶于盐酸:+3+342Fe O +8H =3Fe +4H OC .将氯化亚铁溶液和稀硝酸混合:2++332Fe +4H +NO =Fe +2H O+NO -+↑ D .将铁粉加入稀硫酸中:+322Fe+6H =2Fe 3H ++↑【解析】A 正确,符合3个守恒;B 错误,电荷不守恒,Fe 3O 4中Fe 有两种价态,正确应该为:Fe 3O 4+8H +=2Fe 3++Fe 2++4H 2O ;C 错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe 2++NO 3-+4H +=3Fe 3++NO↑+2H 2O ;D 错误,不符合客观实际,反应后铁只能产生Fe 2+和H 2;【正确答案】A【命题意图】考查离子方程式的正误判断方法!【点评】离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D 这是个重现率很高的的经典错误,考生绝对做过原题!B 项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考考题题中再次出现,这道题就没什么意思了!A 直接取材于课本第二册,C 选项,考生也绝对做过,都是太常见不过了! (2021全国2)8.能正确表示下列反应的离子方程式是A .将铜屑加入3+Fe 溶液中:3+2+2+2Fe +Cu=2Fe +CuB .将磁性氧化铁溶于盐酸:+3+342Fe O +8H =3Fe +4H OC .将氯化亚铁溶液和稀硝酸混合:2++332Fe +4H +NO =Fe +2H O+NO -+↑ D .将铁粉加入稀硫酸中:+322Fe+6H =2Fe 3H ++↑【解析】A 正确,符合3个守恒;B 错误,电荷不守恒,Fe 3O 4中Fe 有两种价态,正确应该为:Fe 3O 4+8H +=2Fe 3++Fe 2++4H 2O ;C 错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe 2++NO 3-+4H +=3Fe 3++NO↑+2H 2O ;D 错误,不符合客观实际,反应后铁只能产生Fe2+和H2;【正确答案】A【命题意图】考查离子方程式的正误判断方法!【点评】离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考考题题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!(2021天津卷)5.下列实验设计及其对应的离子方程式均正确的是A.用Fe Cl3溶液腐蚀铜线路板:Cu + 2Fe3+=Cu2+ + 2Fe2+B.Na2O2与H2O反应制备O2:Na2O2 + H2O=2N a+ + 2O H-+ O2↑C.将氯气溶于[水]制备次氯酸:C l2 + H2O=2H+ + Cl-+ ClO-D.用浓盐酸酸化的KM n O4溶液与H2O2反应,证明H2O2具有还原性: + 6H+ + 5H2O2=2Mn2+ + 5O2↑ + 8H2O2MnO4解析:B中元素不守恒,正确的离子方程式为:2Na2O2+2H2O==4Na++4OH-+O2;C中的HClO是弱酸,不能拆成离子形式;D的离子方程式本身没有问题,但KMnO4的强氧化性能将浓盐酸氧化,不能实现证明H2O2具有还原性的目的(还原性:HCl >H2O2,HCl先反应),D错。
专题10 化学计算(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题10化学计算1.【2022年1月浙江卷】某同学设计实验确定Al(NO 3)3·xH 2O 的结晶水数目。
称取样品7.50g ,经热分解测得气体产物中有NO 2、O 2、HNO 3、H 2O ,其中H 2O 的质量为3.06g ;残留的固体产物是Al 2O 3,质量为1.02g 。
计算:(1)x=_______(写出计算过程)。
(2)气体产物中n(O 2)_______mol 。
【答案】(1)9(2)0.0100【解析】(1)Al(NO 3)3·xH 2O 的摩尔质量为(213+18x)g/mol ,根据固体产物氧化铝的质量为1.02g ,可知样品中n(Al)= 1.0220.02mol 102/g g mol ⨯=,则7.500.02mol (21318)/g x g mol=+,解得x=9。
(2)气体产物中n(H 2O)=3.06g÷18g/mol=0.17mol ,则n(HNO 3)=0.02×9×2-0.17×2=0.02mol ,根据氮元素守恒,n(NO 2)=样品中N 的物质的量-HNO 3中N 的物质的量=0.02×3-0.02=0.04mol ,根据氧元素守恒,n(O 2)=(0.02×18-0.17-0.02×3-0.04×2-0.03)÷2=0.0100mol 。
2.【2022年6月浙江卷】联合生产是化学综合利用资源的有效方法。
煅烧石灰石反应:2-132CaCO (s)=CaO(s)+CO (g)ΔH=1.810kJ mol ⨯⋅,石灰石分解需要的能量由焦炭燃烧提供。
将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成2CO ,其热量有效利用率为50%。
石灰窑中产生的富含2CO 的窑气通入氨的氯化钠饱和溶液中,40%的2CO 最终转化为纯碱。
已知:焦炭的热值为-130kJ g ⋅(假设焦炭不含杂质)。
高中化学高考总复习---热化学方程式和反应热的计算知识讲解及练习题(含答案解析)

1、O=O d kJ·mol—1。
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a+5d-4c-12b)kJ·mol—1
B(4c+12b-6a-5d)kJ·mol—1
C.(4c+12b-4a-5d)kJ·mol—1
D.(4a+5d-4c-12b)kJ·mol—1
【答案】A
【解析】由图可以看出:P4 中有 6mol 的 P-P,5mol 的 O2 中含有 5molO=O,
H2O 放出热量为 817.63 kJ/mol×0.5 mol=408.815 kJ.
(3)因产物为 N2 和 H2O,故不会造成环境污染. 【总结升华】书写热化学方程式,要注意各物质的状态、ΔH 的正负及单位。
举一反三: 【变式 1】(2014 新课标全国卷Ⅰ)已知:
甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) 甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g)
热化学方程式为: B2H6(g)+3O2(g)===B2O3(s)+3H2O(l);ΔH=-2165 kJ/mol (3)1 mol C6H6(l)完全燃烧生成 CO2(g)和 H2O(l)放出的热量为:
4
热化学方程式为:
类型二:有关反应热的计算 例 2、SF6 是一种优良的绝缘气体,分子结构中只存在 S-F 键。已知:1molS(s) 转化为气态硫原子吸收能量 280kJ,断裂 1molF-F 、S-F 键需吸收的能量分别为
(1)反应的热化学方程式为____________________. (2)又已知 H2O(l)===H2O(g);ΔH=+44 kJ/mol。由 16 g 液态肼与液态双氧 水反应生成液态水时放出的热量是________kJ. (3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个 很大的优点是________________. 【答案】(1)N2H4(l)+2H2O2(l)===N2(g)+4H2O(g);ΔH=-641.63 kJ/mol (2)408.815 (3)产物不会造成环境污染 【 解析 】(1)首 先根 据得 失电 子守 恒 即可 配平 该氧 化还 原反 应为 N2H4+ 2H2O2===N2↑ + 4H2O, 因 此 1 mol N2H4(l)完 全 反 应 放 出 热 量 是 :
三年(2022-2024)高考化学真题分类汇编(全国)专题15 物质结构与性质综合题(学生卷)

专题15物质结构与性质综合题考点命题趋势考点1物质结构与性质综合题在当前的旧高考中,"物质结构与性质"属于选择性考试内容,以综合性客观题形式出现,随着新课程的落实,"物质结构与性质"已成为选择性必修课程,将成为新高考的必考内容,在新高考中,部分卷区不再设置"物质结构与性质"综合题,而是将其考查分散到选择题和其他综合题当中。
纵观近年来高考真题,物质结构与性质综合题基本上考的都是最基本、最典型、最主干的知识点。
以下是高考时时常考的知识点:原子结构与元素的性质方面,如原子电子排布式,元素原子的性质;化学键与物质的性质方面,如杂化轨道类型,分子(离子)空间构型;分子间作用力与物质的性质方面;如晶胞判断与计算。
试题均建构在以教材为主的中学化学基础知识之上,没有偏离教材体系和考试说明的要求,试题基本保持稳定。
试卷并不能把所有的知识面全部覆盖,也不能保证重要知识点可能反复出现。
1.(2024·北京卷)锡(Sn )是现代“五金”之一,广泛应用于合金、半导体工业等。
(1)Sn 位于元素周期表的第5周期第IVA 族。
将Sn 的基态原子最外层轨道表示式补充完整:(2)2SnCl 和4SnCl 是锡的常见氯化物,2SnCl 可被氧化得到。
①2SnCl 分子的VSEPR 模型名称是_________。
②4SnCl 的Sn Cl —键是由锡的_________轨道与氯的3p 轨道重叠形成。
键。
(3)白锡和灰锡是单质Sn 的常见同素异形体。
二者晶胞如图:白锡具有体心四方结构;灰锡具有立方金刚石结构。
①灰锡中每个Sn 原子周围与它最近且距离相等的Sn 原子有_________个。
②若白锡和灰锡的晶胞体积分别为31v nm 和32v nm ,则白锡和灰锡晶体的密度之比是_________。
(4)单质Sn 的制备:将2SnO 与焦炭充分混合后,于惰性气氛中加热至800C ︒,由于固体之间反应慢,未明显发生反应。
全国通用_三年高考化学真题分项汇编专题07化学反应中的能量变化及反应机理

专题07化学反应中的能量变化及反应机理2022年高考真题1.(2022·浙江卷)标准状态下,下列物质气态时的相对能量如下表: 物质(g)O HHO HOO 2H 2O 22H O 2H O能量/-1kJ mol ⋅ 249 218 39 10136- 242-可根据22HO(g)+HO(g)=H O (g)计算出22H O 中氧氧单键的键能为-1214kJ mol ⋅。
下列说法不正..确.的是A .2H 的键能为-1436kJ mol ⋅ B .2O 的键能大于22H O 中氧氧单键的键能的两倍 C .解离氧氧单键所需能量:22HOO<H OD .-1222H O(g)+O(g)=H O (g)ΔH=-143kJ mol ⋅【答案】C【解析】A .根据表格中的数据可知,2H 的键能为218×2=436-1kJ mol ⋅,A 正确; B .由表格中的数据可知2O 的键能为:249×2=498-1kJ mol ⋅,由题中信息可知22H O 中氧氧单键的键能为-1214kJ mol ⋅,则2O 的键能大于22H O 中氧氧单键的键能的两倍,B 正确; C .由表格中的数据可知HOO=HO+O ,解离其中氧氧单键需要的能量为249+39-10=278-1kJ mol ⋅,22H O 中氧氧单键的键能为-1214kJ mol ⋅,C 错误;D .由表中的数据可知222H O(g)+O(g)=H O (g)的-1ΔH=-136-249-(-242)=-143kJ mol ⋅,D 正确; 故选C2.(2022·湖南卷)反应物(S)转化为产物(P 或P ·Z)的能量与反应进程的关系如下图所示:下列有关四种不同反应进程的说法正确的是 A .进程Ⅰ是放热反应 B .平衡时P 的产率:Ⅱ>Ⅰ C .生成P 的速率:Ⅲ>Ⅱ D .进程Ⅳ中,Z 没有催化作用【答案】AD【解析】A .由图中信息可知,进程Ⅰ中S 的总能量大于产物P 的总能量,因此进程I 是放热反应,A说法正确;B.进程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P 的产率相同,B说法不正确;C.进程Ⅲ中由S•Y转化为P•Y的活化能高于进程Ⅱ中由S•X转化为P•X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅲ<Ⅱ,C说法不正确;D.由图中信息可知,进程Ⅳ中S吸附到Z表面生成S•Z,然后S•Z转化为产物P•Z,由于P•Z没有转化为P+Z,因此,Z没有表现出催化作用,D说法正确;综上所述,本题选AD。
2009—2012年高考化学试题汇编—热化学(无答案)

2009—2012年高考化学试题分类汇编—化学反应中的能量变化2012年高考化学试题1.(2012江苏∙10)下列有关说法正确的是A .CaCO 3(s)=CaO(s)+CO 2(g)室温下不能自发进行,说明该反应的△H <0B .镀铜铁制品镀层受损后,铁制品比受损前更容易生锈C .N 2(g)+3H 2(g)2NH 3(g) △H <0,其他条件不变时升高温度,反应速率V(H 2)和氢气的平衡转化率均增大D .水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应2.(2012安徽∙7)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为: NaHCO 3+H 2HCOONa+H 2O 下列有关说法正确的是A .储氢、释氢过程均无能量变化B .NaHCO 3、HCOONa 均含有离子键和共价键C .储氢过程中,NaHCO 3被氧化D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 23.(2012江苏∙4)某反应的反应过程中能量变化如右图所示(图中E 1表示正反应的活化能,E 2表示逆反应的活化能)。
下列有关叙述正确的是A .该反应为放热反应B .催化剂能改变反应的焓变C .催化剂能降低反应的活化能D .逆反应的活化能大于正反应的活化能4.(2012浙江∙12)下列说法正确的是:A .在100 ℃、101 kPa 条件下,液态水的气化热为40.69 kJ·mol -1,则H 2O(g)H 2O(l) 的ΔH = 40.69 kJ·mol -1B .已知MgCO 3的K sp = 6.82 × 10-6,则所有含有固体MgCO 3的溶液中,都有c (Mg 2+) =c (CO 32-),且c (Mg 2+) · c (CO 32-) = 6.82 × 10-6C .已知:储氢 释氢则可以计算出反应C H 3(g)+3H 2C H 3(g)的ΔH 为-384 kJ·mol -1 D .常温下,在0.10 mol·L -1的NH 3·H 2O 溶液中加入少量NH 4Cl 晶体,能使NH 3·H 2O 的电离度降低,溶液的pH 减小12.肼(H 2NNH 2)是一种高能燃料,有关化学反应的能量变化如题12所示,已知断裂1mol化学键所需的能量(kJ ):N=N 为942、O=O 为500、N −N 为154,则断裂1molN −H 键所需的能量(KJ )是A .194B .391C .516D .6585.(2012安徽∙12)氢氟酸是一种弱酸,可用来刻蚀玻璃。
高考化学计算试题分类汇编

ΔΔ高考化学计算试题分类汇编1.(06广东26)(6分)地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。
取66.6mg 由高岭石[Al 4Si 4O 10(OH)8]和方解石(CaCO 3)组成的矿物,加热,在673K ~1123K 区间内分解为氧化物,样品总失重13.8mg 。
⑴方解石的失重百分比为 。
⑵计算矿物中高岭石的质量分数。
答案:⑴CaCO 3 ===== CaO+CO 2↑ 方解石的失重百分比为:解得:x=51.6 y=15.0矿物中高岭石的质量分数w=答:⑴方解石的失重百分比为44%。
⑵矿物中高岭石的质量分数为77.5% 2(06广东27)(14分)钴(Co)化合物对化学键的研究起着重要的作用。
为测定某钴化合物[Co(NH 3)x Cl y ]Cl z 的组成,进行如下实验:①称取样品0.5010g ,加入过量的NaOH 溶液,煮沸,蒸出所有的氨,冷却,得到A 。
产生的氨用50.00mL0.5000mol·L -1的盐酸完全吸收并用蒸馏水定容至100mL ,得溶液B 。
取B 溶液20.00mL, 用0.1000mol·L -1NaOH 滴定,消耗NaOH 溶液30.00mL 。
②向A 中加入过量KI 固体,振荡,盐酸酸化后置于暗处,发生反应:Co m++I -→Co 2++I 2 (未配平)反应完成后,蒸馏水稀释,用Na 2S 2O 3溶液滴定析出的I 2,消耗0.1000mol·L -1Na 2S 2O 3溶液20.00mL 。
反应方程式为:I 2+2Na 2S 2O 3==2NaI+Na 2S 4O 6③另称取该物质样品0.2505g,溶于水,以0.1000mol·L-1AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00mL。
相应反应式为:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓通过计算求:⑴[Co(NH3)xCly]Clz中氮元素的质量分数。
高考化学热化学试题汇编完整版

高考化学热化学试题汇编HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】高考化学热化学试题汇编(00年—08年)一、选择题1、(2000年山西卷—14)今有如下3个热化学方程式:H 2(g)+ O 2(g)=H 2O(g) ΔH=a KJ·mol -1 H 2(g)+ O 2(g)=H 2O(l) ΔH=b KJ·mol -1 2H 2(g)+O 2(g)=2H 2O(l) ΔH=c KJ·mol -1 关于它们的下列表述正确的是( )A.它们都是吸热反应B.a 、b 和c 均为正值C.a=b D .2b=c2、(2002年天津卷—9)沼气是一种能源,它的主要成分是CH 4。
0.5molCH 4完全燃烧生成CO 2和H 2O 时,放出445kJ 热量,则下列热化学方程式中正确的是A. 2CH 4(g )+4O 2(g )=2CO 2(g )+4H 2O (l );ΔH=+890kJ·mol -1B. CH 4(g )+2O 2(g )=CO 2(g )+2H 2O (l ); ΔH=+890kJ·mol -1C. CH 4(g )+4O 2(g )=CO 2(g )+2H 2O (l ); ΔH=-890kJ·mol -1D. 1/2CH 4(g )+O 2(g )=1/2CO 2(g )+H 2O (l ); ΔH=-890kJ·mol -13、(03江苏卷—4)已知在25℃,101kPa 下,lgC 8H 18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。
表示上述反应的热化学方程式正确的是 ( )A. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1B. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1C. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1D. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-14、(03全国新课程卷—13)已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-15、(04全国卷Ⅳ—12)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是()A.CH3OH(l)+1.5O2(g) CO2(g)+2H2O(l);△H=+725.8 kJ/molB.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-1452 kJ/molC.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=-725.8 kJ/molD.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l);△H=+1452 kJ/mol6、(04全国卷Ⅲ—8)已知:(l)H2(g) +0.5O2(g) =H2O(g);△H1=a kJ·1mol(2)2H2(g) +O2(g) =2H2O(g);△H2=b kJ·1mol-(3)H2(g) +0.5O2(g)=H2O(l);△H3=c kJ·1mol-(4)2H2(g) +O2(g) =2H2O(l); △H4=d kJ·1mol-下列关系式中正确的是A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>07、(04全国卷Ⅱ—13)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨) + O2(g) === CO2(g) △H = -393.51kJ·mol-1C(金刚石) + O2(g) === CO2(g) △H = -395.41kJ·mol-1据此判断,下列说法中正确的是()A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高8、(04广东卷—17)已知葡萄糖的燃烧热是2804kJ/mol,当它氧化生成1g水时放出的热量是()A、26.0kJB、51.9kJC、155.8kJD、467.3kJ9、(04上海卷—7)实验室制取下列气体,其反应放热的是()A.由无水醋酸钠制CH 4B.由乙醇制C 2H 4 C .由电石制C 2H 2 D.由氯酸钾制O 210、(05江苏4)氢气(H 2)、一氧化碳(CO )、辛烷(C 8H 18)、甲烷(CH 4)的热化学方程式分别为:H 2(g) + 1/2O 2(g) = H 2O(l);△H = —285.8 kJ/molCO(g) + 1/2O 2(g) = CO 2(g);△H = —283.0 kJ/molC 8H 18(l) + 25/2O 2(g) = 8CO 2(g) + 9 H 2O(l);△H = —5518 kJ/molCH 4(g) + 2 O 2(g) = CO 2(g) + 2 H 2O(l);△H = —890.3 kJ/mol相同质量的H 2、CO 、C 8H 18、CH 4完全燃烧时,放出热量最少的是( )A .H 2(g)B .CO(g)C .C 8H 18(l)D .CH 4(g)11、(05全国卷Ⅰ13)已知充分燃烧a g 乙炔气体时生成1 mol 二氧化碳气体和液态水,并放出热量b kJ ,则乙炔燃烧的热化学方程式正确的是 ( )A .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-4b kJ/molB .C 2H 2(g )+25O 2(g ) 2CO 2(g )+H 2O (l );△H=2b kJ/mol C .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=-2b kJ/molD .2C 2H 2(g )+5O 2(g ) 4CO 2(g )+2H 2O (l );△H=b kJ/mol12、(06重庆卷10)25℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol 、285.8 kJ/mol 、890.3 kJ/mol 、2800 kJ/mol,则下列热化学方程式正确的是( )A. C(s)+0.5O 2(g)=CO(g);△H =-393.5 kJ/molB. 2H 2(g)+O 2(g)=2H 2O(g);△H =+571.6 kJ/molC. CH 4g)+2O 2(g)=CO 2(g)+2H 2O(g);△H =-890.3 kJ/molD . 0.5C 6H 12O 6(s )+3O 2(g)=3CO 2(g)+3H 2O(l);△H = -1400 kJ/mol13、(06江苏卷8)下列各组热化学方程式中,化学反应的△H 前者大于后者的是( )①C(s)+O 2(g)===CO 2(g);△H 1 C(s)+12O 2(g)===CO(g);△H 2②S(s)+O 2(g)===SO 2(g);△H 3 S(g)+O 2(g)===SO 2(g);△H 4③H 2(g)+12O 2(g)===H 2O(l);△H 5 2H 2(g)+O 2(g)===2H 2O(l);△H 6④CaCO 3(s)===CaO(s)+CO 2(g);△H 7 CaO(s)+H 2O(l)===Ca(OH)2(s);△H 8A .① B.④ C .②③④ D.①②③14、(06天津13)已知反应:①101KPa 时,2C(s)+O 2(g)=2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol下列结论正确的是()A.碳的燃烧热大于110.5kJ/molB.①的反应热为221kJ/molC.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/molD.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3KJ热量15.(2007年高考广东化学卷—16)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年全国高考化学题分类汇编(热化学计算)
————————————————————————————————作者:————————————————————————————————日期:
2
热化学计算
(2014重庆)
答案:D
(2014四川卷)11.(16分)
(3)已知:25℃、101kp a时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(2014新课标I)28、(15分)
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=
---45.5KJ·mol-1
(2014广东B)31.(16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1
4CaSO4(s)+CO(g)
1
4
CaS(s)+CO2(g) ∆H1= —47.3kJ∙mol-1
② CaSO 4(s)+CO(g) CaO(s)+CO2(g) +SO2(g) ∆H2= +210.5kJ∙mol-1
③ CO(g) 1
2
C(s)+
1
2
CO2(g) ∆H3= —86.2kJ∙mol-1
(1)反应2CaSO 4(s)+7CO(g) CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)
(2014北京)①已知:2NO2(g)ƒN2O4(g)△H1
2NO2(g)ƒN2O4(l)△H2
下列能量变化示意图中,正确的是(选填字母)_______________。
A B
C
②N 2O 4与O 2、H 2O 化合的化学方程式是_________________。
(2014广西)28.(15分)
化合物AX 3和单质X 2在一定条件下反应可生成化合物AX 5。
回答下列问题:
(1)已知AX 3的熔点和沸点分别为-93.6 ℃和76 ℃,AX 5的熔点为167 ℃。
室温时AX 3与气体X 2反应生成lmol AX 5,放出热量123.8 kJ 。
该反应的热化学方程式为 。
(2014新课标II )13、室温下,将1mol 的CuSO 4·5H 2O(s)溶于水会使溶液温度降低,热效应为△H 1,将1mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为△H 2;
CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O(s) =====△CuSO 4(s)+5H 2
O(l), 热效应为△H 3。
则下列判断正确的是
A 、△H 2>△H 3
B 、△H 1<△H 3
C 、△H 1+△H 3 =△H 2
D 、△H 1+△H 2 >△H 3
(2014江苏)10.已知:C(s)+O 2(g)=CO 2(g) △H 1
CO 2(g)+C(s)=2CO(g) △H 2
2CO(g)+O 2(g)=2CO 2(g) △H 3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
(2014海南)4、标准状况下,气态分子断开1mol化学键的焓变称为键焓。
已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是()
A、H2O(g)==H2(g)+1/2O2(g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g)△H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
【答案】D
【解析】根据“H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol”,可以计算出2mol H2和1mol O2完全反应生成2mol H2O(g)产生的焓变是436KJ/mol×2+495KJ/mol×1—463KJ/mol×4= —
485KJ/mol,所以该过程的热化学方程式为2 H2(g) + O2(g)=2 H2O(g) △H = —485KJ/mol,D正确。
