化学课后答案8
北师大《无机化学》第四版习题参考答案8

精心整理第八章水溶液8-1现需1200克80%(质量分数)的酒精作溶剂。
实验室存有浓度为70%的回收酒精和95%的酒精,应各取多少进行配置?解:令用浓度为70%的酒精X 克,95%的酒精Y 克。
(70%X+95%Y )/(X+Y )=80%①X+Y =1200②由①②得,X =720Y =4808-2(1(2(3(4解:(1所以c (2(3)(4)同理c(NH 3)=)()(233O H n NH n +=18/)28100()17/28(-+×100%=29.17% 8-3如何将25克NaCl 配制成质量分数为0.25的食盐水溶液?解:令加水X 克,依题意得0.25=25/(25+X),所以X =75克所以加水75克,使25克NaCl 配成25%的食盐水。
8-4现有100.00mLNa 2CrO 4饱和溶液119.40g ,将它蒸干后得固体23.88g ,试计算:(1)Na 2CrO 4溶解度;(2)溶质的质量分数;(3)溶液的物质的量浓度;(4)Na2CrO4的摩尔分数。
解:(1)令Na2CrO4溶解度为S所以S/(S+100)=23.88g/119.40g 所以S=25g(2)ω(Na2CrO4)=23.88g/119.40g×100%=20%(3)M(Na2CrO4)=162g/mol;molgg3)/162/(88.23--1(4)8-5在-1H2SO4g/100g (H2O8-6纯甲解:m8-7解:由解得:8-8⑴胰岛素的摩尔质量;⑵溶液蒸气压下降Δp(已知在25℃时水的饱和蒸气压为3.17kPa)。
解:(1)C=Π/RT=4.34KP a/8.314P a·L·mol-1×(273+25)K=0.00175mol·L-1摩尔质量=0.101g/0.00175mol·L-1×0.01L=5771.43g/mol(2)△P=P B*×X A=3170P a×n1/(n1+n2)≈3170P a×n1/n2=3170P a×(0.101g/5771.43g/mol)×(18g/mol)/(10×1g)=0.0998P a8-9烟草的有害成分尼古丁的实验式为C5H7N,今有496mg尼古丁溶于10.0g水中,所得溶液在101kPa下的沸点为100.17°C,求尼古丁的相对分子质量。
有机化学第三版答案南开大学出版社第8章

4、按与AgNO3-酒精(SN 1)反应活性顺序排列:
(1) C6H5Br (3) CH3CH2CH2CH2Br CH3 (4) CH3CH2CHCH3 Br (5) Br (6) Br CH2Br
(2)>(1)>(4)>(3)> (6) >(5)
5.比较下列每对反应的速度:
(1) a. CH3CH2CHCH2Br CH3 b. CH3CH2CH2CH2Br + CN+ CN-
CH=CHBr CH2CN
(2)
Br
Cl
BrMg
Cl
Cl (3) CH CH3 CH3
Cl2 hv
C CH3
CH3
(4)
O2N Br
Cl
+
NH3
O2N Br
H Br
NH2
CH3 H CH3 Br H C2H5
≡
Br
H3C
H
CH3
C2H5
H
-
≡
C2H5
H
CH3 CH3
-Br -H2O
CH3 C2H5 CH3
19、有一化合物分子式为C8H10,在铁的存在下与1mol 溴作用,只生成一种化合物A,A在光照下与1mol 氯作用,生成两种产物B和C,试推断A、B、C的结 构: CH
3
CH3
Br2 Fe
Br
Cl2 光照
CH3
CH2Cl B Br
CH3 A
CH3 C Br
CH3
CH2Cl
20、化合物M的分子式为C6H11Cl,M和硝酸银醇精溶液 反应很快出现白色沉淀。M在NaOH水溶液作用下 只得到一种水解产物N,M与KI(丙酮)反应比氯 代环己烷快。试写出M,N的可能结构。
高教第二版徐寿昌有机化学课后习题答案第8章

第八章第九章第十章第十一章第十二章第十三章第十五章第十六章第十七章第十九章第二十章第二十二章第二十四章第二十五章立体化学一、下列化合物有多少中立体异构体?OHClClCl 四种三种..CHCHCHCHCHCHCHCH213333CHCH CHCH CH333CH33CH33ClHClHCl ClHCl Cl ClHH HHClHClH ClH OHHH H OH OHOHH CHCH CH333CH C H CH CH3333OHCH.33两种CHCHCHCH33CHCH33OHHHHOCH(CH))CH(CH2323CH.CHCHCHCHCH4332八种ClClCl CH CH CHCH CH CH CH CH33333333ClH Cl H H Cl H ClCl Cl H H H ClClHCl H Cl H H Cl Cl HCl ClH H H ClH Cl H ClClH Cl Cl H Cl Cl HCl ClH HH H CHCHCH CHCH CH32CHCH3322CHCHCHCH32CHCHCHCH32323232ClCH 没有3四种.CH(OH)CH(OH)COOHCH.6CH3CHClCH53CH CH CH CH3333HOHOH OHH H OHH.β-溴丙醛,没有7HOH HOHOHH OHH CHBrCHCH22COOHCOOH COOHCOOH OCHCH 两种,4-庚二烯,38.23HHCHCH32(对映体)C=C=CC=C=CCHCHCHCHHH32239.1 ,3-二甲基环戊烷,三种CH CH CH H33CH3H3H H H H CH CH33二、写出下列化合物所有立体异构。
指出其中那些是对映体,那些是非对映体。
解:颜色相同的是对映体,不同的为非对映体。
.四种立体异构,两对对映体CHCHCHCH=CH133OH OHOHCHCH33CHC=CCHC=C33HHHHHH OHOHHHCHC=CC=CCH33HCHCHH3H3HCH有三种立体异构,其中两种为3.2对映异构体CH3CHCH33HCHHCH33HH HHCHCH33但大多数认为没有立体异构,对这个题的答案有争议,Cl.应该有两对对是如果考虑环己烷衍生物的构象为椅式,3映体。
基础化学李保山第二版8-氧化还原反应习题答案

8 氧化还原反应习题解答(p222-226)1. 用氧化值法配平下列各氧化还原方程式。
(1)3Cu 2S +22HNO 3 = 6Cu(NO 3)2 +3H 2SO 4 +10NO+8H 2O (2)NH 4NO 2 = N 2 + 2H 2O(3)(NH 4)Cr 2O 7 = N 2 + Cr 2O 3 +4H 2O(4)3As 2S 3 + 28HNO 3+4 H 2O = 6 H 3AsO 4 + 9H 2SO 4 +28 NO (5)K 2Cr 2O 7 + 3H 2S +4 H 2SO 4 = Cr 2(SO 4)3 + 3S + 7H 2O + K 2SO 4 (6)2Na 2S 2O 3 + I 2 = Na 2S 4O 6 + 2NaI (7)2 MnO 4-+3 Mn 2++2 H 2O =5 MnO 2 +4 H +(8)4[Co(NH 3)6]2++ O 2 +2H 2O = 4 [Co(NH 3)6]3++ 4OH -2. 用离子-电子法配平下列方程式。
(1-11)为酸性介质,(12-14)为碱性介质 (1) Cr 2O 72-+ 3H 2O 2 + 8H += 2 Cr 3++ 3O 2 +7 H 2O (2) 2 MnO 4-+5 SO 32-+6 H += 2Mn 2++ 5 SO 42-+3 H 2O (3) ClO 3-+ 6I - + 6H += Cl - +3 I 2 + 3H 2O(4) 5NaBiO 3(s) + 2Mn 2++14 H += 5Na ++5 Bi 3++ 2 MnO 4-+7 H 2O (5) H 2S +2 Fe 3+= S +2Fe 2++ 2H +(6) 3P 4(s)+20HNO 3(浓)+8 H 2O =12H 3PO 4+20NO (7) 2FeS 2+30HNO 3Fe 2(SO 4)3+30NO 2+H 2SO 4+14H 2O (8) 7PbO 2+2MnBr 2+14HNO 37Pb(NO 3)2+2Br 2+2HMnO 4+6H 2O(9) 28HNO 3+3As 2S 3+4H 2O 9H 2SO 4+6H 3AsO 4+28NO (10) As 2S 5+10NO 3-+10H +2H 3AsO 4+10NO 2+5S+2H 2O (11) 2Bi 3++3S 2O 32-+3H 2O Bi 2S 3+3SO 42-+6H + (12) Cl 2 + 2OH -== Cl - + ClO -+ H 2O(13) 2[Cr(OH)4]-+ 3H 2O 2 + 2OH -== 2 CrO 42-+8H 2O (14) SO 32-+ Cl 2 +2OH -==2 Cl - + SO 42-+ H 2O3. (1)逆向进行(2) )(0=θ/Sn n θ+24V E E 15.=++S)(=θ/MgMg θ-V E E 37.22-=+)(2.370.15=-θ-θ+θV E E E 52.2=+=∴正向进行(3) )1.09(==θ/Br Br θ+-2V E E)(77.0==θ/Fe e F θ-+2+3V E E )(32.0=0.77-1.09=-=θ-θ+θV E E E∴正向进行(4) )(=θ/Pbθ+2V E E 13.0-=+Pb )(=θn/Z n θ-2V E E 76.0-=+Z )(0-0.13=-θ-θ+θV E E E 63.076.=+=∴正向进行4.(1)V n n E 55.1100.1)0.1(10.0lg 50592.051.1)M /O M (4824=⨯⨯+=-+-(2)V E 67.110.00.1lg 10592.072.1)Ce /Ce (34=+=++(3)VcK E E HAc 17.01075.110.0lg 0592.000.0lg 10592.0)/H H ()HAc/H (522-=⨯⨯+=+=-+θθ(4)Vc K g E E Cl sp 341.0100.1108.1lg 0592.0799.0lg 10592.0/Ag)A ()AgCl/Ag (210+=⨯⨯+=+=--+-θθ(5)Vc c c c c c E E 40.018.058.0)100.1(0.10.1lg 40592.058.0)/)(/()/(lg 40592.0)O /S SO ()O /S SO (6226OH O S 2SO 232232322323223-=+-=⨯⨯+-=+=--------θθθθ(6)Vc c p p E E O 564.0)100.1(100/0.10lg 40592.0401.0)/(/lg 40592.0)/OH O ()/OH O (434OH 222=⨯+=+=----θθθ5. 解答:(1)2Ag +(0.10 mol·L -1) + Cu(s) ==2Ag(s) + Cu 2+(0.010 mol·L -1) 电池符号: (-) Cu|Cu 2+(0.010 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) 电极反应: (+) Ag ++e = Ag(s) (-) Cu-2e = Cu 2+电动势∶V c c g E A g E Ag 740.010.0lg 0592.0799.0lg 10592.0/Ag)A ()g /A (+=+=+=+++θθV c c C Cu E C Cu E Cu 278.0010.0lg 20592.0337.0lg 20592.0)u /()u /(222+=+=+=+++θθV C Cu E A g E E 462.0278.0740.0)u /()g /A (2=-=-=++(2)MnO 2(s)+ 2Cl -(12 mol·L -1) + 4H +(12 mol·L -1) = Mn 2+(1.0 mol ·L -1) + Cl 2(100kPa) + 2H 2O(l) 电池符号:(-) Pt, Cl 2(100kPa)|Cl -(12.0 mol·L -1)||Mn 2+(1.0mol·L -1),H +(12.0 mol·L-1)|MnO 2(s),Pt(+) 电极反应:(+) MnO 2+ 4H ++2e== Mn 2++ 2H 2O\(-) 2Cl —2e== Cl 2 电动势∶Vc c c c E E Mn 36.10.112lg 20592.023.1/)/(lg 20592.0)/Mn MnO ()/Mn MnO (44H 22222+=+=+=++++θθθV c c p p E E Cl 30.1121lg 20592.036.1)/(lg 20592.0)/Cl Cl ()/Cl Cl (22Cl 222+=+=+=--θθθV E 06.030.136.1=-=(3)H 3AsO 3(0.10 mol·L -1)+ I 2(s) + H 2O(l) = H 3AsO 4(1.0 mol·L -1) + 2I -(0.010 mol·L -1) +2H +(0.10 mol·L -1) 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1), H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010mol·L -1)|I 2(s), Pt (+) 电极反应: (+) I 2+2e =2I -(-) H 3AsO 3+ H 2O-2e = H 3AsO 4+2H +电动势∶34332H AsO H 34333433H AsO 2(/)(/)0.0592(H AsO /H AsO )(H AsO /H AsO )lg2/0.0592 1.0(0.10) 0.559lg 0.52920.10c c c c E E c c Vθθθθ+=+⨯=+=+22222I 0.059210.05921(I /I )(I /I )lg 0.536lg 0.6542(/)2(1.010)E E V c c θθ----=+=+=⨯E = 0.654-0.529=0.125V(4)Cr 2O 72-(1.0 mol·L -1) + 6Fe 2+(0.10 mol·L -1) +14H +(1.0 mol·L -1) = 2Cr 3+(0.10 mol·L -1) + 6Fe 3+(1.0 mol·L -1) + 7H 2O(l) 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1), Cr 3+(0.10mol·L -1), H +(1.0 mol·L -1)|Pt (+) 电极反应:(+) Cr 2O 72-+14H ++6e = 2Cr 3++ 7H 2O(-) Fe 2+-e = Fe3+电动势∶227314Cr O H 232327272Cr (/)(/)0.0592(Cr O /Cr )(Cr O /Cr )lg 6(/)c c c c E E c c θθθθ-++-+-+=+1420.0592(1.0)(1.0)1.33lg 1.356(0.10)V =+= 323232Fe Fe /0.0592 1.0(Fe /Fe )(Fe /Fe )lg 0.7710.0592lg 0.8301/0.10c c E E Vc c θθθ++++++=+=+=+E =1.35-0.830=0.52V6. 解答:(1) E =E (+)-E (-)θθθc c c c E E E /lg 20592.0440.0/lg 20592.0)/Fe Fe ()/Fe Fe ()(22Fe Fe 22+++-=+==+++ Vc c E E E 822.0100.1lg 20592.0763.0/lg 20592.0)/Zn Zn ()/Zn Zn ()(2Zn 222-=⨯+-=+==--+++θθ 0.293= -0.440+(0.0592/2)lg c (Fe2+)+0.822 c (Fe2+)=1.0×10-3(mol ·L -1) (2)(-)Ag ∣Ag +(y mol·L -1)‖Ag +(1.0×10-1mol·L -1)∣Ag (+) E =0.0592V ,求负极Ag +的浓度。
有机化学第8,9,10章部分习题参考答案

有机化学第8,9,10章部分习题参考答案第八章部分习题参考答案1、命名下列化合物(1)3-甲基戊烯-3-醇3-氯-1,2-环氧丁烷3-甲基-3-甲氧基戊烷 (4)3-甲基-4-硝基苯酚(5)2-甲氧基苯酚2,4-二羟基苯甲醇 -3,4-二甲基-3-己烯-2-醇3-甲基-2,4戊二醇 2-甲基-1,4环己二酮2、写出下列化合物的结构式(1)OH(2)OH(3)CH2OHCH2OH(4)H3CCH3COHC2H5HOCH2CCH2OHO (5)C2H5(6)C2H5OCH2CHCH2O(7)OHBrCH2OCH2(8)CH2CHClOHC H2(9)Br(10)CHO2NNO2H3CCH3NO2OCl(11)O3、完成下列反应:(1)CH3H5C2CBrC2H5CH3H5C2CCHCH3(2)OH+C2H5I(3)OCH3COCH2(4)ClH3CCCHC2H5H3CCCH2C2H5CH3CH3(5)CH2OHCH2OH(6)CHCHCH3(7)H3CCH3CHOCHH3CCH3(8)CH3I+(CH3)2CHOH (9)CH2BrCH2MgBrCH2CH2OMgBrCH2(10)CH2CH2OHCH2O CH3CH2CCH3 (11)ONaCH3CH3IOCH3COOHOHCOOH+CH3I(12)BrCH2(13)OH(CH3)3CONa(CH3)3COCH2CH2CH34、下列各醇与卢卡斯试剂反应速率最快和最慢的分别是哪个?(1)最慢:正丁醇;最快:烯丙醇(2) 最慢:2一苯基乙醇;最快:1-苯基乙醇9、比较下列各化合物的酸性,按它们的酸性高至低排列成序。
2,4,6-三硝基苯酚>2,4-二硝基苯酚>对硝基苯酚>对甲基苯酚>苯酚>水>乙醇 10、A:11、CH2OC2H5B:CH2OHC:C2H5IA:12、OHOCH3B:OHC:CH3I13、H3CH3CCHCH2OHH3CCHCH2BrH3CCHCH2DH3CCHCH3EBrH3CH3CCH CH3OHAH3CBH3CCH3C第九章部分习题参考答案1.命名下列化合物:(1)2,3-二甲基丁醛3-甲基-1-苯基-2-丁酮4-羟基-3-甲氧基苯甲醛 (4)2-甲基环己酮(5)1-苯基-1-丙酮(6) 4-甲基-3-戊烯醛 (7)苯乙酮缩胺脲(8)乙醛缩乙二醇2.写出下列化合物的构造式:OCHCHCHOH3CCHCCH3CH2CH3OCClCH3OCOHHNOOOHHCCHCH2CH2CH2CHH3CH3CCNNHOC5.完成下列反应式:OHOHCH3CH2CH2CHCHCH2OHCH2CH3CH3CH2CH2CHCHCHOCH2CH3 NOHMnO2或Cr2O3 /吡啶CH3CH2CH2CHCCHOCH2CH3CH3CH2CH2CHCCH3CH2CH3CH3CH2CH2 CH2CHCH3CH2CH3HCOO- +OHH3CCCNCH2OHCHOH3CCHOHCH2CHOOH3CCCHOHC2H5CCH3CHOOCH3H3COCH3OMgBrOCH3CC2H5CHOCH3 OMgBrC6H5OHOH3CCCH3CHOCH2CCH3CH OHCH2CCH3CH3CH3CH3MgBrCCH3OMgBrCH3CH3COHCH37.按与HCN反应活性大小排列:(3)>(2)>(1)>(8)>(7)>(4)>(5)>(6) 8.O(A)CH3COCCH2CH2CHO或CH3CCH3CCH2CH2CCH3CH3CH3(B)9.CH3CCH2CH2COOHOH(A)CH3CH2CH2CHCHCH3OCH3CH3(B)CH3CH2CH2CHCCH3CH3(C)10CH3OC(D)CH3COOHOHOCH2CCH3.CH2CCH3CH2CHCH3CH2CH2CH3(A)(B)OCH3OCH3(C)OH(D)OH第十章部分习题参考答案1、命名下列化合物:(1) 3-苯基丁酸(β-苯基丁酸) (2)邻溴环己烷甲酸(2-溴环己烷甲酸) (3) 3-苯基丙烯酸(4)对氨基苯甲酸(5) 3-甲基-3-羟基戊二酸(6)2-乙酰基-3-苯基丙酸 (7) 邻羟基苯甲酸乙酯 (8)对乙氧基苯甲酰氯(9) 乙酸丙酸酐 (10)N,N-二甲基-2-甲基丙酰胺2.写出下列化合物的结构:5-甲基-1-萘甲酸水杨酸COOHCOOHα,γ-二氯-β-甲基戊酸顺-4-羟基环己烷羧酸ClH3CCH3ClCOOHOHCOOHCH3OH对苯二甲酰氯 N-甲基苯甲酰胺OCClOCNHCH3COCl(7)α-甲基丙烯酸甲酯;(8)三乙酸甘油酯CH2OOCCHCH2CCH3COOCH3333CHCOOCHCH2COOCH3.比较下列各组化合物的酸性:三氯乙酸>氯乙酸>乙酸>丙酸对氯苯甲酸>苯甲酸>对甲基苯甲酸>苯酚草酸>胡萝卜酸>蚁酸>安息香酸>醋酸>酪酸>石碳酸COOHOHCOOHCOOHCOOH>>OH>OH6.完成下列反应式,并写出各化合物的结构: (1) CH2CH2BrCH2CH2MgBr(A)CH2CH2COOH(B)(C)(2)OO(A)CH3COOH(E)(B)CH3CClOHCCH3CH2(C)CCH3(D)CH2MgBr( 3)OCH3COOHCH3COClCH3CH2CH2COOOCCH3(4)Cl2 / P(5)OCH2CCH3CHCH2COOCH2O2NCHCOClC2H5OCH2CCH3CHCH2CCH2COOCH2CCH3CHCH2COHOCH2CH2OCH3OCH3C lO(6)CH2COOHCH2COOHOHCH2CH3OHCH2CH2CH2CH2CCH2CH2O(7) CH3CH2CH2C (8)COOHOOCOCH3CH3(9)COONaOH(10)OCOHCOCH3OOCNH2COCH3ONaClO + NaOH9.CH3CH2CHCH2CH2OOCHCOOHSOCl2CH3CH2CHCH2CH2OOCHCOCl催化加氢(A)C2H5OHCH3CH2CHCH2CH2OOCHCOOC2H5CH3CH2CHCH2CH2CH3CH2CH2COOHCH2高温KMnO4CH3CH2CHCH2CH2OHCH2OHCH3CH2CHCOOHCOOHH2SO4(浓)(B)10.(A)CH3CHCOONHCH34(B)CH3CHCONH4CH3(C)CH3CHCOOHCH3O (D)CH3CHCH2OHCH3(E)CH3CHCH2CH3(F)CH3CCH3O11.OCH3COCHCH2(A)(B)CH2CHCOCH312.OHACH2CH2COOHBCHCHCOOH22COD第八章部分习题参考答案1、命名下列化合物(1)3-甲基戊烯-3-醇3-氯-1,2-环氧丁烷3-甲基-3-甲氧基戊烷 (4)3-甲基-4-硝基苯酚(5)2-甲氧基苯酚2,4-二羟基苯甲醇 -3,4-二甲基-3-己烯-2-醇3-甲基-2,4戊二醇 2-甲基-1,4环己二酮2、写出下列化合物的结构式(1)OH(2)OH(3)CH2OHCH2OH(4)H3CCH3COHC2H5HOCH2CCH2OHO (5)C2H5(6)C2H5OCH2CHCH2O(7)OHBrCH2OCH2(8)CH2CHClOHCH2(9)Br(10)CHO2NNO2H3CCH3NO2OCl(11)O3、完成下列反应:(1)CH3H5C2CBrC2H5CH3H5C2CCHCH3(2)OH+C2H5I(3)OCH3COCH2(4)ClH3CCCHC2H5H3CCCH2C2H5CH3CH3(5)CH2OHCH2OH(6)CHCHCH3(7)H3CCH3CHOCHH3CCH3(8)CH3I+(CH3)2CHOH (9)CH2BrCH2MgBrCH2CH2OMgBrCH2(10)CH2CH2OHCH2O CH3CH2CCH3 (11)ONaCH3CH3IOCH3COOHOHCOOH+CH3I(12)BrCH2(13)OH(CH3)3CONa(CH3)3COCH2CH2CH34、下列各醇与卢卡斯试剂反应速率最快和最慢的分别是哪个?(1)最慢:正丁醇;最快:烯丙醇(2) 最慢:2一苯基乙醇;最快:1-苯基乙醇9、比较下列各化合物的酸性,按它们的酸性高至低排列成序。
武汉大学无机化学课后习题答案2-8章

第二章第二章1.某气体在293K与9.97×104Pa时占有体积1.910-1dm3其质量为0.132g,试求这种气体的相对分子质量,它可能是何种气体? 解2.一敝口烧瓶在280K时所盛的气体,需加热到什么温度时,才能使其三分之一逸出? 解3.温度下,将1.013105Pa的N2 2dm3和0.5065Pa的O23 dm3放入6 dm3的真空容器中,求O2和N2的分压及混合气体的总压。
的分压及混合气体的总压。
解4.容器中有4.4 g CO2,14 g N2,12.8g O2,总压为2.026105Pa,求各组分的分压。
,求各组分的分压。
解5.在300K,1.013105Pa时,加热一敝口细颈瓶到500K,然后封闭其细颈口,并冷却至原来的温度,求这时瓶内的压强。
来的温度,求这时瓶内的压强。
解dm3洁净干燥的空气缓慢通过H3C—O—CH3液体,1.0 dm6.在273K和1.013×105Pa下,将1.0 时的饱和蒸汽压。
在此过程中,液体损失0.0335 g,求此种液体273K时的饱和蒸汽压。
解7.有一混合气体,总压为150Pa,其中N2和H2的体积分数为0.25和0.75,求H2和N2的分压。
分压。
解8.在291K和总压为1.013×105Pa时,2.70 dm3含饱和水蒸汽的空气,通过CaCl2干燥管,完全吸水后,干燥空气为3.21 g,求291K时水的饱和蒸汽压。
时水的饱和蒸汽压。
解9.有一高压气瓶,容积为30 30 dmdm3,能承受2.6×107Pa,问在293K时可装入多少千克O2而不致发生危险?而不致发生危险?解10.在273K时,将同一初压的4.0 dm3 N2和1.0dm3 O2压缩到一个容积为2 dm3的真空容器中,混合气体的总压为3.26×105 Pa,试求,试求(1)两种气体的初压;)两种气体的初压;(2)混合气体中各组分气体的分压;)混合气体中各组分气体的分压;(3)各气体的物质的量。
有机化学课后习题答案-南开大学版-8卤代烃

(4) O2N Br
NH2
(5)
C=C
3.按与 NaI-丙酮反应的活性顺序排列下面化合物。 (5)>(4)>(1)>(2)>(3)>(6) 4. 按与 AgNO3-酒精(SN1)反应活性顺序排列下列化合物。 (2)>(1)>(4)>(3)>(6)>(5) 5. 比较下列每对反应的速度。 (1)~(6): 全都是 b>a。 6.完成下列转化:
Cl2/H2O Cl2 hv
CH3CHCH2Cl CH2CH=CH2 Cl
Cl2/H2O
b: CH3CH2CH2Cl NaOH/C2H5OH CH3CH=CH2
CH2CH CH2 Cl OH Cl
(3)
OH
PBr3
Br
(CH3)2CuLi
CH3
1
(4)
BrCH3MgI源自CH3Mg 乙醚 Na D2O
CH3CH2 O CH2 Cl
CH3 Cl H CH3 H H B CH3
CH3CH2 O CH2+
CH3CH2O=CH2
+
H 14. H
CH3
Cl H
CH3 H
C=C
H CH3
Cl H
CH3
CH3 H
Cl H
CH3
CH3 H B
H CH3
C=C
H CH3
H
H
CH3 H
CH3
Cl H
CH3 H B
CH3
CHCH2CH3 苄卤代烃 CH2CHCH3 仲卤代烃
1-苯基-1-氯丙烷
1-苯基-2-氯丙烷
CH2CH2CH2Cl
Cl 伯卤代烃
徐寿昌有机化学2-8章课后答案

.徐寿昌编《有机化学》第二版习题参考答案第二章 烷烃1、用系统命名法命名下列化合物1.(CH 3)2CHC(CH 3)2CHCH 3CH 32.CH 3CH 2CH CHCH 2CH 2CH 3CH 3CH(CH 3)2(1)2,3,3,4-四甲基戊烷 (2)3-甲基-4-异丙基庚烷3.CH 3CH 2C(CH 3)2CH 2CH 34.CH 3CH 3CH 2CHCH 2CH 2CCH 2CH3CHCH 3CH 3CH 2CH 312345678(3)3,3-二甲基戊烷 (4)2,6-二甲基-3,6-二乙基辛烷5.12345676.(5)2,5-二甲基庚烷 (6)2-甲基-3-乙基己烷7.8.1234567(7)2,2,4-三甲基戊烷 (8)2-甲基-3-乙基庚烷 2、试写出下列化合物的结构式(1) 2,2,3,3-四甲基戊烷 (CH 3)3CC(CH 2)2CH 2CH 3(2) 2,3-二甲基庚烷 (CH 3)2CHCH(CH 3)CH 2CH 2CH 2CH 3 (3) 2,2,4-三甲基戊烷 (CH 3)3CCH 2CH(CH 3)2(4) 2,4-二甲基-4-乙基庚烷 (CH 3)2CHCH 2C(CH 3)(C 2H 5)CH 2CH 2CH 3 (5) 2-甲基-3-乙基己烷 (CH 3)2CHCH(C 2H 5)CH 2CH 2CH 3 (6) 三乙基甲烷 CH 3CH 2CH(C 2H 5)2(7) 甲基乙基异丙基甲烷 (CH 3)2CHCH(CH 3)CH 2CH 3 (8) 乙基异丁基叔丁基甲烷 CH 3CH(CH 3)CH 2CH(C 2H 5)C(CH 3)3 3、用不同符号表示下列化合物中伯、仲、叔、季碳原子3CH2CCH32CH3CCH3CH31.001111112CH342.430011323)334、下列各化合物的系统命名对吗?如有错,指出错在哪里?试正确命名之。
分析化学答案第8,9章

第5章 重量分析法和沉淀滴定法思考题1. 解释下列现象。
a. CaF 2在 pH =3的溶液中的溶解度较在 pH=5的溶液中的溶解度大;答:这是由于酸效应的影响。
因为()spsp F H K K α'=⋅,随着[H +]的增大,()F H α也增大,sp K '也随之增大,即溶解度变大。
所以,CaF 2在 pH =3的溶液中的溶解度较在 pH=5的溶液中的溶解度大。
b .Ag 2CrO 4在 mol ·L -1AgNO 3溶液中的溶解度较在 mol ·L -1K 2CrO 4溶液中的溶解度小; 答:Ag 2CrO 4的p K sp =Ag 2CrO 4在 mol ·L -1AgNO 3溶液中的溶解度s 1:15.7111.7122101[]0.001010sp KAg mol L s ---+⋅=== Ag 2CrO 4在 mol ·L -1K 2CrO 4溶液中的溶解度s 2:14.36210mol L s --⋅===所以, s 1< s 2,即Ag 2CrO 4在 mol ·L -1AgNO 3溶液中的溶解度较在 mol ·L -1K 2CrO 4溶液中的溶解度小。
c. BaSO 4沉淀要用水洗涤,而 AgCl 沉淀要用稀 HNO 3洗涤;答:BaSO 4沉淀要水洗涤的目的是洗去吸附在沉淀表面的杂质离子。
AgCl 沉淀为无定形沉淀,不能用纯水洗涤,这是因为无定形沉淀易发生胶溶,所以洗涤液不能用纯水,而应加入适量的电解质。
用稀HNO 3还可防止Ag +水解,且HNO 3加热易于除去。
d .BaSO 4沉淀要陈化,而 AgCl 或Fe 2O 3·nH 2O 沉淀不要陈化;答:BaSO 4沉淀为晶形沉淀,陈化可获得完整、粗大而纯净的晶形沉淀。
而 AgCl 或Fe 2O 3·nH 2O 沉淀为非晶形沉淀。
基础化学习题解答(8)

习题解答(第八章)一、选择题1. 下列反应中,属于氧化还原反应的是( C )A.硫酸与氢氧化钡溶液的反应B.石灰石与稀盐酸的反应C.二氧化锰与浓盐酸在加热条件下反应D.醋酸钠的水解反应2. 单质A和单质B化合成AB(其中A显正价),下列说法正确的是( C )A. B被氧化B. A是氧化剂C. A发生氧化反应D. B具有还原性3. 对于原电池的电极名称,叙述中有错误的是( B )A.电子流入的一极为正极B.发生氧化反应的一极是正极C.电子流出的一极为负极D.比较不活泼的金属构成的一极为正极4. 根据下列反应:2FeCl3+Cu→2FeCl2+CuCl22Fe3++Fe→3Fe2+2KMnO4+10FeSO4+8H2SO4→2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 判断电极电势最大的电对为( C )A.Fe3+/Fe2+B.Cu2+/CuC.MnO4-/Mn2+D.Fe2+/Feϕ5. 在含有Cl-,Br-,I-离子的混合溶液中,欲使I-氧化成I2,而Br-,Cl-不被氧化,根据φ值大小,应选择下列氧化剂中的( B )A.KMnO4B.K2Cr2O7C.(NH4)2S2O8D.FeCl36. 在酸性溶液中和标准状态下,下列各组离子可以共存的是( D )A.MnO4- 和Cl-B.Fe3+ 和Sn2+C.NO3- 和Fe2+D.I- 和Sn4+7. 利用标准电极电势表判断氧化反应进行的方向,正确的说法是( B )A.氧化态物质与还原态物质起反应;ϕ较大电对的氧化态物质与φϕ较小电对的还原态物质起反应;B. φC.氧化性强的物质与氧化性弱的物质起反应;D.还原性强的物质屯还原性弱的物质起反应。
二、是非题(下列叙述中对的打“√”,错的打“×”)1. MnO4-离子中,Mn和O的化合价分别为+8和-2。
( ×)2. 根据标准电极电势判定SnCl2 + HgCl2 =SnCl4 + Hg反应能自发向右进行。
生物化学课后习题答案-第八章xt8

第八章 脂代谢一、 课后习题1.为什么说脂肪氧化可产生大量内源性水?2.如果用14C标记乙酰CoA的两个碳原子,并加入过量的丙二酸单酰CoA,用纯化的脂肪酸合成酶体系来催化脂肪酸的合成,在合成的软脂肪酸中,哪两个碳原子是被标记的?3.1mol三软脂酰甘油酯完全氧化分解,产生多少摩尔ATP?多少molCO2?如由3mol软脂肪酸和1mol甘油合成1mol三软脂酰甘油酯,需要多少摩尔ATP?4.在动物细胞中由丙酮酸合成1mol己酸,需净消耗多少摩尔ATP及NADPH?5.1mol下列含羟基不饱和脂肪酸完全氧化成CO2和水?可净生成多少摩尔ATP?CH3-CH2-CH2-CH-CH2-CH2CH-COOHOH6.据你所知,乙酰CoA在动物体内可转变成哪些物质?解析:1.生物体内的主要脂类物质中,脂肪是体内的储存能源物质,其氧化分解后比糖产生多得多的能量,这主要是由于脂肪酸含有高比例的氢氧比,含氢多,脱氢机会多,氧化后产生大量内源性水必然高。
2.标记碳原子将会出现在软脂酸的碳链末端(远羧基端)的15、16号碳原子。
乙酰CoA在脂肪酸的合成过程中是初始原料,而直接原料为丙二酰CoA,乙酰CoA通过羧化形成丙二酰CoA。
合成起始引物为乙酰CoA,合成过程直接由丙二酰CoA提供二碳单位,所以标记首先出现在远羧基端的两个碳原子上。
3.1mol三软脂酰甘油脂首先在脂肪酶的水解作用下生成1mol甘油和3mol软脂酸。
甘油在甘油激酶和ATP供能的作用下生成α-磷酸甘油,α-磷酸甘油再在α-磷酸甘油脱氢酶的作用下生成二羟磷酸丙酮和NADH+H+,二羟磷酸丙酮由此可插入酵解途径生成丙酮酸,丙酮酸再进入TCA循环,能量产生如下:10+2.5+2+2.5(苹果酸穿梭)×2-1=18.5molATP 或10+2.5+2+1.5(α-磷酸甘油穿梭)×2-1=16.5molATP;软脂酸通过β-氧化过程完成完全氧化,1mol软脂酸需要7次循环氧化,每个循环产生一个FADH+H+和NADH + H+,最终产生8mol乙酰2molATP,能量产生如下:[(1.5+2.5)× 7 + 8× 10 - 2] × 3 = 318molATP。
有机化学(刘军主编)第8章习题参考答案
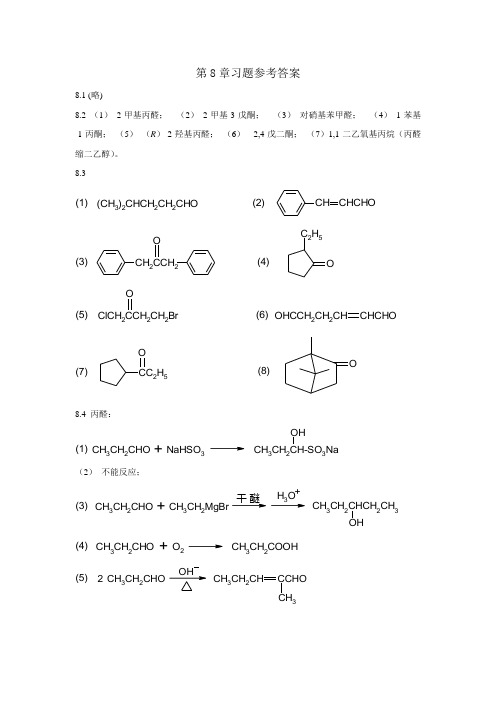
第8章习题参考答案8.1 (略)8.2 (1) 2-甲基丙醛; (2) 2-甲基-3-戊酮; (3) 对硝基苯甲醛; (4) 1-苯基-1-丙酮; (5) (R )-2-羟基丙醛; (6) 2,4-戊二酮; (7)1,1-二乙氧基丙烷(丙醛缩二乙醇)。
8.3(CH 3)2CHCH 2CH 2CHOCH CHCHO(1)(2)CH 2CCH 2OOC 2H 5(3)(4)OHCCH 2CH 2CHCHCHOClCH 2CCH 2CH 2BrO(5)(6)CC 2H 5OO(7)(8)8.4 丙醛:CH 3CH 2CH-SO 3NaOHCH 3CH 2CHONaHSO 3(1)+(2) 不能反应;CH 3CH 2CHCH 2CH 3OHCH 3CH 2CHOCH 3CH 2MgBrH 3O (3)+干 醚+CH 3CH 2CHOO 2CH 3CH 2COOH (4)+CH 3CH 3CH 2CHCCHO CH 3CH 2CHOOH2(5)CH 3CH 2CHOOCH 2CH 2CH 3CH 2CHOClH OH OH(6)+干CH 3CH 2COONH 4AgCH 3CH 2CHO Ag(NH 2)2OH(7)++CH 3CH 2CH 2OHCH 3CH 2CHO LiAlH 4OH 2(8)+干 醚CH 3CH 2CH=NNHC 6H 5CH 3CH 2CHONHNH 2(9)+CH 3CH 2CH 3CH 3CH 2CHOZn-Hg , HCl(10)苯乙酮: (1) 不能反应; (2) 不能反应;CH 3CH 2MgBrH 3O OOH C 2H 5CCH 3CH 3C(3)+干 醚+(4) 不能反应; (5) 难反应;OO CH 2CH 2CH 3ClH OHOHC 6H 5COCH 3C(6)+干(7) 不能反应;LiAlH 4OH 2CHCH 3OHOCH 3C (8)+干 醚NHNH 2NNHCH 3OCH 3C(9)+CZn-Hg , HClCH 2CH 3OCH 3C(10)8.5 能发生碘仿反应的化合物:(2)、(5)、(8)、(10);能和饱和NaHSO 3溶液反应的化合物:(1)、(2)、(3)、(6)、(9)、(10); 能发生银镜反应的化合物:(1)、(3)、(9)、(10)8.6 能与2,4-二硝基苯肼反应的化合物:(1)、(2)、(3)、(4)、(6); 能发生自身羟醛缩合反应的化合物:(2)、(6); 能发生康尼扎罗反应的化合物:(1)、(4); 8.7KMnO 4H 2SO 4CH 3CH 2C CNOH CH 3(1) (A),;(B) (CH 3)3C CH 2OH(CH 3)3C COONa(2) (A)(B)HgSO 4,O H 2NaOH,Cl 2(NaOCl)(3)(A)(B)COOHHOOCCH 3CHOHCHCHO CH 3(4)(A)(5)(A)8.8O(CH 3)2CCC(CH 3)2CH 3CCHOOCH 3CCH 2CH 3O CH 3CHO CHO(1)>>>>CH 3CCH 2CH 3OCCl 3CCH 2CH 3O(2)>OO(3)>8.9 (3) > (5) > (3) > (1) > (4)8.10 (1) 首先在三者中加入次碘酸钠溶液,不发生碘仿反应者为丁醛;然后把能够发生碘仿反应的两者再加NaHSO 3饱和溶液试验,能够产生白色结晶者为2-丁酮,无此反应者为2-丁醇。
普通化学 第八章课后答案

第八章配合物配合物思考题与答案1.设计一些实验,证明粗盐酸的黄色是Fe3+与Cl-的络离子而不是铁的水合离子或者羟合离子的颜色。
(略)2.配位化学创始人维尔纳发现,将等物质的量的黄色CoCl3.6NH3﹑紫红色CoCl3.5NH3﹑绿色CoCl3.4NH3和紫色CoCl3.4NH3四种配合物溶于水,加入硝酸银,立即沉淀的氯化银分别为3 ﹑2 ﹑1 ﹑1mol,请根据实验事实推断它们所含的配离子的组成。
答:配离子分别是[Co(NH3)6]3+, [Co(NH3)5Cl]2+ , [Co(NH3)4Cl2] +, [Co(NH3)4Cl2] +,颜色不同的原因是有同分异构体。
3.实验测得Fe(CN)64-和Co(NH3) 63+均为反磁性物质(磁矩等于零),问它们的杂化轨道类型。
答:中心二价Fe2+亚铁离子外层价电子排布是3d6,有4个未成对电子,测得Fe(CN)64-为抗磁性物质,说明中心的铁离子的外层价电子排布发生变化,进行了重排,使得内层3d轨道上没有未成对电子,所以应采取的是d2sp3杂化方式。
三价Co离子外层价电子排布也是3d6,也有4个未成对电子,测得Co(NH3) 63+为反磁性物质,原理同上,也是d2sp3杂化方式。
4.实验证实,Fe(H2O)63+和Fe(CN) 63-的磁矩差别极大,如何用价键理论来理解?答:Fe(H2O)63+的中心离子铁是采用sp3d2杂化方式,外轨型配合物,高自旋,有5个成单电子,磁矩高;而Fe(CN) 63-采用的是d2sp3杂化方式,内轨型配合物,低自旋,只有1个成单电子,所以磁矩低。
5.上题的事实用晶体场理论又作如何理解?略6.用晶体场理论定性地说明二价和三价铁的水合离子的颜色不同的原因。
略7.FeF63-为 6 配位,而FeCl4-为四配位,应如何解释?1答:三价Fe的外层价电子层电子排布是3d3,d轨道上有2个空轨道。
同样作为中心离子,作为负电荷的配体之间的排斥力是需要重点考虑的。
基础化学李保山第二版8-氧化还原反应习题答案

8 氧化还原反应习题解答(p222-226)1. 用氧化值法配平下列各氧化还原方程式。
(1)3Cu 2S +22HNO 3 = 6Cu(NO 3)2 +3H 2SO 4 +10NO+8H 2O (2)NH 4NO 2 = N 2 + 2H 2O(3)(NH 4)Cr 2O 7 = N 2 + Cr 2O 3 +4H 2O(4)3As 2S 3 + 28HNO 3+4 H 2O = 6 H 3AsO 4 + 9H 2SO 4 +28 NO (5)K 2Cr 2O 7 + 3H 2S +4 H 2SO 4 = Cr 2(SO 4)3 + 3S + 7H 2O + K 2SO 4 (6)2Na 2S 2O 3 + I 2 = Na 2S 4O 6 + 2NaI (7)2 MnO 4-+3 Mn 2++2 H 2O =5 MnO 2 +4 H +(8)4[Co(NH 3)6]2++ O 2 +2H 2O = 4 [Co(NH 3)6]3++ 4OH -2. 用离子-电子法配平下列方程式。
(1-11)为酸性介质,(12-14)为碱性介质 (1) Cr 2O 72-+ 3H 2O 2 + 8H += 2 Cr 3++ 3O 2 +7 H 2O (2) 2 MnO 4-+5 SO 32-+6 H += 2Mn 2++ 5 SO 42-+3 H 2O (3) ClO 3-+ 6I - + 6H += Cl - +3 I 2 + 3H 2O(4) 5NaBiO 3(s) + 2Mn 2++14 H += 5Na ++5 Bi 3++ 2 MnO 4-+7 H 2O (5) H 2S +2 Fe 3+= S +2Fe 2++ 2H +(6) 3P 4(s)+20HNO 3(浓)+8 H 2O =12H 3PO 4+20NO (7) 2FeS 2+30HNO 3Fe 2(SO 4)3+30NO 2+H 2SO 4+14H 2O (8) 7PbO 2+2MnBr 2+14HNO 37Pb(NO 3)2+2Br 2+2HMnO 4+6H 2O(9) 28HNO 3+3As 2S 3+4H 2O 9H 2SO 4+6H 3AsO 4+28NO (10) As 2S 5+10NO 3-+10H +2H 3AsO 4+10NO 2+5S+2H 2O (11) 2Bi 3++3S 2O 32-+3H 2O Bi 2S 3+3SO 42-+6H + (12) Cl 2 + 2OH -== Cl - + ClO -+ H 2O(13) 2[Cr(OH)4]-+ 3H 2O 2 + 2OH -== 2 CrO 42-+8H 2O (14) SO 32-+ Cl 2 +2OH -==2 Cl - + SO 42-+ H 2O3. (1)逆向进行(2) )(0=θ/Sn n θ+24V E E 15.=++S)(=θ/MgMg θ-V E E 37.22-=+)(2.370.15=-θ-θ+θV E E E 52.2=+=∴正向进行(3) )1.09(==θ/Br Br θ+-2V E E)(77.0==θ/Fe e F θ-+2+3V E E )(32.0=0.77-1.09=-=θ-θ+θV E E E∴正向进行(4) )(=θ/Pbθ+2V E E 13.0-=+Pb )(=θn/Z n θ-2V E E 76.0-=+Z )(0-0.13=-θ-θ+θV E E E 63.076.=+=∴正向进行4.(1)V n n E 55.1100.1)0.1(10.0lg 50592.051.1)M /O M (4824=⨯⨯+=-+-(2)V E 67.110.00.1lg 10592.072.1)Ce /Ce (34=+=++(3)VcK E E HAc 17.01075.110.0lg 0592.000.0lg 10592.0)/H H ()HAc/H (522-=⨯⨯+=+=-+θθ(4)Vc K g E E Cl sp 341.0100.1108.1lg 0592.0799.0lg 10592.0/Ag)A ()AgCl/Ag (210+=⨯⨯+=+=--+-θθ(5)Vc c c c c c E E 40.018.058.0)100.1(0.10.1lg 40592.058.0)/)(/()/(lg 40592.0)O /S SO ()O /S SO (6226OH O S 2SO 232232322323223-=+-=⨯⨯+-=+=--------θθθθ(6)Vc c p p E E O 564.0)100.1(100/0.10lg 40592.0401.0)/(/lg 40592.0)/OH O ()/OH O (434OH 222=⨯+=+=----θθθ5. 解答:(1)2Ag +(0.10 mol·L -1) + Cu(s) ==2Ag(s) + Cu 2+(0.010 mol·L -1) 电池符号: (-) Cu|Cu 2+(0.010 mol·L -1)||Ag +(0.10 mol·L -1)|Ag (+) 电极反应: (+) Ag ++e = Ag(s) (-) Cu-2e = Cu 2+电动势∶V c c g E A g E Ag 740.010.0lg 0592.0799.0lg 10592.0/Ag)A ()g /A (+=+=+=+++θθV c c C Cu E C Cu E Cu 278.0010.0lg 20592.0337.0lg 20592.0)u /()u /(222+=+=+=+++θθV C Cu E A g E E 462.0278.0740.0)u /()g /A (2=-=-=++(2)MnO 2(s)+ 2Cl -(12 mol·L -1) + 4H +(12 mol·L -1) = Mn 2+(1.0 mol ·L -1) + Cl 2(100kPa) + 2H 2O(l) 电池符号:(-) Pt, Cl 2(100kPa)|Cl -(12.0 mol·L -1)||Mn 2+(1.0mol·L -1),H +(12.0 mol·L-1)|MnO 2(s),Pt(+) 电极反应:(+) MnO 2+ 4H ++2e== Mn 2++ 2H 2O\(-) 2Cl —2e== Cl 2 电动势∶Vc c c c E E Mn 36.10.112lg 20592.023.1/)/(lg 20592.0)/Mn MnO ()/Mn MnO (44H 22222+=+=+=++++θθθV c c p p E E Cl 30.1121lg 20592.036.1)/(lg 20592.0)/Cl Cl ()/Cl Cl (22Cl 222+=+=+=--θθθV E 06.030.136.1=-=(3)H 3AsO 3(0.10 mol·L -1)+ I 2(s) + H 2O(l) = H 3AsO 4(1.0 mol·L -1) + 2I -(0.010 mol·L -1) +2H +(0.10 mol·L -1) 电池符号:(-) Pt|H 3AsO 4 (1.0 mol·L -1), H +(0.10 mol·L -1), H 3AsO 3(0.10 mol·L -1)||I -(0.010mol·L -1)|I 2(s), Pt (+) 电极反应: (+) I 2+2e =2I -(-) H 3AsO 3+ H 2O-2e = H 3AsO 4+2H +电动势∶34332H AsO H 34333433H AsO 2(/)(/)0.0592(H AsO /H AsO )(H AsO /H AsO )lg2/0.0592 1.0(0.10) 0.559lg 0.52920.10c c c c E E c c Vθθθθ+=+⨯=+=+22222I 0.059210.05921(I /I )(I /I )lg 0.536lg 0.6542(/)2(1.010)E E V c c θθ----=+=+=⨯E = 0.654-0.529=0.125V(4)Cr 2O 72-(1.0 mol·L -1) + 6Fe 2+(0.10 mol·L -1) +14H +(1.0 mol·L -1) = 2Cr 3+(0.10 mol·L -1) + 6Fe 3+(1.0 mol·L -1) + 7H 2O(l) 电池符号:(-)Pt|Fe 3+(1.0 mol·L -1), Fe 2+(0.10 mol·L -1)||Cr 2O 72-(1.0mol·L -1), Cr 3+(0.10mol·L -1), H +(1.0 mol·L -1)|Pt (+) 电极反应:(+) Cr 2O 72-+14H ++6e = 2Cr 3++ 7H 2O(-) Fe 2+-e = Fe3+电动势∶227314Cr O H 232327272Cr (/)(/)0.0592(Cr O /Cr )(Cr O /Cr )lg 6(/)c c c c E E c c θθθθ-++-+-+=+1420.0592(1.0)(1.0)1.33lg 1.356(0.10)V =+= 323232Fe Fe /0.0592 1.0(Fe /Fe )(Fe /Fe )lg 0.7710.0592lg 0.8301/0.10c c E E Vc c θθθ++++++=+=+=+E =1.35-0.830=0.52V6. 解答:(1) E =E (+)-E (-)θθθc c c c E E E /lg 20592.0440.0/lg 20592.0)/Fe Fe ()/Fe Fe ()(22Fe Fe 22+++-=+==+++ Vc c E E E 822.0100.1lg 20592.0763.0/lg 20592.0)/Zn Zn ()/Zn Zn ()(2Zn 222-=⨯+-=+==--+++θθ 0.293= -0.440+(0.0592/2)lg c (Fe2+)+0.822 c (Fe2+)=1.0×10-3(mol ·L -1) (2)(-)Ag ∣Ag +(y mol·L -1)‖Ag +(1.0×10-1mol·L -1)∣Ag (+) E =0.0592V ,求负极Ag +的浓度。
有机化学课后习题参考答案完整版

目录第一章绪论...................................................错误!未定义书签。
第二章饱和烃.................................................错误!未定义书签。
第三章不饱和烃...............................................错误!未定义书签。
第四章环烃...................................................错误!未定义书签。
第五章旋光异构...............................................错误!未定义书签。
第六章卤代烃.................................................错误!未定义书签。
第七章波谱法在有机化学中的应用...............................错误!未定义书签。
第八章醇酚醚.................................................错误!未定义书签。
第九章醛、酮、醌.............................................错误!未定义书签。
第十章羧酸及其衍生物.........................................错误!未定义书签。
第十一章取代酸...............................................错误!未定义书签。
第十二章含氮化合物...........................................错误!未定义书签。
第十三章含硫和含磷有机化合物.................................错误!未定义书签。
第十四章碳水化合物...........................................错误!未定义书签。
大学物理化学核心教程课后参考答案第8章

第八章电化学一.基本要求1.理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday 定律等;2.掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等;了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算;3.了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写出电极反应、电池反应,会计算电极电势和电池的电动势;4.掌握电动势测定的一些重要应用,如:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等;5.了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势;二.把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点;电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念;影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hückel极限定律;电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等;在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面;电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一;会熟练地书写电极反应和电池反应是学好电化学的基础,以后在用Nernst 方程计算电极电势和电池的电动势时才不会出错,才有可能利用正确的电动势的数值来计算其它物理量的变化值,如:计算热力学函数的变化值,电池反应的标准平衡常数,难溶盐的活度积,水的解离平衡常数和电解质的离子平均活度因子等;学习电化学一方面要掌握电化学的基本原理,但更重要的是关注它的应用;对于可逆电池的实验可测量有:可逆电池的电动势E 、标准可逆电动势E 和电动势的温度系数pE T ∂⎛⎫ ⎪∂⎝⎭,利用这些实验的测定值,可以用来: 1 计算热力学函数的变化量,如r m r m r m r m R , , , , G G S H Q ∆∆∆∆等;2 计算电池反应的标准平衡常数,难溶盐的活度积ap K 和水的解离常数W K 等;3 根据电动势数值的正、负,来判断化学反应自发进行的方向;4 计算离子的平均活度因子γ±;5 计算未知溶液的pH 值;6 进行电势滴定7 绘制电势-pH 图,并用于金属的防腐及湿法冶金等;在这些应用中,难免要用到如何将一个化学反应设计成相应电池的问题,所以要了解如何将一些简单的化学反应设计成相应可逆电池的方法;现在使用的标准电极电势表基本上都是氢标还原电极电势,所以关于氧化电极电势可以不作要求,免得在初学时发生混淆;学习电解和极化的知识,主要是了解电化学的基本原理在电镀、电解、防腐和化学电源等工业上的应用,充分利用网络资源,都了解一些最新的绿色环保的新型化学电源,如氢-氧燃料电池和锂离子电池等;了解电解合成、电化学防腐等应用实例,拓宽知识面,提高学习兴趣,充分了解物理化学学科的实用性的一面;三.思考题参考答案1.什么是正极什么是负极两者有什么不同什么是阴极什么是阳极两者有什么不同答:比较电池中两个电极的电极电势,电势高的电极称为正极,电势低的电极称为负极;电流总是从电势高的正极流向电势低的负极,电子的流向与电流的流向刚好相反,是从负极流向正极;根据电极上进行的具体反应,发生还原作用的电极称为阴极,发生氧化作用的电极称为阳极;在原电池中,阳极因电势低,所以是负极;阴极因电势高,所以是正极;在电解池中,阳极就是正极,阴极就是负极;2.电解质溶液的电导率随着电解质浓度的增加有什么变化答:要分强电解质和弱电解质两种情况来讨论;电解质溶液的电导率是指单位长度和单位截面积的离子导体所具有的电导;对于强电解质,如HCl, H SO, NaOH24等,溶液浓度越大,参与导电的离子越多,则其电导率会随着浓度的增加而升高;但是,当浓度增加到一定程度后,由于电解质的解离度下降,再加上正、负离子之间的相互作用力增大,离子的迁移速率降低,所以电导率在达到一个最大值后,会随着浓度的升高反而下降;对于中性盐,如KCl等,由于受饱和溶解度的限制,在到达饱和浓度之前,电导率随着浓度的增加而升高;对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,所以在电解质的浓度增加的情况下,其离子的浓度还是基本不变,所以弱电解质溶液的电导率随浓度的变化不显着,一直处于比较低的状态;3.电解质溶液的摩尔电导率随着电解质浓度的增加有什么变化答:要分强电解质和弱电解质两种情况来讨论;电解质溶液的摩尔电导率是指,将含有1 mol 电解质的溶液,置于相距为单位距离的两个电极之间所具有的电导;由于溶液中导电物质的量已给定,都为1mol,所以,对于强电解质,当浓度降低时,正负离子之间的相互作用减弱,正、负离子的迁移速率加快,溶液的摩尔电导率会随之而升高;但不同的电解质,摩尔电导率随着浓度的降低而升高的程度也大不相同;当浓度降到足够低时,摩尔电导率与浓度之间呈线性关系,可用公式表示为(m m 1∞=-ΛΛ;所以强电解质的无限稀释的摩尔电导率可以用外推到0→c 得到;对于弱电解质溶液,因为在一定温度下,弱电解质的解离平衡常数有定值,在电解质的浓度下降的情况下,其离子的浓度基本不变,所以弱电解质溶液的摩尔电导率在一般浓度下,随浓度的变化不显着,一直处于比较低的状态;直到溶液的浓度很稀薄时,由于正负离子之间的相互作用减弱,摩尔电导率随着浓度的降低开始升高,但不成线性关系,当溶液很稀很稀时,摩尔电导率随着浓度的降低迅速升高,到0→c 时,弱电解质溶液的离子无限稀释的摩尔电导率与强电解质的一样;所以弱电解质的无限稀释的摩尔电导率可以用离子的无限稀释的摩尔电导率的加和得到,即 m m, m,∞∞∞+-=+ΛΛΛ;4.在温度、浓度和电场梯度都相同的情况下,氯化氢、氯化钾、氯化钠三种溶液中,氯离子的运动速度是否相同氯离子的迁移数是否相同答:因为温度、浓度和电场梯度都相同,所以三种溶液中氯离子的运动速度是基本相同的,但氯离子的迁移数不可能相同;迁移数是指离子迁移电量的分数,因为氢离子、钾离子、钠离子的运动速度不同,迁移电量的能力不同,所以相应的氯离子的迁移数也就不同;5.为什么氢离子和氢氧根离子的电迁移率和摩尔电导率的数值比同类离子要大得多答: 因为氢离子和氢氧根离子传导电流的方式与其它离子不同,它们是依靠氢键来传递的,所以特别快;它们传导电流时,不是靠离子本身的迁移,而是依靠氢键和水分子的翻转来传导电荷的;如果在非水溶液中,氢离子和氢氧根离子就没有这个优势;6.强电解质如4CuSO ,2MgCl 等,在其溶液的浓度不是太大的情况下,电解质的摩尔电导率与它的离子摩尔电导率之间是什么关系答:在溶液不太浓时,可以近似认为强电解质是完全解离的,其摩尔电导率就等于离子摩尔电导率的加和;但对于组成离子的电价数大于1,特别是在正、负离子的电价不对称时,在选取基本单元时要注意使粒子的荷电量相同,若粒子的荷电量不同时,要在前面乘以因子,使等式双方相等;现用以下例子来表明它们之间的关系:对于A B -型的对称电解质,它们之间的关系比较简单,如或 22 m 4 m m 4111CuSO Cu SO 222+-⎛⎫⎛⎫⎛⎫=+ ⎪ ⎪ ⎪⎝⎭⎝⎭⎝⎭ΛΛΛ 对于2A B -型的不对称电解质,由于正负离子的电价数不同,要注意选取荷电量相同的粒子作为基本单元,若荷电量不同,要在前面乘以因子,如或 2 m 2 m m 11MgCl Mg (Cl )22+-⎛⎫⎛⎫=+ ⎪ ⎪⎝⎭⎝⎭ΛΛΛ7.在电解质溶液中,如果有i 种离子存在,则溶液的总电导应该用如下的哪个计算式计算答:应该用1式计算;因为溶液的总电导等于各个离子电导的加和,即在溶液中,离子是以并联形式存在的,而不是以串联形式存在的,总的电阻不可能等于所有离子电阻的加和;8.标准电极电势是否就等于电极与周围活度为1的电解质溶液之间的电势差 答:不是;由于电极表面性质比较复杂,电极与周围电解质溶液之间的真实电势差是无法测量的;现在把处于标准状态下的电极即待测电极与标准氢电极组成电池,将待测电极作还原极即正极,并规定标准氢电极的电极电势为零,这样测出的电池电动势就作为待测电极的电极电势,称为标准氢标还原电极电势,简称为标准电极电势,用符号Ox|Red E 表示;9.为什么标准电极电势的值有正有负答:因为规定了用还原电极电势,待测电极与氢电极组成电池时,待测电极放在阴极的位置,令它发生还原反应;但是比氢活泼的金属与氢电极组成电池时,实际的电池反应是金属氧化,氢离子还原,也就是说电池的书面表示式是非自发电池,电池反应是非自发反应,电动势小于零,所以电极电势为负值;如果是不如氢活泼的金属,则与氢电极组成的电池是自发电池,电极电势为正值;10.某电池反应可以写成如下两种形式,则所计算出的电动势E ,标准摩尔Gibbs 自由能变化值和标准平衡常数的数值是否相同1 222H 2Cl H ()Cl ()2HCl()p p a += 2 222H 2Cl 11H ()Cl ()HCl()22p p a +=答:电动势E 是电池的性质,不管电池反应中电子的计量系数是多少,电动势E 总是相同的;如果从计算电池电动势的Nernst 方程看,RT zF 项分母中的z 与B B Ba ν∏项中的指数B ν之间,有固定的比例关系,所以电动势E 有定值,即12E E =;但是摩尔Gibbs 自由能的变化值和标准平衡常数值却不同,r m G ∆中的下标“m ”是指反应进度为1 mol 时的Gibbs 自由能变化值,若化学方程式中的计量系数成倍数的关系,则当反应进度都等于1 mol 时,r m G ∆的值也成倍数的关系,即r m,1r m,22G G ∆=∆;如果电池都处于标准状态,则标准摩尔Gibbs 自由能变化值的关系也是r m,1r m,2G G ∆=∆;标准平衡常数与标准Gibbs 自由能的变化值之间的关系为r m ln G RT K ∆=-,r m G ∆的数值成倍数的关系,则K 的数值就成指数的关系,即212 ()K K =;11.如果规定标准氢电极的电极电势为1 V,则各可逆电极的标准氢标还原电极电势的值有什么变化电池的电动势有什么变化答:由于单个电极的电极电势无法测量,人们不得不采用相对的电极电势;目前国际上绝大多数采用的是氢标还原电极电势,即规定标准氢电极的电极电势为0 V,将待测电极作阴极还原极,这样组成的电池的电动势就作为待测电极的标准还原电极电势Ox Red E |,即如果规定标准氢电极的电极电势为 1 V,组成电池的电动势应是个定值,即实验测定的E 不变,那即各电极的标准还原电极电势值也都增加1 V;电池的电动势是两个电极的电极电势之差,所有的电极电势都增加1 V,电动势的值不会改变,这就是为什么要取共同标准的原因;12.如何用电化学的方法,测定2H O(l)的标准摩尔生成Gibbs 自由能f m 2(H O,l)G ∆答:2H O(l)的生成反应为要设计一个电池,使电池反应与之相同;方程式中,显然2H (g)是被氧化的,将氢电极放在电池的左边作阳极,2O (g)是被还原的,将氧电极放在电池右边作阴极,这是一个氢-氧燃料电池;由于氢-氧燃料电池的电动势与电解质溶液的pH 没有关系,所以两个电极中间的介质在pH 等于114之间都可以,只要保持2H (g)和2O (g)的压力都是标准压力即可;所以设计的电池为这个电池的反应就是2H O(l)的生成反应,测定电池的标准可逆电动势E 或从标准电极电势表,查阅电极的标准电极电势,进行计算得到,就可以计算2H O(l)的标准摩尔生成Gibbs 自由能f m 2(H O,l)G ∆13.设计合适的电池,计算24Hg SO (s)的溶度活度积常数ap K ;答:24Hg SO (s)的解离反应为2+22+2Hg Hg ()a 是从第一类电极中来的,是由Hg(l)氧化而来的,所以用2+22+2Hg Hg(l)Hg ()a |电极作阳极,再用一个难溶盐电极242424SO SO ()Hg SO (s)Hg(l)a --||作阴极,因为24Hg SO (s)在还原时会放出24SO -;2+2Hg 和24SO -不能共存在一个容器内,中间要用盐桥隔开,所以设计的电池为该电池的净反应与24Hg SO (s)的解离反应一致读者可以自己检验一下;从标准电极电势表,查得两个电极的电极电势,得到电池的标准电动势E ,或用实验测定该电池处于标准态时的标准电动势E ,就可以计算难溶盐的活度积常数14.为什么实际分解电压总要比理论分解电压高答:实际分解电压要克服三种阻力:1原电池的可逆电动势,这数值通常称为理论分解电压,其绝对值用R E ||表示; 2由于两个电极上发生极化而产生的超电势a η和c η,通常称为不可逆电动势;3克服电池内阻必须消耗的电位降IR ;所以实际分解电压为这样,实际分解电压E 分解一定大于理论分解电压R E ||;15.在电解池和原电池中,极化曲线有何异同点答:它们的相同点是:无论是在原电池还是在电解池中,随着电流密度的增加,阳极的实际析出电势不断变大,阳极的极化曲线总是向电势增大的方向移动;阴极的实际析出电势不断变小,阴极的极化曲线总是向电势减小的方向移动;所不同的是,在电解池中,由于超电势的存在使实际分解电压变大,随着电流密度的增加,实际消耗的电能也不断增多;而在原电池中,由于超电势的存在,使电池的不可逆电动势小于可逆电动势,随着电流密度的增加,电池的不可逆电动势不断下降,对环境作电功的能力也下降;16.将一根均匀的铁棒,部分插入水中,部分露在空气中;经若干时间后,哪一部分腐蚀最严重为什么答:在靠近水面的部分腐蚀最严重;因为在水下部分的铁棒,虽然有2CO (g)和2SO (g)等酸性氧化物溶于水中,使水略带酸性,但H + 离子的浓度还是很低的,发生析氢腐蚀的趋势不大;铁棒露在空气中的部分,虽然与氧气接触,但无电解质溶液,构成微电池的机会较小;而在靠近水面的部分,既有氧气,又有微酸性的电解质溶液,所以很容易构成微电池,发生耗氧腐蚀,这样形成的原电池的电动势比在水中的析氢腐蚀的电动势大,因而这部分腐蚀最严重;17.以金属铂为电极,电解Na2SO4水溶液;在两极附近的溶液中,各滴加数滴石蕊试液,观察在电解过程中,两极区溶液颜色有何变化为什么答:这实际是一个电解水的过程,硫酸钠仅仅起了导电的作用;电解时,在阳极上放出氧气,阳极附近氢离子的浓度变大,使石蕊试液呈红色;在阴极上析出氢气,阴极附近氢氧根离子的浓度变大,使石蕊试液呈蓝色;18.为了防止铁生锈,分别电镀上一层锌和一层锡,两者防腐的效果是否一样答:在镀层没有被破坏之前,两种防腐的效果是一样的,镀层都起了将铁与环境中的酸性气体和水隔离的目的,防止微电池的形成,防止了铁被电化腐蚀;但是镀层一旦有破损,则两者的防腐效果就大不相同;镀锡铁俗称马口铁,锡不如铁活泼;若将锡与铁组成原电池,则锡作阴极,称为阴极保护层,而铁作阳极,这样铁被腐蚀得更快;镀锌铁俗称白铁,锌比铁活泼,组成原电池时,锌作阳极,称为阳极保护层,锌被氧化,而铁作阴极,仍不会被腐蚀;19.在氯碱工业中,电解NaCl的浓溶液,以获得氢气、氯气和氢氧化钠等化工原料;为什么电解时要用石墨作阳极答:若不考虑超电势的影响,在电解NaCl的水溶液时,根据电极电势的大小,在阳极上首先析出的是氧气,而不是氯气;由于氯气的工业价值比氧气高,所以利用氧气在石墨上析出时有很大的超电势,而氯气在石墨上析出的超电势很小,所以用石墨作阳极,在阳极上首先析出的是氯气,而不是氧气,可以利用氯气作为化工原料;20.氢-氧燃料电池在酸、碱性不同的介质中,它们的电池反应是否不同在气体压力相同时,电池的电动势是否相同答:氢、氧燃料电池的电解质溶液可以是酸性,也可以是碱性,pH 在1~14的范围内,它们的电极反应虽不相同,但电池的净反应相同;在气体压力都等于标准压力时,其标准电动势都等于是 V;具体反应式和计算式如下:1 假定是pH 7<的酸性溶液负极,氧化 22H H H ()2H ()2e p a ++-→+ +2H|H 0 V E =正极,还原22O 2H 1O ()2H ()2e H O(l)2p a ++-++→ +22O |H O,H 1.229 V E =电池净反应 1 222H 2O 21H ()O ()H O(l)2p p +→当22H O p p p ==时,2 假定是pH 7>的碱性溶液负极,氧化 22H 2OH H ()2OH ()2H O(l)2e p a ---+→+正极,还原 22O 2OH 1O ()H O(l)2e 2OH ()2p a ---++→电池净反应 2 222H 2O 21H ()O ()H O(l)2p p +→当22H O p p p ==时,四.概念题参考答案1.按物质导电方式的不同而提出的离子型导体,下述对它特点的描述,哪一点是不正确的A 其电阻随温度的升高而增大B 其电阻随温度的升高而减小C 其导电的原因是离子的存在D 当电流通过时在电极上有化学反应发生 答:A;对于离型子导体,在温度升高时,离子的水合程度下降,溶液的黏度下降,电阻是变小的;2.使2000 A 的电流通过一个铜电解器,在1 h 内,能得到铜的质量是 A 10 g B 100 g C 500 gD 2 369 g答:D;用Faraday 定律计算可得3.在298 K 时,当 H 2SO 4溶液的浓度从 mol·kg -1 增加到 mol·kg -1时,其电导率k 和摩尔电导率m 的变化分别为 A k 减小 , m 增加 B k 增加 , m 增加 C k 减小 , m 减小 D k 增加 , m 减小答:D;强电解质溶液的电导率,随溶液浓度的增加而增加,因为电导率只规定了电解质溶液的体积,是单位立方体,浓度大了,导电离子多了,电导率当然要增加;但是摩尔电导率只规定了电解质的量是1 mol,电极间的距离是单位距离,但没有固定溶液的体积,所以随溶液浓度的增加,溶液体积变小,离子间相互作用增加,因而摩尔电导率减小;4.用同一电导池,分别测定浓度为 1 mol·kg -1和 2 mol·kg -1的两个电解质溶液,其电阻分别为 1000 和 500 ,则 1 与 2 的摩尔电导率之比为A 15∶B 5∶1C 105∶D 5∶10 答: B;根据摩尔电导率的定义, m cκ=Λ,cellK l GA Rκ==,cell K 称为电导池常数,同一电导池的电导池常数相同;所以电导率之比就等于电阻的反比,代入摩尔电导率的定义式,得5.有下面四种电解质溶液,浓度均为 mol·dm -3,现已按它们的摩尔电导率m 的值,由大到小排了次序;请判定下面正确的是A NaCl > KCl > KOH > HClB HCl > KOH > KCl > NaClC HCl > NaCl > KCl > KOHD HCl > KOH > NaCl > KCl 答:B ;这4种都是1-1价的强电解质,当溶液的浓度相同时,氢离子摩尔电导率最大,其次是氢氧根离子,因为氢离子和氢氧根离子是通过氢键导电的;钾离子的离子半径虽然要比钠离子的大,但是钾离子的水合程度小,所以钾离子的摩尔电导率还是比钠离子的大;6.2CaCl 的摩尔电导率与其离子的摩尔电导率之间的关系是A 2m 2m m (CaCl )(Ca )(Cl )∞∞+∞-=+ΛΛΛB 2m 2m m1(CaCl )(Ca )(Cl )2∞∞+∞-=+ΛΛΛ C 2m 2m m (CaCl )(Ca )2(Cl )∞∞+∞-=+ΛΛΛ D 2m 2m m (CaCl )2(Ca )(Cl )∞∞+∞-⎡⎤=+⎣⎦ΛΛΛ答: C;电解质的摩尔电导率与离子摩尔电导率之间关系的通式是在表示多价电解质的摩尔电导率时,为了防止混淆,最好在摩尔电导率的后面加个括号,写明所取的基本质点,防止误解;如 m 2 m 21(CaCl ), (CaCl )2∞∞ΛΛ,两者显然是倍数的关系;7.有4个浓度都是 mol·kg -1 的电解质溶液,其中离子平均活度因子最大 的是A KClB CaCl 2C Na 2SO 4D AlCl 3答:A ;按Debye-Hückel 极限定律,I z z A -+±-=γlg ,离子强度越大,平均活度因子越小;这里KCl 的离子强度最小,所以它的平均活度因子最大;8.下列电池中,哪个电池的电动势与Cl -的活度无关A Zn│ZnCl2aq│Cl2g│PtB Zn│ZnCl2aq‖KClaq│AgCls│AgC Ag│AgCls│KClaq│Cl2g│PtD Hg│Hg2Cl2s│KClaq‖AgNO3aq│Ag答:C;原则上应写出各个电池的反应,再决定电池的电动势与Cl-是否有关,这显然要化去不少时间;快速判断的方法是看电极反应,若正、负极的反应中都有Cl-,两个电极反应中的Cl-刚好可以消去,这样Cl-的活度与电池的电动势就无关,所以只有C符合条件;A和D只有一个电极反应有Cl-,不能对消;B中虽然用了ZnCl2aq,但这是一类电极,电极反应中不会出现Cl-,所以也不能对消;9.用对消法补偿法测定可逆电池的电动势,主要是为了A 消除电极上的副反应B 减少标准电池的损耗C 在可逆情况下测定电池电动势D 简便易行答:C;在用对消法测定电池的电动势时,外加了一个与电池的电动势大小相等、方向相反的工作电源,相当于外电路的电阻趋于无穷大,忽略电池内部的电阻,所得两个电极之间的电位降,可以近似作为电池的电动势;在测定时电路中几乎无电流通过,使极化现象可以忽略不计,所得的电动势可以近似作为可逆电池的电动势;10.若算得可逆电池的电动势为负值,表示此电池反应的方向是A 正向进行B 逆向进行C 不可能进行D 反应方向不确定答:B;电池电动势为负值,表明该电池是非自发电池,不能正向进行,而逆向反应是自发的;这种情况只能出现在书面表示中,就是将电池的正、负极排反了;在实验中若将正、负极接反了,就不可能形成对消线路,也就测不到电动势,能测到的电动势都是正值;11.某电池的电池反应为2+22OH 2Hg(l)O (g)2H O(l)2Hg 4OH ()a --++=+,在等温、等压下,当电池反应达平衡时,电池的电动势E 的值必然是 A E >0 B E E= C E <0 D E =0答: D ;在等温、等压下,电池反应达平衡时,Gibbs 自由能的变化值为零,即r m G ∆=0;因为r m G zEF ∆=-,所以电动势E 也必然等于零;12.某电池在298 K 、标准压力下可逆放电的同时,放出 100 J 的热量,则该电池反应的焓变r H ∆为: A r 100 J H ∆= B r 100 J H ∆> C r 100 J H ∆<- D r 100 J H ∆=-答:C ;因为在等温时,r r r G H T S ∆=∆-∆,可逆放电时放出的热量为r T S ∆,即R r 100 J Q T S =∆=-,r r 100 J G H ∆=∆+;电池能放电,说明是自发电池,r G ∆必定小于零,所以r H ∆必须小于100 J -;13.在等温、等压下,电池以可逆方式对外作电功时的热效应Q R 等于 A R r Q H =∆ B R pE Q zFT T ∂⎛⎫= ⎪∂⎝⎭ C R pE Q zEF T ∂⎛⎫=⎪∂⎝⎭ D R Q nEF = 答:B;因为R r Q T S =∆,r pE S zF T ∂⎛⎫∆=⎪∂⎝⎭所以只有B 是正确的;平时必须熟练记住电化学与热力学的各种联系公式,才能用电动势测定方法计算热力学函数的变化值;。
分析化学课后习题及思考题电位分析法章节答案

分析化学(高教第五版)课后习题及思考题第八章 电位分析法思 考 题1. 参比电极和指示电极有哪些类型它们的主要作用是什么答:参比电极包括标准氢电极(SHE ),标准氢电极是最精确的参比电极,是参比电极的一级标准。
实际工作中常用的参比电极是甘汞电极和银-氯化银电极。
参比电极电位恒定,其主要作用是测量电池电动势,计算电极电位的基准。
指示电极包括金属-金属离子电极,金属-金属难溶盐电极,汞电极,惰性金属电极,离子选择性电极。
指示电极能快速而灵敏的对溶液中参与半反应的离子活度或不同氧化态的离子的活度比,产生能斯特响应,主要作用是测定溶液中参与半反应的离子活度。
2. 直接电位法的依据是什么为什么用此法测定溶液pH 时,必须使用标准pH 缓冲溶液 答:直接电位法是通过测量电池电动势来确定待测离子活度的方法,其主要依据是E=Φ参比— ΦMn+/M = Φ参比—ΦθMn+/M—nFRT ln αMn+ 式中Φ参比和ΦθMn+/M 在温度一定时,都是常数。
由此式可知,待测离子的活度的对数与电池电动势成直线关系,只要测出电池电动势E ,就可求得αMn+。
测定溶液的pH 时是依据:E = ΦHg 2Cl 2/Hg — ΦAgCl/Ag — K + pH试+ ΦL , 式 中ΦHg 2Cl 2/Hg , ΦAgCl/Ag ,K ,ΦL 在一定的条件下都是常数,将其合并为K ˊ,而K ˊ中包括难以测量和计算的不对称电位和液接电位。
所以在实际测量中使用标准缓冲溶液作为基准,并比较包含待测溶液和包含标准缓冲溶液的两个工作电池的电动势来确定待测溶液的pH 值,即:25℃时Es = Ks ˊ+ , Ex = Kx ˊ+ ,若测量Es 和Ex 时的条件保持不变,则Ks ˊ= Kx ˊ,pHx =pHs+(Ex -Es)/ ,由此可知,其中标准缓冲溶液的作用是确定K ˊ。
3. 简述pH 玻璃电极的作用原理。
答:玻璃电极的主要部分是 一 个玻璃泡,泡的下半部是对H +有选择性响应的玻璃薄膜,泡内装有pH 一定的·L -1的HCl 内参比溶液,其中插入一支Ag-AgCl 电极作为内参比电极,这样就构成了玻璃电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)当 r=0 时, 4πr 2ψ 2 =0; 当 r=∞时,ψ =0, 4πr 2ψ 2 =0 8. 从ψ 2p z 轨道的角度分布图[图 8-10(a)]说明ψ 2p z 的最大绝对值
些电子所在各轨道的能量及 Fe 原子系统能量。 解 : (1) 根 据 Slater 规 则 , Z=13 时 , 核 外 电 子 排 布 式 为
-1
的能量。 解:氢原子光谱的能量关系式为:
区) ∴n=3 n=4 n=5 n=6
1 1 − 2 ) ]S −1 =4.57× 1014 s −1 2 2 3 1 1 v β =[ 3.289 × 1015 ( 2 − 2 ) ]S −1 =6.17× 1014 s −1 2 4 1 1 vγ =[ 3.289 × 1015 ( 2 − 2 ) ]S −1 =6.91× 1014 s −1 2 5 1 1 vδ =[ 3.289 × 1015 ( 2 − 2 ) ]S −1 =7.31× 1014 s −1 2 6
69
ψ 2 2 = (1.99 × 10 −4 ) 2 = 3.96 × 10 −8 ;
(4) 4πr 2ψ 1 = 4 × 3.14 × 52.9 2 × 2.91 × 10 −7 = 1.03 × 10 −2 ;
2
4πr 2ψ 2 = 4 × 3.14 × (2 × 52.9) 2 × 3.96 × 10 −8 = 5.57 × 10 −3
n =1,2,3,4,……; l =0,1,2,3,……, n -1; m =- l ,…, − 1 ,0,l…,+ l
对应于一组合理的 n ,l,m 取值则有一个确定的波函数ψ( n , l , m ), 由ψ( n , l , m )可确定原子核外电子的一种运动状态。 根据上述三个量子数取值关系,可知: (A)中三个量子数取值是正确的, (B)中,n=4 时, l 可能取值为 0,1,2,3, m 可能取值为-3,-2, -1,0,1,2,3,而 l =-1 故不正确; (C)中, n =4, l =1 时, m 的可能取值只有-1,0,1,故 m =-2 不 正确。 (D)中, n =3 时, l 可能的取值为 0,1,2,故 l =3 不正确。
Z * = Z − σ =27.00-23.10=3.90 E 3d = ( E 4s = [ − 2.179 × 10 −18 × 6.90 2 )J = −11.53 × 10 −18 J 2 3 − 2.179 × 10 −18 × 3.90 2 ]J = −2.42 × 10 −18 J (3.7) 2
dinger 方程来描述: Schr o
∂ψ
2
∂x
2
+
∂ψ
2
∂y
2
+
∂ψ
2
∂z
2
=−
8π m
2
6.一个原子中, 量子数 n=3,l =2, m =0 时可允许的最多电子数是多 少? 解:n =3, l =2, m=0 为一套量子数。 一套量子数决定一个波函数ψ ,
h2
( E − V )ψ
原子中受核束缚的核外电子的运动状态也可用此方程来描述。此 即一个轨道。 一个轨道可允许至多两个自旋方向相反的电子存在。 故最 方程的解是一系列波函数ψ的具体表达式,一个波函数可表示一种核 多允许两个电子存在。 外电子的运动状态。为保证解的合理性,引入了三个量子数,主量子 数n, 副量子数(或角量子数) l 以及磁量子数 m 。 三个量子数均为整数, 7. 已知ψ 1s =
1
−r
πa 0
e a0 (氢原子基态) 3
68
(1) 计算 r=52.9pm 时的ψ 值; (3)计算(1)与(2)的ψ 2 值;
(2)计算 r=2×52.9pm 时的ψ 值; (4)计算(1)与(2)的 4πr 2ψ 2 值;
对应于曲线的哪一部位,最小绝对值又是哪里?这些部位怎样与 2p x 电子 的出现几率密度相联系? 解:图 8-10(a) 为 ψ 2p z 轨道的角度分布图,即 Y (θ , φ ) 函数图。由
E 3d < E 4s ,∴4s 能级高;
(2)Fe 原子核外电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2 ① σ 3s =0.35×7+0.85×8+1.00×2=11.25,
E 4s =
Z * = Z − σ =26-11.25=14.75 E 3s = ( − 2.179 × 10 −18 × 14.75 2 )J = −5.267 × 10 −17 J 32
v2 =
又由 E = hγ ,得
E 1 = hv 1 = (6.626 × 10 −34 × 5.09 × 1014 )J = 3.373 × 10 −19 J E 2 = hv 2 = (6.626 × 10 −34 × 5.08 × 1014 )J = 3.366 × 10 −19 J
5.下列各组量子数中哪一组是正确的? (A)n=3,l=2,m=-2 (B)n=4,l=-1,m=0 (C)n=4,l=1,m=-2 (D)n=3,l=3,m=-3 解:微观领域中,具有波粒二象性的微观粒子的运动状态可以用
(1)ψ 1 =
1 2 −1 1 1 ) e = × 2.60 × 10 −3 × 1.77 2.718 π 52.9
= 5.40 × 10 −4 1 2 −2 1 1 2 ( ) e = × 2.60 × 10 −3 × ( ) (2)ψ 2 = 1.77 2.718 π 52.9 = 1.99 × 10 − 4
E 3d > E 4s ,∴3d 能级高。
Z=17,核外电子排布式为 1s 2 2s 2 2p 6 3s 2 3p 5 若价电子在 3d 轨道上, σ 3d =1.00×16=16.00, Z * = Z − σ =1.00
② σ 3p =0.35×7+0.85×8+1.00×2=11.25,
E 3d
第八章 原子结构
1.利用氢原子光谱的频率公式,令 n=3,4,5,6。求出相应的谱线 频率。 解:氢原子光谱的频率公式为:γ =3.289×10 (
15
答:频率为 7.32× 1014 s −1 3. 利用氢原子光谱的能量关系式求出氢原子各能级(n=1,2,3,4)
1 2
2
−
1 n
2
) s (可见光
− 2.179 × 10 −18 × 1.00 2 =( )J = −2.421 × 10 −19 J 32 − 2.179 × 10 −18 × 1.90 2 ]J = −5.75 × 10 −19 J 2 (3.7)
Z * = Z − σ =26-11.25=14.75
E 3p = E 3s = −5.267 × 10 −17 J
(5)当 r=0 和 r=∞时,分别 4πr 2ψ 2 等于多少? 解:ψ 1s =
1
−r
πa 0
1 (
e a0 3
3
a 0 =52.9pm
ψ =R(r)・Y (θ , φ ) 可知,只有 R(r)取常数值时,才能确定ψ 随 Y (θ , φ ) 而
变化的关系。当 R(r)为定值时, ψ 2p z 的最大绝对值对应于曲线与 z 轴的 正方向和负方向相交的两个部位,最小的绝对值在 xy 平面上。 电子在核外空间某区域出现的几率 Ω 等于几率密度 ψ 2 与该区域体 积 dv 的乘积: Ω = ψ 2 dv ;而 Ω = R 2 (r )Y 2 (θ , φ ) ,R(r)一定时,ψ 2 正比
-19 -19 -20 -19
n1=1 时,E1= − n1=2 时,E2= − n1=3 时,E3= − n1=4 时,E4= −
RH 1 RH 2 RH 3 RH 4
2 2 2 2
=-0.5448× 10 −12 J; =-0.2421× 10 −12 J; =-0.1369× 10 −12 J
即氢原子各能级能量为 E1=-2.19× 10 −12 J;E2=-0.5448× 10 −12 J; E3=-0.5448× 10 −12 J;E4=-0.1369×1 10 −12 J。 4. 钠蒸汽街灯发出亮黄色光;其光谱由两条谱线组成,波长分别为 589.0nm 和 589.6nm。计算相应的光子能量和频率。
③ σ 3d =0.35×5+1.00×18=19.75, Z * = Z − σ =26-19.75=6.25
E 4s = [
E 3d = (
− 2.179 × 10 −18 × 6.25 2 )J = −2.837 × 10 −17 J 32
E 3d > E 4s ,∴3d 能级高。
Z=27,核外电子排布式为 1s 2s 2p 3s 3p 3d 4s
(3) ψ 1 = (5.40 × 10 −4 ) 2 = 2.92 × 10 −7 ;
2
1
3
于 Y 2 (θ , φ ) ;而电子云的角度分布函数 Y 2 (θ , Φ ) 的图形与原子轨道的角 度分布函数 Y(θ, Φ) 的图形有相似的轮廊 Y 2 (θ , φ ) 只是 Y (θ , φ ) 的平方。所 以,R(r)一定时,Ω正比于| Y (θ , φ ) |。 综上所述,当距核的半径一定时, 2p x 电子出现几率最大的区域就 是上图中 Y (θ , φ ) 曲线与 z 轴正负两个方向相交的部位,即|ψ 2p z |最大 所对应的部位;几率最小的区域在 xy 平面上,即|ψ 2p z |最小所对应的 部位。 9. 试用 Slater 规则: (1)计算说明原子序数为 13,17,27 各元素中,4s 和 3d 哪一个能级 的能量高; (2)分别计算作用于 Fe 的 3s,3p,3d 和 4s 电子的有关核电荷数,这
67
v=
∆E 4.85 × 10 −19 −1 =( )s =7.32× 1014 s −1 h 6.626 × 10 −34
