从人造金刚石触媒酸洗废液中回收镍、钴和锰
氨-碳酸盐法分离PTA废渣中的钴和锰

CHEMICAL INDUSTRY AND ENGINEERING PROGRESS 2016年第35卷第8期·2580·化 工 进 展氨-碳酸盐法分离PTA 废渣中的钴和锰何沁华1,刘维桥1,邹超1,魏成文1,尚通明1,周全法1,高峰2(1江苏理工学院,江苏 常州 213000;2无锡中经金属粉末有限公司,江苏 无锡 214000)摘要:精对苯二甲酸(PTA )生产中的废钴锰催化剂中钴低锰高,常用的钴锰分离方法一般不适用,分离钴锰时非常容易互相夹带,导致分离不完全。
本文采用氨-碳酸盐法分离PTA 废渣浸出液中的钴和锰。
在正交试验的基础上,以钴剩余率和锰沉淀率作为考核指标,考察了碳酸盐的种类、反应时间、反应温度、搅拌速度、氨的用量和碳酸盐的用量等因素对钴、锰分离效果的影响。
实验结果表明,在氨-碳酸钠、氨-碳酸铵、氨-碳酸氢铵3种溶液中,最佳搅拌速度、反应时间、反应温度分别为200r/min 、8h 和20℃,氨的最佳用量分别为理论化学反应计量的1.9倍、1.4倍和1.7倍,碳酸盐的用量分别为理论化学反应计量的1.0倍、1.3倍和1.3倍。
在最佳反应条件下,氨-碳酸钠、氨-碳酸铵、氨-碳酸氢铵3种溶液中,钴的最大剩余率分别可达到96.0%、99.8%和99.5%,锰沉淀率均可达到100%。
关键词:废物处理;回收;配合物;分离中图分类号:X 789;TQ 09 文献标志码:A 文章编号:1000–6613(2016)08–2580–06 DOI :10.16085/j.issn.1000-6613.2016.08.44Study on separation of cobalt and manganese from waste residue of PTAby ammonia-carbonate leachingHE Qinhua 1,LIU Weiqiao 1,ZOU Chao 1,WEI Chengwen 1,SHANG Tongming 1,ZHOU Quanfa 1,GAO Feng 2(1Jiangsu University of Technology ,Changzhou 213000,Jiangsu ,China ;2Wuxi Zhongjing (Metal )Powder Co.,Ltd.,Wuxi 214000,Jiangsu ,China )Abstract :The content of cobalt in the waste cobalt and manganese catalyst in the production of PTA was low and the content of manganese was high. The common cobalt and manganese separation methods generally were not suitable for this material and would make cobalt and manganese mixed with each other ,leading to incomplete separation. Ammonia - carbonate method was used in the separation of the cobalt and manganese from lixivium of the waste residue of PTA in this paper. As the surplus rate of cobalt and the precipitation rate of manganese were used as assessment indicators ,the effects of the carbonates’ types ,reaction time ,temperature ,stirring speed ,the amount of ammonia and the amount of carbonate on the separation effect of cobalt and manganese were studied on the basis of orthogonal experiments. Experimental results show that ,in the solutions of ammonia-sodium carbonate ,ammonium carbonate and ammonium bicarbonate ,the best reaction condition is: stirring rate 200r/min ,reaction time 8 hours and temperature 20℃. The amount of ammonia is 1.9,1.4 and 1.7 times of chemical stoichiometric coefficient, respectively, and the amount of carbonate is 1.0,1.3 and 1.3 times. The surplus rate of cobalt in these three solutions can reach to 96.0%,99.8% and 99.5%,respectively ,and the precipitation rate of manganese can all reach 100%.资源再生利用。
扩散渗析法回收不锈钢酸洗废液中硝酸

关键 词 :酸洗废 液 ;扩散 渗析 ;阴 离子 交换 膜 中图分类 号 :T 2 . Q0 8 8 文献 标识 码 :A 文章编 号 :10 — 9 4 2 1 ) 6O 6 一4 0 78 2 ( 0 O 0 一0 2O
不 锈钢 表面 酸洗过 程 中产生 了大量 含有 重金属
较高 的酸 .
和钝 化液 的循环 利 用 为 目标 , 择 两 种 扩散 渗 析 膜 选
进行动态扩散渗析研究 , 优化扩散渗析工艺参数.
1 实验 部 分
实验用 废 酸液 来 自于某 不 锈 钢 加 工企 业 , 主要 是含 硝 酸 的 酸 洗 废 液 , 主 要 金 属 离 子 及 含 量 见 其
表 1 不锈 铜酸 洗废 液 中主要金 属 离子组 成
Ta l Co p st n fmea o si h ikn be1 m o ii so tlin n tepc ig o
s l to fs e l o u in o t es
渗析法从铝阳极氧化液中回收硫酸, 硫酸的回收率 为 8 % , 离 子 的截 留率 达 到 9 [ . 建 军 等 _ 5 铝 5/5 唐 9 ] 6 6 ]
换 膜 中相应酸 的传 质 系 数【 ] 在 实 际生 产 体 系 中 , _ . 2 Xu等 l 等研 究 了扩散 渗 析法 从 金 属表 面 酸洗 液 中 _ 4 回收盐 酸 , 酸 的 回收率 达 到 8 , 的截 留率 在 盐 8/ 铁 9 6 7 ~8 , 的截 留率 低 于 4 . 研 究 了扩 散 7 9 锌 4 还
研 究 了扩散 渗析 法从 稀 土硫 酸 盐溶 液 中 回收 硫 酸 ,
考 察 了原料 / 流量 比 、 水 原料 流量 对硫 酸 回收率 的影 响, 同时建立 了相应 的传质 模型 并进行 了验证. 随着 环保要 求越 来越 严 , 酸 的 回收 利 用 的需 求 也 在 逐 硝 步扩 大. 文 主要 以不 锈 钢 生产 过 程 中的 硝酸 酸 洗 本
钴与镍的分离技术研究综述

浙江科技学院学报,第19卷第3期,2007年9月Jo ur na l of Zhejiang U niv ersity of Science and T echnolog y Vo l.19No.3,Sep.2007收稿日期:2007-06-11基金项目:浙江省自然科学基金项目(Y406053)作者简介:诸爱士(1966) ),男,浙江湖州人,副教授,主要从事单元操作教学和化工产品开发与应用研究。
钴与镍的分离技术研究综述诸爱士1,徐 亮2,沈芬芳2,成 忠1(1.浙江科技学院生物与化学工程学院,杭州310023;2.浙江工业大学化学工程与材料学院,杭州310014)摘 要:由于钴与镍在矿床中常共生、伴生,并随着其资源的日益枯竭,对它们的分离与回收就显得十分重要。
通过对相关文献进行调研,总结了目前国内外钴与镍的分离与回收技术的现状:目前常用的方法有化学沉淀法、萃取法和树脂法;详细介绍了相关的研究和应用,对其他方法进行了简单介绍,同时介绍了笔者的耦合分离技术的设想和实践。
关键词:钴;镍;分离中图分类号:T Q028;T F 803.23 文献标识码:A 文章编号:1671-8798(2007)03-0169-06Review of Separation Technology Study of Cobalt and NickelZH U A-i shi 1,XU Liang 2,SH EN Fen -fang 2,CH EN Zhong1(1.School of Biolog ical and Chemical Eng i neering,Zhejiang U niversity of Science and Technolog y ,Hangzhou 310023,China;2.College of Chemical Eng ineering and Materials Science,Zhejiang University of Technolo gy ,H angzhou 310014,China)Abstract:As Co and Ni are o ften sy mbio sised or associated in deposit and their r esources are shortage,the separatio n and reco ver y o f Co and N i become m ore important.T hr oug h the invest-i g ation of relative literatures,the technical status at hom e and abro ad is summarized.T he curr ent conventional m ethods are chemical precpitation,ex traction and io n -exchange resin.T he related re -search and application are introduced in detail.T he other methods ar e biefly intro duced.M ean -w hile,the author p s ideas and practice of co upling separation technolog y ar e introduced.Key words:cobalt;nickel;separ ation由于钴、镍的化学性质非常相似,在矿床中常共生、伴生,因此在各种含钴废渣中常有镍,如镍冶炼转炉渣、铜冶炼含钴转炉渣、镍精炼含钴渣等;在各种特殊合金材料、电池材料、催化剂中,也都同时含有钴和镍;而且随着钴与镍资源的日益枯竭,对它们的分离与回收就显得十分重要。
实验操作竞赛试题A选手编号实验题目人造金刚石酸洗触媒废液回收
实验操作竞赛试题A选手编号实验题目:人造金刚石酸洗触媒废液回收重要说明:↘请在规定时间(8:00—16:00)内完成实验与报告,超时会扣分;每超时10 min扣2分,最多不能超时30 min(以10 min为计时单位)。
↘请填好“选手编号”,不要写姓名。
实验结束后,请将试题与报告一起交回!↘实验开始的2 hr内,如实验失败,在监考老师同意后可重做,但要扣去5分。
↘提供给每位选手的各类用品量已足够,请注意节约使用;如需增加使用,将酌情扣1-2分。
↘某些试剂有不同程度的毒性,实验操作要在通风良好的地方进行!↘实验期间,选手必须佩戴防护眼镜。
↘配发的玻璃器皿已按照化学实验基本要求进行了清洗/干燥。
↘实验过程中所得数据与实验现象应及时记录在试卷中,并及时请监考老师签字确认;如要改动数据,要报告监考老师签名确认。
↘为节约实验时间,实验室提供了水浴加热用的热水,请根据需要取用。
↘公用仪器及试剂用完后请立即放回原处。
↘电磁搅拌器的使用方法:将盛有溶液的容器外壁的水珠擦去,放在仪器圆盘中央。
插上电源,打开左侧的加热开关,将温度旋钮调至400℃档加热。
沸腾后,视情况将加热档调低。
注意:(1)电线要离加热面板一定距离,否则电线易被烫坏!(2)不可空烧!(3)电磁搅拌器加热后,加热面板温度很高,不要用手去摸、也不要将电源线或其他物品放在面板上!↘请利用10 min左右的时间认真、全面阅读试卷,注意合理分配时间。
一、实验目的本实验是一个综合实验,目的在于考察选手灵活运用所学化学理论与实验知识解决基础化学实际问题的能力,同时考察选手对化学实验基本操作掌握的规范与熟练程度,也考察选手运用实验技能和相关化学知识完成综合实验的能力、以及实验总结与报告撰写能力。
二、实验要求本实验要求选手从50.0 mL人造金刚石酸洗触媒废液(含有Ni2+、Mn2+、Co2+、Fe3+、Cu2+与SO42-等)中提取锰与镍,制备二氧化锰和硫酸镍,并对这两种产品进行定性或定量分析。
镍钴净化液萃取分离工艺的研究

摘要本文研究了用溶剂萃取法分离镍钴的工艺条件。
该方法是以P507体积分数为30%,TBP体积分数为5%,260#溶剂油体积分数为65%的有机相对镍钴溶液进行萃取分离。
在一系列探索实验的基础上进行了单因素实验,初步确定了该方法的较佳工艺条件为水相pH4.5,反应时间7min,P507皂化率65%,相比O/A 1.5。
在此条件下,钴的萃取率可达到95.5%,镍的萃取率为1%。
通过正交实验,钴的最高萃取率为96.75%,镍的最低萃取率为1.2%。
对正交试验结果进行极差分析,得出各因素对镍钴分离的影响由大到小依次是:水相pH、萃取时间、P507皂化率、相比O/A。
然后进行模拟三级逆流萃取实验,三级逆流萃取产物萃余相中钴的萃取率为99.95%,而镍的萃取率为0.02%,钴镍分离良好。
经过三级反萃,钴的反萃率可达到100%,而镍的反萃率可达到99.95%。
根据正交试验与模拟三级逆流萃取实验的结果,并综合考虑产品中镍钴比和H2SO4溶液以及有机相的消耗量等因素,最终确定P507萃取分离镍钴溶液的最优工艺条件为:水相pH为4.5、萃取时间7min、P507皂化率65%、相比O/A 1.5。
该工艺流程短、能耗小、镍钴分离度高,萃取产物经检测钴镍比可达到2000以上,达到了萃取分离工艺的工业指标。
关键词:P507萃取镍钴分离正交实验优化研究ABSTRACTIn this paper, we have researched using solvent extraction to separated nickel and cobalt and it’s process conditions. The method is based on volume fraction of P507with 30%,260 # solvent oil volume fraction of 65%, TBP volume fraction of 5% .By orthogonal xperi-mental design and range analysis wo determined the better conditions for liquid pH 4.5, reaction time 7min, P507 saponification rate of 65%, phase ratio O/A = 1.5. By orthogonal experimental design and poor analysis of various factors on the impact of the separation of nickel and cobalt ,the order of main factors influence are: liquid pH, extraction time, P507saponification rate, phase ratio O/A.And then proceed to simulate the three counter-current extraction experiments, the three counter-current extraction phase more than the product of extraction of cobalt extraction rate of 99.95 percent, while the extraction rate of nickel 0.02%, Co and Ni separation of After three back-extraction is good, cobalt stripping rate can reach 100%, while nickel back-extraction rate of 99.95% can be achieved. Orthogonal experiment and simulation through three counter-current extraction experiments, and considered more than nickel and cobalt products and H2SO4 solution and the organic phase of consumption and other factors, ultimately determine the P507 purification of nickel and cobalt extraction of the optimal solution conditions were as follows: purification liquidpH 4.5, extraction time of 7min, P507 saponification rate of 65 percent, phase ratio O/A at 1.5.This process is short, less power consumption, high separation of nickel and cobalt, cobalt-nickel products tested than can be achieved over 2000 and reached the industrial extraction process indicators.Key words:P507extraction, Nickel and cobalt’s separation, orthogonal experiment, optimization research目录摘要 (I)ABSTRACT (II)第一章文献综述 (1)1.1化学沉淀分离镍钴 (1)1.2溶剂萃取法分离镍钴 (2)1.2.1 胺类萃取剂 (2)1.2.2 磷(膦)酸类萃取剂 (2)1.2.3 酮肟类萃取剂 (4)1.2.4 萃取剂组合及其他萃取分离技术 (4)1.2.5 溶剂浮选 (5)1.2.6 双水相体系溶剂分离技术 (5)1.2.7 液膜萃取 (6)1.3离子交换树脂法分离镍钴 (6)1.4聚合物-盐-水液-固萃取(非有机溶剂液固萃取)法分离镍钴 (6)1.5电反萃取法分离镍钴 (7)1.6本研究的意义与内容 (8)1.6.1 本研究的意义 (8)1.6.2 本研究的内容 (8)第二章P507萃取分离镍钴溶液工艺的研究 (9)2.1实验部分 (9)2.1.1 实验原理 (9)2.1.2 实验原料与仪器 (9)2.1.3 萃取实验方法与步骤 (10)2.1.4 反萃实验方法与步骤 (11)2.1.5 正交实验方法与步骤 (11)2.2萃取单因素实验结果与讨论 (12)2.2.1 萃取时间对镍钴萃取率的影响 (12)2.2.2 水相pH对镍钴萃取率的影响 (13)2.2.3 P507皂化率对镍钴萃取率的影响 (14)2.2.4 相比O/A对镍钴萃取率的影响 (15)2.3反萃单因素实验结果与讨论 (15)2.3.1 反萃时间对镍钴反萃率的影响 (15)2.3.2 反萃相比A1/O1对镍钴反萃率的影响 (16)2.4正交实验结果与讨论 (17)2.4.1 萃取正交实验结果 (17)2.4.2 萃取实验结果极差分析 (18)2.5本章小结 (18)第三章模拟三级逆流萃取工艺研究 (20)3.1实验方法与步骤 (20)3.2实验结果与讨论 (22)3.2.1 萃取率的变化 (22)3.2.2 反萃率的变化 (22)3.2.3 各级萃余液中镍钴比的变化 (22)3.2.4 各级反萃液中钴镍比的变化 (23)3.3本章小结 (24)第四章结论与展望 (25)4.1结论 (25)4.2展望 (25)致谢 (27)参考文献 (28)第一章文献综述由于钴、镍的化学性质非常相似,在矿床中常共生、伴生,因此在各种含钴废渣中常有镍,如镍冶炼转炉渣、铜冶炼含钴转炉渣、镍精炼含钴渣等;在各种特殊合金材料、电池材料、催化剂中,也都同时含有钴和镍;而且随着钴与镍资源的日益枯竭,对它们的分离与回收就显得十分重要。
电解铜废液的处理方法与设计方案
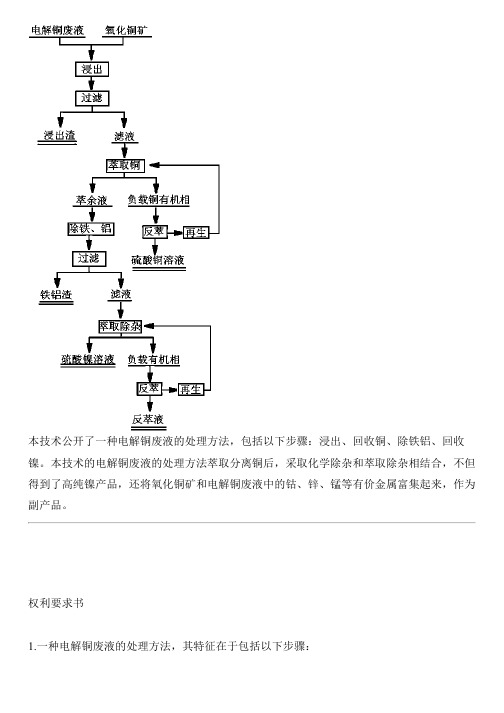
本技术公开了一种电解铜废液的处理方法,包括以下步骤:浸出、回收铜、除铁铝、回收镍。
本技术的电解铜废液的处理方法萃取分离铜后,采取化学除杂和萃取除杂相结合,不但得到了高纯镍产品,还将氧化铜矿和电解铜废液中的钴、锌、锰等有价金属富集起来,作为副产品。
权利要求书1.一种电解铜废液的处理方法,其特征在于包括以下步骤:(1)浸出:将细磨后氧化铜矿投入反应槽加水调浆,并加入电解铜废液进行常压加热搅拌浸出,控制温度为40-80℃,搅拌速度为200-500r/min,终点pH控制为1.0-3.0,反应时间为2-4h,反应完成后,过滤,得到浸出液和浸出渣;(2)回收铜:使用铜萃取剂将步骤(1)所得浸出液中的铜萃入有机相,分相后得到负载铜有机相和第一萃余液;负载铜有机经2mol/L硫酸溶液反萃后可得纯净的硫酸铜溶液;(3)除铁、铝:先通过加入氧化剂将步骤(2)所得第一萃余液中二价铁氧化成三价铁,再通过加入碱性中和剂调节其PH到3.5-5.0,除去铁和铝,过滤得到滤液和滤渣;(4)回收镍:采用皂化P507有机将步骤(3)所得滤液中Ca、Co、Mn、Zn、Mg以及微量的Fe和Al萃入有机相;分相后得到负载杂质有机相和第二萃余液;第二萃余液即纯净的硫酸镍液。
2.根据权利要求1所述的电解铜废液的处理方法,其特征在于:第(4)步得到的所述第二萃余液经加入碳酸钠沉淀生产碱式碳酸镍产品。
3.根据权利要求1或2所述的电解铜废液的处理方法,其特征在于:第(4)步得到的负载杂质有机相经4级酸洗后用3mol/L硫酸5级反萃,所得反萃液可返回钴湿法冶炼车间用于矿浆浆化或作为副产品外售。
4.根据权利要求3所述的电解铜废液的处理方法,其特征在于:反萃后有机相经3酸洗、2级水洗后可循环使用。
技术说明书一种电解铜废液的处理方法技术领域本技术涉及化工冶金技术领域,特别是一种电解铜废液的处理方法。
背景技术国内现有铜冶炼企业通常采用电解法精炼纯铜,在电解铜过程中,电解液中镍、钴、铁等杂质会逐步富集,当杂质离子富集到一定程度时将会阴极铜的质量,因此需要定期排放电解铜废液。
镍废水处理工艺技术

1、一种从废镍氢、镍镉电池回收硫酸镍溶液中一步萃取分离镍、镁、钴的方法2、用含镍氯化铁系废腐蚀液制取镍、铁化合物方法3、一种从废镍氢、镍镉电池回收硫酸镍溶液中去除钠离子的方法4、从废铝基含镍催化剂回收镍和铝的方法5、低铁高镁、高铁低镁红土镍矿用废稀硫酸浸出镍钴的方法6、用废镍料生产硝酸镍的除铜方法7、一种强酸性高磷含镍废水复合除磷除镍混凝剂及其除磷除镍方法8、一种由废雷尼镍催化剂中回收羰基镍的方法9、一种去除化镍废水中镍的方法10、水热氢气还原废水中镍离子制备多孔镍微粒的方法11、从含钒镍的废FCC/ROC触媒中回收稀土、钒、镍的方法12、一种含低量镍废水中镍的回收方法13、用废泡沫镍低温低压羰化合成连续生产超细镍粉工艺14、利用微生物电解池从含镍废水中回收镍的装置与方法15、含镍废水中回收镍的方法16、电镀流水线含镍废水中镍回收装置17、一种综合处理含镍废料回收硫酸镍的方法18、废旧镍钨系催化剂回收钨镍的方法19、一种电解处理含镍电镀废水并回收镍的方法20、以含镍废料再生为原料制造高活性镍饼工艺21、含镍三氯化铁蚀刻废液再生和镍回收方法22、从含镍、AL<sub>2</sub>O<sub>3</sub>的催化剂废渣中制备镍化学品和铝化学品的方法23、含镍三氯化铁蚀刻废液的除镍方法24、除镍离子筛制备方法及含镍废水处理装置25、一种从废旧镍镉电池中回收镉、镍,并制备成金属镉锭与超细镍粉的方法及设备26、一种三价钴镍氧化物废料与废旧钴、镍合金的处理方法27、一种从酸性镀镍废水中回收镍的方法28、从镀镍废水中回收镍及去除杂质的方法29、一种利用废氧化铝基镍触媒提炼镍铁的方法30、从镍、铁氯化物废液中提取镍的方法31、从含镍、锰及少量钴工业废液中直接生产硫酸镍铵的方法32、镍镀层退镀废液的镍回收工艺33、利用表面处理过程产生的含镍废水制备电镀级硫酸镍的方法和设备34、一种含镍废液中回收镍的处理方法35、一种用含镍废水制备镍铝水滑石的方法36、一种锰钴镍废渣中提取镍的方法37、一种锰钴镍废渣中提取钴和镍的方法38、一种利用含镍废水插层生产镍铝类水滑石的方法39、一种从含镍、锡废旧物料中分离回收金属镍、锡的方法40、一种用含镍混酸废液制备镍盐的方法41、一种从废旧镍锌电池中回收镍和锌的方法42、一种镍电解净液系统制备碳酸镍后上清液废水综合回收净化系统及工艺43、化学镀镍废液中提纯镍的方法及镍提纯装置44、一种含镍电镀废水的处理和镍回收方法45、一种利用镍废料制备电子级甲基磺酸镍的工艺方法46、一种电镀镍废水中镍盐回收方法47、一种从酸性镀镍废水中回收镍的设备48、从废镍氢电池中回收镍和钴的方法49、利用网状废镍片制备超细高纯镍粉的方法50、用于去除化学镀镍废水中镍的糠醛渣基吸附剂及制备方法51、含硫酸、盐酸的混合废酸浸出红土镍矿回收镍钴的方法52、从镍氢电池正极废料中回收、制备超细金属镍粉的方法53、一种从镍铁铜合金废料中回收铜、镍的方法54、一种利用化学镀镍废液制备纳米镍/碳纤维催化剂的方法55、一种从废弃铁镍钴合金中回收钴、镍的方法56、常温常压高效提取红土镍矿中镍钴镁铁并利用废渣的方法57、一种红土镍矿酸浸沉镍废水制备七水硫酸镁的方法58、一种在酸性化学镀镍废液中直接提取镍的方法59、一种在碱性化学镀镍废液中直接提取镍的方法60、镀镍废水镍资源与水资源回收方法及回收装置61、从镀镍废水制备氢氧化镍和氧化镍纳米空心管的合成方法62、一种高效快速回收化学镀镍废液中镍和磷的方法63、废旧电池处理过程中产生的镍钴锰废水的处理方法64、处理含镍刻蚀废流体的方法65、火法回收废催化剂中的镍66、一种废水中镍的电解回收方法67、一种从电镀铜镍混合废水中富集铜镍的工艺68、一种电镀废水中镍的回收工艺69、一种电镀废水中镍回收处理系统70、一种从废电镀塑料中分离回收铜、镍及再生塑料的方法71、一种不锈钢酸洗废水中铬、镍盐提取方法72、含钼和镍废催化剂回收金属的方法73、一种铝型材废水中镍、铬离子的去除方法74、镍酸锂废电池正极材料的浸出方法75、活性炭电极电解回收废水中镍(II)的方法76、一种利用废的氨分解催化剂制备碳酸镍的方法77、一种废钨与镍钼矿共同硝石熔炼提取钨钴钼镍的方法78、一种含镍废催化剂的回收利用方法79、工业废酸制取硫化镍精矿的方法80、从废铝基催化剂中提取钒、钼、镍、钴、铝的方法81、电镀漂洗废水中铜和镍的回收及废水零排放工艺82、一种化工废硫酸、废盐酸结合处理红土镍矿综合回收各元素的方法83、电解法从镀镍废渣中精制硫酸镍84、一种铜镍基合金废料回收铜、镍的方法85、一种从化学镀镍废液中回收镍资源的方法86、废旧镍镉电池中镉、铁、镍、钴的回收方法87、化学镀镍废水水循环回用与镍资源循环再利用的方法88、利用镍铬矿和镍铬工业废弃物生产镍铬烧结矿的方法89、化学镀镍废液中制备纳米金属镍的方法90、红土镍矿硫酸、盐酸浸出沉镍废液制融雪剂的方法91、一种由锡镍铁合金废料生产电解镍并回收锡和铁的方法92、一种高硫煤硫化挥发镍锡铁合金废料并氧化造渣制镍铁合金与回收锡的方法93、一种从镍基合金废料中再生高纯硫酸镍的方法94、利用废旧镍氢电池制备纳米晶镍钴铁氧体的方法95、一种含硫废渣与红土镍矿联合生产镍锍的方法96、一种使镍负载型废工业催化剂恢复活性的再生剂97、镍酸锂废电池正极材料的浸出方法98、镍酸锂废电池正极材料的浸出方法99、镍酸锂废电池正极材料的浸出方法100、镍酸锂废电池正极材料的浸出方法101、镍酸锂废电池正极材料的浸出方法102、镍酸锂废电池正极材料的浸出方法103、镍酸锂废电池正极材料的浸出方法104、镍酸锂废电池正极材料的浸出方法105、镍酸锂废电池正极材料的浸出方法106、镍酸锂废电池正极材料的浸出方法107、镍酸锂废电池正极材料的浸出方法108、镍酸锂废电池正极材料的浸出方法109、镍酸锂废电池正极材料的浸出方法110、镍酸锂废电池正极材料的浸出方法111、镍酸锂废电池正极材料的浸出方法112、镍酸锂废电池正极材料的浸出方法113、镍酸锂废电池正极材料的浸出方法114、镍酸锂废电池正极材料的浸出方法115、镍酸锂废电池正极材料的浸出方法116、镍酸锂废电池正极材料的浸出方法具体目录联系网站管理人员411、一种化学镀镍报废液的处理工艺412、一种红土镍矿湿法冶炼废水的综合处理方法413、一种从废旧镍氢电池中回收金属的方法414、一种采用红土镍矿废渣的防火保温墙体板的制造工艺415、直接还原-渣金熔分综合回收利用稀土镍氢电池废料的方法416、一种处理钴镍铜湿法冶金废水渣的方法417、废旧镍氢电池中金属元素回收方法418、一种从含铜镍废塑料镀层中回收有价金属的方法419、镀镍漂洗废水的在线处理系统420、一种废旧镍镉电池的资源化生产方法421、化学镀镍废物的回收方法422、一种化学镀镍磷废液的处理方法423、废旧镍镉电池回收专用的真空蒸馏工业设备424、吸附与再生分离的镀镍废水回收方法425、吸附与再生分离的镀镍废水回收系统426、一种废旧镍镉电池回收镉的方法427、镍钴锰酸锂生产废水的处理方法428、一种两次破络合处理化学镀镍废水的方法429、一种废旧镍镉电池中镉含量的测定方法430、一种酸解红土镍矿废水的利用方法431、一种由废旧动力电池定向循环制备镍钴锰酸锂的方法432、镀镍废水固态沉絮物的回收再利用433、不锈钢酸洗废水污泥中含铬镍铁氧体的回收方法434、一种镍氢废旧电池的综合回收方法435、一种酸解红土镍矿废水处理及渣的利用方法436、电镀镍漂洗废水零排放处理装置及其处理方法437、电镀镍漂洗废水槽边回收处理装置及其方法438、化学镀镍废水处理方法439、一种处理工业废气的含镍铁锰复合氧化物催化剂及其制备方法440、覆钴型球形氢氧化镍边角废料的回收处理方法441、废旧镍氢电池成份的资源化分离和循环生产方法442、磁化电极法回收铝镍钴磁钢废料443、钴镍合金废料的综合处理法444、镀镍烧结钕铁硼废料一种再利用方法445、以废旧锂离子电池为原料制备镍钴锰酸锂正极材料的方法446、一种实验室光亮镀镍废液循环利用的方法447、从废旧镍氢电池中回收稀土元素的方法448、一种电镀镍废液的处理方法449、一种降解化学镀镍废液中有机污染物并回收磷酸盐的方法450、一种利用镍铁冶炼废渣制取超细无机纤维的方法451、基于选择性氧化/还原的稀土镍氢电池废料的综合回收利用方法452、一种含硝酸的化学镀镍废液的处理方法及对应的处理系统453、镍铜冶炼酸性废水治理用耐酸防腐碳砖及其制备方法454、一种锌镍合金电镀废水的处理工艺455、电镀废水铜镍一体化循环在线回收装置及回收方法456、使用废铜镍合金生产含铜奥氏体不锈钢的方法1、本套技术资料160元2、资料都为电子版的,资料包括相关配方制备工艺等,客户也可以根据自己需要选择适合自己的进行打印。
高三化学综合卷3

江苏省前黄高级中学高三化学周末卷(3)可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32选择题(共40分)单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1.2011年诺贝尔化学奖授予以色列科学家达尼埃尔·谢赫特曼,以表彰他发现了准晶体。
准晶体材料具有硬度高,不易损伤,使用寿命长等特点。
下列叙述错误的是A.自然界中的固体可分为晶体、准晶体和非晶态物质B.准晶体是一种介于晶体和非晶态物质之间的固体C.准晶体材料的应用具有较大的发展空间D.化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应2.下列有关化学用语表述正确的是A.碳酸钙电离方程式:CaCO 3Ca2++CO32-B.次氯酸的结构式:H-Cl-OC.二氧化硅的分子式SiO2D.NaClO的电子式为:3.设N A为阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,17g甲基(—14CH3)所含的中子数为9N AB.标准状况下,11.2L苯中含有的碳碳双键数为1.5N AC.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3N AD.1mol氯气与氢氧化钙溶液完全反应生成氯化钙和氯酸钙,转移的电子数为6N A4.下列离子组在指定溶液中一定能大量共存的是A.c(I-)=0.1 mol·L-1的溶液中:Na+、Fe3+、ClO-、SO42-B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:Ba2+、K+、NO3-、Br-C.0.2 mol·L-1NaHC2O4溶液中:Ca2+、Na+、OH-、Cl-D.加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl-5.短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数。
中考化学总复习《流程题》专项试题及答案
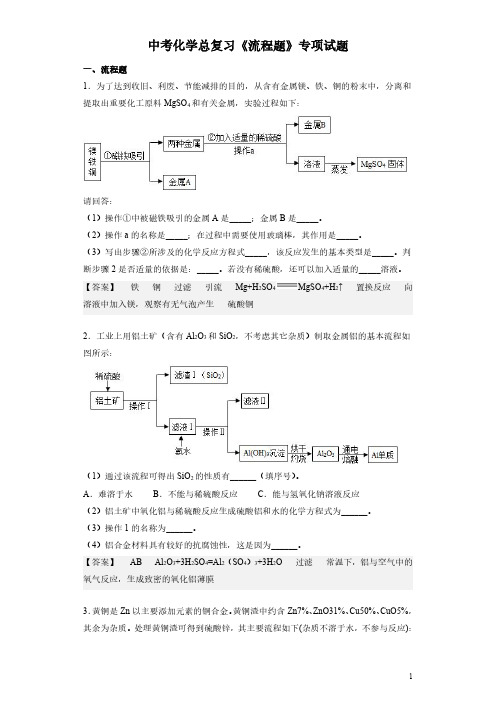
中考化学总复习《流程题》专项试题一、流程题1.为了达到收旧、利废、节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:请回答:(1)操作①中被磁铁吸引的金属A是_____;金属B是_____。
(2)操作a的名称是_____;在过程中需要使用玻璃棒,其作用是_____。
(3)写出步骤②所涉及的化学反应方程式_____,该反应发生的基本类型是_____。
判断步骤2是否适量的依据是:_____。
若没有稀硫酸,还可以加入适量的_____溶液。
【答案】铁铜过滤引流Mg+H2SO4MgSO4+H2↑置换反应向溶液中加入镁,观察有无气泡产生硫酸铜2.工业上用铝土矿(含有Al2O3和SiO2,不考虑其它杂质)制取金属铝的基本流程如图所示:(1)通过该流程可得出SiO2的性质有______(填序号)。
A.难溶于水B.不能与稀硫酸反应C.能与氢氧化钠溶液反应(2)铝土矿中氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式为______。
(3)操作1的名称为______。
(4)铝合金材料具有较好的抗腐蚀性,这是因为______。
【答案】AB Al2O3+3H2SO4=Al2(SO4)3+3H2O过滤常温下,铝与空气中的氧气反应,生成致密的氧化铝薄膜3.黄铜是Zn以主要添加元素的铜合金。
黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。
处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水,不参与反应):(1)步骤Ⅰ中产生气体的化学反应方程式为___________________。
(2)溶液A中的金属阳离子有_________________(填化学式)。
(3)步骤Ⅰ、Ⅱ中均包含的操作名称为_________________,此操作和步骤Ⅲ中的蒸发操作都要用到的玻璃仪器是_________________。
(4)溶液A的质量_____________(填“大于”、“小于”或“等于”)溶液C的质量。
扩散渗析法回收不锈钢酸洗废液中硝酸_王昆

第30卷 第6期膜 科 学 与 技 术V o l.30 N o.6 2010年12月M EM BRAN E SCI EN CE A ND T EC HN O LOG Y Dec.2010应用研究扩散渗析法回收不锈钢酸洗废液中硝酸王 昆1,王 伟2,邢卫红1*(1.南京工业大学膜科学技术研究所,材料化学工程国家重点实验室;2.南京九思高科技有限公司,南京210009)摘 要:采用扩散渗析法回收不锈钢表面酸洗废液中的硝酸.实验比较了两种扩散渗析膜用于酸回收的分离性能,考察了废酸流量、废酸浓度等对动态扩散渗析回收酸的浓度和金属离子的截留率的影响.实验结果表明:APS型阴离子交换膜的性能略优于DSV型膜,在合适的条件下,硝酸回收率大于85%,金属离子截留率大于95%.结果表明扩散渗析对于酸和金属盐的分离是一个极其有效的工艺.关键词:酸洗废液;扩散渗析;阴离子交换膜中图分类号:TQ028.8 文献标识码:A 文章编号:1007-8924(2010)06-0062-04 不锈钢表面酸洗过程中产生了大量含有重金属离子(铁、铬、镍、锰等)的酸性废水,这类废水中含有一定浓度的酸和盐,常用石灰中和法处理,产生大量淤泥的二次污染,同时大量的酸和重金属离子无法回收利用,造成了资源浪费.减压蒸发法、离子交换树脂法、溶剂萃取法、扩散渗析法等都被用以研究作为酸和金属盐回收的新方法[1].减压蒸发法回收酸的纯度较高但是能耗较高.离子交换树脂法和溶剂萃取法需要消耗其它药剂,只适合回收经济价值比较高的酸.由于扩散渗析具有能耗少、操作简单、易与其他工艺耦合等独特的优点成为回收酸的研究热点.一些研究者研究了硝酸、硫酸、盐酸通过离子交换膜静态扩散实验中的扩散现象,并测定了不同的离子交换膜中相应酸的传质系数[2,3].在实际生产体系中, Xu等[4]等研究了扩散渗析法从金属表面酸洗液中回收盐酸,盐酸的回收率达到88%,铁的截留率在77%~89%,锌的截留率低于44%.还研究了扩散渗析法从铝阳极氧化液中回收硫酸,硫酸的回收率为85%,铝离子的截留率达到95%[5].唐建军等[6]研究了扩散渗析法从稀土硫酸盐溶液中回收硫酸,考察了原料/水流量比、原料流量对硫酸回收率的影响,同时建立了相应的传质模型并进行了验证.随着环保要求越来越严,硝酸的回收利用的需求也在逐步扩大.本文主要以不锈钢生产过程中的硝酸酸洗和钝化液的循环利用为目标,选择两种扩散渗析膜进行动态扩散渗析研究,优化扩散渗析工艺参数.1 实验部分实验用废酸液来自于某不锈钢加工企业,主要是含硝酸的酸洗废液,其主要金属离子及含量见表1.表1 不锈钢酸洗废液中主要金属离子组成T able1 Co mpo sitio ns of me tal io ns in the pickingsolution of steels金属离子铁镍铬锰含量/(g·L-1)4.1380.4520.7890.073 扩散渗析器由9片180mm×100mm阴离子交换膜叠装而成,有效膜面积0.162m2.阴离子交收稿日期:2009-09-06;修改稿收到日期:2010-03-08基金项目:教育部新世纪优秀人才支持计划(N CET-06-0506);江苏省高校科研成果产业化推进项目(JH07-014);江苏省“六大”人才高峰项目(06-A-048)作者简介:王 昆(1984-),男,湖南常德市人,硕士生,从事膜分离技术研究.*联系人〈xing wh@〉 第6期王 昆等:扩散渗析法回收不锈钢酸洗废液中硝酸·63 · 换膜分别为DSV 型和APS 型阴离子交换膜(日本旭肖子公司).实验装置流程如图1所示,实验温度应控制在(20±1)℃.1.扩散渗析槽;2.原液槽;3.透析液槽;4.回收液槽;5.水槽;6.蠕动泵图1 扩散渗析流程图Fig .1 Ex perimenta l appa ratus o f diffusio n dialysis cell 实验操作方法:先将纯水充入扩散渗析装置中排除空气,再使用蠕动泵将原料液和纯水分别打入扩散渗析槽的两侧入口,始终保持原料液和纯水的体积流量为1∶1.在间隔时间内取渗透液和回收液测量两者的酸浓度,直至渗透液和回收液的酸浓度均达到稳定,此时视为扩散渗析的动态平衡状态.采用NaOH 滴定法测定酸浓度;采用ICP 法(仪器为PE 公司的PE -2000DV 电感耦合等离子仪)测定金属离子浓度.硝酸的回收率(η)和金属离子的截留率(R )计算公式如下:η=V 回×C 酸,回V 原×C 酸,原×100%(1)R =(1-V 回×C 金属,回V 原×C 金属,原)×100%(2)式中,V 回、V 原为扩散渗析动态平衡时回收侧和原料侧的体积流量,L /h ;C 酸,回、C 酸,原、C 金属,回、C 金属,原为扩散渗析动态平衡时回收侧酸浓度,mol /L ;原料侧酸浓度,mo l /L ;回收侧金属浓度,g /L ;原料侧金属浓度,g /L .2 结果和讨论2.1 动态扩散渗析的传质过程研究根据Fick 定律和溶解-扩散模型可以推导出在静态扩散实验中扩散系数[7],相关方程为:ln (ΔC A ,t )=-U ·S ·VⅠ+V ⅡVⅠ·VⅡ·t +ln (ΔC A ,0)(3)式中,ΔC A ,t 是扩散渗析槽中离子交换膜两室在t 时刻的原液与回收液浓度差;ΔC A ,0是t 0时刻的浓度差,m ol /L ;S 是离子交换膜的面积,m 2;V Ⅰ和V Ⅱ分别是原料室和回收液室的体积,m 3;U 为离子交换膜中的扩散速度系数,m /s .对于扩散渗析过程,S 、V Ⅰ和V Ⅱ均为常数,由方程(3)可知ln (ΔC A ,t )和扩散时间t 成正比例关系[8].赵宜江等[9]测定了静态扩散条件下ΔC A ,t 与时间的关系,实验验证了方程(3),并且通过线性回归计算出了硫酸通过离子交换膜的扩散速度系数.在保持原料液(硝酸浓度为5mo l /L )和纯水流量均为160L /h 的动态扩散渗析试验中,测定了到达扩散渗析的动态平衡前不同扩散时间下的ΔC A ,t ,实验结果见图2.由图2可见,ln (ΔC A ,t )随时间变化并不是单一线性关系,表现出三个阶段:第一阶段斜率很小,扩散速度系数极小,这是由于在动态实验开始加入废酸时,酸根离子首先在膜表面带正电的官能团表面吸附,酸根离子不会马上通过离子交换膜,而在膜表面上积累到一定浓度后才开始透过膜,导致ΔC A ,t 在第一阶段几乎没有变化,该现象类似于离子交换树脂的穿漏交换量[10].第二阶段和第三阶段直线斜率不同表现有明显的折点.这是由于静态扩散实验和动态实验的实验条件不同造成的,在静态试验[2,3]中两室中有搅拌保持主体浓度和膜表面传质层的浓度一致,而动态试验中并没有相应的措施来消除传质边界层浓差极化的影响,本实验的第二阶段可以认为与静态扩散中情况类似,没有受到浓差极化因素的影响.而到了第三阶段,由于吸附作用,酸根离子在膜原料液侧积累,其膜面浓度高出原料液主体浓度.在浓度梯度作用下,部分酸根离子向主体溶液扩散,形成浓差极化边界层,使得过程的传质系数减小.图2 动态扩散试验中ln (ΔC A ,t )随时间变化关系Fig .2 Rela tion of ln (ΔC A ,t )a nd time2.2 进料流量对扩散渗析过程的影响根据传质理论,在动态扩散过程中流体流速增大,其传质边界层变小,边界层和膜表面的传质阻力 ·64 ·膜 科 学 与 技 术第30卷 下降,对传质有促进作用.然而扩散渗析性能受到离子交换膜内传质过程的影响,而膜内传质速率受膜的离子交换容量的限制,如果离子在膜表面的停留时间过短,离子不能被离子交换膜吸附后向另一侧扩散,此时流量增大对于膜内传质并不是有利的因素.进料流量对膜边界层的传质和停留时间的影响是矛盾的,因此必须考察动态扩散过程中进料流量对酸回收率和金属截留率的影响.2.2.1 进料流量对酸回收率的影响在废液中酸浓度为1.38mo l/L,进料侧废酸流量和纯水流量的比为1∶1的条件下,实验考察了DSV和APS两种膜达到动态渗析平衡状态时,进料流量对硝酸回收率的影响,结果如图3所示. 由图3可见,随着进料流量由100m L/h增大到240m L/h,酸回收率逐渐变小,这是因为进料流量增大对被迁移离子在膜表面的停留时间减小的影响大于其对边界层厚度减小的影响,导致硝酸的传质系数减小.本实验得出酸回收率随进料流量减小的规律与唐建军等[6]建立的回收率和流量模型基本吻合.图3中,APS膜对酸的回收率高于DSV膜,两种膜在160m L/h左右的进料流量下均表现出酸回收率略有增大,结合酸回收率与废液处理速度,本实验较为合适的进料流量为160m L/h.图3 不同进料流量下硝酸回收率Fig.3 Re latio n o f recov ery rate of and feed flo w2.2.2 进料流量对金属离子的截留效果酸洗槽中的金属离子含量过高会影响酸洗的效果,因此在回收酸的过程中需尽可能去除金属离子,使得回收酸中的金属离子浓度降到最低以保障其重复利用的酸洗效果.表2给出了不同流量下回收酸中金属离子的含量.由表2可见,随着进料流量的增大,金属离子停留时间减少,不易透过离子交换膜,金属离子的截留率随进料流量增大而增大.APS膜和DSV膜对铁、镍、铬等离子的截留率均高于95%.在相同的进料流量下,APS膜对3种离子的截留率均高于DSV膜.表2 不同进料流量下回收液中金属离子的含量T able2 Co mpo sitio ns of me tal io ns in the recov ered so lutio n under diffe rent feed flo w进料流量/(mL·h-1)回收液/(g·L-1)铁镍铬DS V AP S DSV A PS DSV A PS1000.14250.06420.00940.00220.01280.0023 1200.12640.04560.00730.00130.00900.0019 1600.08320.03830.00720.00030.00720.0009 1900.06450.02320.00500.00010.00550.0005 2400.06280.02170.004700.00530.00042.3 进料液中酸浓度对扩散渗析过程的影响进料液中酸浓度会影响到扩散渗析过程的酸回收率和回收液中的酸浓度.实际生产中的酸洗液也会因加工要求的不同选用不同酸浓度的酸洗液或钝化液.实验考察了不同的酸浓度对扩散渗析过程的影响,实验过程中进料侧废酸流量和回收侧水流量的比为1∶1,进料流量为240m L/h,实验结果如图4所示.由图4可见,A PS膜和DSV膜均随原料酸中硝酸浓度增大酸回收率减小.这是因为原液酸浓度增大,一方面增大了传质推动力;另一方面根据电解质溶液理论[11],溶液离子强度增加,电解质的平均活度系数(γ±)减小,根据Nernst-H arley公式D= D0(1+γ±/ ln C)(式中D为离子浓度C时的扩散系数,D0为无限稀释时的扩散系数),式中的γ±/ ln C<0,扩散系数D下降,因此酸根离子的扩散速度变小.另外,硝酸在较高浓度下,离解度下降,游离酸根浓度下降,造成酸根离子的实际浓度推动力减 第6期王 昆等:扩散渗析法回收不锈钢酸洗废液中硝酸·65 ·图4 进料酸浓度对回收酸浓度和酸回收率的影响Fig.4 Effect of co ncentration on recove ryr ate of nitric acid弱.说明原液酸浓度增大导致溶液离子强度增大和硝酸解离度减小的影响占主导地位,从而导致酸的扩散速度下降和酸回收率下降.3 结论在动态扩散实验中,传质过程表现出3个阶段:即预吸附阶段,扩散速度系数几乎为零;第2阶段为静态扩散速度区;第3阶段为浓差极化扩散速度区.进料流量和酸浓度对扩散渗析过程均有较大影响.随进料流量和酸浓度增大,酸回收率都逐渐减小.在原料液和纯水的流量均为160m L/h的条件下,酸回收率大于80%,金属离子(铁、铬、镍等)的截留率大于95%,APS膜优于DSV膜.实验结果表明,扩散渗析对不同浓度的酸洗废液体系有较强的适应性,适合于酸回收利用.参考文献[1]付 丹,徐 静.酸回收的扩散渗析技术及其发展现状[J].污染防治技术,2008,21(1):59-61.[2]Er so z M,G ug ul H,Sahin A.T ranspo r t of acidsthro ug h po ly ethe r-sulfone anio n-ex change membrane[J].J Co lloid and Interf ace Sci,2001,237:130-135.[3]P alate Z,Zfiko vfi A.Separatio n of H2SO4+Z nSO4mix ture by diffusio n dialy sis[J].Desalinatio n,2004,169:277-285.[4]Xu Jing,Lu Shug uang,F u Dan.Recov ery of hydr o-chloric acid fr om the w aste acid solution by diffusio n di-aly sis[J].J Haza rd M ater,2009,165(1-3):832-837.[5]Xu Jing,F u Dan,L u Shug ua ng.T he recover y of sul-phuric acid from the waste anodic aluminum o xidatio nsolution by diffusio n dialy sis[J].Sep and P urif T echn-ol,2009,69(2):168-173.[6]T ang J J,Z hou K G,Zhang Q X.Sulfuric acid recov eryfro m rare ear th sulphate solution by diffusio n[J].T r ansactio ns N onferr ous M etals Society of China,2006(16):951-955.[7]Wijmans J G,Baker R W.The so lution-diffusion mod-e l:a review[J].J M embr Sci,1995,107(1-2):1-21.[8]周柏青.HCl和FeCl2在阴离子交换膜中扩散速度的测定[J].水处理技术,1998,24(1):30-34.[9]赵宜江,邢卫红,徐南平.扩散渗析法从钛白废酸中回收硫酸[J].高校化学工程学报,2002,16(2):217-221. [10]何炳林.离子交换与树脂吸附[M].上海:上海科技教育出版社,1995.[11]黄子卿.电解质溶液理论导论(修订版)[M].北京:科学出版社,1983.Recovery of nitric acid from picking solution of steels by diffusion dialysis W A N G K un1,W A N G Wei2,X I N G Weihong1(1.Research Cente r of M em brane Science and Technology,S tate Key Laborato ry ofM ate rials-Oriented Chemical Engineering,Nanjing University of Technolo gy;2.N anjing Jiusi H i-Tech Co.,Ltd,Nanjing210009,China)A bstract:Recovery of nitric acid from picking so lution o f steels by diffusio n dialy sis w as studied.Separa-tion perfo rmance of tw o diffusio n dialy sis membranes for acid reco very w as ev aluated.Effects of flow rate and concentratio n of nitric acid on the concentration and retentio n rate of the feed by dy namic diffusion di-aly sis w ere investig ated.The ex perimental results indicated tha t perfo rmance of the io n exchange mem-brane ty pe A PS w as better than the membrane ty pe DSV.Under suitable conditions,the recovery rate of nitric acid w as higher than85%and retention rate of metal io ns w ere higher than95%.It w as proved that diffusion dialy sis w as a very effective operation for the separation o f acid and metal salt.Key words:picking so lution;diffusion dialy sis;anio n exchange mem brane。
2024届高三化学一轮复习-工业流程题,实验题(镍专题)

工业流程题,实验题(镍专题)1从含镍催化剂(含NiO 、Fe 2O 3、Al 2O 3等物质)中回收金属资源的流程如下:下列说法错误的是A.试剂X 可以是NaOH 溶液B.“酸化”反应的离子方程式为CO 2+AlO -2+2H 2O =HCO -3+Al OH 3C.该工艺回收的金属资源为Fe 2O 3、Al 2O 3、NiSO 4⋅7H 2OD.若杂质中含有Fe 2+,浓缩结晶所得产品中可能含有FeSO 4⋅7H 2O2从电镀污泥(含Ni 2+、Ca 2+、Fe 3+、Al 3+等)中提取镍的工艺流程如图所示,下列说法错误的是已知:丁二酮肟可与Ni 2+反应生成易溶于有机溶剂的配合物:Ni 2++2C 4H 8N 2O Ni (C 4H 7N 2O )2+2H +A.“氨浸”可除去Ca 2+、Fe 3+、Al 3+等金属阳离子B.进行操作I 时,将有机相从分液漏斗上口倒出C.操作II 为反萃取,试剂X 可为盐酸,有机相可返回操作I 循环使用D.操作III 可能为过滤、洗涤、干燥、灼烧3一种以镍电极废料(含Ni 以及少量Al 2O 3,Fe 2O 3和不溶性杂质)为原料制备NiOOH 的过程可表示为:“酸浸”后溶液中的金属离子除Ni 2+外还有少量的Al 3+和Fe 2+等。
下列说法错误的是A.氧化性:Fe 3+>Ni 2+B.氧化过程的离子方程式:2Ni 2++ClO -+4OH -=2NiOOH ↓+Cl -+H 2OC.除杂过程仅为过滤操作D.工业上可电解碱性Ni OH 2悬浊液制备NiOOH ,加入一定量的KCl 有助于提高生产效率4氢镍电池适合大电流放电,常用作动力电池,其负极材料M 为Ni 、石墨粉和少量La 、Mg 、MnO 2,放电时电池反应为NiOOH +MH =Ni (OH )2+M 。
实验室对废旧氢镍电池进行综合处理,回收部分金属资源的工艺流程如图:已知:Ni 2+可形成[Ni (NH 3)6]2+配离子;K sp (MgF 2)=5.2×10-11;H 2SO 4第一步完全电离,K a (HSO -4)=1.1×10-2。
2024年中考化学专题强化训练---流程题

2024年中考化学专题强化训练---流程题一、选择题1.CO 2的捕集和利用是我国能源领域的重要战略方向。
如图是CO 2的捕集与转化示意图,有关说法正确的是A .铁的氧化物之间转化的条件相同B .反应Ⅰ属于化合反应C .反应Ⅰ固体质量增加D .FeO 可以循环使用2.从海水中制备纯碱和金属镁的流程如图所示,下列说法错误的是A .流程I 依次向粗盐水中加入过量Ca (OH )2溶液、Na 2CO 3溶液和适量稀盐酸去除杂质B .流程Ⅰ吸氨是使溶液呈碱性,有利于吸收二氧化碳C .流程IV 、V 是通过化学方法富集氯化镁D .上述流程涉及到四种基本反应类型3.利用食盐水制取2ClO 的工业流程如图所示:已知:装置I 中发生的反应为232NaCl 3H ONaClO 3H ++↑通电;2Cl 是一种有毒气体。
下列说法不正确的是A .该生产过程需要消耗电能B .装置Ⅰ中反应的化学方程式:32222NaClO 4HCl=2ClO Cl 2NaCl 2H O +↑+↑++Cl的循环利用可以减少生产过程对环境造成的污染C.2D.装置Ⅰ中发生复分解反应4.某工厂以粗盐为原料利用电解法刺备氢氧化钠的流程如下:下列说法不正确的是A.操作1、2、3中都要用到玻璃棒B.操作2和3可以合并成一步C.氢氧燃料电池将化学能转化成电能D.电解饱和氯化钠溶液得到氯气、氢氧化钠和氢气,该反应属于分解反应5.我国科学家利用CO2合成葡萄糖,该方案先用碳电还原法将CO2转化为醋酸,再利用微生物发酵获得葡萄糖。
下列说法不正确的是A.该过程中C、O化合价发生改变B.理论上若有44gCO2完全参与反应,则共生成16gO2C.利用微生物发酵时,温度不宜过高原因之一是若温度过高,微生物活性会降低D.科学家在分析醋酸溶液和葡萄糖溶液的溶质含量时,测得含氢量相等,则含碳量也一定相等6.下图是自然界中碳、氧循环简图。
下列说法不正确的是A.从分类的角度看,X属于酸,Y属于有机物B.从能量的角度看,两种循环只涉及化学能转化为热能C.从平衡的角度看,大气中二氧化碳和氧气含量基本不变D.从微观的角度看,光合作用不会使自然界中的氧原子总数增加7.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是A.该工艺流程是用来除去煤燃烧时产生的SO2的B.该过程中可得到化工产品H2SO4C.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4D.该过程中化合价发生改变的元素只有Fe和S8.回收含铜废料中的铜,部分实验流程如下图所示。
