热力学复习题
热力学复习题

欢迎共阅《工程热力学》复习题汇总一填空题1.热力系统:忽略家用电热水器的表面散热,取正在加热不在使用的电热水器为控制体,(不包括电加热器),这是系统,把电加热器包括在研究对分装有许多隔板,每抽去一块隔板,让气体先恢复平衡再抽去下一块,问此过程为,理由为。
7.闭口系统热力学第一定律表达式:,稳流开口系统的热力学第一定律表达式为:;开口系统工质跟外界交换的技术功包括,可逆过程技术功的计算式为:;8 闭口容器内的气体从热源吸收了100kJ的热量,并对外膨胀作功消耗了40kJ,其中克服摩擦功5kJ,假设摩擦产生的耗散热全部用于增加工质的热力学能,根据闭口系统能量守恒方程式,系统热力学能增加量为。
工临界流速临界声速。
14.活塞式压缩机中,因的存在,使产气量降低,但理论上对单位质量气体耗功影响。
15.活塞式内燃机有三个循环特征性能参数,分别为。
16.活塞式内燃机循环过程与燃气轮机循环过程的主要区别可概括为。
17.刚性绝热气缸-活塞系统,B侧设有电热丝,判断下列4种情况分别是什么热A 0.06 MPaB 0.04MPaC 0.14 Mpa3.理想气体在某一过程中吸入3100kJ的热量,同时内能增加了150kJ,该过程是():A 膨胀过程,B 压缩过程C定容过程4.理想气体在某过程中吸入100kJ的热量,对外输出100kJ的功,此过程是()。
A压缩过程 B 绝热过程 C 定温过程5.一绝热刚体容器用隔板分成两部分,左边盛有高压理想气体,右边为真空,10.理想气体经某可逆过程后,其Δu和Δh的变化量为0,此过程为();若Δs=0,则此过程为();如w t=0,过程为();若w=0,过程为()。
A定容过程,B定压过程,C定温过程,D绝热过程11.某理想气体经历了一个内能不变的热力过程,则该过程中工质的焓变()A 大于零,B 等于零C小于零12. 单位千克理想气体可逆绝热过程的技术功等于A-Δh B Δu C Δh D -Δu13. 对于理想气体,下列各说法是否正确()17.有位发明家声称他设计了一种机器,当这台机器完成一个循环时,可以从单一热源吸收1000kJ的热,并输出1200kJ的功,这台热机()。
研究生考试热力学基础复习题及答案参考

第9章 热力学基础一、选择题1. 对于准静态过程和可逆过程, 有以下说法.其中正确的是 [ ] (A) 准静态过程一定是可逆过程 (B) 可逆过程一定是准静态过程 (C) 二者都是理想化的过程(D) 二者实质上是热力学中的同一个概念2. 对于物体的热力学过程, 下列说法中正确的是[ ] (A) 内能的改变只决定于初、末两个状态, 与所经历的过程无关 (B) 摩尔热容量的大小与所经历的过程无关(C) 在物体内, 若单位体积内所含热量越多, 则其温度越高(D) 以上说法都不对3. 有关热量, 下列说法中正确的是 [ ] (A) 热是一种物质(B) 热能是物质系统的状态参量(C) 热量是表征物质系统固有属性的物理量 (D) 热传递是改变物质系统内能的一种形式4. 关于功的下列各说法中, 错误的是 [ ] (A) 功是能量变化的一种量度(B) 功是描写系统与外界相互作用的物理量(C) 气体从一个状态到另一个状态, 经历的过程不同, 则对外作的功也不一样 (D) 系统具有的能量等于系统对外作的功5. 理想气体状态方程在不同的过程中有不同的微分表达式, 式表示[ ] (A) 等温过程 (B) 等压过程(C) 等体过程 (D) 绝热过程6. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 式表示[ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 绝热过程7. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 式0d d =+V p p V 表示 [ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 绝热过程8. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 则式表示[ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 任意过程9. 热力学第一定律表明:[ ] (A) 系统对外作的功不可能大于系统从外界吸收的热量 (B) 系统内能的增量等于系统从外界吸收的热量(C) 不可能存在这样的循环过程, 在此过程中, 外界对系统所作的功 不等于系统传给外界的热量 (D) 热机的效率不可能等于110. 对于微小变化的过程, 热力学第一定律为d Q = d E +d A .在以下过程中, 这三者同时为正的过程是[ ] (A) 等温膨胀 (B) 等容膨胀 (C) 等压膨胀 (D) 绝热膨胀11. 对理想气体的等压压缩过程,下列表述正确的是[ ] (A) d A >0, d E >0, d Q >0 (B) d A <0, d E <0, d Q <0 (C) d A <0, d E >0, d Q <0 (D) d A = 0, d E = 0, d Q = 012. 功的计算式适用于[ ] (A) 理想气体 (B) 等压过程 (C) 准静态过程 (D) 任何过程13. 一定量的理想气体从状态),(V p 出发, 到达另一状态)2,(Vp . 一次是等温压缩到2V , 外界作功A ;另一次为绝热压缩到2V, 外界作功W .比较这两个功值的大小是 [ ] (A) A >W (B) A = W (C) A <W (D) 条件不够,不能比较14. 1mol 理想气体从初态(T 1、p 1、V 1 )等温压缩到体积V 2, 外界对气体所作的功为 [ ] (A) 121lnV V RT (B) 211ln V VRT (C) )(121V V p - (D) 1122V p V p -15. 如果∆W 表示气体等温压缩至给定体积所作的功, ∆Q 表示在此过程中气体吸收的热量, ∆A 表示气体绝热膨胀回到它原有体积所作的功, 则整个过程中气体内能的变化为 [ ] (A) ∆W +∆Q -∆A (B) ∆Q -∆W -∆A (C) ∆A -∆W -∆Q (D) ∆Q +∆A -∆W16. 理想气体内能增量的表示式T C E V ∆=∆ν适用于[ ] (A) 等体过程 (B) 等压过程 (C) 绝热过程 (D) 任何过程17. 刚性双原子分子气体的定压比热与定体比热之比在高温时为[ ] (A) 1.0 (B) 1.2 (C) 1.3 (D) 1.418. 公式R C C V p +=在什么条件下成立?[ ] (A) 气体的质量为1 kg (B) 气体的压强不太高 (C) 气体的温度不太低 (D) 理想气体19. 同一种气体的定压摩尔热容大于定体摩尔热容, 其原因是 [ ] (A) 膨胀系数不同 (B) 温度不同(C) 气体膨胀需要作功 (D) 分子引力不同20. 摩尔数相同的两种理想气体, 一种是单原子分子气体, 另一种是双原子分子气体, 从同一状态开始经等体升压到原来压强的两倍.在此过程中, 两气体 [ ] (A) 从外界吸热和内能的增量均相同 (B) 从外界吸热和内能的增量均不相同 (C) 从外界吸热相同, 内能的增量不相同 (D) 从外界吸热不同, 内能的增量相同21. 两气缸装有同样的理想气体, 初态相同.经等体过程后, 其中一缸气体的压强变为原来的两倍, 另一缸气体的温度也变为原来的两倍.在此过程中, 两气体从外界吸热 [ ] (A) 相同 (B) 不相同, 前一种情况吸热多 (C) 不相同, 后一种情况吸热较多 (D) 吸热多少无法判断22. 摩尔数相同的理想气体H 2和He, 从同一初态开始经等压膨胀到体积增大一倍时 [ ] (A) H 2对外作的功大于He 对外作的功 (B) H 2对外作的功小于He 对外作的功 (C) H 2的吸热大于He 的吸热 (D) H 2的吸热小于He 的吸热23. 摩尔数相同的两种理想气体, 一种是单原子分子, 另一种是双原子分子, 从同一状态开始经等压膨胀到原体积的两倍.在此过程中, 两气体 [ ] (A) 对外作功和从外界吸热均相同 (B) 对外作功和从外界吸热均不相同 (C) 对外作功相同, 从外界吸热不同 (D) 对外作功不同, 从外界吸热相同24. 摩尔数相同但分子自由度不同的两种理想气体从同一初态开始作等温膨胀, 若膨胀后体积相同, 则两气体在此过程中 [ ] (A) 对外作功相同, 吸热不同 (B) 对外作功不同, 吸热相同 (C) 对外作功和吸热均相同 (D) 对外作功和吸热均不相同25. 两气缸装有同样的理想气体, 初始状态相同.等温膨胀后, 其中一气缸的体积膨胀为原来的两倍, 另一气缸内气体的压强减小到原来的一半.在其变化过程中, 两气体对外作功[ ] (A) 相同 (B) 不相同, 前一种情况作功较大 (C) 不相同, 后一种情况作功较大 (D) 作功大小无法判断26. 理想气体由初状态( p 1、V 1、T 1)绝热膨胀到末状态( p 2、V 2、T 2),对外作的功为 [ ] (A))(12T T C MV -μ(B))(12T T C Mp -μ(C) )(12T T C MV --μ(D) )(12T T C Mp --μ27. 在273K 和一个1atm 下的单原子分子理想气体占有体积22.4升.将此气体绝热压缩至体积为16.8升, 需要作多少功?[ ] (A) 330 J (B) 680 J (C) 719 J (D) 223 J28. 一定量的理想气体分别经历了等压、等体和绝热过程后其内能均由E 1变化到E 2 .在上述三过程中, 气体的[ ] (A) 温度变化相同, 吸热相同 (B) 温度变化相同, 吸热不同 (C) 温度变化不同, 吸热相同 (D) 温度变化不同, 吸热也不同29. 如果使系统从初态变到位于同一绝热线上的另一终态则 [ ] (A) 系统的总内能不变(B) 联结这两态有许多绝热路径 (C) 联结这两态只可能有一个绝热路径 (D) 由于没有热量的传递, 所以没有作功30. 一定量的理想气体, 从同一状态出发, 经绝热压缩和等温压缩达到相同体积时, 绝热压缩比等温压缩的终态压强[ ] (A) 较高 (B) 较低 (C) 相等 (D) 无法比较31. 一定质量的理想气体从某一状态经过压缩后, 体积减小为原来的一半, 这个过程可以是绝热、等温或等压过程.如果要使外界所作的机械功为最大, 这个过程应是 [ ] (A) 绝热过程 (B) 等温过程(C) 等压过程 (D) 绝热过程或等温过程均可32. 视为理想气体的0.04 kg 的氦气(原子量为4), 温度由290K 升为300K .若在升温过程中对外膨胀作功831 J, 则此过程是[ ] (A) 等体过程 (B) 等压过程(C) 绝热过程 (D) 等体过程和等压过程均可能33. 一定质量的理想气体经历了下列哪一个变化过程后, 它的内能是增大的? [ ] (A) 等温压缩 (B) 等体降压 (C) 等压压缩 (D) 等压膨胀34. 一定量的理想气体从初态),(T V 开始, 先绝热膨胀到体积为2V , 然后经等容过程使温度恢复到T , 最后经等温压缩到体积V .在这个循环中, 气体必然[ ] (A) 内能增加 (B) 内能减少 (C) 向外界放热 (D) 对外界作功35. 提高实际热机的效率, 下面几种设想中不可行的是 [ ] (A) 采用摩尔热容量较大的气体作工作物质 (B) 提高高温热源的温度 (C) 使循环尽量接近卡诺循环(D) 力求减少热损失、摩擦等不可逆因素36. 在下面节约与开拓能源的几个设想中, 理论上可行的是[ ] (A) 在现有循环热机中进行技术改进, 使热机的循环效率达100% (B) 利用海面与海面下的海水温差进行热机循环作功 (C) 从一个热源吸热, 不断作等温膨胀, 对外作功 (D) 从一个热源吸热, 不断作绝热膨胀, 对外作功37. 关于热运动规律,下列说法中唯一正确的是 [ ] (A) 任何热机的效率均可表示为吸Q A =η (B) 任何可逆热机的效率均可表示为高低T T -=1η (C) 一条等温线与一条绝热线可以相交两次(D) 两条绝热线与一条等温线可以构成一个循环38. 卡诺循环的特点是[ ] (A) 卡诺循环由两个等压过程和两个绝热过程组成 (B) 完成一次卡诺循环必须有高温和低温两个热源 (C) 卡诺循环的效率只与高温和低温热源的温度有关 (D) 完成一次卡诺循环系统对外界作的净功一定大于039. 在功与热的转变过程中, 下面说法中正确的是 [ ] (A) 可逆卡诺机的效率最高, 但恒小于1(B) 可逆卡诺机的效率最高, 可达到1(C) 功可以全部变为热量, 而热量不能全部变为功 (D) 绝热过程对外作功, 系统的内能必增加40. 两个恒温热源的温度分别为T 和t , 如果T >t , 则在这两个热源之间进行的卡诺循环热机的效率为 [ ] (A)t T T - (B) t t T - (C) T t T - (D) TtT +41. 对于热传递, 下列叙述中正确的是 [ ] (A) 热量不能从低温物体向高温物体传递 (B) 热量从高温物体向低温物体传递是不可逆的(C) 热传递的不可逆性不同于热功转换的不可逆性(D) 理想气体等温膨胀时本身内能不变, 所以该过程也不会传热42. 根据热力学第二定律可知, 下列说法中唯一正确的是 [ ] (A) 功可以全部转换为热, 但热不能全部转换为功(B) 热量可以从高温物体传到低温物体, 但不能从低温物体传到高温物体 (C) 不可逆过程就是不能沿相反方向进行的过程 (D) 一切自发过程都是不可逆过程43. 根据热力学第二定律判断, 下列哪种说法是正确的[ ] (A) 热量能从高温物体传到低温物体, 但不能从低温物体传到高温物体 (B) 功可以全部变为热, 但热不能全部变为功 (C) 气体能够自由膨胀, 但不能自由压缩(D) 有规则运动的能量能够变为无规则运动的能量, 但无规则运动的能量不能变为有规则运动的能量44. 热力学第二定律表明:[ ] (A) 不可能从单一热源吸收热量使之全部变为有用功 (B) 在一个可逆过程中, 工作物质净吸热等于对外作的功 (C) 摩擦生热的过程是不可逆的(D) 热量不可能从温度低的物体传到温度高的物体45. “理想气体和单一热源接触作等温膨胀时, 吸收的热量全部用来对外作功.”对此说法, 有以下几种评论, 哪一种是正确的?[ ] (A) 不违反热力学第一定律, 但违反热力学第二定律 (B) 不违反热力学第二定律, 但违反热力学第一定律 (C) 不违反热力学第一定律, 也不违反热力学第二定律 (D) 违反热力学第一定律, 也违反热力学第二定律46. 有人设计了一台卡诺热机(可逆的).每循环一次可从400K 的高温热源吸收1800J 的热量, 向300K 的低温热源放热800J, 同时对外作功1000J .这样的设计是 [ ] (A) 可以的, 符合热力学第一定律 (B) 可以的, 符合热力学第二定律(C) 不行的, 卡诺循环所作的功不能大于向低温热源放出的热量 (D) 不行的, 这个热机的效率超过了理论值47. 1mol 的单原子分子理想气体从状态A 变为状态B, 如果变化过程不知道, 但A 、B 两态的压强、温度、体积都知道, 则可求出[ ] (A) 气体所作的功 (B) 气体内能的变化(C) 气体传给外界的热量 (D) 气体的质量48. 如果卡诺热机的循环曲线所包围的面积从图中的abcda 增大为da c b a '',那么循环abcda 与da c b a ''所作的功和热机效率变化情况是:[ ] (A) 净功增大,效率提高(B) 净功增大,效率降低 (C) 净功和效率都不变 (D) 净功增大,效率不变49. 用两种方法: 使高温热源的温度T 1升高△T ;使低温热源的温度T 2降低同样的△T 值;分别可使卡诺循环的效率升高1η∆和 2η∆,两者相比:[ ] (A) 1η∆>2η∆ (B) 2η∆>1η∆(C) 1η∆=2η∆ (D) 无法确定哪个大50. 下面所列四图分别表示某人设想的理想气体的四个循环过程,请选出其中一个在理论上可能实现的循环过程的图的符号. [ ]51. 在T9-1-51图中,I c II 为理想气体绝热过程,I a II 和I b II 是任意过程.此两任意过程中气体作功与吸收热量的情况是:[ ] (A) I a II 过程放热,作负功;I b II 过程放热,作负功(B) I a II 过程吸热,作负功;I b II 过程放热,作负功 (C) I a II 过程吸热,作正功;I b II 过程吸热,作负功(D) I a II 过程放热,作正功;I b II 过程吸热,作正功52. 给定理想气体,从标准状态(p 0,V 0,T 0)开始作绝热膨胀,体积增大到3倍.膨胀后温度T 、压强p 与标准状态时T 0、p 0之关系为(γ 为比热比) [ ] (A) 01)31(T T -=γ, 0)31(p p γ= (B) 0)31(T T γ=,01)31(p p -=γ (C) 0)31(T T γ-=,01)31(p p -=γ (D) 01)31(T T -=γ,0)31(p p γ-=53. 甲说:“由热力学第一定律可证明任何热机的效率不可能等于1.”乙说:“热力学第二定律可表述为效率等于 100%的热机不可能制造成功.”丙说:“由热力学第一定律可证明任何卡诺循环的效率都等于)1(12T T -.”丁说:“由热力学第一定律可证明理想气体卡诺热机(可逆的)循环的效率等于)1(12T T -.”对以上说法,有如下几种评论,哪种是正确的? [ ] (A) 甲、乙、丙、丁全对 (B) 甲、乙、丙、丁全错(C) 甲、乙、丁对,丙错 (D) 乙、丁对,甲、丙错54. 某理想气体分别进行了如T9-1-54图所示的两个卡诺循环:(D)(C)(A)(B)T9-1-51图I(abcda )和II(a'b'c'd'a'),且两个循环曲线所围面积相等.设循环I 的效率为η,每次循环在高温热源处吸的热量为Q ,循环II 的效率为η',每次循环在高温热源处吸的热量为Q ',则[ ] (A) Q Q '<'<,ηη (B) Q Q '>'<,ηη(C) Q Q '<'>,ηη (D) Q Q '>'>,ηη55. 两个完全相同的气缸内盛有同种气体,设其初始状态相同.今使它们分别作绝热压缩至相同的体积,其中气缸1内的压缩过程是非准静态过程,而气缸2内的压缩过程则是准静态过程.比较这两种情况的温度变化:[ ] (A) 气缸1和气缸2内气体的温度变化相同 (B) 气缸1内的气体较气缸2内的气体的温度变化大(C) 气缸1内的气体较气缸2内的气体的温度变化小 (D) 气缸1和气缸2内的气体的温度无变化二、填空题1. 不等量的氢气和氦气从相同的初态作等压膨胀, 体积变为原来的两倍.在这过程中, 氢气和氦气对外作的功之比为 .2. 1mol 的单原子分子理想气体, 在1atm 的恒定压力下从273K 加热到373K, 气体的内能改变了 .3. 各为1摩尔的氢气和氦气, 从同一状态(p ,V )开始作等温膨胀.若氢气膨胀后体积变为2V , 氦气膨胀后压强变为2p, 则氢气和氦气从外界吸收的热量之比为 . 4. 两个相同的容器, 一个装氢气, 一个装氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等.现将6J 热量传给氦气, 使之温度升高.若使氢气也升高同样的温度, 则应向氢气传递的热量为 .5. 1摩尔的单原子分子理想气体, 在1个大气压的恒定压力作用下从273K 加热到373K, 此过程中气体作的功为 .6. 273K 和一个1atm 下的单原子分子理想气体占有体积22.4升.此气体等温压缩至体积为16.8升的过程中需作的功为 .7. 一定量气体作卡诺循环, 在一个循环中, 从热源吸热1000 J, 对外作功300 J . 若冷凝器的温度为7︒C, 则热源的温度为 .8. 理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为1S 和2S ,则二者的大小关系是 .9. 一卡诺机(可逆的),低温热源的温度为C 27,热机效率为40%,其高温热源温度为 K .今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加 K .T9-2-8图10. 一个作可逆卡诺循环的热机,其效率为η,它的逆过程的致冷系数212T T T w -=,则η与w 的关系为 .11. 1mol 理想气体(设V P C C =γ为已知)的循环过程如T -V 图所示,其中CA 为绝热过程,A 点状态参量(11,V T ),和B 点的状态参量(21,V T )为已知.则C 点的状态参量为:=C V , =C T , =C p .12. 一定量的理想气体,从A 状态),2(11V p 经历如T9-2-12图所示的直线过程变到B 状态),(11V p ,则AB 过程中系统作功___________, 内能改变△E =_________________.13. 质量为M 、温度为0T 的氦气装在绝热的容积为V 的封闭容器中,容器一速率v 作匀速直线运动.当容器突然停止后,定向运动的动能全部转化为分子热运动的动能,平衡后氦气的温度增大量为 .14. 有ν摩尔理想气体,作如T9-2-14图所示的循环过程abca ,其中acb 为半圆弧,b -a 为等压过程,a c p p 2=,在此循环过程中气体净吸热量为Q νC p )(a b T T -(填入:> , <或=).15. 一定量的理想气体经历acb 过程时吸热550 J .则经历acbea 过程时,吸热为 .16. 一定量理想气体,从同一状态开始使其体积由V 1膨胀到2V 1,分别经历以下三种过程: 等压过程; 等温过程;● 绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多.17. 一定量的理想气体,从状态a 出发,分别经历等压、等温、绝热三种过程由体积V 1膨胀到体积V 2,试在T9-2-17图中示意地画出这三种过程的p -V 图曲线.在上述三种过程中:(1) 气体的内能增加的是__________过程;T 12TT9-2-11图2p 11T9-2-12图p pT9-2-14图533m 10-T9-2-15图12(2) 气体的内能减少的是__________过程.18. 如T9-2-18图所示,已知图中两部分的面积分别为S 1和S 2. 如果气体的膨胀过程为a →1→b ,则气体对外做功W =________; 如果气体进行a →1→b →2→a 的循环过程,则它对外做功W =_______________.19. 如T9-2-19图所示,一定量的理想气体经历c b a →→过程,在此过程中气体从外界吸收热量Q ,系统内能变化E ∆.则Q 和E ∆ >0或<0或= 0的情况是:Q _________, ∆E __________.20. 将热量Q 传给一定量的理想气体,(1) 若气体的体积不变,则其热量转化为 ; (2) 若气体的温度不变,则其热量转化为 ;(3) 若气体的压强不变,则其热量转化为 . 21. 一能量为1012 eV 的宇宙射线粒子,射入一氖管中,氖管内充有 0.1 mol 的氖气,若宇宙射线粒子的能量全部被氖气分子所吸收,则氖气温度升高了_________________K .(1 eV =1.60×10-19J ,普适气体常量R =8.31 J/(mol ⋅K))22. 有一卡诺热机,用29kg 空气作为工作物质,工作在27℃的高温热源与-73℃的低温热源之间,此热机的效率η=______________.若在等温膨胀的过程中气缸体积增大到2.718倍,则此热机每一循环所作的功为_________________.(空气的摩尔质量为29×10-3 kg ⋅mol -1,普适气体常量R =8.3111K mol J --⋅⋅)23. 一气体分子的质量可以根据该气体的定体比热来计算.氩气的定体比热c V =0.314 k J ·kg -1·K -1,则氩原子的质量m =_____ _____.T9-2-18图T9-2-19图三、计算题1. 1 mol 刚性双原子分子的理想气体,开始时处于Pa 1001.151⨯=p 、331m 10-=V 的状态,然后经图示直线过程I 变到Pa 1004.452⨯=p 、332m 102-⨯=V 的状态.后又经过方程为C pV=21(常量)的过程II 变到压强Pa 1001.1513⨯==p p 的状态.求:(1) 在过程I 中气体吸的热量; (2) 整个过程气体吸的热量.2. 1 mol 的理想气体,完成了由两个等容过程和两个等压 过程构成的循环过程(如T9-3-2图),已知状态1的温度为1T , 状态3的温度为3T ,且状态2和4在同一等温线上.试求 气体在这一循环过程中作的功.3. 一卡诺热机(可逆的),当高温热源的温度为C 127 、低温热源温度为C 27 时,其每次循环对外作净功8000J .今维持低温热源的温度不变,提高高温热源的温度,使其每次循环对外作净功10000J .若两个卡诺循环都工作在相同的两条绝热线之间,试求:(1) 第二个循环热机的效率; (2) 第二个循环的高温热源的温度.4. 某种单原子分子的理想气体作卡诺循环,已知循环效率%20=η,试问气体在绝热膨胀时,气体体积增大到原来的几倍?5. 1mol 双原子分子理想气体作如T9-3-5图所示的可逆循环过程,其中1-2为直线,2-3为绝热线,3-1为等温线.已知13128,2V V T T ==,试求:(1) 各过程的功,内能增量和传递的热量;(用1T 和已知常数表示) (2) 此循环的效率η.(注:循环效率1A =η,A 为每一循环过程气体对外所作的功,1Q 为每一循环过程气体吸收的热量)1p VT9-3-1图T9-3-2图123T9-3-5图6. 如T9-3-6图所示,一金属圆筒中盛有1 mol 刚性双原子分子的理想气体,用可动活塞封住,圆筒浸在冰水混合物中.迅速推动活塞,使气体从标准状态(活塞位置I)压缩到体积为原来一半的状态(活塞位置II),然后维持活塞不动,待气体温度下降至0℃,再让活塞缓慢上升到位置I ,完成一次循环. (1) 试在p -V 图上画出相应的理想循环曲线;(2) 若作100 次循环放出的总热量全部用来熔解冰,则有多少冰被熔化? (已知冰的熔解热 3.35×105 J·kg -1,普适气体常量 R= 8.31J·mol -1·K -1)7. 比热容比 1.40的理想气体,进行如T9-3-7图所示的abca 循环,状态a 的温度为300 K . (1) 求状态b 、c 的温度;(2) 计算各过程中气体所吸收的热量、气体所作的功和气体内能的增量;(3) 求循环效率.8. 一台冰箱工作时,其冷冻室中的温度为-10℃,室温为15℃.若按理想卡诺致冷循环计算,则此致冷机每消耗的功,可以从冷冻室中吸出多少热量?9. 一可逆卡诺热机低温热源的温度为7.0℃,效率为40%;若要将其效率提高50%,则高温热源温度需提高几度?10. 绝热容器中有一定量的气体,初始压强和体积分别为和.用一根通有电流的电阻丝对它加热(设电阻不随温度改变).在加热的电流和时间都相同的条件下,第一次保持体积不变,压强变为;第二次保持压强不变,而体积变为.不计电阻丝的热容量,求该气体的比热容比.11. 空气中的声速的表达式为,其中ρ是气体密度,是体弹性模量,满足关系式.就下列两种情况计算其声速: (1) 假定声波传播时空气的压缩和膨胀过程是一个等温过程(即等温声速模型,亦称为牛顿模型);(2) 假定声波传播时空气的压缩和膨胀过程是一个绝热过程(即绝热声速模型); 比较这两个结果你得出什么结论?(设空气中只有氮气)12. 某热机循环从高温热源获得热量Q H ,并把热量Q L 排给低温热源.设高、低温热源的温度分别为T H =2000K 和T L =300K ,试确定在下列条件下热机是可逆、不可逆或不可能存在的.(1) Q H =1000J ,A =900J ;(2) Q H =2000J ,Q L =300J ;(3) A =1500J ,Q L =500J .13. 研究动力循环和制冷循环是热力学的重要应用之一.内燃机以气缸内燃烧的气体为工质.对于四冲程火花塞点燃式汽油发动机来说,它的理想循环是定体加热循环,称为奥托循环(Otto cycle ).而对于四冲程压=λ=γJ 1020p 0V 0V 1p 0p 1V u κρ=κVp Vκ∆∆=-IT9-3-6图 I IT9-3-7图2)(m 3V 6Pa)10(2⨯p a 2b c O 4134燃式柴油机来说,它的理想循环是定压加热循环,称为狄塞耳循环(Diesel cycle ).如T9-3-13图所示,往复式内燃机的奥托循环经历了以下四个冲程:(1)吸气冲程(0→1):当活塞由上止点T 向下止点B 运时,进气阀打开,在大气压力下吸入汽油蒸气和空气的混合气体.(2)压缩冲程:进气阀关闭,活塞向左运行,混合气体被绝热压缩(1→2);活塞移动T 点时,混合气体被电火花点燃迅速燃烧,可以认为是定体加热过程(2→3),吸收热量.(3)动力冲程:燃烧气体绝热膨胀,推动活塞对外作功(3→4);然后,气体在定体条件下降压(4→1),放出热量.(4)排气冲程:活塞向左运行,残余气体从排气阀排出.假定内燃机中的工质是理想气体并保持定量,试求上述奥托循环1→2→3→4→1的效率.14. 绝热壁包围的气缸被一绝热的活塞分成A ,B 两室,活塞在气缸内可无摩擦自由滑动,每室内部有1摩尔的理想气体,定容热容量.开始时,气体都处在平衡态.现在对A 室加热,直到A 中压强变为2为止.(1) 加热结束后,B 室中气体的温度和体积? (2) 求加热之后,A 、B 室中气体的体积和温度; (3) 在这过程中A 室中的气体作了多少功? (4) 加热器传给A 室的热量多少?15. 如T9-3-15图所示,器壁与活塞均绝热的容器中间被一隔板等分为两部分,其中右边贮有1摩尔处于标准状态的氦气(可视为理想气体),左边为真空.现先把隔板拉开,待气体平衡后,再缓慢向右推动活塞,把气体压缩到原来的体积.求氦气的温度改变量.16. 如T9-3-15图所示,一固定绝热隔板将某种理想气体分成A 、B 两部分,B 的外侧是可动活塞.开始时A 、B 两部分的温度T 、体积V 、压强p 均相同,并与大气压强相平衡.现对A 、B 两部分气体缓慢地加热,当对A 和B 给予相等的热量Q 以后,A 室中气体的温度升高度数与B 室中气体的温度升高度数之比为7:5.(1) 求该气体的定体摩尔热容C V 和定压摩尔热容C p ; (2) B 室中气体吸收的热量有百分之几用于对外作功?17. 有两个全同的物体,其内能为为常数),初始时两物体的温度分别为.现以两物体分别为高、低温热源驱动一卡诺热机运行,最后两物体达到一共同温度.求(1);(2)求卡诺热机所作的功.18. 温度为25℃、压强为1atm 的1mol 刚性双原子分子理想气体,经等温过程体积膨胀至原来的3倍.(普适气体常量R =8.31 ,ln 3=1.0986)(1) 计算这个过程中气体对外所作的功;(2) 假若气体经绝热过程体积膨胀为原来的3倍,那么气体对外作的功又是多少?19. 图T9-3-19为一循环过程的T -V 曲线.该循环的工质为的理想气体,其中和均已知且为常量.已知a 点的温度为,体积为V 1,b 点的体积为V 2,ca 为绝热过程.求:1Q 2Q ηR c V 25=),,(000T V p 0p (u CT C =21T T 、f T f T 1--⋅⋅K mol J 1mol μV C γ1TT9-3-15图He空真T9-3-17图AB。
第三章热力学第二定律 复习题

第三章 热力学第二定律一、选择题1、恒温恒压可逆相变过程中等于零的量是:A.U ∆;B.H ∆;C.G ∆;D.S ∆。
2、根据熵增大原理:A.隔离系统的熵永不减小;B.绝热系统的熵永不减小;C.系统和环境的熵的和永不减小; D 以上三者都对。
3、纯物质由液态蒸发为气态后其标准摩尔熵:A.增大;B.减小;C.不变;D.因物质种类不知所以不能确定。
4、理想气体的物质的量为n ,从始态A (P 1,V 1,T 1)变到末态B (P 2,V 2,T 2),其熵变的计算公式可用:( )A. ΔS = nRln(P 1/P 2) +⎰21T T p )T /dT C ( B. ΔS = nRln(P 1/P 2)-⎰21T T p )T /dT C ( C. ΔS = nRln(V 1/V 2)+ ⎰21T T p )T /dT C ( D. ΔS = nRln(V 1/V 2)-⎰21T T p )T /dT C ( 5、在标准压力P θ下,383.15K 的水变为同温下的蒸汽,吸热Q p 。
对于该相变过程,以下哪个关系式不能成立?( )A ΔG <0B ΔH=Q pC ΔS 隔离<0D ΔS 隔离>06、ΔG =0 的过程应满足的条件是(A) 等温等压且非体积功为零的可逆过程(B) 等温等压且非体积功为零的过程(C) 等温等容且非体积功为零的过程(D) 可逆绝热过程7、在一定温度下,发生变化的孤立体系,其总熵(A )不变 (B) 可能增大或减小 (C) 总是减小 (D)总是增大8、关于吉布斯函数G , 下面的说法中不正确的是(A) ΔG≤W'在做非体积功的各种热力学过程中都成立(B) 在等温等压且不做非体积功的条件下, 对于各种可能的变动, 系统在平衡态的吉氏函数最小(C) 在等温等压且不做非体积功时, 吉氏函数增加的过程不可能发生(D) 在等温等压下,一个系统的吉氏函数减少值大于非体积功的过程不可能发生9、关于热力学第二定律下列哪种说法是错误的(A) 热不能自动从低温流向高温(B) 不可能从单一热源吸热做功而无其它变化(C) 第二类永动机是造不成的(D) 热不可能全部转化为功10、关于克劳修斯-克拉佩龙方程下列说法错误的是(A) 该方程仅适用于液-气平衡(B) 该方程既适用于液-气平衡又适用于固-气平衡(C) 该方程假定气体的体积远大于液体或固体的体积(D) 该方程假定与固相或液相平衡的气体为理想气体11、关于熵的说法正确的是(A) 每单位温度的改变所交换的热为熵(B) 可逆过程熵变为零(C) 不可逆过程熵将增加(D) 熵与系统的微观状态数有关12、氢气进行不可逆循环(A)ΔU>0 (B) ΔS=0 (C) ΔS>0 (D) ΔS<013、下述过程,体系的ΔG何者为零?(A) 理想气体的等温膨胀(B) 孤立体系的任意过程(C) 在100℃,101325Pa下1mol水蒸发成水汽(D) 绝热可逆过程14、关于熵的性质, 下面的说法中不正确的是(A) 环境的熵变与过程有关(B) 某些自发过程中可以为系统创造出熵(C) 熵变等于过程的热温商(D) 系统的熵等于系统内各部分熵之和15、根据热力学第一定律,在一循环过程中()(A) 功与热可以完全相互转换(B) 功与热都不能完全相互转换(C) 功可以完全转变为热,热不能完全转变为功(D) 功不能完全转变为热,热可以完全转变为功16、在下列过程中, ΔG=ΔA的是(A) 液体等温蒸发(B) 气体绝热可逆膨胀(C) 理想气体在等温下混合(D) 等温等压下的化学反应17、在绝热恒容的系统中,H2和Cl2反应化合成HCl。
高等工程热力学总复习题

高等工程热力学总复习题高等工程热力学总复习题高等工程热力学总复习题一、简答题1. 与外界只有一种功量交换的单相简单系统的状态参数都可以两个独立的状态参数确定是否正确?答:不正确,对简单可压缩系统的物理变化过程,确定系统平衡状态的独立状态参数只需两个。
但是对于化学反应的物系,不仅存在热与力两种不平衡势差,而且存在驱动化学反应的化学势差,并使参与反应的物质成分或者浓度发生变化,故确定其平衡状态往往需要两个以上的独立参数。
2. 阐述膨胀功、技术功、轴功与推动功之间的联系与区别?答:膨胀功:气体容积变化所引起的能量的变化;技术功:工程中可以直接利用的那部分能量,包括动能、势能和轴功。
轴功:通过进出口截面以外的边界所传递的功;推进功:在进出口截面上,为推动工质出入系统所传递的功量;稳定流动中,工质受热膨胀而得到的膨胀功一部分用于补偿系统输出的净推动功,一部分用于增加流动工质的流动动能及重力势能,其余部分作为开口系统的轴功输出。
即:膨胀功=技术功+推动功,技术功=轴功+动能+势能。
3. 刚性容器绝热放气,试证明过程中容器内发生的是可逆绝式,所以整个放气过程是可逆的。
在这一放气过程中,可以假象成又一个活塞把剩余气体与放出的气体分割开来进行的,但并不表示容积的总熵不变,因为有质量的流出,不是孤立系统,所以容积内的总熵是减少的。
如果把所有气体以及外界看做是一个系统,考虑放出的气体在容积外的不可逆膨胀过程,所以系统的总熵是增加的。
如果把剩余气体和放出的气体看做是一个整体,则系统是孤立系统,又因为是可逆绝热过程,系统的总熵是不变的。
所以这一过程与熵增原理不违背。
4. 稳定气流对刚性容器绝热充气是可逆过程吗?若不是不可逆损失如何计算?答:不是可逆过程。
存在不可逆损失,熵产ΔSg>0。
取此刚性绝热容器为系统,绝热过程,所以熵流ΔSf=0,故ΔS=ΔSf+ΔSg=ΔSg,所以ΔSg=∫12Cv·dT/T +R·lnV2/V1,又V1=V2,所以ΔSg=Cv·lnT2/T1。
工程热力学复习题

工程热力学复习题一、填空题1.实现热能和机械能相互转化的工作物质就叫做工质。
2.热能动力装置的工作过程,概括起来就是从高温热源吸取热能,将其中一部分转化为机械能,并把余下的一部分传给低温热源的过程。
3.热力系统与外界间的相互作用一般说有三种,即系统与外界间的热量交换、功交换和物质交换。
4.按系统与外界进行物质交换的情况,热力系统可分为闭口系统和开口系统两类。
5.状态参数的变化量等于初、终两状态下该物理量的差值,而与工质的状态变化途径无关。
6.决定简单可压缩系统状态的独立状态参数的数目只需两个。
7.1mmHg= 133.3Pa;1mmH20 9.81Pa。
8.气压计读数为750mmHg,绝对压力为2.5x105Pa的表压力为0.15MPa。
9.用U形管差压计测量凝汽器的压力,采用水银作测量液体,测得水银柱高为720.6mm。
已知当时当地大气压力Pb=750mmHg,则凝汽器内蒸汽的绝对压力为0.19593MPa。
10.一个可逆过程必须是准平衡过程,而且在过程中没有任何形式的能量耗散。
11.只有平衡状态才能用参数坐标图上的点表示,只有准平衡过程才能用参数坐标图上的连续实线表示。
12.热量和功都是系统与外界能量传递的度量,它们不是状态参数而是过程量。
13.工质作膨胀功时w > 0,工质受到压缩时w < 0,功的大小决定于工质的初、终状态以及过程的变化路径14.系统的总储存能包括热力学能、宏观动能和重力位能三部分。
15.热力学能包括内动能和内位能两部分,理想气体的热力学能是温度的单值函数。
16.空气经一热力过程后热力学能增加67kJ,并消耗外功1257kJ,则此过程为放热过程。
(填吸热或放热)17.开口系统稳定流动的能量方程式是(1kg工质)q=(h2-h1)+1/2(c22-c12)+g(z2-z1)+ws,它适用于稳定流动的任何过程。
18.焓的定义式为h=u+pv,其物理意义是工质在流动状态下所具有的总能量中与热力状态有关的那部分能量。
第1章化学热力学基础复习题

化学热力学基础复习题一、是非题下列各题的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”1 在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )1答:⨯2 25℃时H2(g)的标准摩尔燃烧焓在量值上等于25℃时H2O(g)的标准摩尔生成焓。
()2答: √p423 稳定态单质的∆f H m (800K)=0 。
( )3答: √4 d U=nC v,m d T公式对一定量的理想气体的任何pVT过程都适用。
( )4答: √p325 系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。
()5答:√6 若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。
()6答: √7 隔离系统的热力学能是守恒的。
()7答:√8隔离系统的熵是守恒的。
()8答:⨯9 一定量理想气体的熵只是温度的函数。
()9答:⨯10 绝热过程都是定熵过程。
()10答:⨯11 一个系统从始态到终态,只有进行可逆过程才有熵变。
()11答:⨯12 系统从同一始态出发,经绝热不可逆过程到达的终态,若经绝热可逆过程,则一定达不到此终态。
()12答: √13 热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。
()13答:⨯p5114 系统经历一个不可逆循环过程,其熵变> 0。
()14答:⨯p5115 系统由状态1经定温、定压过程变化到状态2,非体积功W’<0,且有W’>∆G和∆G <0,则此状态变化一定能发生。
()15答: √16 绝热不可逆膨胀过程中∆S >0,则其相反的过程即绝热不可逆压缩过程中∆S <0。
()16答:⨯17 临界温度是气体加压液化所允许的最高温度。
( )17答:√18 化学势是一广度量。
()18 答: ⨯19 只有广度性质才有偏摩尔量。
( )19答: √20 ),(,,B B C C n V S n U ≠⎪⎪⎭⎫ ⎝⎛∂∂ 是偏摩尔热力学能,不是化学势。
第二章 热力学第一定律(总复习题)

工程热力学复习题

工程热力学复习题一、判断题1.多变过程的指数1<n<k时,多变比热为负值。
2. 闭口系统经历了一个可逆的定温过程,由于系统温度没有发生变化,故系统与外界没有交换热量。
3. 系统的平衡状态是指系统在无外界影响的条件下(不考虑外力场作用),宏观热力性质不随时间而变化的状态。
4.凡符合热力学第一定律的过程就一定能实现。
5.热力学温标的基准点是一个标准大气压下水的冰点。
6. 通过叶轮输入轴功对绝热刚性容器内的气体进行搅拌,其参数变化为:△U >0、△T >0、△P >0、△S >0。
7. 可以从终态回复到初态的热力过程是可逆过程。
8. 理想气体经绝热节流后,前后稳定截面上的温度相等。
9. 因为伴随压力升高,工质的饱和温度也升高,故工质干饱和蒸汽的比容将增大。
10. 阴雨天中由于大气中水蒸汽量增加了,所以大气压力增大了。
11. 任何不可逆过程工质的熵总是增加的,而任何可逆过程工质的熵总是不变的。
12. 工作在相同热源和在相同冷源之间的一切热机,无论采用什么工质,他们的热效率均相等。
13. 容器中气体的压力不变,压力表的读数也一定不变。
14. 处于平衡状态的热力系,各处应具有均匀一致的温度、压力和比体积。
15. 孤立系统的熵增原理表明:过程进行的结果是孤立系统内各部分的熵都是增加的。
16. 工质经历一可逆循环,其∮d s =0,而工质经历一不可逆循环,其∮d s>0。
17. 孤立系统达到平衡时总熵达极大值。
18. 不可逆绝热稳态流动系统中,系统的熵的变化△S sys = 0。
19. 卡诺循环的热效率仅取决于其热源和冷源的温度,而与工质的性质无关。
20. 混合气体中容积成份较大的组分,则其摩尔成分也较大。
21. 孤立系统的熵与能量都是守恒的。
22. 对未饱和湿空气喷湿球温度的水可以实现空气的等焓加湿降温过程。
23.同一地区同一季节大气压力基本保持不变,空气的含湿量雨天比晴天大,所以雨天空气的密度比晴天空气的密度大。
化工热力学复习题(附答案)

化工热力学复习题一、选择题1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( C )A. 饱和蒸汽 超临界流体 过热蒸汽2. 纯物质的第二virial 系数B ( A )A 仅是T 的函数B 是T 和P 的函数C 是T 和V 的函数D 是任何两强度性质的函数3. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( B ) A. 1x y z Z Z x x y y ⎛⎫⎛⎫∂∂∂⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ B. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ C. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫= ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ D. 1y Z x Z y y x x Z ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭4. 关于偏离函数M R ,理想性质M *,下列公式正确的是( C )A. *R M M M =+B. *2R M M M =-C. *R M M M =-D. *R M M M =+5. 下面的说法中不正确的是 ( B )(A )纯物质无偏摩尔量 。
(B )任何偏摩尔性质都是T ,P 的函数。
(C )偏摩尔性质是强度性质。
(D )强度性质无偏摩尔量 。
6. 关于逸度的下列说法中不正确的是 ( D )(A )逸度可称为“校正压力” 。
(B )逸度可称为“有效压力” 。
(C )逸度表达了真实气体对理想气体的偏差 。
(D )逸度可代替压力,使真实气体的状态方程变为fv=nRT 。
(E )逸度就是物质从系统中逃逸趋势的量度。
7. 二元溶液,T, P 一定时,Gibbs —Duhem 方程的正确形式是 ( C ). a. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 2 = 0 b. X 1dlnγ1/dX 2+ X 2 dlnγ2/dX 1 = 0 c. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 1 = 0 d. X 1dlnγ1/dX 1– X 2 dlnγ2/dX 1 = 08. 关于化学势的下列说法中不正确的是( A )A. 系统的偏摩尔量就是化学势B. 化学势是系统的强度性质C. 系统中的任一物质都有化学势D. 化学势大小决定物质迁移的方向9.关于活度和活度系数的下列说法中不正确的是 ( E )(A )活度是相对逸度,校正浓度,有效浓度;(B) 理想溶液活度等于其浓度。
热力学第二定律复习题

热力学第二定律(r δ/0Q T =∑)→熵函数引出 0< (不可能发生的过程) 0= (可逆过程)0>(自发、不可逆过程)S ∆环)I R ηη≤ 不等式:)0A B iA BS →→∆≥函数G 和Helmholtz 函数A 的目的A U TS ≡-,G H TS ≡-d d d d d d d d T S p VT S V p S T p V S T V p -+---+ W ' =0,组成恒定封闭系统的 可逆和不可逆过程。
但积分时要用可逆途径的V ~p 或T ~S 间 的函数关系。
应用条件: V )S =-(∂p /∂S )V , (∂T /∂p )S =(∂V /∂S )pV )T =(∂p /∂T )V , (∂S /∂p )T =-(∂V /∂T )p应用:用易于测量的量表示不能直接测量的量,常用于热力学关系式的推导和证明<0 (自发过程) =0 (平衡(可逆)过程)判据△A T ,V ,W ’=0判据△G T ,p ,W ’=0<0 (自发过程) =0 (平衡(可逆)过程)基本计算公式/()/rS Q T dU W Tδδ∆==-⎰⎰, △S环=-Q体/T环△A=△U-△(TS) ,d A=-S d T-p d V△G=△H-△(TS) ,d G=-S d T-V d p不同变化过程△S、△A、△G 的计算简单pVT变化(常压下)凝聚相及实际气体恒温:△S =-Q r/T;△A T≈0 ,△G T≈V△p≈0(仅对凝聚相)△A=△U-△(TS),△G=△H-△(TS); △A≈△G恒压变温21,(/)Tp mTS nC T dT∆=⎰nC p,m ln(T2/T1)C p,m=常数恒容变温21,(/)TV mTS nC T dT∆=⎰nC V,m ln(T2/T1)C V,m=常数△A=△U-△(TS),△G=△H-△(TS); △A≈△G理想气体△A、△G的计算恒温:△A T=△G T=nRT ln(p2/p1)=- nRT ln(V2/V1)变温:△A=△U-△(TS),△G=△H-△(TS)计算△S△S=nC V,m ln(T2/T1)+nR ln(V2/V1)= nC p,m ln(T2/T1)-nR ln(p2/p1)= nC V,m ln(p2/p1)+ nC p,m ln(V2/V1)纯物质两相平衡时T~p关系g↔l或s两相平衡时T~p关系任意两相平衡T~p关系:m md/d/p T T V Hββαα=∆∆(Clapeyron方程)微分式:vap m2d lndHpT RT∆=(C-C方程)定积分式:ln(p2/p1)=-△vap H m/R(1/T2-1/T1)不定积分式:ln p=-△vap H m/RT+C恒压相变化不可逆:设计始、末态相同的可逆过程计S=△H/T;△G=0;△A≈0(凝聚态间相变)=-△n(g)RT (g↔l或s)化学变化标准摩尔生成Gibbs函数r m,BG∆定义r m B m,BBS Sν∆=∑,r m B f m,BBH Hν∆=∆∑,r m r m r mG H T S∆=∆-∆或r m B f m,BG Gν∆=∆∑G-H方程(∂△G/∂T)p=(△G-△H)/T或[∂(△G/T)/∂T]p=-△H/T2(∂△A/∂T)V=(△A-△U)/T或[∂(△A/T)/∂T]V=-△U/T2积分式:2r m0()//ln1/21/6G T T H T IR a T bT cT∆=∆+-∆-∆-∆应用:利用G-H方程的积分式,可通过已知T1时的△G(T1)或△A(T1)求T2时的△G(T2)或△A(T2)微分式热力学第三定律及其物理意义规定熵、标准摩尔熵定义任一物质标准摩尔熵的计算一、选择题1. 体系经历一个正的卡诺循环后,试判断下列哪一种说法是错误的? (a ) 体系本身没有任何变化(b ) 再沿反方向经历一个可逆的卡诺循环,最后体系和环境都没有任何变化 (c ) 体系复原了,但环境并未复原 (d ) 体系和环境都没有任何变化(答案) d (什么叫卡诺循环?以理想气体为工作物质,从高温(T h )热源吸收(Q h )的热量,一部分通过理想热机用来对外做功(Wr )另一部分(Qc)的热量放给低温(Tc)热源。
大学物理气体动理论热力学基础复习题及答案详解

第12章 气体动理论一、填空题:1、一打足气的自行车内胎,若在7℃时轮胎中空气压强为×510pa .则在温度变为37℃,轮胎内空气的压强是 ;设内胎容积不变2、在湖面下50.0m 深处温度为4.0℃,有一个体积为531.010m -⨯的空气泡升到水面上来,若湖面的温度为17.0℃,则气泡到达湖面的体积是 ;取大气压强为50 1.01310p pa =⨯3、一容器内储有氧气,其压强为50 1.0110p pa =⨯,温度为27.0℃,则气体分子的数密度为 ;氧气的密度为 ;分子的平均平动动能为 ;分子间的平均距离为 ;设分子均匀等距排列4、星际空间温度可达,则氢分子的平均速率为 ,方均根速率为 ,最概然速率为 ;5、在压强为51.0110pa ⨯下,氮气分子的平均自由程为66.010cm -⨯,当温度不变时,压强为 ,则其平均自由程为1.0mm;6、若氖气分子的有效直径为82.5910cm -⨯,则在温度为600k,压强为21.3310pa ⨯时,氖分子1s 内的平均碰撞次数为 ;7、如图12-1所示两条曲线1和2,分别定性的表示一定量的某种理想气体不同温度下的速率分布曲线,对应温度高的曲线 是 .若图中两条曲线定性的表示相同温度下的氢气和氧气的速率分布曲线,则表示氧气速率分布曲线的是 .8、试说明下列各量的物理物理意义: 112kT , 232kT , 32i kT , 42i RT , 532RT , 62M i RT Mmol ; 参考答案:1、54.4310pa ⨯ 2、536.1110m -⨯ 3、25332192.4410 1.30 6.2110 3.4510m kg m J m ----⨯⋅⨯⨯ 4、2121121.6910 1.8310 1.5010m sm s m s ---⨯⋅⨯⋅⨯⋅ 图12-15、6.06pa6、613.8110s -⨯ 7、2 ,28、略二、选择题:教材习题12-1,12-2,12-3,12-4. 见课本p207~208参考答案:12-1~12-4 C, C, B, B. 第十三章热力学基础一、选择题1、有两个相同的容器,容积不变,一个盛有氦气,另一个盛有氢气均可看成刚性分子它们的压强和温度都相等,现将 5 J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氦气传递的热量是A 6 JB 5 JC 3 JD 2 J2、一定量理想气体,经历某过程后,它的温度升高了,则根据热力学定理可以断定:1该理想气体系统在此过程中作了功;2在此过程中外界对该理想气体系统作了正功;3该理想气体系统的内能增加了;4在此过程中理想气体系统既从外界吸了热,又对外作了正功;以上正确的是:A 1,3B 2,3C 3D 3,43、摩尔数相等的三种理想气体H e 、N 2和CO 2,若从同一初态,经等压加热,且在加热过程中三种气体吸收的热量相等,则体积增量最大的气体是:AH e BN 2CCO 2 D 三种气体的体积增量相同4、如图所示,一定量理想气体从体积为V 1膨胀到V 2,AB,AC为等温过程AD 为绝热过程;则吸热最多的是: A AB 过程 B AC 过程 C AD 过程 D 不能确定 5、卡诺热机的循环曲线所包围的面积从图中abcda 增大为ab’c’da ,那么循环abcda 与ab’c’da 所作的净功和热机效率的变化情况是:A 净功增大,效率提高;B 净功增大,效率降低;C 净功和效率都不变;D 净功增大,效率不变;6、根据热力学第二定律判断下列哪种说法是正确的是:A 热量能从高温物体传到低温物体,但不能从低温物体传到高温物体;B 功可以全部变为热,但热不能全部变为功;C 气体能够自由膨胀,但不能自由压缩;D 有规则运动的能量能够变为无规则运动的能量,但无规则运动的能量不能够变为有规则运动的能量;7、 理想气体向真空作绝热膨胀A 膨胀后,温度不变,压强减小.VB 膨胀后,温度降低,压强减小.C 膨胀后,温度升高,压强减小.D 膨胀后,温度不变,压强不变.8、1mol 的单原子分子理想气体从状态A 变为状态B ,如果不知是什么气体,变化过程也不知道,但A 、B两态的压强、体积和温度都知道,则可求出:A 气体所作的功.B 气体内能的变化.C 气体传给外界的热量.D 气体的质量.9、 有人设计一台卡诺热机可逆的.每循环一次可从 400 K 的高温热源吸热1800 J,向 300 K 的低温热源放热 800 J .同时对外作功1000 J,这样的设计是A 可以的,符合热力学第一定律.B 可以的,符合热力学第二定律.C 不行的,卡诺循环所作的功不能大于向低温热源放出的热量.D 不行的,这个热机的效率超过理论值.10、 一绝热容器被隔板分成两半,一半是真空,另一半是理想气体.若把隔板抽出,气体将进行自由膨胀,达到平衡后A 温度不变,熵增加.B 温度升高,熵增加.C 温度降低,熵增加.D 温度不变,熵不变.二、 填充题1、要使一热力学系统的内能变化,可以通过 或 两种方式,或者两种方式兼用来完成;热力学系统的状态发生变化时,其内能的改变量只决定于 ,而与 无关;2、将热量Q 传给一定质量的理想气体;1若体积不变,热量转化为 ;2若温度不变,热量转化为 ;3、卡诺循环是由两个 过程和两个 过程组成的循环过程;卡诺循环的效率只与 有关,卡诺循环的效率总是 大于、小于、等于1;4、一定量理想气体沿a →b →c 变化时作功abc W =615J,气体在b 、c 两状态的内能差J E E c b 500=-;那么气体循环一周,所作净功=WJ ,向外界放热为=Q J ,等温过程中气体作功=ab WJ ;5、常温常压下,一定量的某种理想气体可视为刚性双原子分子,在等压过程中吸热为Q,对外作功为W,内能增加为E ∆,则W Q =_ _,E Q∆=_________; 6、p V -图上封闭曲线所包围的面积表示 物理量,若循环过程为逆时针方向,则该物理量为 ;填正或负7、一卡诺热机低温热源的温度为27C,效率为40% ,高温热源的温度T 1 = .8、设一台电冰箱的工作循环为卡诺循环,在夏天工作,环境温度在35C,冰箱内的温度为0C,这台电冰箱的理想制冷系数为e = .9、一循环过程如图所示,该气体在循环过程中吸热和放热的情ab coVT况是a →b 过程 ,b →c 过程 ,c →a 过程 ;10、将1kg 温度为010C 的水置于020C 的恒温热源内,最后水的温度与热源的温度相同,则水的熵变为 ,热源的熵变为 ;水的比热容为34.1810ln1.03530.035J kg K ⨯⋅=,参考答案:一、1、C 2、C 3、A 4、A 5、D6、C7、A8、B9、D 10、A二、1、作功,传热,始末状态,过程 2、理想气体的内能,对外作功 3、绝热,等温, 4、115J ,500J ,615J 5、27,576、功,负7、 500K8、9、吸热,放热,吸热 10、11146.3,142.7J K J K --⋅-⋅自测题5一、选择题1、一定量某理想气体按2pV =恒量的规律膨胀,则膨胀后理想气体的温度 A 将升高 B 将降低 C 不变 D 不能确定;2、若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为 A pV m B ()pV kT C ()pV RT D ()pV mT3、如题5.1.1图所示,两个大小不同的容器用均匀的细管相连,管中有一水银作活塞,大容器装有氧气,小容器装有氢气,当温度相同时,水银滴静止于细管中央,试问此时这两种气体的密度哪个大 A 氧气的密度大; B 氢气的密度大; C 密度一样大; D 无法判断;4、若室内生起炉子后温度从015C 升高到027C ,而室内气压不变,则此时室内的分子数减少了A 0.5%B 4%C 9%D 21%5、一定量的理想气体,在容积不变的条件下,当温度升高时,分子的平均碰撞次数Z 和平均自由程λ的变化情况是 A Z 增大,λ不变; B Z 不变,λ增大; C Z 和λ都增大; D Z 和λ都不变;6、一定量的理想气体,从a 态出发经过①或②过程到达b 态,acb 为等温线如题5.1.2图所示,则①,②两过程中外界对系统传递的热量12,Q Q 是A 120,0Q Q >> B 120,0Q Q << C 120,0Q Q >< D 120,0Q Q <>7、如题5.1.3图,一定量的理想气体经历acb 过程时吸热200J ;则经历acbda 过程时,吸热为 A 1200J - B 1000J - C 700J - D 1000J8、一定量的理想气体,分别进行如题5.1.4图所示的两个卡诺循环abcda 和a b c d a ''''';若在P V -图上这两个循环曲线所围面积相等,则可以由此得知这两个循环 A 效率相等; B 由高温热源处吸收的热量相等;C 在低温热源处放出的热量相等;D 在每次循环中对外做的净功相等;9、“理想气体和单一热源接触作等温膨胀时,吸收的热量全部用来对外做功;”对此说法,有如下几种评论,哪种是正确的A 不违反热力学第一定律,但违反热力学第二定律;B 不违反热力学第二定律,但违反热力学第一定律;C 不违反热力学第一定律,也不违反热力学第二定律;D 违反热力学第一定律,也违反热力学第二定律;10、一定量的理想气体向真空作绝热自由膨胀,体积由1V 增至2V ,在此过程中气体的A 内能不变,熵增加;B 内能不变,熵减少;C 内能不变,熵不变;D 内能增加,熵增加;二、填空题:1、在推导理想气体压强公式中,体现统计意义的两条假设是1 ;2 ;2、在定压下加热一定量的理想气体;若使其温度升高1K 时,它的体积增加了倍,则气体原来的温度是 ;3、在相同的温度和压强下,各为单位体积的氢气视为刚性双原子分子气体与氦气的内能之比为 ;4、分子物理学是研究 的学科,它应用的基本方法是 方法;①②题5.1.2图 1 41 4 题5.1.3图o 题5.1.4图5、解释名词:自由度 ;准静态过程 ;6、用总分子数N ,气体分子速率v 和速率分布函数()f v 表示下列各量:1速率大于0v 的分子数= ;2速率大于0v 的那些分子的平均速率= ;3多次观察某一分子的速率,发现其速率大于0v 的概率= ;7、常温常压下,一定量的某种理想气体可视为刚性分子、自由度为i ,在等压过程中吸热为Q ,对外做功为A ,内能增加为E ∆,则A Q = ;8、有一卡诺热机,用29kg 空气为工作物质,工作在027C 的高温热源与073C -的低温热源之间,此热机的效率η= ;若在等温膨胀过程中气缸体积增大倍,则此热机每一循环所做的功为 ;空气的摩尔质量为312910kg mol--⨯⋅ 自测题5参考答案一、选择题1、B2、B3、A4、B5、A6、A7、B8、D9、C 10、A二、填空题1、1沿空间各方向运动的分子数目相等; 2222x y z v v v ==;2、200K3、53;1034、物质热现象和热运动规律; 统计;5、确定一个物体在空间的位置所需要的独立坐标的数目;系统所经历的所有中间状态都无限接近于平衡状态的过程;6、0000()()/()()v v v v Nf v dv vf v dv f v dv f v dv ∝∝∝∝⎰⎰⎰⎰ 7、2;22i i i ++ 8、533.3%;8.3110J ⨯;另外添加的题目:一、选择题:1、双原子理想气体,做等压膨胀,若气体膨胀过程从热源吸收热量J 700,则该气体对外做功为 DA J 350B J 300C J 250D J 2002、在V P -图图1中,mol 1理想气体从状态A 沿直线到达B ,B A V V =2,则此过程系统的功能和内能变化的情况为 CA 0,0>∆>E AB 0,0<∆<E AC 0,0=∆>E AD 0,0>∆<E A3、某理想气体分别经历如图2所示的两个卡诺循环:)(abcd I 和)(d c b a ''''I I ,且两条循环曲线所围面积相等;设循环I 的效率为η,每次循环在高温热源处吸收的热量为Q ,循环II 的效率为η',每次循环在高温Q ',则BA Q Q '<'<,ηη;B Q Q '>'<,ηη;C Q Q '<'>,ηη;D Q Q '>'>,ηη4、一热机在两热源12400,300T K T K ==之间工作,一循环过程吸收1800J ,放热800J ,作功1000J ,此循环可能实现吗 BA 可能;B 不可能;C 无法判断;5、有两个相同的容器,容积不变,一个盛有氦气,另一个盛有氢气均可看成刚性分子它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高相同的温度,则应向氦气传递的热量是CA 6JB 5JC 3JD 2J6、一定量理想气体,经历某过程后,它的温度升高了,则根据热力学定理可以断定:1该理想气体系统在此过程中作了功;2在此过程中外界对该理想气体系统作了功;3该理想气体系统的内能增加了;4在此过程中理想气体系统既从外界吸了热,又对外作了正功;以上正确的是 CA 1,3B 2,3C 3 D3,4 E47、对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值: DA 等容降压过程B 等温膨胀过程C 绝热膨胀过程D 等压压缩过程8、对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比/A Q 等于: DA 1/3B 1/4C 2/5D 2/79、摩尔数相等的三种理想气体e H 、2N 和2CO ,若从同一初态,经等压加热,且在加热过程中三种气体吸收的热量相等,则体积增量最大的气体是: AA e HB 2NC 2COD 三种气体的体积增量相同10、如图所示,一定量理想气体从体积为1V 膨胀到2V ,AB 为等压过程,AC 为等温过程,AD 为绝热过程,则吸热最多的是:AA AB 过程 B AC 过程 C AD 过程 D 不能确定11、根据热力学第二定律判断下列哪种说法是正确的是:CA 热量能从高温物体传到低温物体,但不能从低温物体传到高温物体;B 功可以全部变为热,但热不能全部变为功;C 气体能够自由膨胀,但不能自由压缩;D 有规则运动的能量能够变为无规则运动的能量,但无规则运动的能量不能够变为有规则运动的能量;12、汽缸内盛有一定的理想气体,当温度不变,压强增大一倍时,该分子的平均碰撞频率和平均自由程的变化情况是:C A Z 和λ都增大一倍; B Z 和λ都减为原来的一半; C Z 增大一倍而λ减为原来的一半;D Z 减为原来的一半而λ增大一倍;13、在恒定不变的压强下,气体分子的平均碰撞频率Z 与气体的热力学温度T 的关系为CA Z 与T 无关;B Z 与T 成正比;C Z 与T 成反比;D Z 与T 成正比;14、一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且都处于平衡状态,则它们: CA 温度相同、压强相同;B 温度、压强相同;C 温度相同,但氦气的压强大于氮气的压强;D 温度相同,但氦气的压强小于氮气的压强;15、已知氢气与氧气的温度相同,请判断下列说法哪个正确A 氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强;B 氧分子的质量比氢分子大,所以氧气密度一定大于氢气的密度;C 氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大;D 氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大;16、按2PV =恒量规律膨胀的理想气体,膨胀后的温度为: CA 升高;B 不变;C 降低;D 无法确定17、下列各式中哪一种式表示气体分子的平均平动动能式中M 为气体的质量,m 为气体分子的质量,N 为气体分子总数目,n 为气体分子密度,0N 为阿伏加德罗常数,mol M 为摩尔质量;A 32m PV M ;B 32mol M PV M ;C 32nPV ;D 032mol M N PV M18、一定量的理想气体可以:DA 保持压强和温度不变同时减小体积;B 保持体积和温度不变同时增大压强;C 保持体积不变同时增大压强降低温度;D 保持温度不变同时增大体积降低压强;19、设某理想气体体积为V ,压强为P ,温度为T ,每个分子的质量为μ,玻尔兹曼常数为k ,则该气体的分子总数可以表示为:C A PV k μ B PT V μ C PV kT D PT kV19、关于温度的意义,有下列几种说法:1气体的温度是分子平均平动动能的量度;2气体的温度是大量气体分子热运动的集体表现,具有统计意义;3温度的高低反映物质内部分子运动剧烈程度的不同;4从微观上看,气体的温度表示每个气体分子的冷热程度;上述说法中正确的是:BA1,2,4 B1,2,3 C2,3,4 D1,3,420、设某种气体的分子速率分布函数为()f v ,则速率在12v v →区间内的分子平均速率为:CA 21()v v vf v dv ⎰B 21()v v v vf v dv ⎰ C 2121()()v v v v vf v dv f v dv ⎰⎰ D 210()()v v vf v dv f v dv∝⎰⎰ 21、两容积不等的容器内分别盛有可视为理想气体的氦气和氮气,如果它们温度和压强相同,则两气体:CA 单位体积内的分子数必相同;B 单位体积内的质量必相同;C 单位体积内分子的平均动能必相同:D 单位体积内气体的内能必相同;22、在标准状态下,体积比为1:2的氧气和氦气均视为理想气体相混合,混合气体中氧气和氦气的内能之比为:CA 1:2B 5:3C 5:6D 10:3填空题:1、要使一热力学系统的内能增加,可以通过传热或作功两种方式,或者两种方式兼用来完成;热力学系统的状态发生变化时,其内能的改变量只决定于初末状态,而与过程无关;2、16g 氧气在400K 温度下等温压缩,气体放出的热量为1152J ,则被压缩后的气体的体积为原体积的12倍,而压强为原来压强的2倍;3、一热机从温度为727o C 的高温热源吸热,向温度为527oC 的低温热量放热,若热机在最大效率下工作,且每一循环吸热2000J ,则此热机每一循环作功为400J ;4、一卡诺热机在每次循环中都要从温度为400K 的高温热源吸热418J ,向低温热源放热334.4J ,低温热源的温度为320K ;5、汽缸内有单原子理想气体,若绝热压缩使体积减半,问气体分子的平均速率变为原来速率的 倍若为双原子理想气体又为 倍6、下面给出理想气体状态方程的几种微分形式,指出它们各表示什么过程; 1()mol PdV M M RdT =表示等压过程; 2()mol VdP M M RdT =表示等容或者等体过程;30PdV VdP +=表示等温过程;7、容积为10升的容器中储有10克的氧气;1600m s -=⋅,则此气体的温度T =462K ;压强P = 51.210⨯ Pa ;8、在室温27o C 下,1mol 氢气和1mol 氧气的内能比为1:1;1g 氢气和1g 氧气的内能比为16:19、理想气体的内能是温度的单值函数; 2i kT 表示分子的平均动能; 2i RT 表示1mol 气体分子的内能 2m i RT M 表示m 千克气体分子的内能 10、氮气在标准状态下的分子平均碰撞次数为311.310s -⨯,分子平均自由程为6610cm -⨯,若温度不变,气压降为0.1atm ,则分子平均碰撞次数变为211.310s -⨯;分子平均自由程变为5610cm -⨯。
工程热力学复习题

(×)
17. 可逆绝热过程即等熵过程;反之,等熵过程必为可逆绝热过
程。( √ )
18. 沸腾状态的水总是烫手的。
(×)
19. 容器中气体的压力不变,则压力表的读数也绝对不会改
变。 ( × )
20. 水蒸气在定温过程前后温度不变,则其热力学能也不变。
(×)
21. 对所研究的各种热力现象都可以按闭口系统、开口系统或孤
(×)
42. 湿空气的相对湿度全愈大,其中水蒸气分压力也愈大。
(√)
43. 未饱和湿空气的干球温度总大于湿球温度。
(√)
44. 两种湿空气的相对湿度相等,则吸收水蒸汽的能力也相等。
( ×)
45. 用压力表可以直接读出绝对压力值。
(×)
46. 封闭系统中发生放热过程,系统熵必减少。
(×)
47. 理想气体的、值与气体的温度有关,则它们的差值也与温度
37. 当蒸汽的温度高于饱和温度时,称该蒸汽为过热蒸汽; (
×)
38. 理想气体任意两个状态参数确定后,气体的状态就一定确定
了。( × )
39. 孤立系的热力状态不能发生变化。
(
×)
40. 活塞式压气机采用多级压缩和级间冷却方法可以提高它的容
积效率。( √ )
41. 湿空气的相对湿度盐越大,空气中水蒸气的含量就越大。
50kPa,此时,该工质的测量应选用
(填真空
计或压力表)测压计。
7. 热力系Байду номын сангаас不受外界影响的条件下,系统的状态能够始终保持
不变,这种状态称为( 平衡状态 ) ( 平衡状态还是
稳定状态 )
8. 实现可逆过程的条件是:
。
9. 一稳定流动开口系,从外界吸收热量 500J ,开口系进出口
工程热力学复习题

工程热力学复习题一、填空题1.实现热能和机械能相互转化的工作物质就叫做工质。
2.热能动力装置的工作过程,概括起来就是从高温热源吸取热能,将其中一部分转化为机械能,并把余下的一部分传给低温热源的过程。
3.热力系统与外界间的相互作用一般说有三种,即系统与外界间的热量交换、功交换和物质交换。
4.按系统与外界进行物质交换的情况,热力系统可分为闭口系统和开口系统两类。
5.状态参数的变化量等于初、终两状态下该物理量的差值,而与工质的状态变化途径无关。
6.决定简单可压缩系统状态的独立状态参数的数目只需两个。
7.1mmHg= 133.3Pa;1mmH20 9.81Pa。
8.气压计读数为750mmHg,绝对压力为2.5x105Pa的表压力为0.15MPa。
9.用U形管差压计测量凝汽器的压力,采用水银作测量液体,测得水银柱高为720.6mm。
已知当时当地大气压力Pb=750mmHg,则凝汽器内蒸汽的绝对压力为0.19593MPa。
10.一个可逆过程必须是准平衡过程,而且在过程中没有任何形式的能量耗散。
11.只有平衡状态才能用参数坐标图上的点表示,只有准平衡过程才能用参数坐标图上的连续实线表示。
12.热量和功都是系统与外界能量传递的度量,它们不是状态参数而是过程量。
13.工质作膨胀功时w > 0,工质受到压缩时w < 0,功的大小决定于工质的初、终状态以及过程的变化路径14.系统的总储存能包括热力学能、宏观动能和重力位能三部分。
15.热力学能包括内动能和内位能两部分,理想气体的热力学能是温度的单值函数。
16.空气经一热力过程后热力学能增加67kJ,并消耗外功1257kJ,则此过程为放热过程。
(填吸热或放热)17.开口系统稳定流动的能量方程式是(1kg工质)q=(h2-h1)+1/2(c22-c12)+g(z2-z1)+ws,它适用于稳定流动的任何过程。
18.焓的定义式为h=u+pv,其物理意义是工质在流动状态下所具有的总能量中与热力状态有关的那部分能量。
热力学复习题

《工程热力学》复习题汇总一填空题1.热力系统:忽略家用电热水器的表面散热,取正在加热不在使用的电热水器为控制体,(不包括电加热器),这是系统,把电加热器包括在研究对象内,这是系统,研究对象加入,构成孤立系统。
2.热力系统:盛满热水的真空保温杯是系统,内燃机在汽缸进气或排气阀门打开时,是系统。
3.过程判断:热力系统与外界在绝热但存在摩擦力的情况下,在无限小压差下缓慢的做功过程准静态过程,可逆过程。
4.过程判断:热量从温度为100℃的热源通过薄容器壁缓慢地传递给处于平衡状态下的冰水混合物,此过程准静态过程,可逆过程,理由5.通过搅拌器作功使水保持等温的汽化过程,此过程为,理由为。
6.有一刚性容器,被分成两部分,一部分装有气体,一部分抽成真空,若真空部分装有许多隔板,每抽去一块隔板,让气体先恢复平衡再抽去下一块,问此过程为,理由为。
7.闭口系统热力学第一定律表达式:,稳流开口系统的热力学第一定律表达式为:;开口系统工质跟外界交换的技术功包括,可逆过程技术功的计算式为:;8 闭口容器内的气体从热源吸收了100kJ的热量,并对外膨胀作功消耗了40kJ,其中克服摩擦功5kJ,假设摩擦产生的耗散热全部用于增加工质的热力学能,根据闭口系统能量守恒方程式,系统热力学能增加量为。
9.理想气体是,工程上常用的空气、燃气和烟气理想气体,水蒸气理想气体。
10.一种确定的理想气体,其c p-c v定值,c p/c v定值,c p/c v随变化,其中c p-c v的含义是;工程上常用的空气、燃气理想气体,水蒸气理想气体。
11.过冷水的定压汽化过程在p-v图上可表示出五种状态,分别为:。
12.实际气体与理想气体的偏离可用压缩因子Z表示,理想气体的Z等于,实际气体的Z随压力的增高,呈现的变化。
13.气体在管道内绝热流动,其滞止状态是指,此时的焓h= ;临界压力与有关,0工临界流速临界声速。
14.活塞式压缩机中,因的存在,使产气量降低,但理论上对单位质量气体耗功影响。
热力学题目复习

2、如果一个人在静止状态下向环境散热率为400kJ/h。假设本教室中有60人在上课,教室全封闭,使用空调系统维持室内恒温。现在空调突然发生故障,求:1)故障后20分钟,教室中空气的热力学能增加量。2)假定教室和环境无热量交换,将教室和所有的人取为热力系,该系统热力学能变化多少?应如何解释教室中空气温度的升高?
1、某职工浴室准备采用太阳能热水器提供50°的热水,已知工人下班的半小时内共需要热水2m³,每台热水器的集热板面积为8㎡,每㎡集热面积可以提供1000kJ的热量给热水,用来把20°的水加热到所需的50°,问需要多少台热水器?(50度水的比体积为0.001m³/kg,水的比热4.187kJ/kg.K)
5、压力为15bar,容积为0.2634 m³的干饱和蒸汽,若对其压缩使容积变为初始的一半,求1)定温压缩过程的终态参数;2)按PV=定值计算会得到什么样的结果?
已知t1=400℃, p1=50bar的蒸汽进入汽轮机绝热膨胀至p2=0.04bar。设环境温度t0=20℃,求:1)若过程是可逆的,1kg蒸汽所做的膨胀功及技术功各为多少?2)若汽轮机的相对效率为0.88,求其做功能力损失为多少?
3、某登山运动员携带一只气压计,在出发地测得大气压力为95kpa,在登山过程中,他连续测得另外三个读数,分别为88.4kpa,83.6kpa,78.7kpa,若大气平均密度为1.2kg/M3,重力加速度g=9.81m/s2保持不变,请确定取三个气压值时对应的高度分别是多少?
热力学第二定律复习题
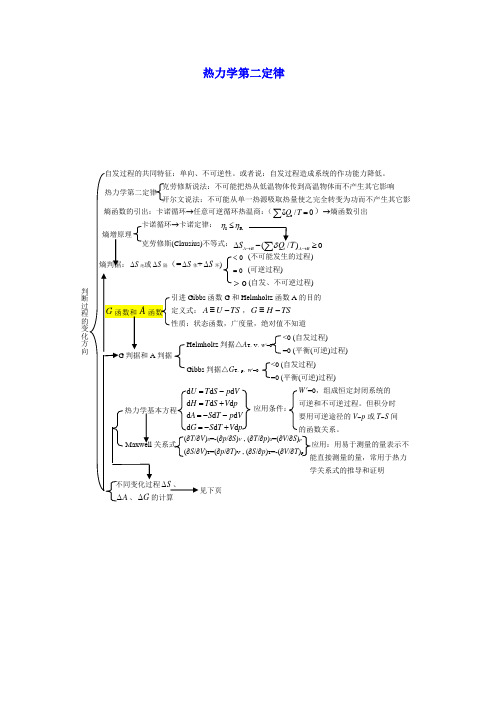
热力学第二定律(r δ/0Q T =∑)→熵函数引出 0< (不可能发生的过程) 0= (可逆过程)0>(自发、不可逆过程)S ∆环)I R ηη≤ 不等式:)0A B iA BS →→∆≥函数G 和Helmholtz 函数A 的目的A U TS ≡-,G H TS ≡-d d d d d d d d T S p VT S V p S T p V S T V p -+---+ W ' =0,组成恒定封闭系统的 可逆和不可逆过程。
但积分时要用可逆途径的V ~p 或T ~S 间 的函数关系。
应用条件: V )S =-(∂p /∂S )V , (∂T /∂p )S =(∂V /∂S )pV )T =(∂p /∂T )V , (∂S /∂p )T =-(∂V /∂T )p应用:用易于测量的量表示不能直接测量的量,常用于热力学关系式的推导和证明<0 (自发过程) =0 (平衡(可逆)过程)判据△A T ,V ,W ’=0判据△G T ,p ,W ’=0<0 (自发过程) =0 (平衡(可逆)过程)基本计算公式/()/rS Q T dU W Tδδ∆==-⎰⎰, △S环=-Q体/T环△A=△U-△(TS) ,d A=-S d T-p d V△G=△H-△(TS) ,d G=-S d T-V d p不同变化过程△S、△A、△G 的计算简单pVT变化(常压下)凝聚相及实际气体恒温:△S =-Q r/T;△A T≈0 ,△G T≈V△p≈0(仅对凝聚相)△A=△U-△(TS),△G=△H-△(TS); △A≈△G恒压变温21,(/)Tp mTS nC T dT∆=⎰nC p,m ln(T2/T1)C p,m=常数恒容变温21,(/)TV mTS nC T dT∆=⎰nC V,m ln(T2/T1)C V,m=常数△A=△U-△(TS),△G=△H-△(TS); △A≈△G理想气体△A、△G的计算恒温:△A T=△G T=nRT ln(p2/p1)=- nRT ln(V2/V1)变温:△A=△U-△(TS),△G=△H-△(TS)计算△S△S=nC V ,m ln(T2/T1)+nR ln(V2/V1)= nC p,m ln(T2/T1)-nR ln(p2/p1)= nC V,m ln(p2/p1)+ nC p,m ln(V2/V1)纯物质两相平衡时T~p关系g↔l或s两相平衡时T~p关系任意两相平衡T~p关系:m md/d /p T T V Hββαα=∆∆(Clapeyron方程)微分式:vap m2d lndHpT RT∆=(C-C方程)定积分式:ln(p2/p1)=-△vap H m/R(1/T2-1/T1)不定积分式:ln p=-△vap H m/RT+C恒压相变化不可逆:设计始、末态相同的可逆过程计S=△H/T;△G=0;△A≈0(凝聚态间相变)=-△n(g)RT (g↔l或s)化学变化标准摩尔生成Gibbs函数r m,BG∆定义r m B m,BBS Sν∆=∑,r m B f m,BBH Hν∆=∆∑,r m r m r mG H T S∆=∆-∆或r m B f m,BG Gν∆=∆∑G-H方程(∂△G/∂T)p=(△G-△H)/T或[∂(△G/T)/∂T]p=-△H/T2(∂△A/∂T)V=(△A-△U)/T或[∂(△A/T)/∂T]V=-△U/T2积分式:2r m0()//ln1/21/6G T T H T IR a T bT cT∆=∆+-∆-∆-∆应用:利用G-H方程的积分式,可通过已知T1时的△G(T1)或△A(T1)求T2时的△G(T2)或△A(T2)微分式热力学第三定律及其物理意义规定熵、标准摩尔熵定义任一物质标准摩尔熵的计算一、选择题1. 体系经历一个正的卡诺循环后,试判断下列哪一种说法是错误的? (a ) 体系本身没有任何变化(b ) 再沿反方向经历一个可逆的卡诺循环,最后体系和环境都没有任何变化 (c ) 体系复原了,但环境并未复原 (d ) 体系和环境都没有任何变化(答案) d (什么叫卡诺循环?以理想气体为工作物质,从高温(T h )热源吸收(Q h )的热量,一部分通过理想热机用来对外做功(Wr )另一部分(Qc )的热量放给低温(Tc)热源.这种循环称为卡诺循环。
热力学复习题

1、当过程不可逆时, 孤立系统的△S 总 > 0, 工质的△S 产生 > 0。
损失功WL > 0。
经历一个不可逆热机的循环过程,体系工质的熵 C 。
A 、增大B 、减小C 、不变D 、可能增大,也可能减小2、空气在封闭的气缸内经历一过程,相应其内能增加15kJ ,对外界作功15kJ ,则此过程中工质与外界交换热量Q= 30 kJ 。
3、流体把2000KJ 的热量传给周围温度为27℃的环境,如果流体的熵变为-5KJ/K ,这整个过程 b 。
a .可能发生且可逆; b. 可能发生但不可逆; c. 不可能发生。
4、系统从某一初态经不可逆与可逆两条途径膨胀到达同一终态,则工质 c 。
a .△S 可>△S 不 b. △S 可<△S 不 c. △S 可=△S 不 d.三者都可能。
5、某流体在稳流装置内经历一个可逆过程,对外做功为30,得到的热量为100。
试问流体的熵变:( A ) A. 为正; B. 为负; C. 可正、可负。
6、稳流过程能量平衡式:( C )A. 仅适用于稳流可逆过程B. 仅适用于稳流不可逆过程;C. 该稳流过程可逆、不可逆均可。
7、体系经一绝热可逆过程熵值不变。
√8、系统向环境放出热量,温度下降,因此熵产生小于零。
×9、Wid 具有状态函数的特点,而普通的Ws 则是过程函数。
√10、自然界一切实际过程的熵产生必大于零。
√11、分别以某一真实气体和理想气体为工质在两个恒温热源T1、T2之间进行卡诺理想循环,试比较这两个循环的热效率。
BA 、前者大于后者B 、两者相等C 、前者小于后者D 、没法比较。
12、i<1的体系的恒沸点为最高温度恒沸点。
√13、二元完全理想体系中i 组份的汽液平衡比Ki=Pis/P 。
√14、汽液平衡数据热力学一致性检验的理论依据是Wilson 方程。
×15、等温条件下,二元体系中超额自由焓函数与组分i 的活度系数的关系为(1122ln ln EG x x RTγγ=+) 活度系数的因次是(无因次) 16、形成共沸物的溶液,由于在共沸点处(i i x y =),所以不能用简单精馏方法同时获得两纯组分。
第二章热力学第一定律复习题(最新整理)

热力学第一定律一、选择题1、有理想气体,温度由T 1变到T 2,压力由P 1变到P 2,则:( )a.;b.;T nC Hm p ∆=∆,T nC Q m p ∆=,c.;d.T nC Q m V ∆=,TnC T nC W m V m p ∆-∆=,,2、,式中W 代表:( )W Q U +=∆a.体积功; b.非体积功c.体积功和非体积功的和;d.体积功和非体积功的差。
3、对W 的规定是:( )a.环境对体系做功W 为正;b. 环境对体系做功W 为负c. 体系对环境做功W 为正;d. W 总为正4、焓的定义式是:( )a.; b. pV U H +=∆pV U H -=c. ;d. pV U H +=pV U H ∆+∆=∆5、反应 H 2(g) + 1/2O 2(g) = H 2O(l) 的 是:( )θm r H ∆a.H 2O(l)的标准生成焓; b.H 2(g)的标准燃烧焓;c.既是H 2O(l)的标准生成焓又是H 2(g)的标准燃烧焓;d.以上三种说法都对。
6、理想气体的 ( ),,/p m V m C C a.大于1; b.小于1;c.等于1;d.以上三者皆有可能。
7、某化学反应的,该化学反应的反应热:( )0=∆p r C a.不随温度而变; b.随温度升高而增大; c.随温度升高而减小; d.随温度降低而降低。
8、封闭物系 ( )a.不与环境交换功;b.不与环境交换热;c.不与环境交换物质;d.物系内物质种类不改变9、用公式 计算某反应在温度T 的反应焓变,要求:⎰∆+∆=∆Tp dT C H T H 298)298()(( )a.反应恒容;b.T >298K ;c.△C P ≠0;d. 298~T 间反应物和产物无相变10、气体标准态规定为 ( )a.298.15K ,100KPa 状态;b.100KPa ,298.15K 纯理想气体状态;c.100KPa 纯理想气体状态;d.298.15K ,101.325KPa 理想气体状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 绪论一、选择题1.对于同一物系, 内能是体系状态的单值函数概念的错误理解是(D)A. 体系处于一定的状态,具有一定的内能B. 对应于某一状态,内能只能有一数值,不能有两个以上的数值C. 状态发生变化,内能也一定跟着变化D. 对应于一个内能值,可以有多个状态2. 真实气体在什么条件下,其行为与理想气体相近? (D)A 高温高压B 低温低压C 低温高压D 高温低压3. 对封闭体系而言,当过程的始态和终态确定后,下列哪项的值不能确定: (A) A. Q B. Q + W, △U C. W (Q=0), △U D. Q (W=0), △U 二、名词解释1.独立变量与从属变量2. 化工热力学的三要素3.均相封闭系统4.热力学性质 三、简答题1.自变量与独立变量、函数与从属变量有何区别?2.为什么当非均相封闭系统中各相达到平衡状态时,每个相都可以视为均相封闭系统?第2章 P-V-T关系和状态方程 一、选择题1. T 温度下的过冷纯液体的压力P(A) A.> B.<C.=D.≤2. T 温度下的过热纯蒸汽的压力P (B) A.>B.<C.=D.=03. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到 (A ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程4.当时,纯气体的值为 (D )A. 0B. 很高的T 时为0C. 与第三virial 系数有关D. 在Boyle 温度时为零5. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 D. 湿蒸汽6. 纯物质的第二virial 系数B (A ) A . 仅是T 的函数 B. 是T 和P 的函数 C . 是T 和V 的函数D. 是任何两强度性质的函数7. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到(A ) A. 第三virial 系数 B. 第二virial 系数C. 无穷项D. 只需要理想气体方程8. 对于纯物质,一定温度下的泡点压力与露点压力是(A )A . 相同的 B. 不同的 C.泡点压力高于露点压力 D. 泡点压力低于露点压力9. 对于纯物质,一定温度下泡点与露点,在P -T 图上是(A )A. 重叠的B. 分开的C. 交叉的D. 平行的 10. 泡点的轨迹称为(A ) A.饱和液相线 B. 饱和汽相线()[]P T V P RT,-0→P ()T P s ()T P s ()T P s ()T P s ()T P s ()T P s ()T P s ()T P sC. 超临界曲线D. 升华曲线 11. 露点的轨迹称为(B )A.饱和液相线B. 饱和汽相线C. 汽液平衡线D. 三相线12. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i =j 时,其值(A ) A.为0 B. 为1 C. >1 D. 从实验数据拟合得到,在没有实验数据时,近似作零处理13. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i≠j 时,其值(C ) A 为1 B. 为0 C. 从实验数据拟合得到,在没有实验数据时,近似作零处理 D.从实验数据拟合得到,在没有实验数据时,近似作1处理 14. 计算纯物质的R-K 方程中的参数a,b,是下列哪个因素的函数。
(D ) A . 温度 B. 压力 C. 组成 D. 物性 15. 某物质的Pc=10MPa,在Tr=0.7时,其饱和蒸气压为0.5MPa,则其偏心因子ω等于(A ) A. 0.3010 B. 1.3010 C. -0.3010 D. 0.05 16. 指定压力下的纯物质,当其摩尔体积小于于该压力下的饱和液体摩尔体积时,则该物质的状态为(D ) A.饱和蒸汽 B.超临界流体 C.过热蒸汽 D.过冷液体 17. 对比态原理认为,所有物质在相同的对比态下,表现出相同的(D ) A. 体积 B. 压力 C. 温度 D. 压缩因子 二、多选题 1.可同时用于汽、液两相的状态方程有(BDE)A. RK 方程B.SRK 方程C.Antoine 方程D.PR 方程E.BWR 方程2.纯物质P-V 图上的临界等温线(ABD ) A.是一条具有拐点的曲线, B. 0=⎪⎭⎫⎝⎛∂∂TV p (在C 点) C. 穿过汽液两相区D. 022=⎪⎪⎭⎫ ⎝⎛∂∂TV p (在C 点)E. 是垂直于P 轴的直线3.混合法则(ABCD )A.可用于状态方程计算混合物的性质B.是将混合物看成一个虚拟的纯物质C. 是一些经验式D.是混合物的虚拟参数与混合物的组成和所含的纯物质的参数之间的关系E. 仅用于P-V-T 计算 三、名词解释 1.两参数对应态原理 2.状态方程 3. 混合物性质计算中的混合法则 四、简答题 1. 什么是纯物质的临界点?说出超临界流体的两个应用领域。
2. 比较RK 方程和PR 方程在计算精度、应用范围上的区别。
3. 以P 为显函数的立方型状态方程在汽液两相区、气相区、临界点分别有几个体积根? 五、综合题 1. 用virial 方程估算0.5MPa ,373.15K 时的等摩尔甲烷(1)-乙烷(2)-戊烷(3)混合物的摩尔体积(实验值5975cm3mol-1)。
已知373.15K 时的virial 系数如下(单位:cm3 ·mol -1): ,75,621,241,201312332211-=-=-=-=-=B B B B B2. 用两项维里截断式计算200℃、0.1MPa 下,异丙醇蒸汽的压缩因子和摩尔体积。
已知:Tc =508.2 K , Pc =5.07MPa,ω=0.700,3.已知乙醇的516.2C T K= ,6.38C P MPa =,2 2.50.42748C CR T a P =,0.08664cCRT b P =若将45.40 Kg 温度为227℃的乙醇装入1.213m3 的容器,试用RK 方程求出该容器内的压力为多少MPa 。
第3章 均相封闭体系热力学原理及其应用 一、选择题1.对于一均匀的物质,其H 和U 的关系为(B ) A. H≤U B. H>U C. H=U D. 不能确定2.一气体符合P=RT/(V-b)的状态方程从V1等温可逆膨胀至V2,则体系的S 为(C ) A.B. 0C.D. 3.对于一均相体系VP T S T T S T ⎪⎭⎫ ⎝⎛-⎪⎭⎫ ⎝⎛∂∂∂∂,等于(D )A.零B.CP/CVC.RD. PV T V T P T ⎪⎭⎫⎝⎛⎪⎭⎫ ⎝⎛∂∂∂∂4.吉氏函数变化与逸度 f 的关系为()f RT p T G P T G ig ln ),(,0=-,则参考态应该为(D )A.T 和P 下纯理想气体B.T 和零压的纯理想气体C. T 和p 下的理想气体混合物D. T 和单位压力的纯理想气体 5.下面哪个热力学性质的变化可表示为(B )dP T V T d PP P ⎰⎰⎪⎭⎫ ⎝⎛∂∂-2121ln C T T P A.△U B.△S C.△H D.△G 6. 热力学基本关系式 dH=TdS+VdP (B ) A..仅适用于可逆过程。
B. 适用于只有体积功存在的封闭体系C. 不能用于液体或固相D.仅用于等温过程 7. 用Maxwell关系式将T PS )(∂∂ 用P 、V 、T 可测量的偏导数表示,应该为(B )A.S V T )(∂∂ B. P TV)(∂∂- C.T V P )(∂∂ D. S PT )(∂∂ 8.吉氏函数变化与P-V-T 的关系为(,)ln ig x G T p G RT p -=,则x G 的状态应12ln V V R b V b V R --12lnb V bV RT --12ln399,122,75,621,24123131233-=-=-=-=-B B B B -0.39010=)(B 0.09314B 1=)(该为(C )A. T 和p 下纯理想气体B. T 和零压的纯理想气体C. T 和单位压力的纯理想气体D. T 和p 下的理想气体混合物 9. 逸度的单位(B)A. 与温度相同B. 与压力相同C. 与密度相同D.与溶解度相同 10. 体系经过一绝热可逆过程,其熵变(A) A.为0 B.大于0C. 小于0D.可正,可负,也可为0 二、多项选择1.计算热力学性质变化时,偏离函数参考态压力P0的选择 (ABDE )A.不影响计算结果B. P0必须统一C. 与计算结果有关D. P0可取单位压力E.可取P0=P2. dU=TdS-PdV 等热力学基本方程(BDE ) A. 适用于气体,而不能用于液体或固相。
B. 适用于只有体积功存在的封闭体系 C. 适用于敞开系统D.适用于定量定组成体系E.适用于任何相态 3. 当时, (ABC ) A. 1→ϕ B. p f →C.1→pfD. ϕ→fE. ∞→f4. 偏离函数可以计算(CDE )A. △TB. △PC. △UD. △HE. △V 三、名词解释 1.偏离函数四、简答题1. 说明偏离函数的文字定义与表达式2. 写出纯物质逸度和逸度系数的微分表达形式3. 写出纯物质逸度和逸度系数的积分表达形式第4章均相敞开系统热力学及相平衡准则 一、选择题1.已知某二元体系的,则对称归一化的活度系数是 (A )A.B.C. D.2.由混合物的逸度的表达式iig i i f RT G G ˆln +=知,ig i G 的状态为(A ) A.系统温度,P=1的纯组分i 的理想气体状态B.系统温度、系统压力的纯组分i 的理想气体状态C.系统温度、P=1的纯组分ID.系统温度、系统压力、系统组成的温度的理想混合物3.二元非理想溶液在极小浓度的条件下,其溶质和溶剂组分分别遵守(B ) A. Henry 规则和Henry 规则B. Henry 规则和Lewis-Randll 规则C. Lewis-Randll 规则和Lewis-Randll 规则D.均不适合4. 由混合物的逸度的表达式{}ii igi i i py fR G y p T ˆln ),,(G =-知,ig i G 的221221x A A 212112x A A 222111211221⎪⎪⎭⎫ ⎝⎛+x A x A x A A 222111222112⎪⎪⎭⎫ ⎝⎛+xA x A x A A 212121211221A x A x A A x x RT G E +=0→P状态为 (D) A. 系统温度,P=1的纯组分i 的理想气体状 B. 系统温度、系统压力的纯组分i 的理想气体状态 C.系统温度,P=1的纯组分I D.系统温度、系统压力、系统组成的理想气体混合物5. 理想溶液一定符合(A) A. Lewis-Randall 规则和Henry 规则 B. 分压定律 C.virial 方程 D.RK 方程6.对于理想溶液的某一容量性质M , 符合i i M M =的有(C )A. M=GB. M=AC. M=VD. M= S 7. 对于理想溶液的某一容量性质,符合 i i M M ≠的有(B )A. HB. GC. UD. V 8. 在一定温度、压力下,由组分1和组分2所形成的二元溶液中,组分1的逸度表达式为312111485ˆx x x f +-=(kPa),试确定上述条件下的逸度f1 为(B)A. 0 kPaB. 1 kPaC. 4 kPaD. 12 kPa 9. 对真实溶液,恒有 A.∑=iiE Mx M B.is EM M-M =C.E i EM M= D. ∑-=i i E M x M M10. 理想溶液必服从(A )A. ˆi i ϕϕ=B. ii f f =ˆ C. 0ˆii f f = D. i i Py P = 11.对所有的容量热力学性质来说,化学位是(B )A .偏摩尔性质; B.偏摩尔自由焓; C. 偏摩尔焓; D.偏摩尔体积。
