吸氧管产品技术审评规范
吸氧技术操作评分标准

3.无菌观念强
4.在规定时间内完成操作
3
4
3
操作不熟练扣1分,查对不规范扣2分
未有效沟通扣1分
无菌观念差酌情扣1-2分
每超时1分钟扣2分
16.协助患者取舒适卧位,整理床单位
17.整理用物
18.记录停氧日期及时间
5
4
3
2
4
3
5
5
3
5
6
4
3
5
6
3
2
2
未问候扣1分,查对不认真扣2分,未查对扣4分
解释不到位扣2分,未解释扣4分
一项不符合要求扣1分
未清洁扣2分
一项不符合要求扣2分
蒸馏水不符合要求扣2分,连接不紧密扣1分
未检查扣2分,连接不符合要求扣3分
氧气吸入技术操作评分标准
项
目
操作标注
分
值
减分细则
操
作
前
准
备
1.着装整洁,洗手,戴口罩
2.用物:中心供氧装置、治疗碗(内盛冷开水)、蒸馏水、一次性吸氧管、棉签、碗盘、纱布、用氧记录单、笔、手表、手电筒
3.用物准备3分钟
3
5
2
一项不符合要求扣1分
缺一项扣一分
超时1分钟扣2分
评
估
1.评估患者意识、身体状况及缺氧程度
2.评估患者鼻腔状况
5
5
评估不全面少一项扣1分,未评估不得分
操
作
步
骤
1.备齐用物,携至患者床旁,查对治疗护理项目单和腕带(床号、姓名、性别住院号),问候患者
2.向患者解释操作目的和配合方法,取得合作
3.安全与舒适:环境整洁、安静,患者体位舒适
一次性使用吸氧管产品技术要求富玛医药

一次性使用吸氧管2.性能指标2.1 外观制品的湿化瓶瓶体和吸氧管均应透明、厚薄均匀,无异味、无气泡、无杂质和异物等明显影响外观的缺陷。
湿化液应无色透明,无絮状物和沉淀物。
2.2 物理性能2.2.1 尺寸鼻塞(孔)的孔距G是指两孔外径间的最大距离。
表1尺寸单位:mm图1 吸氧管示意图2.2.2 湿化瓶与吸氧管的连接力制品中湿化瓶与吸氧管间的连接力,应能承受不小于15N的轴向静拉力,持续15S。
2.2.3 吸氧管拉伸强度制品各组件间的连接,应能承受不小于15N的静拉力,持续15S。
2.2.4 密封性和耐压性制品的各连接部分应密封,在0.4MPa工作压力下,持续保持10S;将瓶体浸入水中,持续保持10S;不得漏气,瓶体无破裂现象。
2.2.5 通气性能制品的各通气管路应在0.2 MPa-0.3 MPa压力下通气性良好,无堵塞现象,并且安全套件在0.2 MPa-0.25 MPa压力下应能开启排气。
2.2.6 装量制品湿化液的装量I应大于160ml,制品湿化液的装量II应大于120ml。
2.3 化学要求2.3.1 还原物质(易氧化物)按3.5.2试验时,所消耗高锰酸钾溶液〔c(KMnO4)= 0.002mol/L〕的总量应不超过2.0 mL。
2.3.2 重金属按3.5.3试验时,浸提液呈现的颜色不应超过质量浓度ρ(Pb2+)=1μg/mL的标准对照液。
2.3.3 酸碱度按3.5.4试验时,浸提液与同批空白液对照,pH值之差不得超过1.5。
2.3.4 蒸发残渣按3.5.5试验时,蒸发残渣的总量应不超过5mg。
2.3.5 环氧乙烷残留量按3.5.6试验时,吸氧管的环氧乙烷残留量应不大于10μg/g。
2.3.6 湿化液要求2.3.6.1 湿化液重金属按3.5.7.1试验时,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
2.3.6.2 湿化液酸碱度按3.5.7.2试验时,甲基红指示液不得显红色,溴麝香草酚蓝指示液不得显蓝色。
201901-013鼻导管吸氧技术评分标准(氧气筒)
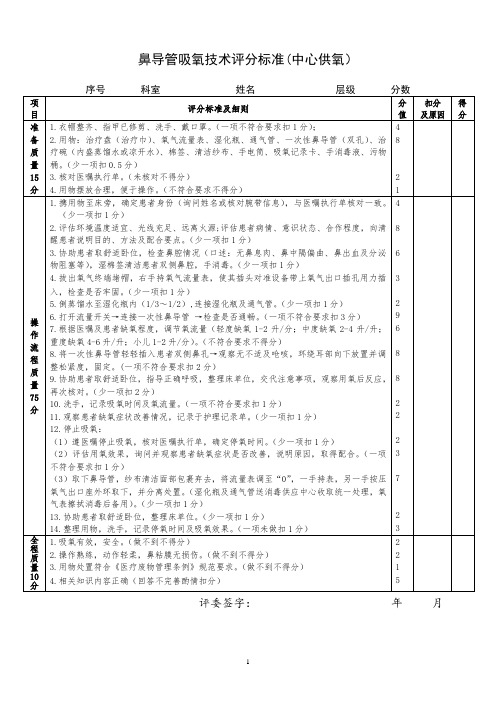
4
8
6
3
2
9
6
8
8
2
2
2
3
7
2
3
全
程
质
量
10分
1.吸氧有效,安全。(做不到不得分)
2.操作熟练,动作轻柔,鼻粘膜无损伤。(做不到不得分)
3.用物处置符合《医疗废物管理条例》规范要求。(做不到不得分)
4.相关知识内容正确(回答不完善酌情扣分)
3.协助患者取舒适卧位,检查鼻腔情况(口述:无鼻息肉、鼻中隔偏曲、鼻出血及分泌物阻塞等),湿棉签清洁患者双侧鼻腔,手消毒。(少一项扣1分)
4.拔出氧气终端堵帽,右手持氧气流量表,使其插头对准设备带上氧气出口插孔用力插入,检查是否牢固。(少一项扣1分)
5.倒蒸馏水至湿化瓶内(1/3~1/2),连接湿化瓶及通气管。(少一项扣1分)
(2)评估用氧效果,询问并观察患者缺氧症状是否改善,说明原因,取得配合。(一项不符合要求扣1分)
(3)取下鼻导管,纱布清洁面部包裹弃去,将流量表调至“0”,一手持表,另一手按压氧气出口座外环取下,并分离处置。(湿化瓶及通气管送消毒供应中心收取统一处理,氧气表擦拭消毒后备用)。(少一项扣1分)
133.核对医嘱执行单。(未核对不得分)
4.用物摆放合理,便于操作。(不符合要求不得分)
4
8
2
1
操
作
流
程
质
量
75分
1.携用物至床旁,确定患者身份(询问姓名或核对腕带信息),与医嘱执行单核对一致。(少一项扣1分)
2.评估环境温度适宜、光线充足、远离火源;评估患者病情、意识状态、合作程度,向清醒患者说明目的、方法及配合要点。(少一项扣1分)
医用中心吸引系统、医用中心供氧系统产品技术审评规范

医用中心吸引系统、医用中心供氧系统产品技术审评规范医用中心吸引系统、医用中心供氧系统产品技术审评规范(2009版)按照《医疗器械注册治理方法》(国家食品药品监督治理局令第16号)的要求并结合医用中心吸引系统、医用中心供氧系统产品的特点,为规范医用中心吸引系统、医用中心供氧系统产品的技术审评工作,特制定本规范。
适用范畴本规范所适用的产品范畴为二类医疗器械产品医用中心吸引系统、医用中心供氧系统(II-6856)。
技术审查要点产品名称的要求产品名称为:医用中心吸引系统、医用中心供氧系统产品工作原理1.医用中心吸引系统。
医用中心吸引系统的负压源是中心吸引站的真空泵机组,通过真空泵机组的抽吸使吸引系统管路达到所需负压值,在手术室、抢救室、治疗室和各个病房的终端处产生吸力,提供医疗使用。
2.医用中心供氧系统。
医用中心供氧系统的氧气气源集中在中心供氧站,气源氧气通过减压装置和管道输送到手术室、抢救室、治疗室和各个病房的终端处,提供医疗使用。
产品的结构组成1.中心吸引系统(1)中心吸引系统要紧由中心吸引站、管道、阀门及终端插头等组成。
(2)中心吸引站是由真空泵机组、真空容器、管道、阀门、电控柜和真空外表等设备组成的独立操作间。
(3)中心吸引系统管路的末端,即输向患者的一端,连有快速接头(或一样接头),插入(或连接)防止液体倒流吸引装置等。
2.中心供氧系统(1)中心供氧系统要紧由中心供氧站、管道、阀门及终端送氧插头等组成。
(2)中心供氧站为集中存放医院氧气气源的建筑物。
供氧方式有:氧气瓶组供氧、液氧供氧、制氧机供氧或联合供氧。
氧气瓶组供氧由高压氧气瓶、汇流排、减压装置、管道及报警装置和安全阀(或释压阀)等组成。
液氧供氧由液氧罐、汽化器、减压装置、管道及报警装置等组成。
制氧机供氧由制氧机、储气装置、管道及报警装置等组成。
(3)汇流排由适当数量的氧气瓶、管道、过滤器、阀门、减压装置、外表和切换装置等器件组成。
(4)终端由快速接头插座(或一样气体接头),可插入(或连接)氧气湿化吸入器、麻醉机和呼吸机等医疗器械的气体插头组成。
氧气吸入(筒装)技术评分标准

未关小开关扣2分
顺序错误扣5分
3..观察停氧时间,卸表。
3
未看时间扣1分
卸表不当扣2分
4.再次核对,询问患者感觉并做宣教。
3
未核对患者扣2分
未询问扣1分
5.协助其取舒适卧位,整理床单位。
2
一项不符合要求扣1分
6.整理用物,洗手,记录。
3
一项不符合要求扣1分
五.整体评价
3
整体评价:熟练程度,爱伤观念,语言沟通表达能力,心理素质等。
2
少一件扣0.5分
未检查扣1分
四.操作步骤
80
1.携用物至患者床旁,使用标准化核对流程。
3
未核对扣3分
核对不规范扣2分
2.吹尘,安装流量表及湿化瓶,确认小开关处于关闭状态,打开氧气筒开关,检查有无漏气,打开小开关,检查流量表完好,(关闭小开关)。
20
未吹尘扣3分
未告知病人、声音太响各扣1分
流量表安装不垂直扣2分
3
合计
100
8.整理用物,洗手,记录。
3
一项不符合要求扣1分
停氧
1.停用氧气时:更换弯盘,使用标准化核对流程。
3
未更换弯盘扣1分
未核对扣2分
2.向患者解释,取下鼻氧管,擦净鼻部分泌物,关闭流量表,分离鼻氧管与流量表,关氧气筒大开关,开流量表小开关放余气,关小开关。
10
未解释扣1分
未擦鼻部扣1分
未关流量表扣2分
未关大开关扣2分
2
未说明目的、未解释各扣1分
3.评估患者病情、意识状态、合作程度,鼻腔情况等。
2
评估少一项扣1分,不符合要求扣1分
4.操作环境:环境清洁,温湿度适宜,无明火。
吸氧技术操作考核评分标准

吸氧技术操作考核评分标准一、考核目的本评分标准旨在对吸氧技术操作进行考核,以确保操作人员具备正确的吸氧技能,提高技术操作的安全性和有效性。
二、考核内容1. 吸氧设备的准备和检查- 检查吸氧设备的完整性和可用性- 检查氧气瓶的气压和剩余量- 确保吸氧面罩或导管的清洁和完好2. 吸氧操作流程- 正确佩戴吸氧面罩或导管- 根据患者需求调整氧气流量- 监测患者吸氧情况,并及时调整氧气流量或换气瓶3. 应急处理能力- 针对吸氧设备故障或意外情况,能够快速采取应急措施- 熟悉吸氧设备操作偏差或故障的常见处理方法4. 患者安全和舒适- 注意患者吸氧过程中的舒适感和安全性- 关注患者的呼吸情况和氧气需求,根据情况进行适当调整三、评分标准根据考核内容对操作人员进行评分,评分标准如下:- 优秀:操作人员能够熟练掌握吸氧技术,并在吸氧操作过程中能够迅速应对各种情况,确保患者的安全和舒适。
无明显错误操作,能够独立完成吸氧操作流程。
(满分:100分)- 良好:操作人员能够基本掌握吸氧技术,但在操作过程中可能存在一些小错误或迟疑,需要他人提醒或帮助纠正。
(分数范围:80-99分)- 合格:操作人员对吸氧技术掌握较为基础,但可能存在一些较为明显的操作错误或不熟悉应急处理措施,需要加强技能训练。
(分数范围:60-79分)- 不合格:操作人员对吸氧技术掌握不够,存在较多的操作错误,无法独立完成吸氧操作流程,需要进行进一步的培训和指导。
(分数范围:0-59分)四、评分记录与反馈操作人员的吸氧技术考核成绩应当记录在个人档案中,并及时向操作人员进行反馈和指导,以帮助其改进和提高吸氧技术操作水平。
请注意,以上评分标准仅供参考,实际应根据吸氧操作的具体要求和情况进行相应调整和确认。
吸氧技术操作评分标准

吸氧技术操作评分标准吸氧技术操作评分标准科室:未知姓名:未知得分:项目素质要求评估操作程序服装衣帽整洁、仪表端庄、动作规范、举止文雅 5用物准备墙壁氧气管道、氧气流量表、湿化瓶、治疗车、治疗盘、医嘱单、吸氧记录单、抹布一块、医用/生活垃圾桶2操作步骤检查一次性吸氧管在有效期、无漏气;检查吸氧装置,关闭流量表开关;擦去无菌水瓶上灰尘,检查;核对医嘱,无菌敷布在有效期内,取湿化瓶,打开无菌水瓶盖,无菌水冲洗瓶口后,向瓶内加入1/3-1/2的灭菌水,拧紧湿化瓶,写明使用时间,放入治疗盘内;用2个湿棉签分别清洁患者两侧鼻孔;取下墙壁氧气上活塞,湿棉签擦氧气接头上的灰尘;安装氧气装置及连接吸氧管,打开流量表开关,检查是否通畅,将鼻塞置于患者鼻腔内;按医嘱要求调节氧流量,记录用氧时间 14停止吸氧洗手、戴口罩,携用物至病人床旁 1以上是吸氧技术操作评分标准。
在操作过程中,护士需要保持仪表端庄、动作规范、举止文雅,同时穿戴整洁的服装衣帽。
在准备用物时,需要准备墙壁氧气管道、氧气流量表、湿化瓶、治疗车、治疗盘、医嘱单、吸氧记录单、抹布一块、医用/生活垃圾桶。
在操作步骤中,需要检查一次性吸氧管在有效期、无漏气,检查吸氧装置,关闭流量表开关,擦去无菌水瓶上灰尘,检查医嘱,无菌敷布在有效期内,取湿化瓶,打开无菌水瓶盖,无菌水冲洗瓶口后,向瓶内加入1/3-1/2的灭菌水,拧紧湿化瓶,写明使用时间,放入治疗盘内,用2个湿棉签分别清洁患者两侧鼻孔,取下墙壁氧气上活塞,湿棉签擦氧气接头上的灰尘,安装氧气装置及连接吸氧管,打开流量表开关,检查是否通畅,将鼻塞置于患者鼻腔内,按医嘱要求调节氧流量,记录用氧时间。
在停止吸氧时,需要洗手、戴口罩,携用物至病人床旁。
201-1床的患者XXX,由于血氧水平超过90%,根据医嘱需要停止吸氧,取下鼻导管,并关闭氧气流量表。
随后,使用纱布为患者擦净口鼻,并记录停止吸氧的时间。
告知患者如有不适,及时按呼叫器。
医用供氧器产品技术审评规范(2011版)

医用供氧器产品技术审评规范(2011版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合医用供氧器产品的特点,为规范医用供氧器产品的技术审评工作,特制定本规范。
一、适用范围本规范适用于主要由氧气瓶、压力表、供氧阀门等组件组成的医用供氧器(不含医用氧)。
该产品管理类别为II类,产品类代号为6854。
二、技术审查要点(一)产品名称的要求医用供氧器产品的名称应以“型号(也可是系列)+医用供氧器”的形式给出。
(二)产品的结构组成医用供氧器一般由氧气瓶(不含医用氧)、压力表、流量表、阀门、氧桥、吸氧管、加湿器、面罩等组成。
氧压表流量表氧压表、流量表、阀门氧桥加湿器供氧器(三)产品工作原理医用供养器产品按工作原理可分为阻尼型和稳压型。
1、阻尼型:瓶内高压气体经过阻尼块,以实现对氧气流量大小的限制。
2、稳压型:瓶内高压气体经过减压稳压器,使气体减压到相对稳定的低压允许范围。
(四)产品适用的相关标准1.GB/T 191-2008 包装储运图示标志2.GB5099-1994钢质无缝气瓶3. GB8982-1998医用氧气4. GB11640-1989 铝合金无缝气瓶5. GB/T12137-2002气瓶气密性试验方法6.YY/T 0316-2008 医疗器械风险管理对医疗器械的应用注:以上标准执行最新版本(五)产品的预期用途医用供氧器产品充氧后可用于为家庭和医疗机构提供保健或急救用氧。
(六)产品的主要风险风险管理报告应符合YY/T0316-2008 《医疗器械风险管理对医疗器械的应用》的有关要求,审查要点包括:表1主要危害(七)产品的主要技术指标1.供氧器(1)贮存压力:医用供氧器的最大贮存压力一般不超过15MPa。
(2)出厂压力(如有)医用供氧器的出厂压力一般不低于10 MPa。
(3)流量医用供氧器的流量在规定的范围内,如可调应明确要求。
(4)气密性医用供氧器各阀门、接口的气密性应良好,当贮存压力不低于出厂压力时,医用供氧器处于关闭和任意开启状态下各部位应无泄露。
医用供氧器产品技术审评规范

医用供氧器产品技术审评规范(2011版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合医用供氧器产品的特点,为规范医用供氧器产品的技术审评工作,特制定本规范。
一、适用范围本规范适用于主要由氧气瓶、压力表、供氧阀门等组件组成的医用供氧器(不含医用氧)。
该产品管理类别为II类,产品类代号为6854。
二、技术审查要点(一)产品名称的要求医用供氧器产品的名称应以“型号(也可是系列)+医用供氧器”的形式给出。
(二)产品的结构组成医用供氧器一般由氧气瓶(不含医用氧)、压力表、流量表、阀门、氧桥、吸氧管、加湿器、面罩等组成。
氧压表流量表氧压表、流量表、阀门氧桥加湿器供氧器(三)产品工作原理医用供养器产品按工作原理可分为阻尼型和稳压型。
1、阻尼型:瓶内高压气体经过阻尼块,以实现对氧气流量大小的限制。
2、稳压型:瓶内高压气体经过减压稳压器,使气体减压到相对稳定的低压允许范围。
(四)产品适用的相关标准1.GB/T 191-2008 包装储运图示标志2.GB5099-1994钢质无缝气瓶3. GB8982-1998医用氧气4. GB11640-1989 铝合金无缝气瓶5. GB/T12137-2002气瓶气密性试验方法6.YY/T 0316-2008 医疗器械风险管理对医疗器械的应用注:以上标准执行最新版本(五)产品的预期用途医用供氧器产品充氧后可用于为家庭和医疗机构提供保健或急救用氧。
(六)产品的主要风险风险管理报告应符合YY/T0316-2008 《医疗器械风险管理对医疗器械的应用》的有关要求,审查要点包括:表1主要危害(七)产品的主要技术指标1.供氧器(1)贮存压力:医用供氧器的最大贮存压力一般不超过15MPa。
(2)出厂压力(如有)医用供氧器的出厂压力一般不低于10 MPa。
(3)流量医用供氧器的流量在规定的范围内,如可调应明确要求。
(4)气密性医用供氧器各阀门、接口的气密性应良好,当贮存压力不低于出厂压力时,医用供氧器处于关闭和任意开启状态下各部位应无泄露。
鼻导管吸氧操作评分标准
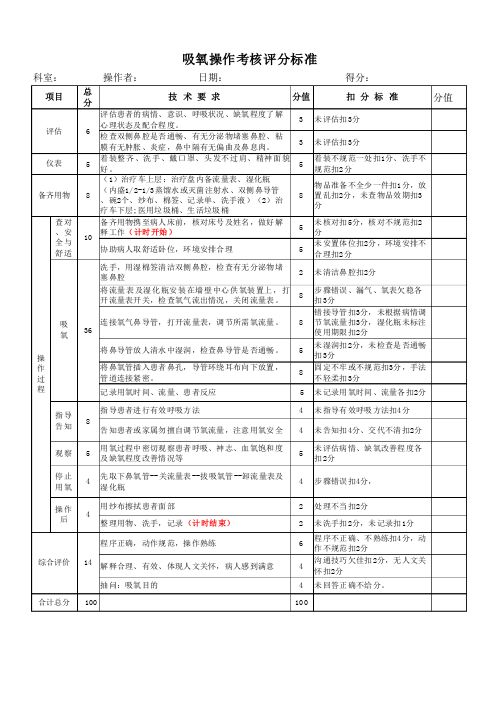
8
5 5 2 8 8 5 8 5 4 4 5 4 2 2 6 4 4 100
吸 氧 操 作 过 程 指导 告知 观察 停止 用氧 操作 后
36
连接氧气鼻导管,打开流量表,调节所需氧流量。 将鼻导管放人清水中湿润,检查鼻导管是否通畅。 将鼻氧管插入患者鼻孔,导管环绕耳布向下放置, 管道连接紧密。 记录用氧时间、流量、患者反应 指导患者进行有效呼吸方法
8 告知患者或家属勿擅自调节氧流量,注意用氧安全 5 4 用氧过程中密切观察患者呼吸、神志、血氧饱和度 及缺氧程度改善情况等 先取下鼻氧管--关流量表--拔吸氧管--卸流量表及 湿化瓶 用纱布擦拭患者面部 整理用物、洗手,记录(计时结束) 程序正确,动作规范,操作熟练
4
综合评价
14 解释合理、有效、体现人文关怀,病人感到满意 抽问:吸氧目的
吸氧操作考核评分标准
科室:
项目 总 分
6
操作者:
日期:
技 术 要 求 分值
பைடு நூலகம்3 3 5
得分:
扣 分 标 准
未评估扣3分 未评估扣3分 着装不规范一处扣1分、洗手不 规范扣2分 物品准备不全少一件扣1分,放 置乱扣2分,未查物品效期扣3 分 未核对扣5分,核对不规范扣2 分 未安置体位扣2分,环境安排不 合理扣2分 未清洁鼻腔扣2分 步骤错误、漏气、氧表欠稳各 扣3分 错接导管扣3分,未根据病情调 节氧流量扣3分,湿化瓶未标注 使用期限扣2分 未湿润扣2分,未检查是否通畅 扣3分 固定不牢或不规范扣3分,手法 不轻柔扣3分 未记录用氧时间、流量各扣2分 未指导有效呼吸方法扣4分 未告知扣4分、交代不清扣2分 未评估病情、缺氧改善程度各 扣2分 步骤错误扣4分, 处理不当扣2分 未洗手扣2分,未记录扣1分 程序不正确、不熟练扣4分,动 作不规范扣2分 沟通技巧欠佳扣2分,无人文关 怀扣2分 未回答正确不给分。
医用中心吸引系统医用中心供氧系统产品技术审评规范

医用中心吸引系统医用中心供氧系统产品技术审评规范医用中心吸引系统、医用中心供氧系统产品技术审评规范(2009版)根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合医用中心吸引系统、医用中心供氧系统产品的特点,为规范医用中心吸引系统、医用中心供氧系统产品的技术审评工作,特制定本规范。
一、适用范围本规范所适用的产品范围为二类医疗器械产品医用中心吸引系统、医用中心供氧系统(II-6856)。
二、技术审查要点(一)产品名称的要求产品名称之:医用中心吸引系统、医用中心供氧系统(二)产品工作原理1.医用中心吸引系统。
医用中心吸引系统的负压源是中心吸引站的真空泵机组,通过真空泵机组的抽吸使吸引系统管路达到所需负压值,在手术室、抢救室、治疗室与各个病房的终端处产生吸力,提供医疗使用。
2.医用中心供氧系统。
医用中心供氧系统的氧气气源集中在中心供氧站,气源氧气通过减压装置与管道输送到手术室、抢救室、治疗室与各个病房的终端处,提供医疗使用。
(三)产品的结构构成1.中心吸引系统(1)中心吸引系统要紧由中心吸引站、管道、阀门及终端插头等构成。
(2)中心吸引站是由真空泵机组、真空容器、管道、阀门、电控柜与真空仪表等设备构成的独立操作间。
(3)中心吸引系统管路的末端,即输向患者的一端,连有快速接头(或者通常接头),插入(或者连接)防止液体倒流吸引装置等。
2.中心供氧系统(1)中心供氧系统要紧由中心供氧站、管道、阀门及终端送氧插头等构成。
(2)中心供氧站为集中存放医院氧气气源的建筑物。
供氧方式有:氧气瓶组供氧、液氧供氧、制氧机供氧或者联合供氧。
氧气瓶组供氧由高压氧气瓶、汇流排、减压装置、管道及报警装置与安全阀(或者释压阀)等构成。
液氧供氧由液氧罐、汽化器、减压装置、管道及报警装置等构成。
制氧机供氧由制氧机、储气装置、管道及报警装置等构成。
(3)汇流排由适当数量的氧气瓶、管道、过滤器、阀门、减压装置、仪表与切换装置等器件构成。
{技术规范标准}医用中心吸引系统医用中心供氧系统产品技术审评规范

{技术规范标准}医用中心吸引系统医用中心供氧系统产品技术审评规范一、引言医用中心吸引系统是医疗机构中用于吸引病人呼气、分泌物等的装置,并通过供氧系统为病人提供氧气。
为了确保医用中心吸引系统能够正常运行,保障病人安全,减少医疗事故发生,制定本技术审评规范。
二、适用范围本技术审评规范适用于医用中心吸引系统及其相关产品的技术审评,包括吸引系统本体、供氧系统以及相关附属设备和配件等。
三、技术要求1.医用中心吸引系统应具备稳定可靠的吸引性能,能够有效吸引病人呼气、分泌物等残留物质。
2.医用中心吸引系统的吸引管路应具备良好的耐磨性和耐化学腐蚀性,且易于清洁和消毒。
3.医用中心吸引系统的吸引管路应具备合理的长度和弯曲度,便于操作和使用。
4.医用中心吸引系统的供氧系统应具备稳定的氧气供应能力,能够按需提供不同浓度的氧气。
5.医用中心吸引系统的供氧系统应具备可靠的供氧安全保护机制,能够及时发现和处理供氧异常情况。
6.医用中心吸引系统的供氧系统应具备合理的氧气供应管路布置,便于连接各种氧气供应设备和吸引系统本体。
7.医用中心吸引系统的相关附属设备和配件应符合相关国家标准和规定,能够与吸引系统本体和供氧系统配套使用。
8.医用中心吸引系统的操作界面和指示灯应设计合理,便于操作和观察。
9.医用中心吸引系统的电气安全要求应符合相关标准和规定,且具备过载保护和漏电保护等功能。
10.医用中心吸引系统的材质和工艺应符合相关卫生标准和规定,无毒无害,易于清洁和消毒。
四、检测方法1.对医用中心吸引系统的吸引性能进行评估,包括吸引流量、吸引压力等指标的测量。
2.对医用中心吸引系统的耐磨性和耐化学腐蚀性进行测试,评估其材质的耐久性。
3.对医用中心吸引系统的供氧性能进行评估,包括氧气供应量、供氧浓度等指标的测量。
4.对医用中心吸引系统的供氧安全保护机制进行测试,包括氧气压力异常、流量异常等情况下的应急处理能力评估。
5.对医用中心吸引系统的电气安全进行测试,包括过载保护、漏电保护等功能的检验。
医用分子筛制氧设备产品技术审评规范(医用分子筛制氧设备产品注册技术审查指导原则)

医用分子筛制氧设备产品技术审评规范根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)的要求并结合医用分子筛制氧设备的特点,为规范该类产品的技术审查工作和指导该类产品的注册申报工作,特制定本规范。
一、适用范围本规范适用于医用分子筛制氧设备。
该类产品适用于以医疗、保健为目的,以沸石分子筛为吸附剂,用变压吸附法(PSA)制取医用氧气的医用分子筛设备(以下简称“制氧设备”)。
二、技术审查要点(一)产品名称的要求1、产品名称建议规范为“医用分子筛制氧机(装置)”;2、若有商品名称,应注意不应有夸大产品功效和误导消费者的含义。
(二)产品的结构组成1、单人用的制氧设备至少应由制氧主机、流量计和湿化器等组成。
2、多人用制氧设备至少应由气源、分子筛吸附分离装置、控制装置、氧气流量检测装置和产品气滤器等部分组成。
图1:家用型制氧设备图2:大型制氧设备空气压缩机 空气预处理 气体控制阀 分子筛吸附塔 监控系统 产品气处理系统 输出废气排出图3:制氧设备结构组成(1)空气压缩机:提供吸附时所必须的气体压力及用于分离氧气的原料(空气)。
(2)空气预处理:主要包括气体降温,除水,过滤等功能。
(3)气体控制阀:由空气压缩机加压后并经过空气预处理系统处理后的加压空气,由控制阀按照一定的控制逻辑,对分子筛吸附塔进行周期性的加压、排气。
(4)分子筛吸附塔:在一个密闭的空间之内,密实地填充沸石分子筛。
利用分子筛对气体的选择性吸附特性,分离空气中的氮气、二氧化碳与氧气。
(5)监控系统:(如适用)操作气体控制阀,按照预先设定的工作流程,实现变压吸附。
通过一系列传感器、电路系统,实现产品的氧浓度监测、故障报警、定时等监视、报警和自动控制功能。
(6)产品气处理系统:主要指对制氧设备产生的氧气进行收集、过滤、调压、湿化等处理的部分。
(三)产品工作原理1、分子筛:分子筛是人工水热合成的硅铝酸盐晶体,其硅铝比不同生成各种不同型号分子筛。
一次性使用鼻氧管产品注册技术审查指导原则

附件16一次性使用鼻氧管产品注册技术审查指导原则本指导原则旨在指导和规范一次性使用鼻氧管产品的技术审评工作,帮助审评人员理解和掌握该类产品结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则是对一次性使用鼻氧管产品的一般要求,审评人员应依据具体产品的特性确定其中的具体内容是否适用并对注册申报资料的内容进行补充要求。
本指导原则所确定的主要内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则适用于按第二类医疗器械管理的一次性使用鼻氧管,类代号现为6856。
二、技术审查要点(一)产品名称的要求产品名称按作用原理和适用范围应命名为“一次性使用鼻氧管”。
(二)产品的结构和组成产品可由氧源接头、输氧管、鼻塞、耳挂固定及氧气湿化装置--------------------------可以编辑的精品文档,你值得拥有,下载后想怎么改就怎么改--------------------------- ==========================================================等组成。
图1图2--------------------------可以编辑的精品文档,你值得拥有,下载后想怎么改就怎么改--------------------------- ==========================================================================图3(三)产品的工作原理一次性使用鼻氧管通过氧源接头连接于氧气吸入器出氧端,鼻塞放置或固定于吸氧者鼻孔处,当开启氧气吸入器氧流开关氧气经输氧管输入鼻腔;配置氧气湿化装置的一体式鼻氧管氧气可被加湿后吸入。
一次性使用无菌呼吸道吸引导管技术审评要点

一次性使用无菌呼吸道吸引导管技术审评要点崔佳;吴莉【摘要】一次性使用呼吸道用吸引导管根据国家食药监总局分类要求,属于第二类医疗器械产品。
此类产品必须在上市前,在生产企业所在地省级药监局进行技术审评和行政审批取得注册证书后才能销售。
为给省级审评中心针对此类产品的技术审评工作提供审评依据,统一审评标准,本文针对企业需要递交的技术资料要求,从技术审评角度出发,提出该类产品的技术审评关键点。
%Disposable suction catheter for use in accordance with the requirements of the national food and Drug Administration classiifcation, belonging to second types of medical equipment products. Such products must be listed before the provincial food and drug administration at the local level of production enterprises to carry out technical review and administrative examination and approval to obtain a certiifcate of registration in order to sel. Provide the basis for the review to the provincial evaluation center for such products, technical review, uniifed standard review, according to the information technology companies need to submit a request, starting from the perspective of technical evaluation, put forward the technical evaluation key points of the products.【期刊名称】《中国医疗器械信息》【年(卷),期】2016(022)023【总页数】4页(P27-30)【关键词】呼吸道吸引导管;技术审评【作者】崔佳;吴莉【作者单位】江苏省食品药品监督管理局认证审评中心南京 210002;江苏省食品药品监督管理局认证审评中心南京 210002【正文语种】中文【中图分类】TH785+.4一次性使用呼吸道用吸引导管的主要组成部分有吸引导管、真空控制装置及其他辅助配件,预期将吸引导管进入患者咽喉部,通过真空控制装置连接负压源,旨在将呼吸道分泌物通过负压吸除,以保持呼吸道通畅。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸氧管产品技术审评规范(2011版)
根据《医疗器械注册管理办法》(国家食品药品监督管理局令第
16号)的要求并结合吸氧管产品的特点,为规范该类产品的技术审查
工作和指导该类产品的注册申报工作,特制定本规范。
一、产品管理类别的确定
依据《医疗器械分类目录》,吸氧管产品类代码为6856 - 4,属病房护理设备及器具,管理类别为H类。
二、产品名称的要求
一般应为一次性使用吸氧管、吸氧面罩。
三、产品的结构组成
吸氧管一般由管座、导管、鼻塞(或者面罩)组成。
吸氧管产品按照结构类型可划分为鼻导管吸氧管(单鼻头、双鼻
头、耳挂式)、面罩吸氧管。
吸氧管产品按照使用对象可划分为成人用吸氧管、小儿用吸氧管。
小儿吸氧管成人用普通吸氧管
四、 产品工作原理
将医用氧气通过管路经鼻腔或呼吸道输入到患者体内
五、 产品适用的相关标准
一般常用的国家标准、行业标准包括:
1. GB 191-2008 包装、储运图示标志
2. GB10010-2009
医用软聚氯乙烯管材 3. GB/T 2828-2003
逐批检验计数抽样程序及表(适用于连续批
的检验) 4. GB/T 2829 - 2002周期检验计数抽样程序及表
(适用于过程稳
8.GB/T 14233.1 - 一部分:化学分析方法
-2008医用输血、输液、注射器具检验方法第 9.GB/T 14233.2 -2005医用输血、输液、注射器具检验方法第
二部分:生物实验方法
定性的检验) 5. G B/T 16886.1 -2001
试验 6. G B/T 16886.5-2003
胞毒性试验 7.GB/T 16886.10-2005
与迟发型超敏反应试验 医疗器械生物学评价 医疗器械生物学评价 医疗器械生物学评价 第1部分:评价与
第5部分:体外细
第10部分:刺激 面罩吸氧管
10. GB 15979-2002 —次性卫生用品卫生标准
11. YY/T0313-1998 医用高分子制品包装、标志、运输和贮存
六、产品预期用途
通过管路经鼻腔或呼吸道对缺氧患者进行供氧。
七、产品的主要风险
吸氧管进行风险管理时应考虑的主要危害
八、产品标准的主要技术要求
吸氧管的主要技术要求一般包括以下几项:
1. 材料
应选择无生物学、化学危害的医用高分子材料(如聚氯乙烯PVC、硅橡胶等)。
应明确材料来源及相应的材料标准。
应提交产品全部的组成
材料(包括增塑剂黏合剂稳定剂的使用比例以及残留量的要求)。
2. 外观吸氧管管材应塑化良好,无异嗅,无气泡,无扭结,内外管壁应清洁无污染。
3. 尺寸
吸氧管应用其公称外径(mm )表示其规格,精度到0.1mm ,公差土0.5mm。
吸氧管在自然放置状态下,不得小于标称长度。
4. 拉伸强度
各组件粘接应有一定强度,应能承受15N 静拉力并保持一定时间而不发生连接处脱落管道断裂。
5 .气密性、通畅性
在规定0.1MPa 压力下,管路应保持通畅并不泄露。
6. 面罩应有侧孔利于排放
7. 微生物要求
(1)吸氧管消毒级别要求:产品经钴60 辐射(或环氧乙烷)消
毒后,应无致病菌检出,即大肠杆菌、致病性化脓菌(指绿脓杆菌、金黄色葡萄球菌)、真菌不得检出。
(2)吸氧管无菌级别要求:产品经钴60 辐射(或环氧乙烷)灭
菌后,应无菌。
8. E O 残留量
吸氧管若采用环氧乙烷消毒/灭菌、按GB/T14233.1-2008 检验时, 环氧乙烷残留量应不大于10旳/g。
9. 生物性能
(1 )吸氧管细胞毒性应不大于 2 级。
(2)吸氧管试验样品与溶剂对照平均记分之差应不大于 1.0(皮内反应)。
(3)吸氧管迟发致敏反应不大于 1 级。
九、产品说明书、标签、包装标识产品说明书、标签、包装标识应按照《医
疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局局令第10 号)的相关要求。
产品说明书应至少包括如下内容:
【产品名称】
一次性使用吸氧管(应与注册证核准的产品名称一致,不得在产品名称任意增加修饰性词语)
【商品名称】如有商品名的,应符合有关产品商标管理的具体规定。
名称应真实体现产品特点和企业特色,不得带有夸大产品宣传、误导使用者的信息。
【注册证号】
核准的注册证号,如有变更情况的,应按变更后的注册证号编写。
【型号、规格】按照注册证核准的型号、规格填写,不得擅自改变产品型号规格的文字表述。
【执行标准】按照注册证登记表标注的产品标准进行填写,并应标注标准年代号。
【主要性能结构及性能】具体将注册产品标准中所列重要信息予以注明,尤其是安全性、有效性性能指标和产品构成部件,如吸氧管组成。
具体性能指标应包括材料类型、外观、尺寸、强度、流畅性、无菌要求、EO 残留量等指标要
求。
【适用范围】详见本规范第六项。
【注意事项】
应按照临床需要选择适宜结构、尺寸的吸氧管明确包装如有破损、严禁使用的警示信息。
明确灭菌有效期。
应明确使用期限。
【禁忌症】对吸氧管所采用材质过敏者禁止使用。
【使用方法】应在医务人员指导下按临床规范操作。
常规吸氧管:操作时,先将吸氧管接头与气源接头相连,调好流量;再将鼻塞插入鼻孔,两根导管沿耳轮绕至下颌用活扣使之固定,之后吸氧开始。
面罩型吸氧管:操作时,先将吸氧管接头与气源接头相连,调好流量;将面罩置于患者面部,使用固定构件将面罩固定于患者头部,之后吸氧开始。
【运输、贮存及保养方法】该产品应避免挤压。
产品应贮存在相对湿度不超过80 %无腐蚀性气体和通风良的室内,避免日晒和潮湿。
十、产品的临床试验要求应遵守《医疗器械临床试验管理规定》(国家食品药品监督管理局局第令5 号)的要求。
十一、注册单元的划分
1. 注册单元划分的原则是考虑其原(机)理、材料、主要性能、预期目的是否基本相同。
2. 如吸氧管的基本原理、材料、主要性能和预期用途基本一致,即可按一个注册单元划分。
(如小儿、成人、单鼻头、双鼻头、面罩型可划分为同一注册单元)。
十二、同一注册单元中典型产品的确定原则
1. 典型产品应是同一注册单元内能够代表本单元内其他产品安全性和有效性的产品。
2. 应考虑功能最齐全、结构最复杂(最小规格)、风险最高的产品。
3. 如其他产品的主要性能与被检产品不一致,则该产品也应作为典型产品进行注册检验。
十三、检测要求
1.吸氧管的出厂检验项目至少应检测外观、尺寸、无菌、气密性、通畅性EO 残留量等指标。
2.产品多为批量生产,所以企业可采取抽样检测的手段来监视产品质量。
抽样方法可参考GB/T 2828-2003 逐批检验计数抽样程序及表(适用于连续批的检验);GB/T 2829 -2002 周期检验计数抽样程序及表(适用于过程稳定性的检验)的要求。
型式检验时,如产品材料未发生变化,可免于生物安全性检测和成分材
料。
3. 常用的检测设备:卡尺、砝码、压力表、紫外可见分光光度计、温度计等。
吸氧管产品技术审评规范》编制说明
一、任务来源及背景吸氧管产品可将医用氧气通过管路经鼻腔或呼吸道输入到患者体内,是一种相对成熟的产品。
本技术审评规范的编写根据《医疗器械注册管理办法》(国家食品药品监督管理局令第16 号)的要求,并结合吸氧管产品的特点,为规范该类产品的技术审查工作和指导该类产品的注册申报工作,特制定本技术审评规范。
二、关于本规范的适用范围本规范适用于普通常规吸氧管,一般由管座、导管、鼻塞(或者面罩)组成。
按照结构类型划分为鼻导管吸氧管、面罩吸氧管。
在此考虑到我市审批产品的实际情况,本技术审评规范不适用于附带具有加湿等其他功能的特殊吸氧管。
三、编写依据
本技术审评规范主要依据《医疗器械监督管理条例》、《医疗器械注册管理办法》(国家食品药品监督管理局局令第16 号)、《医疗器械临床试验规定》(国家食品药品监督管理局局令第5 号)、《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局局令第10 号)、《医疗器械标准管理办法》(国家食品药品监督管理局局令第31 号)。
产品的主要技术指标及工作原理的制定征求了北京市各主要生产吸氧管企业的意见,并结合了产品的特点,依据GB10010-2009 《医用软聚氯乙烯管材》的部分内容制定。
四、关于吸氧管规范制定过程中的一些考虑
经查询,目前吸氧管产品暂无相关国家标准和行业标准。
本规范结合产品特点和临床专家的意见,对该产品提出了基本的技术要求。
对于吸氧管的硬度和异嗅两个技术指标,在规范的制定过程中进行了如下
考虑:
1.本规范仅对吸氧管硬度提出了要求,但未给出具体数值。
企业应结合临床使用情况和产品的实际情况,制定相应的技术要求。
如邵氏硬度值在40-90 之间,且以聚氯乙烯树脂为原材料的吸氧管应执行GB10010-2009 《医用软聚氯乙烯管材》标准。
2 .由于目前的检测手段很难对吸氧管异嗅问题进行量化的要求,故本规范暂时仅对该指标提出定性要求,希望生产企业引起关注和重视,在临床使用过程中对异嗅情况进行评价和控制。
