一文读懂体外诊断试剂IVD
ivd体外诊断试剂标准及要求

ivd体外诊断试剂标准及要求体外诊断试剂是指应用于人体体液、组织和细胞外标本中的试剂,通过测定体液、组织和细胞外标本中的生物体、物质或标记物的变化来提供疾病的诊断、预测、监测、筛查和预后判断的信息。
它起着“通过实验研究,有助于诊断和预测疾病变化”的作用。
标准和要求是确保体外诊断试剂质量和安全性的重要依据。
一、质量控制的标准和要求1.试剂的准确性:体外诊断试剂应准确测量各种指标,其测试结果应与实际情况相符合。
试剂的准确性可以通过与参考方法和已知浓度样品进行比较来评估。
2.试剂的精密度:体外诊断试剂应具有良好的重复性和一致性,即重复测量同一样本应得到相似的结果。
试剂的精密性可以通过多次测定同一样本来评估。
3.试剂的灵敏度:体外诊断试剂应具有灵敏的检测能力,能够检测到生物体、物质或标记物的低浓度。
4.试剂的特异性:体外诊断试剂应具有良好的特异性,能够区分目标物与其他类似物质的差异。
5.试剂的稳定性:体外诊断试剂应具有良好的稳定性,即在有效期内能够保持其性能和质量不变。
6.试剂包装的标识:体外诊断试剂包装上应标明产品名称、规格、有效期、储存条件、使用方法、注意事项等必要信息,以便用户正确使用。
二、安全性的标准和要求1.试剂的毒性评估:体外诊断试剂应经过毒性评估,确保其对人体无毒、无刺激、无致敏等副作用。
2.试剂包装的鉴别和防护:体外诊断试剂应包装完好,能够有效防止试剂泄漏、污染和受潮,避免对人员和环境造成伤害。
3.应急处理和废弃物处理的规定:体外诊断试剂应有相应的应急处理措施和废弃物处理方法,以确保使用过程中人员和环境的安全。
4.用户培训和操作指南:体外诊断试剂生产商应提供相应的用户培训和操作指南,以确保用户正确操作和使用试剂。
三、生产和质量管理的标准和要求1.试剂生产工艺和设备:体外诊断试剂的生产应符合相关的质量管理规范,包括合格原材料的采购与控制、生产工艺的控制和调整,以及设备、环境和人员的合理管理。
ivd型式检验标准

ivd型式检验标准
IVD(体外诊断试剂)型式检验标准通常包括以下方面:
1.稳定性:体外诊断试剂随时间推移保持特性一致性的能力,是试剂必须具有的基本属性和重要指标。
效期稳定性通常在制造商规定的条件下进行试验,加速稳定性则通过设定温度、湿度、光或振动等极端条件考察体外诊断试剂的产品各项物理、化学、生物性能,从而推断体外诊断试剂有效期。
2.分析性能:通常包括稳定性、分析灵敏度、分析特异性、真实性(偏差)、精密度(重复性和重现性)、准确性(真实性和精密度的结果)、检出限和定量限、测量范围、线性、阳性判断值等指标。
在确定样本收集和处理适用标准及控制已知相关内源和外源干扰、交叉反应等方面,也可能需要特定的方法和标准。
ivd ldt icl 概念

IVD是"体外诊断产品"的缩写,是指在体外通过对体液、细胞等样本进行相关检测,从而对疾病进行诊断和监测的一类产品。
IVD产品被广泛应用于临床医学、预防保健、生物技术等领域,对于提高疾病诊断的准确性和速度起到了非常重要的作用。
I. IVD的基本概念IVD产品是一类特殊的医学器械产品,其研发、生产、销售需要严格遵循国家相关的法律法规和标准。
IVD产品包括临床化验诊断试剂、体外诊断仪器设备、血液制品、医疗检验系统等多个类别,涵盖了不同的功能和应用领域。
II. IVD的功能和作用IVD产品通过对样本的检测和分析,可以帮助医生对疾病进行早期的诊断、预防和监测。
与传统的临床检验方法相比,IVD产品具有更快速、准确、便捷的特点,为医疗诊断提供了更多的选择和支持。
III. IVD的发展和应用随着医疗技术和生物技术的不断发展,IVD产品的种类和功能也在不断扩展和改进。
一些新兴的技术,如基因测序、蛋白质组学、微流控技术等,为IVD产品的发展提供了新的机遇和挑战。
IVD产品已经广泛应用于临床诊断、药物研发、生物医药等领域,成为医学和生物技术领域的重要支撑。
IV. IVD的市场前景和发展趋势随着全球人口老龄化加剧、疾病谱的变化和医疗技术的进步,IVD产品市场呈现出快速增长的势头。
未来,随着生物技术和信息技术的深度融合,IVD产品将更加智能化、个性化,开发出更多适用于特定疾病的检测产品,为人类健康保驾护航。
V. IVD的发展机遇和挑战IVD产品的发展虽然前景广阔,但也面临着一些挑战。
包括技术创新、市场监管、产品质量控制等方面的问题,需要产、学、研各方通力合作,共同推动IVD产品的发展和应用。
VI. 结语IVD作为一种新兴的医学器械产品,在提高疾病诊断准确性、促进临床医学发展、保障人类健康方面发挥着越来越重要的作用。
我们期待IVD产品在未来能够更好地服务于人类健康事业,为全球的医疗与生物技术领域做出更大的贡献。
史上最全体外诊断IVD行业分析(2016~2020)

在检验科或独立实验室使用自动化和 高通量的仪器进行大样本量的检测。
专业实验室诊断
无需中心实验室,可直接在患者身旁 进行检测,能快速进行诊疗、护理、 病程观察,进而提高医疗质量,在ICU、 手术、急诊、诊所及患者家中渗透率 均逐步提高。
即时诊断(POCT)
2022/1/8
按检测条件和环境划分
1.IVD行业透视
2022/1/8
1.IVD行业透视
——行业界定
体外诊断,即IVD(In Vitro Diagnosis),是指在人体之外,使 用检测仪器和试剂对人体样本(血 液、体液、组织等)进行检测而获 取临床诊断信息,用于健康评价、 疾病诊断治疗和遗传疾病监测等。
2022/1/8
1.IVD行业透视
——行业分类 按检测方法和原理划分:
2022/1/8
1.IVD行业透视
——细分领域
PCR 技术经历三个发展时代。1985 年穆勒发明PCR 技术,在几十年中经历了从 定性PCR 到荧光定量PCR,再到数字式PCR 的发展过程: 定性PCR 技术,通过凝胶电泳得到定性检测结果,有交叉污染的风险。 实时荧光定量PCR(QPCR)是一种在DNA 扩增反应中,以荧光化学物质为
2022/1/8
1.IVD行业透视
——细分领域 生化诊断-细分
生化诊断中并非一定没有免疫反应。生化诊断和免疫诊断的分类主要是按照检 测项目来分,而并非完全依赖方法来分类,很多生化诊断中包含免疫反应。最 常见的就是在蛋白质检测中应用的免疫浊度法,该检测方法就包含抗原抗体特 异性结合的免疫反应过程,但归属于生化诊断项目。
2022/1/8
1.IVD行业透视
——细分领域
免疫诊断(Immunodiagnostics)是目前IVD市场占比最高的细分领域。利用
体外诊断行业(IVD)入门篇

体外诊断行业(IVD)入门篇体外诊断行业(IVD)入门篇前言:此文是一个月前为项目写的,针对的是IVD行业中的细分子行业——免疫诊断试剂。
由于IVD行业逐渐得到资本市场的重视,现稍作修改完善,供我自己梳理行业的大背景和投资思路之用。
$罗氏控股(RHHBY)$ $赛默飞世尔科技(TMO)$ $Alere Inc(ALR)$ $利德曼(SZ300289)$ $理邦仪器(SZ300206)$1. 什么是体外诊断(IVD)行业?IVD是指在人体之外通过对人体的血液等组织及分泌物进行检测获取临床诊断信息的产品和服务。
我国医院里俗称的“检验检查”中的“检验”包括了IVD的大多数细分种类——如①生化诊断(clinical chem)、②免疫诊断(immunoassay)、③分子诊断(MDx)、元素诊断、微生物诊断、尿液诊断、凝血类诊断、组织诊断、血液学和流式细胞诊断等。
其中前三类为我国医疗机构的主流IVD方式。
体外诊断按运用对象又可分为中心实验室用和④Poi nt-of-Care Test(POCT),两者的主要区别在于:1)即时性和易操作性。
由于POCT无需中心实验室,可直接在患者身旁进行检测,能快速进行诊疗、护理、病程观察,进而提高医疗质量,故在ICU、手术、急诊、诊所及患者家中渗透率均逐步提高。
2)试剂与分析仪器的匹配性。
在应用体外诊断试剂进行检测时,一般需要使用相应的检测仪器来分析结果(除了胶体金、生物芯片等)。
中心实验室用仪器为开放式系统,即任何厂家的试剂在同一台仪器上均可获得结果;而POCT诊断仪器多为封闭系统(如我们熟悉的血糖仪),依靠仪器带动耗材赚钱。
图1:按运用对象分类,广发研报以上这两点意味着POCT市场需求全面爆发,需要注意的是:一台POCT仪器上往往可以读取多种细分技术所制造出来的诊断试剂,如$雅培(ABT)$ 的i-STAT。
2. 我国IVD行业未来5-10年的发展方向?按技术成熟度来说:①生化诊断不论在国内亦或海外都已熟透,技术壁垒低,面临被其他更精确快速的诊断技术完全替代的风险,国内寡头中生北控、科华生物、利德曼对市场的垄断力非常强劲。
一文读懂体外诊断试剂注册单元划分

一文读懂体外诊断试剂注册单元划分一文读懂体外诊断试剂注册单元划分一、体外诊断试剂定义体外诊断试剂:是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。
可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
二、体外诊断试剂分类(一)第一类产品1.微生物培养基(不用于微生物鉴别和药敏试验);2.样本处理用产品,如溶血剂、稀释液、染色液等。
(二)第二类产品除已明确为第一类、第三类的产品,其他为第二类产品,主要包括:1.用于蛋白质检测的试剂;2.用于糖类检测的试剂;3.用于激素检测的试剂;4.用于酶类检测的试剂;5.用于酯类检测的试剂;6.用于维生素检测的试剂;7.用于无机离子检测的试剂;8.用于药物及药物代谢物检测的试剂;9.用于自身抗体检测的试剂;10.用于微生物鉴别或者药敏试验的试剂;11.用于其他生理、生化或者免疫功能指标检测的试剂。
(三)第三类产品1.与致病性病原体抗原、抗体以及核酸等检测相关的试剂;2.与血型、组织配型相关的试剂;3.与人类基因检测相关的试剂;4.与遗传性疾病相关的试剂;5.与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂;6.与治疗药物作用靶点检测相关的试剂;7.与肿瘤标志物检测相关的试剂;8.与变态反应(过敏原)相关的试剂。
三、注册单元划分基本原则依据《体外诊断试剂注册管理办法》(国家食品药品监督管理局局令第5号)二章附则第八十四条的规定,体外诊断试剂的注册或者备案单元应为单一试剂或者单一试剂盒,一个注册或者备案单元可以包括不同的包装规格。
1、外诊断试剂的注册单元应为单一试剂或者单一试剂盒,一个注册单元可以包括不同的包装规格。
2、校准品、质控品可以与配合使用的体外诊断试剂合并申请注册,也可以单独申请注册。
三、具体划分细则1.单一试剂盒是指用于完成某项或某一类检测所使用的所有试剂或部分试剂组合成的试剂盒存在形式,单一试剂是指组成试剂盒的所有以单独形式存在的试剂组份。
ivd体外诊断试剂标准及要求

ivd体外诊断试剂标准及要求IVD(In Vitro Diagnostic)体外诊断试剂是指用于检测人体样本中各种疾病标志物(包括但不限于蛋白质、荷瘤标志物、细胞因子、细菌、病毒等)的试剂盒。
由于其在临床诊断中的重要性,对其标准和要求也需要非常严格。
下面将介绍一下IVD体外诊断试剂的标准和要求。
首先,在试剂的物理特性方面,IVD体外诊断试剂需要达到一定的要求。
首先,试剂应具有足够的稳定性,不容易失活或降解,确保其能够保持长期有效。
其次,试剂需要具备一定的溶解性和溶液稳定性,以便在使用过程中能够方便地溶解,并保持一定的稳定性,不易引起试剂效果上的变化。
另外,试剂的包装也要符合一定的标准要求,包括密封性、防潮、耐热性等。
其次,在试剂的成分和纯度方面,也有一定的要求。
试剂的成分需要明确,并且纯度要达到一定的标准。
其中,关键成分的含量要足够高,以确保准确的检测结果。
此外,试剂中不能含有未列明或不允许使用的有害物质,否则可能对人体健康产生不良影响。
在制备过程中,也需要遵循一定的质量控制标准,确保试剂的质量稳定性。
另外,试剂的性能和准确性是IVD体外诊断试剂标准要求的重点。
试剂的性能需要符合一定的敏感性和特异性要求,即能够准确地检测出目标物质且没有误报。
试剂的准确性也很重要,即在实际临床应用中的检测结果与真实情况相符。
为了达到这些要求,试剂需要进行严格的验证和验证过程。
此外,IVD体外诊断试剂标准还要求试剂具备一定的可重复性和可靠性。
可重复性是指在相同条件下,试剂能够得到一致的结果;可靠性是指试剂能够在不同实验室和不同操作者之间得到相似的结果。
这是因为临床诊断往往需要多次重复测试,如果试剂的可重复性和可靠性不好,将会影响临床诊断结果的准确性和可信度。
最后,IVD体外诊断试剂标准要求试剂具备一定的安全性。
试剂的使用应符合一定的操作规范和安全要求,以避免对操作者和患者造成伤害或危险。
此外,对于一些可能具有传染性的标志物(如病毒),试剂需要具备灭活或去除的能力,以防止其传播。
ivd临床试验

安全性指标分析
不良反应
根据受试者的不良反应发生情况,包括类型、发 生率、严重程度、持续时间等方面进行分析,以 评估药物治疗的安全性。
心电图变化
对于涉及心脏毒性的药物,心电图变化可以作为 安全性指标进行分析。
实验室指标
实验室指标如肝肾功能、血常规等可以反映药物 对机体的作用,可以作为安全性指标进行分析。
有效性指标分析
临床疗效
根据试验组和对照组的临床症状、体征、实验室检查等指 标的变化,评价药物治疗的有效性。
生存分析
采用生存分析方法,比较试验组和对照组患者的生存时间 ,评估药物治疗对生存期的影响。
影像学评估
通过影像学检查,比较试验组和对照组肿瘤病灶的变化, 评估药物治疗对肿瘤的疗效。
病理学评估
通过病理学检查,观察药物治疗对组织病理学的影响,评 估药物治疗的疗效。
02
设计
试验方案设计
1 2
明确研究目的
在进行IVD临床试验前,必须明确研究目的和具 体试验方案,包括试验设计、观察指标、样本 量、试验周期等。
试验设计
根据研究目的选择适合的试验设计,如随机对 照试验、非随机对照试验、单臂试验等。
3
观察指标
为评估试验结果,需要确定合理的观察指标, 包括有效性指标、安全性指标等。
通过ivd临床试验,可以评估体外诊断 试剂的安全性和不良反应,保障患者 使用试剂的安全性和有效性。
ivd临床试验的分类
按照试验目的分类
ivd临床试验可以分为注册性试验 和验证性试验,其中注册性试验 主要用于试剂注册上市前的数据 支持,验证性试验主要用于已上 市试剂的性能验证和比较研究。
按照试验规模分类
确定试验对象的纳入标准和排除 标准,进行试验前的沟通和解释 ,签署知情同意书等。
体外诊断试剂简介

体外诊断试剂简介1.体外诊断试剂概况体外诊断,即In Vitro Diagnosis,缩写IVD,这是一个宽泛的概念,指在人体之外,通过对人体的样品(血液、体液、组织等)进行检测而获取临床诊断信息的产品和服务,包括试剂、试剂产品、校准材料、控制材料、成套工具、仪表、装置、设备或系统等等,包括血液检测、尿液检测等等。
1.1 体外诊断试剂是什么?体外诊断试剂隶属于生物制品行业,是下属诊断试剂行业中的一个细分领域。
体外诊断试剂是指用于单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
1.2 体外诊断试剂分类体外诊断试剂的分类方法比较多,主流的分类方法为按照检测原理或者检测方法分类。
根据检测原理或者检测方法,体外诊断试剂可以分为:生化诊断试剂、免疫诊断试剂、分子诊断试剂、微生物诊断试剂、尿液诊断试剂、凝血类诊断试剂、血液学和流式细胞诊断试剂等。
生化、免疫和分子诊断试剂为我国诊断试剂主要的三大类品种。
免疫诊断在原理上是利用抗原抗体的特异性结合,但是检测端的方法就比较多了,检测方式多样化,比如利用放射性元素的放射性而准确测量抗原抗体结合的放射免疫(放免)、利用氯金酸在特定环境下通过静电作用与蛋白质大分子结合的胶体金技术、利用活性酶作为标记物的酶联免疫(酶免)、利用镧系元素(稀土元素)螯合物荧光寿命长的特定进行检测的时间分辨荧光法(TRFIA)和利用化学发光原理和免疫反应原理相结合的化学发光检测(CLIA)。
放免由于对环境污染较大,现在逐渐被其他免疫诊断方法所替代,目前酶免是免疫诊断中比较主流的方法。
核酸诊断是目前分子诊断中的主要部分,另一种是生物芯片技术。
分子诊断的检测目标直接是决定生命性状的遗传物质和表现形式,包括DNA、RNA和蛋白质。
体外诊断试剂分析报告

体外诊断试剂(IVD)分析报告及建议体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
国家法定用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于《体外诊断试剂注册管理办法(试行)》的管理范围。
一、体外诊断试剂(IVD)市场分析中国体外诊断(IVD)产业兴起于20世纪80年代初期,经历近30年的发展,从无到有,从弱到强,现在整个产业已经具备了规模化发展条件。
中国诊断产品用户主要包括19800 多家医院、39000多个乡镇卫生院和300多家血站,以及日新月异的体检中心和正在兴起的临床检验独立实验室。
总体来看,中国诊断行业仍处在成长初期目前,我国诊断试剂市场基本可以分成7个部分,其中免疫学诊断试剂市场规模最大,市场份额29.61%,其次是:生化诊断试剂,血糖自我监测试剂血液诊断试剂,尿液诊断试剂,生物学诊断试剂3.97%,分子及其他诊断试剂12.01%。
分子诊断试剂是20世纪80年代后期发展起来的,无论技术还是市场,都是目前所有诊断试剂产品中发展最快的。
免疫诊断试剂的市场规模已逐渐超过临床化学试剂,但由于二者的检验对象有所区别,生化诊断试剂还将保持较大份额。
据《2013-2017年中国诊断试剂行业产销需求与投资预测分析报告》[4]分析,2007-2009年中国诊断试剂行业的市场规模年复合增长率达17.93%,呈现高速增长趋势。
2009年中国诊断试剂市场规模达到96.72亿元,人均年费用为7.3元,而日本2008年人均年使用量为227.5元,差距悬殊。
总体来看,中国诊断行业仍处在成长期初期。
诊断试剂行业是生物制药行业的重要组成部分,就国内的现状来说,中国的诊断试剂仍处于弱小成长期,才处于产品研发与生产的投入初期,成长期还没有真正到来。
一文读懂体外诊断试剂IVD

一文读懂体外诊断试剂IVD现如今去医院看病基本上都是医生未见,诊断先行,血检、尿检早已习以为常,而这些检查都是基于体外诊断试剂。
体外诊断试剂也以其精准性、便易性和高效性在整个医疗过程中占据越来越重要的位置,在现代医疗体系中不仅能大大降低医生的工作量,同时也极大的提高了诊断的准确性以及对疾病的预防性,因此,体外诊断又有着“医生的眼镜”之美誉。
今天的每日课堂栏目就一起来学习下体外诊断试剂IVD是什么。
IVD定义业内人士俗称其为IVD也就是英文In Vitro Diagnostic。
体外诊断试剂和器械在国外统一称为体外诊断医疗器械。
属于医疗器械的一部分。
在我国,体外诊断试剂是指:可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
内涵及市场分类体外诊断产品包括对人体样本(包括体液、细胞、组织样本等)进行收集、制备(定向处理)、检测的试剂仪器及分析系统。
通常体外诊断市场主要分为四大类:生化试剂、免疫诊断、分子诊断、即时检验(POCT)。
据《蓝皮书》数据:2014年,体外诊断细分领域占其总体市场比例前三位:占比接近四成的免疫诊断(38%)、占比接近两成的生化试剂(19%)和占比为15%的分子诊断。
目前市场份额占比最大的是免疫诊断。
其中生化试剂类产品主要以国产品牌为主;免疫诊断类产品以进口为主导,国产品牌占有一定份额;分子诊断类产品则是进口和国产品牌鱼龙混杂;而在POCT类产品方面,是以进口为主,国产尚处于起步阶段。
国内体外诊断产业现状中国医药工业信息中心发布的《蓝皮书》显示:2014年我国医疗器械市场总量达到2760亿元,依据市场占比来看,前三位的依次是:市场占比接近两成的医学影像设备(19%)、市场占比为16%的体外诊断产品和市场占比为13%的高值医用耗材及植入物。
一文读懂IVD,最全体外诊断试剂产品分类细则及市场概览!

一文读懂IVD,最全体外诊断试剂产品分类细则及市场概览!说到医疗器械,我们经常会问:你是做什么产品的?做哪个科室的产品?相比于各种设备,我们做体外诊断试剂的亲也不在少数,所以今天我们就来说说这个体外诊断试剂。
详细为大家普及一下体外诊断试剂产品的分类细则,一文搞懂何为IVD(体外诊断试剂),不做IVD的亲也要好好看看哦~毕竟以后装逼就靠它了~体外诊断试剂体外诊断试剂和器械在国外统一称为体外诊断医疗器械。
属于医疗器械的一部分。
在我国,体外诊断试剂是指:可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样本( 各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品( 物) 、质控品( 物)等。
根据产品风险程度的高低,体外诊断试剂依次分为第三类、第二类、第一类产品。
注:1、对于第二类产品中的新产品(未在国内批准注册的产品或被测物相同但分析灵敏度指标不在国家已批准注册产品范围内,且具有新的临床诊断意义),采用与第三类产品相同的技术要求。
2、如有不能按照上述原则进行界定的试剂产品,由国家食品药品监督管理局组织界定。
3、国家法定用于血源筛选的体外诊断试剂、采用放射性核素标记的体外诊断试剂不属于本办法管理的范围。
中国的IVD市场:特点:市场大;进口试剂及诊断仪器的垄断优势正在被民族产品打破和制约。
中国的IVD市场起步晚,但成长速度较快。
并且在国内IVD市场中,进口仪器和试剂占据了50%以上份额,尤其是全封闭检测系统在三甲等医疗机构中更是占据主要地位,未来进口替代空间巨大。
我们保守认为未来5年内,IVD行业在国内依旧能保持15%以上的较快增速。
目前国内体外诊断主要集中在3大领域:生化诊断试剂市场、免疫诊断试剂市场和血液学与流式细胞市场。
中国IVD市场规模(亿元)国内体外诊断市场不同产品分布IVD国内市场竞争目前国内体外诊断市场中,不仅包含了西门子、罗氏、雅培、强生等国际巨头,很多优秀的国内企业也脱颖而出,逐渐获得一定市场份额。
IVD体外诊断试剂液体辅助试剂分类界定

IVD体外诊断试剂液体辅助试剂分类界定体外诊断试剂液体辅助试剂是指在体外诊断检测中起辅助作用,不参与或间接参与检测反应,但在完成整个体外诊断检测项目过程时不可或缺的一类产品。
它们在间接参与反应时主要为特定的检测反应提供必要的反应条件与环境,或仅仅参与检测反应中非特异性的、系统的共同的反应。
主要包括:清洗液、反应物质溶解液、反应物质稀释液、样本预处理液、样本保存溶液、缓冲液、染色液及其封闭剂、显色液、第二抗体溶液(本文中第二抗体溶液不包含直接参与反应形成双抗体夹心的第二株特异性抗体)等。
1 ,常见体外诊断试剂液体辅助试剂包括的内容1.1清洗液。
用于检测反应中对仪器管路及部件或反应体系进行清洗的试剂,可分为:1.1.1仪器管路清洗液,仅用于相关仪器、实验用具的清洗,不参与任何反应。
如:“血细胞分析仪用清洗液”,用于血细胞分析仪管路的清洗;“生化分析仪用浓缩洗涤液”,用于生化分析仪上探针的洗涤。
1.1.2反应体系清洗液,用于在检测反应过程中对反应体系的清洗。
如:常见的清洗液、洗涤液等。
1.2反应物质溶解液。
用于经冷冻干燥或其他附着于固体材料上的反应物质的溶解,经溶解后的反应物质直接参与检测反应,可分为以下两类。
1.2.1通用反应物质溶解液,适用于一个反应体系中的一系列检测反应的样本或反应物质的溶解。
1.2.2专用反应物质溶解液,适用于某一个特定检测反应的样本或反应物质的溶解。
如:进口产品“触发液”,用于血小板功能检测开始前润湿生物膜,将反应物质溶解到反应体系中,保证反应正常进行,是血小板功能检测的辅助试剂。
1.3反应物质稀释液。
用于稀释待检样本或原试剂,降低它们的浓度,经稀释后的样本或试剂直接参与检测反应。
如:“生化分析仪用样品稀释液”,为Tris缓冲液,适用于对该生化分析仪上多种检测项目待检样品的稀释。
1.4样本预处理液。
用于正式检测前的样本分离、提取、纯化、酶切等过程,包括:提取液、纯化液、脱水试剂、消化酶溶液等。
中国体外诊断行业(IVD)简介

中国体外诊断行业(IVD)简介什么是中国IVD?“IVD”是英文in vitro diagnostic products的缩写,中文译为体外诊断产品。
在国际上,IVD作为医疗器械的一个独立分支,拥有其特有的界定和法规监管体系,特别是美国食品药品监督管理局(FDA)与欧盟(EC)。
IVD主要包括用于体外诊断的仪器、试剂或系统。
但在中国情况却不同,IVD未被独立区分与界定,即没有IVD的概念。
而国际上通常的IVD 概念所包括的产品被打散,分别从属于医疗器械(Medical Devices,MD)、体外诊断试剂(IVD Reagents) 以及药品中。
在中国,除用于血源筛查与采用放射性核素标记被界定归属药品管理的体外诊断试剂,其它全部IVD产品均隶属于医疗器械(MD)。
医疗器械的定义在中国国务院2000年276号文《医疗器械监督管理条例》规定。
医疗器械是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件;其用于人体体表及体内的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手段参与并起一定的辅助作用;其使用旨在达到下列预期目的:(一)对疾病的预防、诊断、治疗、监护、缓解;(二)对损伤或者残疾的诊断、治疗、监护、缓解、补偿;(三)对解剖或者生理过程的研究、替代、调节;(四)妊娠控制。
并且规定对医疗器械实行分类管理。
根据风险以及采取的措施分为三级,由低到高为:第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。
第二类是指,对其安全性、有效性应当加以控制的医疗器械。
第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。
但是依据实际需要,又将IVD试剂单独界定、独立管理。
并于2007年4至5月出台了从质量管理、生产、产品注册到经营的一系列法规与规则。
对体外诊断试剂的定义在2007年6月1日起实施的《体外诊断试剂注册管理办法(试行)》中有明确规定,即体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
ivd是什么意思

ivd是什么意思
IVD是英文in vitro diagnostic products的缩写,是指体外诊断
产品。
IVD作为医疗器械的分支,有特有的界定和法规监管。
IVD主要包
括用于体外诊断的仪器、试剂或系统。
IVD的主要目的:
1、对疾病的预防、诊断、治疗、监护、缓解;
2、对损伤或者残疾的诊断、治疗、监护、缓解、痊愈、补偿;
3、对解剖或者生理过程的研究、调节;
4、妊娠控制。
扩展资料:
IVD的应用:
1、蛋白诊断
IVD抗体诊断是最常使用蛋白诊断技术,是利用抗原抗体特异性结合,同时搭配发光或者颜色变化放大检测信号的方法。
蛋白诊断的检测结果灵敏、检测速度快、操作简单、不需要仪器辅助,但研发滞后于核酸诊断,必须制备出相应抗体才能投入使用,但现在IVD
抗体诊断在美国发挥着重要作用。
2、下一代基因测序诊断
IVD基因测序诊断方法更适合于定制化服务,比如通过羊水穿刺对胎
儿进行基因检测,分析胎儿是否患有重大疾病等。
IVD-从六个维度概览IVD行业全貌

防黑箱理论在人类认识世界、从事科学研究的时候,常常会遇到这样的情况,有一些我们所要认识或控制的客体,由于种种条件的限制,其内部的结构一时不能够(不允许或不容易)被我们直接观测到,仿佛是一个既不透明又密闭的箱子,其复杂的结构和机理深藏其中,人们无法从外部直接打开来一探其个中奥秘。
传统的中医学说,人体就是这样一个黑箱;现在检验医学发展至今,其中的体外诊断技术同样也是力求通过外部检测的方式对人体这样精妙的封闭系统进行精确的分析来判断健康状况。
体外诊断是一个比较复杂、检测分类繁多、技术快速革新的行业,因此仅一次概括和总结很难面面俱到,此次分享主要通过对体外诊断行业进行以下六个方面的分解,以期望大家能概览其全貌。
01 概念及分类A基本概念体外诊断(IVD , In-Vitro Diagnostics )是指将血液、体液、组织等样本从人体中取出,使用体外检测试剂、试剂盒、校准物、质控物等对样本进行检测与校验,以便对疾病进行预防、诊断、治疗检测、后期观察、健康评价、遗传疾病预测等的过程。
由此,我们可以看出,体外诊断涵盖甚广,在疾病的预防、诊断检测以及愈后评价等方方面面皆有应用,是医疗健康产业十分重要的组成部分。
体外诊断包括诊断仪器和诊断试剂两个部分。
其中体外诊断仪器归属于医疗器械二级分类下的临床检验分析仪器,而诊断试剂则属于生物医药制品中的生物制品大类。
A 主要技术基础从根本上来讲,任何行业的发展都离不开科学研究的进步。
体外诊断在生 物医药领域主要依赖生物化学、遗传学、分子生物学、分子影像学、细胞 学、免疫学、微生物学这几大学科的发展,且大致经历了三个主要的发展 阶段:20世纪以前,显微镜的发明催生了以微生物镜检为主的一些传统检验手 段; 20世纪初,酶催化反应、抗体抗原反应的发现为生化和免疫诊断奠定了 根基,行业逐步兴起;20世纪上半页,DNA 双螺旋结构的发现、单克隆抗体和大分子标记技术 的开发,使得行业发展迈入了分子诊断的崭新时代。
教你如何进行体外诊断试剂(IVD)的临床试验

教你如何进行体外诊断试剂(IVD)的临床试验一文对体外诊断试剂(IVD)临床试验部分的解读体外诊断试剂(IVD)临床试验定义体外诊断试剂的临床试验(包括与已上市产品进行的比较研究试验)是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。
临床试验注意的问题1.临床机构的选择2.临床试验方案3.参比系统的选择4.样品种类和数量5.临床试验数据的统计和分析法规对临床机构的要求1.第三类体外诊断试剂申请人应当选定不少于3家(含3家)、第二类体外诊断试剂申请人应当选定不少于2家(含2家)临床试验机构,按照有关规定开展临床试验。
2.体外诊断试剂的临床试验机构应获得国家食品药品监督管理总局资质认可。
3.申请人应根据产品特点及其预期用途,综合不同地区人种、流行病学背景、病原微生物的特性等因素选择临床试验机构。
临床试验机构必须具有与试验用体外诊断试剂相适应的专业技术人员及仪器设备,并能够确保该项试验的实施。
临床试验前的准备工作1.提交证件:营业执照、医疗器械生产企业许可证、医疗器械经营企业许可证、机构代码等2.提交注册检验报告3.提交说明书:考核试剂的说明书、参比试剂说明书4.自检报告5.提交食品药品监督管理部门备案情况说明6.与临床试验机构签订协议伦理的不同点1.临床试验必须符合赫尔辛基宣言的伦理学准则,必须获得临床试验机构伦理委员会的同意。
2.研究者应考虑临床研究用样本,如血液、羊水、胸水、腹水、组织液、胸积液、组织切片、骨髓等的获得或研究结果对受试者的风险性,应提交伦理委员会的审查意见及受试者的知情同意书。
3.对于例外情况,如客观上不可能获得受试者的知情同意或该临床研究对受试者几乎没有风险,可不提交伦理委员会的审评意见及受试者的知情同意书,但临床研究者应提供有关伦理事宜的说明。
4.对于例外情况,如客观上不可能获得受试者的知情同意或该临床试验对受试者几乎没有风险,可经伦理委员会审查和批准后免于受试者的知情同意。
【生物医药行业专题】一张图看懂体外诊断

【生物医药行业专题】一张图看懂体外诊断
注:此为G45产业研究团队研究成果,如需转载请注明,转自G45产业研究(G45industry),谢谢!
体外诊断的概念及分类
体外诊断,IVD(in-Vitro Diagnostics),是指在人体之外,通过对人体的样品(血液、体液、组织等)进行检测而获取临床诊断信息的产品和服务。
包括诊断仪器、诊断试剂及相关的校准质控等周边耗材。
体外诊断分类
政策及市场
政策导向:政策积极鼓励发展分子诊断和POCT两大领域
市场格局:免疫诊断、分子诊断和POCT未来增长潜力较大
企业布局
我国京津冀、长三角、珠三角三大都市圈,依托科研技术、人才优势形成产业集聚区;中西部地区依托政策和成本优势,快速发展。
京津冀格局:
· 北京科研优势突出,分子诊断占国内绝对优势、免疫诊断技术突破、POCT龙头布局;
· 技术新兴领域企业,研发中心布局北京,产业化环节逐步向河北、天津转移外溢。
体外诊断IVD 产品分类及检测物质
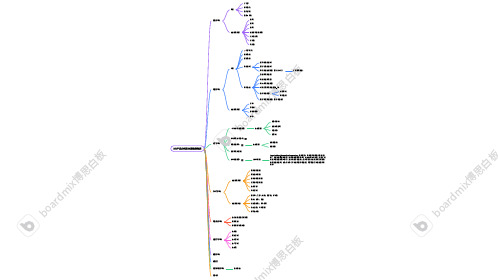
IVD 产品分类及主要检测物质⽣化诊断免疫诊断分⼦诊断POCT 诊断微⽣物诊断⾎液学诊断尿液诊断质谱仪流式细胞诊断流⽔线类别主要测定物质种类主要测定物质PCR 聚合酶链反应FISH 荧光原位杂交液态基因芯⽚流式荧光多重检NGS 基因测序主要测定物质主要应⽤场景全⾃动微⽣物分析系统药敏实验细菌培养形态观察⾎细胞凝⾎分析⾎球分析⾎⽓分析⾎型仪流式细胞⼲化学液体⽣化⽣化试剂⽣免⼀体机酶类糖类酯类蛋⽩和⾮蛋⽩氮类⽆机离⼦类肝功能肾功能化学发光酶联免疫放射免疫免疫层析荧光免疫肝炎传染病肿瘤标志物早孕主要检测主要检测tNGS 检测药物残留检测凝⾎指标检测肿瘤标志物检测过敏原快速检测⾎液⼄醇毒物分析救护⻋、⻔诊、病房、监护室、⼿术室海关、禁毒、法医社区保健站、私⼈诊所⻝品卫⽣、环境检测采供⾎机构胶体⾦免疫层析量⼦点免疫层析荧光免疫层析检测(常⻅POCT )直接荧光免疫法间接免疫荧光法夹⼼荧光免疫检测时间分辨荧光免疫法TR-FIA流式细胞检测数字荧光免疫检测(数字微流控)感染性疾病肿瘤早期诊断优⽣优育遗传病致病微⽣物癌症基因targeted Next-Generation Sequencing ,靶向测序。
靶向测序通常⽤于临床诊断,特别是癌症基因组学、遗传疾病检测等领域。
是 NGS 的⼀种形式,专注于特定区域或基因组的⼀部分,⽽不是整个基因组。
这种⽅法可以更⾼效地分析感兴趣的基因或区域,因为它减少了不必要的测序数据量,使得数据分析更加集中和⾼效⼲式荧光免疫悬浮阵列荧光微球bo a r d mi x 博思⽩板bo a r d m i x 博思⽩板bo a r d mi x 博思⽩板ix 博思⽩板。
一文读懂体外诊断试剂IVD

一文读懂体外诊断试剂IVD现如今去医院看病基本上都是医生未见,诊断先行,血检、尿检早已习以为常,而这些检查都是基于体外诊断试剂。
体外诊断试剂也以其精准性、便易性和高效性在整个医疗过程中占据越来越重要的位置,在现代医疗体系中不仅能大大降低医生的工作量,同时也极大的提高了诊断的准确性以及对疾病的预防性,因此,体外诊断又有着“医生的眼镜”之美誉。
今天的每日课堂栏目就一起来学习下体外诊断试剂IVD是什么。
IVD定义业内人士俗称其为IVD也就是英文In Vitro Diagnostic。
体外诊断试剂和器械在国外统一称为体外诊断医疗器械。
属于医疗器械的一部分。
在我国,体外诊断试剂是指:可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
内涵及市场分类体外诊断产品包括对人体样本(包括体液、细胞、组织样本等)进行收集、制备(定向处理)、检测的试剂仪器及分析系统。
通常体外诊断市场主要分为四大类:生化试剂、免疫诊断、分子诊断、即时检验(POCT)。
据《蓝皮书》数据:2014年,体外诊断细分领域占其总体市场比例前三位:占比接近四成的免疫诊断(38%)、占比接近两成的生化试剂(19%)和占比为15%的分子诊断。
目前市场份额占比最大的是免疫诊断。
其中生化试剂类产品主要以国产品牌为主;免疫诊断类产品以进口为主导,国产品牌占有一定份额;分子诊断类产品则是进口和国产品牌鱼龙混杂;而在POCT类产品方面,是以进口为主,国产尚处于起步阶段。
国内体外诊断产业现状中国医药工业信息中心发布的《蓝皮书》显示:2014年我国医疗器械市场总量达到2760亿元,依据市场占比来看,前三位的依次是:市场占比接近两成的医学影像设备(19%)、市场占比为16%的体外诊断产品和市场占比为13%的高值医用耗材及植入物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一文读懂体外诊断试剂IVD
现如今去医院看病基本上都是医生未见,诊断先行,血检、尿检早已习以为常,而这些检查都是基于体外诊断试剂。
体外诊断试剂也以其精准性、便易性和高效性在整个医疗过程中占据越来越重要的位置,在现代医疗彳本系中不仅能大大降低医生的工作量,同时也极大的提高了诊断的准确性以及对疾病的预防性,因此,体外诊断又有着“医生的眼镜”之美誉。
今天的每日课堂栏目就一起来学习下体外诊断试剂IVD是什么。
IVD定义
业内人士俗称其为IVD也就是英文InVitroDiagnostic。
体外诊断试剂和器械在国外统一称为体外诊断医疗器械。
属于医疗器械的一部分。
在我国,体外诊断试剂是指:可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)等。
内涵及市场分类
彳本外诊断产品包括对人彳本样本(包括彳本液、细胞、组织样本等)进行收集、制备(定向处理)、检测的试剂仪器及分析系统。
通常体外诊断市场主要分为四大类:生化试剂、免疫诊断、分子诊断、即时检验(POCT)。
据《蓝皮书》数据:2014年,体外诊断细分领域占其总体市
场比例前三位:占比接近四成的免疫诊断(38%)、占比接近两成的生化试剂(19%)和占比为15%的分子诊断。
目前市场份额占比最大的是免疫诊断。
其中生化试剂类产品主要以国产品牌为主;免疫诊断类产品以进口为主导,国产品牌占有一定份额;分子诊断类产品则是进口和国产品牌鱼龙混杂;而在POCT类产品方面,是以进口为主,国产尚处于起步阶段。
国内体外诊断产业现状
中国医药工业信息中心发布的《蓝皮书》显示:2014年我国医疗器械市场总量达到2760亿元,依据市场占比来看,前三位的依次是:市场占比接近两成的医学影像设备(19%)、市场占比为16%的体外诊断产品和市场占比为13%的高值医用耗材及植入物。
IVD行业已成为整个医械市场的一个重要增长极。
■中国体外诊断试別市场圾閏仁元
我国偉;外惟画试割帘场细分tWSr方式)
临辰生比
血液学与盅式
细胞仪
而有数据显示:国内体外诊断产品市场一直为国外几家大的跨国公司所牢牢占据,罗氏(Roche)、雅培(Abbott)等5家国际行业巨头目前占据37%多的国内体外诊断试剂市场份额。
而国产体外诊断产品品牌却处于相对弱势地位,不但在国际市场上知名度和认可度低,就是在国内三甲医院的采购单上也难觅踪迹。
来自食品药品监督管理部门的资料显示:我国体外诊断产品生产企业众多,规模大小也是参差不齐,产品质量水平更是差距明显。
具体目前仅体外诊断试剂产品注册总数就达到1.7万个,生产企业在1000家左右,经营企业在9000家左右,而在使用环节上,光医院就有近2.6万家。
同时在《蓝皮书》中也指出:目前国内大多数体外诊断生产企业的规模十分有限,年销售收入达到5亿元规模的企业屈指可数。
目前国内市场上较大的体外诊断生产商主要为夕卜资品牌有罗氏、雅培、西门子医学诊断;国内本土品牌有科华生物、迈瑞医疗、达安基因等。
而从企业聚集区域来看,依然以珠三角、长三角和京津冀地区为龙头,尤其是位于珠三角的广东深圳和珠海两市拥有国内知名的业内企业月前该省的体外诊断试剂产业在全国占有相当的份额,在生产经营企业数量、生产总值以及监督抽检合格率等各项数据指标上都位居全国前列。
未来发展
医疗市场规模的逐渐扩大和健康意识的逐渐加深沫来体外诊断市场规模依然潜力巨大。
据中国医药工业信息中心的预测,2019年我国体外诊断市场规模将达到723亿元。
北京天坛医院试验诊断中心主任、首都医科大学临床检验诊断学系主任康熙雄教授曾指出:体外诊断具有大诊断、自动化、高通量、简易化、信息流和床旁化六大特征,而其产品的主流发展方向是个体化、快速化、样本少量化、装备一体化、床旁化、设备小型化、手机化、APP软件化等。
此外,中南大学湘雅三院检验科主任伍勇教授指出,分子诊断技术在个体化诊断应用方面具有重要价值,而基因芯片又是分子诊断技术中最具发展前途的领域。
总结起来就是朝着个体化、床旁化、便易化发展;也就是说在未来,分子诊断领域和POCT是体外诊断最具发展潜力的两个领域。
中国医药工业信息中心也指出,从主要产品类别的增长潜力来看,从低到高依次是血液检测、临床生化、其他产品(包括细胞诊断、微生物诊断、凝血诊断
等)、免疫化学、分子诊断、床旁检测。
也在此印证了未来分子诊断和POCT将是发展的重心,也将是未来市场竞争的主要领域。
体外诊断试剂公司排行
全球IVD公司排行
排名国寡
1R.oche<氏]|瑞士
2Abtott(雅培)「|美国
Siemens-[克i门子〕德国
X JohnEcm&Johnion(强竺I美国
5BeckmanCoulter'.i.贝克曼库尔特]美国
&BeetonDickm&on.:(碧迪\美国
7Th.emioFisher赛默飞i»美国
S Alere〔美艾利尔]美国
9bicMeneux:.(生物梅昱埃缓_|法国
10Bayei.C拜耳):美国
11Sy&me.\(希森美)日丰
12Bio-Rad(怕乐〕美国
13Kovarti^Diagnostics g诺华d美国
14InstrunierLtationLaLs HL)西班牙
15Arkray〔量科来)日本
16Gen-Piobe(根普博}美国
1~Qiisen.1凯需忑|芬兰
1S LidicmeteLDamhwrJ丹纳赫-宙jf米将)丹麦
合4
中国IVD公司排行
序号主宴产品
1科华生物免疫诊断仪器和试和九强生物主化诊断试剂
3达安基因核酸谡断试剂
4利徳曼生化诊斷试剂。
