陶瓷的晶体结构
陶瓷材料的晶体结构

主要特征
8.63
无方向性,高配位数,
7.94
低温不导电,高温离子
7.20
导电
6.90
1.37 1.68 3.87 3.11
1.63 1.11 0.931 0.852
方向性,低配位数,纯 金属低温导电率很小
陶瓷无材方料向的性,化高学配键位?数,
密度高,导电性高,塑 性好
0.020 0.078
低熔点、沸点压缩系数 大,保留分子性质
原子对价电子的束缚强弱。
Company Logo
陶瓷的晶体结构
First ionization energies as a function of atomic number
C原子的电离能(eV) I1: 11.260 I2: 24.383 I3: 47.887 I4: 64.492 I5: 392.077 I6: 489.981
0.52 0.30
结合力高于无氢键分子
Company Logo
陶瓷的晶体结构
2.1 离子晶体的结构规则—鲍林规则
陶瓷化合物的结合键:离子键与共价键混合。 金属正离子与非金属离子组成的化合物通常不是纯粹的 离子化合物,性质不能只用离子键来解释。
离子键的比例取决于组成元素的电负性差,电负性相差 越大,离子键比例越高。
鲍林给电负性下的定义为“电负性是元素的原子在化合物中吸 引电子能力的标度”。
元素电负性数值越大,表示其原子在化合物中吸引电子的能力 越强;反之,电负性数值越小,相应原子在化合物中吸引电子 的能力越弱(稀有气体原子除外)。
Company Logo
陶瓷的晶体结构
2.1 离子晶体的结构规则—鲍林规则 原子负电性的概念:
Si
陶瓷导论

陶瓷导论第一章 陶瓷总论以粉体为原料,通过成型和烧结等所制得的无机非金属材料制品统称为陶瓷。
本章主要介绍陶瓷的种类、陶瓷的晶体结构和玻璃体结构、陶瓷的显微组织和相变、陶瓷的力学性质和热学性能以及陶瓷的制造工艺等。
陶瓷的种类繁多,根据陶瓷的化学组成、性能特点、通途等不同,可讲陶瓷分为普通陶瓷和特殊陶瓷两大类。
1.1.1普通陶瓷普通陶瓷又称传统陶瓷,主要是由①粘土、②长石和③石英为原料而制成的,故又称为三组分陶瓷。
1具有某种独特性能的新型陶瓷称为特殊陶瓷。
按照显微结构和基本性能,可将特殊陶瓷分为结构陶瓷、功能陶瓷、智能陶瓷、纳米陶瓷和陶瓷基复合材料。
①粘土由多种水合硅酸盐和一定量的氧化铝、碱金属氧化物和碱土金属氧化物组成,并含有石英、长石、云母及硫酸盐、硫化物、碳酸盐等杂质。
粘土矿物用水湿润后具有可塑性,在较小压力下可以变形并能长久保持原状,而且比表面积大,颗粒上带有负电性,因此有很好的物理吸附性和表面化学活性,具有与其他阳离子交换的能力。
主要产地有江苏苏州、湖北均县、四川叙永县等地。
粘土具有颗粒细、可塑性强、结合性好,触变性过度,收缩适宜,耐火度高等工艺性能,因而,粘土是成为瓷器的基础。
它主要有瓷土、陶土和耐火土粘土等三类,据矿物的结构与组成的不同,陶瓷工业所用粘土中的主要粘土矿物有高岭石类、蒙脱石类和伊利石(水云母)等三种,另外还有较少见的水铝石。
②长石是长石族岩石引的总称,它是一类含钙、钠和钾的铝硅酸盐类矿物。
为地壳中最常见的矿物,比例达到60%,在火成岩、变质岩、沉积岩中都可出现。
③石英,无机矿物质,主要成分是二氧化硅,常含有少量杂质成分如Al2O3、、CaO 、MgO 等,为半透明或不透明的晶体,一般乳白色,质地坚硬。
石英是一种物理性质和化学性质均十分稳定的矿产资源, 它是非可塑性原料,其与粘土在高温中生成的莫来石晶体赋予瓷器较高的机械强度和化学稳定性,并能增加坯体的半透明性,是配制白釉的良好原料。
材料化学之陶瓷

光学陶瓷
பைடு நூலகம்
荧光性
红外透过性
Al2O3
CaAs
激光
红外线窗口
高透明性
电发色效应
SiO2
WO3 ZnFe2O SrO CdS VO2 BaO 多种金属氧化物 PZT
光导纤维
显示器 磁带 电声器件 太阳电池 温度传感器 热阴极 催化剂 超声成像
磁性陶瓷 半导体陶瓷
软磁性 硬磁性 光电效应 阻抗温度变化效应 热电子放射效应
陶瓷一般结构
形成:加工过程中形成。 含量:0—90% 气孔包括开孔和闭孔
合理控制气孔数量、 形态和分布对保证陶 瓷成品诸多性能十分 重要。
陶瓷的基本性质
具有金属光泽,如WC、TaC等。
导电性接近金属,如金属锆的电阻率为
0.41×10-4 Ώ〃cm 间隙相陶瓷在保持与原金属相近的导电性 同时,却表现出比金属更高的硬度。如金属 钨、WC、TiC
多功能化
低维化
化学响应陶瓷 生物陶瓷
化学反应性 生物活性 生物物理响应
结构 陶瓷
特种陶瓷 光声电 磁热、 生物、 化学等 性能陶 瓷
功能陶瓷
我们是“压 电陶瓷点火 器”
传统陶瓷的大观
功能陶瓷研究进展与发展趋势 电介质陶瓷
压电铁电陶瓷
半导体陶瓷 快离子导体陶瓷 高温超导陶瓷
功能陶瓷 发展的趋 势特点
复合化
06
功能陶瓷
功能陶瓷是指其自身具有 某方面的物理化学特性,表 现出对点、光、磁、化学和 生物环境产生响应的特征性 陶瓷。
功能陶瓷的分类
种类 电子陶瓷
性能特征 绝缘性 热电学 压电性 强介电性 主要组成 Al2O3、Mg2SiO4 PbTiO3、BaTiO3 PbTiO3、LiNbO3 BaTiO3 用途 集成电路基板 热敏电阻 振荡器 电容器
结构陶瓷3(SiC)

发生化学反应,使坯件质量增加,孔隙减小,并烧结 成具有一定强度和尺寸精度的成品的工艺。
α-SiC粉+石墨粉→多孔胚体 液态Si β-SiC
4)反应烧结:通过多孔坯件同气相或液相
反应烧结可制得形状复杂的致密SiC陶瓷, 并且具有良好的抗热震性,同其它烧结工艺比较, 反应烧结在致密过程中的尺寸变化小,可以制造尺 寸精确的制品 烧结体中相当数量游离Si的存在,使得反应 烧结的SiC陶瓷高温性能较差
2.2 SiC的热学性质 的
∗ 只作较粗略计算时,碳化硅的平均热膨胀系数在25~ 1400℃范围内可以取4.4×10-6/℃。SiC的热膨胀系数 测定结果表明:其量值与其他磨料及高温材料相比要 小得多,如刚玉的热膨胀系数可高达(7~8)×10-6/℃ ∗ SiC的导热系数很高,这是SiC物理性能方面的另一个 重要特点。它的导热系数比其他耐火材料及磨料要大 的多,约为刚玉导热系数的4倍
SiC陶瓷 陶瓷
内容提要
∗ SiC晶体结构 ∗ SiC性质 ∗ SiC陶瓷及其应用 ∗ SiC陶瓷的制备
1 SiC晶体结构
∗ SiC主要为共价键,SiC晶体中存在呈四面体空间排列 的杂化键sp3 ∗ SiC晶格结构中单位晶胞:Si-C面配位体 ∗ 所有结构均由SiC四面体堆积而成,所不同的只是平 行结合或者反平行结合
2)热压烧结:将干燥粉料充填入模型内,再从 )热压烧结
热压烧结工艺只能制备形状简单的SiC部件, 而且一次热压烧结过程中所制备的产品数量很小, 因此不利于工业化生产
3)热等静压烧结 )
Duna以B和C为添加剂,采用热等静压烧结工艺, 在1900℃便获得了密度大于98%、室温抗弯强度高达 600MPa左右的细晶SiC陶瓷 研究表明:当SiC粉末的粒径小于0.6μm时,即 使不引入任何添加剂,通过热等静压烧结,在 1950℃即可使其致密化 尽管热等静压烧结可获得形状复杂的致密SiC制 品,并且制品具有较好的力学性能,但是HIP烧结必 须对素坯进行包封,所以很难实现工业化生产
陶瓷晶界和各类固体分界面

杂质在分界面外的作用有: (1)使界面可动离子电荷密度Nm,发生变化Na+、 H-等使Nm增大,而Cl-使Nm减小 (2)Au、Cs、B、P等杂质能引起固定氧化物电荷 Nf变化。 (3)Cr、Au、Ni等杂质具有多重能级.除引起界面 态变化外,还可形成杂质界面陷阱。 (4)引起界面附近缺陷数量变化,如Cl-可以明显地 减少热氧化层错。
(1) Si-SiO2分界面的结构
Si-SiO2分界面的结构有一下三种模型:
(1)三层模型:从Si到Si02不是一个突变层,而是由 三层组成。第一层基本上是Si晶体,但存在有较 多缺陷;第二层是比较完整的Sio2,厚度约为几 个原子距,具有二维晶格结构;第三层(最外层) 是非晶态的Sio2网格。 (2)迪安(Deal)模型。Si-SiO2的分界面也由三层组成。 与(1)的不同之处是,中间的Sio2缺氧较多,有相 当数量的不饱和键,第三层也是非晶态的Sio2网 格。Deal模型可以解释Mos结构中的很多现象。
1、Si-SiO2分界面
目前硅的完整性和纯度已达到很高的指标,加 上超纯氧和洁净生产条件,出热氧化生成的SiO2 纯度很高,故Si-SiO2分界面能做到可控,而且可 排除非本征因素,为理论研究提供十分有利的条 件。 Si-SiO2与器件和电路的性能、成品率、可靠 性等都有直接的关系. 因此人们非常重视对Si-SiO2 分界面的研究,这种界面是日前研究最多、了解 最清楚的一种分界面。
4、金属-非金属分界面
金属-非金属分界面是许多技术领域都感兴趣 的一个课题。如金属的腐蚀与它表面生成的氧化 物的附着力和稳定性有非常密切的关系;在催化 过程中,金属被附着在氧化物颗粒上;在电子元 器件的电接触和包封中,金属和陶瓷间的附着力 起着决定性的作用。下面着重讨论金属与氧化物、 陶瓷等非金属交界面的持性。
陶瓷材料的晶体结构与应力分析

陶瓷材料的晶体结构与应力分析一、介绍陶瓷材料是一类具有特殊结构和性质的无机非金属材料。
在陶瓷材料中,晶体结构的性质起着重要的作用。
本文将探讨陶瓷材料的晶体结构以及应力分析方面的内容。
二、陶瓷材料的晶体结构1. 颗粒晶体结构陶瓷材料中常见的晶体结构是颗粒状的结构。
这种结构由大量的微小晶体颗粒组成。
这些颗粒有特定的结构排列方式,形成陶瓷材料的整体结构。
2. 结晶晶体结构在其他一些陶瓷材料中,晶体结构呈现出明确的晶格结构。
晶格是由原子或离子组成的周期性结构。
晶体结构的稳定性与晶格的完整性密切相关。
3. 硅酸盐晶体结构硅酸盐是一种重要的陶瓷材料类型,其晶体结构含有硅和氧的化合物。
硅酸盐的晶体结构可以用于制造陶瓷工艺品、建筑材料等。
三、陶瓷材料的应力分析1. 内应力陶瓷材料在制备或使用过程中,会受到各种力的作用,从而产生内应力。
内应力可能导致陶瓷材料的破裂或变形。
对陶瓷材料的应力分析是为了预测和控制内应力的产生。
2. 热应力热应力是由于温度变化引起的。
在陶瓷材料的制备过程中,高温和冷却过程会导致温度的变化,从而产生热应力。
热应力是陶瓷材料中常见的一种应力形式。
3. 力学应力陶瓷材料在受到外力作用时,会产生力学应力。
力学应力的大小和方向与外力的大小和方向密切相关。
对陶瓷材料的力学应力进行分析有助于了解材料的强度和韧性。
四、工程应用陶瓷材料的晶体结构和应力分析在工程领域有着广泛的应用。
例如,在陶瓷制品的设计和开发过程中,通过对晶体结构的研究,可以改善材料的性能和品质。
同时,应力分析可以帮助工程师预测陶瓷材料在使用过程中可能产生的破裂和变形情况,从而设计更可靠的陶瓷产品。
五、结论陶瓷材料的晶体结构对其性能有重要影响。
对陶瓷材料的晶体结构进行研究可以改善材料的品质和性能。
同时,应力分析对于预测和控制陶瓷材料的破裂和变形具有重要意义。
通过合理的晶体结构设计和应力分析,可以提高陶瓷材料的可靠性和应用价值。
陶瓷材料的晶体结构与应力分析是一个复杂而有趣的课题。
陶瓷物理知识点总结

陶瓷物理知识点总结陶瓷物理知识点总结导言陶瓷是一种广泛应用于许多领域的材料,具有优越的物理性能和化学稳定性。
本文将介绍陶瓷的物理知识点,包括结构、导电性、热性能和光学特性等方面。
通过深入了解陶瓷的物理性质,我们能更好地理解其应用和制备过程。
一、陶瓷的结构陶瓷的结构是指其由离子、分子或原子组成的晶体结构。
陶瓷一般具有离子晶体和共价晶体两种结构类型。
离子型陶瓷由阴阳离子组成,如氧化物陶瓷。
共价型陶瓷由共价键连接的原子组成,如碳化硅陶瓷。
这两种结构类型决定了陶瓷的物理性质。
二、陶瓷的导电性陶瓷是一种绝缘体,其导电性很低。
这是由于陶瓷的结构中存在大量的离子或共价键,并且这些离子或键在晶格中排列得十分有序,使得电子很难在陶瓷中移动。
因此,陶瓷在电绝缘、绝缘体、电介质和电绝缘等方面有着广泛的应用。
三、陶瓷的热性能陶瓷具有较好的热性能,具体表现在以下几个方面。
首先,陶瓷的热导率较低,表明它是一种良好的绝热材料。
其次,陶瓷能够承受高温环境,具有较高的熔点,稳定性好。
此外,陶瓷的热膨胀系数相对较低,能够抵抗温度梯度引起的热应力,具有较好的抗热冲击性能。
四、陶瓷的光学特性陶瓷在光学方面有着广泛的应用,主要体现在以下几个方面。
首先,陶瓷具有高透明性,可以作为透明窗户或透镜材料使用。
其次,陶瓷对于不同波长的光有不同的吸收、散射和反射特性,具有选择性吸收和选择性反射的功能。
此外,陶瓷还可以通过调整成分和结构来改变其光学性质,实现特定的光学功能。
五、其他物理性质除了上述介绍的几个主要物理性质之外,陶瓷还具备其他特殊的物理性质。
例如,陶瓷具有较高的硬度和刚性,能够抵抗磨损和外力影响。
此外,陶瓷的化学惰性好,不易被化学物质侵蚀。
这些特殊的物理性质使得陶瓷在实际应用中起到重要的作用。
结论陶瓷作为一种特殊的材料,具备许多独特的物理性质,包括结构、导电性、热性能和光学特性等方面。
了解这些物理知识点,可以更好地理解陶瓷的应用和制备过程。
陶瓷材料的结构.pptx
综上所述,金
属材料的成分、 工艺、组织结构 和性能之间有着 密切的关系。
图2-11 两种晶粒大小不同的纯铁示意图
第12页/共35页
2.2 高分子材料的结构与性能
• 2.2.1 高分子材料的结构 • 1.大分子链的构成 • (1)化学组成 • 组成大分子链的化学元素,主要是碳、氢、氧,
另外还有氮、氯、氟、硼、硅、硫等,其中碳 是形成大分子链的主要元素。 • 大分子链根据组成元素不同可分为三类,即碳 链大分子、杂链大第13分页/共子35和页 元素链大分子。
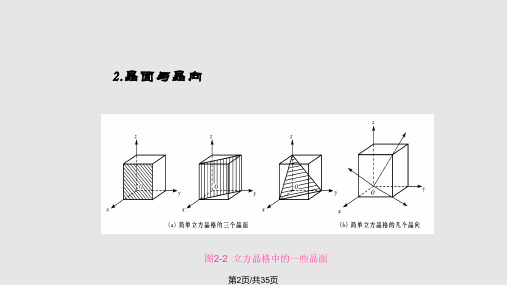
2.晶面与晶向
图2-2 立方晶格中的一些晶面
第2页/共35页
3.金属晶体的类 (型1)体心立方晶格 (2)面心立方晶格 (3)密排六方晶格
图2-3 体心立方晶胞
图2-4 面心立方晶胞
第3页/共35页
图2-5 密排六方晶胞
2.1.2 金属的实际晶体结构
1.单晶体和多晶体
图2-6 单晶体和多晶体结构示意图
图2-20 蠕变前、后分子构象变化示意图 ●应力松弛 如图2-21所示。
图2-21 应力松弛过程中分子构象变化示意图
第22页/共35页
●滞后与内耗 高聚物受周期性载荷时,产生 伸-缩的循环应变,如图2-22所示。
图2-22 橡胶在一个承载周期中的应力-应变曲线
第23页/共35页
图2-23可以看出高聚物的变形特点。A点为 初始状态,B点为屈服点,C点为断裂点。
第25页/共35页
陶瓷的典型组织结构包括: 晶体相(莫来石和石英) 玻璃相 气相
1.晶体相
(1)硅酸盐
硅酸盐基本结构具有以下特点: ①构成硅酸盐的基本单元为硅氧四面 体结构,如图2-24所示; ②硅氧四面体只能通过共用顶角而相 互结合; ③ Si4+通过 O2-结合, Si—O—Si 的结合键在氧上的键角接近于145° ; ④稳定的硅酸盐结构中,硅氧四面体 采取最高空 间维数互相结合; ⑤硅氧四面体采取比较紧密的结构结 合; ⑥同一结构中硅氧四面体最多只相差 1个氧原子。
陶瓷晶体结构

纳米陶瓷晶体结构
纳米陶瓷晶体结构是未来研究的重要方向之 一,通过控制纳米陶瓷晶体的尺寸和形貌, 可以获得具有优异性能的陶瓷材料,如高强
度、高韧性、高耐磨性等。
提高陶瓷晶体结构的性能
要点一
优化制备工艺
通过优化陶瓷材料的制备工艺,如采用先进的烧结技术、 热处理工艺等,可以提高陶瓷晶体结构的致密度、纯度和 结晶度,从而提高其力学性能和物理性能。
要点二
掺杂改性
通过掺杂改性方法,向陶瓷材料中添加适量的杂质元素或 第二相,可以改善其力学性能、热学性能和电学性能等, 以满足不同领域的应用需求。
陶瓷晶体结构在其他领域的应用
能源领域
陶瓷晶体结构在能源领域具有广 泛的应用前景,如用于制造高效 能电池、燃料电池和热电转换器 件等。
环保领域
陶瓷晶体结构具有优异的耐腐蚀、 耐高温和化学稳定性等特点,可 用于制造高效过滤器、气体分离 膜和催化剂载体等环保器件。
03
陶瓷发动机
具有高耐火性和高温强度,可用 于制造炉具、坩埚和耐火材料等。
具有高硬度、高耐磨性和耐高温 性,可用于制造切削刀具和铣刀 等。
采用耐高温、高强度的陶瓷材料 制作发动机零件,能够提高发动 机性能和燃油效率。
06 未来展望
新型陶瓷晶体结构的探索
探索新型陶瓷晶体结构
随着科技的发展,新型陶瓷晶体结构不断涌 现,如氮化硼、碳化硅等,这些新型陶瓷晶 体结构具有更高的硬度、耐高温和化学稳定 性等优点,为材料科学和工程领域提供了新 的选择。
共价键和离子键是陶瓷材料中最常见的键合方式,它们对材料
03
的硬度、熔点和电导率等性质有显著影响。
晶体结构中的缺陷
01
晶体结构中的缺陷是指偏离理想晶体结构的部分。
温度对陶瓷材料性能的影响

温度对陶瓷材料性能的影响一、引言陶瓷材料是一种常见的非金属材料,具有高硬度、耐磨、高化学稳定性等优点,在工业、化学、医学等领域得到广泛应用。
然而,温度对陶瓷材料的性能有一定的影响,本文将从热性能、晶体结构和物理性质三个方面探讨温度对陶瓷材料性能的影响。
二、热性能1. 热膨胀性陶瓷材料的热膨胀系数较小,变形率较低,随着温度升高,热膨胀系数也会增大,进而影响材料的稳定性。
这一点在高温场景下尤为明显,例如在高温中,陶瓷材料易发生热膨胀,容易出现瓷裂和裂纹。
2. 热导率陶瓷材料的热导率较低,弱导热特性使得其在高温环境、制热或者绝缘领域有很好的应用,此时热导率变化较小。
但是,在某些特殊情况下,例如需要进行较快热传递的场景中,比如炉膛里的高温熔融炉料、热传递装置或者基体需要快速散热时,这种弱导热的特性反而会成为滞碍,影响材料的效率。
三、晶体结构1. 晶体缺陷陶瓷材料由于其独特的晶体结构具有极好的高温稳定性,在高温中仍可以保持其结构的完整性,因此被广泛应用于高温环境中。
但是,随着温度升高,材料结构中存在的晶体缺陷会逐渐增多,导致其性能降低甚至破坏。
2. 晶粒长大另一方面,随着温度升高,晶格中的原子振动幅度相对增加,也使得晶粒长大。
晶粒的长大会影响材料的性能,例如硬度下降、韧性降低等,热加工陶瓷材料时需要考虑到晶粒长大的影响。
四、物理性质1. 电学性能陶瓷材料的电性能随着温度升高会降低,这种电性能的变化与材料表面导体自由电子数量的变化有关,同时也会影响材料的介电常数、电耗等物理性质,判断材料性能时应注意这种变化。
2. 磁学性能具有磁学性能的陶瓷材料在磁场中具有一定的磁化率,然而随着温度升高,其磁性会下降,这主要是由于材料中电子激发方式的变化导致磁矩的变化,磁学性能随温度变化的特性可以作为判断材料特性的重要指标之一。
五、总结总的来说,温度对陶瓷材料的性能会产生一定的影响,需要在生产或者使用过程中谨慎考虑,并根据实际情况定制合理的加工和使用环境,保证其材料的性能表现。
第三版胡赓祥材料科学基础的知识点总结及课后答案

第三版胡赓祥材料科学基础的知识点总结及课后答案第一章材料科学基础概念知识点总结1. 材料的定义与分类:材料是制造各种结构和器件的物质基础,可分为金属材料、无机非金属材料、有机高分子材料和复合材料等。
2. 材料的性能:包括力学性能、热性能、电性能、磁性能等,是评价材料性能好坏的重要指标。
3. 晶体结构:晶体是由原子、离子或分子按照一定的空间点阵排列成的周期性结构,常见的晶体结构有金属晶体、离子晶体、共价晶体和分子晶体等。
4. 材料的制备方法:包括合成、加工、处理等,如熔炼、铸造、轧制、挤压、拉伸、热处理、腐蚀等。
5. 材料的设计与性能调控:根据材料的使用性能要求,进行结构、组成和制备工艺的设计,以实现性能的优化。
课后答案1. 材料是什么?请举例说明。
答案:材料是制造各种结构和器件的物质基础,如钢铁、水泥、塑料、玻璃等。
2. 材料的性能有哪些?它们对材料的用途有何影响?答案:材料的性能包括力学性能、热性能、电性能、磁性能等,不同的性能影响材料在不同领域的应用。
例如,塑料的具有良好的柔韧性和耐腐蚀性,广泛应用于包装、建筑等领域;金属材料具有良好的导电性和导热性,广泛应用于电子、能源等领域。
3. 晶体结构有哪些类型?请简要介绍。
答案:晶体结构有金属晶体、离子晶体、共价晶体和分子晶体等类型。
金属晶体是由金属原子按照一定的空间点阵排列成的结构,具有较高的强度和韧性;离子晶体是由正负离子按照一定的空间点阵排列成的结构,具有较高的熔点和硬度;共价晶体是由共价键连接的原子按照一定的空间点阵排列成的结构,具有较高的硬度和脆性;分子晶体是由分子按照一定的空间点阵排列成的结构,具有较低的熔点和脆性。
4. 材料的制备方法有哪些?它们对材料性能有何影响?答案:材料的制备方法包括合成、加工、处理等,如熔炼、铸造、轧制、挤压、拉伸、热处理、腐蚀等。
不同的制备方法对材料的性能有不同的影响。
例如,熔炼法制备的金属材料具有较高的纯度和均匀性;热处理工艺可以改变金属材料的组织结构和性能,如提高硬度和强度等。
陶瓷材料的显微结构

相组成:晶相、玻璃相、气相
晶形:每一种晶体在形成、长大的过程中,往往习 惯地、自发地按一定的规律生长和发育成一 定的几何形态。
这种习惯称为结晶习性。
自形晶:先结晶的晶体在较好的环境下生长,即在有利于按其 本身的结晶习性的环境中生长发育的,而形成晶形完整 的晶体。
• Al2O3含量↑,玻璃相↓。 • Al2O3含量↑,烧成温度↑。95%瓷→1600℃;
99%瓷→1700℃。
二次重结晶,导致局部晶粒 易于长大。
原料本身不均匀; 成型时的压力因素; 烧成温度偏高; 局部不均匀的液相存在。
异常显微结构,晶粒大小分 布显著不均匀。
与添加剂的选用与加入量不 当有关
2、ZrO2陶瓷
与应力诱导相变不 同,后者在相变开 始点周围应力变化 较大处产生,因此 成核相变可能是应 力诱导相变的先兆。
1、大孔径的孔隙 2、不纯原料 3、异常大晶粒 4、团聚 5、第二相夹杂物
二、高温缺陷
温度↑,陶瓷的强度↓ ➢高温破坏:广泛分布的显微结构 损伤的积累过程; ➢室温破坏:已经存在的裂纹的突 然破坏所致。
高温下损伤的形成与材料承受蠕变或蠕 变破坏的能力有关。 与高温强度有关的重要因素— 晶界相
I. 烧结助剂如MgO等与Si3N4中的SiO2杂质 反应形成硅酸盐液相;
③微裂纹增韧
材料制备过程中,由高温降至 低 温 时 , 一 些 晶 粒 的 t-ZrO2 自 发 地 相变到m-ZrO2,产生微裂纹,使材 料增韧。
(2)影响相变增韧的因素
①晶粒大小
I. ZrO2相变增韧材料中存在临界晶粒尺寸; II. 晶粒尺寸大于临界尺寸时,易于相变,冷却过程中,伴随相
陶瓷的微观结构

陶瓷的微观结构引言陶瓷是一种具有特殊微观结构的无机非金属材料,具有优异的物理、化学和机械性能。
本文将重点介绍陶瓷的微观结构,包括陶瓷的组成成分、晶体结构以及晶界和孔隙等微观特征。
一、陶瓷的组成成分陶瓷的主要成分是氧化物,如氧化铝、氧化硅、氧化锆等。
此外,还可以添加少量的其他氧化物、非氧化物以及杂质元素来调整陶瓷的性能。
不同成分的陶瓷具有不同的微观结构和性能特点。
二、陶瓷的晶体结构陶瓷的晶体结构是其微观结构的基础。
大多数陶瓷是由离子晶体构成的,其晶体结构可以分为离子型和共价型两种。
离子型陶瓷的晶体结构由正负离子通过电荷作用力相互排列而成,共价型陶瓷的晶体结构由共价键连接的原子构成。
三、陶瓷的晶界晶界是陶瓷微观结构中重要的组成部分,它位于晶体之间。
晶界的存在对陶瓷的性能有重要影响。
晶界可以分为晶界位错和晶界面两部分。
晶界位错是晶体中原子间的错位,晶界面是晶体之间的界面。
晶界的存在会导致晶体的结构畸变和局部应变,从而影响陶瓷的力学性能和导电性能。
四、陶瓷的孔隙结构陶瓷的孔隙是指在其微观结构中存在的空隙或孔洞。
孔隙可以分为连通孔和闭孔两种。
连通孔是指孔隙之间存在通道,可以与外界相连,闭孔则是孔隙之间没有通道,与外界隔绝。
孔隙的存在对陶瓷的力学性能、导热性能和气密性等性能有重要影响。
结论陶瓷的微观结构是其优异性能的基础。
陶瓷的微观结构包括组成成分、晶体结构、晶界和孔隙等要素。
不同成分的陶瓷具有不同的微观结构特点,晶体结构和晶界的存在对陶瓷的性能有重要影响,而孔隙的存在则对陶瓷的多项性能产生影响。
深入了解和研究陶瓷的微观结构,可以为陶瓷的设计、制备和应用提供理论依据,进一步拓展陶瓷材料的应用领域。
陶瓷的科学原理

陶瓷的科学原理陶瓷是一种非金属无机材料,其制作和应用已有几千年的历史。
陶瓷的科学原理涉及材料的组成、结构和工艺等方面。
本文将从这几个方面探讨陶瓷的科学原理。
一、陶瓷的组成陶瓷主要由氧化物组成,如氧化铝、氧化硅、氧化锆等。
这些氧化物具有高熔点、高硬度和抗化学腐蚀等特性,使得陶瓷成为一种理想的结构材料。
此外,陶瓷中还可以添加其他元素,如钙、镁等,以改变其性能。
不同元素的添加可以调节陶瓷的热膨胀系数、导热性能和机械强度等。
二、陶瓷的结构陶瓷的结构与其制备工艺密切相关。
陶瓷材料可以通过烧结、熔融和化学合成等方法制备。
其中,烧结是最常用的制备陶瓷的方法之一。
在烧结过程中,陶瓷粉末被加热到高温,使其颗粒之间发生结合,形成致密的结构。
这种结构具有良好的机械强度和耐磨性。
陶瓷的结构也与晶体学有关。
陶瓷晶体的排列方式决定了陶瓷的性能。
例如,氧化铝晶体呈六方紧密堆积结构,具有高硬度和良好的耐磨性。
而氧化硅晶体呈四方紧密堆积结构,具有良好的绝缘性能和高温稳定性。
三、陶瓷的工艺陶瓷的工艺包括成型、烧结和表面处理等环节。
成型是将陶瓷粉末制成所需形状的过程。
常见的成型方法有压制、注塑和挤压等。
烧结是将成型坯体加热到一定温度,使其颗粒结合成致密的陶瓷材料。
表面处理可以提高陶瓷的光洁度和耐磨性,常用的处理方法有抛光、涂层和加工等。
陶瓷工艺对陶瓷性能的影响很大。
例如,成型方法会影响陶瓷的尺寸精度和表面光洁度。
烧结温度和时间会影响陶瓷的致密度和晶体尺寸。
表面处理方法可以改善陶瓷的外观和性能。
四、陶瓷的应用陶瓷具有独特的性能和广泛的应用领域。
在工业领域,陶瓷材料常用于制造磨料、切割工具和耐磨零件等。
在电子领域,陶瓷材料常用于制造电容器、压电器件和介质等。
在医疗领域,陶瓷材料常用于制作人工关节和牙科修复材料等。
陶瓷的应用还在不断拓展。
例如,陶瓷基复合材料具有高强度和耐高温性能,被广泛应用于航空航天和汽车工业。
纳米陶瓷材料具有特殊的光学和电学性能,被应用于显示技术和光电子器件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
23
2.3.3
硅酸盐的晶体结构
• 硅酸盐的结构组成:都是由硅氧四面体作为骨 架组成。 硅酸盐晶体的结构特点: (1)构成的基本结构单元是由Si和O组成的[SiO4]4 -四面体。 (2)每个O最多只能为两个[SiO4]4-四面体所 (3)[SiO4]四面体可以独立地在结构中存在,也可 以通过[SiO4]4-共用四面体顶点连接 (4)[SiO4]4-中Si-O-Si结合键不是一条直线,呈 145º 夹角。
24
硅酸盐的分类(掌握)
1.孤岛状硅酸盐: [ SiO4]4-以孤立状存在。如 镁橄榄石Mg2SiO4,锆英石ZrSiO4等 2.组群状硅酸盐:由[SiO4]4-通过共用氧(桥氧)相 生成2、3、4或者6个硅氧组群。绿宝石 3.链状硅酸盐:由[SiO4]4-通过桥氧的连接在一维 方向伸长成单链或双链、链与链间为正离子链结。 辉石
2 玻璃相:非晶态固体,将晶相粘结 在一起,降低烧结温度,抑制晶相晶 粒长大和填充气孔。 3 气相:气孔(5%-10%)。
对性能的不利影响:增加脆性、降低强度、电击穿强度降 低,绝缘性能降低。
对性能的有利影响:提高吸振性,使陶瓷密度减小
5
陶瓷材料的制备工艺 原料配置 →
坯料成型 → 烧结 → 成品
12
应用一:判断晶体结构是否稳定
如:NaCl晶体 应用二:判断(确定)共用一个顶点的八面体的数目
如:[SiO4]、 [AlO6]、[MgO6]
13
3、鲍林第三规则 —— 多面体共顶、共棱、共面规则 在配位结构中,两个阴离子多面体以共棱, 特别是共面方式存在时,结构的稳定性便降低。
14
15
4、鲍林第四规则 —— 不同配位多面体连接规则
7
3.配位原子所组成的 多面体。
氧离子
硅离子
铝离子
硅氧四面体和铝氧八面体
8
4.离子堆积
• 离子晶体通常由负离子堆积成骨架,正离子按其自身 大小居于相应负离子空隙(负离子配位多面体)。 • 其堆积方式主要有立方最密堆积、六方最密堆积、立方体 心密堆积和四面体堆积等 • 负离子配位多面体:离子晶体中与某一正离子成配位关系 而邻接的各负离子中心线所构成的多面体
26
27
28
29
30
2.3.4 同质多晶现象(掌握)
1、概念 同质多晶:化学组成相同的物质,在不同的热 力学条件下,结晶成为两种以上结构不同的晶体的 现象。
由此而产生的化学组成相同、结构不同的晶体
称为变体。 类质同晶:化学组成相似的不同化合物,具有 相同晶体结构的现象。
31
例如:
石墨
金刚石
2
2. 陶瓷的分类
结构陶瓷主要是用于耐磨损、高强度、耐热、耐热冲击、硬
质、高刚性、低热膨胀性和隔热等结构陶瓷材料
不同形状的特种结构陶瓷件
3
功能陶瓷中包括电磁功能、光学功能和生物-化学功能等陶 瓷制品和材料,此外还有核能陶瓷和其它功能材料等。
电子绝缘件
氧化锆陶瓷光学导管
4
陶瓷的组成
1.结晶相:主要组成相,由离 子键或共价键结合而成,决定 陶瓷的性能:高熔点、高耐热 性、高化学稳定性、高绝缘性、 高脆性。
25
4.层状硅酸盐:由[SiO4]4-四面体某个面在平面 内以共用顶点的方式连接成六角对称的二维结 构,多为二节单层。当活性氧与其它负离子一起 与金属正离子组成八面体层,就与四面体构成双 层结构。 滑石,白云母 5.骨架状硅酸盐:由[SiO4]4-四面体连成无限六 元环状,层中未饱合和交替指向上或向下,把这 样的层叠置起来使两个为一个公共氧所代替。 石英
32
2、多晶转变 根据多晶转变前后晶体结构变化和转变速度 的情况不同,分为:
位移性转变:质点间位移、键长、键角的调整,
转变 速度快(高低温型转变)。 重建型转变:旧键的破坏,新键的形成,转变速 度慢。
33
34
2.3.5 晶态与玻璃结构
与晶体在三维空间有序的排列不同,非晶是长 程无序的。即在较大距离上结构无周期性,但近 程(几个Å内)结构是有序的。 无机非晶态:无机玻璃、凝胶、非晶态半导体、 无定形碳以及合金玻璃。 玻璃:具有玻璃转换点的非晶态固体。 短程有序,长程无序
在一个含有不同阳离子的晶体中,电价高而
配位数小的那些阳离子特别倾向于共角连接。 例:岛状镁橄榄石(Mg2SiO4)
16
5、鲍林第五规则 —— 节约规则 在一个晶体结构中,本质不同的结构组元 的种类倾向于最少数目。 不同尺寸的离子和多面体很难有效地堆积 在一起
17
2.3.2.3 几种典型的晶体结构
材料科学基础
2.3
陶 瓷 的 晶 体 结 构
主讲 徐敏虹
1. 陶瓷的概述
“陶瓷”是指所有以粘土为主要原料与其它天然矿物 原料经过粉碎、混炼、成形、烧结等过程而制成的各种制品。
日用陶瓷-餐具
建筑陶瓷-地砖
电瓷
性能:耐高温、耐磨、耐腐蚀、高硬度、高强度及其 它特殊性能(压电性、磁性和光学性能),但脆性大
19
• 1)AB型结构
• NaCl型结构,其化学式为NaCl,晶体结构为立方晶系。氯 化钠是一种立方面心格子。其中阴离子按立方最紧密方式 堆积,阳离子填充于全部的八面体空隙中,阴、阳离子的 配位数都为6。
20
闪锌矿型结构,如立方ZnS,为立方晶系,ZnS是面 心立方格子,阴离子位于立方面心格子的节点位置, 而阳离子交错分布于立方体内的1/8小立方体的中 心。阳离子的配位数是4,阴离子的配位数也是4。
的半径之和,阳离子的配位数则取决于它们的半
径之比。 如:NaCl6,氯八面体
11
2、鲍林第二规则 —— 静电价规则
在一个稳定的离子晶体结构中,每一个负离子的电
价等于或近似等于相邻正离子分配给他的静电键强度的 总和。
静电键强度 S= 正离子电荷数 正离子配位数
Z = Si
i
=
Z
n
负离子电荷数
35
玻璃的结构
• 1.晶子学说 玻璃是由无数晶子组成,晶子是带有晶格 变形的有序排列小区域,他们分散在无定形中, 并且从晶子到无定形的过渡是逐步完成的。 意义:玻璃结构的微观不均匀性和近程有序现 象。
36
• 1.无规则网络学说 玻璃的结构与相应的晶体结构相似,同样形 成连续的三维空间网络结构。但玻璃的网络与晶 体的网络不同,玻璃的网络是不规则的、非周期 性。 意义:解释玻璃的各向同性、内部性质的均匀性、 成分变化是其性能变化的连续性等现象
立方ZnS
六方ZnS
21
• (2)AB2型结构
• 萤石结构,CaF2,结构属于立方晶系,阳离子位于 立方面心的节点位置上,阴离子则位于立方体内8 个小立方体的中心。阳离子的配位数位8,而阴离 子的的配位数为4。
22
• (3)A2B3型结构 刚玉型结构,属于三方晶系。阴离子按六方紧
密堆积排列,而阳离子填充于2/3的八面体空隙,因 此阳离子的分布必须有一定的规律,其原则就是在同 一层和层与层之间,阳离子之间的距离应保持最远, 这是符合于鲍林规则的。
9
2.3.2.2 离子晶体的结构规则—鲍林规则 负离子配位多面体规则 符合最小内能原理
电价规则
负离子多面体共用顶、棱、面的规则 棱、面,会降低结构稳定性 不同种类正离子多面体间连接规则 节约规则 同种正离子和同种负离子的结合方式 应最大限度地趋于一致. 共用点、
10
1、鲍林第一规则 —— 配位多面体规则 在离子晶体中,围绕每一阳离子,形成一个 阴离子配位多面体,阴阳离子的间距决定于它们
主要原料:黏土、石英、长石
黏土矿物-高岭石
钾长石
石英
6
2.3.2 离子的晶体结构
离子晶体有关概念 • 1.离子晶体:由正、负离子通过离子键按一定方 式堆积起来而形成的。陶瓷大多数属于离子晶体。 • 2.离子半径:从原子核中心到其最外层电子的平 衡距离。对离子晶体,通常认为晶体中相邻的正 负离子中心之间的距离作为正负离子半径之和, 即R0=R++R- 。 离子半径大小的一般规律P70。
39
非晶态材料的制备方法
• 由气相直接凝固成非晶态固体,如溅射,化学气 相沉积
• 由液态通过快速淬火
• 由结晶材料通过辐照、离子注入等。
40
(1) CsCl型 (2) NaCl型 (3) 立方ZNS(闪锌矿)型: (4) 六方ZNS(纤锌矿)型: (1) CaF2(萤石型) (2) TiO2(金红石)型 (3)β-SiO2(方晶石.方石英)型 (1)赤铜矿结构 (2)反萤石结构(K2O)
1. AB型
2. AB2型
3. A2B型
18
4. A2B3型 (1) α- Al2O3 (2)A、B、C型稀土化合物 5. AB3型 WO3 6. A2B5型 V2O5 7. ABO3型(1) CaTiO3(钙钛矿、灰钛矿)型 (2) CaCO3(方解石)型、三方晶系 6. AB2O4型 尖晶石(MgAl2O4)
37
玻璃的生成条件及性质(了解)
• 玻璃的生成条件 • 黏度:表征流体中两流体层相对位移时,内摩擦 力大小的性能参数 黏度——重要条件 冷却条件——外部因素
38
玻璃的种类
• 无机玻璃 P94表2-37 结构玻璃 功能玻璃 玻璃陶瓷:由玻璃相基体和大量弥散的微小晶体 金属玻璃:金属元素,原子无规则排列成玻璃态
