总RNA的提取和RT-PCR、RTPCR
RNA提取,RT-PCR实验报告

RNA制备及其鉴定实验目的初步掌握组织总RNA制备的原理及其基本方法,掌握RNA纯度鉴定的基本方法。
实验原理细胞内的RNA通常与蛋白质结合,以核蛋白(RNP)的形式存在。
分离制备RNA时,首先必须破碎细胞,使RNP释放到溶液中并与蛋白质分离,然后将RNA同其他的细胞成分分离开并保证RNA的完整性。
本次实验我们选用了Trizol法分离提取小鼠肝组织的总RNA,Trizol法分离提取的RNA产率高、纯度好且不易降解。
评价RNA质量的标准是RNA的均一性和完整性。
均一的RNA取决于有效的去除RNA提取物中的DNA、蛋白质和其他杂质;完整的RNA取决于最大限度地避免纯化过程中内源性及外源性RNA酶对RNA的降解。
通常采用紫外分光光度法测定RNA的浓度和纯度,纯RNA的A260/A280=2.0,但由于所用的标本不同,此比值有一定的变化,一般在1.8~2.0之间,低于改值表明有蛋白污染,需进一步用酚/氯仿抽提。
RNA的完整性可通过琼脂糖电泳法进行鉴定。
完整的RNA电泳时,28S和18SrRNA经EB染色后,两条电泳条带的显色强度近似为2比1。
本实验中几个重要试剂的作用:Trizol试剂:Trizol的主要成分是苯酚、异硫氰酸胍、十二烷基肌氨酸钠、β-巯基乙醇、醋酸钠、柠檬酸钠。
它的主要作用是1、裂解细胞,使细胞中的蛋白、核酸物质解聚得到释放。
2、使蛋白质变性,有利于DNA和RNA与蛋白质的分离。
3、抑制内源和外源RNase。
氯仿:氯仿的作用有多个方面,一、作为有机溶剂变性蛋白,使其沉淀并通过离心除去。
二、通过变性作用抑制RNase活性;三、通过氯仿把水相里参与的苯酚抽提掉;四、作为溶剂抽提样品中的一些脂溶性杂质(比如油脂、脂溶性色素等),起到一定除杂作用。
异丙醇:异丙醇是沉淀核酸用的,作用和乙醇一样。
只不过用量要比乙醇少。
异丙醇是等体积,而乙醇一般需要2.5倍体积。
在水相很多,离心管容积有限,加不下太多乙醇的时候一般会用异丙醇沉淀。
RT-PCR实验步骤

RT-PCR实验步骤一、总RNA提取1. 取200mg组织,放到1.5mlEP管中,加入1mlTrizol剪碎。
2. 震荡30s。
3. 加0.2ml氯仿,剧烈摇动30s,室温3min。
4. 12000×g,4℃离心,15min。
5. 吸上层无色水相,移入另一EP管中(约0.5ml)。
6. 加等体积异丙醇,-20℃,30min。
7. 12000×g,4℃离心,10min。
在管底部可见微量RNA沉淀8. 弃上清,加75%乙醇1ml,振荡。
9. 7500×g,4℃离心,10min。
10. 弃上清,用滤纸小心吸取残留液体,室温干燥5-10min。
11. 沉淀溶于20μlDEPC水,取1μl加入79μlDEPC水测OD260/OD28012. 计算浓度与纯度,-70℃保存。
二、逆转录合成cDNA第一链反应体系如下混匀快速离心一次反应条件如下-20℃ 冰箱冻存三、PCR反应混匀快速离心一次反应条件如下PCR产物-20℃冰箱保存取PCR产物8μl 加5×Loading Buffer 2μl 2%琼脂糖凝胶电泳120V。
100mA 30min 溴化乙锭染色,凝胶成象仪成象并保存结果。
RT-PCR实验方法总结1,2RT-PCR实验有三步:抽提RNA,RT,PCR。
要求:1.做RT前必需测RNA浓度,逆转录体系对RNA量还是有一些要求,常用500ng或1ug。
2. RT按要求做,一般不会出太大问题。
3. PCR,按常规。
但如需扩长片段,则对前两步要求较高,需要有完整的cDNA存在,不是单改变Mg2+浓度、退火温度能解决的。
1)RT和PCR时的引物设计是不是一定要先知道目的基因的序列?必须在RT时,引物设计有3种方法即a:Random 9mers;b:Oligo dT-Adaptor Primer;和c:特异的下游引物。
如果用a和b方法,是扩增的所有的cDNA(理论上),还要用此产物做PCR 的模板继续扩增。
植物总RNA的提取及RT-PCR

植物总RNA的提取及RT-PCR生物学实验技术植物总RNA的提取及RT-PCR一、实验目的1. 学习从植物组织中提取总RNA的方法2. 了解RT-PCR的基本原理和实验方法二、实验原理1. RNA提取的原理RNA是一类极易降解的分子,要得到完整的RNA,必须最大限度地抑制提取过程中内源性及外源性核糖核酸酶对RNA的降解。
高浓度强变性剂异硫氰酸胍可溶解蛋白质,破坏细胞结构,使核蛋白与核酸分离,失活RNA酶,所以RNA从细胞中释放出来时不被降解。
细胞裂解后,除了RNA,还有DNA、蛋白质和细胞碎片,通过酚、氯仿等有机溶剂处理得到纯化、均一的总RNA。
2. RT-PCR的原理提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)作引物利用逆转录酶反转录成cDNA。
再以cDNA 为模板进行PCR扩增,获得目的基因或检测基因表达。
RT-PCR 使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA 样品分析成为可能。
该技术主要用于分析基因的转录产物、获取目的基因和合成cDNA探针等。
三、仪器、药品与试剂配方(一) 仪器及器皿1.低温离心机;2.琼脂糖凝胶电泳系统;3.高压灭菌锅;4. PCR仪;5.研钵;6. 一次性手套等;7. 离心管;8. 培养皿;9. 烧杯及试剂瓶等。
(二) 药品1. 焦碳酸二乙酯(DEPC)2. 异硫氰酸胍(GT)3. 醋酸钠(NaAc)4. 苯酚5. 异丙醇6. 氯仿7. 乙醇8. β-巯基乙醇9. 琼脂糖10. MLV反转录试剂盒11. Taq DNA聚合酶12. 引物(三) 试剂配制1.0.1% DEPC水灭菌2. 4 mol/L异硫氰酸胍3. 2 mol/L NaAc (pH4.8)灭菌4. 3 mol/L NaAc (pH 4.8)灭菌5. 4 mol/L LiCl 灭菌6. 1×TE缓冲液:10 mM Tris-HCl(pH8.0),1 mM EDTA (pH8.0), 灭菌。
总RNA的提取和RT-PCR(20154)

青海大学医学院 高原医学研究中心
2015-4-10
目的
完整RNA的提取和纯化,是进行RNA 方面的研究工作如 Nothern杂交、mRNA分离、RT-PCR、定量PCR、 cDNA合成及体外翻译等的前提。
掌握从组织及细胞中提取总RNA的方法 熟悉紫外吸收法检测RNA浓度与纯度的原理及测定方
液氮研磨 匀浆或液氮研磨 应用红细胞裂解液处理 直接裂解或胰蛋白酶处理
Trizol的主要成分
Trizol 是一种新型总 RNA 抽提试剂 主要成分是异硫氰酸胍和酚。异硫氰酸胍属于解偶剂,
是一类强力的蛋白质变性剂,可溶解蛋白质,其主要作 用是裂解细胞,使细胞中的蛋白/核酸物质解聚得到释放。 酚虽可有效的变性蛋白质,但是它不能完全抑制RNA酶 活性,因此Trizol中还加入了8-羟基喹啉、β-巯基乙醇等 来抑制内源和外源RNase。
法 掌握RT-PCR基因扩增的原理和过程
实验流程
提取
PCR
电泳
提取原理 操作步骤
计算方法 操作步骤
逆转录原理 操作步骤
原理体系 引物选择
电泳原理 电泳步骤
第一部分
组织及细胞总RNA的提取及定量
原理
10-5mg RNA/细胞
rRNA 80-85%:28S 18S 5S tRNA, snRNA 10-15% mRNA 1-5%
常用的RNA酶抑制剂:
焦磷酸二乙酯(DEPC):与RNA酶的活性 基团组氨酸的咪唑环结合,有高致癌性。 (实验准备阶段使用)
异硫氰酸胍、氯仿:提取RNA同时也使 RNA酶失活。
RNA酶的蛋白抑制剂(RNasin):从大鼠 肝或人胎盘中提取得来的酸性糖蛋白。(合 成cDNA阶段使用)
总RNA的提取与RT、Realtime-PCR

总RNA 的提取与RT、Realtime - PCR一、实验原理RNA是基因表达的中间产物,存在于细胞质与核中。
获得高纯度和完整的RNA是很多分子生物学实验所必需的,如Northern杂交、cDNA合成及体外翻译等实验的成败,在很大程度上取决于RNA的质量。
由于细胞内的大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。
再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA。
1 . RNA提取的最大影响因素-RNA酶但是由于RNA酶(RNase)广泛存在且稳定,可耐受多种处理而不被灭活,如煮沸、高压等。
RNase催化的反应一般不需要辅助因子,因而RNA制剂中只要存在少量的RNase就会引起RNA在制备与分析过程中的降解,所以RNA的制备过程中要抑制内源和外源的RNase活性,保护RNA分子不被降解。
外源性的RNase存在于操作人员的手汗、唾液等,也可存在于灰尘中。
在其它分子生物学实验中使用的RNase 也会造成污染。
这些外源性的RNase可污染器械、玻璃制品、塑料制品、电泳槽、研究人员的手及各种试齐叽而各种组织和细胞中则含有大量内源性的RNaseo2 .常用的RNA酶抑制剂*焦碳酸二乙酯(DEPQ:是一种强烈但不彻底的RNase抑制剂。
它通过和RNase的活性基团组氨酸的咪唑环结合使蛋白质变性,从而抑制酶的活性。
*异硫氰酸胍:目前被认为是最有效的RNase抑制剂,它在裂解组织的同时也使RNase失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNase有强烈的变性作用。
*氧钒核糖核苷复合物:由氧化钒离子和核苷形成的复合物,它和RNase结合形成过渡态类物质,几乎能完全抑制RNase的活性。
*RNA酶的蛋白抑制剂(RNasin):从大鼠肝或人胎盘中提取得来的酸性糖蛋白。
RNasin是RNase的一种非竞争性抑制剂,可以和多种RNase结合,使其失活。
总RNA的提取,RT-PCR实验报告

生物化学实验报告姓名:学号:专业年级:组别:第二实验室生物化学与分子生物学实验教学中心实验名称总RNA的提取与RT-PCR实验日期2019-11-22 实验地点第二实验室合作者指导老师评分XX 教师签名李某某批改日期2013-06-03 一、实验目的1. 掌握从细胞中提取总RNA的方法2. 熟悉离心机的基本操作3. 掌握RT-PCR基因扩增的原理和过程4. 熟悉电泳法鉴定所得RNA二、实验原理1. 细胞总RNA的提取及定量1)每个细胞内大概有10-5mg RNA(主要有rRNA,tRNA,mRNA三种)2)mRNA 3’端存在20-250个多聚腺苷酸(polyA)结构,可用oligo(dT)亲和层析柱分离mRNA 3)对RNA进行分离有异硫氰酸胍氯化铯超速离心法,盐酸胍-有机溶剂法,氯化锂-尿素法,蛋白酶K-细胞质RNA提取法等、异硫氰酸胍-酚-氯仿一步法等。
4)目前常用的是Trizol法,能快速地从细胞组织中分离出RNA,适用于小量样品也使用于大量样品5)在加入氯仿离心后,溶液分为水相和有机相,RNA在上层水相中。
6)取出水相用异丙醇沉淀可回收RNA ,用乙醇沉淀中间层可回收DNA;用异丙醇沉淀有机相可回收蛋白质2. 逆转录-聚合酶链反应(RT-PCR)提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA。
再以cDNA为模板进行PCR扩增,而获得目的基因或检测基因表达三、材料与方法:以流程图示意材料总RNA的提取RT-PCR1. 微量加样枪,灭菌超薄PCR反应管, 1.基因扩增仪、微量加样枪、灭菌超2. Trizol试剂,氯仿,异丙醇,75%乙醇,无RNase的水或0.5%SDS(溶液均用DEPC 处理过的水配置)薄PCR反应管2.提取的总RNA3.第一链cDNA合成试剂盒(含有逆转录酶、RNA酶抑制剂、缓冲液)4.dNTP mix:含dATP、dCTP、dGTP、dTTP各2 mmol/L四、结果与讨论:①结果:实验数据、现象、图谱;②讨论:以结果为基础的逻辑推论,并得出结论。
总RNA的提取与RT、Realtime-PCR

总RNA的提取与RT、Realtime-PCR一、实验原理RNA是基因表达的中间产物,存在于细胞质与核中。
获得高纯度和完整的RNA是很多分子生物学实验所必需的,如Northern杂交、cDNA合成及体外翻译等实验的成败,在很大程度上取决于RNA的质量。
由于细胞内的大部分RNA是以核蛋白复合体的形式存在,所以在提取RNA时要利用高浓度的蛋白质变性剂,迅速破坏细胞结构,使核蛋白与RNA分离,释放出RNA。
再通过酚、氯仿等有机溶剂处理、离心,使RNA与其他细胞组分分离,得到纯化的总RNA.1.RNA提取的最大影响因素—RNA酶但是由于RNA酶(RNase)广泛存在且稳定,可耐受多种处理而不被灭活,如煮沸、高压等.RNase催化的反应一般不需要辅助因子,因而RNA制剂中只要存在少量的RNase就会引起RNA在制备与分析过程中的降解,所以RNA的制备过程中要抑制内源和外源的RNase活性,保护RNA分子不被降解。
外源性的RNase存在于操作人员的手汗、唾液等,也可存在于灰尘中.在其它分子生物学实验中使用的RNase也会造成污染.这些外源性的RNase可污染器械、玻璃制品、塑料制品、电泳槽、研究人员的手及各种试剂。
而各种组织和细胞中则含有大量内源性的RNase.2.常用的RNA酶抑制剂*焦碳酸二乙酯(DEPC):是一种强烈但不彻底的RNase抑制剂。
它通过和RNase的活性基团组氨酸的咪唑环结合使蛋白质变性,从而抑制酶的活性。
*异硫氰酸胍:目前被认为是最有效的RNase抑制剂,它在裂解组织的同时也使RNase失活。
它既可破坏细胞结构使核酸从核蛋白中解离出来,又对RNase有强烈的变性作用.*氧钒核糖核苷复合物:由氧化钒离子和核苷形成的复合物,它和RNase结合形成过渡态类物质,几乎能完全抑制RNase的活性。
*RNA酶的蛋白抑制剂(RNasin):从大鼠肝或人胎盘中提取得来的酸性糖蛋白。
RNasin是RNase的一种非竞争性抑制剂,可以和多种RNase结合,使其失活.*其它:SDS、尿素、硅藻土等对RNase也有一定抑制作用。
RNA抽提和RT-----SG

RNA抽提和RT- PCR总RNA抽提:12孔细胞用PBS洗三次,每孔加入RNA Trizol 500ul,用枪头吹打均匀,移入新的EP管中,室温静置5-10min,以保证完全裂解。
每管加入氯仿100ul,震荡混匀15s,室温静置10min,4度12000rpm 离心15min,样品会分三层,有机层,中间层和上层无色透明水相。
中间层即为变性的蛋白层,上层无色透明水相包含有RNA,小心吸去上层水相层,不要吸到中间蛋白层。
上清转入新的EP管中,在向其加入100ul氯仿,做第二次抽提。
重复上一步骤后上清转入新的EP管中,加入250ul异丙醇,混匀,室温静置20-30min,或者-20度30min。
静置过后,4度12000rpm 离心15min,离心过后会看到乳白色的沉淀,吸走上清,小心沉淀很容易脱落,再用1ml 75% 乙醇(用DEPC水配置)洗沉淀,4度10000rpm离心5min,尽量弃上清,沉淀室温晾干3-5min,不要晾的过久否则RNA很难融。
取20ul DEPC水溶解RNA沉淀。
RT-PCR:测定好RNA的浓度后,取0.5ug进行反转录反应,本实验室使用Takara的快速反应试剂盒,每个反应加入0.5ug RNA,2ul 5×buffer,0.5ul Ramdom primer,0.5ul Oligo DT,0.5ul 反转录酶Mix,加DEPC水定容到10ul,37度静置15min,85度5s失活反转录酶。
也可以不使用试剂盒,逆转录每个反应加入2ug RNA,4ul dNTP(2。
5mM),2ul Oligo DT 或Ramdom primer(0.5ug/ul)加DEPC水至16ul,70度孵育5min,快速置于冰上,冰浴5min,然后加入5×RT Buffer 4ul,逆转录酶0.5ul,RNA酶抑制剂0.5ul,42度孵育1-2h。
95度孵育5min以失活逆转录酶,得到的样品就是cDNA。
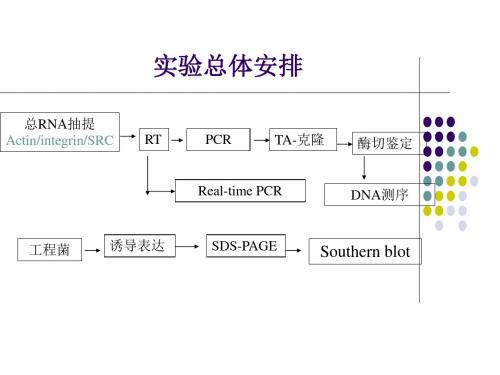
RNA提取RTPCR
三、实验步骤:
RNase free dH2O 10µl 70℃、10min 冰上急冷、2min
Oligo(dt15) primer(50µM) 2 µl Total RNA 2 µl
5×M-MLV buffer 离心数秒
4 µl 1 µl
20 µl体系 0.5 µl
dNTP Mixture (10 mM each) RNase Inhibitor(40U/µl)
RTase M-MLV(RNase H-)(200U/µl) 0.5µl 42 ℃、60min 70 ℃、15min 冰上冷却即得到总cDNA
PCR
一、实验原理:
PCR(Polymerase Chain Reaction,聚合酶链式反 应)。聚合酶链式反应(PCR)是体外酶促合成特异 DNA片段的一种方法,由高温变性、低温退火(复 性)及适温延伸等几步反应组成一个周期,循环进 行,使目的DNA得以迅速扩增,具有特异性强、灵 敏度高、操作简便、省时等优点。 标准反应中一般采用三温度点法,双链DNA在90-95℃ 变性,再迅速冷却至40-60℃,引物退火并结合到靶 序列上,然后快速升温至70-75℃,在TaqDNA聚合酶 的作用下,使引物链沿模板延伸。
PCR反应程序
94℃ 94℃ 57.0℃ 72℃ 72℃ 4min 40s 40s 1.5mim 10min
35个循环
反应结束后,取反应液10μ l进行琼脂糖凝胶电泳, 确认μ l Eppendorf管(PCR管)中依次加入: ddH2O 15μ l 10×PCR Buffer 2.5μ l Mg2+ 2 μ l dNTP (10 mM) 1μ l primer 1 1μ l primer 2 1μ l 模板 2μ l Taq酶 0.5μ l Total 25μ l
植物总RNA的提取及RT-PCR

植物总RNA的提取及RT-PCR一、实验目的1. 学习从植物组织中提取总RNA的方法2. 了解RT-PCR的基本原理和实验方法二、实验原理1. RNA提取的原理RNA是一类极易降解的分子,要得到完整的RNA,必须最大限度地抑制提取过程中内源性及外源性核糖核酸酶对RNA的降解。
高浓度强变性剂异硫氰酸胍可溶解蛋白质,破坏细胞结构,使核蛋白与核酸分离,失活RNA酶,所以RNA从细胞中释放出来时不被降解。
细胞裂解后,除了RNA,还有DNA、蛋白质和细胞碎片,通过酚、氯仿等有机溶剂处理得到纯化、均一的总RNA。
2. RT-PCR的原理提取组织或细胞中的总RNA,以其中的mRNA作为模板,采用Oligo(dT)作引物利用逆转录酶反转录成cDNA。
再以cDNA为模板进行PCR扩增,获得目的基因或检测基因表达。
RT-PCR使RNA检测的灵敏性提高了几个数量级,使一些极为微量RNA 样品分析成为可能。
该技术主要用于分析基因的转录产物、获取目的基因和合成cDNA 探针等。
三、仪器、药品与试剂配方(一) 仪器及器皿1.低温离心机;2.琼脂糖凝胶电泳系统;3.高压灭菌锅;4. PCR仪;5.研钵; 6. 一次性手套等;7. 离心管;8. 培养皿;9. 烧杯及试剂瓶等。
(二) 药品1. 焦碳酸二乙酯(DEPC)2. 异硫氰酸胍(GT)3. 醋酸钠(NaAc)4. 苯酚5. 异丙醇6. 氯仿7. 乙醇8. β-巯基乙醇9. 琼脂糖10. MLV反转录试剂盒11. Taq DNA聚合酶12. 引物(三) 试剂配制1. 0.1% DEPC水灭菌2. 4 mol/L异硫氰酸胍3. 2 mol/L NaAc (pH4.8)灭菌4. 3 mol/L NaAc (pH 4.8)灭菌5. 4 mol/L LiCl 灭菌6. 1×TE缓冲液:10 mM Tris-HCl(pH8.0),1 mM EDTA(pH8.0), 灭菌。
四、实验步骤(一)总RNA的提取(1)研钵冷却后,倒入2/3液氮,加入0.2 g植物材料,充分研磨后转入一个含有300 μl的4M GT的1.5 ml的聚丙烯管中,摇匀。
总RNA的提取和RT-PCR

Taq DNA聚合酶:用于PCR 扩增。
04
05
引物:用于特异性地扩增目 标基因片段。
实验步骤
总RNA提取
逆转录
使用总RNA提取试剂从细胞或组织中提取 总RNA。
将提取的RNA与逆转录酶、dNTPs混合, 合成cDNA。
PCR扩增电泳ຫໍສະໝຸດ 析将合成的cDNA与Taq DNA聚合酶、引物 混合,进行PCR扩增。
避免使用锐器,如刀 片、针头等,以防意 外伤害。
使用一次性手套和实 验服,避免交叉污染。
实验操作注意事项
使用高质量的试剂和耗材,确保 实验结果的准确性。
在实验过程中,要保持低温环境, 以防RNA降解。
严格按照试剂盒说明书进行操作, 避免操作失误导致实验失败。
实验质量控制注意事项
1
在实验前进行质量控制,确保实验设备和环境的 清洁度。
洗涤RNA
加入等体积的异丙醇,混合均 匀后离心,弃去上清液,用 75%乙醇洗涤RNA沉淀。
干燥RNA
将RNA沉淀晾干,溶解于DEPC 处理的水中。
02
RT-PCR
实验原理
逆转录
逆转录是指以RNA为模板,通过逆转录酶的作用合成cDNA的过程。在RT-PCR中, 逆转录酶将RNA转化为cDNA,以便进行后续的PCR扩增。
在疾病诊断和治疗中的应用
病原微生物检测
肿瘤诊断和预后评估
RT-PCR技术可用于检测和鉴定病原 微生物,如病毒、细菌和寄生虫等, 为疾病的诊断提供快速和准确的方法。
通过检测肿瘤组织中特定基因的表达 水平,可以辅助肿瘤的诊断和预后评 估,为制定治疗方案提供依据。
耐药性基因检测
通过RT-PCR技术可以检测病原微生 物中的耐药性基因,了解其耐药机制, 为临床治疗提供指导。
提取RNA,以及RT-PCR的问题整理

Trizol法提取组织总RNA:1、将组织置于匀浆器后,再以50-100mg(一般50mg足矣)组织加入1ml Trizol液研磨,注意样品总体积不能超过所用Trizol体积的10%。
2、取出组织匀浆室温放置5分钟,然后以每1mlTrizol液加入0.2ml的比例加入氯仿,盖紧离心管,用手剧烈摇荡离心管15秒。
3、取上层水相于一新的离心管,按每mlTrizol液加0.5ml异丙醇的比例加入异丙醇,室温放置10分钟,12000g离心10分钟。
4、弃去上清液,按每ml Trizol液加入至少1ml的比例加入75%乙醇,涡旋混匀,4℃下7500g 离心5分钟。
5、小心弃去上清液,然后室温或真空干燥5-10分钟,注意不要干燥过分,否则会降低RNA的溶解度。
然后将RNA溶于水中,必要时可55℃-60℃水溶10分钟。
RNA可进行mRNA分离,或贮存于70%乙醇并保存于-70℃。
RT-PCR实验有三步:抽提RNA,RT,PCR。
要求:1.做RT前必需测RNA浓度,逆转录体系对RNA量还是有一些要求,常用500ng或1ug。
2. RT按要求做,一般不会出太大问题。
3. PCR,按常规。
但如需扩长片段,则对前两步要求较高,需要有完整的cDNA存在,不是单改变Mg2+浓度、退火温度能解决的。
1)RT和PCR时的引物设计是不是一定要先知道目的基因的序列?必须在RT时,引物设计有3种方法即a:Random 9mers;b:Oligo dT-Adaptor Primer;和c:特异的下游引物。
如果用a和b方法,是扩增的所有的cDNA(理论上),还要用此产物做PCR 的模板继续扩增。
如果用c方法,那么要去那里查它的序列呢?问题:在做RT-PCR遇到一怪现象,即对同一动物不同组织扩增同一段基因,结果从一种组织中可以扩出我的目的基因,条带非常的好,而另一组织在同样的条件下却得到许多非特异性的条带,尝试其他条件同样无法得到满意的结果,百思不得其解!(注:已肯定该基因在两种组织中都表达,且内参照在两种组织都可扩增出来)从这两种组织中提取的RNA的量是不一样的,我测过吸光度,差异还很大,会不会和这有关呢?请高手指教!解答:1.RT-PCR有两种做法:条件具备的话可用kit进行一步法进行;若条件不太好的话可分两步进行逆转录再PCR。
RNA提取,PCR以及rt-PCR的实验试剂配制及操作流程

RT-PCR所需1、0.1% DEPC水:1000ml的蒸馏水中加入1ml的DEPC粉剂,磁力搅拌器搅拌过夜,第二天,高压蒸汽灭菌备用2、5×TBE琼脂糖凝胶电泳缓冲液:54gTris,3.72gNa2EDTA,27.5g硼酸,蒸馏水溶解,调PH为8.3,充分搅拌,定容止1000ml.3、溴化乙啶(10mg/ml):称取1g溴化乙啶至于100ml烧杯中,加入80ml去离子水后充分搅拌,将溶液定容至100ml,转移到棕色瓶中保存。
RNA提取1向10cmdish中加入1mlTrizol,用移液枪反复吹吸至裂解液中无明显沉淀2.冰上放置5min,加入氯仿200ml,猛烈震荡15s3.冰上静置2-3min,4℃离心,1200g,15min4.取上层水相至新的EP管中,加入500ul异丙醇混匀,冰上静置10min5. 4℃离心, 1200g,10min,弃上清,加入75%乙醇(用低温DEPC水配制),轻轻混匀6. 4℃离心, 7500g,5min,后弃上清,室温干燥5min7.用适量DEPC水溶解沉淀,混匀后,测浓度,进行琼脂糖凝胶电泳验证,可于-80℃保存十七、PCR1.cDNA制备(1)在EP管中配下列混合液Total RNA的模板使用量一般为5ug以下,mRNA的使用量一般为1ug以下(2).65℃保温5min后迅速在冰上急冷2min以上(3).离心数秒钟使模板RNA/引物等混合物集中于EP管底部(4).在上述EP管中配制下列反转录反应液(5).42℃ 30-60min(6)70℃保温15分钟后冰上冷却,得到的cDNA 溶液可保存于-80℃ 2.PCR(1).引物设计 用Primer5软件设计并在NCBI 中进行比对 (2).PCR 反应体系(一般30的反应体系)PCR 反应条件 98℃ 10s 55℃ 5/15 72℃ 1min/kb轻轻混匀,离心,置入PCR 仪进行反应 (3).琼脂糖凝胶电泳检测十八、Real time –PCR1. 梯度稀释的标准品及待测样品的管家基因(β-actin )实时定量PCR(1)Actin 标准梯度制备 阳性模板的浓度为1011,反应前取3μl 按10倍稀释(加水27μl 并充分混匀)为1010,依次稀释至109、108、107、106、105、104,以备用 (2)反应体系 标准品反应体系30循环轻弹管底将溶液混合,6000rpm 短暂离心。
(完整)总RNA的提取定量与RT-PCR

生物化学实验报告姓名:学号:专业年级: 级临床八年制组别:第二实验室生物化学与分子生物学实验教学中心【预习报告】一、实验原理1)总RNA的提取与定量在哺乳动物中,平均每个细胞内大约含有10-5μg RNA,其中rRNA占总量的80%—85%,tRNA和核内小分子RNA占10—15%,而mRNA只占1—5%。
rRNA由28S、18S、5S等几类组成,这些RNA分子根据密度和分子大小,通过密度梯度离心、凝胶电泳、离子交换层析进行分离。
mRNA分子种类繁多,分子量大小不均一,在细胞中含量少,绝大多数mRNA分子(除血红蛋白、有些组蛋白mRNA以外),在3’端存在20—250个多聚腺苷酸(polyA)。
利用此特点,用oligo(dT)亲和层析柱分离mRNA。
RNA分离的方法有:异硫氰酸胍氯化铯超速离心法,盐酸胍—有机溶剂法,氯化锂-尿素法,蛋白酶K-细胞质RNA提取法等、异硫氰酸胍-酚-氯仿一步法等。
目前常用的是Trizol法.Trizol试剂适用于从细胞和组织中快速分离RNA.TRIzol的主要成分是异硫氰酸胍和酚。
异硫氰酸胍属于解偶剂,是一类强力的蛋白质变性剂,可溶解蛋白质主要作用是裂解细胞,使细胞中的蛋白,核酸物质解聚得到释放。
酚虽可有效的变性蛋白质,但是它不能完全抑制RNA酶活性,因此Trizol中还加入了8-羟基喹啉、β-巯基乙醇等来抑制内源和外源RNase。
在加入氯仿离心后,溶液分为水相和有机相,RNA选择性地进入无DNA和蛋白质的水相中。
取出水相用异丙醇沉淀可回收RNA;用乙醇沉淀中间层可回收DNA;用异丙醇沉淀有机相可回收蛋白质。
Trizol试剂可用于小量样品(50~100mg组织、5×106细胞)也适用于大量样品(≥1g组织、〉107细胞)。
对人,动物,植物组织,细菌均适用,整个提取过程在一小时内即可完成。
分离的总RNA无蛋白质和DNA污染,可用于Northern blot,dot blot,ployA筛选,体外翻译,RNase 保护分析和分子克隆。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
仪器和主要试剂
1. 基因扩增仪、微量加样枪、灭菌超薄PCR反应 管
2. 总RNA 3. 第一链cDNA合成试剂盒 (含有逆转录酶、 RNA酶抑制剂、缓冲液) 4. dNTP mix:含dATP、dCTP、dGTP、dTTP各 2 mmol/L
操作步骤
采用康为世纪HiFi-MMLV cDNA Kit 合成cDNA第一链
RNA评价与鉴定
分光光度计法检测RNA的浓度:RNA在260nm波长处
有最大的吸收峰。因此,可以用260nm波长分光测定RNA浓 度,OD值为1相当于大约 40μg/ml 的单链RNA。用双蒸水稀 释RNA样品n倍并以双蒸水为空白对照,根据此时读出的 OD260 值即可计算出样品稀释前的浓度:
用移液枪反复吹吸,直至 收集适量细胞, (1) 裂解液中无明显沉淀 加1ml Trizol 室温静置3min
(2)
向裂解液中 加200 μ l氯仿
盖紧离心管盖,用手振荡15s 室温静置3min (3)
4℃, 12000g 离心15min
(4)
吸取上清液400~450 μ l 向上清中加入等体积 上下颠倒离心管充分混匀 至另一新离心管中 室温静置5min (6) (5) 异丙醇混匀 (切忌吸出白色中间层) 4℃, 12000g 离心10min
(一)反转录酶的选择
1. 鼠白血病病毒(MMLV)反转录酶:有强的聚合酶活性,RNA酶H活性 相对较弱。最适作用温度为37℃。在长时间的逆转录过程中,不会造 成模板的降解,获得cDNA的几率大,适用于较长的cDNA链的合成。
2. 禽成髓细胞瘤病毒(AMV)反转录酶:有强的聚合酶活性和RNA酶H 活性。最适作用温度为42℃。 3. Thermus thermophilus、Thermus flavus等嗜热微生物的热稳定性 反转录酶:在Mn2+存在下,允许高温反转录RNA,以消除RNA模板的 二级结构。 4. MMLV反转录酶的RNase H-突变体:商品名为Superscript 和 SuperScriptⅡ。此种酶较其它酶能多将更大部分的RNA转换成cDNA, 这一特性允许从含二级结构的、低温反转录很困难的mRNA模板合成较 长cDNA。
原 理
RT-PCR是将RNA的反转录(RT)和以反转录产物
cDNA为模板的聚合酶链式扩增(PCR)相结合的技术。 首先经反转录酶的作用从RNA合成cDNA,再以cDNA
为模板,扩增合成目的DNA片段。RT-PCR技术灵敏而且用 途方便,可用于检测细胞中基因的表达水平,细胞中RNA
病毒的含量和直接克隆特定基因cDNA序列等研究。
小心弃去上清 缓慢沿离心管壁
(7)
轻轻上下颠倒
(8) 洗涤离心管壁
加入1ml 75%乙醇
4℃, 12000g 离心5min 室温干燥沉淀2min 小心尽量弃去乙醇 (9)
加入10μ l DEPC水 溶解沉淀, -80℃保存备用
关键点
所有RNA的提取过程中都有五个关键点:
1.样品细胞或组织的有效破碎; 2.有效地使核蛋白复合体变性; 3.对内源RNA酶的有效抑制; 4.有效地将RNA从DNA和蛋白混合物中分离; 5.对于多糖含量高的样品还牵涉到多糖杂质的有效除去。
防止RNA酶污染的措施
1. 所有的玻璃器皿均应在使用前于180℃的高温下干烤6h或更长时间。
2. 塑料器皿可用0.1%DEPC水浸泡12h以上,高压灭菌。 3. 有机玻璃的电泳槽等,可先用去污剂洗涤,双蒸水冲洗,乙醇干燥, 再浸泡在3%H2O2室温10min,然后用0.1%DEPC水冲洗,晾干。 4. 配制的溶液应尽可能用0.1% DEPC在37℃处理12h以上。然后用高 压灭菌除去残留的DEPC。不能高压灭菌的试剂,应当用DEPC处理 过的无菌双蒸水配制,然后经滤膜过滤除菌。 5. 操作人员戴一次性口罩、帽子、手套,实验过程中手套要勤换。 6. 设置RNA操作专用实验室,所有器械等应为专用。
真核生物RNA聚合酶Ⅱ转录因子及其功能
2. 起始
a. RNA聚合酶结合在DNA上形成闭 合启动子复合体;
b. δ因子促使聚合酶由闭合启动子 复合体转变为开放启动子复合体;
c. 聚合酶合成9~10nt的初生RNA产 物; d.聚合酶的启动子清除,进入转录 延伸阶段, δ因子在此时或进入延 伸阶段以后被释放。
RNA转录基本过程
曹玉霖 2018.11.13
DNA指导下的RNA合成
• 在RNA聚合酶的催化下,以一段DNA链为模 板合成RNA,从而将DNA所携带的遗传信息传递 给RNA的过程称为转录。 RNA转录合成时,只能以DNA分子中的某一 段作为模板,故存在特定的起始位点和特定的终 止位点。特定起始点和特定终止点之间的DNA链 构成一个转录单位。
(二)引物的选择
1. 随机六聚体引物:此种方法适合各种RNA的RT,尤其适合峰度低 的模板和具有复杂二级结构的模板,体系中所有RNA分子全部充 当了cDNA第一链模板,通常用此引物合成的cDNA中96%来源于 rRNA。 2. Oligo(dT):是一种对mRNA特异的方法。Oligo(dT)要求RNA必 须有Poly A,所以适用于真核生物的mRNA。 Oligo(dT)主要适合 长链甚至全长mRNA的RT,对RNA样品的质量要求较高,不要有 明显的DNA污染、RNA降解和RNA断裂。
按下列组分配制RT反应液
1. dNTP Mix (2.5mM Each) 2. Primer Mix 4 l 2 l
3. 5×RT Buffer
4. DTT (0.1M) 5. HiFi-MMLV (200U/ml)
4 l
2 l 1 l
Total RNA
7 l
反转录反应条件如下 42℃ 40min (反转录反应) 70℃ 15min (反转录酶失活反应) 注:反转录步骤在PCR仪中进行
原核生物启动子
真核生物的转录起始区上游也存在一段富 含TA的顺序,被称为Hogness盒或TATA盒。 除此之外,在真核生物中还可见到其他带共性 的序列,如CAAT盒及GC盒等。 真核生物的转录起始较为复杂。
目前已知RNA聚合酶Ⅱ 至少有六种不同的蛋白 因子参与转录复合体的 形成。这些蛋白因子被 称为转录因子 (transcriptional factor, TF)。包括 TFⅡA, TFⅡB, TFⅡD, TFⅡE, TFⅡF, TFⅡI。
PCR反应体系
取0.2 ml PCR反应管一只,用微量加样枪按下述顺序分别加入各试剂 (注意每换一种试剂换一个新吸头): 第一链cDNA 2l
PerfectShot Taq(绿色) 上游引物 (10M)
下游引物 (10M) RNase free H2O
10l 1l
1l 6l
总体积
20l
如配好的反应液较多沾到管壁上,可将PCR反应管置台式离心机中瞬时 离心,使反应液集中于管底,然后将反应管放到基因扩增仪(PCR仪)上 .
真核生物中的RNA聚合酶可按其对α-鹅膏 覃碱敏感性分为三种,它们均有10~12个大小 不同的亚基所组成,结构非常复杂,其功能也 不同。
RNA转录合成的基本过程
1. 识别
原核生物RNA聚合酶的δ因子识别转录起始点,并促使 核心酶结合形成全酶复合物。 RNA聚合酶与与启动子结合后,可开始转录。 启动子:位于基因上游,与RNA聚合酶识别、结合并起 始转录有关的一些DNA顺序称为启动子。 原核生物中的两个启动子:-10序列和-35序列。
悬浮细胞先离心沉淀,每5-10 ×106个细胞加1ml Trizol后,反复用枪吹打或 剧烈振荡以裂解细胞。 培养贴壁细胞不须消化,可直接用Trizol进行消化、裂解,Trizol体积按 10cm2/ml比例加入。 (注意:匀浆一定要彻底,是提取高质量RNA的前提;细胞数量与Trizol的比
操作步骤
RNA (μg/ml) = 40×OD260 读数×稀释倍数(n)
RNA纯度检测
分光光度计法:
RNA纯品的OD260 /OD280 的比值为2.0,故根据OD260
/OD280 的比值可以估计RNA的纯度。
若OD260/OD280小于2,说明可能有DNA片段污染; 若小于1.8,说明样品中还可能含有蛋白质或酚,应再用酚/氯仿 抽提,以乙醇沉淀纯化RNA; 若比值太高(大于2.2),则提示RNA有降解。
植物材料-液氮研磨
动物材料-匀浆、液氮研磨
细菌-溶菌酶破壁
酵母-液氮研磨、玻璃珠处理
RNA提取流程
2. 细胞裂解
方法:异硫氰酸胍氯化铯超速离心法,盐酸胍-有机 溶剂法,氯化锂-尿素法,蛋白酶K-细胞质RNA提取 法等、异硫氰酸胍-酚-氯仿一步法等。 目前常用的是Trizol法。
提取组织RNA时,每50~100mg组织用1ml Trizol试剂对组织进行裂解;
RNA完整性检测
琼脂糖凝胶电泳:
完整RNA的电泳可明显地观察 到28S和18S两条带,并且28S 大约是18S的两倍宽(RNA完整 性较好)。
若两条带不明显, 则说明RNA部 分降解,可能的原因是污染了 RNase。
逆转录-聚合酶链反应
(Reverse Transcription-Polymerase Chain Reaction,RT-PCR)
RNA转录合成时,只能向一个方向进行聚 合,所依赖的模板DNA链的方向为3’ →5’,而 RNA链的合成方向为5’ →3’。
合成的RNA中,如只含一个基因的遗传信 息,称为单顺反子;如含有几个基因的遗传信 息,则称为多顺反子。
原核生物中RNA聚合酶全酶由5个亚基构成, 即α2ββ’ δ。 δ亚基与转录起始点的识别有关,而在转录合成 开始后被释放,余下的部分( α2ββ’ )被称为 核心酶,与RNA链的聚合有关。
