药物化学PPT课件第四章 新药研究概论
药物化学PPT课件完整版

O
O
NH2CONH2 C2H5ONa
H3C RH2C
CH R/
N NH
ONa
H+
H3C CH RH2C R/
NH O
NH
HN
O
3. 举例:苯巴比妥
O3
•结构式:
4NH
H 5C 2 O
52
6
N
H
1
O
•化学名:5-乙基-5-苯基丙二酰脲,又名鲁米那
C H 2 C lK C N
C H 2 C NH 2 O
第二章、麻醉用药
临床上使用的麻醉用药包括: 全身麻醉药(全麻药)、
局部麻醉药(局麻药) 和麻醉辅助药(肌肉松弛药)。
•全身麻醉药作用于中枢神经,使其受到可逆性抑制, 从而使意识、感觉和反射消失;
•局部麻醉药作用于神经末梢和神经干,阻滞神经冲动 的传导,使局部的感觉消失; •肌肉松弛药又称骨骼肌松弛药或肌松药,作用在神经 肌肉接头处,可使骨骼肌完全松弛。
•药物研究和开发的各个环节,要严格控制,符合要求, 目的是保证药物的有效和安全。
传统的新药研究与开发的模式
现代新药设计
基因治疗药物
基于疾病发生机制的药物设计 基于药物作用靶点结构的药物设计
合理药物设计:依据生物化学、酶学、分子生物学及分
子遗传学等领域的研究成果,针对这些基础研究所揭示的包括
酶、受体、离子通道、核酸等潜在的药物作用的靶点,以
COOCH2CH2N
C2H5 C2H5
.HCl
•化学名:对-氨基苯甲酸-β-二乙氨基乙酯盐酸盐,
O2N
又名奴佛卡因
CH3 Na2Cr2O7,H2SO4O2N
COOH
HOCH2CH2N(C2H5)2O2N
中山大学药学综合课件-第四章 新药研究与开发概论(XS-20070822)
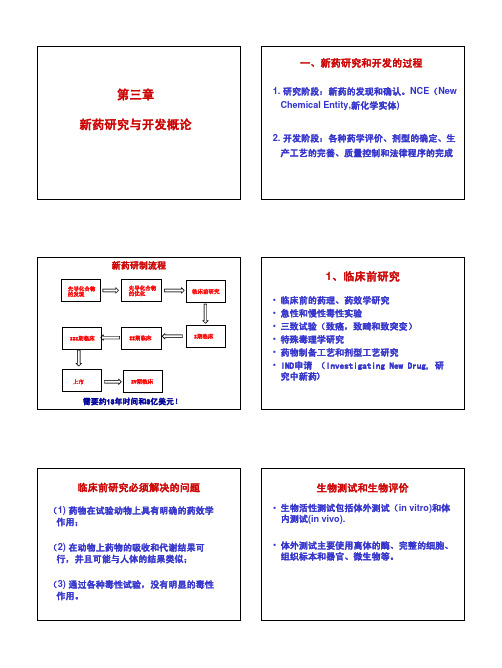
第三章新药研究与开发概论一、新药研究和开发的过程1. 研究阶段:新药的发现和确认。
NCE(New Chemical Entity,新化学实体)2. 开发阶段:各种药学评价、剂型的确定、生产工艺的完善、质量控制和法律程序的完成新药研制流程先导化合物的发现先导化合物的优化临床前研究I期临床II期临床III期临床IV期临床上市需要约13年时间和3亿美元!1、临床前研究•临床前的药理、药效学研究•急性和慢性毒性实验•三致试验(致癌,致畸和致突变)•特殊毒理学研究•药物制备工艺和剂型工艺研究•IND申请(Investigating New Drug, 研究中新药)临床前研究必须解决的问题(1) 药物在试验动物上具有明确的药效学作用;(2) 在动物上药物的吸收和代谢结果可行,并且可能与人体的结果类似;(3) 通过各种毒性试验,没有明显的毒性作用。
生物测试和生物评价•生物活性测试包括体外测试(in vitro)和体内测试(in vivo).•体外测试主要使用离体的酶、完整的细胞、组织标本和器官、微生物等。
•体内测试的重要性在于确定候选的药物在有生命系统中能否达到预期的靶点,产生希望的生理效应,是否有其他的不良反应。
NSCOOMeMe Me H H NR OH ON S COOHMe MeH H NROH O水解酶青霉素青霉素甲酯生物测试的指标•ED 50是指50%的受试动物产生预期生理活性的药物剂量。
•LD 50(半数致死剂量)是指50%受试动物死亡时的药物剂量。
•药物的治疗指数(LD 50与ED 50的比值),越大表示药物越安全。
9550551050100药物效能治疗剂量曲线致死剂量曲线剂量(mg)ED 50LD 50一种镇静药物的治疗和致死剂量-药物效应曲线2、临床研究•I期临床研究:确定新药在人体上的毒性和耐受性,获得药物代谢动力学数据。
•II期临床研究:在少量的病人身上进行新药的药效学研究,确证药物具有明确的疗效,观察药物的安全性和不良反应,确定最佳的用药剂量等。
《药物化学》ppt课件

药物的化学结构也影响其稳定性,如某些药物在光、热、酸、碱等 条件下容易发生分解或变质。
03
药物合成与反应
药物合成的基本方法
01
02
03
化学合成法
通过化学反应将简单化合 物转化为复杂药物分子, 包括加成、消除、取代、 重排等反应。
生物合成法
利用生物体内的代谢途径 和酶催化反应合成药物, 如发酵工程、基因工程等。
药物化学的历史与发展
早期的药物化学
早期的药物主要来源于天然产物,如植物、动物和矿物等。人们通过经验和试错的方式发现 了一些具有治疗作用的物质,并逐渐积累了一些用药的知识。
近代药物化学的发展
随着化学和医学科学的进步,人们开始运用化学方法对天然产物进行分离、纯化和结构鉴定, 进而合成了一些具有相似或更好疗效的药物。同时,人们也开始探索通过化学方法合成全新 的药物。
高纯度的药物产品。
04
药物设计与优化
药物设计的基本原理
基于受体结构的药物设计
通过了解受体的三维结构和作用机制,设计与之匹配的药物分子。
基于配体的药物设计
通过分析已知活性化合物的结构特征,设计具有相似或改进活性的 新药物。
计算机辅助药物设计
利用计算机模拟和预测药物与受体的相互作用,指导药物分子的优 化。
06
新药研究与开发
新药研究的策略与方法
基于靶点的研究策略
通过寻找与疾病相关的特定靶点,设计和合成能够与之相互作用的候 选药物。
基于表型的研究策略
通过观察疾病表型的变化,寻找能够逆转或改善疾病表型的候选药物。
基于天然产物的研究策略
从天然产物中筛选具有药理活性的化合物,进行结构优化和改造,以 获得更好的药效和安全性。
药物化学课件ppt

总结词:介绍新药开发的流程和策略,包括靶点发现与验证、先导化合物的筛选与合成、候选药物的选定与优化等。
总结词
介绍几个具有代表性的创新药物研发案例,包括治疗癌症、心血管疾病、神经退行性疾病等方面的药物。
要点一
要点二
详细描述
近年来,随着生物医药技术的不断发展,越来越多的创新药物被研发出来。例如,针对癌症的治疗药物,如PD-1抑制剂、PARP抑制剂等,能够通过调节免疫系统或抑制肿瘤细胞生长等方式发挥抗癌作用。针对心血管疾病的治疗药物,如ACE抑制剂、ARBs等,能够降低血压、保护心脏和肾脏等器官。针对神经退行性疾病的治疗药物,如阿尔茨海默病药物等,能够改善认知功能和延缓疾病进展。这些创新药物的研发成功为人类健康事业做出了巨大贡献。
氧化还原反应
在酸或碱的催化下,醇与羧酸或其他含羧基的化合物反应,生成酯类化合物。
酯化反应
两个或多个分子之间发生反应,形成新的化学键,同时生成新的分子。
缩合反应
按照实验步骤进行操作,控制好反应温度、压力、浓度等条件。
实验操作
注意安全问题,如使用腐蚀性试剂时需佩戴防护眼镜和手套;注意环保问题,如废液的处理和回收;注意实验记录和报告的撰写,确保实验数据的真实性和完整性。
CHAPTER
06
药物化学的未来发展与挑战
THANKSFOR
感谢您的观看
WATCHING
药物化学课件
药物化学概述药物分子的化学结构与性质药物合成的基本原理与技术药物设计与新药开发药物化学的应用与实践药物化学的未来发展与挑战
contents
目录
CHAPTER
01
药物化学概述
总结词
药物化学是一门研究药物分子的化学性质、结构特征、构效关系及其与生物活性关系的科学。
药学导论第四章药物化学PPT课件

• 对药物转运代谢过程和规律的研究是安全合理用 药和新药设计的重要课题。为安全合理用药和新 药设计提供依据。
-
13
第四节 有机药物的化学结构修饰
• 化学结构改造是利用各种化学原理,将药物化学结构加以衍化或者进行显 著改变,以获得新药的方法。
• 药物开发的过程
• 药物发现 • 临床前研究 • 临床研究与应用
-
25
药与某种无毒性的化合物连接而形成。
-
16
提高药物的选择性
OH
己烯雌酚
HO
PO3H
己烯雌酚 二磷酸酯
HO3盐修饰
• 酸性较强具有羧基的药物多做成钾、钠或钙盐 类
• 酸性较羧基药物弱的具有酰亚胺基和酰脲基的 药物,一般做成钠盐
• 酸性较羧基药物强的具有磺酸基、磺酰胺基或 磺酰亚胺基的药物,通常做成碱金属盐类
• 解热镇痛药物(阿司匹林、对乙酰氨基酚) • 非甾体抗炎药物(羟布宗、甲芬那酸)
-
20
第五节 常见有机药物简介
• 抗生素药物
• β内酰胺抗生素(青霉素、阿莫西林、头孢氨苄、克拉维酸) • 四环素类抗生素(四环素、土霉素) • 氨基糖苷类抗生素(链霉素、卡拉霉素) • 大环内酯类抗生素(红霉素、泰利霉素) • 氯霉素类抗生素(氯霉素、甲砜霉素)
华力等作用力来产生药效。
-
11
• 药物的立体结构对药效的影响
• 立体结构:特定原子间的距离、手性中心、取代基的位置等
• 通过立体结构的改变影响药物分子与受体大分子间结构上的互补性和复合物的形成来 影响药效
-
12
第三节 药物的转运代谢与药效 关系
药物化学MedicinalChemstry

PPT文档演模板
药物化学MedicinalChemstry
药物化学的任务
(The purpose of medicinal chemistry)
v 1.不断探索研究和开发新药 发现具有进一步研究、开发价值 的先导化合物(Lead Compounds),对其进行结构改造和 优化,创制出疗效好,毒副作用小的新药;改造现有药物或 有效化合物,以期获得更为有效、安全的药物。
v The structure of the lead compound is then modified by synthesis to amplify the desired activity and to minimize or eliminate the unwanted properties.
of bioactive compounds
v The MW is over 500; v The lg P is over 5; v There are more than 10 rotary bonds; v There are more than 5 H-bond donors; v There are more than 10 H-bond acceptors.
v The lead compound is a prototype compound that has the desired biological or pharmacological activity, but may have many other undesirable characteristics, for example, high toxicity, other biological activities, insolubility, or metabolism problems.
新药研究的发展与研究过程PPT课件

• 3.临床前毒理学研究
• 毒理学研究的主要目的是对新药的安全作出评价,为临 床试验用药提供科学依据,保证用药安全。主要包括急性 毒性、亚急性毒性或慢性毒性、局部毒性以及特殊毒性等。
• 2药物化学的研究内容 • 虽然药物化学的研究内容很多,但从大的方面来看主要包
括以下两点:
• ① 已知药理作用并在临床上应用的换以及化学结构和 药理活性之间的关系(构效关系)。解决的问题是什么是 好药,如何得到安全有效的药物。
• ② 从生物学和化学角度设计和创制新药,主要研究药物 与生物体相互作用的物理化学过程,从分子水平上揭示药 物作用机理和作用方式包括在体内的变化(ADME的研 究)。解决的问题是如何找到更安全有效的药物,为什么 是好的药物。
• 利用反义寡核苷酸技术通过抑制特定的信使RNA对蛋白 质的翻译来确认新的靶标。例如嵌入小核核糖核酸 (snRNA)控制基因的表达,对确证靶标有重要作用。
• 2.生物学模型机体外评价方法的建立
• 靶标选定以后,就要建立生物学模型和各种体外评价方 法,建立药理实验的基本动物模型等,以筛选和评价化 合物的活性。
• 4. 天然物提取
• 从天然化合物中提取有效单体并进行相应的改造,已经成 为新药开发的一个重要手段,目前约有一半左右的临床用 药是天然产物及其衍生物,包括像抗生素这一大类作用显 著、品种繁多的药物,如吗啡(1804年)奎宁(1820年)、 可卡因(1860年)利血平(1918年)以及阿托品、青霉素、 氯霉素、青蒿素、长春新碱、喜树碱、紫杉醇等。
• 药物指的是可以“用于预防、治疗、诊断人的疾病,有目 的的调节生理功能并规定有适应症、用法和用量的物质 。
• 从从分子角度来看,药物就是在体内可以与大分子靶点相 互作用并能产生药理活性的小分子化学物质,药物所产生 作用的有益还是有害取决于使用的药物和药物的量。
第四章 新药研究概论 PPT课件

1. 天然生物活性物质作为先导物
• 天然生物活性物质来源广泛
– 植物 – 动物 – 微生物 – 海洋生物 – 矿物
• 天然生物活性物质的特点
– 新颖的结构类型(分子多样性) – 独特的药理活性 – 资源有限及地域性差异 – 有效成分含量很低 – 大多数结构复杂,作用强度不同
一、天然生物活性物质
(一)青蒿素
青蒿素是我国学者自黄花蒿分离出的倍半萜类化 合物,具有强效抗疟作用。青蒿素分子中含有的过 氧键证明是必要的药效团。由于青蒿素的生物利用 度较低,而且复发率较高,对其进行优化获得一些 更好的治疗各种疟疾的药物。
O OO
O
O 青蒿素
O OO
O
OR
R=H 二氢青蒿素
R=CH3蒿甲醚 R=COCH2CH2COOH 琥珀酸单酯钠青蒿琥酯
• 药物分子设计 Molecular Drug Design
– 概念及内容
• 先导化合物 Lead Compound
药物作用的三个重要相
给药剂量
剂型崩解药物溶出
可被吸收的药物 药物利用度
吸收、分布、代谢、排泄
可产生作用的药物 生物利用度
药物与靶点相互作用
药剂相 药代动力相 药效相
效应
Molecular drug design
第四章 新药研究概论
Outline of Drug Research
新药研究概论
• 引言 Introduction
• 先导化合物的产生 Lead discovery
• 先导化合物的优化 Lead optimization
第一节 引言
• 新药研发 R&D of New Drugs
– 新药
– 新药研发过程 – 新药研发涉及学科 – 新药研发特点
药学导论第4章-药物化学全解

穿过生物膜需要脂溶性的分子型。 与受体结合、相互作用需要离子型。 吸收、分布和保持有效浓度,需混合型。
三、药物的基本结构对药效的影响
在药物构效关系研究中,将具有相同药理 作用药物的化学结构中相同或相似的部分称为 相应类型药物的基本结构,即药物药效结构。 药物的基本结构决定结构特异性药物的 生物活性,是结构特异性药物与受体相互作用, 形成复合物而发生药效的必要结构。
一、决定药物药效的主要因素
1、药物必须以一定的浓度达到作用部位才能产生应有
的药效。与药物在体内的吸收、分布、排泄等多个过 程相关。 2、在作用部位,药物与受体相互作用,形成复合物,
可以引发、改变或阻断一系列相互依赖的生理、生化
过程,从而发挥治疗作用。依赖于药物特点的化学结 构,以及它与受体的空间互补性和结合点的化学键合
②
③ ④
第三节 药物的转运代谢与药效关系
药物的体内过程一般分为吸收、分布、代谢和排 泄。吸收、分布和排泄统称为转运。 药效产生依赖于 吸收和分布;代谢和排泄则控制了药物的作用过程和 持效时间。药物的转运代谢与药物的化学结构和理化 性质密切相关
一、药物吸收
药物吸收除受许多生理因素影响外,其化学结构、 酸碱性、解离度、脂水分配系数、晶型及颗粒大小等均 有显著影响。 胃的pH值为1~3,小肠5~7,大肠7~8。碱类吸收 随pH增大而增加;长链脂肪酸类随pH增大而减少,药 物的吸收与其解离度和脂水分配系数有关。脂溶性药物 易通过表皮角质层和脂蛋白,为被动扩散,无选择性
三、代谢
药物代谢是指药物在体内发生的结构变化。大多数药物 主要在肝脏,部分药物也可在其他组织,被有关的酶催化而 进行化学变化。 药物代谢常分为两相:
•
一相代谢:为生物转化反应(biotransformation reaction),包 括氧化、还原、水解等反应。 二相代谢:为结合反应(conjugation reaction),系和内源性物 质相结合的反应。
药物化学PPT课件第四章 新药研究概论(一)

7
2021/6/18
②检测系统的确定:
➢作用靶点选定后,需要建立对其作用可评价的检验测定的生物模型,
一般开始是用离体方法,在分子水平、细胞水平,或离体器官进行活
性评价,在此基础上用实验动物的病理模型进行体内试验。
➢这些体外或体内模型应定性和定量地反映出药物对所选定的靶点的
作用方式和程度,并与临床的病理过程相关联。
④先导化合物的优化:
➢为了进行先导化合物的优化,前人积累的各种经验性法则或规律是
重要的借鉴或依托。
➢对许多药物研制成功的过程和背景材料加以研究和系统化,可总结
出经验性规律,即化学结构与生物活性间的关系,利用这些定性或定
量的规律性变化加以引伸或扩展,特别是计算机辅助进行优化设计,
对先导物进行结构变换或修饰,以使生物学性质臻于完善,达到安全、
➢先导化合物又称原型物,简称先导物,是通过各种途径或方法得到
的具有某种生物活性的化学结构。
➢先导物未必是可实用的优良药物,可能由于药效不强,特异性不高,
药代动力学性质不合理,或毒性较大等缺点,不能直接药用,但作为
新的结构类型和线索物质,对进一步结构修饰和改造,即先导物的优
化,却是非常重要的。
9
2021/6/18
12
2021/6/18
基于生物大分子与配体小分子作用机理进行分子设计,即基于机理 的分子设计(mechanism-based molecular design),通过化学和分子模拟, 是产生先导物的重要方法; 根据化合物活性的多样性或临床使用中发现的副作用,可作为先导 物质,创制新药; 天然产物或合成的活性化合物的中间体也可成为先导物的来源; 随机筛选,一药多筛; 偶然发现,也可产生先导化合物。
2024年药物化学课件(带目录)

药物化学课件(带目录)药物化学课件一、引言药物化学是研究药物的化学结构、性质、合成方法、作用机制及其在生物体内的代谢过程的一门学科。
它是药物研发和创新的基础,对于提高药物疗效、降低毒副作用、缩短研发周期等方面具有重要意义。
本课件旨在介绍药物化学的基本概念、研究方法和应用领域,帮助读者了解药物化学的基本知识。
二、药物化学的基本概念1.药物化学的定义药物化学是一门研究药物的化学结构、性质、合成方法、作用机制及其在生物体内的代谢过程的学科。
它涉及到有机化学、生物化学、药理学、分子生物学等多个领域,是药物研发和创新的基础。
2.药物的化学结构药物的化学结构是决定其药效和毒性的重要因素。
药物分子通常由一个或多个活性中心组成,这些活性中心可以与生物体内的靶标分子发生特异性相互作用,从而发挥药效。
药物化学家通过对药物分子的化学结构进行改造和优化,可以提高药物的疗效和安全性。
3.药物的合成方法药物的合成方法对于药物的生产和应用具有重要意义。
药物化学家需要根据药物的化学结构和性质,选择合适的合成方法,包括有机合成、生物合成等。
有机合成是药物合成的主要方法,通过有机合成可以制备出具有特定化学结构的药物分子。
4.药物的作用机制药物的作用机制是指药物分子在生物体内的作用过程和作用方式。
药物的作用机制可以通过研究药物的化学结构、生物活性、代谢过程等方面来揭示。
了解药物的作用机制有助于我们更好地理解药物的作用效果和副作用,从而指导药物的研发和应用。
5.药物的代谢过程药物在生物体内的代谢过程是指药物分子在生物体内的吸收、分布、代谢和排泄过程。
药物化学家需要研究药物的代谢过程,了解药物在生物体内的行为,从而指导药物的研发和应用。
三、药物化学的研究方法1.有机合成方法有机合成是药物化学研究的重要方法之一。
通过有机合成,药物化学家可以制备出具有特定化学结构的药物分子。
有机合成方法包括传统的有机合成方法和现代有机合成方法,如催化合成、光合成等。
药物化学课件全

结构优化
前药设计
通过改变官能团、碳骨架或立体构型等方式, 提高药物的疗效和降低副作用。
将药物分子转化为无活性或低活性的前药, 在体内经代谢后转化为活性药物,提高药物 的生物利用度和靶向性。
代谢稳定性改善
手性药物开发
通过结构修饰提高药物在体内的稳定性,延 长药物作用时间。
针对手性药物分子的不同构型进行研究和开 发,提高药物的疗效和安全性。
审批与监管
药品监管部门对新药申请进行审批,批准后方可上市销售。同 时,对上市药品进行持续监管,确保药品质量和安全。
THANKS FOR WATCHING
感谢您的观看
03 药物合成方法与策略
药物合成基本方法
化学合成法
通过化学反应将简单化合 物转化为复杂药物分子, 包括经典有机合成、金属 有机化学合成等。
生物合成法
利用生物体内的代谢途径 和酶催化反应合成药物, 如发酵工程、基因工程等。
组合化学法
通过高通量合成和筛选技 术,快速合成和评估大量 化合物,寻找具有生物活 性的药物候选物。
药物质量控制
药物化学为医药产业提供药物质量控 制方法和标准,确保药品的安全性和 有效性。
医药产业发展推动力量
药物化学的不断发展和创新,推动了 医药产业的科技进步和产业升级。
02 药物分子结构与性质
药物分子基本结构
01
02
03
碳骨架
构成药物分子的基本骨架, 包括链状、环状等多种结 构。
官能团
决定药物分子性质的原子 或原子团,如羟基、羧基、 氨基等。
药物合成策略选择
逆合成分析
多样性导向合成
从目标药物分子出发,逆向推导合成 路线,选择合适的起始原料和反应条 件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
➢ 双键作为功能基比相应的饱和烷基有较强的生物活性, 例如:含不饱和键的巴比妥类药物的催眠作用强于相应 的饱和化合物。
➢ 烯键的引入使分子的刚性增加,会改变物理化学性质。 与双键相连不同的基团会因产生几何异构体而呈现不同 的生物活性。
➢ 在分子中加入乙烯基或多乙烯基,根据插烯规则 (vinylogy principle)在分子A-B之间插入一个或多个乙烯基 制成插烯物A-(CH=CH)n-B,n为1,2或3,或A与B处于 苯环的邻位或对位,此时,在电性分布上,A同B犹如直 接相连,往往可获得相似或活性更强的药物。 ➢ A与B被乙烯基或共轭多烯分开,空间距离加长,也会 对活性产生很大的影响。
(三)引入烯键
➢ 生物活性分子中引入双键包括两个方面:一是在饱和碳 链上引入双键,另一是形成插烯物(vinylogues)。
➢ 由于双键的引入改变了分子的构型和构象,分子形状与 饱和化合物有较大的差别,因此,生物活性会有较大的 变化。
➢ 例如:顺式苯丙烯酸具有调节植物生长作用,而相应的 饱和化合物苯丙酸无此活性。
➢ 负诱导效应的原子和基团按照吸电子性的强弱次序为:-NH2+,NR3+,-NO2,-CN,-COOH,-COOR,-CHO,-COR,-F,-Cl,Br,-OH,-OR,-SH,-SR,-CH=CH2,-CR=CR2,,-C≡CH; ➢ 正诱导效应的原子和基团按照推电子性强弱依次为:-CH3,CH2R,-CHR2,-CR3,-COO-。 ➢ 分子中存在的,л-л共轭或p-л共轭由于电子的离域化而导致电荷 的流动称为共轭效应。能够增加共轭系统电荷密度的原子或基团呈
➢止咳药奥昔拉定(Oxeladin,4-87)和喷托维林(Pentoxyverine,488)分别是开环和闭环化合物,前者的二乙基被四亚甲基代替,成 为环戊化合物。
➢同样,抗胆碱药曲地碘铵(Tridihex-ethy1 Iodide,4-89)的三乙铵基被 N-甲基吡咯烷代替,成为三环氯铵(Tricyclamol chloride,4-90)。 ➢抗疟药氯胍和环氯胍也分别是开环和闭环化合物。 ➢开链-闭环的变换也会引起活性发生质的变化,例如:平喘药麻黄素 (Ephedrine,4-91)的相应环状化合物芬美曲秦(Phen-metrazine,4-92) 无平喘作用,为食欲抑制剂。
N,N-二甲基多巴胺(4-81) N,N-二甲基-5,6-二羟基四氢萘(4-82) N,N-二甲基-6,7-二羟基四氢萘(4-83)
➢抗 菌 药 培 氟 沙 星 (Pefloxacin , 4-84) 经 环 合 到 8 位 , 得 到 OPC7241(4-85),再经氧原子替换亚甲基,制出氧氟沙星(Ofloxacin,486),后者的抗菌作用强于培氟沙星。
➢普鲁卡因的插烯物(4-78)仍有局部麻醉作用。乙氧脲(Ethoxyurea,479)和甘素(Dulcin,4-80)均为生甜物质,后者是前者的插烯(对位取代 苯)物。
(四)合环和开环
➢ 饱和链状化合物合环成环状化合物,或环状化合物开环成链状物, 是分子设计中常见的方法。
➢ 由于合环或开环,分子的形状、构象和表面积发生了变化,会影响 与受体的结合,也会改变药代动力学性质。
一般而言,优化的策略是根据先导化合物结构的复杂 程度和要达到的目标而定的。 结构较复杂的先导物用简化的方法,即将复杂结构的 化舍物解体成小片分子,即设计剖裂物; 分子大小适中的化合物则效仿原化合物的结构,设计 类似物,也可以将两个相同或不同活性的分子缀合在一 起,形成孪生药物或拼合物。
二、先导物优化的一般方法
➢ 同系化合物生物活性的变化随化合物序列和活性特征的不同而改 变,无普遍规律可循。 ➢ 例如:全身麻醉药、挥发性杀虫药和表面活性物质等结构非特异 性药物,随碳原子数的增加活性有规律地增高,达到最高活性后, 再增加碳原子数则活性降低,直至完全无活性。 ➢ 具有蕈毒碱样作用的RNMe3+同系物和神经节阻滞剂R3N+(CH2)nNR3+, 活性随碳原子数的增加而升高,当前者的R为4个碳原子、后者n为4、 5或6时活性达最大值,在一定范围内进一步增加碳原于数,活性变 化不显著。
五环系吗啡(4-69)
四环系吗啡喃(4-70)
三环系苯并吗啡烷(4-71)
二环系派替啶(4-72)
➢天 然 产 物 曲 林 菌 素 (Asperlicin , 4-73) 是 缩 胆 囊 素 (Cholecystokinin,CCK)受体的强效拮抗剂,通过简化结 构和活性测定,证明苯并二氮卓酮与四氢吲哚片段是重 要药效团,并合成了MK-329(4-74)其活性强于曲林菌素 100000倍,选择性高,作用时间长,且可口服。
同系物的变换
➢ 同系物原理最早始于有机化学,在药物化学中该原理的含义相同, 即分子间的差异只是亚甲基的数目不同。在先导物优化中最常见的 同系物操作是单烷基衍生化,不同碳原子数的脂环同系物,直链双 功能基化合物和多亚甲基化合物。
➢ 单烷基衍生化是在先导物结构中逐个增加或减少亚甲基的操作。烷 基链的增长或缩短,得到活性高或低同系物,这是最常用的设计方 法。
迄今所用的优化方法大都是经验性的操作,通过这样的化 学操作和生物评价,可能发现决定药理作用的药效团。
优化过程就是扬弃那些不利性质,提高和改善所希望 的性质。变换先导化合物的化学结构是千差万别的,相 当不明确的,在一定意义上讲,往往要靠药物化学家的 知识、经验和直觉,而且是个反复试验的过程。 此外,先导物的优化也有出于专利保护的考虑。
➢ 对于药效团的三维结构以及重要功能基的立体配置,可用半刚性或 合环的方法,将柔性的先导物“固定”于某个特定的构象,这对于 提高药理作用和确定药效构象意义是很大的。
➢ N,N-二甲基多巴胺(4-81)是多巴胺受体激动剂,在与受体结合时, 苯环与胺乙基侧链究竟呈怎样的构象配置,可用N,N-二甲基-5, 6-二羟基四氢萘(4-82)和N,N-二甲基-6,7-二羟基四氢萘(4-83)作为 构象的限制物,这两个化合物代表了柔性的多巴胺分子两种不同的 构象。 ➢药理试验表明,N,N-二甲基-6,7-二羟基四氢萘活性强于5,6异构体,提示多巴胺在与受体结合时,苯环处于特定的空间取向。
组胺的咪唑环被二苯甲氧基代替,变成苯海拉明,使H1受体激动作 用转向为拮抗作用,为抗过敏药;4-甲基咪唑的侧链修饰成,如西咪 替丁的长链结构,则由H2受体激动剂变成具有抗消化道溃疡作用的 H2受体拮抗剂。
➢α-肾上腺能激动剂去甲肾上腺素(4-93)分子中引入大体积基团,可 转变成拮抗剂,例如:莫西赛利(Moxisylyte,4-94)为肾上腺能拮抗 剂,是血管扩张药;β-肾上腺能激动剂异丙肾上腺素(Isoprenaline, 4-95)的苯环换成萘环,侧链再作适当的修饰,则为β-受体阻滞剂普 萘洛尔(Propranolol,4-96)。
曲林菌素(Asperlicin,4-73)
MK-329(4-74)
(二)类似物
先导物优化的结构改造,更常用的方法是类似物变换,即对先导物 结构作局部变换或修饰。
包括:改变分子的大小,增加或减少饱和碳原子数的同系化合物, 引人双键的插烯操作,引入或除去手性中心,引入、去除或变换功 能基或有空间障碍的大体积基团,链状化合物变成环状物,环状分 子开环成链状物,柔性-刚性分子的变换,基团的位置或方向的变 换,分子的电荷分布或状态的变换等,这些都是局部变换和修饰的 内容。
➢乙 酰 胆 碱 (4-97) 的 甲 基 被 三 环 代 替 , 成 为 抗 胆 碱 药 溴 丙 铵 太 林 (Propantheiineromide,4-98); ➢5-羟色胺的受体拮抗剂美西麦角(Methyyse响df,4-99)是治疗偏头痛 药物,它含有引哚乙胺的结构。
(六)改变基团的电性
➢3-哌嗪基-1,2,5,6-四氢-1-甲基吡啶(4-75)为M1蕈毒 碱样受体激动剂;由O-甲基增加到O-丁基,对M1受体亲 和力由0.85mmol/L增加到0.017mmol/L.
➢ 组成脂环的碳原子数不同所构成同系物,对活性的影响可用缩胆 囊素的拟肽加以说明。 ➢ α-甲基色氨酸的氨基被环烷氧羰基酰化,羧基将苯乙胺酰化,所得 到的拟三肽(4-76),对受体的结合作用与环的大小相关,但并不完全 与分配系数相平行。
现正性共轭效应+R;降低系统电荷密度的原于或基团呈现负性共轭 效应-R。
➢ 具有负性共轭效应(-R)和负性诱导效应(-I)的基团有:-NO2,-CN, -CHO,-COR,-COOH,-COOR,-CONH2,-CF3;
➢ 具有正性共轭效应(+R)和正性诱导效应(+I)的基团有:-O-,-S,CH3,-CR3; ➢ 同时具有正性共轭效应(+R)和负性诱导效应(-I)的原子或基团有:F,-C1,-Br,-I,-OH,-OR,-OCOR,-SH,-SR,-NH2,-NR2,NHCOR。 ➢ 分子设计中常把卤素(尤其是F、Cl)原子引入芳香环上,从而改 变了药代和药效学性质。 ➢ 芳香环上引入卤原子可产生3种效应:立体效应、电性效应和阻断 效应,氟或氯作用占据了苯环的对位,可以阻滞因生物氧化而形成的 环氧化合物或羟基,从而,可降低毒性及延长作用时间。
(五)大基团的引入、去除或置换
药物分子中引入体积较大的基团,会阻碍与酶或受体的 相互作用,导致生物活性改变。
例如:青霉素和头孢菌素类抗生素分子中解破坏,提 高耐受β-内酰胺酶的能力。
在药物设计中。向内源性活性物质分子中引入大体积基团,可造成 分子与受体作用的强烈变化,甚至翻转活性,例如由激动作用转成 拮抗作用。
基团的变换引起分子电荷分布的改变,主要通过两种效应:诱导效 应和共轭效应。这两种效应会导致药物的物理和化学性质发生深刻 的变化,因而,对活性产生重大的影响。
由于元素电负性的不同,分子内电荷沿着键移动所产生的静电引力 就是诱导效应。吸电子比氢原子强的原子或基团产生负诱导效应(I),比氢原子弱的基团产生正诱导效应(+I)。
