常见非金属及其化合物知识网络图
非金属及其化合物全部课件

一、氯气的物理性质
黄绿色
看
易溶于水(1:2)
测
物理性质
闻?
“尝”
刺激性气味
有毒
南
中新网南昌6月6日消息:南昌发生一起
昌 儿童游泳集体氯气中毒事件,11名症状较重
儿 童
的儿童被立刻送往医院抢救。
游
原因是馆内一工作人员操作失误,在
泳
集 泳池内还有队员的情 况下,将净 化水质用
体 的氯气管道 打开消毒,当即导致靠近管道附 氯 气 近的多名小选手出现呕吐、头晕、四肢无力
现象:有白色胶状沉淀生成 方程式:Na2SiO3+H2O+CO2==H2SiO3+Na2CO3 结论:硅酸是一种很弱的酸,酸性比碳酸还弱
硅酸凝胶经干燥脱水就形 成干胶,称为“硅胶”。 是一种常用的干燥剂。
归纳总结 三、硅酸
1、制法: Na2SiO3+2HCl+H2O=2NaCl+H4SiO4↓ Na2SiO3+CO2+H2O=Na2CO3+H4SiO4↓
京
沪
新华网报道:2019年3月29日,京沪高速公路
高 淮安段一辆满载液氯的液罐车和对面来车相撞 ,
速 公 路
大量液氯外泄。据目击者描述 : "一股黄绿色的 气体就像探照灯光一样,‘唰’地射向高空,足
氯 有5米高,并有刺鼻的味道,眼睛也熏得有些睁不
气 开 。” 事发后消防队员不断地用水枪喷射,但
泄 漏
思考:二氧化硅具有哪些物理性质?
化学稳定性如何?根据是什么? SiO2的这些性质是由什么决定的?
物理性质: 难溶于水,熔点高,硬度大。
化学性质: 化学性质很稳定,不活泼
高中化学基础知识网络结构图(完整版)
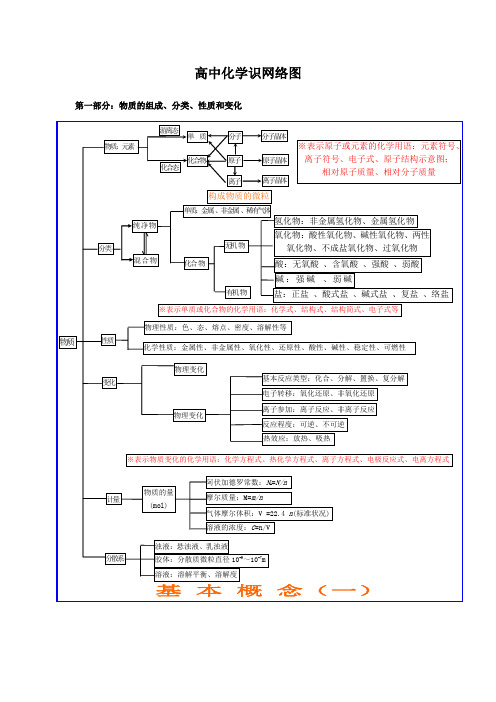
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃 饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构) 二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
必修一第四章《非金属及其化合物》知识框架图

第四章非金属元素及其化合物一、非金属元素的主角――硅二、富集海水中的元素-氯1. 物理性质:黄绿色,有刺激性气味的气体,有毒,易液化,可溶于水(溶解度1:2)①2Na+Cl22NaCl (白烟)A. 与金属反应②Cu+Cl2CuCl2 (棕黄色烟,与变价金属反应生成高价金属)③2Fe+3Cl22FeCl3(产生棕色的烟,常温下不与干燥氯气反应)①H2+Cl22HCl 白雾,发生爆炸H2+Cl22HCl(苍白色火焰,HCl工业制法)1.氯气的 B.与非金属反应:②2P+3Cl22PCl3 (白烟) 白色烟雾化学性质2P+5Cl22PCl5(白雾)C.与水反应:Cl2+H2O HCl+HClO 氯气的水溶液叫氯水4. 化学性质:①Cl2+2NaOH = NaCl+NaClO+H2O (制漂白液,制氯气尾气处理)D.与碱反应②2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O(工业制漂白粉制法)①2FeCl2+Cl2 = 2FeCl3(溶液由浅绿色变为黄色)②2KI+Cl2 = 2KCl + I2湿润的淀粉KI试纸变蓝,用于氯气的检验E.氧化性:③SO2+Cl2+2H2O = 2HCl + H2SO4 (除废水中的氯)①反应原理:MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑注意:MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
5.氯气的 A.实验室制法:②装置组成:发生装置---收集装置---吸收装置制法:③实验步骤:检密—装药—固定—加热—收集④收集方法:向上排空气法(或排饱和食盐水法)⑤检验方法: 用湿润的KI淀粉试纸置于瓶瓶口观察是否变蓝。
⑥净化装置:用饱和食盐水除去HCl,用浓硫酸干燥⑦尾气处理:用碱液(NaOH)吸收B. 工业制法:(氯碱工业) 2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑6.用途:1.氯水(氯气的水溶液)Cl 2+H 2O ====== HCl+HClO (可逆)新制 A.分子:Cl 2、H 2O 、HClO2.氯水的成分: B.离子:H +、Cl -、ClO -(少量) 、OH -(少量) 2HClO ======= 2HCl + O 2久置: 久制的氯水主要成份为H 2O 、HCl 。
非金属及其化合物知识点框架图

1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①Si和NaOH溶液的反应Si+2OH-+2H2O===SiO32-+2H2↑②SiO2和NaOH溶液的反应SiO2+2OH-===SiO32-+H2O③SiO2和C的反应SiO2+2CSi+2CO↑④向Na2SiO3溶液中通入过量CO2气体SiO32-+2CO2+2H2O===H2SiO3↓+2HCO3-⑤Si和氢氟酸的反应Si+4HF===SiF4↑+2H2↑⑥Mg在CO2中燃烧2Mg+CO22MgO+C⑦向苯酚钠溶液中通入少量CO2气体⑧向澄清石灰水中通入少量CO2气体Ca2++2OH-+CO2===CaCO3↓+H2O⑨向澄清石灰水中通入过量CO2气体OH-+CO2===HCO3-⑩除去CO2中的COCO+CuOCO2+Cu?Na2CO3和SiO2的反应Na2CO3+SiO2Na2SiO3+CO2↑?CaO和MgCl2溶液的反应CaO+Mg2++H2O===Mg(OH)2+Ca2+2.氯气及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式:①Cl2和H2O的反应Cl2+H2O H++Cl-+HClO②Cl2和NaOH的反应Cl2+2OH-===Cl-+ClO-+H2O③Cl2和石灰乳的反应2Cl2+2Ca(OH)2===2Ca2++2Cl-+2ClO-+2H2O④把Cl2通入到Na2SO3溶液中Cl2+SO32-+H2O===SO42-+2H++2Cl-⑤将Cl2和SO2混合通入H2OSO2+Cl2+2H2O===4H++2Cl-+SO42-⑥将Cl2通入到氢硫酸溶液中Cl2+H2S===S↓+2H++2Cl-⑦将浓盐酸和MnO2混合加热MnO2+4H++2Cl-Mn2++Cl2↑+2H2O⑧电解饱和食盐水2Cl-+2H2OCl2↑+H2↑+2OH-⑨将浓盐酸与漂白液混合Cl-+ClO-+2H+===Cl2↑+H2O⑩将浓盐酸与KClO3溶液混合6H++5Cl-+ClO3-===3Cl2↑+3H2O?向KMnO4固体滴加浓盐酸2MnO4-+16H++10Cl-===2Mn2++5Cl2↑+8H2O?向漂白粉溶液中通入少量CO2气体Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO?向漂白粉溶液中通入少量SO2气体Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO?向漂白粉溶液中通入过量SO2气体Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO42-+4H+(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
高中化学基础知识网络图完整版

高中化学识网络图第一部分:物质的组成、分类、性质和变化游离态单质分子分子晶体物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:NA=N/n 物质的量摩尔质量:M=m/n(mol) 气体摩尔体积:V =22.4 n ( 标准状况 ) 溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m 基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性物理性质游离态单质宏观元素化合物组金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物分类化合态大多数有机物稀有气体分子晶体分子酸气态及挥发性物质原子晶体原石墨(混合晶体)子金属晶体大多数盐离强碱离子晶体子碱性氧化物部分过氧化物微观性质无机物有机物金属氢化物酸性氢化物物质非金属氢化物碱性成盐氧化物两性氧化物特殊变化不成盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混合物有机、无机升华、萃取物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子原子分分分核外电子原子核化子子子学的的间(键形极作运排成性用分动力层布状()规范态律共离金德价子属极非华键键键力特性极最次各能)殊分性外外层量性子分共离金层层最最子不不多低价子属超超容原化化单电过过纳理合合质子影818 2n物物及云响个2 合个个金物理性质中子质子质量数同位素核电荷数元素性质规律原子序数变化元素周期律表现形式元素周实期质律表元元元核晶示方素编素归素外体决制类结构简图法周周纳性定电型表期期质子表律 的 排的 电子式结周布 构 期 周金 分 原 离 性 期性 属 子 子 子晶晶晶晶横:周期 元素种类体 体 体 体 起止序号n=1 21~ 2n=2 8短周期3~10元素性质 n=3 8 11~18周 原 n=4 18 19~36 期 子表 n=5 18 长周期37~54 结位 构 n=6 32 55~86 置n=721 不完全周期 87~111纵:族 主族:ⅠA ~Ⅶ A副族 :ⅢB ~Ⅶ B 、Ⅰ B Ⅱ B Ⅷ族0 族比较类型构成晶体微粒形成晶体作用力熔沸点硬度物理导电性性传热性质延展性溶解性典型实例离子晶体原子晶体分子晶体阴、阳离子原子分子离子键共价键范德华力较高很高低硬而脆大小熔融 .导电绝缘体 (半导体 ) 不良不良水溶液不良不良不良不良不良不良易溶于极性溶剂不溶于任何溶剂相似相溶NaCl , KBr单质:金刚石、 SiC、单质:H2、O2Si、 SiO2 化合物:冰、干冰化化学化学反学应反平速应衡化表示方法学反应速特点率计算影响因素应用:vA =△cA /△t 单位: mol/L ·s(min 或 h )是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同各物质表示的速率比等于该反应方程式的系数比内因 (主 ) 反应物的结构、性质浓度压强率和的合选成择氨适于化条学件平衡外因(辅)可逆反应化学平衡建立的条件: v 正=v逆≠ 0化学平衡的特征(平衡标志的判断)温度催化剂其他条件光、超声波、激光、放射线⋯定各成分百分含量保持不变等v 正 =v 逆≠ 0动动态平衡变条件改变,平衡状态改变化学平衡、化学反应速率浓度平衡移动原理影响化学平衡因素压强(勒沙特列原理)温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电电离平衡 AB - +B- 电离度的定义 (电离度 α= 弱电解质的分子总数×100%)弱 部 A 解 电 分 电离度平衡的移动质解 电化质 离 -14合水的离子积 ℃ ))K W =1×10 (25物 水的电离平衡 H 2O + +OH - +H 溶液的酸碱性: PH=-log[H]实质装置发生条件表示方式-离子方程式离子反应非氧化还原 常见类型氧化还原类型盐类的水解规律(酸碱性性判断) 影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理 蓄电池 化 能 应用 电源 干电池 高能电池 学 的原电池能 转 化学能电解池 电能与换 原理 氯碱工业(电解饱和食盐水)电:电镀应用非电解精练(精练铜) 电解 电冶炼金属(冶炼铝)质电 解 质 溶 液比较 装置能量转换 (实质) 装置特点电极名称电子流向电极反应--原电池 电解池化学能→电能 电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极 e e e负极(-)→正极(+) 电源负极→阴极 电源正极→阳极氧化 n + + 还原 n + 还原活泼金属失去电子 + ne →M负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M被氧化、被溶解、被腐蚀。
常见非金属元素及其化合物P区元素ppt课件

氦
Li Be
B C N O F Ne 硼碳氮氧氟氖
Na Mg
Al Si P S Cl Ar 硅磷硫氯氩
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 砷硒溴氪
Rb Sr Y Zr Nb Mo Tc Ru Ru Pd Ag Cd In Sn Sb Te I Xe 碲碘氙
● F以氟化钙的形式存在于人的骨骼和牙齿中,缺 氟容易引起龋齿。碘是甲状腺激素的重要组成成 分,缺碘造成甲状腺肿大,导致智力低下、聋哑、 身材矮小等。Cl是多种体液的主要成分,食物中缺 少氯时会引起多种病症。
引言
● P在人体和生命中具有重要的意义:骨骼中失 去磷,人体就会缩成一团;肌肉失去磷,就会失 去运动能力;脑子失去磷,人的一切思想活动就 会立即停止。
● Se能够抑制过氧化、抗毒性、刺激免疫球蛋 白及抗体的产生,具有抑制癌细胞的作用,并为 智力发育的营养素。
P区元素概述
p 区元素包括ⅢA ~ ⅦA 族和 0 族元素。p 区元 素沿 B─Si─As─Te─At 对角线分为两部分,对角线 右上角的元素(含对角线上的元素)为非金属元素, 对角线左下角的元素为金属元素。
答案:1. B、2. D
第一节 卤族元素
3.下列物质能使淀粉-KI试纸变蓝的是( )
A. 氢氟酸 B. 碘溶液 C. 碘化钾溶液 D. 氯化钠溶 液 E. 溴水 4.下列物质具有漂白作用的是( )
A. 氯水 B. 次氯酸钙 C. 氯化钙 D. 碳酸钙 E. 氟化氢
答案:3. B、E 4.A、B
第二节 氧族元素
HBrO2 HBrO3 HBrO4
碘 HIO
HIO3 HIO4、HIO6
非金属及其化合物知识点框架图

1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①Si 和NaOH 溶液的反应 Si +2OH -+2H 2O===SiO 32-+2H 2↑②SiO 2和NaOH 溶液的反应SiO 2+2OH -===SiO 32-+H 2O ③SiO 2和C 的反应SiO 2+2C=====高温Si +2CO ↑④向Na 2SiO 3溶液中通入过量CO 2气体 SiO 32-+2CO 2+2H 2O===H 2SiO 3↓+2HCO 3- ⑤Si 和氢氟酸的反应Si +4HF===SiF 4↑+2H 2↑⑥Mg 在CO 2中燃烧2Mg +CO 2=====点燃2MgO +C⑦向苯酚钠溶液中通入少量CO 2气体⑧向澄清石灰水中通入少量CO 2气体Ca 2++2OH -+CO 2===CaCO 3↓+H 2O⑨向澄清石灰水中通入过量CO 2气体OH -+CO 2===HCO 3-⑩除去CO 2中的COCO +CuO=====△CO 2+Cu?Na 2CO 3和SiO 2的反应 Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑?CaO 和MgCl 2溶液的反应CaO +Mg 2++H 2O===Mg(OH)2+Ca 2+2.氯气及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式: ①Cl 2和H 2O 的反应Cl 2+H 2O H ++Cl -+HClO②Cl 2和NaOH 的反应 Cl 2+2OH -===Cl -+ClO -+H 2O③Cl 2和石灰乳的反应 2Cl 2+2Ca(OH)2===2Ca 2++2Cl -+2ClO -+2H 2O ④把Cl 2通入到Na 2SO 3溶液中 Cl 2+SO 32-+H 2O===SO 42-+2H ++2Cl -⑤将Cl 2和SO 2混合通入H 2OSO 2+Cl 2+2H 2O===4H ++2Cl -+SO 42-⑥将Cl 2通入到氢硫酸溶液中Cl 2+H 2S===S ↓+2H ++2Cl -⑦将浓盐酸和MnO 2混合加热 MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O⑧电解饱和食盐水2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH - ⑨将浓盐酸与漂白液混合Cl -+ClO -+2H +===Cl 2↑+H 2O⑩将浓盐酸与KClO 3溶液混合6H ++5Cl -+ClO 3-===3Cl 2↑+3H 2O?向KMnO 4固体滴加浓盐酸2MnO 4-+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O ?向漂白粉溶液中通入少量CO 2气体Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO ?向漂白粉溶液中通入少量SO 2气体Ca 2++3ClO -+SO 2+H 2O===CaSO 4↓+Cl -+2HClO?向漂白粉溶液中通入过量SO 2气体 Ca 2++2ClO -+2SO 2+2H 2O===CaSO 4↓+2Cl -+SO 42-+4H +3.硫及其化合物(1)知识网络构建(2)重要反应必练 写出下列反应的方程式,是离子反应的写离子方程式。
《非金属及其化合物》课件

非金属元素在周期表中的位置主要在碳族、氮族、氧族、卤素等族中,它们通 常具有较低的电负性和较高的电子亲和力,容易形成共价键和分子晶体。
非金属元素的分类
01
02
03
惰性气体
氦、氖、氩、氪、氙等。
非金属元素
氢、硼、碳、氮、氧、磷、硫 等。
卤素
氟、氯、溴、碘等。
04
准金属元素
砷、硒、锑、铋等。
非金属元素在地壳中的分布
分布情况
非金属元素在地壳中的分布非常广泛 ,其中氧、硅、铝、铁等是地壳中含 量最高的元素,而其他非金属元素在 地壳中的含量相对较低。
影响因素
非金属元素的分布受到多种因素的影 响,如元素的电负性、原子半径、离 子半径等,这些因素决定了元素在地 球各圈层中的分布和迁移。
02
非金属单质的物理性质
总结词
不稳定性
有些非金属单质在特定条件下不稳定,容易发生化学反应, 如氟气、氯气等在强光照射下易分解。
04
非金属化合物的性质
非金属氧化物的性质
总结词
非金属氧化物大多为酸性氧化物,除个别如CO、N2O等外,大多数不与水反应。
详细描述
非金属氧化物大多数是酸性氧化物,这是因为非金属氧化物中的非金属元素通常具有较高的电负性,容易获得电 子而形成负离子。这些负离子可以与水分子结合形成含氧酸或酸酐。例如,二氧化碳(CO2)是一种典型的酸性 氧化物,它可以与水反应生成碳酸(H2CO3)。
总结词
非金属单质的溶解性是影响其应用的重要物理性质之 一。
详细描述
不同非金属单质的溶解性差异很大,如碘易溶于汽油、硫难溶 于水等。了解非金属单质的溶解性有助于对其制备、分离和提 纯等操作进行指导。
初三化学酸碱盐知识结构网络图

常见化合物的颜色 离子 Fe2+ Fe3+ Cu2+ 沉淀 Fe(OH)2 Fe(OH)3 Cu(OH)2 Mg(OH)2 Al(OH)3 AgCl BaSO4 CaCO3 BaCO3 MgCO3 其它 Fe3O4 Fe2O3 CuO Cu2(OH)2CO3 Cu HgO KMnO4 KClO3 KCl MnO2
序号反应特点反应方程式举例反应条件金属单质生成沉淀常见化合物的颜色离子沉淀其它cuocu金属酸碱盐知识结构图金属单质氧气金属氧化物金属氧化物非金属单质氧气非金属氧化物非金属氧化物h前金属复分解反应发生的条件feagclhgokclbaso
金属-酸-碱-盐பைடு நூலகம்识结构图
序号 金属单质 ⑺ 非金属单质 反应特点 反应方程式举例 反应条件 —— 常温 ⑴⑺ 金属单质+氧气=金属氧化物 ⑵ 金属氧化物+ ⑴ ⒃ 金属氧化物 ⑽ ⑵ ⒂ ⑻ ⑼ ⑸ ⑹ ⑿酸+盐= 碱 ⒀ ⑶ ⑾ ⑿ ⑹ 酸 + ②③ 常温 —— ⑻ 金属氧化物+非金属氧化物= ⑼ ⑽ ⑾ 盐 ⒁ 盐 ⒁ ⒂ ① 复分解反应发 生的条件 ② ③ 生成水 生成气体 生成沉淀 ⒃ H前金属 活动性 顺序 非金属氧化物 ⑷ ⑶ ⒀碱+盐= + 点燃 常温 ⑷ 非金属单质+氧气=非金属氧化物 ⑸ 非金属氧化物+ =酸 =碱
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见非金属及其化合物知识网络图 考纲考情:①了解碳、硅单质及其重要化合物的主要性质及其用途。
②了解氯单质及其化合 物的主要性质及应用。
③了解硫及其化合物的主要性质及应用和对环境质量的影响。
④了解 氮单质及其化合物的主要性质及应用和对环境质量的影响。
2.氯元素单质及其化合物间的转化关系
NaOH
AgNOj H 2SO 4 Br 312 CuCh FcClj^zFeCli
HC1O Ca(C10)2 I j NaBr L J
KI
Fe
NaOH
-Cl
NaClO HCU
NaCl AgNt>1 AgCI
^CaCOv SftvxZ.* J i.
畀 Ca(HCO 並 bio 警%sg
1.碳、硅及重要化合物间的转化关系
CH 4
NaOftl co c NaO
aOH«RA
C02+H ;O' NaHC °3
NaOH
S1F4
-SiO, NaOH
Ng a.檢酸, Z •浓酸,GA
FeS Fes. N 趾SO*空 H :SCh ―—_ H 2SCV^^BaSO 4
4.氮及其重要化合物的转化关系
3.硫及其重要化合物间的转化关系 0触雄烧
与品红化合(检
验)
Ca(OH)2
乙 H 20
HzO Cu N H O H NH ; =NH 3
o ?1催化训 ±HNOx 浓 llzSO^ A NaNO 3 催化剖 MSO 呻 * Na^SO*。
