酪氨酸酶抑制剂筛选
酪氨酸酶抑制剂及对黑素生物合成的影响

postmitotic differentiating cells.J Invest Dermatol,2000,114(3): 413-420.5Pellegrini G,Dellambra E,G olisano O,et al.p63identifies ker2 atinocyte stem cells.Proc Natl Acad Sci USA,2001,98(6):3156-3161.6Christensen R,Jensen UB,Jensen TG.Cutaneous gene therapy2an update.Histochem Cell Biol,2001,115(1):73-82.7Kuhn U,Terunuma A,Pfutzner W,et al.In vivo assessment of gene delivery to keratinocytes by lentiviral vectors.J Virol,2002, 76(3):1496-1504.8Ghazizadeh S,Taichman LB.Multiple classes of stem cells in cuta2 neous epithelium:a lineage analysis of adult mouse skin.EMBO J, 2001,20(6):1215-1222.9Morris RJ.K eratinocyte stem cells:targets for cutaneous carcino2 gens.J Clin Invest,2000,106(1):3-8.10van Ruissen F,de Jongh G J,van Erp PE,et al.Cell kinetic charac2 terization of cultured human keratinocytes from normal and psoriatic individuals.J Cell Physiol,1996,168(3):684-694.11Bata2Csorgo Z,Hammerberg C,Voorhees JJ,et al.K inetics and regulation of human keratinocyte stem cell growth in short2term pri2mary ex vivo culture.Cooperative growth factors from psoriatic le2 sional T lymphocytes stimulate proliferation among psoriatic unin2 volved,but not normal,stem keratinocytes.J Clin Invest,1995,95(1):317-327.12Finch PW,Murphy F,Cardinale I,et al.Altered expression of ker2 atinocyte growth factor and its receptor in psoriasis.Am J Pathol, 1997,151(6):1619-1628.13Haase I,Hobbs RM,Romero MR,et al.A role for mitogen2activat2 ed protein kinase activation by integrins in the pathogenesis of psoria2 sis.J Clin Invest,2001,108(4):527-536.14Gniadecki R.Effects of1,25-dihydroxyvitamin D3and its20-epi analogues(MC1288,MC1301,KH1060),on clonal keratinocyte growth:evidence for differentiation of keratinocyte stem cells and analysis of the modulatory effects of cytokines.Br J Pharmacol, 1997,120(6):1119-1127.15Javier AF,Bata2Csorgo Z,Ellis CN,et al.Rapamycin(sirolimus) inhibits proliferating cell nuclear antigen expression and blocks cell cycle in the G1phase in human keratinocyte stem cells.J Clin Invest, 1997,99(9):2094-2099.(收稿日期:2002-09-23)・综述・酪氨酸酶抑制剂及对黑素生物合成的影响闫军陈声利李春阳摘要 酪氨酸酶是皮肤黑素生物合成的关键酶、限速酶,可以酪氨酸酶为靶点筛选增白美容的药物,用于治疗色素沉着性皮肤病。
遗传学研究中的抑制剂筛选和评价

遗传学研究中的抑制剂筛选和评价抑制剂是指一类能抑制生物体内特定酶或蛋白质活性的化合物,在药物研发和基因治疗等领域具有广泛的应用。
遗传学研究中,抑制剂的使用可以帮助科学家深入探索不同基因的作用机制。
这一篇文章将着重讨论如何从抑制剂中筛选出合适的化合物,并对其效果进行评价。
一、抑制剂筛选抑制剂的筛选一般涉及以下几个方面:1. 靶点的确定首先需要确定研究的靶点。
一般而言,基因组学研究中可以通过CRISPR/Cas9技术沉默不同的基因,然后观察其对细胞或生物体影响的变化来确定靶点。
抑制剂的使用可以进一步验证这些基因的作用机制。
2. 抑制剂库的构建确定了靶点后,接下来需要构建抑制剂库,即收集可能有抑制作用的化合物。
这个过程一般有两种方法,一是通过现有的文献数据或其他资源进行预测,二是进行高通量筛选,即在大量化合物中对其作用进行快速筛选,沉淀出具有潜力的抑制剂。
无论采用哪种方法,抑制剂库的建立对于后期的抑制剂评价具有非常重要的意义。
3. 抑制剂的筛选与鉴定将抑制剂添加到细胞或生物体中,通过测定抑制剂对靶点的作用程度,确定哪些抑制剂具有潜力。
鉴定合适的抑制剂可以使用多种方法,如荧光素酶法、荧光标记探针等。
二、抑制剂效果评价抑制剂的效果评价主要关注三个方面:1. 抑制剂的效力使用荧光素酶法、RNA测序等技术,来测试抑制剂的效力。
2. 抑制剂的选择性选择性指抑制剂对其他酶或蛋白质的干扰程度。
一般而言,选择性越高,抑制剂对靶点的效果就越显著。
3. 抑制剂的毒性除了考虑抑制剂对靶点的作用,还需要考虑其对整个细胞的影响。
抑制剂毒性的测定可以通过细胞存活率、细胞缺陷等多种方法来进行评估。
总之,在遗传学研究中,抑制剂的作用机制非常复杂。
只有在确定了靶点的基础上,对抑制剂进行快速筛选和评价,才能为研究提供更可靠的数据支撑。
随着技术的不断发展,人们在抑制剂筛选和评价方面也会有更多的进步。
对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶的抑制效果

对香豆酸、阿魏酸和低聚糖阿魏酸酯对酪氨酸酶的抑制效果易晶晶;欧仕益;董颖妍;陈秋明【摘要】通过测定酶的稳态活力、迟滞时间和动力学参数,研究对香豆酸、阿魏酸及低聚糖阿魏酸酯对酪氨酸酶的抑制效果。
结果表明,3种物质对酪氨酸酶单酚酶活性均有抑制作用,其中对香豆酸的抑制作用最强,其次为低聚糖阿魏酸酯和阿魏酸。
对香豆酸、低聚糖阿魏酸酯和阿魏酸对单酚酶的IC 50值分别为0.75,3.20,9.30 mmol/L。
对香豆酸和阿魏酸抑制二酚酶活性,IC 50值分别为4.3,12.7 mmol/L;但低聚糖阿魏酸酯对二酚酶活力没有影响。
对香豆酸能明显延长单酚酶反应的迟滞时间,阿魏酸影响很小,而低聚糖阿魏酸酯则缩短迟滞时间。
动力学研究结果显示,阿魏酸和低聚糖阿魏酸酯对单酚酶的抑制作用表现为混合性抑制,而对香豆酸为竞争性抑制。
%This study investigated the inhibitory effects of p-coumaric acid,ferulic acid and feruloylated oligosaccharides on catalytic activi-ties of tyrosinase by analysising tyrosinase steady state activity and enzyme kinetics.The results showed that the three compounds were found to efficiently inhibit tyrosinase monophenolase activities.The p-Coumaric acid was the strongest inhibitor followed by feruloylated oligosaccharides and ferulic acid,with the IC 50 value of 0.75,3.20, 9.30 mmol/Lrespectively.Moreover,p-coumaric acid and ferulic acid were found to inhibit the activities of diphenolase with IC 50 value of 4.3,12.7 mmol/L respectively;however,feruloylated oligosac-charides showed no inhibitory effect on diphenolase activity.p-Cou-maric acid increased the lag time of monophenolase activity,but fer-ulic acid showed little effect;while feruloylated oligosaccharides re-duced the lag time of monophenolaseactivity.Enzyme kinetics analy-sis indicated that p-coumaric acid is a competitive inhibitor of the monophenolase,while ferulic acid and feruloylated oligosaccharides showed a mixed inhibitory effect.【期刊名称】《食品与机械》【年(卷),期】2016(032)011【总页数】5页(P9-12,63)【关键词】对香豆酸;阿魏酸;低聚糖阿魏酸酯;酪氨酸酶【作者】易晶晶;欧仕益;董颖妍;陈秋明【作者单位】暨南大学食品科学与工程系,广东广州 510632;暨南大学食品科学与工程系,广东广州 510632;暨南大学食品科学与工程系,广东广州 510632;暨南大学食品科学与工程系,广东广州 510632【正文语种】中文酪氨酸酶(EC 1.14.18.1)是一种多酚氧化酶,其活性中心有两个铜离子,可催化单酚类物质(单酚酶活性)和二酚类物质氧化为醌类(二酚酶活性)[1],在黑色素形成的反应前期起着非常重要的作用,是人体黑色素合成的限速酶。
酪氨酸酶抑制及激活作用动力学的分析

❖ 酪氨酸酶是皮肤黑素生物合成的关键酶,它不仅决定黑素 合成的速率,还是黑素细胞分化成熟的特征性标志,因此 它给人体皮肤美白带来困难。酪氨酸酶的活性与黑素合成 量相关,控制其活力即可控制黑素生成量。因此,研究酪 氨酸酶的抑制,对防止水果、蔬菜的褐变,化妆品中的皮 肤增白,以及因酪氨酸酶催化产生黑色素引起的疾病(黄 褐斑、黑色素瘤等色素沉着性皮肤病等),具有非常重要 的治疗意义。
一、实验基本原理
酪氨酸酶(Tyraseosinase ,Tyrase)又称儿茶酚氧 化酶(Ec.1.14.18.1)属于 多酚氧化酶(漆酶和二酚 氧化酶)中的一种。它广 泛存在于红薯、香蕉、苹 果、蘑菇、马铃薯及人体 等动植物中,也存在于微 生物,特别是霉菌之中。
在动植物体内,酪氨酸酶 对酪氨酸和其它酚类化合 物的代谢以及黑色素的合 成起重要的催化作用。酪 氨酸酶可以催化两类不同 的反应:单酚羟基化形成 邻二酚和邻苯二酚氧化成 邻醌,这两类反应都必须 有氧分子的直接参与。
实验仪器和条件
北京普析通用UV-1901 紫 外可见分光光度计
实验条件: 缓冲液:0.1mol/LpH 6.8磷酸盐缓冲液。 底物:25mol/L 邻苯二 酚 化合物溶液的配制: 1-萘酚和二羟基二苯甲酮 用乙醇配成50mol/L。 2-萘酚和六羟基二苯甲酮 用乙醇配成10mol/L。 硫酸亚铁和硫酸铜用蒸馏 水配成50mol/L。
高校生物化学专业酶抑制剂筛选实验方案

高校生物化学专业酶抑制剂筛选实验方案为了研究酶抑制剂在生物化学领域的应用,本实验旨在筛选具有抑制特定酶活性的化合物,以便深入了解其生物活性和可能的药理效应。
以下是本实验的详细方案:实验材料:1. 目标酶:选择具有明确酶活性的酶作为目标,如乙酰胆碱酯酶(AChE)或蛋白酪氨酸激酶(PTK)等。
2. 酶底物:适合目标酶反应的底物,如乙酰胆碱对于AChE活性的检测。
3. 酶抑制剂样本:准备一系列有机化合物作为潜在的酶抑制剂,如天然产物或化学合成物。
4. 阳性对照组:包含已知具有抑制目标酶活性的化合物作为阳性对照,用于验证实验方法和设定阈值。
5. 阴性对照组:包含不具有抑制目标酶活性的化合物或溶剂,用于验证实验方法和排除假阳性结果。
6. 试剂:如缓冲液、底物浓度递增液、酶抑制剂稀释液等。
实验步骤:1. 预处理:根据实验需要,将目标酶、底物、酶抑制剂样本以及阳性、阴性对照组等准备好。
2. 负对照组实验:a. 在微量试管中加入适量缓冲液作为空白对照组,并记录酶活性测定结果。
b. 加入适量目标酶,使其达到最佳反应条件,并记录酶活性测定结果。
3. 阳性对照组实验:a. 在微量试管中加入适量缓冲液、阳性对照组样本和目标酶,使其达到最佳反应条件。
b. 加入适量底物,启动酶反应,并根据实验方法测定酶活性,作为阳性对照组结果。
4. 酶抑制剂筛选:a. 在微量试管中加入适量缓冲液、酶抑制剂样本和目标酶,使其达到最佳反应条件。
b. 加入适量底物,启动酶反应,并根据实验方法测定酶活性。
c. 比较各个酶抑制剂样本组的酶活性与负对照组的差异,确定是否具有抑制目标酶活性的效果。
5. 数据分析:a. 将实验结果转化为定量数据,如化合物浓度与酶活性的相关性。
b. 统计和分析每个酶抑制剂样本与目标酶的抑制作用,确定有效的化合物。
实验注意事项:1. 严格遵循实验操作规程,使用个人防护装备,如实验手套和防护眼镜等。
2. 每个实验步骤都要准确记录实验条件、操作过程和结果,以备后续分析。
表皮生长因子受体酪氨酸激酶抑制剂的研究进展

表皮生长因子受体酪氨酸激酶抑制剂的研究进展一、本文概述表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKIs)是一类针对EGFR信号通路的关键药物,广泛应用于非小细胞肺癌、结直肠癌、头颈癌等多种癌症的治疗。
本文旨在综述近年来EGFR TKIs的研究进展,包括其作用机制、药物研发、临床应用以及面临的挑战等方面。
通过深入了解EGFR TKIs的研究现状和发展趋势,有望为癌症治疗提供新的思路和方法,进一步改善患者的生活质量和预后。
本文将从EGFR TKIs的作用机制出发,阐述其如何通过抑制EGFR 的酪氨酸激酶活性来阻断癌细胞的增殖和转移。
接着,我们将回顾EGFR TKIs的药物研发历程,介绍目前市场上主流的EGFR TKIs药物及其特点。
在此基础上,我们将重点关注EGFR TKIs在临床试验中的应用情况,包括其疗效、安全性以及耐药性等问题。
我们将探讨EGFR TKIs面临的挑战和未来发展方向,包括如何克服耐药性、提高治疗效果以及拓展新的适应症等。
通过本文的综述,我们希望能够为相关领域的研究者和临床医生提供有价值的参考信息,推动EGFR TKIs在癌症治疗中的进一步应用和发展。
二、EGFR-TK抑制剂的分类与机制表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TK抑制剂)是近年来癌症治疗领域的重要突破,其通过抑制表皮生长因子受体(EGFR)的酪氨酸激酶活性,从而阻断细胞的生长、增殖和转移过程。
根据药物的作用机制和化学结构,EGFR-TK抑制剂主要分为两大类:可逆性抑制剂和不可逆性抑制剂。
可逆性抑制剂,如吉非替尼和厄洛替尼,能够与EGFR的ATP结合位点形成可逆性结合,从而竞争性地抑制酪氨酸激酶的活性。
这类药物对于EGFR敏感突变的非小细胞肺癌具有较好的疗效,但在长期治疗过程中,患者往往会出现耐药现象。
不可逆性抑制剂,如阿法替尼和奥希替尼,能够与EGFR的ATP 结合位点形成共价键,导致EGFR的永久性失活。
蛋白酪氨酸激酶(PTK)抑制剂的研究进展

• 染料木黄酮(Genistein, Gen)是大豆生长过程中形 成的一类次生代谢产物,
• 研究发现Gen可通过抑制 PTK活性阻断VEGF诱导的内 皮细胞活化,从而发挥抗 肿瘤血管生成作用。
对 ABL 酪氨酸激酶的抑 制作用 主要表现在对慢 性粒细胞白血病 ( CM L) 细胞有抗增殖活性
伯舒替尼
嘧啶类PTK抑制剂
• 伊马替尼、达沙替尼、尼罗替尼。 • 近两年的研究发现, 吡咯并嘧啶类、嘧啶并嘧啶类化
合物对 PTK 也显示出一定的抑制活性。
吲哚类PTK抑制剂
• 吲哚类小分子化合物也是一类重要的PTK抑制剂, 无论 是已经上 市的舒尼替尼 ( sun itinib,SU11248 ), 还 是 处 于 临 床 研 究 中 的 SU 6668、B IBF1000等都具有很好的抑制活性,其母核均为2位氧代的 苯并吡咯环。
舒尼替尼
• VEGFR-2 是舒尼替尼抑制肿瘤细胞血 管生成的关键靶点 。在 VEGFR-2 的 活 性 空 腔 中 ,Glu885,Ile888 ,Asp1028, Asp1046 和 His1026 五 个氨基酸残基都能和 sunitinib 形成疏水作用。
• sunitinib 还 能 与VEGFR-2 形成三 条氢键, 分别是
• sunitinib 中 吡 咯基的氮原子( N) 与 His1026 中的氮原子 ( ND1 ) 之 间的氢键,
• 吲哚基团上的氮原子( NAH) 与 Cys1024中氧原子 ( O ) 之 间 的 氢键
• 氮 原 子 ( NAV) 与Asp1046 中氧 原子( OD1 ) 之间的氢键
天然植物酪氨酸酶活性抑制剂研究进展

w
q e ihbtr f c fb tnc lihbtr ftrs a ew sdsu sd.T epo lmse itdwfep i e u .An ' n ii y e e to oa ia n ii so o i s a ic se n o o y n h rbe xse  ̄ ontdo t r d山ed v lp n t t e eeo me tsr e S a g"
的代谢紊乱, 导致患有各种黑色斑症状的人群增多。所 以,
美 白型化妆 品成为化妆 品领域研 究的热 点 。因此 , 研究 酪氨 酸酶的抑制 机理 , 求安 全 、 寻 高效 的 酶抑 制 剂 , 医药 、 妆 在 化 品领域都有重 要的意义 。
1 酪氨酸酶 及其抑制 剂概 况
酪氨 酸 酶 (y s a ) 皮 肤 黑 色 素 生 物 合 成 的 关 键 Tri s 是 one 酶| , 】 不仅决定 黑色 素合 成 的速 率 , J 而且 是 黑色 素 细胞 分 化
不断加快 以及 因污 染而引起 的环 境破坏 , 得黑 色素形 成酶 使
上极 易接受 的美 白剂 。V 对 除 去后 天性 黑色 素沉积 有 明显 c 的效果 , 且具 有抗 氧 和清 除 自由基作 用 , 主要 用 于祛 并 因此 斑美 白化妆 品。虽然 v 具 有水溶性 不稳定 和不易被 皮肤 吸 c 收 等缺点 , 但开发 出的 V 脂肪酸酯 和 V 磷 酸酯盐 可 以避 免 c c 这些缺 点 。其 中 ,c v 棕榈 酸酯 是 V 的脂 肪酸酯 , c 油溶性 , 常 与其 他美 白成分 复配 , 以获得 稳定 、 的美 白效 果[ 7 可 高效 6J -。 22 熊果 苷 . 熊果苷 的来 源有植 物 提取 、 物组织 培养 、 植 酶 法及有 机合成 。熊果 苷 是一 种安 全 有效 的美 白剂 。它对 黑 色素 的抑制作用 及 日 晒色 素沉 着效 果 明显 。研究 表 明 , 熊果 苷对 酪氨酸酶的抑制 是 曲酸的 2 0 。为此 , 一 步提 ~1 倍 为进 高熊 果苷 的 功效 , 开发 出很 多新 衍生 物 , 中值得关 注 的是 其 v 熊果苷磷 酸酯 。它表 现 出与 V 熊果苷 的协 同作 用 , c c 并具 有很好 的稳 定性 。为了提高效 果 , 8 J 熊果苷 美 白剂 多与 氨 甲 环酸衍 生物 、 七叶醇 、 乙基化合 物 、 氨 色氨酸及烷 氨基 水杨酸
酪氨酸酶活性抑制实验方法
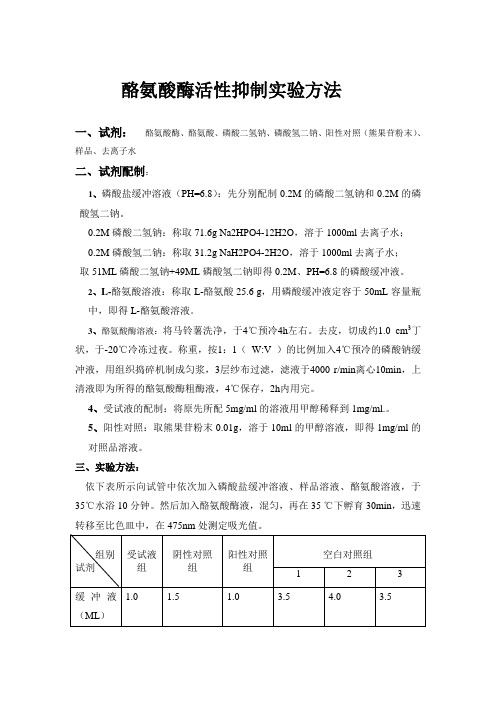
酪氨酸酶活性抑制实验方法一、试剂:酪氨酸酶、酪氨酸、磷酸二氢钠、磷酸氢二钠、阳性对照(熊果苷粉末)、样品、去离子水二、试剂配制:1、磷酸盐缓冲溶液(PH=6.8):先分别配制0.2M的磷酸二氢钠和0.2M的磷酸氢二钠。
0.2M磷酸二氢钠:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 去离子水;0.2M磷酸氢二钠:称取 31.2g NaH2PO4-2H2O,溶于1000ml 去离子水;取51ML磷酸二氢钠+49ML磷酸氢二钠即得0.2M、PH=6.8的磷酸缓冲液。
2、L-酪氨酸溶液:称取L-酪氨酸25.6 g,用磷酸缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
3、酪氨酸酶溶液:将马铃薯洗净,于4℃预冷4h左右。
去皮,切成约1.0 cm3丁状,于-20℃冷冻过夜。
称重,按1:1(W:V )的比例加入4℃预冷的磷酸钠缓冲液,用组织捣碎机制成匀浆,3层纱布过滤,滤液于4000 r/min离心10min,上清液即为所得的酪氨酸酶粗酶液,4℃保存,2h内用完。
4、受试液的配制:将原先所配5mg/ml的溶液用甲醇稀释到1mg/ml.。
5、阳性对照:取熊果苷粉末0.01g,溶于10ml的甲醇溶液,即得1mg/ml的对照品溶液。
三、实验方法:依下表所示向试管中依次加入磷酸盐缓冲溶液、样品溶液、酪氨酸溶液,于35℃水浴10分钟。
然后加入酪氨酸酶液,混匀,再在35 ℃下孵育30min,迅速转移至比色皿中,在475nm处测定吸光值。
受试组用空白对照组1调零,阴性对照组用空白对照组2调零,阳性对照组用空白对照组3调零。
受试组吸光值为A1,阴性对照组吸光值为A2,阳性对照组吸光值为A3。
抑制率=1-[(A1-A2)/(A3-A2)]×100%=(A3-A1)/(A3-A2)×100% 注:受试液组共四种样品。
酪氨酸酶抑制剂筛选
记录每分钟
含底物缓冲液+
不同浓度的抑制剂
+ 酶液
的OD值
30度水浴10min
对酪氨酸酶单酚酶(二酚酶)影响
以OD值—时间作图
曲线的切线反向延长与X轴相交点 即为—延滞时间 若均相交于一点—抑制剂对延滞 时间没有影响 若不交于一点—抑制剂对延滞时 间有影响 曲线1为无抑制剂的对照组 曲线2—7抑制剂浓度由低到高 切线斜率即为酶活
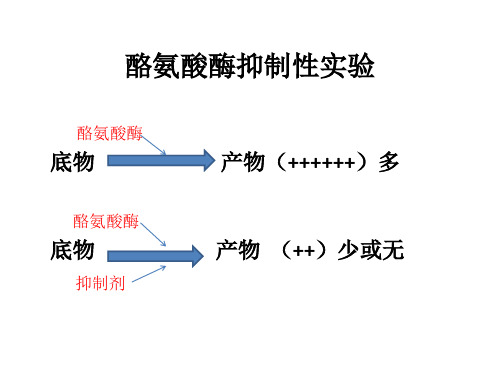
酪氨酸酶抑制性实验
酪氨酸酶
底物
酪氨酸酶
产物(++++++)多
底物
抑制剂
产物 (++)少或无
EC是各种酶的编号 可在The Comprehensive Enzyme Information System(BRENDA)数据库 中找到对应的酶信息
Enzyme-Ligand Interactions
酶信息
实验原理
酪氨酸酶催化的反应为:
475nm
酶活的定义
1.酪氨酸酶的酶活定义: 以每分钟催化生成1umol多 巴色素的酶量为一个活力单位。 通过测定酶催化反 应体系OD475随时间的增长曲线, 从曲线斜率即可得 到酶活=106kv/ε (k斜率 v体积l ε消光系数) 酶比活=106 kv/εm(k斜率,v体积L,ε消光系数,m酶质量 mg ) 2.剩余酶活%=Kt/K ×100 % 3.抑制酶活% (被抑制的活力)=(K-Kt)/K ×100 % Kt=有抑制剂的曲线的斜率 K=没有抑制剂的曲线的斜率
酶活的推导
1.Beer定律A=kbc,公式A=kbc kbc εc 我们测得的动力学曲线斜率△A/t= ε△c/t= ε△M/tV △M/t=△A V /tε △M/t = kv/ε
酪氨酸激酶抑制剂的研究新进展[1]
![酪氨酸激酶抑制剂的研究新进展[1]](https://img.taocdn.com/s3/m/ec6af8cca1c7aa00b52acb1c.png)
抑制剂的合理药物设计中[29]。 根据这个药效团模
型, 酪氨酸激酶中的 A T P 作用位点可以分成以下 5 个区域。
(1) 腺嘌呤区域
这个区域是强烈的疏水区域。 在 EGFR 激酶
中, A T P 腺嘌呤环的 N 1 和 N 6 这两个氮原子和关
图 2 化合物 SU 2101 和 CGP 59326
Abstract P ro tein ty ro sine k ina ses p lay an im po rtan t ro le in signa l t ran sduct ion p a thw ay s in regu la t2 ing a num ber of cellu la r funct ion s. T y ro sine k ina ses a re a t t ract ive a s ta rget s in the resea rch of therap eu t ic agen t s, no t on ly aga in st cancer, bu t a lso aga in st m any o ther d isea ses. T he p rog ress in ty ro sine k ina se in2 h ib ito r ha s been review ed, includ ing the chem ica l st ructu res and the p ha rm acop ho re m odels.
关键词 酪氨酸激酶 抑制剂 A T P 药效团模型 中图分类号: Q 55517 文献标识码: A 文章编号: 10052281X (2002) 0520355205
Progress in Tyros ine K ina se Inh ib itor
小分子多靶点酪氨酸激酶抑制剂 原理

小分子多靶点酪氨酸激酶抑制剂原理【摘要】小分子多靶点酪氨酸激酶抑制剂具有重要的研究意义和临床应用前景。
本文首先介绍了小分子药物的多靶点作用机制,然后阐述了酪氨酸激酶在癌症治疗中的重要作用。
接着详细解析了小分子多靶点酪氨酸激酶抑制剂的原理,并总结了该领域的研究进展和应用前景。
未来,发展方向包括结构改进和亲和力提升,致力于提高药物的疗效和安全性。
本文强调了小分子多靶点酪氨酸激酶抑制剂在临床上的重要意义,为癌症患者提供新的治疗选择,具有巨大的发展潜力和医学意义。
【关键词】关键词:小分子多靶点酪氨酸激酶抑制剂、药物、多靶点作用、酪氨酸激酶、癌症治疗、研究背景、原理、研究进展、应用前景、未来发展方向、临床意义1. 引言1.1 小分子多靶点酪氨酸激酶抑制剂原理的意义小分子多靶点酪氨酸激酶抑制剂原理的意义可以从多个方面来解释。
这类药物的研究与开发可以为治疗多种疾病提供新的思路和途径。
传统药物往往只专注于单一的靶点,而小分子多靶点酪氨酸激酶抑制剂则可以同时作用于多个靶点,具有更广泛的生物活性和药理作用,有望在治疗复杂疾病中发挥更为显著的效果。
小分子多靶点酪氨酸激酶抑制剂的研究将有助于揭示药物与疾病之间更为复杂的相互作用机制。
通过深入研究药物与靶点之间的相互作用,可以更好地理解药物的作用机制和药效,为药物设计和改进提供更为有效的理论基础。
小分子多靶点酪氨酸激酶抑制剂的研究也将促进药物的个体化治疗。
不同患者对药物的反应存在差异,而多靶点抑制剂的个体化治疗策略可以根据患者的基因型、表型等个体特征来选择最适合的治疗方案,提高治疗效果并减少不良反应的发生。
小分子多靶点酪氨酸激酶抑制剂的研究具有重要的临床意义和应用前景。
1.2 小分子多靶点酪氨酸激酶抑制剂的研究背景随着癌症的高发率和治疗难度不断增加,寻找更有效的治疗方法成为当前医学领域的重要课题之一。
在癌症治疗领域,酪氨酸激酶被认为是一个重要的靶点,因为它参与了细胞的增殖、凋亡和转移等重要生物过程。
酪氨酸酶抑制率测定方法

1. 4念珠藻甲醇提取物对酪氨酸酶活性的抑制1. 4. 1念珠藻甲醇提取物对酪氨酸酶活力的影响提取物对酪氨酸酶的抑制参照Masuda和Kubo的方法[ 6, 7] , 并略作修改。
待测样品用DMSO 进行浓度梯度稀释, 浓度分别为1、05、025、0125 mg / mL; 换算成反应体系中的终浓度分别为333、1665、8325、4 3 g /mL。
反应在96孔细胞板上进行, 每组8孔, 分别是: A. 不含样品, 但含酪氨酸酶的阴性对照, 3孔重复; B. 不含样品及酪氨酸酶的空白对照, 1孔; C. 包含样品及酪氨酸酶, 3孔重复,D. 含样品但不含酪氨酸酶的空白对照, 1 孔。
A 孔中加入190 L pH 68、0 1 mo l/L 磷酸缓冲液,10 L 1380 U /mL酪氨酸酶; B 孔中加入200 L 相同的磷酸缓冲液; C 孔中加入180 L磷酸缓冲液,10 L 1380 U /mL酪氨酸酶, 10 L样品; D 孔中加入190 L磷酸缓冲液, 10 L样品。
然后将细胞板在30条件下放置5 m in, 再在每孔中加入100 L2 5 mmo l/L L-酪氨酸( 见表1 )。
在30反应10m in后, 立即置于Tecan Sunrise 酶标仪中测量在475 nm下的吸光值。
提取物对酪氨酸酶活性的抑制按公式计算:抑制率=( A - B ) - ( C- D)*100%A – B参照文献方法〔3〕在数支干燥的试管中各加入1.oml0.03%左旋多巴溶液,再加上维生素E一日环糊精溶液,(加入量按表所列体积) 最后的磷酸钠缓冲液加至5.Oml,25℃恒温10 min后,加入0.4ml酶提取液,立即计时并迅速置于恒温槽内,待反应1min,用BaCRmanDV一70型分光原度计在475nm处测定吸收度,以缓冲液为参比,然后根据多巴色素的消光系数“=3700求出Vi,把无维生素E一日环糊精溶液存在时速度定为100%,求出不同浓度维生素E一日环糊精存在时酶的相对活性以及对酶的抑制率抑制率二V。
中药材中酪氨酸酶抑制剂筛选方法研究进展

是采用大粒径填料填充的一种色谱柱ꎬ具有液相色
2. 1 超滤 ̄LC ̄MS 技术筛选法 超滤 ̄LC ̄MS 技术
谱和分子排阻色谱的双重特性ꎮ 流动相在高流速下
是利用超滤膜的分子筛作用ꎬ通过超滤离心法对靶
可产生涡流状态ꎬ大分子的基质成分如蛋白质等还
蛋白、靶蛋白与活性小分子的结合物以及未结合的
未能扩散进入填料孔隙就被快速洗脱ꎬ而小分子物
选具有抑制酪氨酸酶活性作用的天然美白原料提供
理论基础和试验依据ꎬ该实验最终筛选出 6 个与对
酪氨酸酶的抑制作用呈正相关的共有峰和 2 个呈负
相关的共有峰ꎮ
甜味素经 HPLC 色 谱 柱 分 离 后ꎬ 利 用 二 极 管 阵 列
紫外光谱图ꎬ接取流出液在 96 孔板中与酪氨酸酶、
L ̄DOPA 作用ꎬ利用酶标仪检测酶剩余活力ꎬ从而实
ꎮ 该方法将色谱分
离的优点与活性评估相结合ꎬ为复杂植物提取物的
体结合的原理ꎬ从复杂混合物中分离潜在配体的极
为方便有效的方法 [26] ꎬ例如ꎬ将靶分子亲和技术与
298
新乡医学院学报 http: / / www. xxyxyxb. com 2021 年 第 38 卷
本文引用:徐敬朴ꎬ陶兴隆ꎬ郑丽亚. 中药材中酪氨酸酶抑制剂筛选方法研究进展[ J] . 新乡医学院学报ꎬ2021ꎬ38
(3) :296 ̄300. DOI:10. 7683 / xxyxyxb. 2021. 03. 020.
【 综述】
收稿日期:2020 - 07 - 24
基金项目:河北省中医药管理局课题( 编号:2018124) ꎮ
作者简介:徐敬朴(1985 - ) ꎬ女ꎬ河北石家庄人ꎬ硕士ꎬ主管药师ꎬ研
究方向:中药质量控制及活性成分筛选ꎮ
蛋白酪氨酸激酶小分子抑制剂

状态影响激酶的活性。
蛋白质相互作用
02
与其他蛋白质的相互作用可以调节蛋白酪氨酸激酶的活性,影
响其磷酸化反应。
小分子抑制剂
03
小分子抑制剂是调节蛋白酪氨酸激酶活性的重要手段之一,通
过与激酶结合,抑制其活性。
03
蛋白酪氨酸激酶小分子抑制剂的设计
与发现
小分子抑制剂的设计策略
基于结构的药物设计
利用蛋白质三维结构信息,针对激酶活性位点或调节 位点设计小分子抑制剂。
小分子抑制剂还可以通过影响信号转导通路中其他蛋白质的活性,进一步调节信 号转导通路的输出。
05
蛋白酪氨酸激酶小分子抑制剂的药理
学特性与临床应用
小分子抑制剂的药代动力学特性
01
吸收
小分子抑制剂通常能快速通过胃肠 道吸收,进入血液循环。
代谢
小分子抑制剂在体内经过代谢,产 生药效。
03
02
分布
小分子抑制剂在体内广泛分布,能 快速到达靶组织。
排泄
小分子抑制剂主要通过肾脏排泄, 部分通过胆汁排泄。
04
小分子抑制剂的抗肿瘤活性与作用机制
抑制肿瘤细胞增殖
小分子抑制剂能抑制肿瘤细胞内的蛋白酪氨酸激酶活性,从而阻 止肿瘤细胞增殖。
诱导肿瘤细胞凋亡
小分子抑制剂能诱导肿瘤细胞凋亡,加速肿瘤细胞的死亡。
抑制肿瘤血管生成
小分子抑制剂能抑制肿瘤血管生成,切断肿瘤的营养供给,从而 抑制肿瘤的生长。
蛋白酪氨酸激酶小分子抑 制剂
• 引言 • 蛋白酪氨酸激酶的分类与结构 • 蛋白酪氨酸激酶小分子抑制剂的设计
与发现 • 蛋白酪氨酸激酶小分子抑制剂的作用
机制
• 蛋白酪氨酸激酶小分子抑制剂的药理 学特性与临床应用
酪氨酸激酶底物的筛选与特征分析

酪氨酸激酶底物的筛选与特征分析酪氨酸激酶是一类重要的信号转导分子,在细胞生命活动中扮演着重要的角色。
酪氨酸激酶可以磷酸化其底物,导致底物的活性、稳定性、亲和力和定位等方面的变化。
由于底物的活性、稳定性和亲和力的变化,酪氨酸激酶的底物特异性是非常重要的。
因此,酪氨酸激酶底物的筛选与特征分析是酪氨酸激酶研究的重要方向之一。
一、酪氨酸激酶底物筛选目前,常用的酪氨酸激酶底物筛选方法主要包括化学筛选、生物筛选和生物信息学筛选三种方式。
化学筛选:化学筛选的主要优点在于速度快,操作简便,一次可以筛选出大量潜在的底物。
其基本操作流程为:首先,化学修饰底物,使其具有磷酸化背景(如添加亚硝基硫代甘氨酸)。
接下来,将修饰后的底物加入已知的激酶反应体系中,经过一定的反应时间后,采用质谱或放射性测定等手段检测出与激酶相结合的底物。
然后,通过质谱分析确定底物的化学结构,最后由生物学实验验证其是否真是酪氨酸激酶底物。
生物筛选:生物筛选的主要优点是筛选出的底物具有生物活性,适用于分析酪氨酸激酶催化的生物效应。
其基本操作流程为:首先,挑选具有代表性的组织或细胞,提取其中酪氨酸激酶。
接下来,向酪氨酸激酶反应液中加入不同的底物组分,反应一定时间后,通过生化方法检测出与酪氨酸激酶反应的底物。
然后,对筛选出的底物进行进一步的生物学,生物化学和分子生物学研究。
生物信息学筛选:生物信息学筛选是一种虚拟筛选技术,可预测成百上千的可能酪氨酸激酶底物。
该方法基于计算机分析酪氨酸激酶底物信息学特征。
具体操作为先确定酪氨酸激酶的保守序列,然后基于该序列进行分析预测其底物。
具体可以通过计算机模拟和数据挖掘等方式实现。
二、酪氨酸激酶底物特征分析酪氨酸底物特征的分析可从底物序列特点、磷酸化区域、细胞定位、生物功能等角度进行。
底物序列特点:研究发现,不同酪氨酸激酶对底物序列的特异性不同。
一般情况下,酪氨酸磷酸化靶标包括酪氨酸和苏氨酸,有的酪氨酸激酶还可以催化龙胆氨酸的磷酸化。
JAK3激酶抑制剂的设计、合成与筛选开题报告

JAK3激酶抑制剂的设计、合成与筛选开题报告一、研究背景及意义JAK3(Janus激酶3)是一种重要的酪氨酸激酶,参与了多个细胞信号通路的调控,如白细胞介素(IL)2、IL4、IL7、IL9、IL15和IL21依赖信号 transductions,以及IL2受体信号转导,这些信号通路在细胞生长、分化和免疫应答中发挥着至关重要的作用。
由于JAK3激酶参与了免疫细胞的信号传递,因此其在肿瘤和炎症的调控中也扮演着重要的角色。
因此,设计、合成 JAK3 激酶抑制剂具有重要的临床应用价值。
目前已有一些 JAK3 激酶抑制剂被研发,但由于它们仍存在副作用等问题,因此有必要继续开展 JAK3 激酶抑制剂的设计、合成与筛选的研究。
二、研究现状目前已有一些研究报道了 JAK3 激酶抑制剂的设计和合成。
例如,Ding等人报道了一种基于ATP基团的JAK3激酶抑制剂,其在体外研究中表现出优异的抑制活性(Ding K, et al., 2012)。
Mikita等人研发了一种经过修饰的JAK3激酶抑制剂,可以选择性地抑制JAK3激酶,同时对其他JAK同源体系具有低亲和力(Mikita A, et al., 2017)。
在筛选方面,高通量筛选技术已经被广泛应用于药物发现中,其中包括JAK3激酶抑制剂的筛选。
例如,郭等人使用的化学基因组学策略,实现了对JAK3激酶和其他JAK同源体系抑制剂的高通量筛选(Guo L, et al., 2020)。
三、研究内容和方法1.根据现有的文献,设计新型的 JAK3 激酶抑制剂的化合物,比如基于ATP结构的抑制剂,或者是针对特定JAK3结构域的抑制剂。
2.进行化合物的有机合成,并通过技术手段(比如NMR和质谱)鉴定化合物结构的准确性。
3.利用体外和体内实验方法,对合成的化合物进行抑制活性的筛选,包括抑制常见的JAK3依赖细胞通路和癌细胞的生长等。
4.通过化学基因组学等高通量筛选技术,对我们所设计的化合物进行全面的筛选和评估,找出具有较高亲和力和选择性的化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶活测量步骤
1.抑制剂对酪氨酸酶单酚酶(二酚酶)影响
缓冲液(不含抑制剂)
含底物缓冲液+
+ 酶液
不同浓度的抑制剂
30度水浴10min
记录每分钟
的OD值
对酪氨酸酶单酚酶(二酚酶)影响
以OD值—时间作图
曲线的切线反向延长与X轴相交点 即为—延滞时间 若均相交于一点—抑制剂对延滞 时间没有影响 若不交于一点—抑制剂对延滞时 间有影响 曲线1为无抑制剂的对照组 曲线2—7抑制剂浓度由低到高 切线斜率即为酶活
总结性图表
抑制剂对单酚酶,多酚酶作用图示
谢谢
米氏方程
½ Vmax
混合级反应 一级反应
v Vmax [S] Km [S]
零级反应
Km
一级反应中可求反应初速度
一、酶活力测定— 酶反应初速度的测定: 常用单位时间内、产物的浓度增加量表示。
Product Concentration
A =εC d
延滞时间的原理(多巴为例)
对酪氨酸酶单酚酶(二酚酶)影响
抑制剂浓度—延滞时间 作图
抑制剂浓度—Vss 作图
IC50
Vss为酶的活力百分比=Vt/V ×100 % IC50即为酶失去一半活力时的抑制剂
结论
• 上述三个图标我们可以得出几点结论 • 1.抑制剂浓度对酶的延滞时间是否有影响? • 2.计算出酶的活力(酶的剩余活力) • 3.计算酶的抑制酶活 • 4.酶的IC50
酶信息
Enzyme-Ligand Interactions
Substrate/Product Inhibitors KM Value Ki Value IC50 Value pH Optimum
酪氨酸酶概述
• 酪氨酸酶(TYR)含铜酶是黑素代谢和儿茶酚胺的 关键酶。酪氨酸酶活性高,黑色素生成增多。因 此,抑制酪氨酸酶活性是有效减少黑色素生成的 一种途径
竞争性图
抑制剂只与酶结合 Ki
竞争: 两线K相交于(0 ,1/Vm)
曲线相交一点且在Y轴上 Vm值不变,Km值随浓度 上升而变大 以抑制剂浓度—该抑制剂曲线的截 距作图,该图的斜率即为Ki
2.非竞争性
• 非竞争性抑制剂和底物可能分别与酶的不 同部位结合。抑制剂与酶的结合并不妨碍 酶再与底物结合,但所形成的酶—底物—抑 制剂复合
酪氨酸酶抑制性实验
酪氨酸酶
底物
酪氨酸酶
底物
抑制剂
产物(++++++)多 产物 (++)少或无
酪氨酸酶来源
多酚氧化酶
单酚单氧化酶(酪氨 酸酶) EC.1.14.18.1 双酚氧化酶(儿茶多 酚氧化酶) EC.1.10.3.2 漆酶 EC.1.10.3.1
EC是各种酶的编号 可在The Comprehensive Enzyme Information System(BRENDA)数据库 中找到对应的酶信息
曲线1-5抑制剂浓度逐渐上 升(曲线1为对照品) 曲线相交一点且在X轴上 Km值不变,Vm值随浓度 上升而变小
ห้องสมุดไป่ตู้ 非竞争性图
1.以抑制剂浓度—该抑制剂曲线的斜率作图,该图的斜率即 为Ki 2.以抑制剂浓度—该抑制剂曲线的截距作图,该图的斜率即 为Kis 3.非竞争抑制中Ki,Kis的值是一致的
3.反竞争性
• 对酶活性的一种抑制作用,其特征是反应 的最大速度比未加抑制剂时反应的最大速 度低,当以速度的倒数相对底物浓度的倒 数作图,所得图线与未被抑制反应的图线 平行
• 抑制剂只与酶-底物复合物结合,而不与游 离酶结合的一种酶促反应抑制作用。
反竞争性图
抑制剂只与酶底物复合物结合 Kis 反竞争: 两线K相差0.01 截距相差0.1
v= dC /dt
: 3600 M-1cm-1 d: 1cm
确定酶反 应时间!
Time
返回
Km值变小,Vmax值变小,但 Vmax/Km值不变
以抑制剂浓度—该抑制剂曲线的截 距作图,该图的斜率即为Kis
特殊抑制类型
混合型 抑制剂既于酶又与底物结合 Ki Kis
混合型的抑制:曲线相交与一点但该点不在X或Y轴上, 一般在第二或三象限
特殊抑制类型
混合型的Ki Kis值与非竞争性计算方式一样 切记:两个数值不一样
酶在不同浓度抑制剂下的作用
该次的测量主要断定此抑制是否可逆?
酶浓度
抑制剂浓度
OD值
A
E 对照
AE AF AG AH
B
F
BE BF BG BH
C
G
CE CF CG CH
D
H
DE DF DG DH
酶在不同浓度抑制剂下的作用
• 以酶浓度—OD值作图 转换
酶浓度—酶活力(剩余活力)
可逆性抑制作用
1.曲线1-5代表不同浓度(有低到高) 的抑制剂,曲线1不加抑制剂的对照组 Y轴是酶活活力,是剩余酶活。所以酶活 达不到100 2.该图是可逆型的,酶活随抑制剂浓度 上升而下降 3.Vm值不变 Km值随浓度上升而上升
实验原理
酪氨酸酶催化的反应为:
475nm
酶活的定义
1.酪氨酸酶的酶活定义: 以每分钟催化生成1umol多 巴色素的酶量为一个活力单位。 通过测定酶催化反 应到体酶活系O=1D0467k5随v/ε时(k间斜的率增v体长积曲l线ε消, 从光曲系线数斜) 率即可得 酶比活=106 kv/εm(k斜率,v体积L,ε消光系数,m酶质量 mg ) 2.剩余酶活%=Kt/K ×100 % 3.抑制酶活% (被抑制的活力)=(K-Kt)/K ×100 %
• 研究酪氨酸酶抑制剂主要运用于美容行业,防止 植物水果的褐变症。
• 酪氨酸酶结构中心的两个Cu+是活性中心
抑制剂种类
1.含酚基的化合物 与酪氨酸酶的双铜离子活性中心结合, 大多数是酪氨酸酶的竞争性抑 制剂. 2.芪类及其类似物 只有一个羟基取代基时, 该羟基芪没有抑制酪氨酸酶的活性; 当结构 中有两个羟基时, 对酪氨酸酶的抑制活性显著增强 3.黄酮类物质 螯合酶活性中心的铜来抑制酶活力. 4. 醛类化合物 羰基与酪氨酸酶活性中心周围的亲核基团, 形成稳定的螯合配体结构 (席夫碱结构), 生成的产物在酪氨酸酶的疏水性环境中能稳定存在, 并在活 性中心周围形成空间位阻, 阻止底物与活性中心作用, 从而抑制酪氨酸酶 的催化活性, 抑制黑色素的合成.
Km值测定: 米氏双倒数作图法
1.竞争性抑制
• 抑制剂和底物在结构上有某些相似之处, 二者可能竞争与酶分子的同一部位结合。
竞争性抑制
一.特点:抑制剂与底物竞争酶的活性部位, 当抑制剂与酶的活性部位结合后,底物就不 能再与酶结合,同样反之。 二.竞争性抑制的机理 1 抑制剂与底物在结构上有类似之处 2 可能结合在底物所结合的位点(如结合基 团)上,从而阻断了底物和酶的结合 3 降低酶和底物的亲和力。
Kt=有抑制剂的曲线的斜率 K=没有抑制剂的曲线的斜率
酶活的推导
1.Beer定律A=kbc,公式A=kbc kbc εc 我们测得的动力学曲线斜率△A/t= ε△c/t= ε△M/tV
△M/t=△A V /tε
△M/t = kv/ε
△M/t:每分钟多巴色素的生成(mol/min),等同 于每分钟的分解量
上图即为可逆型抑制
不可逆性抑制作用
Km值不变, Vm值与抑制剂量成反比,增大抑制剂量可使反 应速度变为0
抑制类型的判断
• 可逆型抑制类型分为 • 1.竞争性抑制 • 2.非竞争性抑制 • 3.反竞争性抑制
三种类型图示
使1/ v(酶速度)对1/S(酶浓度)作图,可 以获得一条直线。
抑制常数: 1.Km为米氏常数 2.Ki为与酶结合的抑制常数 3.Kis为与酶底物复合物的抑制常数
非竞争性
1. 非竞争性抑制作用:抑制剂不能与游离酶 结合,但可与ES复合物结合并阻止产物生 成,使酶的催化活性降低 2. 特点为:a.抑制剂与底物可同时与酶的不同 部位结合;b.必须有底物存在,抑制剂才能对 酶产生抑制作用;c.动力学参数
非竞争性
抑制剂既于酶又与底物结合 Ki Kis
非竞争: 两线K相交于(-1/Km,0)
