第八章 氧化还原反应
第八章氧化还原电极电势(基).

->电极电位的测量
(一)标准氢电极
比与溶液中H+可达到以下平衡:
2H+ + 2e- H H2
lOOkPa^气饱和了的钳片和氢离子浓度
为lmolL>的酸溶液之间所产生的电势
差就是标准氢电极的电极电位,定为零:
SHE: Pt, H2(l««kPa) JI+(m =1)
(二)标准电极电位标准氢电极与其它各种标准状态下的电极组成原电池,标准氨电极
定在左边,用实验方法测得这
个原电池的电动势数值,就是
该电极的标准电极电位。
比较氧化剂或还原剂的强弱
标准电极电势值越大,电对中氧化型得电 子倾向越大,是强氧化剂;其共觇的还原型失 电子倾向越弱。
标准电极电势值越小,电对中 还原型失电子倾向越大,是强还原剂;其共 的氧化型得电子倾向越小。
判断氧化还原反应自发进行的方向.对角线规则
试判断标准态下反应2Fe2++ i2=2Fe3++2厂自 发进行的方向。
两电对中0°值高的氧化型物质为较强的
6
氧化剂,0值低的还原型物质为较强的还原剂。
Fe 2+ (aq) 0(Fe^/Fe^ ) = 0.77 IV
反应将逆向(由右向左)自发进行。
即:
2Feh + 21- = 2Fe2+ +
1
1 ■
强氧化剂| +强还原剂2
弱还原剂| +弱氧化剂2
bU/I )=0.5355^
【2 (s)+
2e" 广
(aq)
Fe*(aq) + e'。
教材第八章习题解答

第八章氧化还原反应和电化学习题解答1.回答下列问题。
(1)怎样利用电极电势来确定原电池的正负极,并计算原电池的电动势?(2)怎样理解介质的酸性增强,KMnO 4的电极电势代数值增大、氧化性增强?(3)Nernst 方程式中有哪些影响因素?它与氧化态及还原态中的离子浓度、气体分压和介质的关系如何?(4)区别概念:一次电池与二次电池、可逆电池与不可逆电池。
(5)介绍几种不同原电池的性能和使用范围。
(6)什么是电化学腐蚀,它与化学腐蚀有何不同? (7)防止金属腐蚀的方法主要有哪些?各根据什么原理? 【解答】(1)电极电势值高的电极做正极,电极电势值低的电极做负极。
原电池的电动势等于正极的电动电势减去负极的电极电势。
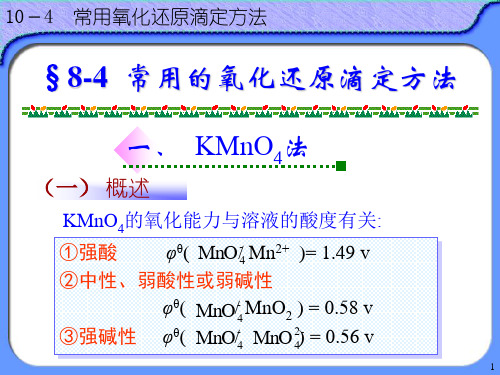
(2)根据电极反应:-+-2+42M nO +8H +5e =M n +4H O2442284c(M n)0.0592M nO M nO c ()()lg M nM nc(M nO )5c(H )()cc+--ΘΘ++-ΘΘϕ=ϕ-+⋅由电极电势的能斯特公式可知,介质酸性增强时,H +浓度增大,42M nO ()M n-+ϕ代数值增大,电对中MnO 4-的氧化性增强。
(3)对于电极反应 -a(O x)+ze b(R ed) 电极电势的Nernst 方程为:bR e d aO x (c /c )R T (O x /R e d )(O x /R e d )lnzF(c /c )ΘΘΘϕ=ϕ-影响电极电势大小的因素:a )浓度对电极电势的影响 电对中氧化态的离子浓度(或气体分压)增大时,电极电势增加;还原态的离子浓度(或气体分压)增大时,电极电势降低。
b )酸度对电极电势的影响 对于有H +或OH -参加的电极反应,溶液酸度的变化会对电极电势产生影响,对于没有H +或OH -参加的电极反应,溶液酸度的变化对电极电势的影响很小。
(4)一次电池是指电池放电到活性物质耗尽只能废弃而不能再生和重复使用的电池。
第八章 氧化还原反应

第八章氧化还原反应第一节基本概念有电子得失或电子转移的反应,被称为氧化还原反应。
氧化:还原:Zn2+ Zn - 2eCu Cu2+ + 2eZn + Cu2+Zn2+ + Cu氧化剂:还原剂:Cu2+Zn半反应①单质中,元素的氧化值为零。
②在单原子离子中,元素的氧化值等于该离子所带的电荷数 。
③在大多数化合物中,氢的氧化值为 +1;只有在金属氢化物中氢的氧化值为 -1。
④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF 2 和O 2F 2中,氧的氧化值分别为+2和+1。
确定氧化值的规则: 氧化值:是指某元素的一个原子的荷电数,该荷电数是假定把每一化学键中的电子指定给电负性更大的原子而求得的。
⑤中性分子中,各元素原子的氧化值的代数和为零 ,复杂离子的电荷等于各元素氧化值的代数和。
第二节氧化还原反应方程式的配平配平原则:① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最小公倍数。
将两个半反应方程式中各项分别乘以相应的系数,使得、失电子数目相同。
然后,将两者合并,就得到了配平的氧化还原反应的离子方程式。
有时根据需要可将其改为分子方程式。
例1:配平反应方程式+)42−+−−++=+10e10H 5SOO 5H 5SO223+−+−+=++O8H 2Mn 10e 16H 2MnO 224+−+−+=++O 4H Mn 5e 8H MnO ②224①−+−−++=+2e2H SO O H SO 24223②③①×2+②×5得O3H SO K 6MnSO 22424++=O 3H 5SO 2Mn 6H 5SO 2MnO 2242234++=++−++−−+−−−++Mn SO SO MnO ①2242343H SO SO 5K 2KMnO 4324++2第三节电极电势一、原电池利用自发氧化还原反应产生电流的装置。
有机化学课件:第8章 氧化还原反应

还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
第八章氧化还原和电极电位 - 第八章氧化还原反应

2Fe3+ +Sn4+
Cu+ FeCl3
CuCl(s)+ FeCl2
28
(二) 原电池组成式
电池组成:电极、盐桥(或多空隔膜)、电解质 溶液及导线。
电池组成式(电池符号)表示法的统一规定: 1. 半电池中,“|”表示相界面,同一相的不同物 质用“,”隔开,用“||”表示盐桥。负极写在左边, 正极写在右边。
化物中为-1,如在NaH、CaH2中。 (5)卤族元素。氟的氧化值在所有化合物中为-1;
其它卤原子的氧化值在二元化合物中为-1,但在
卤族的二元化合物中,列在周期表中靠前的卤原
子的氧化数为-1,如Cl在BrCl中;
在含氧化合物中按氧化物决定,如ClO2中Cl的氧 化值为+4。
(6)电中性的化合物中所有原子的氧化值的和为零。
由正极反应和负极反应所构成的总反应,称
为电池反应(cell reaction)。
Zn + Cu2+
Cu + Zn2+
27
电池反应就是氧化还原反应: 正极反应--还原半反应; 负极反应--氧化半反应。
从理论上讲:任一自发的氧化还原反应都可 以设计成一个原电池。
思考 下列反应如何设计成原电池呢?
一、氧化值
(一) 氧化值的定义 氧化值是某元素一个原子的表观荷电数,这种
荷电数是假设把每一个化学键中的成键电子指定 给电负性较大的原子而求得。
电负性(electronegativity):表示一个原子在 分子中吸引成键电子能力的量度。一般用X表示 (无单位)。p188
3
注:分子中元素的氧化数取决于该元素成键电 子对的数目和元素的电负性的相对大小。
第8章氧化还原反应与 氧化还原滴定法2
定剩余的MnO4- 。根据已知过量的KMnO4和还原剂标
准溶液的浓度和消耗的体积,即可计算出甲酸的含量
。
7
10-4 常用氧化还原滴定方法
二 、重铬酸钾法(Potassium Dichromate Method)
(一) 概述
K2Cr2O7在酸性条件下与还原剂作用: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O (2) 应用范围比KMnO4 法窄;
18
10-4 常用氧化还原滴定方法 2. 硫酸铜中铜的测定
三、 碘 量 法
2 Cu2+ + 4 I - = 2CuI↓ + I2
I2 + 2S2O32- = S2O32- + 2 I -
n Cu 2+ / n Na 2S2O3= 1 / 1
可逆反应,应加入过量 KI。CuI 沉淀表面吸附 I2导致结果
(4) 滴定终点:高锰酸钾自身指示终点(淡粉红色30秒不退)。
4
10-4 常用氧化还原滴定方法
一、 KMnO4法
(三) 高锰酸钾法应用示例 1. 过氧化氢的测定
可用KMnO4标准溶液直接滴定,其反应为: 5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2 + 8H2O 室温、在硫酸或盐酸介质。开始时反应进行较慢。
最后以Na2S2O3标准溶液滴定析出的 I2。
22
10-4 常用氧化还原滴定方法
2
10-4 常用氧化还原滴定方法
一、 KMnO4法
(二) 标准溶液的配制与标定(间接法配制)
KMnO4自行分解反应:
八氧化还原反应共30页PPT资料

如
Cu 2 Cu
Cu 2 2 eCu
C2rO72 C3r
C2rO72 1 4H6 e2 C3r7 H 2O
H H2
2 H 2 eH2
注意:物质的氧化还原性质不是固定不变的。
如F2e
F2e
F3e
Fe
F2e
Cu
C2u Cu
பைடு நூலகம்
Cu Cu
14
5、常见的氧化剂和还原剂
计算 是将成键电子指定给电负性较大的原子
6
氧化数的确定规则:
1、单质中元素的氧化数为0 2、氢在化合物中的氧化数一般为+1,但在活泼金属的氢化物
中为-1 3、氟化合物中氟的氧化数为-1 4、氧在化合物中的氧化数一般为-2,在过氧化物中氧化数为-1; 在超氧化物中氧化数为1/2;氧的氟化物中,氧化数为+1和+2 5、化合物中所有元素的氧化数代数和为0 6、离子或离子团中,所有元素的氧化数代数和等于离子所带
第八章 氧化还原反应
1
本章基本要求: 1、理解氧化还原反应的基本概念及反应式的配平 2、了解原电池的基本概念,了解电极电势的意义 3、掌握Nerst方程的简单应用 4. 掌握电极电势的应用
2
氧化还原反应的应用
1 燃气燃烧供给热能! 2 冶炼金属 3 化学电源(各种电池) 4. 生物能的获得 金属腐蚀
15
二、 氧化还原反应方程式的配平
1、氧化数法 原则:
1、元素原子的氧化数升高的总数等于元素原子的氧化数降 低的总数;
2、反应方程式两边各种元素原子的总数相等。
16
步骤: (1)根据实验事实确定氧化还原产物,写出基反应方程式。 (2)确定被氧化元素原子氧化数的升高值 和被还原元素原子
第八章土壤酸碱性和氧化还原反应

胶体
-Ca -(x-2)H
+2H+
(3)土壤胶体上铝离子作用
Al3++H2O⇋Al(OH)2++H+ Al(OH)2++ H2O⇋Al(OH)2++H+ Al(OH)2++H2O ⇋Al(OH)3↓+H+ 土壤中羟基铝离子实际上还很复杂。[Al6
(OH)12]6+、 [Al10(OH)22]8+等等 土壤中交换性铝离子才是土壤潜性酸的主要
(三)生物因素 生物产生的CO2溶于水,产生的H+对于土壤酸化 有重要作用。另外植被不同,残体成分不同,影响土壤酸碱性。
(四)施肥和灌溉的影响 造成土壤酸化等。
如酸性肥(NH4)2SO4、 KCl长期使用
四、土壤酸碱性对土壤肥力的影响
(一)土壤酸碱性对土壤养分有效性的影响
大
附
多
近
数 土 壤
pH6.5 (中性)
• 2.弱酸及其盐类的缓冲作用 土壤中大量存在的碳酸、磷酸、硅
酸、腐殖酸和其他有机酸及其盐类构成 许多缓冲对,也可以缓冲酸和碱的作用。
当加入酸时:CaCO3+H2SO4 →CaSO4+H2CO3 当加入碱时:H2CO3+KOH →KHCO3+H2O
3.两性物质的缓冲作用
土壤中的一些两性胶体物质,对酸、碱都 有中和缓冲作用。
教学目标
(1)熟悉土壤酸碱性及其成因,掌握土壤酸碱变化 规律,明确酸碱性对林木生长和土壤养分的影响。 (2)掌握土壤氧化还原性能的衡量指标
第一节 土壤酸碱性
中国土壤酸碱性分布规律
中国土壤的酸碱性反应,大多数在 pH4.5~8.5之间。在地理分布上有“东南酸 西北碱”的规律性。大致可以长江为界(北 纬33~35),长江以南的土壤为酸性或强酸 性,长江以北的土壤多为中性或碱性。我国 土壤的酸碱性南北差异很大,由南向北土壤 pH相差7个数量级。
氧化还原反应和电极电位

第八章氧化还原反应和电极电位一、选择题1.下列关于氧化值的叙述中,不正确的是()A.单质的氧化值为0B.氧气的氧化值为-2C.在多原子分子中,各元素原子的氧化值的代数和等于0D.氧化值可以是整数或分数2.已知ϕ°(Fe3+/Fe2+)=0.77V,ϕ°(Cu2+/Cu)=0.34V,ϕ°(Sn4+/Sn2+)=0.15V,ϕ°(Fe2+/Fe)=-0.41V。
在标准态下,下列反应能进行的是()A.2Fe3++Cu=2Fe2++Cu2+B.Sn4++Cu=Sn2++Cu2+C.Cu+Fe2+=Cu2++FeD.Sn4++2Fe2+=Sn2++2Fe3+3.已知ϕ°(Zn2+/Zn)=-0.76V,ϕ°(Ag+/Ag)=0.80V,将电对Zn2+/Zn和Ag+/Ag组成原电池,该原电池的标准电动势为()。
A.2.36VB.0.04VC.0.84VD.1.56V4.对于电池反应Cu2++Zn=Cu+Zn2+,下列说法正确的是()。
A.当c(Cu2+)=c(Zn2+)时,反应达到平衡B.当ϕ°(Cu2+/Cu)=ϕ°(Zn2+/Zn)时,反应达到平衡C.当ϕ(Cu2+/Cu)=ϕ(Zn2+/Zn)时,反应达到平衡D.当原电池的标准电动势等于零时,反应达到平衡5.已知ϕ°(Fe2+/Fe)=-0.41V,ϕ°(Ag+/Ag)=0.80V,ϕ°(Fe3+/Fe2+)=0.77V,在标准态下,电对Fe2+/Fe、Ag+/Ag和Fe3+/Fe2+中,最强的氧化剂和最强的还原剂分别是()A.Ag+、Fe2+B.Ag+、FeC.Fe3+、AgD.Fe2+、Fe2+6.已知ϕ°(F2/F-)>ϕ°(Cl2/Cl-)>ϕ°(Br2/Br-)>ϕ°(Fe3+/Fe2+)>ϕ°(I2/I-)。
基础化学第八章氧化还原反应和电极电位ppt课件

精选PPT课件
4
第一节 氧化还原反应
一、氧化值(氧化数 oxidation number) 1. 1970年IUPAC给出的定义是:氧化值是某
元素一个原子的表观荷电数(apparent charge number),这种荷电数是假设把每 一个化学键中的电子指定给电负性更大的 原子而求得。 例:NH3中,N的氧化值是-3,H的氧化值
⑥ 电中性的化合物中所有原子的氧化值的和为 零。多原子离子中所有原子的氧化值的和等 于离子的电荷数。
精选PPT课件
7
第一节 氧化还原反应
氧化值可为整数,也可为分数。 例: Fe3O4 中,Fe:+8/3; S4O62- 中,S:+5/2。
按确定元素氧化值6条规则的先后顺序,就 能正确确定化合物中各元素的氧化值。 例:KMnO4,先确定K,+1; 再确定O,-2; 最后确定Mn,+7。
精选PPT课件
13
第一节 氧化还原反应
三、氧化还原反应方程式的配平
例: KMnO4 + HCl → MnCl2 + Cl2 + H2O 1. 写出离子方程式
MnO4- + Cl- → Mn2+ + Cl2 +H2O 2. 根据氧化还原电对,拆成两个半反应
还原反应:MnO4- + H+ → Mn2+ + H2O
精选PPT课件
3
教学基本要求
1. 掌握电池组成式的书写,了解电极电位产生的 原因,熟悉标准电极电位概念,掌握用标准电 极电位判断氧化还原反应的方向。掌握离子— 电子法配平氧化还原反应式。
基础化学 第八章 氧化还原反应与电极电位

子的氧化数为-1,如Cl在BrCl中;
在含氧化合物中按氧化物决定,如ClO2中Cl的氧 化值为+4。
(6)电中性的化合物中所有原子的氧化值的和为零。
多原子离子中所有原子的氧化值的和等于离子的
电荷数。
6
例1:试计算Na2S2O3(硫代硫酸钠)和Na2S4O6 (连四硫酸钠)中硫的氧化数。
解:Na2S2O3中S的氧化数为: (+1)× 2+3×(-2)+2X=0, X=+2
4
(二)确定元素氧化值的规则
日本化学教授桐山良一(在1952年)和美国著名化学家 鲍林(1975年)等人分别发表论说,对确定元素氧化数的 方法制定了一些规则。
(1)单质中原子的氧化值为零。 (2)单原子离子中原子的氧化值等于离子的电荷 数。例如Na+离子中Na的氧化值为+1。 (3)化合物中,氧的氧化值一般为-2,
14
(2)计算氧化数升(降)总数,并按照最小公倍 数原则确定系数
+2-5=-3
+5
0 +5
+2
HNO3 + P H3PO4 + NO
+5+0=+5 5 H N O 3+ 3 P3 H 3 P O 4+ 5 N O
(3)最后配平H、O原子
= 5 H N O 3+ 3 P + 2 H 2 O 3 H 3 P O 4+ 5 N O
9
Zn + 2HCl
ZnCl2 + H2
其中,锌失去电子,氧化值升高,被氧化,称为
还原剂(reducing agent),又称电子的供体(electron
donor)。HCl中的H+得到电子,氧化值降低,被还
第八章氧化还原反应与电极电位

2.判断氧化还原反应进行的方向
定温定压时:
Δ rG m 0 即
E 0 , 正反应自发
平衡状态
逆反应自发
Δ rG m 0 即 E 0 ,
Δ rG m 0 即 E 0 ,
如果在标准状态下,则用Eθ或
θ进行判断:
当Eθ>0 即θ+> θ- 正反应能自发进行 当Eθ=0 即θ+= θ- 反应达到平衡 当Eθ<0 即θ+< θ- 逆反应能自发进行
例:
求S2O32-,S2O82-,Na2S4O6 中 S的氧化数。
2、氧化还原反应
1) 不同类型的氧化还原反应: ① 电子转移 Zn + Cu2+ = Cu + Zn2+ ② 电子偏移
C
•
+
O2
=
CO2
这两类不同的氧化还原反应可以用氧化数概 念统一:元素的氧化数发生了变化 。
2) 定义氧化还原反应
2)电极电位的测定 v 将待测电极和已知电极组成 原电池 v 原电池的电动势: E=待测-已知
铜电极电极电位的测定 E (Cu 2 /Cu ) SHE (Cu 2 /Cu ) 0.00000 V (Cu 2 /Cu )
3)标准电极电位及应用 ① 标准态下测得的氧化还原电对的电极电位就是 标准电极电位,符号qox/red。 ② 是热力学标准态下的电极电位; ③ 反应用 Ox + neRed表示,所以电极电 位又称为还原电位; ④ 电极电位是强度性质,与物质的量无关,如 Zn2+ + 2eZn q (Zn2+/Zn)= -0.7618V 1/ Zn2+ + e1/ Zn q (Zn2+/Zn)= 2 2 0.7618V
第八章-氧化还原反应与氧化还原滴定习题及答案

第⼋章-氧化还原反应与氧化还原滴定习题及答案第⼋章氧化还原反应与氧化还原滴定习题1.是⾮判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na 2S ,Na 2S 2O 3,Na 2SO 4和NaS 4O 6中,硫离⼦的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH 4+中,氮原⼦的氧化数为-3,其共价数为4。
1-4氧化数发⽣改变的物质不是还原剂就是氧化剂。
1-5任何⼀个氧化还原反应都可以组成⼀个原电池。
1-6两根银丝分别插⼊盛有 mol ·L -1和 1 mol ·L -1 AgNO 3溶液的烧杯中,且⽤盐桥将两只烧杯中的溶液连接起来,便可组成⼀个原电池。
1-7在设计原电池时,θ?值⼤的电对应是正极,⽽θ?值⼩的电对应为负极。
!1-8原电池中盐桥的作⽤是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO 3- + H + + e ?NO + H 2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进⾏的反应CrO 2-+Cl 2+OH -?CrO 42-+Cl -+H 2O 被配平后反应⽣成物CrO 42-的系数分别为8和2。
1-11对电极反应S 2O 82-+2e2SO 42- 来说,S 2O 82- 是氧化剂被还原,SO 42-是还原剂被氧化。
1-12原电池中,电⼦由负极经导线流到正极,再由正极经溶液到负极,从⽽构成了回路。
1-13⾦属铁可以置换CuSO 4溶液中的Cu 2+,因⽽FeCl 3溶液不能与⾦属铜反应。
1-14标准电极电势表中的θ值是以氢电极作参⽐电极⽽测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
1-17电极反应为Cl2+2e2Cl -的电对Cl 2/Cl -的E θ=;电极反应为12Cl 2+e Cl -时θ(Cl 2/Cl -) …=1/2×=。
第八章-氧化还原反应与氧化还原滴定习题及答案

—第八章氧化还原反应与氧化还原滴定习题1.是非判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na2S,Na2S2O3,Na2SO4和NaS4O6中,硫离子的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH4+中,氮原子的氧化数为-3,其共价数为4。
1-4氧化数发生改变的物质不是还原剂就是氧化剂。
1-5任何一个氧化还原反应都可以组成一个原电池。
¥1-6两根银丝分别插入盛有 mol·L-1和 1 mol·L-1 AgNO3溶液的烧杯中,且用盐桥将两只烧杯中的溶液连接起来,便可组成一个原电池。
ϕ值大的电对应是正极,而θϕ值小的电对应为负极。
1-7在设计原电池时,θ1-8原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO3- + H+ + e⇔NO + H2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进行的反应CrO2-+Cl2+OH-⇔CrO42-+Cl-+H2O 被配平后反应生成物CrO42-的系数分别为8和2。
1-11对电极反应S2O82-+2e2SO42- 来说,S2O82- 是氧化剂被还原,SO42-是还原剂被氧化。
1-12原电池中,电子由负极经导线流到正极,再由正极经溶液到负极,从而构成了回路。
1-13金属铁可以置换CuSO4溶液中的Cu2+,因而FeCl3溶液不能与金属铜反应。
¥1-14标准电极电势表中的θ值是以氢电极作参比电极而测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
Cl2+e Cl-时θ(Cl2/Cl-)1-17电极反应为Cl2+2e2Cl-的电对Cl2/Cl-的Eθ=;电极反应为12=1/2×=。
1-18电极电势大的氧化态物质氧化能力大,其还原态物质还原能力小。
1-19在一定温度下,电动势Eθ只取决于原电池的两个电极,而与电池中各物质的浓度无关。
第八章氧化还原反应

例: H 5I O 6
S2 O32
S4 O62
Fe3O4
根据氧化数的概念,凡是反应中出现元素的氧 化数发生变化的反应即为氧化还原反应。其中 氧化数降低的过程称为还原,氧化数升高的过 程称为氧化。
氧化数 +2
0
Cu2 (aq) Zn(s)
+2
0
Zn2 (aq) Cu(s)
Cu2+ Zn
Cu Zn2+
还原过程 氧化过程
自身氧化还原反应
2KClO3(s) 2KCl(s) 3O2 (g) 2HgO(s) 2Hg(l) O2 (g)
同一物质,既是氧化剂,又是还原剂,但氧 化、还原发生在不同元素的原子上。
负极(电子流出) Zn(s) - 2e正极(电子流出)Cu(s)+ 2e-
Zn2+(aq) 氧化反应 Cu2+(aq) 还原反应
电池反应: Zn(s) Cu2+ (aq)
Zn2+(aq) Cu(s)
氧化型 电对:
+ ne-
还原型
Zn 2 + /Zn , Cu 2 + /Cu
电极
金属导体如 Cu、Zn 惰性导体如 Pt、石墨棒
() Pt Fe2 1.0mol L1 , Fe3 0.1mol L1 ‖Cl 2.0mol L1 Cl2101325Pa ,Pt ()
5.2.2 电极电势差
在Cu-Zn原电池中,为何总是Zn失电子,Cu得电子? 原因: 电极电势产生的原因:
第八章 氧化还原反应与氧化还原滴定法

三、能斯特方程式
RT cOx ln nF cRe d
θ
当T=298.15K时: θ
0.05916 cOx lg n cRe d
应用能斯特方程式应注意下列问题:
1. 固体、纯液体或稀溶液中的溶剂不出现在能斯特方程式中。 2. 如果电极中的氧化态或还原态物质的计量数不是1时,则以计 量数作其浓度的指数。 3. 除氧化态和还原态物质外,若有H+或OH-参加电极反应,也应 出现在能斯特方程式中。 4. 电极中的氧化态或还原态物质是气体时,则用其相对分压。
Ca2+含量的计算公式:
5 cKMnO4VKMnO4 M Ca 10-3 Ca 2 % 2 100% ms
三、碘量法
一、基本原理
利用I2的氧化性或I-的还原性进行的氧化还原滴定法。
(因I2在水中溶解度小,通常将其溶解在KI溶液中。)
半电池反应
I2 + 2e I2 + I I3- + 2e
◆
返滴定法: 某些氧化性物质可用返滴定法测定。
间接滴定法: 某些非氧化还原性物质能与另一氧化剂或
还原剂定量反应,可采用间接滴定法进行测定。 如测定Ca2+含量时,首先将Ca2+沉淀为CaC2O4,过滤后,再 用稀H2SO4将CaC2O4溶解,然后用KMnO4滴定液滴定溶液 中的C2O42-,从而间接求得Ca2+含量。
基础化学 第2版
第八章
氧化还原反应与氧化还原滴定法
第八章
氧化还原反应与氧化还原滴定法 氧化还原反应
第一节
第二节
第三节
原电池与电极电势
氧化还原滴定法
学习要点
1.氧化还原反应的有关慨念及配平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4) 离子化合物中,氧化数 = 离子电荷数
共价化合物中,氧化数 = 形式电荷数
(5) 离子总电荷数=各元素氧化数的代数和。
中性化合物,各元素氧化数的代数和为0。
例:
K2Cr2O7 Cr为+6 Fe3O4 中,Fe为+8/3 Na2S2O3中,S 为+2 Na2S4O6中, 平均为+ 2.5 (2个S 为0, 二个S为+5)
AgCl/Ag
(二)电极电势的产生(了解)
电极电势 (电位) E的符号
E ø n+
M /
E n+
M /M
Eø 标准态电极电势 E 非标准态电极电势
单 位:V
电池电动势E 的形成及符号
Eø= E+ ø E–ø
E = E+ E–
(三)标准氢电极
将任何2个半电池组成电池,都能测定电池的电 动势(如用电位差计)。
数。找出氧化剂、还原剂的系数。 (4) 核对,可用H+, OH–, H2O配平。
例1 配平As2S3 + HNO3—→H3AsO4 + NO + H2SO4
a、找出氧化值有改变的元素
+3 -2
+5
+5
+2
+6
As2S3 + HNO3 → H3AsO4 + NO + H2SO4
b、按最小公倍数法确定氧化剂和还原剂的系数
电池符号:(-) PtH2(p0 )H+(1 mol·L-1) Cl– (c mol·L-1) Cl2(p0 ) Pt(+)
写出该电池的电极反应方程式和总反应方程式
负极反应: H2
2H+ + 2e
正极反应: Cl2 + 2 e
2Cl–
总反应: H2 + Cl2 = 2H+ + 2Cl–
3、氧化还原电对
氧化值的定义∶元素一个原子的电荷数, 这种电荷数有时是人为地将成键电子指定 给电负性较大的原子而求得的。
氧化值经验规则∶
(1)单质中,元素的氧化值为零。 如∶H2 、 Cl2、 Fe 、 S8 、O2 、O3 (2)正常氧化物中,氧的氧化值为-2,
过氧化物 (如H2O2 和Na2O2)中O为- 1, 超氧化物(如KO2)中O的氧化值为- 0.5, 臭氧化物(如KO3)中O的氧化值为- 1/3, 氟的氧化物(如OF2 )中O的氧化值为+2。 (3) H 一般为+1。
第三节 电极电势
一、原电池和电极电势 (一)原电池 1、原电池的组成与工作原理
定量表示氧化 剂、还原剂的 相对强弱
Zn + CuSO4 Cu + ZnSO4
直接反应∶产生热量,不能直接观察到电子转移; 原电池中∶产生电能,能观察到有电子转移。
铜-锌原电池示意图
工作状态的化学电池同时发生三个过程: ● 两个电极表面分别发生氧化反应和还原反应 ● 电子流过外电路 ● 离子流入电解质溶液
e、表示出相应的离子浓度或气体压力。
上述Cu-Zn原电池的电池符号∶
(-)ZnZn2+(c1/ mol·L-1) Cu2+(c2/mol·L-1) Cu(+)
电极符号∶ 负极 ZnZn2+(c1/ mol·L-1)
正极 Cu Cu2+(c2/mol·L-1 ) (可参见p129 电极的类型)
(-) Pt H2(p0 )H+(1mol·L-1)
(2×2+3×8),+28×3
+3 -2
+5
+5
+2
+6
3As2S3 + 28HNO3 → 6H3AsO4 + 28NO + 9H2SO4
O
-3×28
c、检查H个数,最后检查O个数。
(通过两边加H2O的方法)
3As2S3 + 28HNO3+4H2O===6H3AsO4 + 28NO + 9H2SO4
电极反应(或半电池反应) ∶
负极: Zn
Zn2+ + 2e (氧化反应)
正极: Cu2+ + 2e
Cu (还原反应)
电池反应(或总离子反应) ∶
Cu2+ + Zn
Cu + Zn2+
(由2个电极反应相加)
原电池是将氧化还原反应的化学能转变为电 能的装置。
2、原电池的表示方法— 电池符号 a、负极写在左边,正极写在右边 b、用∣表示不同物相之间的界面,用表示盐桥 c、同一相中的不同物质之间用,隔开。 d、加上不参与电极反应的惰性电极(如Pt,C(石墨)等)。
★氧化数(可为正或负、整数或分数)与化合价(只为 正整数)的区别与联系:二者有时相等,有时不等。
第二节 氧化还原反应方程式的配平
一、离子-电子法(半反应法) 二、氧化值法 原则:还原剂氧化值升高数和氧化剂氧化值降
低数相等(得失电子数目相等) (1) 写出化学反应方程式 (2) 确定有关元素氧化值升高及降低的数值 (3) 确定氧化值升高及降低的数值的最小公倍
H2
EøH
/
H
=
2
0.0000
V
(四)标准电极电势的测定
有电子得失的反应∶ 10 HClO3 + 3P4 = 10HCl + 12H3PO4
有电子对偏移的反应(电负性不同)∶ H2+Cl2 = 2HCl
氧化还原总是同时发生于一个反应之中。
氧化还原反应∶反应中有电子得失或电子对 偏移、有元素氧化值改变的反应。
二、氧化值(氧化数)
为判断和便于配平氧化还原反应,人为 地引入了氧化值的概念。
Fe3+(1mol·L-1) ,Fe2+ (1 mol·L-1) Pt (+)
负极反应: H2
2H+ + 2e
正极反应: Fe3+ + e
Fe2+
电池反应(总反应) : H2 + 2 Fe3+ = 2H+ + 2 Fe2+
要求:1. 题中给出电池符号,要能够写出电 极反应和总反应方程式。
例题:已知电池符号如下:
E电池= E+ E–
而单一半电池电极电势的绝对值无法测定。
为测定电极电势的相对值,采用标准氢电极作为 H / H2
比较标准,以测得其它电极的电极电势的相对值。
标准氢电极∶
298K,硫酸溶液中。
电极符号 电极反应 人为规定
Pt(s) H2(100kPa) H+ (1mol·L-1 )
2H+ + 2e
氧化还原电对常用符号 氧化型/还原型 来表示。
对电极反应 MnO4-+8H+ +5e
Mn2+ +4H2O
氧化还原电对为: MnO4-/Mn2+
MnO4- + e
MnO42- , Cl2 + 2e
2Cl-
MnO4-/MnO42-
Cl2/Cl-
Ag+ + e
Ag ,
AgCl + e
Ag+ Cl-
Ag+ /Ag
