分离工程课后习题答案_概要()
分离工程课后习题答案概要

第一章1.列出5种使用ESA和5种使用MSA的分离操作。
答:属于ESA分离操作的有精馏、萃取精馏、吸收蒸出、再沸蒸出、共沸精馏。
属于MSA分离操作的有萃取精馏、液-液萃取、液-液萃取(双溶剂)、吸收、吸附。
5.海水的渗透压由下式近似计算:π=RTC/M,式中C为溶解盐的浓度,g/cm3;M为离子状态的各种溶剂的平均分子量。
若从含盐g/cm3的海水中制取纯水,M=,操作温度为298K。
问反渗透膜两侧的最小压差应为多少kPa?答:渗透压π=RTC/M=×298×=。
所以反渗透膜两侧的最小压差应为。
9.假定有一绝热平衡闪蒸过程,所有变量表示在所附简图中。
求:(1)总变更量数Nv;(2)有关变更量的独立方程数Nc;(3)设计变量数Ni;(4)固定和可调设计变量数Nx , Na;(5)对典型的绝热闪蒸过程,你F z iT FP FV , y i ,T v , P vL , x i , T L , P L习题5附图将推荐规定哪些变量?思路1:3股物流均视为单相物流,总变量数Nv=3(C+2)=3c+6独立方程数Nc物料衡算式C个热量衡算式1个相平衡组成关系式C个1个平衡温度等式1个平衡压力等式共2C+3个故设计变量Ni=Nv-Ni=3C+6-(2C+3)=C+3固定设计变量Nx=C+2,加上节流后的压力,共C+3个可调设计变量Na=0解:(1)Nv = 3 ( c+2 )(2)Nc 物c能1相c内在(P,T) 2Nc = 2c+3(3)Ni = Nv – Nc = c+3(4)Nxu = ( c+2 )+1 = c+3(5)Nau = c+3 –( c+3 ) = 0思路2:输出的两股物流看成是相平衡物流,所以总变量数Nv=2(C+2)独立方程数Nc:物料衡算式C个,热量衡算式1个,共C+1个设计变量数Ni=Nv-Ni=2C+4-(C+1)=C+3固定设计变量Nx:有C+2个加上节流后的压力共C+3个可调设计变量Na:有011.满足下列要求而设计再沸汽提塔见附图,求:(1) 设计变更量数是多少?(2) 如果有,请指出哪些附加变量需要规定?解: N x u 进料 c+2压力 9c+11=7+11=18N a u 串级单元 1 传热 1合计 2N V U = N x u +N a u = 20 附加变量:总理论板数。
智慧树答案分离工程知到课后答案章节测试2022年

第一章1.下列操作中,不属于平衡分离过程的是()答案:加热2.下列分离过程中属于机械分离过程的是()答案:离心分离3.下列哪一个是速率分离过程()答案:膜分离4.下列分离过程中只利用了物质媒介的平衡分离过程是()答案:吸收5.平衡分离过程的分离基础是利用两相平衡时()实现分离。
答案:组成不同6.约束变量关系数就是()答案:变量之间可以建立的方程数和给定的条件7.设计变量数就是()答案:独立变量数与约束数之差第二章1.平衡常数计算式在()条件下成立。
答案:气相是理想气体,液相是理想溶液2.气液相平衡常数K值越大,说明该组分越()答案:易挥发3.当把一个气体溶液冷凝时,开始产生液滴的点叫作()答案:露点4.计算溶液泡点时,若,则说明()答案:温度偏高5.进行等温闪蒸时,当满足()条件时,系统处于两相区。
答案:;6.当物系处于泡点、露点之间时,体系处于()答案:气液两相7.闪蒸过程成立的条件是闪蒸温度T()答案:大于闪蒸条件下物料的泡点温度,且小于闪蒸条件下物料的露点温度第三章1.多组分精馏过程,下列有关最小理论级数值的说法正确的是()。
答案:与进料组成及进料状态均无关2.当萃取精馏塔的进料为饱和汽相时,萃取剂的加入位置是()答案:塔顶几个级以下加入3.关于均相恒沸物的描述不正确的是()答案:部分汽化可以得到一定程度的分离4.多组分精馏过程,当进料中的非分配组分只有重组分而无轻组分时,恒浓区出现于()答案:上恒浓区出现于精馏段中部,下恒浓区出现于进料级下5.吉利兰关联图,关联了四个物理量之间的关系,下列哪个不是其中之一()答案:压力6.全回流操作不能用于()。
答案:正常生产稳定过程7.用芬斯克公式求全塔最小理论板数时,式中相对挥发度应为()。
答案:全塔相对挥发度的平均值8.萃取精馏过程,若饱和液体进料,萃取剂应该从()进料。
答案:精馏段上部和进料级9.对于一个恒沸精馏过程,从塔内分出最低恒沸物,则较纯组分的产品应该从()得到。
分离工程习题集及答案

分离工程习题集目录第一部分填空题 (1)第二部分选择题 (6)第三部分名词解释及参考答案 (12)第四部分问答题及参考答案 (14)第五部分计算题及参考答案 (18)第一、第二部分参考答案 (50)第一部分填空题1. 分离作用是由于加入()而引起的,因为分离过程是()的逆过程。
2. 衡量分离的程度用()表示,处于相平衡状态的分离程度是()。
3. 分离过程是()的逆过程,因此需加入()来达到分离目的。
4. 工业上常用()表示特定物系的分离程度,汽液相物系的最大分离程度又称为()。
5. 固有分离因子是根据()来计算的。
它与实际分离因子的差别用()来表示。
6. 汽液相平衡是处理()过程的基础。
相平衡的条件是()。
7. 当混合物在一定的温度、压力下,满足()条件即处于两相区,可通过()计算求出其平衡汽液相组成。
8. 萃取精馏塔在萃取剂加入口以上需设()。
9. 最低恒沸物,压力降低是恒沸组成中汽化潜热()的组分增加。
10. 吸收因子为(),其值可反应吸收过程的()。
11. 对一个具有四块板的吸收塔,总吸收量的80%是在()合成的。
12. 吸收剂的再生常采用的是(),(),()。
13. 精馏塔计算中每块板由于()改变而引起的温度变化,可用()确定。
14. 用于吸收过程的相平衡关系可表示为()。
15. 多组分精馏根据指定设计变量不同可分为()型计算和()型计算。
16. 在塔顶和塔釜同时出现的组分为()。
17. 吸收过程在塔釜的限度为(),它决定了吸收液的()。
18. 吸收过程在塔顶的限度为(),它决定了吸收剂中()。
19. 吸收的相平衡表达式为(),在()操作下有利于吸收,吸收操作的限度是()。
20. 若为最高沸点恒沸物,则组分的无限稀释活度系数与饱和蒸汽压的关系式为()。
21. 解吸收因子定义为(),由于吸收过程的相平衡关系为()。
22. 吸收过程主要在()完成的。
23. 吸收有()关键组分,这是因为()的缘故。
分离工程2013年第二章习题参考答案
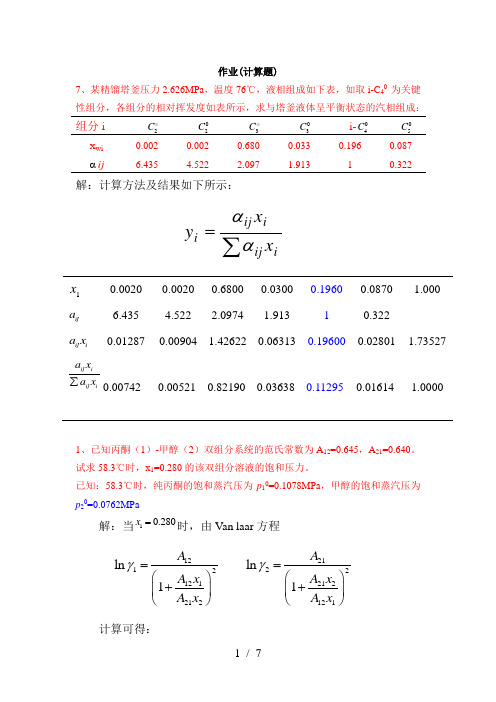
作业(计算题)7、某精馏塔釜压力2.626MPa ,温度76℃,液相组成如下表,如取i-C 40 为关键性组分,各组分的相对挥发度如表所示,求与塔釜液体呈平衡状态的汽相组成:组分i 2C =2C 3C = 03C i-04C05C x wiαij0.002 6.4350.002 4.5220.680 2.0970.033 1.9130.196 10.087 0.322解:计算方法及结果如下所示:1x0.0020 0.0020 0.6800 0.0300 0.1960 0.0870 1.000 ija6.4354.5222.09741.91310.322ij ia x0.01287 0.00904 1.42622 0.06313 0.19600 0.02801 1.73527ij iij i a x a x ∑0.007420.00521 0.82190 0.03638 0.11295 0.01614 1.00001、已知丙酮(1)-甲醇(2)双组分系统的范氏常数为A 12=0.645,A 21=0.640。
试求58.3℃时,x 1=0.280的该双组分溶液的饱和压力。
已知:58.3℃时,纯丙酮的饱和蒸汽压为p 10=0.1078MPa ,甲醇的饱和蒸汽压为 p 20=0.0762MPa解:当10.280x =时,由Van laar 方程计算可得:12211222121212212121ln ln 11A A A x A x A x A x γγ==⎛⎫⎛⎫++ ⎪ ⎪⎝⎭⎝⎭∑=iij iij i x x y αα120.645ln 0.3330.6450.28010.6400.720γ==⎛⎫+⨯ ⎪⎝⎭得:1 1.395γ=220.640ln 0.0510.6400.72010.6450.280γ==⎛⎫+⨯ ⎪⎝⎭得:2 1.0525γ= 所以001112220.1078 1.3950.2800.0762 1.05250.7200.0998p p x p x MPa γγ=+=⨯⨯+⨯⨯=2、已知某混合物0.05乙烷,0.30 丙烷,0.65正丁烷(摩尔分数),操作压力下各组分的平衡常数可按下式进行计算,试求其泡点温度。
分离工程简答题答案

1安德鲁公式(恩特伍德公式)
∑αi(x i,D)m
αi−θ
=R m+1
∑αi x i,F
αi−θ
=1−q
推导时所用的假设:1.塔内气相和液相均为恒摩尔流率
2.各组分的相对挥发度均为常数
2萃取和恒沸的区别
恒沸精馏和萃取精馏的基本原理是一样的,不同点仅在于共沸剂在影响原溶液最分的相对挥发度的同时,还与它们中的一个或数个形成共沸物。
3何谓清晰分割
若分馏出液中除了重关键组分外没有其他重组分,而釜液中除了轻关键组分外没有其他轻组分,称为清晰分割。
4分离顺序的选择
1)按相对挥发度递减的顺序,逐个从塔顶分离出各组分
2)最困难的分离应放在塔序的最后
3)应使各个塔的溜出液的摩尔数与釜液的摩尔数尽量接近
4)分离很高回收率的组分的塔应放在塔序的最后
5)进料中含量高的组分应尽快分出
5多组分精馏与二组分精馏在浓度分布上的区别
1)多组分精馏中,关键组分的浓度分布有极大值
2)非关键组分通常是非分配的,因此重组分仅出现在釜液中,轻组分仅出现在溜出液中
3)重轻非关键组分分别在进料板下、上形成集合恒浓的区域
4)全部组分均存在于进料板上,但进料板浓度不等于进料浓度,塔内各组分的浓度分布曲线在进料板处事不连续的
6萃取精馏过程中溶剂的作用
1)与组分1形成具有较强正偏差的非理想溶液,与组分2形成负偏差溶液或理想溶液,从而提高两者相对挥发度
2)稀释,减弱组分间相互作用
1/ 1。
化学分离工程_习题集(含答案)

《化学分离工程》课程习题集一、名词解释题1.微波辅助溶剂萃取2.超临界流体萃取3.尺寸排阻色谱技术4.纳滤技术5.分子蒸馏技术6.色谱分离的比移值7.平衡分离过程8.双水相萃取9.亲和色谱10.电渗析分离技术11.泡末吸附分离12.化学键合相色谱13.富集14.胶团萃取15.吸附色谱16.萃取分配平衡常数17.柱色谱法18.速度差分离过程19.微孔过滤技术20.分离度21.反胶团及反胶团萃取22.超临界流体23.反应分离24.物理萃取25.色谱分离26.吸附色谱法27.分离因子28.液膜分离技术29.富集倍数30.螯合物萃取31.色谱流出曲线32.膜污染33.薄层色谱法34.分配色谱法35.萃取平衡36.离子缔合物萃取37.空间排阻色谱法38.离子交换色谱法39.膜分离技术40.浓差极化现象41.协同萃取体系42.电渗析43.超临界流体色谱44.色谱分离的分配系数45.离子对色谱法46.双水相萃取技术47.液液分配色谱技术48.液固吸附色谱技术49.液膜分离技术50.亲合膜分离技术51.胶团萃取二、填空题52.胶团萃取是指被萃取的物质以从水相被萃取到的溶剂萃取方法。
53.微孔过滤技术是为推动力,利用筛网状微孔膜的进行分离的技术。
54.按分离过程的本质将分离方法分为过程,过程,过程。
55.评价分离方法常用的三个指标:,,。
56.影响溶剂萃取的主要因素:,,,,,等。
57.反胶团萃取体系中反胶团通过,,,等四种模型将蛋白质溶解到反胶团中。
58.色谱保留值表示试样中各组分在色谱柱内。
通常用来表示。
59.柱色谱法是将装在一金属或玻璃柱中或是将固定相附着在毛细管内壁上做成色谱柱,从柱头到柱尾沿一个方向移动而进行分离的色谱法。
60.色谱图中峰的区域宽度称为。
习惯上常用以下三个量来表示:(1),即色谱峰宽度的一半。
(2),即色谱峰的宽度;(3)。
61.色谱分离的速率理论认为造成色谱谱带展宽的效应有:扩散,扩散,流动相的。
分离工程作业答案讲义

4•一液体混合物的组成为:苯0.50;甲苯0.25;对二甲苯0.25(摩尔分率)。
分别用平衡常数法和相对挥发度法计算该物系在100kPa 时的平衡温度和汽相组成。
假设为完全理想系。
苯:1n : =20.7936-2788.51/( T-52.36);甲苯:1n - =20.9065-3096.52/( T-53.67);对-二甲苯:1n : =20.989 1-3346・65/(T-57.84);解1:(1)平衡常数法。
假设为完全理想系。
设t=95C 苯:ln P; =20.7936-2788.5/(95 273.15-52.36) =11.96 ;P; =1.569 105Pa甲苯:ln P255 =20.9065-3096.52/(95 273.15 -53.67) = 11.06 ;.P2S-6.358 104Pa对二甲苯:In P3S= 20.9891 -3346.65/(95 273.15 -57.84)= 10.204 ;S 4.P s = 2.702 10 PaK“ = P% 二1.569"0^^ =1.569; K2=听=0.6358K3』P = 0.2702' K必=1.596 0.5 0.2702 0.25 0.6358 0.25 = 1.011 1 选苯为参考组分:K/ =1.569(.01^1.552 ;由K^P1/P , R S =1.552O05Pa 解得t2=94.61C.lnP2S=11.05 ; P2S= 6.281 104Paln P3S=10.19 ; P3S= 2.6654 104PaK 2=0.6281 K 3=0.2665'K N =1.552 0.5 0.6281 0.25 0.2665 0.25 = 0.9997 1 故泡点温度为94.61 C,且y1 =1.552 0.5 = 0.776 ;y2 =0.6281 0.25 = 0.157 ; y3二0.2665 0.25 二0.067(2)相对挥发度法设t=94.61C,同上求得K1 =1.552, K2 =0.6281, K3=0.2665K 1 552-<13-5.824 ,胃-23 - 2.357 , ^- 33 -1K 3 0.2665二送 % B X j =5.824汉 0.5+ 2.357 汇 0.25 十 1 x 0.25= 3.752.357 汉 0.25 …“ y 20.157 ; y 3 =3.75'温度为 94.61C, R S =1.552 "05Pa ,s 534R 捲=1.552x105xO.5 = Py 1 =100x10 x 0.776 = 7.76乂 104满足完全理想系的相平衡条件 解2: (1)平衡常数法: 设T=368K用安托尼公式得:R s=156.24kPa ; P 2s-63.28k P a ; P,^ 26.88k P a 由式(2-36)得:K 1 =1.562 ; 0= 0.6 3 3 ; "0.269y 1 = 0.781; y 2 = 0.1 5 8 ; y 3 = 0.0 6 7 ; ' y^ 1.006由于v y >1・001,表明所设温度偏高。
生物分离工程部分习题和答案

2 生物分离工程在生物技术中的地位?答:生物技术的主要目标产物是生物物质的高效生产,而分离纯化是生物产品工程的重要环节,而且分离工程的质量往往决定整个生物加工过程的成败,因此,生物分离纯化过程在生物技术中极为重要。
3 分离效率评价的主要标准有哪些?各有什么意义?(ppt)答:根据分离目的的不同,评价分离效率主要有3个标准:以浓缩为目的:目标产物浓缩程度(浓缩率m)以纯度为目的:目标产物最终纯度(分离因子a)以收率为目的:产品收得率(%)5 在设计下游分离过程前,必须考虑哪些问题方能确保我们所设计的工艺过程最为经济、可靠?(ppt)答:<1>、目标产物性质及其共存杂质的特性 <2>、充分考虑目标产物商业价值<3>、考虑生物加工过程自身规模 <4>、采用步骤次序相对合理<5>、尽可能采用最少步骤 <6>、产品稳定性与物性<7>、产品规格与型式 <8>、生产过程中废水等排放6 下游加工过程的发展趋势有哪些方面?(ppt)答:成本控制和质量控制第二章发酵液预处理一解释名词凝聚剂:让不稳定的胶体微粒(或者凝结过程中形成的微粒)聚合在一起形成集合体的过程中所投加的试剂的统称。
过滤:利用多孔介质(如滤布、微孔膜、致密膜)截流悬浮液中的固体粒子,进行液固分离的过程。
离心:在离心力作用下,利用固体和液体之间的密度差达到沉降分离目的。
细胞破碎:利用外力破坏细胞膜和细胞壁,使细胞内容物包括目的产物成分释放出来的技术包含体:指细胞或细菌中高表达的蛋白质(也可以汇同其他细胞成分)聚集而成的不溶性颗粒。
二简答题1 为什么要进行发酵液的预处理?常用处理方法有哪几种?答:提高过滤速度与过滤质量改变发酵液性质(黏度↓、颗粒 、颗粒稳定性↓) 去除部分杂质使产物转入到易处理的相中(通常是液相)方法:加热、调节、pH、凝聚、絮凝2 凝集与絮凝过程有何区别?如何将两者结合使用?常用的絮凝剂有哪些?答:凝集:在中性盐作用下,由于双电层排斥电位降低使胶体体系不稳定的现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章1. 列出5种使用ESA 和5种使用MSA 的分离操作。
答:属于ESA 分离操作的有精馏、萃取精馏、吸收蒸出、再沸蒸出、共沸精馏。
属于MSA 分离操作的有萃取精馏、液-液萃取、液-液萃取(双溶剂)、吸收、吸附。
5.海水的渗透压由下式近似计算:π=RTC/M ,式中C 为溶解盐的浓度,g/cm 3;M 为离子状态的各种溶剂的平均分子量。
若从含盐0.035 g/cm 3的海水中制取纯水,M=31.5,操作温度为298K 。
问反渗透膜两侧的最小压差应为多少kPa?答:渗透压π=RTC/M =8.314×298×0.035/31.5=2.753kPa 。
所以反渗透膜两侧的最小压差应为2.753kPa 。
9.假定有一绝热平衡闪蒸过程,所有变量表示在所附简图中。
求: (1) 总变更量数Nv;(2) 有关变更量的独立方程数Nc ; (3) 设计变量数Ni;(4) 固定和可调设计变量数Nx , Na ; (5) 对典型的绝热闪蒸过程,你将推荐规定哪些变量?思路1:3股物流均视为单相物流, 总变量数Nv=3(C+2)=3c+6 独立方程数Nc 物料衡算式 C 个 热量衡算式1个 相平衡组成关系式C 个 1个平衡温度等式1个平衡压力等式 共2C+3个 故设计变量Ni=Nv-Ni=3C+6-(2C+3)=C+3固定设计变量Nx =C+2,加上节流后的压力,共C+3个 可调设计变量Na =0 解:(1) Nv = 3 ( c+2 )(2) Nc 物 c 能 1 相 c 内在(P ,T) 2 Nc = 2c+3 (3) Ni = Nv – Nc = c+3V -2F z iT F P FV , y i ,T v , P vL , x i , T L , P L习题5附图(4) Nxu = ( c+2 )+1 = c+3 (5) Nau = c+3 – ( c+3 ) = 0 思路2:输出的两股物流看成是相平衡物流,所以总变量数Nv=2(C+2) 独立方程数Nc :物料衡算式 C 个 ,热量衡算式1个 ,共 C+1个 设计变量数 Ni=Nv-Ni=2C+4-(C+1)=C+3固定设计变量Nx:有 C+2个加上节流后的压力共C+3个 可调设计变量Na :有011.满足下列要求而设计再沸汽提塔见附图,求: (1) 设计变更量数是多少? (2) 如果有,请指出哪些附加变量需要规定?解: N x u 进料 c+2压力 9 c+11=7+11=18N a u 串级单元 1 传热 1 合计 2 N V U= N x u+N a u= 20 附加变量:总理论板数。
16.采用单个精馏塔分离一个三组分混合物为三个产品(见附图),试问图中所注设计变量能否使问题有唯一解?如果不,你认为还应规定哪个(些)设计变量? 解: N X U 进料 c+2 压力 40+1+1 c+44 = 47N a u 3+1+1+2 = 7 N v u = 54设计变量:回流比,馏出液流率。
第二章4.一液体混合物的组成为:苯0.50;甲苯0.25;对二甲苯0.25(摩尔分率)。
分别用平衡常数法和相对挥发度法计算该物系在100kPa 式的平衡温度和汽相组成。
假设为完全理想系。
解1:(1)平衡常数法: 设T=368K 用安托尼公式得:kPa P s 24.1561= ;kPa P s 28.632= ;kPa P s 88.263=进料,227K ,2068kP a组分N 2C 1C 2C 3C 4C 5C 6K m ol/h1.054.467.6141.154.756.033.3塔顶产物塔底产物92习题6附图由式(2-36)得:562.11=K ;633.02=K ;269.03=K781.01=y ;158.02=y ;067.03=y ;006.1=∑i y 由于∑i y >1.001,表明所设温度偏高。
由题意知液相中含量最大的是苯,由式(2-62)得: 553.11'1==∑iy K K 可得K T 78.367'= 重复上述步骤:553.1'1=K ;6284.0'2=K ;2667.0'3=K 7765.0'1=y ;1511.0'2=y ;066675.0'3=y ;0003.1=∑i y 在温度为367.78K 时,存在与之平衡的汽相,组成为:苯0.7765、甲苯0.1511、对二甲苯0.066675。
(2)用相对挥发度法:设温度为368K ,取对二甲苯为相对组分。
计算相对挥发度的: 5.807 13=α ; 2.353 23=α ;000.133=α组分i苯(1) 甲苯(2) 对二甲苯(3)0.500.250.25 1.0005.807 2.353 1.0002.9035 0.5883 0.25003.74180.77600.15720.06681.0000解2:(1)平衡常数法。
假设为完全理想系。
设t=95℃苯: 96.11)36.5215.27395/(5.27887936.20ln 1=-+-=s P ; 甲苯: 06.11)67.5315.27395/(52.30969065.20ln 2=-+-=s P ; 对二甲苯:204.10)84.5715.27395/(65.33469891.20ln 3=-+-=s P ;569.11010569.15511=⨯==PP K s;6358.022==PP K s选苯为参考组分:552.1011.1569.112==K ;解得T 2=94.61℃05.11ln 2=s P ; Pa P s 4210281.6⨯= 19.10ln 3=s P ;Pa P s 43106654.2⨯=2K =0.6281 3K =0.2665故泡点温度为94.61℃,且776.05.0552.11=⨯=y ;157.025.06281.02=⨯=y ;067.025.02665.03=⨯=y(2)相对挥发度法设t=95℃,同上求得1K =1.569,2K =0.6358,3K =0.2702807.513=α,353.223=α,133=α故泡点温度为95℃,且776.074.35.0807.51=⨯=y ;157.074.325.0353.22=⨯=y ;067.074.325.013=⨯=y11.组成为60%(mol)苯,25%甲苯和15%对二甲苯的100kmol 液体混合物,在101.3kPa 和100℃下闪蒸。
试计算液体和气体产物的量和组成。
假设该物系为理想溶液。
用安托尼方程计算蒸气压。
解:在373K 下苯: ()36.5251.27887936.20ln 1--=T P S kPa P S 315.1791= 甲苯: ()67.5352.30969065.20ln 2--=T P S kPa P S 834.732= 对二甲苯:()84.5765.3346981.20ln 3--=T P S kPa P S 895.313= 计算混合组分的泡点T B T B =364.076K 计算混合组分的露点T D T D =377.83K此时:x 1=0.38,x 2=0.3135,x 3=0.3074,L=74.77kmol ; y 1=0.6726,y 2=0.2285,y 3=0.0968,V=25.23kmol 。
12.用图中所示系统冷却反应器出来的物料,并从较重烃中分离轻质气体。
计算离开闪蒸罐的蒸汽组成和流率。
从反应器出来的物料温度811K ,组成如下表。
闪蒸罐操作条件下各组分的K 值:氢-80;甲烷-10;苯-0.01;甲苯-0.004组分 流率,mol/h 氢 200 甲烷200解:以氢为1,甲烷为2,苯为3,甲苯为4。
总进料量为F=460kmol/h ,4348.01=z ,4348.02=z ,1087.03=z ,0217.04=z 又K1=80,K2=10,K3=0.01,K4=0.004 由式(2-72)试差可得:Ψ=0.87, 由式(2-68)计算得:y1=0.4988,y2=0.4924,y3=0.008,y4=0.0008;V=400.2mol/h 。
14.在101.3kPa 下,对组成为45%(摩尔)正己烷,25%正庚烷及30%正辛烷的混合物。
⑴求泡点和露点温度⑵将此混合物在101.3kPa 下进行闪蒸,使进料的50%汽化。
求闪蒸温度,两相的组成。
解:⑴因为各组分都是烷烃,所以汽、液相均可看成理想溶液,K I 只取决于温度和压力,可使用烃类的P-T-K 图。
泡点温度计算得:T B =86℃。
露点温度计算得:T D =100℃。
⑵由式(2-76)求T 的初值为93℃,查图求K I组分 正己烷 正庚烷 正辛烷 z i 0.45 0.25 0.30 K i1.92 0.88 0.410.2836-0.0319-0.2511所以闪蒸温度为93℃。
由式(2-77)、(2-68)计算得:x C6=0.308,x C7=0.266,x C8=0.426 y C6=0.591,y C7=0.234,y C8=0.175所以液相中含正己烷30.8%,正庚烷26.6%,正辛烷42.6%; 汽相中含正己烷59.1%,正庚烷23.4%,正辛烷17.5%。
第三章12.在101.3Kpa 压力下氯仿(1)-甲醇(2)系统的NRTL 参数为: 12τ=8.9665J/mol ,12τ=-0.83665J/mol ,12α=0.3。
试确定共沸温度和共沸组成。
安托尼方程(S P :Pa ;T :K)氯仿:)(16.4679.26968660.20ln 1--=T P S甲醇:)(29.3455.36264803.23ln 2--=T P S 解:设T 为53.5℃苯 50 甲苯10则)(16.4665.32679.26968660.20ln 1--=S P S P 1=76990.1 S P 2=64595.6由)(ij ij ij G τα-=exp ,ij α=ji α)(121212exp τα-=G =)(9665.83.0exp ⨯-=0.06788)(212121exp τα-=G =)(8365.03.0exp ⨯=1.2852 =⎥⎦⎤⎢⎣⎡+-⨯+⨯-+⨯--211221221]06788.01[06788.09665.8]2852.11[2852.18365.01x x x x x )()()()( =⎥⎦⎤⎢⎣⎡-+---21212193212.016086.02852.02852.13817.11)()()(x x x =⎥⎦⎤⎢⎣⎡-+⨯-++-⨯211211221]12852.1[2852.18365.006788.0106788.09665.8)()(x x x x x =⎥⎦⎤⎢⎣⎡--+-2121212852.02852.107507.193212.0104131.0)()(x x x 1ln γ-2ln γ=S S P P 21ln =6.645951.76990ln=0.1755 求得1x =0.321γ=1.2092 2γ=0.8971=8971.06.6459568.02092.11.7699032.0⨯⨯+⨯⨯ =69195.98Pa 101.3kPa设T 为60℃则)(16.4615.33379.26968660.20ln 1--=S PS P 1=95721.9 S P 2=84599.91ln γ-2ln γ=S S P P 21ln =9.845999.95721ln=0.1235 设T 为56℃则)(16.4615.32979.26968660.20ln 1--=S PS P 1=83815.2 S P 2=71759.31ln γ-2ln γ=S S P P 21ln =3.717592.83815ln=0.1553 当1ln γ-2ln γ=0.1553时求得1x =0.30 1γ=1.1099 2γ=0.9500=9500.03.7175970.01099.12.8381530.0⨯⨯+⨯⨯ =75627.8Pa 101.3kPa14.某1、2两组分构成二元系,活度系数方程为221ln Ax =γ,212ln Ax =γ,端值常数与温度的关系:A=1.7884-4.25⨯10-3T (T ,K) 蒸汽压方程为T P S40500826.16ln 1-=T P S 40503526.16ln 2-= (P :kPa :T :K)假设汽相是理想气体,试问99.75Kpa 时①系统是否形成共沸物?②共沸温度是多少? 解:设T 为350K则A=1.7884-4.25⨯10-3⨯350=1.7884-1.4875=0.300935040500826.16ln 1-=S P ;∴SP 1=91.0284 kPa35040503526.16ln 2-=S P ;SP 2=119.2439 kPa因为在恒沸点由1221112==S SP P γγα得SS PP 1221=γγ 解得:1x =0.9487 2x =0.0513∴210513.03009.0ln ⨯=γ;1γ=1.0008229487.03009.0ln ⨯=γ;2γ=1.3110P=∑Si i i Px γ=1.0008⨯0.9487⨯91.0284+1.3110⨯0.0513⨯119.2439 =95.069275.99≠ kPa设T 为340K则A=1.7884-4.25⨯10-3⨯340=0.343434040500826.16ln 1-=S P ;SP 1=64.7695 kPa 34040503526.16ln 2-=S P ;SP 2=84.8458 kPa由)(12121ln x A P PS S -=;)(1213434.08458.847695.64ln x -=解得:1x =0.8931 2x =1-0.8931=0.1069∴211069.03434.0ln ⨯=γ;1γ=1.0039228931.03434.0ln ⨯=γ;2γ=1.3151P=∑Si i i Px γ=1.0039⨯0.8931⨯64.7695+1.3151⨯0.1069⨯84.8458 =69.999275.99≠ kPa设T 为352K则A=1.7884-4.25⨯10-3⨯352=0.292435240500826.16ln 1-=S P ;SP 1=97.2143 kPa 35240503526.16ln 2-=S P ;SP 2=127.3473 kPa由)(12121ln x A P PS S -=;)(1212924.03473.1272143.97ln x -=∴1x =0.96172x =1-0.9617=0.0383∴210383.02924.0ln ⨯=γ;1γ=1.0004229617.02924.0ln ⨯=γ;2γ=1.3105P=∑Si i i Px γ=1.0004⨯0.9617⨯97.2143+1.3105⨯0.0383⨯127.3473 =99.920275.99≈ kPa说明系统形成共沸物,其共沸温度为352K 。
