最新初中常见物质化学式与元素化合价
2024年初中化学化合价和化学式总结

2024年初中化学化合价和化学式总结化合价是指元素在化合物中所具有的化学价值。
化合价可以帮助我们了解元素之间的化学反应和化合物的组成。
在初中化学课程中,学生们学习了常见元素的化合价和化学式。
下面是一个总结,列出了一些常见元素的化合价和化学式。
第一组元素:1. 氢(H):化合价为+1,最简化学式为H2;2. 铯(Cs):化合价为+1,最简化学式为CsCl。
第二组元素:1. 铍(Be):化合价为+2,最简化学式为BeO;2. 镁(Mg):化合价为+2,最简化学式为MgCl2;3. 钙(Ca):化合价为+2,最简化学式为CaO。
第三组元素:1. 钠(Na):化合价为+1,最简化学式为NaCl;2. 铝(Al):化合价为+3,最简化学式为Al2O3。
第四组元素:1. 钾(K):化合价为+1,最简化学式为KCl;2. 铬(Cr):化合价为+2或+3(六价态时),最简化学式为CrCl2或CrCl3。
第五组元素:1. 银(Ag):化合价为+1,最简化学式为AgCl;2. 锌(Zn):化合价为+2,最简化学式为ZnO。
第六组元素:1. 铜(Cu):化合价为+1或+2,最简化学式为CuCl或CuCl2;2. 镉(Cd):化合价为+2,最简化学式为CdO。
第七组元素:1. 氯(Cl):化合价为-1,最简化学式为NaCl;2. 锌(Zn):化合价为+2,最简化学式为ZnCl2。
第八组元素:1. 氩(Ar):为惰性气体,不与其他元素形成化合物。
这只是一部分常见元素的化合价和化学式。
对于其他元素,学生们可以参考化学元素周期表,并根据元素家族和化合物的性质来推测它们的化合价和化学式。
以上是____年初中化学化合价和化学式的总结,希望对您有所帮助。
中学化学式中常用的化合价
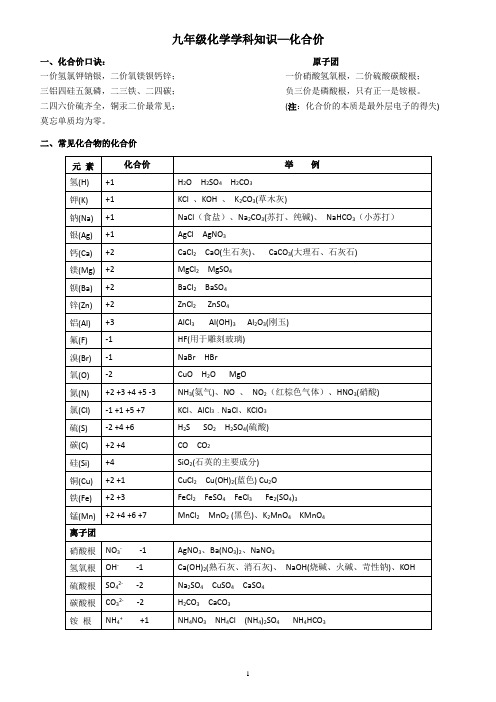
一、化合价口诀:原子团
一价氢氯钾钠银,二价氧镁钡钙锌;一价硝酸氢氧根,二价硫酸碳酸根;
三铝四硅五氮磷,二三铁、二四碳;负三价是磷酸根,只有正一是铵根。
二四六价硫齐全,铜汞二价最常见;(注:化合价的本质是最外层电子的得失)
莫忘单质均为零。
二、常见化合物的化合价
元素
化合价
举例
氢(H)
锰(Mn)
+2 +4 +6 +7
MnCl2MnO2(黑色)、K2MnO4KMnO4
离子团
硝酸根
NO3--1
AgNO3、Ba(NO3)2、NaNO3
氢氧根
OH--1
Ca(OH)2(熟石灰、消石灰)、NaOH(烧碱、火碱、苛性钠)、KOH
硫酸根
SO42--2
Na2SO4CuSO4CaSO4
碳酸根
CO32--2
H2CO3CaCO3
铵根
NH4++1
NH4NO3NH4Cl (NH4)2SO4NH4HCO3
钡(Ba)
+2
BaCl2BaSO4
锌(Zn)
+2
ZnCl2ZnSO4
铝(Al)
+3
AlCl3Al(OH)3Al2O3(刚玉)
氟(F)
-1
HF(用于雕刻玻璃)
溴(Br)
-1
NaBr HBr
氧(O)
-2
CuO H2O MgO
氮(N)
+2 +3 +4 +5 -3
NH3(氨气)、NO、NO2(红棕色气体)、HNO3(硝酸)
+1
H2O H2SO4H2CO3
初中化学化合价和化学式总结

初中化学化合价和化学式总结化学是一门研究物质的性质、结构、组成、变化规律以及它们之间的相互作用的科学。
化学是自然科学中一门非常重要的学科,也是理工类专业中一门基础的必修课。
在初中化学中,化合价和化学式是两个重要的概念,对于初学者来说是一个比较难以理解的部分。
下面将会对这两个概念进行总结,帮助初中化学学习者更好地理解和掌握。
一、化合价化合价是指元素与其他元素结合时所表现出的化学性质。
化合价可以帮助我们了解元素在化合物中的结合方式和元素之间的电子转移或共用情况。
化合价的大小决定了元素与其他元素形成化合物的可能性和形式。
1.单质的化合价:单质的化合价主要取决于元素所在的族别和周期。
例如,从第一周期到第七周期,元素的化合价逐渐增加。
周期表中,主族元素的化合价一般为族别数,即1A族元素的化合价为+1,2A族元素的化合价为+2、其中有一些特殊的例子,如氢原子的化合价为+1,氧原子的化合价为-2,氮原子的化合价为-32.化合物的化合价:化合物的化合价是指化合物中各元素的化合价之和。
根据化合价的大小,可以确定化合物中各元素的相对含量。
例如,氯化钠(NaCl)是一种非常常见的化合物,其中氯的化合价为-1,钠的化合价为+1、因此,氯化钠中钠的相对含量为1,氯的相对含量为13.化合价的计算:化合价的计算是基于元素与其他元素的电子转移或共用规律。
对于电子转移,如果一个非金属元素愿意捐出电子,则其化合价为正数;如果一个金属元素愿意接收电子,则其化合价为负数。
对于共用,如果两个非金属元素共用一个电子对,则它们的化合价都为正数。
二、化学式化学式是用化学符号和数字表示化合物的组成和结构。
化学式可以帮助我们了解化合物中各元素的相对含量和原子组成。
1.原子符号:化学式中使用的是元素的化学符号,如H表示氢,O表示氧,C表示碳等。
2.个数指示:化学式中通过数字表示元素的个数,如H2表示2个氢原子,O2表示2个氧原子。
3.括号使用:当化合物中含有多个相同的基团时,可以使用括号来表示。
初中常见化合价化学式及化学方程式
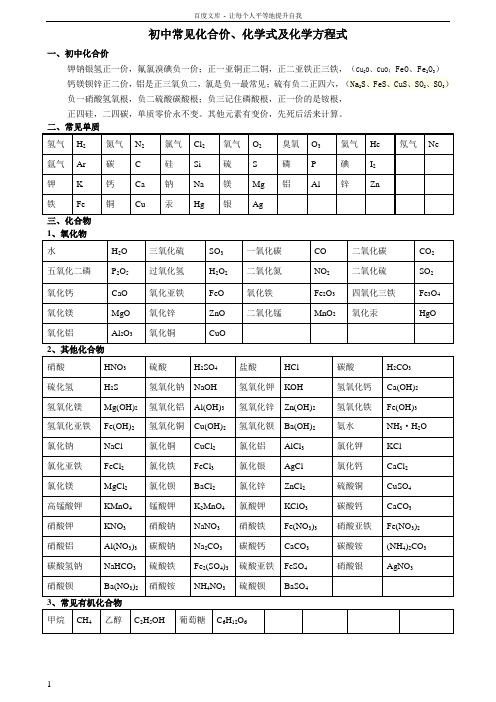
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
初中常见化合价、化学式及化学方程式
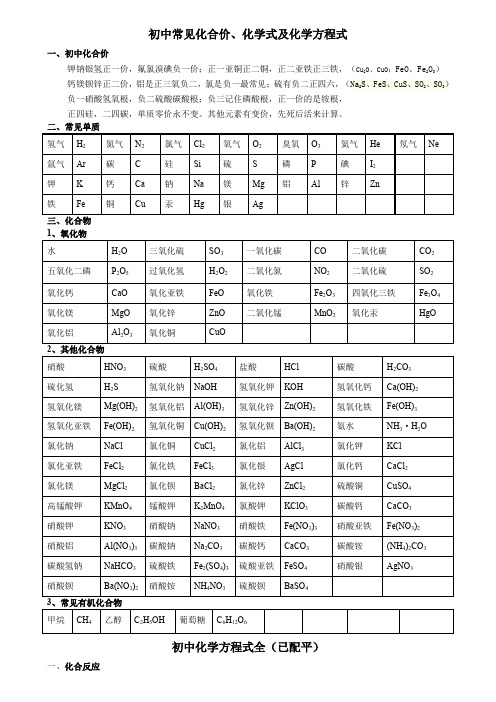
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O点燃2MgO2、铁在氧气中燃烧:3Fe+2O点燃Fe3O43、铝在空气中燃烧:4Al+3O点燃2Al2O34、氢气在空气中燃烧:2H2+O点燃2H2O5、红磷在空气中燃烧:4P+5O点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
初三化学式与化合价知识点归纳

初三化学式与化合价知识点归纳初三化合价知识化合价口诀化合价一:一价氟氯溴碘氢,还有金属钾钠银。
二价氧钡钙镁锌,铝三硅四都固定。
氯氮变价要注意,一二铜汞一三金。
二四碳铅二三铁,二四六硫三五磷。
常见元素的主要化合价二:氟氯溴碘负一价;正一氢银与钾钠。
氧的.负二先记清;正二镁钙钡和锌。
正三是铝正四硅;下面再把变价归。
全部金属是正价;一二铜来二三铁。
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
化合价口诀三:一价氢氯钾钠银;二价氧钙钡镁锌,三铝四硅五氮磷;二三铁二四碳,二四六硫全都齐;铜以二价最常见。
化合价口诀四:一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁二四碳二四六硫都齐全铜汞二价最常见负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根初三化学式知识单质:氢气H2、氮气N2、氧气O2、氯气Cl2、氦He、碳C 、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氩Ar、钾K、钙Ca、锌Zn、铁Fe、铜Cu、汞Hg、银Ag。
非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO。
酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)。
碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
微溶于水,水溶液俗称澄清石灰水)、氢氧化镁Mg(OH)2(不溶于水,白色沉淀)、氢氧化铁 Fe(OH)3(不溶于水,红褐色沉淀)、氢氧化铜 Cu(OH)2(不溶于水,蓝色沉淀)、一水合氨NH3•H2O(水溶液俗称氨水)。
初中化学元素化合价完整版

初中化学元素化合价完整版元素的化合价是指一个元素在化合物中的电荷数。
化合价的了解对于理解元素之间的化学反应和化学反应的类型非常重要。
下面是初中化学元素化合价的完整版:一、常见元素的化合价1.碱金属元素(IA族)的化合价一般为+1,如氢(H)的化合价为+12.碱土金属元素(IIA族)的化合价一般为+2,如钙(Ca)的化合价为+23.铝(Al)作为典型的删去两个电子外壳的元素,其化合价为+34.氧(O)与许多元素形成的化合物中,氧的化合价一般为-2,如二氧化碳(CO2)中的氧的化合价为-25.氢(H)与非金属元素的化合物中,氢的化合价一般为+1,如甲烷(CH4)中的氢的化合价为+16.氯(Cl)与同族元素的化合物中,氯的化合价一般为-1,如氯化钠(NaCl)中的氯的化合价为-1二、元素的变价有些元素可以变化其化合价形成不同的化合物,这被称为变价。
例如,氮(N)在氨气(NH3)中化合价为-3,而在一氧化二氮(N2O)中化合价为+1、变价的原因是元素电子层的结构和元素与其他元素的相互作用。
三、元素的共价价电子对数共价价电子对数指一个元素与其他元素形成共价键时,共享电子的数量。
以氮(N)为例,氮的的电子组态为1s22s22p3,氮原子的最外面一层有5个电子,它需要3个电子来填满它的p轨道。
所以氮原子可以形成3个共价键,共享3对电子(或称价电子对)。
四、多价元素有些元素可以形成不同的化合价,这被称为多价元素。
例如,铁(Fe)可以形成2价和3价两种化合价。
在二价铁化合物中,铁的化合价为+2,如亚铁离子(Fe2+);而在三价铁化合物中,铁的化合价为+3,如三价铁离子(Fe3+)。
五、化合价的计算在一些情况下,我们需要根据化合物的成分计算元素的化合价。
计算化合价的方法是根据化合物的总电荷和不同元素的电荷数来确定。
对于二氧化碳(CO2),总电荷为0。
氧的化合价为-2,所以2个氧原子的电荷数为-4、因此,碳原子的电荷数必须为+4,即碳的化合价为+4化合价的计算也可以通过元素在周期表上的位置来推断。
八年级化学化合价表

八年级化学化合价表在人教版八年级化学中,常见元素化合价如下:一、一价元素。
1. 氢(H)- 通常显 +1价,例如在氯化氢(HCl)中,氢元素为+1价。
2. 钾(K)- 钾元素在化合物中通常显 +1价,如氯化钾(KCl)。
3. 钠(Na)- 钠元素在化合物中一般为+1价,像氯化钠(NaCl)。
4. 银(Ag)- 银元素常见化合价为 +1价,例如硝酸银(AgNO₃)。
二、二价元素。
1. 钙(Ca)- 在化合物中钙元素常显+2价,如碳酸钙(CaCO₃)。
2. 镁(Mg)- 镁元素在化合物里通常为+2价,像氧化镁(MgO)。
3. 钡(Ba)- 钡元素一般显+2价,例如硫酸钡(BaSO₄)。
4. 锌(Zn)- 锌元素常见化合价为+2价,如硫酸锌(ZnSO₄)。
5. 铜(Cu)- 铜元素有+2价,例如氧化铜(CuO);也有 +1价(亚铜离子),如氧化亚铜(Cu₂O)。
三、三价元素。
1. 铝(Al)- 铝元素在化合物中通常显+3价,如氧化铝(Al₂O₃)。
四、变价元素(铁元素)1. 铁(Fe)- 有+2价(亚铁离子),如氯化亚铁(FeCl₂);- 还有+3价(铁离子),例如氯化铁(FeCl₃)。
五、特殊元素化合价。
1. 氧(O)- 在化合物中通常显 - 2价,如二氧化碳(CO₂)。
但在过氧化物(如过氧化氢H₂O₂)中氧元素为 - 1价。
2. 氯(Cl)- 通常显 - 1价,如氯化钠(NaCl);但在氯酸钾(KClO₃)中氯元素为+5价,在高氯酸(HClO₄)中为+7价等。
3. 氮(N)- 化合价比较复杂,有 - 3价(如氨气NH₃)、+2价(一氧化氮NO)、+4价(二氧化氮NO₂)、+5价(硝酸HNO₃)等。
4. 碳(C)- 有 +2价(如一氧化碳CO)、+4价(如二氧化碳CO₂)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人民广场地铁站有一家名为“漂亮女生”的饰品店,小店新开,10平方米不到的店堂里挤满了穿着时尚的女孩子。不几日,在北京东路、淮海东路也发现了“漂亮女生”的踪影,生意也十分火爆。现在上海卖饰品的小店不计其数,大家都在叫生意难做,而“漂亮女生”却用自己独特的经营方式和魅力吸引了大批的女生。氖气
初中常见物质化学式与元素化合价
一.常见单质
氢气
H2
氧气
O2
木质、石质、骨质、琉璃、藏银……一颗颗、一粒粒、一片片,都浓缩了自然之美,展现着千种风情、万种诱惑,与中国结艺的朴实形成了鲜明的对比,代表着欧洲贵族风格的饰品成了他们最大的主题。氮气
N2
氯气
Cl
臭氧
O3
然而影响我们大学生消费的最主要的因素是我们的生活费还是有限,故也限制了我们一定的购买能力。因此在价格方面要做适当考虑:我们所推出的手工艺制品的价位绝大部分都是在50元以下。一定会适合我们的学生朋友。氦气
硫酸银
AgSO4
硝酸银
AgNO3
氯化铵
ClNH4
硫酸铵
(NH4)SO4
硝酸铵
NH4NO3
氯化钙
CaCl2
硫酸钙
CaSO4
硝酸钙
Ca(NO3)2
氯化镁
MgCl2
硫酸镁
MgSO4
硝酸镁
Mg(NO3)2
氯化钡
BaCl2
硫酸钡
BaSO4
硝酸钡
Ba(NO3)2
氯化锌
ZnCl2
硫酸锌
ZnSO4
硝酸锌
Zn(NO3)2MnO2氧Fra bibliotek汞HgO
氧化铝
Al2O3
氧化铜
CuO
2.其他化合物
其他化合物
盐酸
HCl
硫酸
H2SO4
硝酸
HNO3
氯离子
Cl-
硫酸根离子
SO4-2
硝酸根离子
NO-
元素化合价
-1
原子团化合价
-2
原子团化合价
-1
氯化钠
NaCl
硫酸钠
Na2SO4
硝酸钠
NaNO3
氯化钾
KCl
硫酸钾
K2SO4
硝酸钾
KNO3
氯化银
AgCl
丁烷
C4H10
丁醇
C4H9OH
淀粉
(C6H12O6)n
戎烷
C5H12
戎醇
C5H11OH
…
己烷
C6H14
己醇
C6H13OH
庚烷
C7H16
庚醇
C7H15OH
辛烷
C8H18
辛醇
C8H17OH
壬烷
C9H20
壬醇
C9H19OH
癸烷
C10H22
癸醇
C10H21OH
…
…
化学方程式
1.化合反应
氧与非金属单质
O2+C=CO2
钙镁钡锌+2价通常氧显-2价
1 2铜2 3铁3铝4硅磷+5
硫有-2 +4 +6价莫忘单质价为零
氧化物
水
H2O
三氧化硫
SO3
一氧化碳
CO
二氧化碳
CO2
五氧化二磷
P2O5
过氧化氢
H2O2
二氧化氮
NO2
二氧化硫
SO2
氧化钙
CaO
氧化亚铁
FeO
氧化铁
Fe2O3
四氧化三铁
Fe3O4
氧化镁
MgO
氧化锌
ZnO
二氧化锰
CO32-
原子团化合价
-1
氢氧化铝
AL(OH2)3
原子团化合价
-2
氢氧化钙
KOH
氨水
NH3·H2O
碳酸钾
K2CO3
氢氧化钠
NaOH
碳酸钠
Na2CO3
氢氧化钙
CaOH2
碳酸氢钠
NaHCO3
碳酸铵
(NH4)2CO3
氢氧化镁
MgOH2
碳酸氢钾
KHCO3
碳酸钙
CaCO3
氢氧化钡
BaOH2
高锰酸钾
KMnO4
碳酸钡
(二)创业优势分析Ne
喜欢□一般□不喜欢□氩气
(四)DIY手工艺品的“个性化”Ar
氪气
(二)大学生对DIY手工艺品消费态度分析Kr
一、消费者分析氙气
Xe
碳
3、竞争对手分析C
硅
Si
硫
S
磷
P
碘
I
钾
K
钙
Ca
钠
Na
镁
Mg
铝
Al
铜
Cu
汞
Hg
银
Ag
锌
Zn
铁
Fe
二.化合物
1.氧化物
1)化合价口诀
钾钠银氢+1价氟氯溴碘-1价
氯化铜
CuCl2
硫酸铜
CuSO4
硝酸铜
Cu(NO3)2
氯化亚铁
FeCl2
硫酸亚铁
FeSO4
硝酸亚铁
Fe(NO₃)₂
氯化铁
FeCl3
硫酸铁
Fe2(SO4)3
硝酸铁
Fe(NO3)3
氯化铝
AlCl3
硫酸铝
Al2(SO4)3
硝酸铝
Al(NO3)3
续表
碳酸
H2CO3
氢氧根离子
OH
氢氧化铁
Fe(OH2)3
碳酸根离子
BaCO3
氢氧化锌
ZnOH2
锰酸钾
K2MnO4
碳酸镁
MgCO3
氢氧化铜
CuOH2
氯酸钾
KClO3
氢氧化亚铁
FeOH2
硫化氢
H2S
3.常见有机化合物
常见有机化合物
甲烷
CH4
甲醇
CH3OH
葡萄糖
C6H12O6
乙烷
C2H6
乙醇
C2H5OH
果糖
C6H12O6
丙烷
C3H8
丙醇
C3H7OH
麦芽糖
C12H22O11·H2O
