水的电离知识点.docx
水的电离知识点

水的电离知识点(1)电离平衡和电离程度 水是极弱的电解质,能微弱电离H 2O+H 2O H 3O ++OH -,通常简写为H 2O H ++OH -;ΔH >025℃时,纯水中c(H +)=c(OH -)=1×10-7mol/L(2)水的离子积在一定温度时,c(H +)与c(OH -)水的电离知识点。
K W =c(H +)·c(OH -),25℃时,K W =1×10-14(无单位)。
①K W 只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K W 增大。
25℃时K W =1×10-14,100℃时K W 约为1×10-12。
②水的离子积不仅适用于纯水,也适用于其他稀溶液水的电离知识点液,只要温 度不变,K W 就不变。
(3)影响水的电离平衡的因素 ①温度:温度越高电离程度越大c(H +)和c(OH -)同时增大,K W 增大,但c(H +)和c(OH -)始终保持相等,仍显中性。
纯水由25℃升到100℃,c(H +)和c(OH -)从1×10-7mol/L 增大到1×10-6mol/L(pH 变为6)。
②酸、碱向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K W 不变。
③加入易水解的盐由于盐的离子结合H +或OH -而促进水的电离,使水的电离程度增大。
温度不变时,K W 不变。
练习:影响水的电离平衡的因素可归纳如下:溶液的酸碱性溶液的酸碱性取决于溶液中的c(H +)与c(OH -)的相对大小。
在常温下,中性溶液:c(H +)=c(OH -)=1×10-7mol/L ;酸性溶液:c(H +)>c(OH -), c(H +)>1×10-7mol/L ;碱性溶液:c(H+)<c(OH-),c(H+)<1×10-7-mol/L。
思考:c(H+)>1×10-7mol/L (pH<7)的溶液是否一定成酸性?溶液的pH⑴表示方法pH=-lgc(H+) c(H+)=10-pHpOH=-lgc(OH-) c(OH-)=10-pOH常温下,pH+pOH=-lgc(H+)-lgc(OH-)=-lgc(H+)·c(OH-)=14。
水的电离知识详细讲解

水 的 电 离(一)水的电离1. 水是极弱的电解质.存在极弱的电离 H 2O +H 2O H 3O ++OH - 简写为 H 2O H ++OH -25℃ 1 L H 2O181000 = 55.6(mol)中有10-7mol 发生电离 H 2O H + + OH - 起始(mol) 55.6 0 0 电离(mol) 10-7 10-7 10-7 平衡(mol)55.6-10-7 10-7 10-725℃.[H +]·[OH -]=10-7·10-7=10-14=Kw 称作水的离子积常数.2.温度升高,Kw 增大.水的电离为吸热过程,所以当温度升高时,水的电离度增大,Kw 也增大.例如100℃,1 L H 2O 有10-6mol 电离.此时水的离子积常数为 Kw =10-6·10-6=10-12.常温下,Kw =10-143. 在中性、酸性、碱性稀溶液中Kw 的讨论.凡是在水溶液中,都存在着水的电离平衡.H 2O H ++OH -, H +和OH -总是同时存在的.(1)中性溶液中,Kw =[H +]·[OH -]=10-7·10-7=10-14(2)酸性溶液中, 由于[H +]增大, 水的电离平衡逆向移动, [OH -]减小, 但Kw =[H +]· [OH -]=10-14.(3)碱性溶液中, 由于[OH -]增大, 水的电离平衡逆向移动.[H +]减小, 但Kw =[H +]· [OH -]=10-14.结论:常温下,[H +]·[OH -]=10-14=Kw,适于纯水,中性、酸性、碱性稀溶液.4. 根据Kw 计算溶液中的[H +]或[OH -]由于水电离出来的H +或OH -很少,所以在酸(或碱)溶液中,一般就以酸(或碱)的浓度计算出[H +]或([OH -]),然后根据Kw 再计算溶液中的[OH -](或[H +])(1)酸溶液:强酸 [H +] 弱酸 [H +]=C α (2)碱溶液 强碱 [OH -] 弱碱 -]=C α(二)溶液的酸碱性和pH 值完全电离 部分电离 ]H [Kw + =[OH -] 完全电离 部分电离 ]OH [Kw - =[H +].1. 溶液的pH 值-lg[H +] = pH. [H +] = 10-pH2. 溶液的酸碱性与pH 值关系 (1)纯水和中性溶液 [H +] = 10-7mol/l.pH = -lg10-7 = -(-7)= 7 (2)酸性溶液 例如 0.01mol/l 盐酸 [H +] = 10-2mol/lpH = -lg10-2 = -(-2) = 2(3)碱性溶液 例如 0.01mol/l 烧碱溶液 [OH -] = 10-2mol/l[H +] =2141010-- = 10-12mol/lpH = -lg10-12 =123.pH 值取值围与[H +]对照关系[H +]:100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14(1)pH <7 溶液酸性,pH =7 溶液中性,pH >7 溶液碱性.(2)pH 增大1,[H +]减小10倍,[OH -]增大10倍;pH 减小1,[H +]增大10倍,[OH -]减小10倍.(3)当[H +]>1,pH <0或[H +]<10-14,pH >14直接用物质的量浓度而不用PH 值表示.4. 溶液的酸、碱性、PH 值与离子积常数小结. (三)pH 值的计算1. 基本计算公式C: 一元酸(碱)的物质的量浓度[H +]、[OH -]: 溶液中的H +浓度、OH -的浓度 α: 弱酸或弱碱的电离度强酸: C [H +] pH全部电离 -lg[H +] 10-PH溶液酸碱性 酸性增强 中性 碱性增强C [OH -] [H +] pHC [H +] pH弱碱 C [OH -] [H +] pH(四)酸碱指示剂2. pH 试纸的使用把待测试液滴在pH 试纸上,试纸所显示的颜色与标准比色板(pH 值1~14)相比,确定溶液的pH 值.3. pH 计可精确测定溶液的pH 值三、重点、难点剖析有关pH 值及其计算是本节难点 (一)有关pH 值的问与答1. 为什么要引进pH 值概念?答:当[H +]很小时,用物质的量浓度表示溶液的酸碱性很不方便. 2. 什么是溶液的pH 值?答:采用[H +]的负对数表示溶液酸碱性的强弱,叫做溶液的pH 值.pH =-lg[H +] 3. 溶液的酸碱性与PH 值有什么关系?答:常温下纯水和中性溶液中[H +]=10-7mol/l,因此,当pH =7为中性;pH <7为酸性,pH 值越小,溶液酸性越强;pH >7为碱性,pH 值越大,溶液碱性越强.4. 是否对任意浓度的[H +]或[OH -]用pH 值表示溶液的酸碱性均方便?答:pH 值一般是用来表示稀的酸性、碱性和中性溶液的酸碱性的.当pH 值小于0时,一般直接用H +物质的量浓度表示酸性强弱较为方便;当pH 值大于14时,一般直接用OH -物质的量浓度表示其碱性强弱较为方便.5. pH 值小于7,溶液一定为酸性吗?答:由于水的电离受到温度的影响,故不能简单地认为pH <7时,溶液一定是酸性.例如100℃时,Kw =10-12,pH =6为中性.则pH <6才是酸性.全部电离 部分电离 ]OH[Kw - αC部分电离 αC]OH [Kw- α+]H [ α-]OH [强碱 弱酸若不注明温度,一般认为是常温(25℃)就以pH <6溶液为酸性.6. 用试纸检验气体的酸碱性必须先将试纸湿润,那么检验溶液的pH 值是否也须将PH 试纸湿润呢?答:用pH 试纸来测定溶液的pH 值是定量测定其酸碱度.可用洁净的干玻璃棒直接蘸取少许待测液,滴在pH 试纸上,将试纸显示的颜色随即与标准比色板对照.注意不能将试纸先用水湿润或用湿玻璃棒,这样相当于将溶液稀释了,导致测定的pH 值不准确.(二)有关pH 值的计算1. 强碱、强碱溶液的pH 值: (1)酸:先求出[H +],pH =-lg[H +]碱:必先求出[OH -],再利用Kw 求出[H +],即[H +]=]OH [Kw-,再求其PH 值.(2)对于碱性溶液求pH 值,可先求出POH,即POH =-lg[OH -], ∵ 常温下[H +]·[OH -]=10-14,∴ -lg[H +]-lg[OH -]=14. ∴ pH =14-POH,这样计算pH 值较为简便.例1 0℃ Ca(OH)2溶解度为0.185g,假设饱和溶液ρ=1g/cm 3,水的离子积Kw =10-14,求此溶液pH 值.解 C 2)OH (Ca =100010074185.0=0.025 mol/L[OH -]=0.025×2=0.05 mol/LPOH =-lg0.05=2-lg5=2-0.7=1.3 pH =14-1.3=12.7.2. 弱酸、弱碱溶液的PH 值:利用电离度求出弱酸的[H +] 即[H +]=C α或弱碱的[OH -].即[OH -]=C α,再求其pH 值例2 25℃时,0.1mol/L 某弱酸电离度为1%,求此溶液的PH 值. 解 [H +]=C α=0.1×1%=10-3mol/L pH =-lg10-3=-(-3)=33. 强酸、强碱溶液稀释后的PH 值. (1)酸:以稀释后[H +]变化计算碱:以稀释后[OH -]变化计算,再求[H +].(2)强酸稀释10n 倍,pH 值增大n 个单位,强碱稀释10n 倍,pH 值减少n 个单位. (3)高度稀释以酸溶液为例:溶液中H +不仅来自酸的电离,还来自水的电离平衡.一般情况下,酸电离出的[H +]要比水电离出的[H +]大得多,水的电离可忽略不计.但是,当稀释的倍数很大,酸电离出的[H +]或碱电离出的[OH -]接近或小于水电离出的[H +]或[OH -]时,就应当考虑水的电离.由此得如下结论:酸:pH 值接近于7但小于7.碱:pH 值接近于7但大于7.例3 ① pH =13的NaOH 溶液稀释100倍后.pH =_____. 解 POH =-lg[OH -]稀释=-lg10-1·10-2=-lg10-3=3 pH =14-3=11 常见错误:pH =-lg[H +]稀释=-lg10-13·10-2=15分析 越稀释,碱溶液的pH 值越大,显然不合理.在强碱溶液中,[OH -]随稀释时体积的变化而变化是决定pH 值的主要因素.而[H +]是水电离产生,其电离平衡在稀释时发生移动.②将pH =5的盐酸溶液稀释1000倍后,溶液的pH 值接近但小于7. 见3③关于高度稀释问题的分析. 常见错误:[H +]=1×10-5·10-3=10-8mol/L pH =-lg10-8=8照此结果,酸溶液稀释成了碱溶液,不可能.例4 100 mol 水PH 值由7变为4,应加入0.1mol 盐酸多少ml?(精确至0.1)解析 本题实为盐酸的稀释,应有稀释前后盐酸中H +物质的量不变.(稀溶液ρ≈1g/cm 3).设:应加0.1mol 盐酸xml. 0.1x ·1=(100+x)·1·10-4x =0.1mL4. 两强酸稀溶液混合后及两强碱稀溶液混合后溶液的PH 值 ① 混合后总体积可近似看作两者体积之和.酸:先算出混合后溶液的[H +].再求PH 值. 碱:先算出混合后溶液的[OH -]② 混和前后酸溶液的H +物质的量不变 [H +]1V 1+[H +]2V 2=[H +]混合·(V 1+V 2) 混和前后碱溶液的OH -物质的量不变[OH -]1V 1+[OH -]2V 2=[OH -]混和·(V 1+V 2) 注意不可以:pH 1+pH 2=pH 3例5 计算下列混合溶液的PH 值① pH =2和pH =5的两盐酸等体积混合.② pH =8和pH =13的两氢氧化钠溶液等体积混合. 解① 设两溶液体积均为vL.[H +]混合=V2V 10V 1052⋅+⋅--=5×10-3mol/L.pH =-lg[H +]混合=-lg(5×10-3)=2.3解② pH =8的碱溶液中[OH -]=10-6mol/L.pH =13的碱溶液中[OH -]=10-1mol/L..[OH -]混合=V2V10V 1016⋅+⋅--=5×10-2mol/L.POH =-lg[OH -]混合=-lg(5×10-2)=1.3pH =14-POH =14-1.3=12.7 常见错误:[H +]混合=V2V10V 10138--+=21×10-8mol/L.pH =-lg(-21×10-8)=8.3. 再次提醒:两强碱溶液混合,应先计算[OH -]混合. 由例5得如下小结:若碱有剩余,应先计算剩余的[OH -],再求pH 值.例6 pH =1的盐酸50ml 和pH =13的NaOH 溶液49mL 混合后.求PH 值. 解 pH =1 [H +]=0.1mol/L,pH =13 [OH -]=0.1mol/L H + + OH - = H 2O50×0.1 49×0.1 酸过量 [H +]余=4950)4950(1.0+-=10-3mol/L.pH =3例7 pH =3的强酸与pH =12的强碱溶液混和后,溶液pH =10,则强酸与强碱溶液的体积比为______解 设酸、碱溶液体积各为x 、y,已知pH =10,碱过量.[OH -]余=10-4=yx y 10x 1032+⋅-⋅--10-2y -10-4y =10-3x +10-4x. y x= 434210101010------=33101.1109.9--⨯⨯9. =1四、典型例题例8 (1)有A 、B 两种溶液,PH 值各为1.8与4.8,则A 的[H +]是B 的[H +]的_______倍.解析BA ]H []H [++=8.48.11010--=103=1000(2)某温度下,纯水中的[H +]=2×10-7mol/l,则此时[OH -]=2×10-7mol/L.若温度不变, 滴入稀硫酸使[H +]=5×10-6mol/L, 则[OH -]=8×10-9mol/L, 由水电离出[H +]为8×10-9mol/L.该纯水的PH 值 < 7.(填>、<、=)解析纯水中 H 2O H + + OH - mol/L 2×10-7 2×10-7加酸后,水的电离平衡逆向移动,使[OH -]减小,可由Kw 、[H +]求出[OH -],此温度下Kw 值为2×10-7×2×10-7=4×10-14[OH -]=614105104--⨯⨯=8×10-9mol/L.由水电离出的[H +]=[OH -]=8×10-9mol/L 该温度下,pH =-lg2×10-7=7-lg2<7.例9 25℃时,等体积H 2SO 4溶液和NaOH 溶液混合后,溶液呈碱性.则混合前H 2SO 4溶液的pH 值和NaOH 溶液的pH 值之间应满足的关系是A. pH 酸+pH 碱>14B. pH 酸+pH 碱<13C. pH 酸+pH 碱=14D. pH 酸+pH 碱=13 解析 本题选项A.假定H 2SO 4与NaOH 恰好中和,溶液呈中性,设H 2SO 4溶液PH =x,NaOH 溶液PH =y.体积均为V,则酸溶液的[H +]=10-x mol/L,碱溶液的[OH -]=10-(14-y).[H +]酸·V =[OH -]碱·V 10-x =10-(14-y) -x =-14+y x +y =14.但溶液呈碱性,即pH 碱>y ∴ pH 酸+pH 碱>14.例10 某地酸雨经检测除H +和OH -外, 还有[Na +]=7×10-6、 [Cl -]=3.5×10-5、[NH 4+]=2.3×10-5、[SO 42-]=2.5×10-6(单位均mol/L).则该酸雨的PH 值是A. 3B. 4C. 5D. 6 解析 本题选项C.在电解质溶液中,阳离子所带正电荷总和一定等于阴离子所带负电荷总和.即电荷平衡原理,则有阳离子物质的量×阴离子的电荷数=阴离子物质的量×阴离子的电荷数.由题意,得 [Na +]+[NH 4+]+[H +]=[Cl -]+2[SO 42-]+[OH -]将题中数据代入 得 7×10-6+2.3×10-5+[H +]=3.5×10-5+2×2.5×10-6+[OH -] [H +]=1×10-5+[OH -]∵ 酸雨中,[OH -]<10-7mol/L,[OH -]忽略不计. ∴ [H +]=10-5mol/l. pH =5例11 氢氧化钠溶液和氨水的PH 值均为12,且体积相同.下列叙述正确的是 A. 温度升高10℃,两者的PH 值仍相等.B. 温度不变,分别加水稀释100倍,PH 值都变为10C. 各加入同浓度的盐酸,使酸碱恰好中和,两者消耗的盐酸体积相同.D. 分别加入足量的FeCl 3溶液,前者产生的沉淀比后者少. 解析 本题选项D. A. NaOH 是强电解质、NH 3·H 2O 是弱电解质,温度升高.NH 3·H 2O 电离度增大,其[OH -]=C α也增大,故氨水PH 值较大.B. 均加水稀释100倍,使[OH -]减小,但随着溶液变稀,NH 3·H 2O 电离度增大.故氨水PH 值虽减小,但大于10.C. NaOH 和NH 3·H 2O 与HCl 的中和能力是比较它们物质的量的大小.因为C OH NH 23⋅=α-]OH [,α<1.可知同PH 值、同体积的两种碱溶液中,NH 3·H 2O 物质的量大于NaOH 物质的量,故氨水消耗的盐酸体积大.D. 同C 项,由于NaOH 物质的量小于NH 3·H 2O 物质的量.所以NaOH 与FeCl 3生成的Fe(OH)3沉淀少.例12 某溶液中若滴入甲基橙变为黄色,若滴入石蕊显红色.若滴入酚酞不变色,求该溶液PH 值围.练习一、选择题(每小题有1至2个正确选项)1. 将pH=10和pH=13的两强碱溶液等体积混合,混合溶液的PH值是( )A. 10.3B. 11.5C. 12.7D. 13.32. 把99.5ml 0.2mol/L NaOH溶液加到100.5mL 0.1mol/L H2SO4溶液中,所得溶液pH值是( )A. 3B. 3.3C. 4D. 2.73. 将pH=3的某未知酸溶液稀释100倍,所得溶液的pH值( )A. 等于5B. 大于5C. 小于5D. 等于5或小于54. 将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中[H +]最接近于( )A. (10-8+10-10)/2 mol/LB. 2×10-10 mol/LC. (10-8+10-10) mol/LD. (1×10-14-5×10-5) mol/L5. 健康的人的血液pH值为7.35~7.45,患某种疾病的人血液的pH值可暂降至6.0,则此时血液中氢离子溶度为健康人的( )A. 1.35~1.45倍B. 101.35~101.45倍C. 106倍D. 100倍6. 下列溶液中酸性最强的是( )=10-141(V)的关系是( )+]的( )D. 1010倍2溶液混合,再加水稀释至1升,取10mL滴入甲基橙试剂,溶液所呈的颜色是( )A. 蓝色B. 红色C. 橙色D. 黄色10.重水(D2O)在某温度时的离子积常数Kw=1.6×10-15,下列有关POD(即-lg[D+])叙述正确的是( )A. 该温度下D2O的PD是7.0B. 该温度下1L D2O中溶解0.01mol NaOD时,PD是12C. 将50ml 0.2mol/l的NaOD重水溶液加到100ml 0.25mol/l DCl重水溶液中,反应后PD=1.0.D. 该温度下1升D2O中溶解0.01mol DCl时,PD=2.011.中和相同体积,相同pH值的H2SO4、HCl、CH3COOH三种稀溶液时,用去同种浓度的NaOH溶液的体积依次为V1、V2、V3,则V1、V2、V3的大小关系正确的是( )A. V1=V2=V3B. V1=V2<V3C. V1=V2>V3D. V1<V2<V312.有两瓶pH=2的酸溶液,一瓶是强酸、一瓶是弱酸,可用于鉴别的一组试剂是( )A. 石蕊试液和水B. 酚酞试液和水C. pH试纸和水D. 石蕊试液和酚酞试液13.向稀硫酸溶液中逐渐通入氨气,当溶液中[NH4+]=2[SO42-]时,溶液的pH值( )A. 大于7B. 小于7C. 等于7D. 无法判断14.下列四种溶液中,由水电离生成的氢离子浓度之比(①:②:③:④)是( )①pH=0的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH溶液④pH=11的NaOH溶液A. 1:10:100:1000B. 0:1:12:11C. 14:13:12:11D. 14:13:2:315.25℃时一某溶液中由水电离出的[H+]=1×10-12mol/L,向该溶液中滴入几滴甲基橙试液后,溶液的颜色可能变为( )A. 橙色B. 红色C. 蓝色D. 黄色16.在一定温度下,某酸溶液中水的电离度与某碱溶液中水的电离度相等.两者等体积混合后,溶液的pH值( )A. 大于7B. 小于7C. 等于7D. 无法确定17.pH值相同的醋酸和盐酸溶液,分别用蒸馏水稀释至原体积的m倍和n倍.稀释后两溶液的pH值仍相同.则m和n的关系是( )A. m=nB. m>nC. m<nD. 无法确定18.在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后呈中性,则混合之前,该强酸的pH值x与强碱的pH值y之间应满足的关系是( )A. x+y=14B. x+y=15C. x+y=10-14D. x+y=13二、计算19.有硫酸和盐酸的混合液20毫升,在这溶液中加入0.025摩/升的Ba(OH)2溶液时,生成硫酸钡的量和溶液的pH值得到如图所示结果,问:(1)最初混合溶液中硫酸和盐酸的摩尔浓度各为多少?(2)在A点溶液的pH值是多少?(3)在B点溶液的pH值是多少?答案与提示一、1. C 2. A 3. D 4. B 5. B 6. B 7. B 8. D 9. C10.CD 11.B 12.C 13.C 14.A 15.BD 16.D 17.B18.B二、19.(1)C 42SO H =0.025mol/l C HCl =0.1mol/l(2)1.3 (3)1.8[提示]一、13.本题中(NH 4)2SO 4发生了水解,但据题意只需从电荷平衡出发∵ [NH 4+]+[H +]=2[SO 42-]+[OH -] 又知 [NH 4+]=2[SO 42-]∴ [H +]=[OH -] 也就是PH =715.水电离的[H +]=10-12mol/L,溶液可能为酸式碱.酸[H +]=10-2mol/L,使甲基橙试液变红色,碱[OH -]=10-2mol/L,使甲基橙试液变黄色.二、19.解 (1)加Ba(OH)2 20ml 时,H 2SO 4与Ba(OH)2恰好完全反应 0.025×20=C 42SO H ·20.C 42SO H =0.025mol/l当加入Ba(OH)2 60ml 时,H +与OH -恰好中和.20×0.025×2+20·C HCl =0.025×60×2.C HCl =0.1mol/l(2)A 点:加Ba(OH)2 20ml,此时酸过量,且恰好Ba(OH)2+H 2SO 4=BaSO 4↓+2H 2O,溶液中只有HCl.[H +]=2020201.0+⨯=0.05. PH =1.3 B 点加Ba(OH)2 40ml.H +过量.可看作Ba(OH)2 20ml 已与H 2SO 4反应,另20ml 与HCl 反应.[H +]=40202025.0)2040(1.020+⨯⨯--⨯=601,PH =-lg 601≈1.8.。
高二化学《水的电离》知识点汇总

高二化学《水的电离》知识点汇总高二化学《水的电离》知识点汇总一、水的离子积纯水大部分以H2的分子形式存在,但其中也存在极少量的H3+(简写成H+)和H-,这种事实表明水是一种极弱的电解质。
水的电离平衡也属于化学平衡的一种,有自己的化学平衡常数。
水的电离平衡常数是水或稀溶液中氢离子浓度和氢氧根离子浓度的乘积,一般称作水的离子积常数,记做。
只与温度有关,温度一定,则值一定。
温度越高,水的电离度越大,水的离子积越大。
对于纯水说,在任何温度下水仍然显中性,因此(H+)=(H&ar;),这是一个容易理解的知识点。
当然,这种情况也说明中性和溶液中氢离子的浓度并没有绝对关系,pH=7表明溶液为中性只适合于通常状况的环境。
此外,对于非中性溶液,溶液中的氢离子浓度和氢氧根离子浓度并不相等。
但是在由水电离产生的氢离子浓度和氢氧根浓度一定相等。
二、其它物质对水电离的影响水的电离不仅受温度影响,同时也受溶液酸碱性的强弱以及在水中溶解的不同电解质的影响。
H+和H&ar;共存,只是相对含量不同而已。
溶液的酸碱性越强,水的电离程度不一定越大。
无论是强酸、弱酸还是强碱、弱碱溶液,由于酸电离出的H+、碱电离出的H&ar;均能使H2<=>H&ar; + H+平衡向左移动,即抑制了水的电离,故水的电离程度将减小。
盐溶液中水的电离程度:①强酸强碱盐溶液中水的电离程度与纯水的电离程度相同;②NaHS4溶液与酸溶液相似,能抑制水的电离,故该溶液中水的电离程度比纯水的电离程度小;③强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐都能发生水解反应,将促进水的电离,故使水的电离程度增大。
三、水的电离度的计算计算水的电离度首先要区分由水电离产生的氢离子和溶液中氢离子的不同,由水电离的氢离子浓度和溶液中的氢离子浓度并不是相等,由于酸也能电离出氢离子,因此在酸溶液中溶液的氢离子浓度大于水电离的氢离子浓度;同时由于氢离子可以和弱酸根结合,因此在某些盐溶液中溶液的氢离子浓度小于水电离的氢离子浓度。
第二节第一课时水的电离

。
2.某温度下,测得纯水中的c(H+)=2×10-7 mol/L, 则c(OH-)为 ———— 水的离子积KW ———————— 若温度不变,滴入稀盐酸,使c(H+)=5×10-4 mol·L-1,则此时溶液中由水电离产生的c(H+)= ________
3.纯水在25℃和80℃时的氢离子浓度,前后两个量
(2)KW=c(H+)·c(OH-)不仅适用于中性溶液,也 同样适用于稀的酸溶液和稀的碱溶液。在任何时候、 在任何溶液中,都同时存在H+、OH-,其乘积也为 一常数。在不同的溶液中,c(H+)和c(OH-)虽然不一 定相等,但是由水电离出的c(H+)和c(OH-)却总是相 等的。
(3)KW=c(H+)·c(OH-)式中的c(H+)和c(OH-)指的 是溶液中的H+和OH-的总浓度,要弄清溶液中的c(H+) 和水电离出的c(H+),溶液中的c(OH-)和水电离出的 c(OH-)。一般来说,当溶液中的c(H+)或c(OH-)大于由 水电离出的H+或OH-溶液1000倍,水电离产生的H+或 OH-浓度即可忽略。
的大小关系为
()
A.大于
B.等于
C.小于
D.不能肯定
水的电离平衡:H2O
H++OH-
影响因素 移动方向 c(H+) c(OH-)
升温
向右移动 增大 增大
ΔH>0 KW 增大
加酸
向左移动 增大 减小 不变
加碱
向左移动 减小 增大 不变
加活泼金属 向右移动
(如Na)
Байду номын сангаас
减小
增大
不变
[例1] 25℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是
()
A.向水中加入稀氨水,平衡逆向移动,c(OH-) 降低
水的电离知识点范文

水的电离知识点范文水的电离是指水分子在溶液中发生离解的过程,产生氢离子(H+)和氢氧根离子(OH-)。
水的电离是化学反应中的重要概念,对于理解溶液的性质和酸碱中和反应具有重要意义。
以下是水的电离知识点。
1.水的电离方程式:水的电离方程式可以用如下的化学方程式表示:H2O→H++OH-在水的电离中,一个水分子会分解为一个氢离子和一个氢氧根离子。
2.氰根离子与硒化电离:水的电离产生的氢离子和氢氧根离子都是离子。
水的电离是一个弱电离反应,反应的平衡常数(Keq)远小于1,因此水在一般情况下几乎不会完全电离。
在纯水中,水的电离程度非常小。
3.离子积与离子积常数:离子积是指水的电离产生的氢离子和氢氧根离子浓度的乘积。
根据离子积定律,离子积恒为一个常量,即[H+][OH-]=Kw,其中Kw为离子积常数。
在纯水中,离子积常数Kw约等于1.0×10^-14、在酸碱溶液中,水的电离程度会受到其他物质的影响。
4.酸性溶液和碱性溶液:酸性溶液是指溶液中氢离子浓度高于氢氧根离子浓度的溶液。
酸性溶液具有酸味,并可导电。
碱性溶液是指溶液中氢离子浓度低于氢氧根离子浓度的溶液。
碱性溶液具有苦味,并可导电。
5.酸碱中和反应:酸碱中和反应是指酸和碱的化学反应,其中氢离子和氢氧根离子会结合生成水分子。
酸和碱的摩尔比必须满足反应平衡,并且满足反应物的摩尔数和生成物的摩尔数之间的化学计量关系。
6.pH和pOH:pH是一个表示溶液酸碱性的指标。
它是一个对数尺度,表示溶液中氢离子浓度的负对数。
pOH是一个与pH相似的指标,表示溶液中氢氧根离子浓度的负对数。
pH和pOH之和恒为147.酸碱指示剂:酸碱指示剂是一种可以通过颜色变化来判断溶液酸碱性的物质。
酸碱指示剂的颜色变化与溶液的pH值有关,可以根据指示剂颜色的变化来判断溶液的酸碱性。
8.酸碱滴定:酸碱滴定是一种实验方法,用于确定溶液的酸碱性。
实验中使用一种已知浓度的酸溶液或碱溶液(称为滴定液),将滴定液滴入待测溶液中,直到滴定液与待测溶液中的酸或碱完全中和,通过滴定液的消耗量和浓度的计算来确定待测溶液的酸碱性。
水的电离知识点
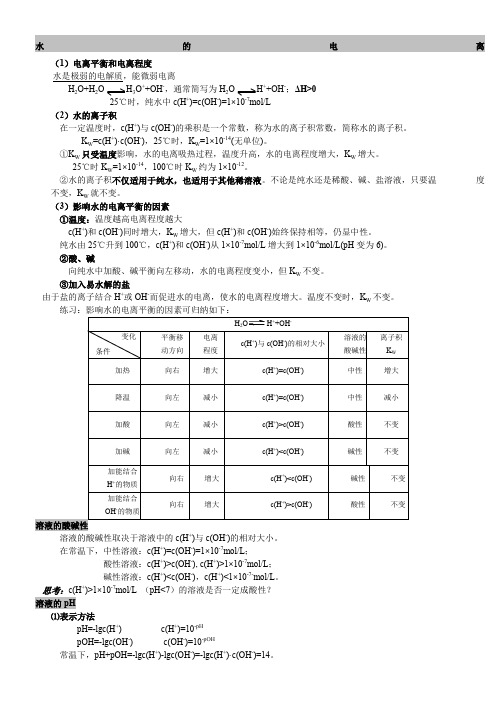
水的电离(1)电离平衡和电离程度水是极弱的电解质,能微弱电离H 2O+H 2O H 3O ++OH -,通常简写为H 2O H ++OH -;ΔH >025℃时,纯水中c(H +)=c(OH -)=1×10-7mol/L(2)水的离子积在一定温度时,c(H +)与c(OH -)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
K W =c(H +)·c(OH -),25℃时,K W =1×10-14(无单位)。
①K W 只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K W 增大。
25℃时K W =1×10-14,100℃时K W 约为1×10-12。
②水的离子积不仅适用于纯水,也适用于其他稀溶液。
不论是纯水还是稀酸、碱、盐溶液,只要温 度不变,K W 就不变。
(3)影响水的电离平衡的因素 ①温度:温度越高电离程度越大c(H +)和c(OH -)同时增大,K W 增大,但c(H +)和c(OH -)始终保持相等,仍显中性。
纯水由25℃升到100℃,c(H +)和c(OH -)从1×10-7mol/L 增大到1×10-6mol/L(pH 变为6)。
②酸、碱向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K W 不变。
③加入易水解的盐由于盐的离子结合H +或OH -而促进水的电离,使水的电离程度增大。
温度不变时,K W 不变。
溶液的酸碱性取决于溶液中的c(H )与c(OH )的相对大小。
在常温下,中性溶液:c(H +)=c(OH -)=1×10-7mol/L ;酸性溶液:c(H +)>c(OH -), c(H +)>1×10-7mol/L ; 碱性溶液:c(H +)<c(OH -),c(H +)<1×10-7-mol/L 。
思考:c(H +)>1×10-7mol/L (pH<7)的溶液是否一定成酸性? 溶液的pH⑴表示方法pH=-lgc(H +) c(H +)=10-pH pOH=-lgc(OH -) c(OH -)=10-pOH常温下,pH+pOH=-lgc(H +)-lgc(OH -)=-lgc(H +)·c(OH -)=14。
水的电离知识点

水的电离知识点1. 什么是电离?电离是指在特定条件下,原子、分子或离子从中心原子中失去或获得一个或多个电子的过程。
在水的情况下,电离是指水分子(H2O)中的氢原子失去电子成为氢离子(H+),同时水分子中的氧原子获得电子成为氢氧根离子(OH-)的过程。
2. 水的电离方程式水的电离过程可以通过以下方程式表示:H2O ⇌ H+ + OH- 在平衡状态下,水分子存在着动态的电离和复合过程。
3. 水的离子化程度水的电离程度可以通过离子积(Kw)来衡量。
离子积是水中氢离子和氢氧根离子的浓度乘积,即: Kw = [H+][OH-] 在纯净水中,离子积的值约为10^-14。
由于水的电离是自发的,所以氢离子和氢氧根离子的浓度相等。
4. pH值和pOH值pH值是用来表示溶液酸碱性强弱的指标,pH值越低表示酸性越强,pH值越高表示碱性越强。
pH值的计算公式为: pH = -log[H+] 同样地,pOH值是用来表示溶液酸碱性强弱的指标,pOH值越低表示碱性越强,pOH值越高表示酸性越强。
pOH值的计算公式为: pOH = -log[OH-] pH值和pOH值的和等于14,即: pH + pOH = 145. 酸性溶液和碱性溶液根据pH值的范围,可以将溶液分为酸性溶液、中性溶液和碱性溶液。
pH值小于7的溶液被称为酸性溶液,pH值等于7的溶液被称为中性溶液,pH值大于7的溶液被称为碱性溶液。
6. 水的自离解常数水的自离解常数(Kw)表示了水的电离程度,其定义如下: Kw = [H+][OH-]在25摄氏度下,纯净水的Kw值约为10^-14。
离子积Kw的值越大,水的电离程度越高,溶液越碱性;Kw的值越小,水的电离程度越低,溶液越酸性。
在常温下,水的离子积保持恒定,即[H+][OH-] = 10^-14。
7. 水的电离对生命的重要性水的电离过程对生命起着重要的作用。
在生物体内,许多化学反应都发生在水中。
水的电离产生的氢离子和氢氧根离子在维持生物体酸碱平衡、调节细胞内外pH值以及参与代谢反应等方面发挥着重要的作用。
水的电离

? 竹子的好处,周作人写过文章,都细细谈到。那一株株长在知堂文章里的竹子想必是杆杆细瘦,瘦竹才见风致,碗口粗的大竹怎么可以入画?三十年前的一幅《毛竹丰收》画得就是碗口粗的大毛竹,现
在看来是太少了一些传统笔墨的风韵,而多了一些时代的豪壮之气在里边。郑板桥的竹子根根细瘦,正是文人的风骨。竹子的好处真是太多,从桌椅板凳到桥梁竹楼。说到吃,没有什么菜蔬可以替代竹笋。清炒竹笋不可加老抽,要的就是那细净的白爽,看相就好。夏天纳凉最好是湘妃竹榻,
找出了“梅花香自苦寒来”。竹子来得复杂了一些,一是让人想到气节,因为它的有节,二是让人想到虚心,因为它的中空。所以把它给安排到了四君子的行列里去。但老百姓才不管什么君子不君子,那是文人们的事,老百姓眼里的竹子只是好用,一是做人人吃饭必用的筷子,二是做老人们
的拐杖,三是做床,四是做挑物的担,五是做水桶,不能再一二三四地数了,竹的用处几乎是无穷的,从穿到吃,比如竹鞋,比如竹衫,比如雨帽,竹笋之好吃就更不用说。竹子可以说是最完美的植物,松树可以盖房子做家具,但就是不能用来大吃特吃,虽然松籽是可以吃的,的松仁小肚就
③不论是在中性溶液还是在酸碱性溶液,水 电离出的C(H+)=C(OH-)
④根据Kw=C(H+)×C(OH-) 在特定温度下为 定值,C(H+) 和C(OH-) 可以互求.
练习 ⑴﹑0.1mol/L的盐酸溶液中水电离出的C(H+ ) 和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L = C(H+ )
道它的眼睛在想说什么?我想它现在应该还在井下,做着拉煤的工作,拉着铁架子车,摸着黑,努力上着坡,出着淋漓的大汗,几乎终日见不到太阳,肚子一起一伏,一起一伏,一起一伏,一起一伏…… 可怜的骡子。 乡下的年 ? 怎么说呢?我去乡下过年,并不是想在那地方写什么东西,
水的电离知识点总结

水的电离知识点总结1. 水的电离的定义水的电离是指水分子在溶液中发生电离现象,形成氢离子(H+)和氢氧根离子(OH-)的过程。
在纯净水中,极少部分的水分子会自发地发生电离,形成氢离子和氢氧根离子。
这种自发的电离过程被称为自离解反应,其反应式可以表示为:2H2O ⇌ H3O+ + OH-。
2. 离子积和离子积常数在水的电离过程中,氢离子和氢氧根离子的浓度并不是固定不变的,而是随着时间的推移而变化。
为了描述溶液中离子浓度的变化规律,引入了离子积的概念。
离子积(ionic product)是指在溶液中氢离子和氢氧根离子的浓度之积的结果。
离子积的数值越大,表明水的电离程度越高。
离子积的数值可以用数学表达式表示,即离子积常数(Kw)。
离子积常数Kw由氢离子和氢氧根离子的浓度决定,其表达式为:Kw=[H+][OH-],其中[H+]表示溶液中氢离子的浓度,[OH-]表示溶液中氢氧根离子的浓度。
在25摄氏度下,纯水的离子积常数Kw的数值等于1.0×10^-14。
3. pH值和pOH值pH值是用来表达溶液酸碱性的指标,它表示溶液中氢离子浓度的负对数。
pH的数值越小,表示溶液中酸性越强。
pH的数值可以用数学表达式表示,即pH=-log[H+],其中[H+]表示溶液中氢离子的浓度。
与pH值相似,pOH值也是用来表达溶液酸碱性的指标,它表示溶液中氢氧根离子浓度的负对数。
pOH的数值越小,表示溶液中碱性越强。
pOH的数值可以用数学表达式表示,即pOH=-log[OH-],其中[OH-]表示溶液中氢氧根离子的浓度。
在水的电离过程中,pH值和pOH值之和等于14,即pH + pOH = 14。
这个关系是因为在纯净水中,氢离子和氢氧根离子的浓度相等,所以pH值和pOH值之和等于14。
4. 酸碱中和在溶液中,如果存在酸性物质和碱性物质,那么它们会发生中和反应。
中和反应是指酸性物质和碱性物质中的氢离子和氢氧根离子相互结合,形成水分子的过程。
高二化学下册水的电离知识点总结

高二化学下册水的电离知识点总结一、水的离子积纯水大部分以H2O的分子情势存在,但其中也存在极少量的H3O+(简写成H+)和OH-,这种事实表明水是一种极弱的电解质。
水的电离安稳也属于化学安稳的一种,有自己的化学安稳常数。
水的电离安稳常数是水或稀溶液中氢离子浓度和氢氧根离子浓度的乘积,一样称作水的离子积常数,记做Kw。
Kw只与温度有关,温度一定,则Kw值一定。
温度越高,水的电离度越大,水的离子积越大。
对于纯水来说,在任何温度下水仍旧显中性,因此c(H+)=c(OH¯),这是一个容易知道的知识点。
当然,这种情形也说明中性和溶液中氢离子的浓度并没有绝对关系,pH=7表明溶液为中性只合适于通常状态的环境。
另外,对于非中性溶液,溶液中的氢离子浓度和氢氧根离子浓度并不相等。
但是在由水电离产生的氢离子浓度和氢氧根浓度一定相等。
二、其它物质对水电离的影响水的电离不仅受温度影响,同时也受溶液酸碱性的强弱以及在水中溶解的不同电解质的影响。
H+和OH¯共存,只是相对含量不同而已。
溶液的酸碱性越强,水的电离程度不一定越大。
不论是强酸、弱酸还是强碱、弱碱溶液,由于酸电离出的H+、碱电离出的OH¯均能使H2OOH¯ + H+安稳向左移动,即抑制了水的电离,故水的电离程度将减小。
盐溶液中水的电离程度:①强酸强碱盐溶液中水的电离程度与纯水的电离程度相同;②NaHSO4溶液与酸溶液类似,能抑制水的电离,故该溶液中水的电离程度比纯水的电离程度小;③强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐都能产生水解反应,将增进水的电离,故使水的电离程度增大。
三、水的电离度的运算运算水的电离度第一要区分由水电离产生的氢离子和溶液中氢离子的不同,由水电离的氢离子浓度和溶液中的氢离子浓度并不是相等,由于酸也能电离出氢离子,因此在酸溶液中溶液的氢离子浓度大于水电离的氢离子浓度;同时由于氢离子可以和弱酸根结合,因此在某些盐溶液中溶液的氢离子浓度小于水电离的氢离子浓度。
《水的电离》 知识清单

《水的电离》知识清单一、水的电离水是一种极弱的电解质,能发生微弱的电离。
水分子在液态时会发生自偶电离,即一个水分子将一个氢原子转移给另一个水分子,形成水合氢离子(H₃O⁺)和氢氧根离子(OH⁻),其电离方程式为:H₂O + H₂O ⇌ H₃O⁺+ OH⁻。
为了简化,通常写成:H₂O ⇌ H⁺+ OH⁻。
二、水的离子积常数在一定温度下,水的电离达到平衡时,氢离子和氢氧根离子浓度的乘积是一个常数,称为水的离子积常数,简称水的离子积,用符号Kₗₗ(w)表示。
实验测定,25℃时,纯水中 c(H⁺)= c(OH⁻)=10×10⁻⁷mol/L ,所以 Kₗₗ(w)= c(H⁺)·c(OH⁻)= 10×10⁻¹⁴。
需要注意的是,水的离子积常数只随温度的变化而变化,温度升高,水的离子积常数增大。
例如,100℃时,Kₗₗ(w)= 10×10⁻¹²。
三、影响水的电离平衡的因素1、温度升高温度,水的电离平衡向右移动,电离程度增大,氢离子和氢氧根离子浓度同时增大,但仍然相等,水的离子积常数增大;降低温度,水的电离平衡向左移动,电离程度减小,氢离子和氢氧根离子浓度同时减小,水的离子积常数减小。
2、酸或碱向水中加入酸,氢离子浓度增大,水的电离平衡向左移动,抑制水的电离;向水中加入碱,氢氧根离子浓度增大,水的电离平衡向左移动,抑制水的电离。
3、盐(1)强酸强碱盐强酸强碱盐在溶液中不会发生水解,对水的电离平衡没有影响。
(2)强酸弱碱盐强酸弱碱盐中的弱碱阳离子在水溶液中会与水电离出的氢氧根离子结合,生成弱碱,从而促进水的电离,使溶液呈酸性。
(3)强碱弱酸盐强碱弱酸盐中的弱酸根离子在水溶液中会与水电离出的氢离子结合,生成弱酸,从而促进水的电离,使溶液呈碱性。
(4)弱酸弱碱盐弱酸弱碱盐中的弱酸根离子和弱碱阳离子都会发生水解,水解程度的大小与弱酸和弱碱的相对强弱有关,可能相互促进,也可能相互抑制。
水的电离与水的离子积常数.docx
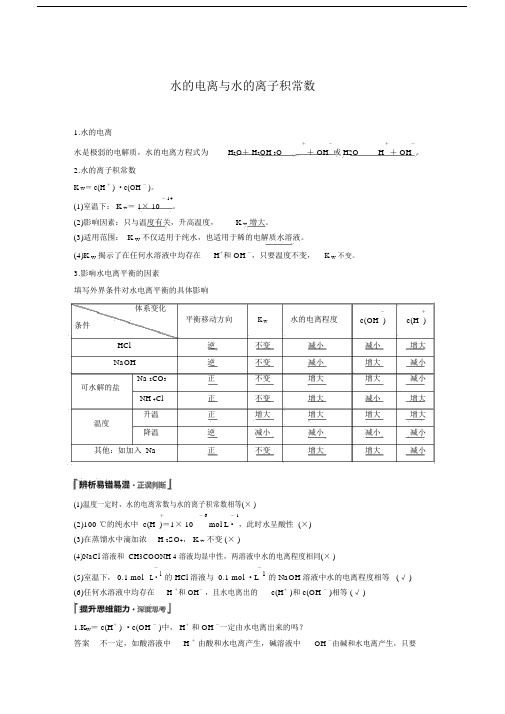
水的电离与水的离子积常数1.水的电离水是极弱的电解质,水的电离方程式为+-或 H2O+-。
H2O+ H2OH 3O+ OH H+ OH2.水的离子积常数K w= c(H + ) ·c(OH - )。
(1)室温下: K w= 1× 10- 14。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围: K w不仅适用于纯水,也适用于稀的电解质水溶液。
(4)K w揭示了在任何水溶液中均存在H+和 OH -,只要温度不变,K w不变。
3.影响水电离平衡的因素填写外界条件对水电离平衡的具体影响体系变化平衡移动方向K w-+水的电离程度条件c(OH )c(H ) HCl逆不变减小减小增大NaOH逆不变减小增大减小Na 2CO3正不变增大增大减小可水解的盐NH 4Cl正不变增大减小增大升温正增大增大增大增大温度降温逆减小减小减小减小其他:如加入 Na正不变增大增大减小(1)温度一定时,水的电离常数与水的离子积常数相等(× )+- 6- 1(2)100 ℃的纯水中 c(H )=1× 10mol L·,此时水呈酸性 (×)(3)在蒸馏水中滴加浓H 2SO4, K w不变 (× )(4)NaCl 溶液和 CH3COONH 4溶液均显中性,两溶液中水的电离程度相同(× )(5)室温下, 0.1 mol--1的 NaOH 溶液中水的电离程度相等 (√ ) L·1的 HCl 溶液与 0.1 mol ·L(6)任何水溶液中均存在H +和 OH-,且水电离出的c(H+ )和 c(OH - )相等 (√ )1.K w= c(H+ ) ·c(OH - )中, H+和 OH -一定由水电离出来的吗?答案不一定,如酸溶液中H +由酸和水电离产生,碱溶液中OH -由碱和水电离产生,只要是水溶液必定有H + 和 OH -,当溶液浓度不大时,总有K w = c(H +) ·c(OH -)2.25 ℃, pH = 3 的某溶液中, H 2O 电离出的 +浓度为多少?H答案 (1) 若为水解呈酸性的盐溶液,促进水的电离,由水电离出的c +- 3- 1水 (H)= 1× 10 mol L ·。
《水的电离》 讲义

《水的电离》讲义一、水的电离概述在我们日常生活中,水是最常见的物质之一。
然而,你是否知道,看似平静的水分子在微观世界里正发生着一种重要的变化——电离?水的电离是一个非常微妙但又极其关键的过程。
简单来说,水的电离就是水分子在一定条件下分解为氢离子(H⁺)和氢氧根离子(OH⁻)的过程。
这个过程虽然很微弱,但却对许多化学和生物过程有着深远的影响。
二、水的电离方程式水的电离可以用一个简单的方程式来表示:H₂O ⇌ H⁺+ OH⁻。
这里的“⇌”表示可逆反应,意味着这个电离过程是双向的。
在一定条件下,水分子会电离出氢离子和氢氧根离子,同时,氢离子和氢氧根离子也会重新结合成水分子。
需要注意的是,在纯水中,氢离子和氢氧根离子的浓度是相等的。
这是因为水的电离过程中,产生的氢离子和氢氧根离子的数量是相等的。
三、影响水的电离的因素(一)温度温度对水的电离有着显著的影响。
一般来说,温度升高,水的电离程度增大。
这是因为温度升高,分子的热运动加剧,更多的水分子能够获得足够的能量来克服电离所需的能量壁垒,从而使电离程度增加。
(二)酸和碱向水中加入酸或碱会抑制水的电离。
酸会提供大量的氢离子,使得水的电离平衡向左移动;碱会提供大量的氢氧根离子,同样使电离平衡向左移动。
(三)盐类某些盐类的加入也会对水的电离产生影响。
比如强酸弱碱盐会促进水的电离,因为弱碱阳离子在水中会结合氢氧根离子,从而使水的电离平衡向右移动;强碱弱酸盐则会抑制水的电离,因为弱酸根离子会结合氢离子。
四、水的离子积常数在一定温度下,水中氢离子浓度和氢氧根离子浓度的乘积是一个常数,称为水的离子积常数,用 Kw 表示。
例如,在室温(25℃)时,Kw = 10×10⁻¹⁴。
这个常数只与温度有关,温度升高,Kw 增大。
这也进一步说明了温度对水的电离的影响。
五、水的电离在实际中的应用(一)溶液的酸碱性判断通过测量溶液中氢离子和氢氧根离子的浓度,与水的离子积常数进行比较,可以判断溶液的酸碱性。
水的电离知识详解

水 的 电 离(一)水的电离1. 水是极弱的电解质.存在极弱的电离 H 2O +H 2O H 3O ++OH -简写为 H 2O H ++OH -25℃ 1 L H 2O181000 = 55.6(mol)中有10-7mol 发生电离 H 2O H ++ OH -起始(mol) 55.6 0 0电离(mol) 10-7 10-7 10-7平衡(mol)55.6-10-7 10-7 10-725℃.[H +]·[OH -]=10-7·10-7=10-14=Kw 称作水的离子积常数.2.温度升高,Kw 增大.水的电离为吸热过程,所以当温度升高时,水的电离度增大,Kw 也增大.例如100℃,1 L H 2O 有10-6mol 电离.此时水的离子积常数为 Kw =10-6·10-6=10-12.常温下,Kw =10-143. 在中性、酸性、碱性稀溶液中Kw 的讨论.凡是在水溶液中,都存在着水的电离平衡.H 2O H ++OH -, H +和OH -总是同时存在的.(1)中性溶液中,Kw =[H +]·[OH -]=10-7·10-7=10-14(2)酸性溶液中, 由于[H +]增大, 水的电离平衡逆向移动, [OH -]减小, 但Kw =[H +]· [OH -]=10-14.(3)碱性溶液中, 由于[OH -]增大, 水的电离平衡逆向移动.[H +]减小, 但Kw =[H +]· [OH -]=10-14.结论:常温下,[H +]·[OH -]=10-14=Kw,适于纯水,中性、酸性、碱性稀溶液.4. 根据Kw 计算溶液中的[H +]或[OH -]由于水电离出来的H +或OH -很少,所以在酸(或碱)溶液中,一般就以酸(或碱)的浓度计算出[H +]或([OH -]),然后根据Kw 再计算溶液中的[OH -](或[H +])(1)酸溶液:强酸 [H +] 弱酸 [H +]=C α (2)碱溶液强碱 [OH -] 弱碱 -]=C α(二)溶液的酸碱性和pH 值 1. 溶液的pH 值-lg[H +] = pH.完全电离 部分电离]H [Kw + =[OH -] 完全电离 部分电离 ]OH [Kw - =[H +] .[H +] = 10-pH2. 溶液的酸碱性与pH 值关系 (1)纯水和中性溶液 [H +] = 10-7mol/l.pH = -lg10-7 = -(-7)= 7 (2)酸性溶液 例如 0.01mol/l 盐酸 [H +] = 10-2mol/lpH = -lg10-2 = -(-2) = 2(3)碱性溶液 例如 0.01mol/l 烧碱溶液[OH -] = 10-2mol/l[H +] =2141010-- = 10-12mol/lpH = -lg10-12 =123.pH 值取值范围与[H +]对照关系 [H +]:100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14(1)pH <7 溶液酸性,pH =7 溶液中性,pH >7 溶液碱性.(2)pH 增大1,[H +]减小10倍,[OH -]增大10倍;pH 减小1,[H +]增大10倍,[OH -]减小10倍.(3)当[H +]>1,pH <0或[H +]<10-14,pH >14直接用物质的量浓度而不用PH 值表示.4. 溶液的酸、碱性、PH 值与离子积常数小结. (三)pH 值的计算1. 基本计算公式C: 一元酸(碱)的物质的量浓度 [H +]、[OH -]: 溶液中的H +浓度、OH -的浓度 α: 弱酸或弱碱的电离度强酸: C [H +] pHC [OH -] [H +] pH全部电离-lg[H +] 10-PH 全部电离]OH [Kw-αC溶液酸碱性 酸性增强 中性 碱性增强 强碱 弱酸C [H +] pH弱碱 C [OH -] [H +] pH(四)酸碱指示剂2. pH 试纸的使用把待测试液滴在pH 试纸上,试纸所显示的颜色与标准比色板(pH 值1~14)相比,确定溶液的pH 值.3. pH 计可精确测定溶液的pH 值三、重点、难点剖析有关pH 值及其计算是本节难点 (一)有关pH 值的问与答1. 为什么要引进pH 值概念?答:当[H +]很小时,用物质的量浓度表示溶液的酸碱性很不方便. 2. 什么是溶液的pH 值?答:采用[H +]的负对数表示溶液酸碱性的强弱,叫做溶液的pH 值.pH =-lg[H +] 3. 溶液的酸碱性与PH 值有什么关系?答:常温下纯水和中性溶液中[H +]=10-7mol/l,因此,当pH =7为中性;pH <7为酸性,pH 值越小,溶液酸性越强;pH >7为碱性,pH 值越大,溶液碱性越强.4. 是否对任意浓度的[H +]或[OH -]用pH 值表示溶液的酸碱性均方便? 答:pH 值一般是用来表示稀的酸性、碱性和中性溶液的酸碱性的.当pH 值小于0时,一般直接用H +物质的量浓度表示酸性强弱较为方便;当pH 值大于14时,一般直接用OH -物质的量浓度表示其碱性强弱较为方便.5. pH 值小于7,溶液一定为酸性吗?答:由于水的电离受到温度的影响,故不能简单地认为pH <7时,溶液一定是酸性.例如100℃时,Kw =10-12,pH =6为中性.则pH <6才是酸性.若不注明温度,一般认为是常温(25℃)就以pH <6溶液为酸性.6. 用试纸检验气体的酸碱性必须先将试纸湿润,那么检验溶液的pH 值是否也须将PH 试纸湿润呢?答:用pH 试纸来测定溶液的pH 值是定量测定其酸碱度.可用洁净的干玻璃棒直接蘸取少许待测液,滴在pH 试纸上,将试纸显示的颜色随即与标准比色板对照.部分电离 部分电离 αC]OH [Kw- α+]H [ α-]OH [注意不能将试纸先用水湿润或用湿玻璃棒,这样相当于将溶液稀释了,导致测定的pH 值不准确.(二)有关pH 值的计算1. 强碱、强碱溶液的pH 值:(1)酸:先求出[H +],pH =-lg[H +]碱:必先求出[OH -],再利用Kw 求出[H +],即[H +]=]OH [Kw -,再求其PH 值. (2)对于碱性溶液求pH 值,可先求出POH,即POH =-lg[OH -],∵ 常温下[H +]·[OH -]=10-14,∴ -lg[H +]-lg[OH -]=14. ∴ pH =14-POH,这样计算pH 值较为简便.例1 0℃ Ca(OH)2溶解度为0.185g,假设饱和溶液ρ=1g/cm 3,水的离子积Kw =10-14,求此溶液pH 值.解 C 2)OH (Ca =100074185.0=0.025 mol/L[OH -]=0.025×2=0.05 mol/LPOH =-lg0.05=2-lg5=2-0.7=1.3 pH =14-1.3=12.7.2. 弱酸、弱碱溶液的PH 值:利用电离度求出弱酸的[H +] 即[H +]=C α或弱碱的[OH -].即[OH -]=C α,再求其pH 值例2 25℃时,0.1mol/L 某弱酸电离度为1%,求此溶液的PH 值.解 [H +]=C α=0.1×1%=10-3mol/LpH =-lg10-3=-(-3)=33. 强酸、强碱溶液稀释后的PH 值.(1)酸:以稀释后[H +]变化计算碱:以稀释后[OH -]变化计算,再求[H +].(2)强酸稀释10n 倍,pH 值增大n 个单位,强碱稀释10n 倍,pH 值减少n 个单位. (3)高度稀释以酸溶液为例:溶液中H +不仅来自酸的电离,还来自水的电离平衡.一般情况下,酸电离出的[H +]要比水电离出的[H +]大得多,水的电离可忽略不计.但是,当稀释的倍数很大,酸电离出的[H +]或碱电离出的[OH -]接近或小于水电离出的[H +]或[OH -]时,就应当考虑水的电离.由此得如下结论:酸:pH 值接近于7但小于7. 碱:pH 值接近于7但大于7.例3 ① pH =13的NaOH 溶液稀释100倍后.pH =_____.解 POH =-lg[OH -]稀释=-lg10-1·10-2=-lg10-3=3 pH =14-3=11常见错误:pH =-lg[H +]稀释=-lg10-13·10-2=15分析 越稀释,碱溶液的pH 值越大,显然不合理.在强碱溶液中,[OH -]随稀释时体积的变化而变化是决定pH 值的主要因素.而[H +]是水电离产生,其电离平衡在稀释时发生移动.②将pH =5的盐酸溶液稀释1000倍后,溶液的pH 值接近但小于7. 见3③关于高度稀释问题的分析. 常见错误: [H +]=1×10-5·10-3=10-8mol/LpH =-lg10-8=8照此结果,酸溶液稀释成了碱溶液,不可能.例4 100 mol 水PH 值由7变为4,应加入0.1mol 盐酸多少ml?(精确至0.1)解析 本题实为盐酸的稀释,应有稀释前后盐酸中H +物质的量不变.(稀溶液ρ≈1g/cm 3).设:应加0.1mol 盐酸xml.0.1x ·1=(100+x)·1·10-4x =0.1mL4. 两强酸稀溶液混合后及两强碱稀溶液混合后溶液的PH 值 ① 混合后总体积可近似看作两者体积之和.酸:先算出混合后溶液的[H +].再求PH 值.碱:先算出混合后溶液的[OH -]② 混和前后酸溶液的H +物质的量不变 [H +]1V 1+[H +]2V 2=[H +]混合·(V 1+V 2)混和前后碱溶液的OH -物质的量不变[OH -]1V 1+[OH -]2V 2=[OH -]混和·(V 1+V 2) 注意不可以:pH 1+pH 2=pH 3例5 计算下列混合溶液的PH 值① pH =2和pH =5的两盐酸等体积混合.② pH =8和pH =13的两氢氧化钠溶液等体积混合. 解① 设两溶液体积均为vL.[H +]混合=V 2V 10V 1052⋅+⋅--=5×10-3mol/L.pH =-lg[H +]混合=-lg(5×10-3)=2.3解② pH =8的碱溶液中[OH -]=10-6mol/L.pH =13的碱溶液中[OH -]=10-1mol/L.[OH -]混合=V 2V 10V 1016⋅+⋅--=5×10-2mol/L.POH =-lg[OH -]混合=-lg(5×10-2)=1.3pH =14-POH =14-1.3=12.7 常见错误:[H +]混合=V2V 10V 10138--+=21×10-8mol/L..pH =-lg(-21×10-8)=8.3. 再次提醒:两强碱溶液混合,应先计算[OH -]混合. 由例5得如下小结:若碱有剩余,应先计算剩余的[OH -],再求pH 值.例6 pH =1的盐酸50ml 和pH =13的NaOH 溶液49mL 混合后.求PH 值.解 pH =1 [H +]=0.1mol/L,pH =13 [OH -]=0.1mol/LH + + OH -= H 2O50×0.1 49×0.1 酸过量 [H +]余=4950)4950(1.0+-=10-3mol/L.pH =3例7 pH =3的强酸与pH =12的强碱溶液混和后,溶液pH =10,则强酸与强碱溶液的体积比为______解 设酸、碱溶液体积各为x 、y,已知pH =10,碱过量.[OH -]余=10-4=yx y10x 1032+⋅-⋅--10-2y -10-4y =10-3x +10-4x.y x= 434210101010------= 33101.1109.9--⨯⨯=19.四、典型例题例8 (1)有A 、B 两种溶液,PH 值各为1.8与4.8,则A 的[H +]是B 的[H +]的_______倍.解析BA ]H []H [++=8.48.11010--=103=1000(2)某温度下,纯水中的[H +]=2×10-7mol/l,则此时[OH -]=2×10-7mol/L.若温度不变, 滴入稀硫酸使[H +]=5×10-6mol/L, 则[OH -]=8×10-9mol/L, 由水电离出[H +]为8×10-9mol/L.该纯水的PH 值 < 7.(填>、<、=)解析纯水中 H 2O H + + OH -mol/L 2×10-7 2×10-7加酸后,水的电离平衡逆向移动,使[OH -]减小,可由Kw 、[H +]求出[OH -],此温度下Kw 值为2×10-7×2×10-7=4×10-14[OH -]=614105104--⨯⨯=8×10-9mol/L.由水电离出的[H +]=[OH -]=8×10-9mol/L该温度下,pH =-lg2×10-7=7-lg2<7.例9 25℃时,等体积H 2SO 4溶液和NaOH 溶液混合后,溶液呈碱性.则混合前H 2SO 4溶液的pH 值和NaOH 溶液的pH 值之间应满足的关系是A. pH 酸+pH 碱>14B. pH 酸+pH 碱<13C. pH 酸+pH 碱=14D. pH 酸+pH 碱=13 解析 本题选项A.假定H 2SO 4与NaOH 恰好中和,溶液呈中性,设H 2SO 4溶液PH =x,NaOH 溶液PH =y.体积均为V,则酸溶液的[H +]=10-x mol/L,碱溶液的[OH -]=10-(14-y).[H +]酸·V =[OH -]碱·V 10-x =10-(14-y) -x =-14+y x +y =14.但溶液呈碱性,即pH 碱>y ∴ pH 酸+pH 碱>14.例10 某地酸雨经检测除H +和OH -外, 还有[Na +]=7×10-6、 [Cl -]=3.5×10-5、[NH 4+]=2.3×10-5、[SO 42-]=2.5×10-6(单位均mol/L).则该酸雨的PH 值是 A. 3 B. 4 C. 5 D. 6 解析 本题选项C.在电解质溶液中,阳离子所带正电荷总和一定等于阴离子所带负电荷总和.即电荷平衡原理,则有阳离子物质的量×阴离子的电荷数=阴离子物质的量×阴离子的电荷数.由题意,得 [Na +]+[NH 4+]+[H +]=[Cl -]+2[SO 42-]+[OH -]将题中数据代入 得7×10-6+2.3×10-5+[H +]=3.5×10-5+2×2.5×10-6+[OH -] [H +]=1×10-5+[OH -]∵ 酸雨中,[OH -]<10-7mol/L,[OH -]忽略不计.∴ [H +]=10-5mol/l. pH =5例11 氢氧化钠溶液和氨水的PH 值均为12,且体积相同.下列叙述正确的是 A. 温度升高10℃,两者的PH 值仍相等.B. 温度不变,分别加水稀释100倍,PH 值都变为10C. 各加入同浓度的盐酸,使酸碱恰好中和,两者消耗的盐酸体积相同.D. 分别加入足量的FeCl 3溶液,前者产生的沉淀比后者少. 解析 本题选项D.A. NaOH 是强电解质、NH 3·H 2O 是弱电解质,温度升高.NH 3·H 2O 电离度增大,其[OH -]=C α也增大,故氨水PH 值较大.B. 均加水稀释100倍,使[OH -]减小,但随着溶液变稀,NH 3·H 2O 电离度增大.故氨水PH 值虽减小,但大于10.C. NaOH 和NH 3·H 2O 与HCl 的中和能力是比较它们物质的量的大小.因为C O H NH 23⋅=α-]OH [,α<1.可知同PH 值、同体积的两种碱溶液中,NH 3·H 2O 物质的量大于NaOH 物质的量,故氨水消耗的盐酸体积大.D. 同C 项,由于NaOH 物质的量小于NH 3·H 2O 物质的量.所以NaOH 与FeCl 3生成的Fe(OH)3沉淀少.例12 某溶液中若滴入甲基橙变为黄色,若滴入石蕊显红色.若滴入酚酞不变色,求该溶液PH 值范围.练习一、选择题(每小题有1至2个正确选项)1. 将pH=10和pH=13的两强碱溶液等体积混合,混合溶液的PH值是( )A. 10.3B. 11.5C. 12.7D. 13.32. 把99.5ml 0.2mol/L NaOH溶液加到100.5mL 0.1mol/L H2SO4溶液中,所得溶液pH值是( )A. 3B. 3.3C. 4D. 2.73. 将pH=3的某未知酸溶液稀释100倍,所得溶液的pH值( )A. 等于5B. 大于5C. 小于5D. 等于5或小于54. 将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中[H+]最接近于( )A. (10-8+10-10)/2 mol/LB. 2×10-10 mol/LC. (10-8+10-10) mol/LD. (1×10-14-5×10-5) mol/L5. 健康的人的血液pH值为7.35~7.45,患某种疾病的人血液的pH值可暂降至6.0,则此时血液中氢离子溶度为健康人的( )A. 1.35~1.45倍B. 101.35~101.45倍C. 106倍D. 100倍6. 下列溶液中酸性最强的是( )-14(V)的关系是( )的( )D. 1010倍9. 将10mL 0.21mol/L盐酸和10mL 0.10mol/L Ba(OH)2溶液混合,再加水稀释至1升,取10mL滴入甲基橙试剂,溶液所呈的颜色是( )A. 蓝色B. 红色C. 橙色D. 黄色10.重水(D2O)在某温度时的离子积常数Kw=1.6×10-15,下列有关POD(即-lg[D+])叙述正确的是( )A. 该温度下D2O的PD是7.0B. 该温度下1L D2O中溶解0.01mol NaOD时,PD是12C. 将50ml 0.2mol/l的NaOD重水溶液加到100ml 0.25mol/l DCl重水溶液中,反应后PD=1.0.D. 该温度下1升D2O中溶解0.01mol DCl时,PD=2.011.中和相同体积,相同pH值的H2SO4、HCl、CH3COOH三种稀溶液时,用去同种浓度的NaOH溶液的体积依次为V1、V2、V3,则V1、V2、V3的大小关系正确的是( )A. V1=V2=V3B. V1=V2<V3C. V1=V2>V3D. V1<V2<V312.有两瓶pH=2的酸溶液,一瓶是强酸、一瓶是弱酸,可用于鉴别的一组试剂是( )A. 石蕊试液和水B. 酚酞试液和水C. pH试纸和水D. 石蕊试液和酚酞试液13.向稀硫酸溶液中逐渐通入氨气,当溶液中[NH4+]=2[SO42-]时,溶液的pH值( )A. 大于7B. 小于7C. 等于7D. 无法判断14.下列四种溶液中,由水电离生成的氢离子浓度之比(①:②:③:④)是( )①pH=0的盐酸②0.1mol/L的盐酸③0.01mol/L的NaOH溶液④pH=11的NaOH溶液A. 1:10:100:1000B. 0:1:12:11C. 14:13:12:11D. 14:13:2:315.25℃时一某溶液中由水电离出的[H+]=1×10-12mol/L,向该溶液中滴入几滴甲基橙试液后,溶液的颜色可能变为( )A. 橙色B. 红色C. 蓝色D. 黄色16.在一定温度下,某酸溶液中水的电离度与某碱溶液中水的电离度相等.两者等体积混合后,溶液的pH值( )A. 大于7B. 小于7C. 等于7D. 无法确定17.pH值相同的醋酸和盐酸溶液,分别用蒸馏水稀释至原体积的m倍和n倍.稀释后两溶液的pH值仍相同.则m和n的关系是( )A. m=nB. m>nC. m<nD. 无法确定18.在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后呈中性,则混合之前,该强酸的pH值x与强碱的pH值y之间应满足的关系是( )A. x+y=14B. x+y=15C. x+y=10-14D. x+y=13二、计算19.有硫酸和盐酸的混合液20毫升,在这溶液中加入0.025摩/升的Ba(OH)2溶液时,生成硫酸钡的量和溶液的pH值得到如图所示结果,问:(1)最初混合溶液中硫酸和盐酸的摩尔浓度各为多少?(2)在A点溶液的pH值是多少?(3)在B点溶液的pH值是多少?答案与提示一、1. C 2. A 3. D 4. B 5. B 6. B 7. B 8. D 9. C10.CD 11.B 12.C 13.C 14.A 15.BD 16.D 17.B 18.B 二、19.(1)C 42SO H =0.025mol/l C HCl =0.1mol/l(2)1.3 (3)1.8[提示]一、13.本题中(NH 4)2SO 4发生了水解,但据题意只需从电荷平衡出发∵ [NH 4+]+[H +]=2[SO 42-]+[OH -] 又知 [NH 4+]=2[SO 42-]∴ [H +]=[OH -] 也就是PH =715.水电离的[H +]=10-12mol/L,溶液可能为酸式碱.酸[H +]=10-2mol/L,使甲基橙试液变红色,碱[OH -]=10-2mol/L,使甲基橙试液变黄色.二、19.解 (1)加Ba(OH)2 20ml 时,H 2SO 4与Ba(OH)2恰好完全反应 0.025×20=C 42SO H ·20. C 42SO H =0.025mol/l当加入Ba(OH)2 60ml 时,H +与OH -恰好中和.20×0.025×2+20·C HCl =0.025×60×2. C HCl =0.1mol/l(2)A 点:加Ba(OH)2 20ml,此时酸过量,且恰好Ba(OH)2+H 2SO 4=BaSO 4↓+2H 2O,溶液中只有HCl.[H +]=2020201.0+⨯=0.05. PH =1.3 B 点加Ba(OH)2 40ml.H +过量.可看作Ba(OH)2 20ml 已与H 2SO 4反应,另20ml 与HCl 反应.[H +]=40202025.0)2040(1.020+⨯⨯--⨯=601,PH =-lg 601≈1.8.。
《水的电离》 讲义

《水的电离》讲义一、水的电离的基本概念水是一种极弱的电解质,能发生微弱的电离。
在纯水中,水分子会部分电离为氢离子(H⁺)和氢氧根离子(OH⁻)。
其电离方程式可以表示为:H₂O ⇌ H⁺+ OH⁻。
需要注意的是,这个电离过程是可逆的,并且在一定温度下会达到动态平衡。
二、水的电离平衡的影响因素1、温度温度对水的电离平衡有着显著的影响。
一般来说,温度升高会促进水的电离。
这是因为温度升高,分子的热运动加剧,更多的水分子具备了足够的能量来克服电离过程中的能量障碍,从而使电离程度增大。
例如,在常温(25℃)时,水的离子积常数 Kw = 10×10⁻¹⁴;而在 100℃时,Kw 约为 10×10⁻¹²。
2、酸和碱向水中加入酸或碱会抑制水的电离。
加入酸时,酸会电离出大量的 H⁺,使得溶液中的 H⁺浓度增大,平衡向左移动,从而抑制水的电离。
同理,加入碱时,碱会电离出大量的 OH⁻,使得溶液中的 OH⁻浓度增大,平衡同样向左移动,抑制水的电离。
3、盐某些盐类的加入也会影响水的电离平衡。
(1)强酸弱碱盐强酸弱碱盐中的阳离子能与水电离出的 OH⁻结合生成弱碱,从而使溶液中的 H⁺浓度大于 OH⁻浓度,促进水的电离。
(2)强碱弱酸盐强碱弱酸盐中的阴离子能与水电离出的 H⁺结合生成弱酸,从而使溶液中的 OH⁻浓度大于 H⁺浓度,促进水的电离。
(3)强酸强碱盐强酸强碱盐对水的电离平衡没有影响,因为它们电离出的阴阳离子均不会与水电离出的 H⁺或 OH⁻结合。
三、水的离子积常数(Kw)水的离子积常数 Kw 是指在一定温度下,溶液中 H⁺和 OH⁻浓度的乘积。
Kw = H⁺·OH⁻在 25℃时,Kw 的值约为 10×10⁻¹⁴。
需要明确的是,Kw 只与温度有关,温度改变,Kw 也会随之改变。
无论是在酸性、碱性还是中性溶液中,在一定温度下,Kw 始终是一个定值。
水的电离

讨论: 对常温下的纯水进行下列操作,完成下表:
酸碱性
水的电离平 衡移动方向
加 热 中性
→
C(H+)
C(OH-)
C(H+) 与C(OH-) 大小关系
↑↑
=
加HCl 酸性 ←
↑↓
>
加NaOH 碱性
ห้องสมุดไป่ตู้
←
↓↑
<
Kw变化
↑ 不变 不变
小结:
加入酸或碱都抑制水的电离
3、影响水电离的因素
(1)加入酸或碱,抑制水的电离, Kw不变;
(2)升高温度,电离过程是一个 吸热过程,促进水的电离,水 的离子积增大,在100℃时, KW=1×10-12。
新课的延伸: 1、C(H+)=1×10-7mol/L,溶液一定呈中性吗?
说明:溶液或纯水呈中性,是因为溶液中 C(H+)=C(OH-)
2、纯水中溶液C(H +)、C(OH-)浓度的计算方法:
C(H +)=C(OH-)= Kw
注意:
① 任何水溶液中H+和OH-总是同时存在的,只 是相对含量不同.
②常温下,任何稀的水溶液中 C(H+)×C(OH-)===1×10-14
③不论是在中性溶液还是在酸碱性溶液,水 电离出的C(H+)=C(OH-)
提问:根据前面所学知识,水的离子积会 受什么外界条件影响?
讨论:分析下表中的数据有何规律,并解释之
温
度
0℃
20℃
25℃
50℃
100℃
Kw 1.14×10-15 6.81×10-15
1×10-14
5.47×10-14
水的电离

C(H +)=C(OH-)= Kw
注意:
① 任何水溶液中H+和OH-总是同时存在的,只 是相对含量不同.
②常温下,任何稀的水溶液中 C(H+)×C(OH-)===1×10-14
③不论是在中性溶液还是在酸碱性溶液,水 电离出的C(H+)=C(OH-)
水的电离
一、水的电离 ⑴.水是一种极弱的电解质,能微弱的电离:
+
+
பைடு நூலகம்
25℃,纯水
H2O+H2O
H3O++OH-
( H2O
H++OH-)
C(H+)=C(OH-)=1×10-7mol/L
平衡常数:K 电离=
C(H+)×C(OH-)
C(H2O)
水的浓度为常数,所以 K W= C(H+)×C(OH-)
2、水的离子积 在一定温度时: C(H+)×C(OH-)=Kw,叫水的离子积 25℃时,Kw=1×10-14
3、影响水电离的因素
(1)加入酸或碱,抑制水的电离, Kw不变;
(2)升高温度,电离过程是一个 吸热过程,促进水的电离,水 的离子积增大,在100℃时, KW=1×10-12。
新课的延伸: 1、C(H+)=1×10-7mol/L,溶液一定呈中性吗?
说明:溶液或纯水呈中性,是因为溶液中 C(H+)=C(OH-)
提问:根据前面所学知识,水的离子积会 受什么外界条件影响?
讨论:分析下表中的数据有何规律,并解释之
温
度
0℃
20℃
25℃
50℃
100℃
Kw 1.14×10-15 6.81×10-15
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)电离平衡和电离程度
水是极弱的电解质,能微弱电离
H2O+H2O . H3θ++OH-,通常简写为H2O . H++OH-;ΔH>0
25C 时,纯水中c(H+)=c(OH-)=1 ×0-7mol∕L
(2)水的离子积
在一定温度时,C(H )与C(OH )的乘积是一个常数,称为水的离子积常数,简称水的离子积。
+ - -14
K W=C(H ) C(OH ), 25 C 时,K w=I ×10 (无单位)。
①K W只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K W增大。
25C时K w=1 ×10-14, IOO C时K W约为1×10-12°
②水的离子积不仅适用于纯水,也适用于其他稀溶液。
不论是纯水还是稀酸、碱、盐溶液,
只要温度不变,K W就不变。
(3)影响水的电离平衡的因素
①温度:温度越高电离程度越大
C(H+)和c(OH-)同时增大,K W增大,但C(H+)和C(OH-)始终保持相等,仍显中性。
纯水由25C升到100C, C(H+)和C(OH-)从1 ×10-7mol∕L 增大到1 ×10-6mol/L(PH 变为6)。
②酸、碱
向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K W不变。
③加入易水解的盐
由于盐的离子结合H+或OH-而促进水的电离,使水的电离程度增大。
温度不变时,K W不变。
溶液的酸碱性取决于溶液中的C(H+)与C(OH-)的相对大小。
在常温下,中性溶液:c(H+)=c(OH -)=1 ×0-7mol∕L ;
酸性溶液:c(H+)>c(OH -), C(H +)>1 ×0-7mol∕L ; 碱性溶液:c(H+)<c(OH -), C(H +)<1
思考:c(H+)>i ×07mol∕L(pH<7 )的溶液是否一定成酸性?
×0-7-mol∕L。
溶液的PH
⑴表示方法
+ + -PH
PH=-IgC(H ) C(H )=10 P
POH=-IgC(OH -) C(OH-)=10-POH
常温下,PH+pOH=-lgc(H +)-∣gc(OH -)=-Igc(H +) C(OH-)=14。
⑵溶液的酸碱性与PH的关系(常温时)
①中性溶液:c(H+)=c(OH -)=1 ×0-7mol L-1, pH=7。
②酸性溶液:C(H )>1 ×0- mol L- >c(OH -), pH<7 ,酸性越强,PH越小。
③碱性溶液:c(H+)<1 ×0-7mol L-1>c(OH-), pH>7 ,碱性越强,PH 越大。
思考:1、甲溶液的PH是乙溶液的2倍,则两者的C(H+)是什么关系?
2、pH<7的溶液是否一定成酸性?(注意:pH=0的溶液c(H+)=1mol∕L。
)
⑶PH的适用范围
c(H+)的大小范围为:1.0 ×0-14mol L-1<c(H +)<1mol L-1)即PH 范围通常是0~ 14) 当c(H+) ≥1mol -∙1或c(OH-) ≥1mol -1时,用物质的量浓度直接表示更方便。
⑷溶液PH的测定方法
①酸碱指示剂法:只能测出PH的范围,一般不能准
确测定PH。
②PH试纸法:粗略测定溶液的PH。
PH试纸的使用方法:取一小块PH试纸放在玻璃片(或表面皿)上,用洁净的玻璃
棒蘸取待测液滴在试纸的中部,随即(30s内)与标准比色卡比色对照,确定溶液的PH。
测定溶液PH时,PH试剂不能用蒸馏水润湿(否则相当于将溶液稀释,使非中性溶液的PH测定产生误差);不能将PH试纸伸入待测试液中,以免污染试剂。
标准比色卡的颜色按PH从小到大依次是:红(酸性),蓝(碱性)。
③PH计法:精确测定溶液PH。
4、有关PH的计算
基本原则:
一看常温,二看强弱(无强无弱,无法判断) ,三看浓度(PH Or C )
酸性先算C(H+),碱性先算C(OH—)
⑴单一溶液的PH计算
①由强酸强碱浓度求PH
②已知PH求强酸强碱浓度
⑵加水稀释计算
思考:c(H+)>i ×07mol∕L(pH<7 )的溶液是否一定成酸性?
①强酸pH=a ,加水稀释
②弱酸pH=a ,加水稀释
③强碱pH=b,加水稀释
④弱碱pH=b,加水稀释
⑤酸、碱溶液无限稀释时,PH只能约等于或接近于7,酸的PH不能大于7,碱的
PH不能小于7。
⑥对于浓度(或PH)相同的强酸和弱酸,稀释相同倍数,强酸的PH变化幅度大。
⑶酸碱混合计算
①两种强酸混合
c(H+)混=C(HlV1+c(H4)2V2
V i +V2
②两种强碱混合
C(QH^I V I C(QH^2 V2
V1+V2
若酸过量,则求出C(H+),再得出PH;
若碱适量,则先求C(QH-),再由K W得出C(H+),进而求得PH,或由C(OH-)得出PQH 再得PH。
(二)溶液酸碱性PH计算经验规律
(1)两强酸等体积混合混合后的PH=小的+0.3
(2)两强碱等体积混合混合后的PH=大的一0.3
(3)当按所给反应物质的量之比计算时,酸碱不论强弱,谁大谁过剩,溶液呈谁性。
(5)PH减小一个单位,[H+]扩大为原来的10倍。
PH增大2个单位,[H+]减为原来的1/100
(6)稀释规律:分别加水稀释m倍时,溶液的物质的量的浓度均变为原来的1/m ,强酸中
C( H+)变为原来的1/m,但弱酸中C( H)减小小于m倍,故稀释后弱酸酸性强于强酸。
酸碱中和滴定
主要仪器
(1)滴定管
滴定管分为_________ 滴定管和_________ 滴定管。
酸性溶液装在___________ 滴定管中,碱性溶液装在_________ 滴定管中。
如图所示:
(2)锥形瓶、烧杯、铁架台、滴定管夹等。
2.主要试剂
标准液、待测液、指示剂、蒸馏水。
O
1
L-
B-
li
E~
⅛
醸式滴宦管織式滴宦管
10 倍,贝U pH=a+n。
10n倍,则pH<a+n。
10n倍,则pH=b-n。
10n倍,则pH>b-n。
C(OH )混=
③酸碱混合, ,者过量时
C(QH )混或c(H+)混=
1 C(H
)酸
V
酸-
C(Q
H ^碱
V
碱
1
实验操作(用标准盐酸滴定待测 NaoH 溶液) ①洗涤 ②查漏③润洗 ①量取待测液并加指示剂
③ 重复操作三次
【注意】
①滴定时在瓶底垫一张白纸;
② 滴定时左手控制旋钮、右手振荡锥形瓶、目光注视锥形瓶内溶液颜色变化。
③ 锥形瓶:只用蒸馏水洗涤,不能用待测液润洗 ④ 先快后慢,当接近终点时,应一滴一摇
⑤ 注入标准液至“ 0”刻度上方 2~3cm 处,将液面调节到“ 0”刻度(或“ 0”刻度以下某一 刻度)
注意:指示剂的选择:变色灵敏、明显。
一般用酚酞,不用石蕊
4.常用酸碱指示剂及变色范围
5. 滴定终点判断
当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色, 即为滴定终
点。
问题思考
(1)KMnO 4(H +
)溶液、溴水、Na 2CO 3溶液、稀盐酸应分别盛放在哪种滴定管中?
⑵滴定终点就是酸碱恰好中和的点吗?
6. 酸碱中和滴定的误差分析
原理(以标准盐酸滴定待测 NaOH 溶液为例)
C A V A
CB
= V B
V B ――准确量取的待测液的体积; C A — ■—标准溶液的浓度。
C (待)的大小取决于 V (标)的大小,V (标)大,则C (待)大,V (标)小,则C (待)小。
常见误差
以标准酸溶液滴定未知浓度的碱(酚酞作指示剂)为例,常见的因操作不正确而引起的误 差有:
3. 1. 准备: 2. 滴定: ④装液体⑤排气泡⑥调整液面 ⑦读数 ②滴定至终点并读数 ④计算。
