电解质溶液理论导论(黄子卿)思维导图
基础化学:第三章 电解质溶液

第一节 强电解质溶液
É lectrolyte 电解质
—substance qui conduit le courant électrique en solution aqueuse ou à l’état de fusion.
Le rôle de solution électrolytique : maintenir la concentration osmotique des liquides du corps humain, valeur de pH et les autres fonctions physiologiques et biochimiques
为了表达溶液中离子氛或离子对的影响,引入活度 活度(activité)a :concentration effective des ions 离子有效浓度
aΒ=γB ·cB / cθ
量纲:一
γB :活度因子 coefficient d’activité Cθ:标准摩尔浓度, 1 mol·L-1
∵aB< cB,∴γ B <1
les électrolyte fort se dissocient complètement dans l’eau. la force électrostatique inter ionique forme l’atmosphère
ionique离子氛, empêche le mouvement libre des ions.
体液(血浆、胃液、泪水、尿液)含有许多 电解质离子,如Na+、K+、Ca2+、Mg2+、Cl-、 HCO3-、CO32-、HPO42-、H2PO4-、SO42- 等, 它们维持着体液渗透浓度、pH值.
一、Électrolyte 电解质 et degréde dissociation 解离度
电解质溶液课件

性,或碳酸钠的碱性。
二、酸碱质子理论
(一)酸碱的概念
酸:凡是能给出质子H+的物质(HCl,H3O+ ,H2O ,HCO3-) 碱:凡是能接受质子H+的物质(Cl-,H2O, OH-,CO32-)
H2O + Ac-
HAc + OH-
结论:一种酸和一种碱发生反应,总是伴随着一种新 酸和新碱的生成。酸1 和碱1是一对共轭酸碱对,同2.
酸碱反应实质是两对共轭酸碱对之间的质子传递反应
酸碱反应的 方向:
总是由较强的酸或是较强的碱作 用,向着生成较弱的酸或较弱的 碱的方向进行。
HCl+NH3 NH4++Cl-
强电解质 完全电离 强酸、强碱、大多数盐 弱电解质 不完全电离 弱酸、弱碱、部分盐
一 弱酸、弱碱的解离平衡
弱电解质在水溶液中的电离是可逆的
HAc + H2O
Ac- + H3O+
解离平衡:在一定温度下,当分子解离成离子和离子结合成
分子的速率相同时,溶液中各组分的浓度不再发生改变,即
达到动态平衡,这种状态称为解离平衡。
两性物质:既能给出质子又能接受质子的物质
酸碱质子理论中没有盐的概念
一般来说:共轭酸给出质子的能力越强, 酸性越强,它的共轭碱接受质子的能力 就越弱,共轭碱的碱性就越弱;共轭碱 越强,它的共轭酸就越弱。
如:H2OH++OH水为最弱的酸,它的共轭碱是最强的碱。
(二) 酸碱反应的实质
❖ 按照酸碱质子理论,酸碱反应的实质是质子 的传递,酸碱反应是两对共轭酸碱对共同作 用的结果。
物理化学课件第7章_电解质溶液

生化和医学等方面都要用不同类 型的化学电源。
⒊电分析 ⒋生物电化学
上一内容 下一内容 ²回主目录
O返回
2021-3-12
电化学分析
电化学传感器
电化学技术与环境监测 快速、灵敏、准确、结构简单、便于自动化
离子传感器:
掺EuF2 的氟化镧传感器监测饮用水或污水中氟的含量 硫化银+卤化银混合的晶体膜电极测定卤素离子(Cl- 、Br- 、I- ) 硫化银+金属硫化物膜电极 测定相应金属离子(如Cu2 + 、Pb2 + 、Cd2 + )
• 直到1950年代后,电化学中的动力学问题才 得到重视。新材料、新体系、新方法的利用, 对电化学的发展作用越来越大。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
电化学发展趋势
i)向交叉领域发展: 有机电化学、生物电化学、 光谱电化学、量子电化学等等。
ii)向微观发展: 从原子、分子水平上研究电化 学体系。并进一步向上拓宽至纳米尺度,向 下拓宽至单分子 (单原子) 水平 纳米电 化学的兴起。这可能是解决电化学学科中一 些长期未决的基本科学问题的关键。
法拉第定律的文字表述
⒈ 在电极界面上发生化学变化物质的量与 通入的电量成正比。
⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各 个电极上发生反应的物质,其物质的量 相同,析出物质的质量与其摩尔质量成 正比。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
法拉第定律的数学表达式
W
f
0
GT . p 0
当充分发挥时, GT.p Wf(M)
第10章 电解质溶液剖析

p
Ki
lg
[In ] [H I n]
[H ] Ki , [In ] [H I n], pH p Ki
指示剂的 理论变色点
[HIn] /[In] 10,显HIn 的颜色 [HIn] /[In] 0.1,显In 的颜色
pH
p
K
i
1
指示剂变色范围
NH
4
OH
K
b
[NH
4
]
[OH
]
[NH 3 H2O]
[OH ]2 c0 [OH ]
若
c0
K
b
﹥ 400 ,则
K
b
[OH ]2 c0
[OH ]
c0
K
b
[OH ] c0
c
0
K
b
K
b
c0
c0
2. 同离子效应和盐效应
同离子效应
HAc
H + + Ac-
若向HAc 溶液中加入少量NaAc,由于 [Ac-] 增大,使得HAc 的解离平衡左移, 从而降低了HAc 的α。
用的浓度。以 a 表示。
a fc
f 为活度系数, 稀溶液中,f < 1;极稀溶液中,f 接近1
一般来说,离子自身的电荷数越 高,所在溶液的离子强度越大,则 f 的 数值越小。
§10-2 弱酸、弱碱的解离平衡
2-1 一元弱酸、弱碱的解离平衡 2-2 水的离子积和溶液的pH值 2-3 多元弱酸的解离平衡 2-4 缓冲溶液
1-1 离子氛和离子强度 1-2 活度和活度系数
1-1 离子氛和离子强度
1. 离子氛
1923年,Debye 及 Hückel 提出离子 氛(ionic atmosphere)概念。
人教版九年级化学下册 《溶液的形成》思维导图课件

典例精析
【例3】在盛有等体积水的A、B、C三支试管中,分别加入甲、乙、丙三种物质。
充分振荡后看到:A试管的液体中有分散着的小液滴;B试管的液体中有分散着的固
体小颗粒;C试管中看不到丙物质,试管内的液体为蓝色透明液体。则A试管中的
是 乳浊液 ;B试管中的是悬浊液 ;C试管中的是 溶液 。如果外界条件不变,
(3)乳化剂 乳化剂(乳浊液的稳定剂)是一类表面活性剂,阻止小液滴相互凝结。如洗涤剂能 把植物油分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分 层,所形成的乳浊液稳定性增强。这种现象称为乳化。
思维导图解读——浊 液
(4)乳化作用在生活中的应用 ①洗涤:用洗涤剂(乳化剂)可以将衣服上、餐具上的油污洗掉。 ②农药中的应用:将农药加入一定量的乳化剂后,再溶解在有机溶剂 里,混合均匀后所制成的透明液体叫乳油。 ③生活中常用的乳化剂:肥皂、洗洁精等。
思维导图解读——溶液
注意:a.同一种溶液里,溶剂只有一种,而溶质可以是一种,也可以是多种; b.同一种溶液里的溶质和溶剂不发生化学反应; c.有两种或两种以上溶质的溶液,溶质之间不发生反应,即它们能共存于同一溶液 里。 d.溶质可以是固体,也可以是液体或气体。 e.溶剂一般为液体,水是最常用的溶剂,酒精和汽油也是常用的溶剂。 f.溶液是澄清透明的,但不一定都是无色的。如FeSO4溶液为浅绿色,CuSO4溶液为 蓝色。
三支试管静置片刻后可以看到,A试管中 分层
;B试管中 分层 ;C试管
中 不分层 ,由此可见,C试管中的液体具有 稳定性 和均一性。
谢谢观看
思维导图解读——溶液
注意:a.一般水溶液中不指明溶剂,如硫酸铜溶液,就是硫酸铜的水 溶液,蔗糖溶液就是蔗糖的水溶液,所以未指明溶剂的一般为水。 b.物质在溶解时发生了化学变化,那么在形成的溶液中,溶质是反应 后分散在溶液中的生成物。如Na2O溶于水后发生化学反应,生成物是 NaOH,因此溶质是NaOH,而不是Na2O。 c.结晶水合物如蓝矾(CuSO4·5H2O)溶于水,溶质是硫酸铜(CuSO4),结 晶水则成为水的一部分。
物化部分思维导图及总结
aRed aOx
对任意反应: cC dD gG hH
E
Ox|Red
()
Ox|Red
()
E
RT zF
ln
aGg aHh aCc aDd
(2)由电池电动势求反应的热力学函数
rGm zEF rGm RT ln Ka
由电动势E及其温度系数求反应的r H m和r Sm
例:习题 1 第十三章 表面物理化学
一.基本概念、基本知识
1、表面自由能 保持相应的特征变量不变,每增加单位表面积时,相应热力学函数的增
值。
U ( A )S,V,nB
H ( A )S,P,nB
F ( A )T,V,nB
G ( A )T,P,nB
表面自由能狭义定义: 保持温度、压力和组成不变,每增加单位表面积时,Gibbs 自由能
不同点:两者的物理意义不同,所用单位不同。
3、弯曲表面下的附加压力
液面水平,附加压力 Ps 等于零。
液面为凸形,附加压力 PS 大于零
液面为凹形,附加压力 PS 小于零
杨-拉普拉斯公式:
pS
2 R'
曲率半径 R’越小,附加压力越大
凸面 R’大于零,凸面下液体所受压力比平面下要大
凹面 R’小于零,凹面下液体所受压力比平面下要小 附加压力与毛细管中液面高度的关系: 2 cos gh
lg A | z z | I
离子平均质量摩尔浓度: m def (mm )1
a
m m
aB
(
m m
)
7、电导测定的应用计算
(1)计算弱电解质的解离度和解离常数
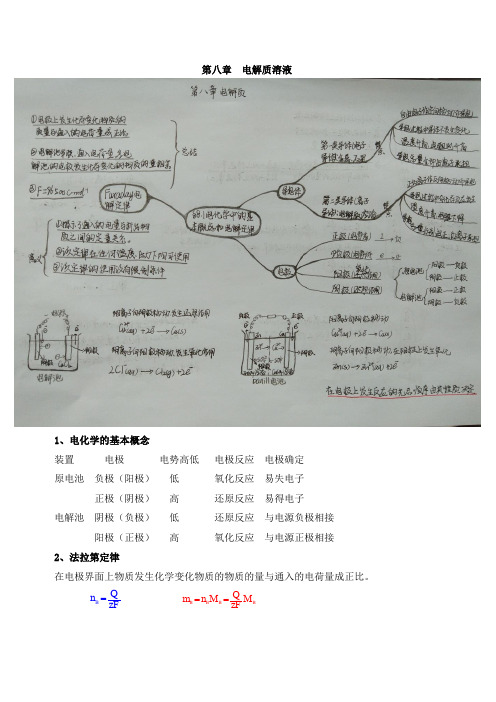
电解质 思维导图
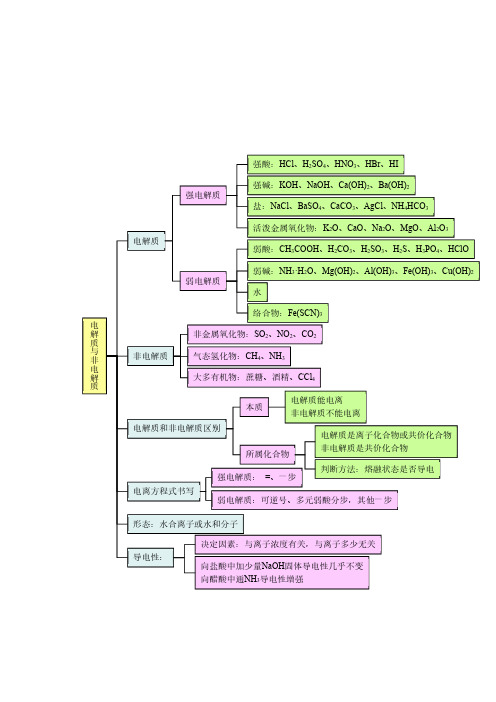
弱电解质
弱碱:NH3·H2O、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2 水
络合物:Fe(SCN)3
电
解
非金属氧化物:SO2、NO2、CO2
质
与 非
非电解质
气态氢化物:CH4、NH3
电
ห้องสมุดไป่ตู้
解
大多有机物:蔗糖、酒精、CCl4
质
本质
电解质能电离 非电解质不能电离
电解质和非电解质区别
所属化合物
电解质是离子化合物或共价化合物 非电解质是共价化合物
电离方程式书写
强电解质: =、一步
判断方法:熔融状态是否导电
弱电解质:可逆号、多元弱酸分步,其他一步
形态:水合离子或水和分子
导电性:
决定因素:与离子浓度有关,与离子多少无关
向盐酸中加少量NaOH固体导电性几乎不变 向醋酸中通NH3导电性增强
强酸:HCl、H2SO4、HNO3、HBr、HI
强电解质
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2 盐:NaCl、BaSO4、CaCO3、AgCl、NH4HCO3
电解质
活泼金属氧化物:K2O、CaO、Na2O、MgO、Al2O3 弱酸:CH3COOH、H2CO3、H2SO3、H2S、H3PO4、HClO
高考化学一轮复习:知识图构系列 Z5电解质溶液
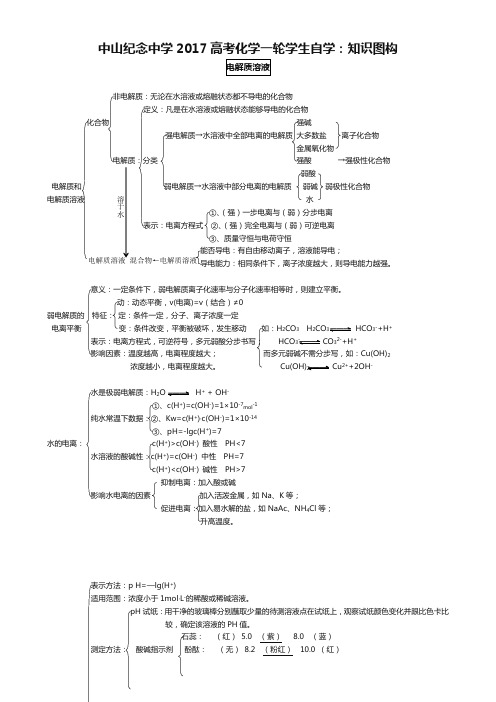
中山纪念中学2017高考化学一轮学生自学:知识图构非电解质:无论在水溶液或熔融状态都不导电的化合物定义:凡是在水溶液或熔融状态能够导电的化合物 化合物 强碱强电解质→水溶液中全部电离的电解质 大多数盐 离子化合物金属氧化物电解质:分类 强酸 →强极性化合物弱酸电解质和 弱电解质→水溶液中部分电离的电解质 弱碱 弱极性化合物 电解质溶液 水 ①、(强)一步电离与(弱)分步电离 表示:电离方程式 ②、(强)完全电离与(弱)可逆电离 ③、质量守恒与电荷守恒能否导电:有自由移动离子,溶液能导电;导电能力:相同条件下,离子浓度越大,则导电能力越强。
意义:一定条件下,弱电解质离子化速率与分子化速率相等时,则建立平衡。
动:动态平衡,v(电离)=v (结合)≠0弱电解质的 特征: 定:条件一定,分子、离子浓度一定电离平衡 变:条件改变,平衡被破坏,发生移动 如:H 2CO 3 H 2CO HCO 3-+H +表示:电离方程式,可逆符号,多元弱酸分步书写; HCO - CO 32-+H +影响因素:温度越高,电离程度越大; 而多元弱碱不需分步写,如:Cu(OH)2浓度越小,电离程度越大。
2 Cu 2++2OH -水是极弱电解质:H 2 H + + OH -①、c(H +)=c(OH -)=1×10-7mol -1纯水常温下数据:②、Kw=c(H +)·c(OH -)=1×10-14③、pH=-lgc(H +)=7水的电离: c(H +)>c(OH -) 酸性 PH<7水溶液的酸碱性:c(H +)=c(OH -) 中性 PH=7c(H +)<c(OH -) 碱性 PH>7抑制电离:加入酸或碱影响水电离的因素 加入活泼金属,如Na 、K 等;促进电离:加入易水解的盐,如NaAc 、NH 4Cl 等;升高温度。
表示方法:p H=—lg(H +)适用范围:浓度小于1mol ·L -的稀酸或稀碱溶液。
第8章电解质溶液
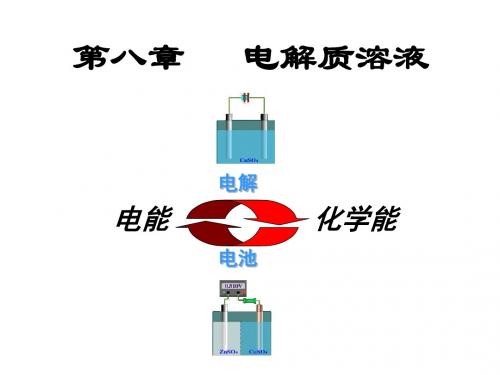
1. 原电池和电解池
1.1 基本概念
(1)导体:能导电的物质称为导电体,通常分为两类:
第一类导体又称电子导体,如金属、石墨等
第一类导体的特点是: A. 自由电子作定向移动而导电 B. 导电过程中导体本身不发生变化 C. 温度升高,电阻也升高 D. 导电总量全部由电子承担
第二类导体又称离子导体,如电解质溶液、熔融电解质等
2HCl H2(g)+Cl2(g)
完成电子在界面的传递
1.2 原电池和电解池
(2)原电池:化学能电能 可逆情况下:
H2
阳 极
负
-
极
- -
-
-
负载电阻Biblioteka e-e-Cl2阴 极
+
正
+ +
极
+
+
Wf=ΔG=-Q·E 外电路:负极 e正-极
电解质溶液:在外电场作用下, 阴阳离子定向移动,共同完成 导电任务。
极
S
O
24
S
O
24
极
ZnSO4溶液 CuSO4溶液
在阴极上发生还原的是
C u2aq2e C u(s)
阴离子迁向阳极 在阳极上发生氧化的是
Daniell电池
Z ns Z n2(aq)2e
在电极上发生反应的先后由其性质决定
在电解池中, 用惰性电极
-
- 电源 +
e-
+
e-
Pt
Pt
=正 负 离 离 子 子 的 的 迁 迁 移 移 速 速 率 率 ((rr ))
如果正、负离子荷电量不等,如果电极本身也发 生反应,情况就要复杂一些。
2.离子的电迁移率和迁移数
2.1离子的电迁移率:又称为离子淌度(ionic mobility), 相当于单位电位梯度时离子迁移的速率
第十章电解质溶液-

一、一元弱酸、弱碱的解离平衡
1.解离常数 Kiθ
HAc H + + A c -
起始浓度
C0
平衡浓度 C0 –[H+]
00 [H+] [H+]
K
(H)(Ac ) (HAc)
K : 酸的解离平衡常数
2019/11/5 8
HAc H + + A c -
弱电解质稀溶液 f≈1 α≈c
组成
弱酸和它的盐 HAc-NaAc 弱碱和它的盐 NH3·H2O-NH4CI 多元弱酸的酸式盐及其对应的次级盐
NaH2PO4Na2HPO4 ,NaHCO3-Na2CO3
2019/11/5 31
(2)缓冲作用原理
HAcH + +- Ac
量大
量少 量大
外加少量强碱,H++OH-→H2O,平衡右 移,HAc电离补充减少的H+,即HAc是抗碱成分;
2019/11/5 28
同离子效应与盐效应是两种完全相反的 作用,而且在发生同离子效应的同时,也伴 有盐效应的发生。由于盐效应的影响比同离 子效应的影响小得多,故一般只在解释问题 时考虑,计算时不考虑。
2019/11/5 29
3.缓冲溶液
(1)定义与组成
在100dm3纯水(pH=7)中,加入 1.0dm3 1.0mol·dm-3的HCI或NaOH溶液, 则纯水的pH值由7→3或7→11,变化了4个单 位。说明纯水不能抵抗外加少量酸碱的影响。
2019/11/5 19
思考:某溶液使甲基橙显黄色,使 酚酞显无色,则该溶液
pH值在4.4-8.2之间
用单一指示剂只能确定溶液的pH值范围, 但不能确定溶液的酸碱性。
