一些溶剂与水形成的二元共沸物
实验室常用溶剂共沸体系

实验室常用溶剂共沸体系18、00、960浓盐酸1、1912、10、372浓硝酸1、4215、90、704磷酸1、7014、80、855冰醋酸1、0517、450、998浓氨水0、9014、530、566浓氢氧化钠1、5419、40、505注:表中数据录自JohnA、 Dean、Lange’s Handbook of Chemistry、13th ed、1985常见的共沸混合物1)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/%溶剂沸点/℃共沸点/℃含水量/%氯仿61、256、12、5甲苯185、020四氯化碳77、066、04、0正丙醇97、287、728、8苯80、469、28、8异丁醇108、4 89、988、2丙稀腈78、070、013、0二甲苯137- 40、592、037、5二氯乙烷83、772、019、5正丁醇117、737、5乙睛82、076、016、0吡啶1 15、594、042乙醇78、378、14、4异戊醇1 31、095、149、6乙酸乙酯77、170、48、0正戊醇1 38、395、444、7异丙醇82、480、412、1氯乙醇197、859、0乙醚35341、0二硫化碳46442、0甲酸101107262)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/%共沸物的沸点/℃乙醇-乙酸乙酯78、3,78、030:7072、0乙醇-苯78、3,80、632:6868、2乙醇-氯仿78、3,61、27:9359、4乙醇-四氯化碳78、3,77、016:8464、9乙酸乙酯-四氯化碳78、0,77、043:5775、0甲醇-四氯化碳77、021:7955、7甲醇-苯64、7,80、439:6148、3氯仿-丙酮61、2,56、480:2064、7甲苯-乙酸101、5,1 18、572:28105、4乙醇-苯-水78、3,80、6,10019:74:764、9。
常见共沸混合物

8月28日常见共沸混合物近期想低温下蒸出DMF,于是想共沸的方式,但没找到很好的共沸体系.下面是一些常见共沸体系.(a)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃ 共沸点/℃ 含水量/% 溶剂沸点/℃ 共沸点/℃ 含水量/%氯仿 61.2 56.1 2.5 甲苯 110.5 85.0 20四氯化碳 77.0 66.0 4.0 正丙醇 97.2 87.7 28.8苯 80.4 69.2 8.8 异丁醇 108.4 89.9 88.2丙稀腈 78.0 70.0 13.0 二甲苯 137-40.5 92.0 37.5二氯乙烷 83.7 72.0 19.5 正丁醇 117.7 92.2 37.5乙睛 82.0 76.0 16.0 吡啶 115.5 94.0 42乙醇 78.3 78.1 4.4 异戊醇 131.0 95.1 49.6乙酸乙酯 77.1 70.4 8.0 正戊醇 138.3 95.4 44.7异丙醇 82.4 80.4 12.1 氯乙醇 129.0 97.8 59.0乙醚 35 34 1.0 二硫化碳 46 44 2.0甲酸 101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃ 共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯 78.3,78.0 30:70 72.0乙醇-苯 78.3,80.6 32:68 68.2乙醇-氯仿 78.3,61.2 7:93 59.4乙醇-四氯化碳 78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳 78.0,77.0 43:57 75.0甲醇-四氯化碳 64.7,77.0 21:79 55.7甲醇-苯 64.7,80.4 39:61 48.3氯仿-丙酮 61.2,56.4 80:20 64.7甲苯-乙酸 101.5,118.5 72:28 105.4乙醇-苯-水 78.3,80.6,100 19:74:7 64.9共沸的二个溶剂间沸点不要相差太大,这可能是经验之说.。
常见的共沸混合物的组成及共沸点
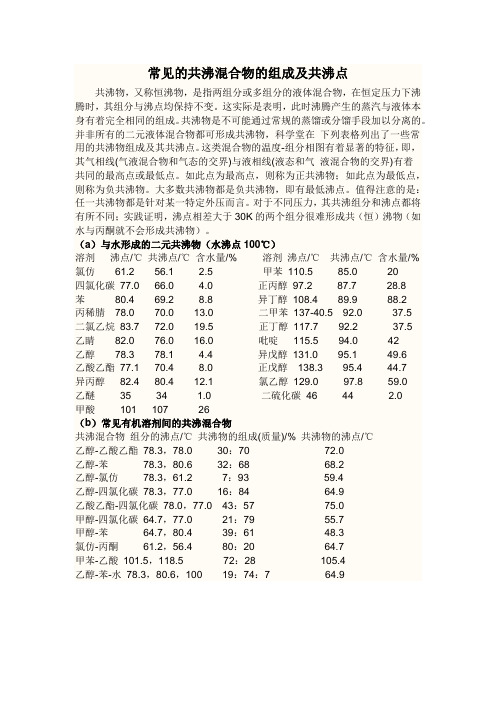
常见的共沸混合物的组成及共沸点共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。
大多数共沸物都是负共沸物,即有最低沸点。
值得注意的是:任一共沸物都是针对某一特定外压而言。
对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。
(a)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/% 溶剂沸点/℃共沸点/℃含水量/% 氯仿61.2 56.1 2.5 甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0 正丙醇97.2 87.7 28.8苯80.4 69.2 8.8 异丁醇108.4 89.9 88.2丙稀腈78.0 70.0 13.0 二甲苯137-40.5 92.0 37.5二氯乙烷83.7 72.0 19.5 正丁醇117.7 92.2 37.5乙睛82.0 76.0 16.0 吡啶115.5 94.0 42乙醇78.3 78.1 4.4 异戊醇131.0 95.1 49.6乙酸乙酯77.1 70.4 8.0 正戊醇138.3 95.4 44.7异丙醇82.4 80.4 12.1 氯乙醇129.0 97.8 59.0乙醚35 34 1.0 二硫化碳46 44 2.0甲酸101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9。
实验室常见有机溶剂间的共沸混合物

昂常见有机溶剂间的共沸混合物来源:有机化学网作者:chemfei共沸物的沸点/℃共沸混合物组分的沸点/℃共沸物的组成(质量)/%乙醇-乙酸乙酯78.3,78.030:7072.0乙醇-苯78.3,80.632:6868.2乙醇-氯仿78.3,61.27:9359.4乙醇-四氯化碳78.3,77.016:8464.9乙酸乙酯-四氯化碳78.0,77.043:5775.0甲醇-四氯化碳64.7,77.021:7955.7甲醇-苯64.7,80.439:6148.3氯仿-丙酮61.2,56.480:2064.7甲苯-乙酸101.5,118.572:28105.4乙醇-苯-水78.3,80.6,10019:74:764.9实验室常用酸、碱的浓度来源:有机化学网作者:chemfei试剂名称密度(20℃)g/ml浓度mol/L质量分数浓硫酸 1.8418.00.960浓盐酸 1.1912.10.372浓硝酸 1.4215.90.704磷酸 1.7014.80.855冰醋酸 1.0517.450.998浓氨水0.9014.530.566浓氢氧化钠 1.5419.40.505一些溶剂与水形成的二元共沸物来源:有机化学网作者:chemfei各种显色剂及其配制方法来源:有机化学网作者:admin碘:不饱和或者芳香族化合物配制方法在100ml广口瓶中,放入一张滤纸,少许碘粒。
或者在瓶中,加入10g碘粒,30g硅胶紫外灯含共厄基团的化合物,芳香化合物硫酸铈:生物碱配制方法10%硫酸铈(IV)+15%硫酸的水溶液氯化铁苯酚类化合物配制方法1% FeCl3 + 50% 乙醇水溶液.桑色素(羟基黄酮)广谱, 有荧光活性配制方法0.1% 桑色素+甲醇茚三酮氨基酸配制方法1.5g 茚三酮+ 100mL of 正丁醇+ 3.0mL 醋酸二硝基苯肼(DNP)醛和酮配制方法12g二硝基苯肼+ 60mL 浓硫酸+ 80mL 水+ 200mL 乙醇香草醛(香兰素)广谱配制方法15g 香草醛+ 250mL 乙醇+2.5mL 浓硫酸高锰酸钾含还原性基团化合物,比如羟基,氨基,醛配制方法1.5g KMnO4 + 10g K2CO3 + 1.25mL 10% NaOH + 200mL 水. 使用期3个月溴甲酚绿羧酸,pKa<=5.0配制方法在100ml乙醇中,加入0.04g溴甲酚绿,缓慢滴加0.1M的NaOH水溶液,刚好出现蓝色即至。
常见有机溶剂间的共沸混合物

沸点 /℃ 110.5 97.2 108.4 137-40.5 117.7 115.5 131.0 138.3 129.0 46
共沸点 /℃ 85.0 87.7 89.9 92.0 92.2 94.0 95.1 95.4 97.8 44
含水量 /% 20 28.8 88.2 37.5 37.5 42 49.6 44.7 59.0 2.0
甲醇-苯 氯仿-丙酮 甲苯-乙酸 乙醇-苯-水
组分的沸点/℃ 78.3,78.0 78.3,80.6 78.3,61.2 78.3,77.0 78.0,77.0 64.7,77.0 64.7,80.4 61.2,56.4 101.5,118.5
78.3,80.6,100
共沸物的组成(质量)/% 30:70 32:68 7:93 16:84 43:57 21:79 39:61 80:20 72:28
共沸点 /℃ 56.1 66.0 69.2 70.0 72.0 76.0 78.1 70.4 80.4 34 107
含水量 /% 2.5 4.0 8.8 13.0 19.5 16.0 4.4 8.0 12.1 1.0 26
溶剂
甲苯 正丙醇 异丁醇 二甲苯 正丁醇 吡啶 异戊醇 正戊醇 氯乙醇 二硫化碳
/articles/open.asp?id=2202006-2-6 20:45:33
有机化学网-技术文章-常见有机溶剂间的共沸混合物
常见有机溶剂间的共沸混合物 来源:有机化学网 作者:chemfei
共沸混合物 乙醇-乙酸乙酯
乙醇-苯 乙醇-氯仿 乙醇-四氯化碳 乙酸乙酯-四氯化碳 甲醇-四氯化碳
有机化学网-技术文章-一些溶剂与水形成的二元共沸物
一些溶剂与水形成的二元共沸物 来源:有机化学网 作者:chemLeabharlann ei溶剂氯仿 四氯化碳
有机化学实验考试(四个制备实验)

实验原理:蒸馏:利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分。
分馏:利用分馏柱的理论塔板将混合液蒸汽进行一系列的热交换,使高沸点组分冷凝回流,低沸点组分蒸出,从而达到分离。
萃取分液:利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
重结晶:利用混合物中各组分在某种溶剂中的溶解度不同,或在同一溶剂时不同温度的溶解度不同,从而使它们相互分离。
环己烯的制备(消去反应)实验原理:物理原理:分馏、萃取、蒸馏化学原理:正反应:副反应:生成二环己基醚,烯烃聚合物,分子间的失水碳化。
实验仪器及用品:用品:名称用量作用环己醇0.1mol(10g10.4mL)反应物实验仪器:加热:升降台、电热套制备:50mL圆底烧瓶、分馏柱、温度计套管、温度计、蒸馏头、直形冷凝管、接引管、50ml锥形瓶(冷水浴)分液:小分液漏斗蒸馏:50mL圆底烧瓶、温度计套管、温度计、蒸馏头、直形冷凝管、接引管、接收器实验步骤:1.制备:在干燥的50ml圆底烧瓶放入0.1mol环己醇及少量多次加入4mL浓磷酸,充分摇荡使两种液体混合均匀。
投入几粒沸石,装好装置,接收器冷水浴。
加热至沸腾,保持温度计度数不超过90℃,慢慢蒸出环己烯和水,约1h。
当无液体蒸出时,可大火加热;当烧瓶内只剩下很少的残渣并出现白雾时,停止加热。
2.分液:将馏出液用约1g氯化钠饱和,然后加入3~4mL5%的碳酸钠溶液中和微量的酸。
然后将液体倒入小分液漏斗,振摇静置,分层后放出下方水层,将上层粗产品用1~2g无水氯化钙干燥(清亮透明),然后滤入50mL蒸馏烧瓶中,加入沸石进行蒸馏,收集80~85℃的馏分,产物为无色有刺激性气味液体,称量体积。
注意事项重难点:1.所有仪器需干燥,粗产物需干燥才能进行蒸馏。
2.正确进行操作,温度计玻璃球位置应在支口处。
(下端液面上,上端在支管口下沿),记得加沸石。
共沸表 jlac

与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/%氯仿61.2 56.1 2.5甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0正丙醇97.2 87.7 28.8苯80.4 69.2 8.8异丁醇108.4 89.9 88.2丙稀腈78.0 70.0 13.0二甲苯137-40.5 92.0 37.5二氯乙烷83.7 72.0 19.5正丁醇117.7 92.2 37.5乙睛82.0 76.0 16.0吡啶115.5 94.0 42乙醇78.3 78.1 4.4异戊醇131.0 95.1 49.6乙酸乙酯77.1 70.4 8.0正戊醇138.3 95.4 44.7异丙醇82.4 80.4 12.1乙醇129.0 97.8 59.0乙醚35 34 1.0二硫化碳46 44 2.0甲酸101 107 26常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9表1乙醇-水-苯三元共沸物性质共沸物(简记)共沸点℃共沸物组成,wt% 乙醇水苯乙醇-水-苯(T) 64.85 18.5 7.4 74.1 乙醇-苯(AB Z) 68.24 32.7 0.0 67.63 苯-水(BW Z) 69.25 0.0 8.83 91.17 乙醇-水(AW Z) 78.15 95.57 4.43 0.0表2乙醇、水、苯的常压沸点物质名称(简记) 乙醇(A) 水(B) 苯(B)沸点温度,℃78.3 100.0 80.2。
异丙醇和水的混合物常用的分离方法
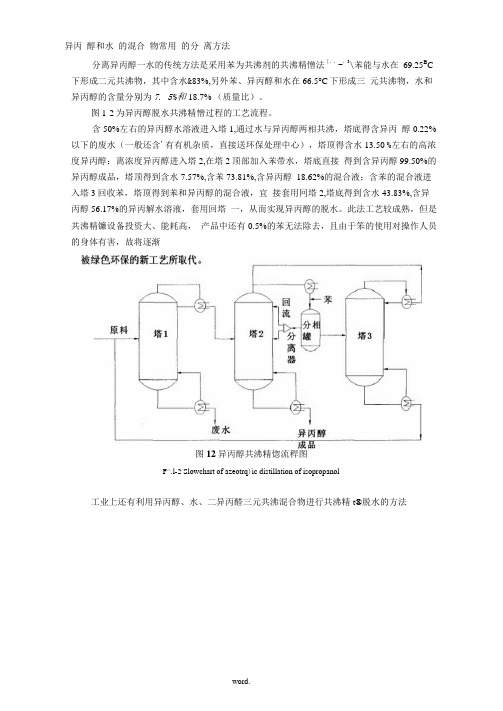
异丙醇和水的混合物常用的分离方法分离异丙醇一水的传统方法是采用苯为共沸剂的共沸精憎法[,,-,3\苯能与水在69.25B C 下形成二元共沸物,其中含水&83%,另外苯、异丙醇和水在66.5°C下形成三元共沸物,水和异丙醇的含量分别为7. 5%和18.7% (质量比)。
图1-2为异丙醇脱水共沸精憎过程的工艺流程。
含50%左右的异丙醇水溶液进入塔1,通过水与异丙醇两相共沸,塔底得含异丙醇0.22%以下的废水(一般还含'有有机杂质,直接送环保处理中心),塔顶得含水13.50 %左右的高浓度异丙醇;离浓度异丙醇进入塔2,在塔2顶部加入苯带水,塔底直接得到含异丙醇99.50%的异丙醇成品,塔顶得到含水7.57%,含苯73.81%,含异丙醇18.62%的混合液;含苯的混合液进入塔3回收苯,塔顶得到苯和异丙醇的混合液,宜接套用冋塔2,塔底得到含水43.83%,含异丙醇56.17%的异丙解水溶液,套用回塔一,从而实现异丙醇的脱水。
此法工艺较成熟,但是共沸精镰设备投资大、能耗高,产品中还有0.5%的苯无法除去,且由于笨的使用对操作人员的身体有害,故将逐渐图12异丙醇共沸精惚流稈图F^.l-2 Slowchart of azeotrq)ic distillation of isopropanol工业上还有利用异丙醇、水、二异丙醛三元共沸混合物进行共沸精t®脱水的方法,10\二异丙醛虽然無性较苯低,但易与空气形成过氧化物,有爆炸的危险,且带水壘比苯少,总体效果也不理想。
1.3.2吸附蒸tg工艺吸附分离技术^是20世纪60年代以后得到迅速发展的新分离技术,对于相对挥发度接近1・0的难分离物系,吸附技术在许多方面明显优于常规蒸蚀技术。
吸附蒸馅是将吸附和蒸懈相复合的分离过程,具有吸附过程分离因数高、蒸馆过程连续的优点, 适用于有共沸点物系的分离。
文献:⑷采用吸附蒸馆技术分离异丙醇-水混合物,该工艺流程如图卜3所示。
常见有机溶剂间的共沸混合物
常见有机溶剂间的共沸混合物压力单位换算表注:毫米水柱是指4摄氏度状态的水柱高度,毫米汞柱是指0摄氏度状态的水柱高度。
实验室常用酸、碱的浓度试剂名称密度(20℃)g/ml 浓度mol/L 质量分数浓硫酸 1.84 18.0 0.960 浓盐酸 1.19 12.1 0.372 浓硝酸 1.42 15.9 0.704 磷酸 1.70 14.8 0.855 冰醋酸 1.05 17.45 0.998 浓氨水0.90 14.53 0.566 浓氢氧化钠 1.54 19.4 0.505一些溶剂与水形成的二元共沸物用于有机溶剂的中等强度的干燥剂有机化合物的鉴别在药品的生产、研究及检验等过程中,常常会遇到有机化合物的分离、提纯和鉴别等问题。
有机化合物的鉴别、分离和提纯是三个既有关联而又不相同的概念。
分离和提纯的目的都是由混合物得到纯净物,但要求不同,处理方法也不同。
分离是将混合物中的各个组分一一分开。
在分离过程中常常将混合物中的某一组分通过化学反应转变成新的化合物,分离后还要将其还原为原来的化合物。
提纯有两种情况,一是设法将杂质转化为所需的化合物,另一种情况是把杂质通过适当的化学反应转变为另外一种化合物将其分离(分离后的化合物不必再还原)。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。
如鉴别一组化合物,就是分别确定各是哪种化合物即可。
在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:(1)化学反应中有颜色变化(2)化学反应过程中伴随着明显的温度变化(放热或吸热)(3)反应产物有气体产生(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
本课程要求掌握的重点是化合物的鉴别,为了帮助大家学习和记忆,将各类有机化合物的鉴别方法进行归纳总结,并对典型例题进行解析。
一.各类化合物的鉴别方法1.烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去(2)高锰酸钾溶液,紫色腿去。
环己烯的制备及其思考题

环己烯的制备实验目的1、学习、掌握由环己醇制备环己烯的原理及方法;2、了解分馏的原理及实验操作;3、练习并掌握蒸馏、分液、干燥等实验操作方法;实验原理主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物沸点℃,含水10%;但是原料环己醇也能和水形成二元共沸物沸点℃,含水80%;为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃;反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应; 分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离试剂环己烯,浓硫酸,食盐,无水氯化钙,5%碳酸钠实验步骤在50毫升干燥的圆底烧瓶中,放进15g环己烯,、1ml浓硫酸和几粒沸石,充分振摇使混合均匀;烧瓶上装一短的分馏柱作分馏装置,接上冷凝管,用锥形瓶作接受器,外用冰水冷却;将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上真个温度不要超过90℃,馏液为带水的混合物;当烧瓶中只剩下很少量的残渣并出现阵阵白雾时,即可停止蒸馏;全部蒸馏时间约需1h;将蒸馏液用精盐饱和,然后加进3—4ml 5%碳酸钠溶液中和微量的酸;将此液体倒进小分液漏斗中,振摇后静置分层;将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒进干燥的小锥形瓶中,加进1-2克无水氯化钙干燥;将干燥后的产物滤进干燥的蒸馏瓶中,加进沸石后用水浴加热蒸馏;收集80-85℃的馏分于一已称重的干燥小锥形瓶中;产率7-8g;注意事项1、环己醇在常温下是粘碉状液体,因而若用量筒量取时应注意转移中的损失;所以,取样时,最好先取环己醇,后取硫酸;2、环己醇与磷酸应充分混合,否则在加热过程中可能会局部碳化,使溶液变黑;3、安装仪器的顺序是从下到上,从左到右;十字头应口向上;4、由于反应中环己烯与水形成共沸物沸点℃,含水l0%;环己醇也能与水形成共沸物沸点℃,含水80%;因比在加热时温度不可过高,蒸馏速度不宜太快,以减少末作用的环己醇蒸出;文献要求柱顶控制在73℃左右,但反应速度太慢;本实验为了加快蒸出的速度,可控制在90℃以下;5、反应终点的判断可参考以下几个参数:1反应进行40min左右;2分馏出的环己烯和水的共沸物达到理论计算量;3反应烧瓶中出现白雾;4柱顶温度下降后又升到85℃以上;6、洗涤分水时,水层应尽可能分离完全,否则将增加无水氯化钙的用量,使产物更多地被干燥剂吸附而招致损失;这里用无水氯化钙干燥较适合,因它还可除去少量环己醇;无水氯化钙的用量视粗产品中的含水量而定,一般干燥时间应在半个小时以上,最好干燥过夜;但由于时间关系,实际实验过程中,可能干燥时间不够,这样在最后蒸馏时,可能会有较多的前馏分环己烯和水的共沸物蒸出;7、在蒸馏已干燥的产物时,蒸馏所用仪器都应充分干燥;接收产品的三角瓶应事先称重;8、一般蒸馏都要加沸石;9、最好用简易空气浴,使蒸馏时受热均匀;由于反应中环己烯与水形成共沸物沸点℃,含水l0%;环己醇与环己烯形成共沸物沸点℃,含环己醇%;环己醇与水形成共沸物沸点℃,含水80%;因比在加热时温度不可过高,蒸馏速度不宜太快;以减少末作用的环己醇蒸出;10、水层应尽可能分离完全,否则将增加无水氯化钙的用量,使产物更多地被干燥剂吸附而招致损失,这里用无水氯化钙干燥较适合,因它还可除往少量环己醇;思考题1、在纯化环己烯时,用等体积的饱和食盐水洗涤,而不用水洗涤,目的何在答:在纯化有机物时,常用饱和食盐水洗涤,而不用水直接洗涤是利用其盐析效应,可降低有机物在水中的溶解度,并能加快水、油的分层;2、本实验提高产率的措施是什么答:本实验主反应为可逆反应,提高反应采取的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物,并控制柱顶温度不超过90℃;3、实验中,为什么要控制柱顶温度不超过90℃答:由于环己烯和水形成的二元共沸物含水10%沸点是℃,而原料环己醇也能和水形成二元共沸物沸点℃,含水80%;为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃;4、本实验用磷酸作催化剂比用硫酸作催化剂好在哪里答:采用硫酸作催化剂虽然反应速度较快,但由于硫酸的氧化性比磷酸强,反应时部分原料会被氧化、甚至碳化,使溶液颜色加深,产率有所降低;此外,反应时会有少量SO2气化放出;在纯化时,需要碱洗,增加了纯化步骤;5、蒸馏时,加入沸石的目的是什么答:沸石就是未上釉的瓷片敲碎而成的小粒;它上面有很多毛细孔,当液体加热时,能产生细小的气泡,成为沸腾中心;这样可以防止液体加热时产生过热现象,防止暴沸,使沸腾保持平稳; 一般加热回流、蒸馏、分馏、水蒸汽发生器产生水蒸汽都需要加沸石;但减压蒸馏、水蒸气蒸馏、电动搅拌反应不需要加沸石; 在一次持续蒸馏时,沸石一直有效;一旦中途停止沸腾或蒸馏,原有沸石即失效,再次加热蒸馏时,应补加新沸石;如果事先忘了加沸石,决不能在液体加热到沸腾时补加;因为这样会引起剧烈暴沸,使液体冲出瓶外,还容易发生着火事故;故应该在冷却一段时间后再补加;6、使用分液漏斗有哪些注意事项答:使用分液漏斗洗涤和萃取时,有以下注意事项:1分液漏斗在长期放置时,为防止盖子的旋塞粘接在一起,一般都衬有一层纸;使用前,要先去掉衬纸,检查盖子和旋塞是否漏水;如果漏水,应涂凡士林后,再检验,直到不漏才能用;涂凡士林时,应在旋塞上涂薄薄一层,插上旋转几周;但孔的周围不能涂,以免堵塞孔洞;2萃取时要充分振摇,注意正确的操作姿势和方法;3振摇时,往往会有气体产生,要及时放气;4分液时,下层液体应从旋塞放出,上层液体应从上口倒出;5分液时,先把顶上的盖子打开,或旋转盖子,使盖子上的凹缝或小孔对准漏斗上口颈部的小孔,以便与大气相通;6在萃取和分液时,上下两层液体都应该保留到实验完毕;以防止操作失误时,能够补救;7分液漏斗用毕,要洗净,将盖子和旋塞分别用纸条衬好;7、用无水氯化钙干燥有哪些注意事项答:1一般要在干燥的小锥形瓶中进行干燥;2一般用块状的无水氯化钙进行干燥,便于后面的分离;3用无水氯化钙干燥的时间一般要在半个小时以上,并不时摇动;但实际实验中,由于时间关系,只能干燥5-10分钟;因此,水是没有除净的,在最后蒸馏时,会有较多的前馏分环己烯和水的共沸物蒸出;8、查药品物理常数的途径有哪些答:在进行或设计一个有机合成实验之前,必须首先弄清楚反应物料和生成物的物理常数,这样在反应、分离纯化时,才能设计出合理的工艺路线,操作时才能做到心中有数;通常查找物理常数有四个途径:1在教材书中,每一章的物理性质都列出了一些常见化合物的物理常数;另外,在多数实验教材书的附表中,也列有一些常见溶剂和物料物理常数;2在图书馆中,查阅相关的手册;主要查阅有机化合物手册、有机合成手册、化学手册、物理化学手册等;3在网上查找,有些网站和化学品电子手册专门提供物理常数; 4在实验室的试剂瓶上,一般都列有主要物理性质的常数;9、当浓硫酸与环己醇混合时,为什么要充分摇匀答:浓硫酸与环己醇混合时应要充分摇匀,以免加热时使环己醇局部炭;10、如果经干燥后蒸出的环己烯仍然浑浊,是何原因答:用无水氯化钙干燥的时间一般要在半个小时以上,并不时摇动;但实际实验中,由于时间关系,只能干燥 5~10 分钟;因此,水可能没有除净的,在最后蒸馏时,会有较多的前馏分环己烯和水的共沸物蒸出,蒸出的环己烯会仍然浑浊;另外如果粗制品的最后一步蒸馏所用的仪器不干燥或干燥不彻底,则蒸出的产品将浑浊;11、为什么蒸馏粗环已烯的装置要完全干燥答:因为环已烯可以和水形成二元共沸物,如果蒸馏装置没有充分干燥而带水,在蒸馏的时候可能因为形成共沸物使前馏份增多而降低产率;12、用最简单的方法来证明最后得到的产品是环己烯答:1.取少量产品,向其中滴加溴的四氯化碳溶液,若红棕色褪去,说明产品是环己烯;2.取少量的产品,向其中滴加冷的稀高锰酸钾碱性溶液,若高锰酸钾的紫色消失,说明产品是环己烯;。
共沸精馏分离2-甲基吡啶和水

2017年第36卷第9期 CHEMICAL INDUSTRY AND ENGINEERING PROGRESS·3243·化 工 进展共沸精馏分离2-甲基吡啶和水杨颖,范开功,白鹏,郭翔海(天津大学化工学院,天津 300350)摘要:采用共沸精馏的方法分离2-甲基吡啶和水二元均相共沸物系。
选取环己烷作为共沸剂,利用流程模拟软件Aspen Plus 对共沸精馏塔进行模拟计算,分析了不同共沸剂用量、塔底采出量以及进料位置等操作参数对产品纯度、共沸剂的损失量以及精馏塔热负荷的影响,模拟结果表明当精馏塔的塔板数为21,共沸剂的用量为3600kg/h ,塔底采出量为888kg/h ,原料进料位置在第15块板时,共沸精馏塔塔底可得到质量分数为99.54% 的2-甲基吡啶,塔顶分相罐下层可采出质量分数为99.97% 的水。
最后,通过间歇共沸精馏实验对以环己烷为共沸剂分离2-甲基吡啶-水物系的效果进行检验,结果表明共沸精馏塔塔底2-甲基吡啶的质量分数达99.85%,塔顶水相可采出质量分数达99.96%的水,证明了该工艺路线具有良好的可行性。
关键词:2-甲基吡啶;水;环己烷;共沸精馏;模拟中图分类号:TQ028 文献标志码:A 文章编号:1000–6613(2017)09–3243–07 DOI :10.16085/j.issn.1000-6613.2016-2065Separation of the binary system with 2-mehtylpyridine and water byazeotropic distillationYANG Ying ,F AN Kaigong ,BAI Peng ,GUO Xianghai(School of Chemical Engineering and Technology ,Tianjin University ,Tianjin 300350,China )Abstract :Azeotropic distillation was used to separate 2-methylpyridine and water azeotropic mixture. First ,cyclohexane was chosen as the azeotropic entrainer. Second ,Aspen Plus were used to simulate the continuous azotropic distillation process. The effects of entrainer flow rate and output quantity at the bottom and feed location on the product purity and heat duty were analyzed to get the optimal operation parameters. The result indicated that when the theoretical stage number was 21,the entrainer flow rate was 3600kg/h ,the output quantity at the bottom was 888kg/h ,and the feed location was 15,the purity of 2-methylpyridine and water can achieve as 99.54% and 99.97%,respectively. Finally ,in order to investigate the effectiveness of the solvent ,the batch azeotropic distillation experiments were carried out. The results showed that the purity of 2-methylpyridine and water can achieve as 99.85% and 99.96%,respectively ,which revealed that cyclohexane was an ideal azeotropic agent and the azeotropic distillation was useful in the separation of 2-methylpyridine and water system. Key words :2-methylpyridine ;water ;cyclohexane ;azeotropic distillation ;simulation2-甲基吡啶,化学式C 6H 7N ,相对分子质量93.13,常温常压下是一种具有强烈不愉快吡啶气味的无色油状液体。
共沸以及溶剂共沸参数

共沸(Azeotrope)两种(或几种)液体形成的恒沸点混合物称为共沸混合物是指处于平衡状态下,气相和液相组成完全相同时的混合溶液。
对应的温度称为共沸温度或共沸点。
与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/% 溶剂沸点/℃共沸点/℃含水量/% 氯仿61.2 56.1 2.5 甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0 正丙醇 97.2 87.7 28.8苯80.4 69.2 8.8 异丁醇 108.4 89.9 88.2丙稀腈78.0 70.0 13.0 二甲苯137-40.5 92.0 37.5二氯乙烷 83.7 72.0 19.5 正丁醇 117.7 92.2 37.5乙睛82.0 76.0 16.0 吡啶115.5 94.0 42乙醇78.3 78.1 4.4 异戊醇 131.0 95.1 49.6乙酸乙酯 77.1 70.4 8.0 正戊醇 138.3 95.4 44.7异丙醇82.4 80.4 12.1 氯乙醇 129.0 97.8 59.0乙醚35 34 1.0 二硫化碳46 44 2.0甲酸101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9。
环己烯的制备(1)

环己烯的制备一、实验目的1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
二、实验原理OH+ H 2O OH2+ H 2O主反应副反应主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。
但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。
为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离。
详细的原理参见P88-89。
三、实验药品及物理常数四、实验装置图圆底烧瓶刺形分馏柱温度计直形冷凝管接引管锥形瓶蒸馏头水浴温度计直形冷凝管接引管锥形瓶图1 反应装置图2 蒸馏装置图3 分液漏斗五、实验流程图10ml5ml85%80-85度馏分H 3PO六、实验步骤在50毫升干燥的圆底(或茄形)烧瓶中,放入10ml 环己醇(9.6g ,0.096mol)、5ml85%磷酸,充分振摇、混合均匀。
投入几粒沸石,按图1安装反应装置,用锥形瓶作接受器。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上端的温度不要超过90℃,馏出液为带水的混合物。
当烧瓶中只剩下很少量的残液并出现阵阵白雾时,即可停止蒸馏。
全部蒸馏时间约需40min 。
将蒸馏液分去水层,加入等体积的饱和食盐水,充分振摇后静止分层,分去水层(洗涤微量的酸,产品在哪一层?)。
将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒入干燥的小锥形瓶中,加入1-2克无水氯化钙干燥。
常用有机溶剂性质

常用有机溶剂物理性质*CC-Closed Cup:闪点试验用闭杯misc-soluble in all proportions(miscible):可混溶的aq-aqueous, water:水alc-alcohol (ethanol usually):乙醇bz-benzene:苯eth-diethyl ether:二乙醚chl-chloroform:氯仿acet-acetone:丙酮PE- petroleum ether:石油醚s- soluble:可溶的常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0 乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4 乙醇-四氯化碳78.3,77.0 16:84 64.9 乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0 甲醇-四氯化碳64.7,77.0 21:79 55.7 甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9实验室常用酸、碱的浓度试剂名称密度(20℃)g/ml 浓度mol/L 质量分数浓硫酸 1.84 18.0 0.960浓盐酸 1.19 12.1 0.372浓硝酸 1.42 15.9 0.704磷酸 1.70 14.8 0.855冰醋酸 1.05 17.45 0.998浓氨水0.90 14.53 0.566 浓氢氧化钠 1.54 19.4 0.505常用显色剂及配制方法1、碘:不饱和或者芳香族化合物【配制方法:在100ml广口瓶中,放入一张滤纸,少许碘粒。
或者在瓶中,加入10g碘粒,30g硅胶2、紫外灯:含共厄基团的化合物,芳香化合物3、硫酸铈:生物碱【配制方法:10%硫酸铈(IV)+15%硫酸的水溶液4、氯化铁:苯酚类化合物【配制方法:1% FeCl3 + 50% 乙醇水溶液.5、桑色素(羟基黄酮):广谱, 有荧光活性【配制方法:0.1% 桑色素+甲醇6、茚三酮:氨基酸【配制方法:1.5g 茚三酮+ 100ml正丁醇+ 3.0ml 醋酸7、二硝基苯肼(DNP):醛和酮【配制方法:12g二硝基苯肼+60ml浓硫酸+80ml水+200ml乙醇8、香草醛(香兰素):广谱【配制方法:15g 香草醛+ 250ml 乙醇+2.5ml 浓硫酸9、高锰酸钾:含还原性基团化合物,比如羟基,氨基,醛【配制方法:1.5g KMnO4 + 10g K2CO3 + 1.25ml 10% NaOH + 200ml 水(使用期3个月)10、溴甲酚绿:羧酸,pKa<=5.0【配制方法:在100ml乙醇中,加入0.04g溴甲酚绿,缓慢滴加0.1M的NaOH水溶液,刚好出现蓝色即至。
混合萃取剂萃取精馏分离四氢呋喃-乙醇-水二元共沸物

山 东 化 工 收稿日期:2020-04-22作者简介:李小平(1968—),山东青岛人,工程师,本科,研究方向为环保管理。
混合萃取剂萃取精馏分离四氢呋喃-乙醇-水二元共沸物李小平1,赵永滕2(1.中国石油化工股份有限公司齐鲁分公司,山东淄博 255408;2.青岛科技大学化工学院,山东青岛 266042)摘要:本文探究了混合萃取剂用于处理含三个二元共沸物的四氢呋喃-乙醇-水体系分离的三元萃取精馏工艺。
基于相对挥发度曲线,筛选出二甲基亚砜(DMSO)和乙二醇(EG)两种具有较好分离性能的单一萃取剂。
基于序贯迭代优化方法,以最小年总花费(TAC)为目标,对提出的使用混合萃取剂的分离工艺进行了参数优化,进而确定了最优的混合萃取剂组成(60%DMSO+40%EG)。
结果表明,混合萃取剂的使用可以通过调整两个萃取精馏塔的分离表现来权衡两个萃取精馏塔能耗,故而其具有更好的经济性表现。
关键词:萃取精馏;混合萃取剂;年总花费;共沸物中图分类号:TQ028.3 文献标识码:A 文章编号:1008-021X(2020)12-0034-05SeparationofTetrahydrofuran-Ethanol-WaterBinaryAzeotropebyExtractiveDistillationwithMixedSolventLiXiaoping1,ZhaoYongteng2(1.SinopecQiluPetrochemicalCompany,Zibo 255408,China;2.QingdaoUniversityofScienceandTechnology,Qingdao 266042,China)Abstract:Aternaryextractivedistillationprocessfortheseparationoftetrahydrofuran-ethanol-watersystemcontainingthreebinaryazeotropewasinvestigated.Basedontherelativevolatilizationcurve,twosinglesolventswithgoodseparationperformance,dimethylsulfoxide(DMSO)andethyleneglycol(EG),werescreenedout.Usingthesequentialiterativeoptimizationmethodandtakingtheminimumtotalannualcost(TAC)astheobjectivefunction,theparametersoftheseparationprocesswasoptimized,soastodeterminetheoptimalcompositionofthemixedsolvent(60%DMSO+40%EG).Theresultsshowthatthemixedsolventcanbalancetheenergyconsumptionoftheprocessbyadjustingtheseparationperformanceofthetwoextractivedistillationcolumns,whichisthereasonforitsbettereconomicperformance.Keywords:extractivedistillation;mixedsolvent;totalannualcost;azeotrope1 研究背景四氢呋喃(THF)和乙醇是化学和制药工业中常用的有机溶剂。
环己烯的制备及其思考题

环己烯的制备【实验目的】1、学习、掌握由环己醇制备环己烯的原理及方法。
2、了解分馏的原理及实验操作。
3、练习并掌握蒸馏、分液、干燥等实验操作方法。
【实验原理】主反应为可逆反应,本实验采用的措施是:边反应边蒸出反应生成的环己烯和水形成的二元共沸物(沸点70.8℃,含水10%)。
但是原料环己醇也能和水形成二元共沸物(沸点97.8℃,含水80%)。
为了使产物以共沸物的形式蒸出反应体系,而又不夹带原料环己醇,本实验采用分馏装置,并控制柱顶温度不超过90℃。
反应采用85%的磷酸为催化剂,而不用浓硫酸作催化剂,是因为磷酸氧化能力较硫酸弱得多,减少了氧化副反应。
分馏的原理就是让上升的蒸汽和下降的冷凝液在分馏柱中进行多次热交换,相当于在分馏柱中进行多次蒸馏,从而使低沸点的物质不断上升、被蒸出;高沸点的物质不断地被冷凝、下降、流回加热容器中;结果将沸点不同的物质分离【试剂】环己烯,浓硫酸,食盐,无水氯化钙,5%碳酸钠【实验步骤】在50毫升干燥的圆底烧瓶中,放进15g环己烯(15.6ml,0.15mol)、1ml浓硫酸和几粒沸石,充分振摇使混合均匀。
烧瓶上装一短的分馏柱作分馏装置,接上冷凝管,用锥形瓶作接受器,外用冰水冷却。
将烧瓶在石棉网上用小火慢慢加热,控制加热速度使分馏柱上真个温度不要超过90℃,馏液为带水的混合物。
当烧瓶中只剩下很少量的残渣并出现阵阵白雾时,即可停止蒸馏。
全部蒸馏时间约需1h。
将蒸馏液用精盐饱和,然后加进3—4ml 5%碳酸钠溶液中和微量的酸。
将此液体倒进小分液漏斗中,振摇后静置分层。
将下层水溶液自漏斗下端活塞放出、上层的粗产物自漏斗的上口倒进干燥的小锥形瓶中,加进1-2克无水氯化钙干燥。
将干燥后的产物滤进干燥的蒸馏瓶中,加进沸石后用水浴加热蒸馏。
收集80-85℃的馏分于一已称重的干燥小锥形瓶中。
产率7-8g。
【注意事项】1、环己醇在常温下是粘碉状液体,因而若用量筒量取时应注意转移中的损失。
所以,取样时,最好先取环己醇,后取硫酸。
有机化学常用操作介绍

常见有机溶剂间的共沸混合物压力单位换算表注:毫米水柱是指4摄氏度状态的水柱高度,毫米汞柱是指0摄氏度状态的水柱高度。
实验室常用酸、碱的浓度试剂名称密度(20℃)g/ml 浓度mol/L 质量分数浓硫酸 1.84 18.0 0.960 浓盐酸 1.19 12.1 0.372 浓硝酸 1.42 15.9 0.704 磷酸 1.70 14.8 0.855 冰醋酸 1.05 17.45 0.998 浓氨水0.90 14.53 0.566 浓氢氧化钠 1.54 19.4 0.505一些溶剂与水形成的二元共沸物用于有机溶剂的中等强度的干燥剂有机化合物的鉴别在药品的生产、研究及检验等过程中,常常会遇到有机化合物的分离、提纯和鉴别等问题。
有机化合物的鉴别、分离和提纯是三个既有关联而又不相同的概念。
分离和提纯的目的都是由混合物得到纯净物,但要求不同,处理方法也不同。
分离是将混合物中的各个组分一一分开。
在分离过程中常常将混合物中的某一组分通过化学反应转变成新的化合物,分离后还要将其还原为原来的化合物。
提纯有两种情况,一是设法将杂质转化为所需的化合物,另一种情况是把杂质通过适当的化学反应转变为另外一种化合物将其分离(分离后的化合物不必再还原)。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。
如鉴别一组化合物,就是分别确定各是哪种化合物即可。
在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:(1)化学反应中有颜色变化(2)化学反应过程中伴随着明显的温度变化(放热或吸热)(3)反应产物有气体产生(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
本课程要求掌握的重点是化合物的鉴别,为了帮助大家学习和记忆,将各类有机化合物的鉴别方法进行归纳总结,并对典型例题进行解析。
一.各类化合物的鉴别方法1.烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去(2)高锰酸钾溶液,紫色腿去。
乙腈-水的变压精馏分离模拟与优化

乙腈-水的变压精馏分离模拟与优化杨倩;王彩琴【摘要】利用乙腈-水体系在不同压力下共沸点有较大的变化特性,采用变压精馏对该物系进行高纯度的分离研究.基于Aspen Plus流程模拟软件,采用WILSON物性方程进行模拟,模拟结果表明:在0.35 MPa和0.101 MPa下,共沸点组成变化为8%;采用高压塔和低压塔工艺,可以有效分离,得到纯度较高的乙腈与水,其中高压塔塔板数30,进料位置15,回流比为1,采出率为0.199;低压塔塔板数24,进料位置第10块板,回流比0.2.%Pressure swing distillation was used for the separation of acetonitrile and water since the azeotropic point of the system varies with pressure. Based on Aspen Plus simulation software , using the WILSON physical equation to simulate, the results showed:the composition of azeotrope changed to 8%due to the pressure changed from 0.35 MPa to 0.101 MPa. So the process of high pressure tower (HP) and low pressure tower (LP) was taken into consideration, which could get a higher purity of acetonitrile and water. For HP tower,30 of theoretical plate numbers, 15th of the feeding plate and 1 of reflux ratio, in which the bottom rate of the feed ratio was 0.199. For LP tower , the plate numbers were 24 with the feed position 10th plate in the reflux ratio of 0.2.【期刊名称】《浙江化工》【年(卷),期】2018(049)005【总页数】4页(P28-31)【关键词】变压精馏;流程模拟;共沸;回流比【作者】杨倩;王彩琴【作者单位】陕西能源职业技术学院, 陕西咸阳 712099;陕西能源职业技术学院,陕西咸阳 712099【正文语种】中文0 引言乙腈是优良的有机溶剂,能溶解多种有机、无机和气体物质,能发生典型的腈类反应,是重要的有机合成中间体;此外,在织物染色、照明、香料制造及感光材料制造中也有许多用途[1]。
