常见的共沸混合物的组成及共沸点
乙酸和水的共沸物组成

乙酸和水可以形成共沸物,即在一定温度下以特定比例混合后共同沸腾。
这种混合物的组成取决于其蒸汽压-组成图。
在常压下,乙酸和水的共沸组成为约为97.2% 乙酸和 2.8% 水。
这意味着当乙酸和水按照这个比例混合后,它们会在共沸点(约为118.1摄氏度)时同时转变为气态。
需要注意的是,乙酸和水的共沸组成并不是固定不变的,而是随着温度的变化而改变。
因此,在不同的温度下,共沸组成也会有所不同。
以上给出的组成是在常压下的一个近似值。
请注意,乙酸是一种有毒挥发性液体,操作时需要小心,并遵循安全操作规程。
常见共沸物

常见有机溶剂间的共沸混合物压力单位换算表物Pa bar kgf atm at Tor mm mmH Ps质帕巴/cm2r H2O g1 Pa 帕10.000010.000010.000010.000010.00750.101970.00750.00141 bar巴10000011.019720.98691.01972750.06210.1972750.062145041kg f/cm298066.50.9806710.967811735.610.000735.614221 tm标准大气压1013251.013251.0331 76010.3327601471 at 工程大气压980670.98067110.96781735.610.000735.614221To rr 托133.30.001330.001360.001320.00136113.610.1934H2O mm毫米水柱9.80670.0000980.00010.00009680.00010.0735610.073560.01421 mmHg毫米汞柱133.3220.001330.001360.001320.00136113.595110.19341 6890.060.00.0680.051.70351.1Psi磅/4.76 895 7031 05 7031 7149 .07 7149寸2注:毫米水柱是指4摄氏度状态的水柱高度,毫米汞柱是指0摄氏度状态的水柱高度。
实验室常用酸、碱的浓度试剂名称密度(20℃)g/ml浓度mol/L质量分数浓硫酸 1.84 18.0 0.960 浓盐酸 1.19 12.1 0.372 浓硝酸 1.42 15.9 0.704 磷酸 1.70 14.8 0.855 冰醋酸 1.05 17.45 0.998 浓氨水0.90 14.53 0.566 浓氢氧化钠1.54 19.4 0.505一些溶剂与水形成的二元共沸物用于有机溶剂的中等强度的干燥剂有机化合物的鉴别在药品的生产、研究及检验等过程中,常常会遇到有机化合物的分离、提纯和鉴别等问题。
常见共沸混合物

8月28日常见共沸混合物近期想低温下蒸出DMF,于是想共沸的方式,但没找到很好的共沸体系.下面是一些常见共沸体系.(a)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃ 共沸点/℃ 含水量/% 溶剂沸点/℃ 共沸点/℃ 含水量/%氯仿 61.2 56.1 2.5 甲苯 110.5 85.0 20四氯化碳 77.0 66.0 4.0 正丙醇 97.2 87.7 28.8苯 80.4 69.2 8.8 异丁醇 108.4 89.9 88.2丙稀腈 78.0 70.0 13.0 二甲苯 137-40.5 92.0 37.5二氯乙烷 83.7 72.0 19.5 正丁醇 117.7 92.2 37.5乙睛 82.0 76.0 16.0 吡啶 115.5 94.0 42乙醇 78.3 78.1 4.4 异戊醇 131.0 95.1 49.6乙酸乙酯 77.1 70.4 8.0 正戊醇 138.3 95.4 44.7异丙醇 82.4 80.4 12.1 氯乙醇 129.0 97.8 59.0乙醚 35 34 1.0 二硫化碳 46 44 2.0甲酸 101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃ 共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯 78.3,78.0 30:70 72.0乙醇-苯 78.3,80.6 32:68 68.2乙醇-氯仿 78.3,61.2 7:93 59.4乙醇-四氯化碳 78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳 78.0,77.0 43:57 75.0甲醇-四氯化碳 64.7,77.0 21:79 55.7甲醇-苯 64.7,80.4 39:61 48.3氯仿-丙酮 61.2,56.4 80:20 64.7甲苯-乙酸 101.5,118.5 72:28 105.4乙醇-苯-水 78.3,80.6,100 19:74:7 64.9共沸的二个溶剂间沸点不要相差太大,这可能是经验之说.。
常见的共沸物

常见的共沸物共沸物组分的沸点(度) 组成(w/w) 共沸点(度)水--乙醇 100--78、5 5--95 78、15水--正丙醇--97、2 28、8--71、2 87、7 水--异丙醇--82、4 12、1--87、9 80、4 水--正丁醇--117、7 37、5--62、5 92、2 水--异丁醇--108、4 30、2--69、8 89、9 水--叔丁醇--82、5 11、8--88、2 79、9 水--异戊醇--131、0 49、6--50、4 95、1 水--正戊醇--138、3 44、7--55、3 95、4 水--氯乙醇--129、0 59、0--41、0 97、8 水--乙醚--35 1、0--99、0 34水--乙腈--81、5 14、2--85、8 76水--丙烯腈--78、0 13、0--87 70、0 水--甲酸--101 26--74 107水--丙酸--141、4 82、2--17、8 99、1水--乙酸乙酯--78 9、0--91 70水--二氧六环--101、3 18--82 87、8水--氯仿--61、2 2、5--97、5 56、1 水--四氯化碳--77、0 4、0--96 66、0 水--二氯乙烷--83、7 19、5--80、5 72、0 水--苯--80、4 8、8--91、2 69、2 水--甲苯--110、5 20--80 85、0 水--二甲苯--137-140、5 37、5--62、5 92、0 水--吡啶--115、5 42--58 94、0水--二硫化碳--46 2、0--98、0 44甲醇--二氯甲烷 64、7--41 7、3--92、7 37、8 甲醇--氯仿--56、2 12--88 55、5甲醇--四氯化碳--77、0 21--79 55、7甲醇--丙酮--56、2 12--88 55、5甲醇--苯--80、6 39、1--60、9 57、6 甲醇/甲酸甲酯/环己烷 17、8/48、6/33、6 50、8乙醇--乙酸乙酯 78、3--78、0 30--70 72、0乙醇--苯--80、6 32--68 68、2乙醇--氯仿--61、2 7--93 59、4乙醇--四氯化碳--77、0 16--84 65、1乙醇/苯/水78、3/80、6/100 19/74/7 64、9乙酸乙酯--四氯化碳78、0--77、0 43--57 75、0乙酸乙酯--环己烷 46--54 71、6乙酸甲酯--环己烷83--17 54、9氯仿--丙酮 61、2--56、4 80--20 64、7甲苯--乙酸 101、5--118、5 72--28 105、4请问有什么方法把甲醇与水分开得到99以及的甲醇,直接精馏可以不可以,我给山东寿光做过一台甲醇精馏塔,可以做到塔底连续出甲醇含量不大于0、1%,塔顶连续出甲醇含量大于99、9%以上的,属于连续精馏塔,连续进料,塔径根据您的处理量而定,联系方式:,,华东理工大学徐承中课题名称:低能耗制备无水乙醇工艺条件探索申请人:徐承中职称:高工核定所需学生数:3课题完成时间:2008、12实验室:实验十楼224联系人:徐承中联系电话:联系地址:华东理工大学实验十楼220课题背景:无水乙醇常用于工业有机合成,就是许多化工产品的基本原料,使用量很大。
异丙醇和水的共沸点

异丙醇和水的共沸点
摘要:
1.异丙醇的沸点
2.异丙醇与水共沸点的概念
3.异丙醇与水在不同比例混合下的共沸点
4.利用共沸物浓缩组分或干燥除水的方法
5.计算异丙醇沸点的方法
正文:
异丙醇是一种常见的有机化合物,具有较低的沸点。
在水中,异丙醇的沸点为82.4 度。
当异丙醇与水混合时,它们会在一个大气压下形成共沸物。
共沸物是指两种或多种物质在一个特定的温度和压力下同时蒸发的物质。
异丙醇与水在不同比例混合下的共沸点是80.4 度。
共沸物中含有12.1% 的水。
这意味着无论初始混合物的比例是多少,它们的共沸点都是80.4 度。
在蒸馏过程中,蒸出的气体中含有87.9% 的异丙醇。
因此,可以利用共沸物来浓缩异丙醇或干燥除水。
计算异丙醇沸点的方法可以使用克劳修斯- 克拉佩龙方程积分式。
该公式为:ln(p2p1)Hm(1T2-1T1)R。
其中P1 为常压,0.1MPa,P2 为给定压力,T1 为常压下沸点,T2 为所求沸点。
异丙醇的蒸气压(Pa):92232(80);38463(60);1187(0)。
通过这个公式,可以计算出异丙醇的沸点。
总之,异丙醇与水共沸点的概念以及它们在不同比例混合下的共沸点具有
重要意义。
常见的共沸混合物的组成及共沸点
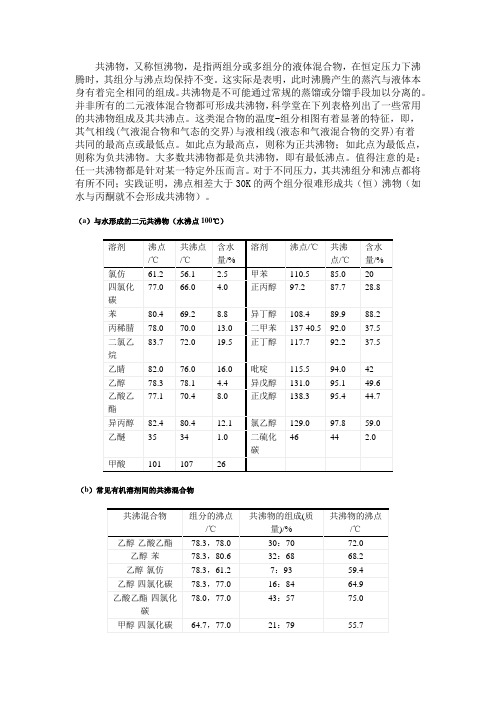
共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。
大多数共沸物都是负共沸物,即有最低沸点。
值得注意的是:任一共沸物都是针对某一特定外压而言。
对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。
(a)与水形成的二元共沸物(水沸点100℃)(b)常见有机溶剂间的共沸混合物常见的共沸物共沸物组分的沸点(度)组成(w/w) 共沸点(度)水--乙醇 100--78.5 5--95 78.15水--正丙醇--97.2 28.8--71.2 87.7水--异丙醇--82.4 12.1--87.9 80.4水--正丁醇--117.7 37.5--62.5 92.2水--异丁醇--108.4 30.2--69.8 89.9水--叔丁醇--82.5 11.8--88.2 79.9水--异戊醇--131.0 49.6--50.4 95.1水--正戊醇--138.3 44.7--55.3 95.4水--氯乙醇--129.0 59.0--41.0 97.8水--乙醚--35 1.0--99.0 34水--乙腈--81.5 14.2--85.8 76水--丙烯腈--78.0 13.0--87 70.0水--甲酸--101 26--74 107水--丙酸--141.4 82.2--17.8 99.1水--乙酸乙酯--78 9.0--91 70水--二氧六环--101.3 18--82 87.8水--氯仿--61.2 2.5--97.5 56.1水--四氯化碳--77.0 4.0--96 66.0水--二氯乙烷--83.7 19.5--80.5 72.0水--苯--80.4 8.8--91.2 69.2水--甲苯--110.5 20--80 85.0水--二甲苯--137-140.5 37.5--62.5 92.0水--吡啶--115.5 42--58 94.0水--二硫化碳--46 2.0--98.0 44甲醇--二氯甲烷 64.7--41 7.3--92.7 37.8甲醇--氯仿--56.2 12--88 55.5甲醇--四氯化碳--77.0 21--79 55.7甲醇--丙酮--56.2 12--88 55.5甲醇--苯--80.6 39.1--60.9 57.6甲醇/甲酸甲酯/环己烷 17.8/48.6/33.6 50.8乙醇--乙酸乙酯 78.3--78.0 30--70 72.0乙醇--苯--80.6 32--68 68.2乙醇--氯仿--61.2 7--93 59.4乙醇--四氯化碳--77.0 16--84 65.1乙醇/苯/水78.3/80.6/100 19/74/7 64.9 乙酸乙酯--四氯化碳78.0--77.0 43--57 75.0乙酸乙酯--环己烷 46--54 71.6 乙酸甲酯--环己烷83--17 54.9 氯仿--丙酮 61.2--56.4 80--20 64.7 甲苯--乙酸 101.5--118.5 72--28 105.4。
dmso和水的共沸点

dmso和水的共沸点摘要:1.介绍DMSO和水的共沸点的基本概念2.解释DMSO和水的共沸点的形成原因3.描述DMSO和水的共沸点在实际应用中的重要性4.总结DMSO和水的共沸点的研究现状和未来发展趋势正文:DMSO(二甲基亚砜)是一种常见的极性溶剂,广泛应用于化学、生物学和医学领域。
在实际应用中,DMSO经常与水混合使用,因为它们可以形成一种特殊的共沸物。
这种共沸物具有较高的沸点,有利于保持混合物的稳定性。
本文将详细介绍DMSO和水的共沸点的基本概念、形成原因、实际应用及其研究现状。
一、DMSO和水的共沸点的基本概念DMSO和水的共沸点是指在一定压力下,DMSO和水混合物同时沸腾的温度。
由于DMSO和水具有不同的沸点(DMSO的沸点为189.6°C,水的沸点为100°C),在正常情况下它们不会同时沸腾。
然而,当它们混合在一起时,它们可以形成一种特殊的共沸物,使混合物的沸点显著提高。
二、DMSO和水的共沸点的形成原因DMSO和水的共沸点的形成主要归因于氢键。
当DMSO和水混合时,它们的分子间会发生氢键作用。
氢键是一种较强的分子间相互作用力,可以显著提高混合物的沸点。
由于DMSO和水可以形成大量的氢键,它们的混合物的沸点通常高于任一组成成分的沸点。
三、DMSO和水的共沸点在实际应用中的重要性DMSO和水的共沸点在实际应用中具有重要意义。
首先,共沸点混合物可以提高药物和其他化合物的溶解度,从而提高其生物利用度和药效。
其次,共沸点混合物可以作为反应介质,在化学反应中起到稳定作用。
此外,共沸点混合物还可以用于提取、纯化和浓缩等过程。
四、DMSO和水的共沸点的研究现状和未来发展趋势近年来,关于DMSO和水的共沸点的研究取得了很多进展。
研究人员已经揭示了共沸点的形成机制,并开发了多种方法来调控共沸点混合物的性质。
然而,关于共沸点的应用仍然存在一些挑战,如如何实现对共沸点混合物的精确控制等。
实验室常见有机溶剂间的共沸混合物

昂常见有机溶剂间的共沸混合物来源:有机化学网作者:chemfei共沸物的沸点/℃共沸混合物组分的沸点/℃共沸物的组成(质量)/%乙醇-乙酸乙酯78.3,78.030:7072.0乙醇-苯78.3,80.632:6868.2乙醇-氯仿78.3,61.27:9359.4乙醇-四氯化碳78.3,77.016:8464.9乙酸乙酯-四氯化碳78.0,77.043:5775.0甲醇-四氯化碳64.7,77.021:7955.7甲醇-苯64.7,80.439:6148.3氯仿-丙酮61.2,56.480:2064.7甲苯-乙酸101.5,118.572:28105.4乙醇-苯-水78.3,80.6,10019:74:764.9实验室常用酸、碱的浓度来源:有机化学网作者:chemfei试剂名称密度(20℃)g/ml浓度mol/L质量分数浓硫酸 1.8418.00.960浓盐酸 1.1912.10.372浓硝酸 1.4215.90.704磷酸 1.7014.80.855冰醋酸 1.0517.450.998浓氨水0.9014.530.566浓氢氧化钠 1.5419.40.505一些溶剂与水形成的二元共沸物来源:有机化学网作者:chemfei各种显色剂及其配制方法来源:有机化学网作者:admin碘:不饱和或者芳香族化合物配制方法在100ml广口瓶中,放入一张滤纸,少许碘粒。
或者在瓶中,加入10g碘粒,30g硅胶紫外灯含共厄基团的化合物,芳香化合物硫酸铈:生物碱配制方法10%硫酸铈(IV)+15%硫酸的水溶液氯化铁苯酚类化合物配制方法1% FeCl3 + 50% 乙醇水溶液.桑色素(羟基黄酮)广谱, 有荧光活性配制方法0.1% 桑色素+甲醇茚三酮氨基酸配制方法1.5g 茚三酮+ 100mL of 正丁醇+ 3.0mL 醋酸二硝基苯肼(DNP)醛和酮配制方法12g二硝基苯肼+ 60mL 浓硫酸+ 80mL 水+ 200mL 乙醇香草醛(香兰素)广谱配制方法15g 香草醛+ 250mL 乙醇+2.5mL 浓硫酸高锰酸钾含还原性基团化合物,比如羟基,氨基,醛配制方法1.5g KMnO4 + 10g K2CO3 + 1.25mL 10% NaOH + 200mL 水. 使用期3个月溴甲酚绿羧酸,pKa<=5.0配制方法在100ml乙醇中,加入0.04g溴甲酚绿,缓慢滴加0.1M的NaOH水溶液,刚好出现蓝色即至。
常见有机溶剂间的共沸混合物

沸点 /℃ 110.5 97.2 108.4 137-40.5 117.7 115.5 131.0 138.3 129.0 46
共沸点 /℃ 85.0 87.7 89.9 92.0 92.2 94.0 95.1 95.4 97.8 44
含水量 /% 20 28.8 88.2 37.5 37.5 42 49.6 44.7 59.0 2.0
甲醇-苯 氯仿-丙酮 甲苯-乙酸 乙醇-苯-水
组分的沸点/℃ 78.3,78.0 78.3,80.6 78.3,61.2 78.3,77.0 78.0,77.0 64.7,77.0 64.7,80.4 61.2,56.4 101.5,118.5
78.3,80.6,100
共沸物的组成(质量)/% 30:70 32:68 7:93 16:84 43:57 21:79 39:61 80:20 72:28
共沸点 /℃ 56.1 66.0 69.2 70.0 72.0 76.0 78.1 70.4 80.4 34 107
含水量 /% 2.5 4.0 8.8 13.0 19.5 16.0 4.4 8.0 12.1 1.0 26
溶剂
甲苯 正丙醇 异丁醇 二甲苯 正丁醇 吡啶 异戊醇 正戊醇 氯乙醇 二硫化碳
/articles/open.asp?id=2202006-2-6 20:45:33
有机化学网-技术文章-常见有机溶剂间的共沸混合物
常见有机溶剂间的共沸混合物 来源:有机化学网 作者:chemfei
共沸混合物 乙醇-乙酸乙酯
乙醇-苯 乙醇-氯仿 乙醇-四氯化碳 乙酸乙酯-四氯化碳 甲醇-四氯化碳
有机化学网-技术文章-一些溶剂与水形成的二元共沸物
一些溶剂与水形成的二元共沸物 来源:有机化学网 作者:chemLeabharlann ei溶剂氯仿 四氯化碳
甲基环己烷与水共沸点及共沸组成

甲基环己烷与水共沸点及共沸组成下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!甲基环己烷与水的共沸点及共沸组成1. 引言甲基环己烷(Methylcyclohexane)与水的共沸现象是许多混合物研究中的重要课题。
常见溶剂共沸点

68.2 59.4 64.9
75 55.7 48.3 64.7 105.4 64.9 71.6 66.2 54.9 59.4
65 68 72 53.4 37.8 65.05 50.8 51.1 53.9 77 57.5 58 76.5 79.9 56 56.4 78.2 56.4 63.2 57.5
常见有机溶剂共沸点
组分的沸点/℃ 78.3,78.0 78.3,80.6 78.3,61.2 78.3,77.0 78.0,77.0 64.7,77.0 64.7,80.4 61.2,56.4 101.5,118.5 78.3,80.6,100
共沸物的组成(质量)/% 30:70 32:68 0.35625 0.725 43:57:00 0.929861111 39:61 80:20:00 72:28:00 0.843136574 46.0-54.1 16.3-83.8 83.0-17.1 8.0-92.1 16.0-84.1 31.70-68.4 48.0-52.1 12.6-87.5 7.3-92.8 30.4-10.8-58.9 17.8-48.6-33.7 16.0-43.5-40.6 17.7-82.4 73.0-27.1 39.1-60.10 67.5-32.6 68.0-32.1 83.0-17.1 87.4-12.7 12.0-88.1 4.0-96.1 21.6-27.0-51.5 10.4-24.3-65.4 23.0-30.0-47.1
共沸混合物
乙醇-乙酸乙酯
乙醇-苯
乙醇-氯仿
乙醇-四氯化碳
乙酸乙酯-四氯化碳
甲醇-四氯化碳
甲醇-苯
氯仿-丙酮
甲苯-乙酸
乙醇-苯-水 乙酸乙酯-环己烷 异丙醇-二异丙醚 乙酸甲酯-环乙烷 乙醇-氯仿 乙醇-四氯化碳 乙醇-苯 乙醇-庚烷 甲醇-氯仿 甲醇-二氯甲烷 乙醇-苯-环己烷 甲醇-乙酸乙酯-环己烷 甲醇-丙酮-环己烷 甲醇-乙酸乙酯 丁酮-庚烷 甲醇-苯 丙酮-环己烷 乙醇-甲苯 丁酮-氯仿 丙酮-四氯化碳 甲醇-丙酮 水-乙醇 甲醇-乙酸甲酯-氯仿 乙醇-丙酮-氯仿 甲醇-丙酮-氯仿
常见溶剂共沸点

共沸混合物 乙醇-乙酸乙酯 乙醇-苯 乙醇-氯仿 乙醇-四氯化碳 乙酸乙酯-四氯化碳 甲醇-四氯化碳 甲醇-苯 氯仿-丙酮 甲苯-乙酸 乙醇-苯-水 组分的沸点/℃ 78.3,78.0 78.3,80.6 78.3,61.2 78.3,77.0 78.0,77.0 64.7,77.0 64.7,80.4 61.2,56.4 101.5,118.5 78.3,80.6,100 共沸物的组成(质量)/% 30:70 32:68 0.35625 0.725 43:57:00 0.929861111 39:61 80:20:00 72:28:00 0.843136574 共沸物的沸点/℃ 72 68.2 59.4 64.9 75 55.7 48.3 64.7 105.4 64.9
71.6 66.2 54.9 59.4 65 68 72 53.4 37.8 65.05 50.8 51.1 53.9 77 57.5 58 76.5 79.9 56 56.4 78.2 56.4 63.2 57.5
பைடு நூலகம்
乙酸乙酯-环己烷 异丙醇-二异丙醚 乙酸甲酯-环乙烷 乙醇-氯仿 乙醇-四氯化碳 乙醇-苯 乙醇-庚烷 甲醇-氯仿 甲醇-二氯甲烷 乙醇-苯-环己烷 甲醇-乙酸乙酯-环己烷 甲醇-丙酮-环己烷 甲醇-乙酸乙酯 丁酮-庚烷 甲醇-苯 丙酮-环己烷 乙醇-甲苯 丁酮-氯仿 丙酮-四氯化碳 甲醇-丙酮 水-乙醇 甲醇-乙酸甲酯-氯仿 乙醇-丙酮-氯仿 甲醇-丙酮-氯仿
46.0-54.1 16.3-83.8 83.0-17.1 8.0-92.1 16.0-84.1 31.70-68.4 48.0-52.1 12.6-87.5 7.3-92.8 30.4-10.8-58.9 17.8-48.6-33.7 16.0-43.5-40.6 17.7-82.4 73.0-27.1 39.1-60.10 67.5-32.6 68.0-32.1 83.0-17.1 87.4-12.7 12.0-88.1 4.0-96.1 21.6-27.0-51.5 10.4-24.3-65.4 23.0-30.0-47.1
水在不同压力下的沸点及常见的共沸物

常见的共沸物及水在不同压力下的沸点共沸物组分的沸点(度)组成(w/w) 共沸点(度)水--乙醇 100--78.5 5--95 78.15水--正丙醇--97.2 28.8--71.2 87.7水--异丙醇--82.4 12.1--87.9 80.4水--正丁醇--117.7 37.5--62.5 92.2水--异丁醇--108.4 30.2--69.8 89.9水--叔丁醇--82.5 11.8--88.2 79.9水--异戊醇--131.0 49.6--50.4 95.1水--正戊醇--138.3 44.7--55.3 95.4水--氯乙醇--129.0 59.0--41.0 97.8水--乙醚--35 1.0--99.0 34水--乙腈--81.5 14.2--85.8 76水--丙烯腈--78.0 13.0--87 70.0水--甲酸--101 26--74 107水--丙酸--141.4 82.2--17.8 99.1水--乙酸乙酯--78 9.0--91 70水--二氧六环--101.3 18--82 87.8水--氯仿--61.2 2.5--97.5 56.1水--四氯化碳--77.0 4.0--96 66.0水--二氯乙烷--83.7 19.5--80.5 72.0水--苯--80.4 8.8--91.2 69.2水--甲苯--110.5 20--80 85.0水--二甲苯--137-140.5 37.5--62.5 92.0水--吡啶--115.5 42--58 94.0水--二硫化碳--46 2.0--98.0 44甲醇--二氯甲烷 64.7--41 7.3--92.7 37.8甲醇--氯仿--56.2 12--88 55.5甲醇--四氯化碳--77.0 21--79 55.7甲醇--丙酮--56.2 12--88 55.5甲醇--苯--80.6 39.1--60.9 57.6甲醇/甲酸甲酯/环己烷 17.8/48.6/33.6 50.8乙醇--乙酸乙酯 78.3--78.0 30--70 72.0乙醇--苯--80.6 32--68 68.2乙醇--氯仿--61.2 7--93 59.4乙醇--四氯化碳--77.0 16--84 65.1乙醇/苯/水78.3/80.6/100 19/74/7 64.9乙酸乙酯--四氯化碳78.0--77.0 43--57 75.0乙酸乙酯--环己烷 46--54 71.6乙酸甲酯--环己烷83--17 54.9氯仿--丙酮 61.2--56.4 80--20 64.7甲苯--乙酸 101.5--118.5 72--28 105.4(a)与水形成的二元共沸物(水沸点100℃)(b)常见有机溶剂间的共沸混合物水在不同压力下的沸点水在不同压力下的沸点 BoilingPoints of Water at DifferentPressures水在不同压力下的沸点Boiling Points of Water at Different。
常见共沸物
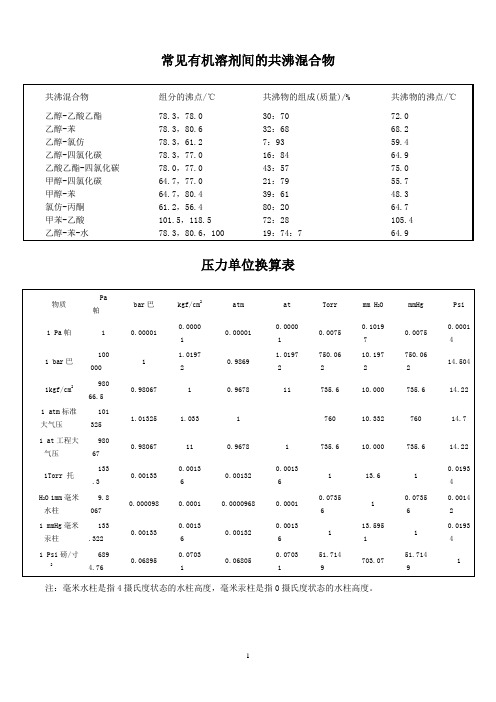
常见有机溶剂间的共沸混合物压力单位换算表注:毫米水柱是指4摄氏度状态的水柱高度,毫米汞柱是指0摄氏度状态的水柱高度。
实验室常用酸、碱的浓度试剂名称密度(20℃)g/ml 浓度mol/L 质量分数浓硫酸 1.84 18.0 0.960 浓盐酸 1.19 12.1 0.372 浓硝酸 1.42 15.9 0.704 磷酸 1.70 14.8 0.855 冰醋酸 1.05 17.45 0.998 浓氨水0.90 14.53 0.566 浓氢氧化钠 1.54 19.4 0.505一些溶剂与水形成的二元共沸物用于有机溶剂的中等强度的干燥剂有机化合物的鉴别在药品的生产、研究及检验等过程中,常常会遇到有机化合物的分离、提纯和鉴别等问题。
有机化合物的鉴别、分离和提纯是三个既有关联而又不相同的概念。
分离和提纯的目的都是由混合物得到纯净物,但要求不同,处理方法也不同。
分离是将混合物中的各个组分一一分开。
在分离过程中常常将混合物中的某一组分通过化学反应转变成新的化合物,分离后还要将其还原为原来的化合物。
提纯有两种情况,一是设法将杂质转化为所需的化合物,另一种情况是把杂质通过适当的化学反应转变为另外一种化合物将其分离(分离后的化合物不必再还原)。
鉴别是根据化合物的不同性质来确定其含有什么官能团,是哪种化合物。
如鉴别一组化合物,就是分别确定各是哪种化合物即可。
在做鉴别题时要注意,并不是化合物的所有化学性质都可以用于鉴别,必须具备一定的条件:(1)化学反应中有颜色变化(2)化学反应过程中伴随着明显的温度变化(放热或吸热)(3)反应产物有气体产生(4)反应产物有沉淀生成或反应过程中沉淀溶解、产物分层等。
本课程要求掌握的重点是化合物的鉴别,为了帮助大家学习和记忆,将各类有机化合物的鉴别方法进行归纳总结,并对典型例题进行解析。
一.各类化合物的鉴别方法1.烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去(2)高锰酸钾溶液,紫色腿去。
共沸表 jlac

与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/%氯仿61.2 56.1 2.5甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0正丙醇97.2 87.7 28.8苯80.4 69.2 8.8异丁醇108.4 89.9 88.2丙稀腈78.0 70.0 13.0二甲苯137-40.5 92.0 37.5二氯乙烷83.7 72.0 19.5正丁醇117.7 92.2 37.5乙睛82.0 76.0 16.0吡啶115.5 94.0 42乙醇78.3 78.1 4.4异戊醇131.0 95.1 49.6乙酸乙酯77.1 70.4 8.0正戊醇138.3 95.4 44.7异丙醇82.4 80.4 12.1乙醇129.0 97.8 59.0乙醚35 34 1.0二硫化碳46 44 2.0甲酸101 107 26常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9表1乙醇-水-苯三元共沸物性质共沸物(简记)共沸点℃共沸物组成,wt% 乙醇水苯乙醇-水-苯(T) 64.85 18.5 7.4 74.1 乙醇-苯(AB Z) 68.24 32.7 0.0 67.63 苯-水(BW Z) 69.25 0.0 8.83 91.17 乙醇-水(AW Z) 78.15 95.57 4.43 0.0表2乙醇、水、苯的常压沸点物质名称(简记) 乙醇(A) 水(B) 苯(B)沸点温度,℃78.3 100.0 80.2。
乙酸和乙醇共沸点

乙酸和乙醇共沸点
摘要:
一、共沸点概念介绍
1.共沸点的定义
2.乙酸和乙醇共沸点的特性
二、乙酸和乙醇的物理性质
1.乙酸的物理性质
2.乙醇的物理性质
三、乙酸和乙醇共沸点的原因
1.氢键的形成
2.分子间作用力的增强
四、共沸点的应用
1.实验室操作中的注意事项
2.工业生产中的应用
正文:
乙酸和乙醇共沸点是指在一定压力下,乙酸和乙醇的混合物在一定温度下可以同时沸腾。
共沸点与物质的物理性质密切相关,本文将从乙酸和乙醇的物理性质以及共沸点的原因和应用等方面进行阐述。
乙酸(C2H4O2)是一种有机化合物,具有刺激性气味,易挥发,能与水混溶。
乙醇(C2H5OH)也是一种有机化合物,具有醇香气味,易燃,能与水、乙醚等混溶。
乙酸和乙醇在一定比例下可以形成共沸混合物,这是因为它
们之间可以形成氢键。
氢键是一种分子间作用力,当两个分子中的氢原子与氧、氮或氟原子形成较弱的相互作用时,就会产生氢键。
在乙酸和乙醇的混合物中,乙酸的羧基(-COOH)与乙醇的羟基(-OH)可以形成氢键,从而增强分子间作用力。
这种作用力的增强使得乙酸和乙醇在一定比例下可以共沸。
乙酸和乙醇共沸点的原因主要是氢键的形成和分子间作用力的增强。
在实验室中,这种共沸现象在分馏操作中需要注意,以避免实验结果出现偏差。
在工业生产中,共沸点原理被应用于某些化学品的制备和提纯过程,如酯化反应、醇的脱水等。
总之,乙酸和乙醇共沸点是一种特殊的物理现象,与物质的物理性质和分子间作用力密切相关。
共沸以及溶剂共沸参数

共沸(Azeotrope)两种(或几种)液体形成的恒沸点混合物称为共沸混合物是指处于平衡状态下,气相和液相组成完全相同时的混合溶液。
对应的温度称为共沸温度或共沸点。
与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/% 溶剂沸点/℃共沸点/℃含水量/% 氯仿61.2 56.1 2.5 甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0 正丙醇 97.2 87.7 28.8苯80.4 69.2 8.8 异丁醇 108.4 89.9 88.2丙稀腈78.0 70.0 13.0 二甲苯137-40.5 92.0 37.5二氯乙烷 83.7 72.0 19.5 正丁醇 117.7 92.2 37.5乙睛82.0 76.0 16.0 吡啶115.5 94.0 42乙醇78.3 78.1 4.4 异戊醇 131.0 95.1 49.6乙酸乙酯 77.1 70.4 8.0 正戊醇 138.3 95.4 44.7异丙醇82.4 80.4 12.1 氯乙醇 129.0 97.8 59.0乙醚35 34 1.0 二硫化碳46 44 2.0甲酸101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9。
水在不同压力下的沸点及常见的共沸物

常见的共沸物及水在不同压力下的沸点共沸物组分的沸点(度)组成(w/w) 共沸点(度)水--乙醇 100--78.5 5--95 78.15水--正丙醇--97.2 28.8--71.2 87.7水--异丙醇--82.4 12.1--87.9 80.4水--正丁醇--117.7 37.5--62.5 92.2水--异丁醇--108.4 30.2--69.8 89.9水--叔丁醇--82.5 11.8--88.2 79.9水--异戊醇--131.0 49.6--50.4 95.1水--正戊醇--138.3 44.7--55.3 95.4水--氯乙醇--129.0 59.0--41.0 97.8水--乙醚--35 1.0--99.0 34水--乙腈--81.5 14.2--85.8 76水--丙烯腈--78.0 13.0--87 70.0水--甲酸--101 26--74 107水--丙酸--141.4 82.2--17.8 99.1水--乙酸乙酯--78 9.0--91 70水--二氧六环--101.3 18--82 87.8水--氯仿--61.2 2.5--97.5 56.1水--四氯化碳--77.0 4.0--96 66.0水--二氯乙烷--83.7 19.5--80.5 72.0水--苯--80.4 8.8--91.2 69.2水--甲苯--110.5 20--80 85.0水--二甲苯--137-140.5 37.5--62.5 92.0水--吡啶--115.5 42--58 94.0水--二硫化碳--46 2.0--98.0 44甲醇--二氯甲烷 64.7--41 7.3--92.7 37.8甲醇--氯仿--56.2 12--88 55.5甲醇--四氯化碳--77.0 21--79 55.7甲醇--丙酮--56.2 12--88 55.5甲醇--苯--80.6 39.1--60.9 57.6甲醇/甲酸甲酯/环己烷 17.8/48.6/33.6 50.8乙醇--乙酸乙酯 78.3--78.0 30--70 72.0乙醇--苯--80.6 32--68 68.2乙醇--氯仿--61.2 7--93 59.4乙醇--四氯化碳--77.0 16--84 65.1乙醇/苯/水78.3/80.6/100 19/74/7 64.9乙酸乙酯--四氯化碳78.0--77.0 43--57 75.0乙酸乙酯--环己烷 46--54 71.6乙酸甲酯--环己烷83--17 54.9氯仿--丙酮 61.2--56.4 80--20 64.7甲苯--乙酸 101.5--118.5 72--28 105.4(a)与水形成的二元共沸物(水沸点100℃)(b)常见有机溶剂间的共沸混合物水在不同压力下的沸点水在不同压力下的沸点 Boiling Pointsof Water atDifferentPressures水在不同压力下的沸点Boiling Points of Water at Different。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的共沸混合物的组成及共沸点
共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。
大多数共沸物都是负共沸物,即有最低沸点。
值得注意的是:任一共沸物都是针对某一特定外压而言。
对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。
(a)与水形成的二元共沸物(水沸点100℃)
溶剂沸点/℃共沸点/℃含水量/%溶剂沸点/℃共沸点/℃含水量/%氯仿61.256.1 2.5甲苯110.585.020
四氯化碳77.066.0 4.0正丙醇97.287.728.8苯80.469.28.8异丁醇108.489.988.2丙稀腈78.070.013.0二甲苯137-40.592.037.5二氯乙烷83.772.019.5正丁醇117.792.237.5乙睛82.076.016.0吡啶115.594.042乙醇78.378.1 4.4异戊醇131.095.149.6乙酸乙酯77.170.48.0正戊醇138.395.444.7异丙醇82.480.412.1氯乙醇129.097.859.0乙醚3534 1.0二硫化碳4644 2.0甲酸10110726
(b)常见有机溶剂间的共沸混合物
共沸混合物组分的沸点/℃共沸物的组成(质量)/%共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.030:7072.0乙醇-苯78.3,80.632:6868.2
乙醇-氯仿78.3,61.27:9359.4乙醇-四氯化碳78.3,77.016:8464.9乙酸乙酯-四氯化碳78.0,77.043:5775.0甲醇-四氯化碳64.7,77.021:7955.7甲醇-苯64.7,80.439:6148.3
氯仿-丙酮61.2,56.480:2064.7
甲苯-乙酸101.5,118.572:28105.4
乙醇-苯-水78.3,80.6,10019:74:764.9。
