二组分溶液沸点—组成图的绘制
双液相图 (2)

从工作曲线上查得相应的组成,获得沸点与 组成的组成。
七、思考题
1. 沸点仪中的小球体积过大或过小,对测量有何影响?
2. 若在测定时,存在过热或分馏作用,将使测得的相 图图形产生什么变化?
I. 将组成不同的系统逐次置于沸点仪中,加热至沸 腾,在气液两相达平衡,测定其沸点
II. 用数字阿贝折射仪测定达到平衡的两相组成 III. 分别将沸点下的气相点和液相点连成气相线和液
相线,就得到完全互溶双液系的t-x相图。
二、实验原理(4)
本实验采用的环己烷(B)-乙醇(A) 系统是完全互溶的二组分系统, 其沸点-组成图属于具有最低恒 沸点的类型。
用针管从支管加入20mL乙醇溶液于烧瓶中,接通冷凝 水和电源,调节调压器加热电压到20V左右。将液体 缓缓加热,当液体沸腾后,待毛细管中出现均匀小泡状 的冷凝液往烧瓶中从底部回流,开始记录温度。反复 2—3次,待温度稳定后记下沸点,停止通电,充分冷 却后,测定折射率。
四、实验步骤(5)
4. 测定相应溶液的沸点及平衡时气—液两 相的折射率
附2:阿贝折射仪的使用:
◦ 1、将折射仪与超级恒温器相连接,并调节好水温进行恒温并 通入恒温水。
◦ 2、当温度恒定时,打开棱镜,滴一两滴丙酮在镜面上,合上两 棱镜,使镜面全部被丙酮润湿再打开,用镜头纸吸干,然后用重 蒸馏水或已知折射率的试剂滴在标准玻璃块上来校正标尺刻 度。
◦ 3、测定时拉开棱镜把待测液体滴在洗净擦干了的棱镜上,合 上棱镜进行观察。如样品很容易挥发,可把样品由棱镜间小 槽滴入。
3. 按所得相图,讨论环已烷-乙醇溶液蒸馏时的分离 情况。
4.在本实验中,气、液两相是怎样达到平衡的?如何 判定气-液相已达平衡?
第6章 二组分液态部分互溶系统及完全不互溶系统气液平衡相图
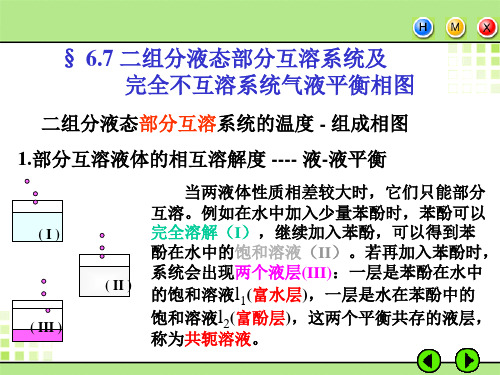
C L1’
称为高临界溶解温度或高会溶
富水
温度。
l
L2’
富酚
温度高于高会溶温度,液 体水与液体苯酚可完全互溶, 温度低于高会溶温度,两液 体只能部分互溶。
l1+ l2
0M A (水)
N 100
wB /%
B(苯酚)
t
p=const.
e
加热
l1+ l2
g
冷却
的相变化,温度和三相组成均 不变,但三相的数量却在改变, 改变量之间的关系符合杠杆规 则。
二组分系统三相平衡的杠杆规则:
设A、B二组分系统成α,β, γ 三相平衡时,三个相的组成分 别为xB(α)、xB(β)、xB(γ) ,且 xB(γ) 介于xB(α)和xB(β)之间 。如 图:
又为另一液层的饱和蒸汽压。即气相与两个液
L2
相均平衡,而这两个液相相互平衡。
根据这三相组成的关系,可将部分互溶系统气-液平衡的温 度 - 组成图分为两类:
3.部分互溶系统的温度 - 组成图
(1)气相组成介于两液相组成之间的系统
t
P
92
L1 0M A
p=101.325kPa
Q
G L2
wB/%
N 100 B
对照相图理解三相平衡的杠 杆规则
Δn(α) xB ( β ) xB (γ ) Δn( β ) xB (γ ) xB (α)
Δn(α) α
Δn(β) γβ
0 xB(α) xB(γ) xB (β) 1
A
B
Δn(α) [xB (γ ) xB (α)] Δn( β ) [xB ( β ) xB (γ )]
P
实验二 双液系沸点-成分图的绘制
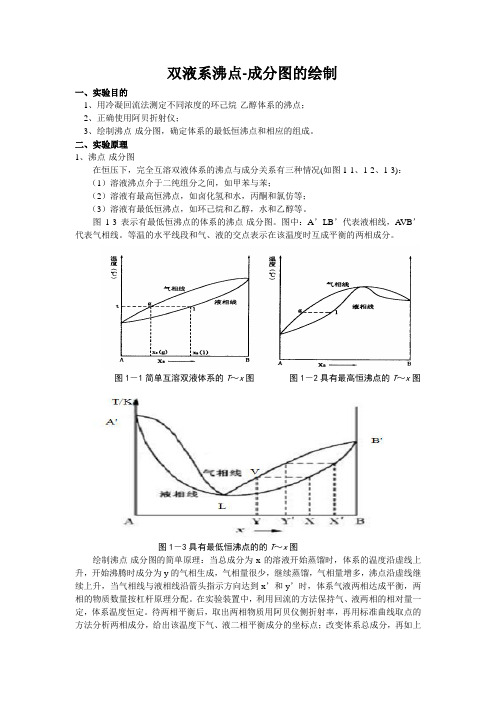
双液系沸点-成分图的绘制一、实验目的1、用冷凝回流法测定不同浓度的环己烷-乙醇体系的沸点;2、正确使用阿贝折射仪;3、绘制沸点-成分图,确定体系的最低恒沸点和相应的组成。
二、实验原理1、沸点-成分图在恒压下,完全互溶双液体系的沸点与成分关系有三种情况(如图1-1、1-2、1-3):(1)溶液沸点介于二纯组分之间,如甲苯与苯;(2)溶液有最高恒沸点,如卤化氢和水,丙酮和氯仿等;(3)溶液有最低恒沸点,如环己烷和乙醇,水和乙醇等。
图1-3表示有最低恒沸点的体系的沸点-成分图。
图中:A’LB’代表液相线,A VB’代表气相线。
等温的水平线段和气、液的交点表示在该温度时互成平衡的两相成分。
图1-1简单互溶双液体系的T~x图图1-2具有最高恒沸点的T~x图图1-3具有最低恒沸点的的T~x图绘制沸点-成分图的简单原理:当总成分为x的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成分为y的气相生成,气相量很少,继续蒸馏,气相量增多,沸点沿虚线继续上升,当气相线与液相线沿箭头指示方向达到x’和y’时,体系气液两相达成平衡,两相的物质数量按杠杆原理分配。
在实验装置中,利用回流的方法保持气、液两相的相对量一定,体系温度恒定。
待两相平衡后,取出两相物质用阿贝仪侧折射率,再用标准曲线取点的方法分析两相成分,给出该温度下气、液二相平衡成分的坐标点;改变体系总成分,再如上法找出另一对坐标点。
将所有气相点和液相点连成气相线和液相线,即得T-x平衡图。
2、阿贝仪的使用阿贝仪利用了折射和全反射全反射原理设计而成。
将样品滴在棱镜上,旋转棱镜使目镜能看到半明半暗现象。
旋转补偿棱镜消除色散,在转动棱镜使明暗界线正好与目镜中的十字线交点重合,从标尺上直接读取折射率。
三、实验仪器及药品1、仪器恒沸点仪阿贝尔折射仪(WZS-I 940168)蒸馏瓶电阻丝变压器水银温度计(50~100℃,分度值0.1℃)恒温水浴装置5mL、20mL移液管滴瓶万分之一天平2、药品乙醇环己烷图1-4 恒沸点仪四、实验内容1、沸点和两相成分的测定1)洗净、烘干蒸馏瓶,加20mL乙醇使温度升高并沸腾,每隔30s记一次数据;2)待温度稳定3min后,记最终温度及大气压;3)断电,用两只滴管取支管口处气相冷凝液及蒸馏瓶中液体,用阿贝折射仪测折射率,气相冷凝液测1次,液相测2次;4)蒸馏瓶中依次加2mL、2mL、3mL、4mL、5mL环己烷,按上述方法测沸点及气液两相折射率;5)回收母液,少量环己烷洗蒸馏瓶3~4次,注入20mL环己烷,测纯沸点及气液两相折射率;6)再向蒸馏瓶中依次加0.5mL、0.5mL、0.5mL、2mL、5mL、5mL乙醇,分别测沸点及气、液两相折射率。
二组分溶液沸点-组成图

实验4.5二组分溶液沸点-组成图的绘制一、目的要求1.掌握阿贝折光仪及超级恒温槽的使用方法2.掌握沸点-组成图的绘制方法3.掌握用折光率确定二元液体组成的方法二、实验原理二组分完全互溶液体系统蒸馏曲线可分为三类:(1)系统中两组分对拉乌尔定律的偏差都不大,在T-x图上溶液的沸点总是介于A、B两纯液体的沸点之间,(如图)(2)两组分对拉乌尔定律都产生较大的负偏差,在p-x图上出现最小值时,在T-x图上将出现最高点,(如图)(3)两组分对拉乌尔定律都产生较大的正偏差,在p-x图上出现最大值时,在T-x图上将出现最低点,(如图)最高点和最低点分别称为最高恒沸点和最低恒沸点,对应的组成称为恒沸组成,其相应的混合物称为恒沸混合物。
系统中两组分对拉乌尔定律的偏差都不大两组分对拉乌尔定律都产生较大的负偏差两组分对拉乌尔定律都产生较大的正偏差本实验是在某恒定压力下则定乙醇—正己烷二组分系统的沸点与组成平衡数据,并绘制该液体混合物的蒸馏曲线,其类型是系统中两组分对拉乌尔定律的偏差都较大的类型。
三、仪器试剂超级恒温槽、阿贝折光仪、蒸馏瓶、恒流源、精密数字温度计、量筒、移液管、滴管、环己烷、无水乙醇、丙酮、重蒸馏水、80%、60%、40%、20%环己烷—-乙醇标准混合液;各种组成的环己烷—乙醇混合液。
四、实验步骤1.测定沸点与组成的关系:使用折光率仪测量上述混合溶液相应的折光率。
以折射率对浓度作图,即可绘制工作曲线。
2. 一定组成环己烷——乙醇混合液沸点及气液两相折射率的测定。
按图装好装置后,加入药品,环己烷/乙醇:26.21ml/0.45ml、25.44ml/1.23ml、23.41ml/3.25ml、19.46ml/7.21ml、17.15ml/9.52、11.61ml/15.85ml、6.4ml/20.23ml、1.41ml/25.26ml,加热回流。
3.待温度读数稳定后,将蒸馏瓶稍稍倾斜,使小槽中的冷凝回流蒸气瓶,发福倾倒三次,待小槽收集满后,记下沸点温度,停止加热,立即取出小槽中的气相样品,测其折光率。
双液系的气—液平衡相图

实验五双液系的气—液平衡相图一、实验目的1、绘制在标准压力下乙醇-正丙醇体系的沸点组成图,并确定其恒沸点及恒沸组成;2、熟练掌握测定双组分液体沸点的方法及用折光率确定二组分物系组成的方法;3、掌握超级恒温槽、阿贝折射仪、气压计等仪器的使用方法。
二、实验原理1、相图任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系,如环已烷-乙醇、正丙醇-乙醇体系都是完全互溶体系。
若只能在一定比例范围内溶解,称为部分互溶双液系,例苯-水体系。
在完全互溶双液系中,有一部分能形成理想液态混合物,如苯-甲苯系统,二者的行为均符合拉乌尔定律,但大部分双液系是非理想液态混合物,其行为与拉乌尔定律有偏差。
液体的沸点是指液体的蒸气压与外界压力相等时的温度。
在一定外压下,纯液体的沸点有其确定值,但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
双液系两相平衡时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点T(或t)-组成(x)图,即T(或t)—x图。
它表明了沸点与液相组成和与之平衡的气相组成之间的关系。
在恒定压力下,二组分系统气液达到平衡时,其沸点-组成(t-x)图分三类:(1)混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
如苯-甲苯系统,此时混合物的行为符合拉乌尔定律或对拉乌尔定律的偏差不大。
如图5-1(a)所示。
(2)有最低恒沸点体系,如环已烷-乙醇体系,t—x图上有一个最低点,此点称最低恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大正偏差,如图5-1(b)所示。
对于这类的双液系,用分馏法不能从溶液中同时分离出两个纯组分。
(3)有最高恒沸点体系,如氯仿-丙酮体系,t—x图上有一个最高点,此点称最高恒沸点,在此点相互平衡的液相和气相具有相同的组成,此时混合物的行为对拉乌尔定律产生最大负偏差,如图5-1(c)所示。
双液系气液相图的绘制实验报告

基础化学
(物理化学部分)
题目双液系气一液相图的绘制
班级
姓名
组号
仪器号
室温
216c
大气压
实验地点
实验楼C311
日
期
825.3MB
2008.11.9
一、实验目的
1、用沸点仪测定标准压力下环已烷-乙醇双液系的气液平衡数据,绘制系统的沸 点一组成图,确定系统的恒沸温度及恒沸混合物的组成。
2、了解用沸点仪测量液体沸点的方法,了解阿贝折光仪的测量原理和使用方法。
ห้องสมุดไป่ตู้二、实验原理
1、将两种完全互溶的挥发性液体组分A和组分B混合后,在一定的温度下, 平衡共存的气、液两相的组成通常并不相同。因此,如果在定压下将液态混合物 蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就可得到平衡时气、液两 相的组成并绘制出沸点一组成图(即T—x图)。下图为完全互溶双液系的一种蒸
物理化学实验报告讲义完全互溶双液系沸点-组成图的测定

图 3-11 完全互溶双液系的沸点-组成图
仪器和药品
实验原理
室温下两种液体混合后,按其相互溶解情况,可形成完全互溶、部分互溶和完全不 互溶三种类型的混合物。完全互溶的双液系,因两种组分具有不同的挥发性,故在一定 外压下混合物沸腾时,平衡共存的气、液两相的组成通常不同。同时,混合物的沸点也 会随着平衡组成的不同而发生变化。因此,在恒压下将溶液蒸馏,测定其相平衡温度(沸 点)和相平衡组成(气相组成,液相组成),描述这种关系的图,称为恒压下的沸点-组成 图。获得此类相图的方法称为蒸馏法。
仪器:平衡蒸馏仪一套(见图 3-12);阿贝折光仪(附带超级恒温水浴);调压器; 数字式温度计;取样管;洗耳球;移液管,漏斗。
药品:环己烷(A·R);无水乙醇(A·R)。
实验步骤
1.配制具有不同组成的环己烷-乙醇溶液 22 mL。打开连接在阿贝折光仪上的超级恒 温水浴,恒温于 250.1 oC。
2.向干燥蒸馏瓶中加入 22 mL 无水乙醇,盖好磨口塞,通冷却水。打开加热器电源 开关,缓慢调节调压器的输出电压至 20 V 左右,加热蒸馏瓶,待蒸馏瓶内的液体稳定沸 腾 3~5 min 后,记录沸点及大气压,切断电源。
作曲线上查得的各试样组成记入表 3-3。
表 3-3 二组分气-液平衡相图原始数据记录表
试剂加入量 V/mL 环己烷 无水乙醇
沸点/℃
气相冷凝液
折光率
y 环己烷
平衡液相
实验十一_二组分沸点组成相图的制作

实 验 报 告一、 数据记录和处理1.数据记录表T 室温= 23.4℃表1 室温时正丙醇-乙醇溶液的组成与折射率的对应关系数据记录表始P = 102.7kpa 末P = 102.7kpa表2 正丙醇-乙醇溶液沸点-组成相图各数据记录表2. 室温时绘制正丙醇—乙醇溶液组成与其折射率标准曲线表3 室温时正丙醇-乙醇溶液的组成与折射率的对应关系表η 1.3575 1.3624 1.3662 1.3721 1.3749 1.3798 D表3数据的计算示例:查附表9-8表计算得到:ρ0.8013=正丙醇ρ0.7865=乙醇再求正丙醇-乙醇溶液中正丙醇的物质的量分数浓度X正丙醇。
由表3数据绘制标准曲线:. .图1 正丙醇物质的量分数与折射率的标准曲线3. 常压下正丙醇-乙醇体系的沸点-组成相图的测绘表4 正丙醇-乙醇溶液沸点-组成相图各数据处理表由表4数据绘制相图:图2 正丙醇-乙醇体系的沸点-组成相图二、回答问题1.本实验如何判断气、液两相达到平衡?用相律加以说明。
如果取样口或空气口塞子漏气,会有什么现象?为什么?2.折射率-组成标准曲线的测定误差可能来自哪些方面?应采取哪些措施来减小误差?3.实验中超级恒温槽的作用?能否换成普通恒温槽?4.气液平衡后,气相和液相在平衡仪内的温度不同,某同学认为这样测量出的气、液相折射率会存在误差,这种说法是否正确?为什么?5.本实验中气液平衡仪及毛细管为什么必须干燥?本实验测得的沸点-组成相图的误差主要来源是那些操作?6.本实验中Ⅰ-Ⅹ号溶液的浓度应如何选择?若某一号溶液的浓度发生不大的变化,对实验测得的相图有无影响?7.影响纯物质沸点的因素有哪些?影响混合液沸点的因素有哪些?加入平衡仪内液体的量的多少对沸点有影响吗?。
实验2 dyl双液相图

物理化学实验备课材料实验二完全互溶两组分液态混合物的气液平衡相图一、基本介绍相平衡属于物理化学的重要教学内容,其中气液平衡是最常见,同时也是讨论最多的内容之一。
理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似、性质相近的组分之间可以形成近似的理想体系,此时体系的沸点组成图(T -x图)如下图1a所示。
大多数情况下为非理想体系,这时在反映体系沸点与组成关系的T-x图上将出现或正或负的偏差,当这一偏差足够大时,T-x曲线上将出现极低点(对拉乌尔定律产生极大正偏差,如下图1b所示)或极高点(对拉乌尔定律产生极大负偏差,如下图1c所示)。
出现极大点的体系常见的有:乙酸异戊酯—四氯乙烷;丙酮-氯仿;水—盐酸;水—硝酸等。
出现极小点的体系常见的有:四氯化碳—乙酸乙酯;甲醇—苯;正丙醇—水;异丙醇—环己烷,乙醇—水等。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
注意,恒沸混合物不是一种物质,而是一种具有特定组成的混合物。
在恒沸点是气液两相的组成一致。
恒沸混合物的组成由温度或压力中的一个所确定,即指定温度,压力及组成由体系自定,不能改变。
图1 两组分体系的等压T-x图根据相平衡原理,对二组分体系,当压力恒定时.在气液平衡两相区,体系的自由度为1。
若温度一定.则气液两相的组成也随之而定,反之亦然。
当原溶液组成一定时,根据杠杆原理,两相的相对量也一定。
反之,实验中利用回流的方法保持气液两相的相对量一定,则体系的平衡温度也随之而定。
沸点测定仪就是根据这一原理设计的。
二、实验目的1、用沸点测定仪测定常压下不同组成的正丙醇—水体系的沸点,绘制该体系的T-x图。
2、掌握沸点测定方法。
阿贝折射仪1-反光镜;2-棱镜座转轴;3-遮光板;4-温度计;5-进光棱镜座;6-色散调节手轮; 7-色散刻度图;8-目镜;9-盖板10-手轮;11-折射棱镜;12-照明刻度盘聚光镜;13-温度计座3、进一步掌握阿贝折射仪的测量原理及操作方法。
双液体系气—液平衡相图的绘制及思考题

双液体系气—液平衡相图的绘制一、实验目的1. 绘制环己烷—异丙醇双液体系的沸点组成图,确定其恒沸组成和恒沸温度。
2. 掌握回流冷凝管法测定溶液沸点的方法。
3.掌握阿贝折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不 同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图 (a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图 (b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图 (c))所示。
上图为二组分真实液态混合物气—液平衡相图(T-x 图)t At AtAt Bt B t Bt / o Ct / o t / o x Bx Bx BABAABB(a)(b)(c)x 'x '后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T-x相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-异丙醇为体系,该体系属于上述第三种类型,在沸点仪中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。
本实验中两相的成分分析均采用折光率法测定。
三、仪器与试剂1、仪器:沸点仪1台;调压变压器1台;阿贝折射仪1台;温度计(0-100℃) 1支;长滴管1个;短滴管2支;2、试剂:环己烷(分析纯);异丙醇(分析纯)异丙醇—环己烷标准溶液(异丙醇分别为0.20,0.40,0.50,0.60,0.80,0.90)四、主要实验步骤1. 测定环己烷、异丙醇及标准溶液的折射率调节阿贝折射仪,用一支干燥的短滴管吸取环己烷数滴,注入折射仪的加液孔内,测定其折射率n,读数两次,取其平均值。
实验六 完全互溶双液体系沸点

实验六完全互溶双液体系沸点~组成图的绘制一、实验目的1.了解溶液的沸点与气液二相组成的关系;2.绘制环己烷-异丙醇溶液的沸点~组成图;3.进一步理解分馏原理;4.掌握阿贝折光仪的正确使用方法。
二、基本原理液体的沸点是液体的饱和蒸气压与外压相等时的温度。
在一定的外压下,单一组分的液体有确定的沸点值,对于一个完全互溶的双液体系,沸点不仅与外压有关,还和液体的组成有关。
在常温下,具有挥发性的A和B两种液体以任意比例相互溶解所组成的物系,在恒定压力下表示该溶液沸点与组成关系的相图称之为沸点~组成图,即T ~x图。
完全互溶双液体系在恒压下的沸点~组成图大致可分为以下三类。
图6-1简单互溶双液体系的T~x图图6-2具有最高恒沸点的T~x图图6-3具有最低恒沸点的的T~x图第Ⅰ类:溶液沸点介于两纯组分沸点之间,如苯与甲苯的混合体系,其沸点~组成图如图6-1所示。
此类溶液在恒压下蒸馏时,其气相组成和液相组成并不相同,具有较低蒸气压的液体(B)在气相中的组成X B(g)总是小于在液相中的组成X B(l),因此可以通过反复蒸馏——精馏,使互溶的二组分完全分离。
第Ⅱ类:溶液具有最高恒沸点,如卤化氢和水、丙酮与氯仿等,其沸点~组成图如图6-2所示。
第Ⅲ类:溶液具有最低恒沸点,如苯与乙醇、乙醇与水、环己烷与异丙醇、环己烷与乙醇、乙醇与1,2-二氯乙烷等,其沸点~组成图如图6-3所示。
在第Ⅱ、Ⅲ类的T ~x图中,出现极值点(极大值或极小值),在极值点处加热蒸发时,只能使气相的总量增加,气液相组成及沸点均保持不变,此点的温度称为恒沸点。
在恒沸点时,气相的组成与液相的组成相同,称为恒沸组成。
而具有此组成的混合物称为恒沸混合物。
对于Ⅱ、Ⅲ两类溶液,简单的反复蒸馏只能获得某一纯组分和恒沸混合物,而不能同时得到两种纯组分。
恒沸点和恒沸混合物的组成与外压有关,改变外压可使恒沸点和恒沸混合物的组成发生变化。
本实验环己烷与异丙醇的混合物属于第Ⅲ类溶液,具有最低恒沸点。
第6节:二组分液态部分互、完全不互溶系统l-g相图
0.4 0.6 0.8 wB
1.0 B
m(l1)/m(l2) = l 2c1/ l1c1 = ( 0.70– 0.4)/( 0.40–0.21) = 1.58 m (l1) + m (l2) = 18 kg m (l2) = 6.98 kg m (l1) = 11.02 kg
(1) 例 A和B在液态部分互溶, A和p B一定 在100kPa下的沸点分别为 120 P = 1, , g (A+B), F , =且知 2 100℃和120 ℃, 该二组分的气 , 液平衡相图如图所示 C, E, 液相部分互溶 , 拉乌尔定律 亨利定律 D三个相点的组成分别为 100 xB,C = 0.05, yB,E = 0.60, xB,D = 0.97. P = 2, l1 (A+B) + (1)试将图中各相区及CED 线的相数, 相态及成分, 自由度F; gL (A+B), FM =1 P℃ = 2, l2 (A+B) + G 80 A的混合物, 在100kPa, (2)试计算3mol B与7mol 80 达成平衡 g (A+B), F=1 时气, 液两相各相的物质的量各为多少摩尔? D P = 1, C P = 1, P = 3, lC +gE +lD , F = 0 (3)假定平衡相点C 和60 D 所代表的两个溶液均可视为理想稀溶液 . l1(A+B), E l2(A+B), F = 2 试计算60℃时纯A(l)及B(l)的饱和蒸气压及该两溶液中溶质的亨 P = 2 , F=1, F=2 40 利系数(浓度以摩尔分数表示 ). l1 (A+B) + l2 (A+B)
t p 一定 g(A+B)
双液系二组分相图

3、根据所得蒸出液和蒸馏液的折光率, 在标准曲线上找出对应的成分,并对应 各沸点温度的蒸出液和蒸馏液的折光率 与含环己烷量列表。
4、作环己烷-乙醇的T-x图。并从图中 确定出最低恒沸点和恒沸物组成。
七、思考题
1、在测量沸点,如溶液过程或出现分馏 现象,将使绘出的相图图形会产生什么 变化?
五、实验注意事项
1、加热电热丝一定要被欲测液体浸没, 否则通电加热时会引起有机溶液的燃烧 或烧断加热丝,所加电压不能太大,加 热丝上有小气泡逸出即可,温度计水银 球不要直接碰到加热丝。
2、一定要使体系达到平衡,即温度计 读数稳定,先停止通电加热再取样分析。
3、使用阿贝折光仪时,棱镜上不能触 及硬物(如滴管)。
六、数据处理
1、沸点温度校正 (1)正常沸点。在PQ下测得的沸点称为正 常沸点。通常外界压力并不恰好等于 101.325KPa,因此,应对实验测得值作 压力校正。应用特鲁顿规则及克劳修斯 -克拉见龙公式校正。
△t后=(273.15+ t观)/10·(101325-P)/101325
校正后溶液的正常沸点为
完全互溶双液系在恒定压力下的气-液 平衡相图可分为三类:
绝对大多数实际体系与拉乌尔 (Raoult)定律有一定偏差。如果偏差不 大时,在T-x图上,液体的蒸气压和沸 点介于A-B两纯组分蒸气压及沸点之间, 如甲苯-苯体系如图1所示,为第一类。
但是,实际溶液由于A-B两组分的相互 影响,常与拉乌尔定律有很大的偏差, 以至其相图将出现极值,在T-x图上出 现最低点和最高点,如图2、图3。这些 点称为恒沸点,其相应的溶液称为恒沸
度测量时,需对温度计读 数校正。根据玻璃与水银膨胀系数的差 异,校正计算式为:
6.双液系相图的绘制

化学化工学院
化学化工学院
实验6:双液系相图的绘制 数据处理
1. 将实验数据列表。 2. 绘制工作曲线,即环己烷—乙醇标准溶液的折光率与组 成的关系曲线。 3. 根据工作曲线确定各待测溶液气相和液相的平衡组成, 4. 确定最低恒沸点的温度和组成。
化学化工学院
实验6:双液系相图的绘制 思考题
1. 待测溶液的浓度是否需要精确计量?为什么? 2. 本实验不测纯环己烷、纯乙醇的沸点,而直接用标准压 力下的数据,这样会带来什么误差? 3. 如果要测纯环己烷、纯乙醇的沸点,蒸馏瓶必须洗净, 而且烘干,而测混合液沸点和组成时,蒸馏瓶则不洗也不 烘,为什么?
化学化工学院
实验6:双液系相图的绘制
测定方法
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。在 100KPa下测定一系列不同组成的混合溶液的沸点及在沸点 时呈平衡的气液两相的组成,绘制T—x图,并从相图中确 定恒沸点的温度和组成。测定沸点的装置叫沸点测定仪。 这是一个带回流冷凝管的长颈圆底烧瓶。冷凝管底部有一 半球形小室,用以收集冷凝下来的气相样品。电流通过浸 入溶液中的电阻丝。这样既可减少溶液沸腾时的过热现象, 还能防止暴沸。测定时,温度计水银球要一半在液面下, 一半在气相中,以便准确测出平衡温度。
化学化工学院
实验6:双液系相图的绘制
双液系的T—x图有三种情况: (1)理想溶液的T—x图,它表示混合液的沸点介于A、B二 纯组分沸点之间。这类双液系可用分馏法从溶液中分离出 两个纯组分。 (2)有最低恒沸点体系的T—x图和有最高恒沸点体系的 T—x图。这类体系的T—x图上有一个最低和一个最高点, 在此点相互平衡的液相和气相具有相同的组成,分别叫做 最低恒沸点和最高恒沸点。对于这类的双液系,用分馏法 不能从溶液中分离出两个纯组分。
二组分溶液沸点—组成图的绘制实验报告

实验名称:二组分溶液沸点——组成图的绘制班级:09级应化一班 学号:0120 报告人:裴哲民同组人:匡江梅,李琪瑶,潘齐常,陈斌,梁细莲 实验时间:2011年9月16日 辅导老师:李传华 一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
二. 基本原理在一定的外压下,纯液体的沸点是恒定的,但对于完全互溶双液系,沸点不仅与外压有关,而且还与其组成有关,并且在沸点时,平衡的气-液两相组成往往不同。
根据相律:F=C-P+2,一个气液共存的二组分体系,其自由度为2,只需再任意确定一个变量,其自由度就减为1,整个体系的存在状态就可以用二维图来描述。
本实验中采用在一定压力下,作出体系的温度T 和组分x 的关系图,即T-x 图。
完全互溶体系的T-x 图可分为三类:①液体与Raoult 定律的偏差不大,在T-x 图上,溶液的沸点介于两种纯液体的沸点之间(图),如苯-甲苯系统;②由于两组分的相互作用,溶液与Raoult 定律有较大的负偏差,在T-x 图上存在最高沸点(图),如卤化氢-水系统;③ 溶液与Raoult 定律有较大的正偏差,在T-x 图上存在最低沸点(图),如乙醇-水系统。
②和③类溶液,在最高或最低沸点时的气-液两相组成相同,这些点称为恒沸点,此浓度的溶液称为恒沸点混合物,相应的温度称为恒沸温度,相应的组成称为恒沸组成。
本实验所要测绘的环己烷-乙醇体系即属于第二类溶液。
对于一个组成恒定的封闭系t/t/t/AAABBBx B (a ) x B (b ) 气气气液液液x B (c )统,当系统达到气液平衡温度时,气液两相的组成和温度恒定不变,以此便能得到该温度下的平衡气-液两相组成的一对坐标。
依次改变系统的组成就能得到一系列的平衡气-液两相组成坐标点,用光滑曲线连接即成相图。
实验所用的沸点仪结构如图2,冷凝管底部的小球用以收集冷凝下来的气相样品。
4.3二组分气-液平衡系统剖析

一、理想液态混合物
双液系统分类
完全互溶 部分互溶 完全溶容
理想液态混合物 非理想双液系统
理想液态混合物 全部浓度范围内均能互溶形成均匀的单一液相,同时在全部浓 度范围内符合拉乌尔定律。
f 3 max 3 p不变 =1 f=2 称为 T-x图
T不变 =1 f=2 称为 p-x图
1. 理想液态混合物的蒸气压(定T下,p-x图)
3. 负偏差很大的体系
非理想的完全互溶双液系统
3. 负偏差很大的体系 例:1atm下,H2O-HCl体系
Tb最高=108.5C 恒沸物组成 HCl% =20.24%
非理想的完全互溶双液系统
常见恒沸混合物的数据
solution
HCl+H2O HCl+H2O HNO3+H2O HBr+H2O HCOOH+ H2O CHCl3+(CH)2CO C2H5OH+ H2O CCl4+CH3OH CS2+ (CH)2CO CH3COOC2H5+ H2O
x 0 0.025 0.1 0.240 0.360 0.462 0.563 0.710 0.833 0.942
y 0 0.070 0.164 0.295 0.398 0.462 0.507 0.600 0.735 0.880
T 77.15 76.70 75.0 72.6 71.8 71.6
72.0 72.8 74.2 76.4
p
l
pB*
p1
p2
l=g
pA*
g
A
xA
B
在对气体的恒温加压过程中,随着压力的增加,气体将逐渐液化
2. 理想液态混合物在定压下的T-x图(沸点组成图)
实验六双液系沸点-组成图的绘制预习及实验报告书写要点

董 超 编 写实验六 双液系沸点-组成图的绘制【重要提示】环己烷-异丙醇溶液的浓度调整为:序号1 2 3 4 5 6%V 异丙醇10% 20% 35%50% 70% 85%一、实验原理部分书写要点1.二组分气-液平衡相图的概况及其特征(简单概括....); 2.本实验所涉及双液系的特点; 3.本实验绘制相图所使用的实验方法。
【注】:实验原理部分如果较长,可附页书写;物理化学实验教材另需预习内容:(1) Excel 常用函数 ④ round P 13(2) 金属电阻温度计P 131物理化学理论课相关内容:① §6.1 相律P 228 ② §6.4 二组分真实液态混合物的气-液平衡相图2.温度-组成图P 244二、实验原始数据记录室温:______________ 大气压:______________气相折光率gD n 及其测定温度T ∕℃液相折光率lD n 及其测定温度T ∕℃1 2 3 1 2 3 溶液序号T b ∕℃ gDn T g D nT g Dn T l Dn T l Dn T l D nT 1 2... ... ... ... ... ... ... ... ... ... ... ... ... (6)董 超三、实验数据处理要求1.计算气、液相折光率测定值的平均值,并根据环己烷-异丙醇双液系的温度系数41410Ddn dt−−=−×℃进行温度校正; 2.用Excel 软件对教材P 48的环己烷-异丙醇双液系的D x n −异丙醇数据进行二次多项式拟合,建立()D x f n =异丙醇的拟合方程;3.由()D x f n =异丙醇的拟合方程根据经过温度校正的折光率计算气、液相的平衡组成; 4.绘制环己烷-异丙醇双液系的沸点组成图; 5.根据相图确定恒沸点的相关数据:,b T 恒、x 异丙醇,恒,并作误差分析。
四、实验数据处理部分书写参考格式1.环己烷-异丙醇双液系的()D x f n =异丙醇拟合方程为:______(填入拟合方程表达式)_____2.折光率温度校正及气、液相平衡组成计算环己烷-异丙醇双液系的温度系数41410Ddn dt−−=−×℃编 写3.环己烷-异丙醇双液系沸点-组成图相图示例,b T 恒(实验)﹦_______,,b T 恒(文献)﹦_______ x 异丙醇,恒(实验)﹦_______,x 异丙醇,恒(文献)﹦_______恒沸点相对误差:,b T 恒68.6568.65−℃×100%=_________恒沸物组成相对误差:,0.410.41x −异丙醇恒×100%=_________【注】:环己烷-异丙醇双液系的D x n −异丙醇数据二次多项式拟合方法、相图的计算机绘制方法均见相应教程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学号:21
成绩:
基础物理化学实验报告
实验名称:二组分溶液沸点—组成图
的绘制
应用化学二班级3 组号
实验人姓名:xx
同组人姓名:xx
指导老师:周崇松
实验日期:2013.9
湘南学院化学与生命科学系
一.实验目的
1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理
在一定的外压下,纯液体的沸点是恒定的,但对于完全互溶双液系,沸点
不仅与外压有关,而且还与其组成有关,并且在沸点时,平衡的气-液两相组成往往不同。
根据相律:F=C-P+2,一个气液共存的二组分体系,其自由度为2,只需再任意确定一个变量,其自由度就减为1,整个体系的存在状态就可以用二维图来描述。
本实验中采用在一定压力下,作出体系的温度T 和组分x 的关系图,即T-x 图。
完全互溶体系的T-x 图可分为三类:①液体与Raoult 定律的偏差不大,在T-x 图上,溶液的沸点介于两种纯液体的沸点之间(图1.a ),如苯-甲苯系统;②由于两组分的相互作用,溶液与Raoult 定律有较大的负偏差,在T-x 图上存在最高沸点(图1.c ),如卤化氢-水系统;③ 溶液与Raoult 定律有较大的正偏差,在T-x 图上存在最低沸点(图1.b ),如乙醇-水系统。
②和③类溶液,在最高或最低沸点时的气-液两相组成相同,这些点称为恒沸点,此浓度的溶液称为恒沸点混合物,相应的温度称为恒沸温度,相应的组成称为恒沸组成。
本实验所要测绘的环己烷-乙醇体系即属于第二类溶液。
对于一个组成恒定的封闭系统,当系统达到气液平衡温度时,气液两相的组成和温度恒定不变,以此便能得到该温度下的平衡气-液两相组成的一对坐标。
依次改变系统的组成就能得到一系列的平衡气-液两相组成坐标点,用光滑曲线连接即成相图。
实验所用的沸点仪结构如图2,冷凝管底部的小球用以收集冷凝下来的
气相样品。
电热丝直接浸入溶液中加热可避免暴沸现象,温度计外的小玻璃罩有利于降低周围环境可能造成的温度计读数波动。
平衡时气-液两相组成的分析用的是折射率法,因为溶液的折射率与其组成有关。
若在一定温度下,测得一系列已知浓度溶液的折射率,作出该温度下溶液的折射率-组成工作曲线,就可通过测量同温度下的未知浓度溶液的折射率得到此溶液的浓度。
因折射率是温度的函数,测定时必须严格控制阿贝折光仪的测量温度。
t/℃
t/℃
t/℃
A
A
A
B
B
B
x B (a) x B (b) 气
气
气
液
液
液
x B (c)
三、实验仪器和试剂
仪器:蒸馏瓶,阿贝折光仪,超级恒温槽,移液管两支,精密数字温度计,滴管若干,吸球。
试剂:环己烷(AR ),无水乙醇(AR )。
丙酮、重蒸馏水、80%、60%、40%、20%环己烷—-乙醇标准混合液;这种组成的环己烷—乙醇混合液。
四、实验步骤(环己烷中加入乙醇)
1.工作曲线的测定:测定沸点与组成的关系:使用折光率仪测量纯环己烷,
纯乙醇,80%、60%、40%、20%环己烷—-乙醇标准混合液相应的折光率。
以折射率对浓度作图,即可绘制工作曲线。
2.一定组成环己烷——乙醇混合液沸点及气液两相折射率的测定。
按图装
好装置后,加入药品,环己烷/乙醇:26.21ml/0.45ml 、25.44ml/1.23ml 、23.41ml/3.25ml 、19.46ml/7.21ml 、17.15ml/9.52、11.61ml/15.85ml 、6.4ml/20.23ml 、1.41ml/25.26ml 、0ml26.65ml ,再加入几小块沸石,加热回流。
3.待温度读数稳定后,将蒸馏瓶稍稍倾斜,使小槽中的冷凝回流蒸气瓶,发福倾倒三次,待小槽收集满后,记下沸点温度,停止加热,立即取出小槽中的气相样品,测其折光率。
同时用另一短取样管从磨口取出少量液相混合物测其折光率。
4.测完气、液相折光率后,将混合物从磨口倒回原试剂瓶中,不必弄干蒸
馏瓶,继续取下一号混合液进行实验。
直到做完为止。
5.实验注意事项:
(1)加热电阻丝一定要被欲测液体浸没,否则通电加热时可能会引起有机
液体燃烧;所加电压不能太大,加热丝上有小气泡逸出即可;温度计的水银球不要直接碰到加热丝。
(2)一定要使体系达到气液平衡,即温度读数要稳定,然后再取样;先停
止通电再取样。
(3) 注意保护阿贝折射仪的棱镜,不能用硬物触及(如滴管),擦拭棱镜需
用擦镜纸。
五.实验结果及数据处理:
环己烷百分比及折光率
2
3
4
6
图2. 沸点仪结构简图
1.辅助温度计;
2.测量温度计;
3.加料口;
4.加热丝;
5.冷凝液 取样口;
6.盛冷凝液的小球
%
20
40 60 80 100 环己烷
1.3591 1.3661
1.755
1.3914
1.4102
1.4236
20%
40%
60%
80%
100%
1.35
1.361.371.381.391.40
1.411.421.43折光率
环己烷的百分比
工作曲线
.3
混合液编号
混合液近似组成% (环己烷)
温度 ℃ 气相冷凝液分析
液相分析
折光率
%(mol )环己烷
折光率 %(mol )环己烷
1
100
75
1.4213 1.0014
1.4214
1.0074
2 97 78.51 1.4066 78.20 1.421
3 100.06 3 92 70.49 1.4005 69.13 1.422
4 101.70 4 80 62.99 1.4137 88.76 1.4187 96.20 5
60
63.34
1.3966
63.33
1.4013
70.32
据实验所记录的数据及工作曲线可得:
64666870727476
0.0
0.2
0.4
0.6
0.8
1.0
环己烷的百分比 (100%)
温度 (摄氏度)
气相 液相
六、误差分析:
根据物理化学手册得其恒沸点为64.62 ℃ 组分为 0.5263
6 50 63.99 1.4190 96.64 1.3949 60.80
7 30 64.81 1.3994 67.49 1.3790 37.15
8 15 69.30 1.3688 21.98 1.3616 11.27
9 3 75.20 1.3612 10.68 1.3589 7.26 10 0
74.65 1.3616 0.0077 1.3614 0.0084
实验所得为恒沸点为64.2℃组分为0.5424误差不是很大
1. 本实验的主要误差来源:给双液体系加热而产生的液相的组成并不固定,而且加热的时间长短不十分固定,因此而使测定的折光率产生误差。
另外,温度计水银球的位置并不固定,有时比较靠近电热丝,测得的温度稍微偏高。
2. 实验时测定气相折射率时不够迅速,导致温度波动较小,温度变化不大,使得气相蒸馏挥发出去。
3.因该组仪器存在问题,故数据属于和旁边组一起共用的仪器测试数据。
