高中化学专题——化学能与热能
高三化学一轮复习化学能与热能

高三化学一轮复习化学能与热能在高三化学的一轮复习中,“化学能与热能”这一板块是非常重要的基础知识。
它不仅是高考的常考内容,也是理解化学反应本质和应用的关键。
首先,我们来明确一下什么是化学能。
化学能是物质发生化学反应时所释放或吸收的能量。
而热能呢,简单来说就是与温度相关的能量形式。
当化学能发生转化时,常常会以热能的形式表现出来。
化学反应的过程中,能量的变化是必然存在的。
有的反应会释放出能量,比如燃烧反应,燃料燃烧时会放出大量的热,这就是化学能转化为热能的典型例子。
而有的反应则需要吸收能量才能进行,像碳酸钙受热分解为氧化钙和二氧化碳的反应,就需要从外界吸收热量。
我们来深入探讨一下化学反应中能量变化的原因。
从微观角度看,化学反应的本质是旧化学键的断裂和新化学键的形成。
断裂旧化学键需要吸收能量,而形成新化学键则会释放能量。
如果吸收的能量大于释放的能量,反应就表现为吸热;反之,如果释放的能量大于吸收的能量,反应就表现为放热。
在判断一个化学反应是吸热还是放热时,我们可以通过反应热来衡量。
反应热是指化学反应在一定温度下进行时,所释放或吸收的热量。
如果反应热为正值,表示反应吸热;如果反应热为负值,表示反应放热。
那么,如何准确地计算反应热呢?这就需要用到盖斯定律。
盖斯定律指出,化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关。
这意味着,无论一个反应是一步完成还是分几步完成,其反应热都是相同的。
在实际应用中,化学能与热能的相互转化有着广泛的用途。
例如,在工业生产中,利用化学反应释放的热能来进行加热、发电等;在日常生活中,我们使用的暖宝宝,就是利用铁粉氧化这一放热反应来提供热量。
对于高三的同学们来说,掌握好化学能与热能这部分知识,不仅有助于应对考试中的相关题目,更能为后续学习更深入的化学知识打下坚实的基础。
在复习过程中,要注重理解概念,多做一些练习题来加深对知识的理解和应用。
比如,通过做一些关于反应热计算的题目,来提高自己的计算能力和解题技巧。
高二化学化学能与热能1

表示为: △H=E生— E反 也就是说Na+、Cl-间形成离子键时释 放了能量。
一、化学键与化学反应中能量变化关系 H + H → H–H ; ∆H=-436kJ/mol
H-H → H + H ; ∆H=+436kJ/mol
CH4 → C +4H ; ∆H=+1660kJ/mol
C +4H → CH4 ; ∆H=-1660kJ/mol
形成1mol化学键时释放的能量或断 开1mol化学键所吸收的能量叫做键能
1、化学键的断裂和形成是化学反应中 能量变化的主要原因
2、从键能的角度看: 反应物 生成物 化学反应: 旧化学键断裂 新化学键形成 吸收能量E反 放出能量E生
当E反 > E生 当E反 < E生
表示为:
反应吸收能量 反这要烧着了,可不是闹着玩儿的!”说着就要跳下土圪台。郭氏赶快拉住她,说:“没有事儿,摇‘火团儿’是三狗子的绝活 儿,他掌握着分寸呢!你没有看见妞儿看得多高兴吗?就别去扫娃娃们的兴了!”刘氏只好继续提心吊胆地看着,发现这三狗子果然很 会掌握分寸,每一次在妞儿面前变换花样儿都是有惊无险,也就慢慢放下心来。一会儿,裴氏发现青山从人群中挤出来了。再继续望去, 呵,这小子往对面的一棵垂柳树下快步走去了„„很快,青海也出来了。左顾右盼一会儿以后,往南面儿人群外一溜儿小跑。顺着青海 跑去的方向望去,一个穿了花裳儿的人影儿正在那儿招手呢!一会儿,俩人并肩走到旁边的树阴里看不清楚了„„裴氏无声地笑了。顺 着裴氏的眼神儿,郭氏也看到了这一切。看着裴氏宽心的笑容,郭氏满怀歉意地说:“弟妹啊,很快了!等秀儿做了俺的媳妇以后,你 也就可以当婆婆了!”裴氏高兴地点点头,说:“是啊,俺和他爹盼了好几年了哇!”刘氏也说:“俺家二壮也在等着了呢!等英子嫁 给大壮以后,俺们就给二壮定了那门亲了!”郭氏问:“没有听你说过哇!也是咱们镇上的?”刘氏说:“不,不是咱们镇上的,是俺 娘家隔壁的小花儿。小花儿和她姐姐一样,也是一个很好的女娃儿!她姐姐是去年腊月才出嫁的,没有出村儿,嫁了全村儿上最好的人 家呢!”站在更远处观看的耿老爹、耿憨和董家成老哥仨就着明亮的月光,清楚地看到耿正扶着秀儿的腰,慢慢地往村南的那棵大槐树 走去了„„不一会儿,大壮也扶着耿英的腰,慢慢地向南走一段儿以后,拐到通往小河边的那条路上去了„„10第百三二回 轻轻松松看 水稻|(高高兴兴收家什,轻轻松松看水稻;亲情融融逗乐子,欢欢喜喜盼拜月。)送左邻右舍两家人都回去以后,耿老爹要来帮着收拾 饭桌,郭氏推开他,说:“去去去,俺们娘儿三个呢!”耿老爹笑一笑,听话地乖乖退在一旁,对两个儿子说:“听青海说,你们把木 匠师傅们下午做的活计都安排好了?”耿正说:“是告了他们一下了!”耿老爹说:“那你们俩和爹一起去看看咱家的水稻哇,已经开 始灌浆了呢!”耿直一听就高兴了,说:“是哩,俺俩是有一段日子没去看了呢,光顾了学堂那边的事情了。”耿正也说:“都开始灌 浆了?那咱现在就走哇,俺也很想去看一看呢!”郭氏一边拾掇碗筷一边说:“你俩去看看哇,你爹在地边上扎了好多草人儿,热闹着 呢!”那边爷儿三个各自拿起一顶草帽出门去了。这边娘儿三个慢慢地收拾剩下的饭菜。看着剩下的饺子太多了,郭氏洗干净一个大海 碗,装满了让耿英给董家成家送去。耿英很快就送了返回来,郭氏将空了的大海碗里再装满了,说:“这一碗给你憨婶儿送去!”耿英 又返回来了,郭氏再
高中化学 化学能与热能

化学能与热能课标要求1.认识物质具有能量,认识吸热反应与放热反应,了解化学反应体系能量改变与化学键的断裂和形成有关。
2.能基于化学键解释某些化学反应的热效应。
3.认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律。
知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。
课标要求4.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示,了解盖斯定律及其简单应用。
5.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
6.能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,能运用反应焓变合理选择和利用化学反应。
核心考点核心命题角度考题取样命题情境素养能力化学反应中能量变化的有关概念 结合能量变化图像判断吸热反应和放热反应2016海南,11学习探索归纳与论证结合反应历程考查化学反应能量变化(新角度)2020天津,10学术探索归纳与论证热化学方程式结合物质的燃烧热或物质的能量书写热化学方程式(新角度)2020全国卷Ⅰ,28(1)学习探索理解与辨析盖斯定律的应用及反应热的计算和大小比较根据键能计算反应热2015新课标全国卷Ⅱ,27(1)生活实践归纳与论证根据盖斯定律计算反应热(热点角度)2019全国卷Ⅲ,28(2)学习探索归纳与论证高考怎么考高考中常结合基本概念考查热化学方程式的书写和反应热的计算等,体现高考命题的基础性;也会结合最新科研成果中的反应历程等考查反应过程中的能量变化,体现高考命题的创新性。
预计2022年高考中,有关反应热的考查内容将不断拓宽,对热化学方程式的书写及盖斯定律的应用要求会有所提高,另外试题很可能涉及能源问题,引导考生形成与环境和谐共处、合理利用自然资源的观念。
考点1 化学反应中能量变化的有关概念考点帮·必备知识通关考法帮·解题能力提升考法1 化学反应中的能量变化考点2 热化学方程式考点帮·必备知识通关考法帮·解题能力提升考法2 热化学方程式的正误判断与书写考点3 盖斯定律的应用及反应热的计算和大小比较考点帮·必备知识通关考法帮·解题能力提升考法3 反应热的计算考法4 反应热的大小比较11.反应热、焓变(1)反应热:在等温条件下,在化学反应过程中吸收或放出的热量称为反应热。
化学能与热能

五、生物体中的能量转换
氧化
剧烈氧化(燃烧)
生物氧化
若反应相同, 则放出能量相 等
在体温条件和酶的催化下,经一系列的化学反应 逐步进行的,能量的转化率和利用率都很高。
欲使煤在煤炉中充分燃烧,下列 措施可行的是( )
A、B A、向炉内喷吹空气 B、把大块状煤碾成粉末 C、使用MnO2催化剂 D、提高炉内体系的温度
四、燃料的充分燃烧
课本p52
根据生活中的知识,回答下面的问题: 1、燃料充分燃烧的条件是什么? 2、燃料不充分燃烧会造成怎样的结果? 3、为使燃料充分燃烧,要通入足够多 的空气。是否空气越多越好?
4、增大燃料与空气接触面可采取哪些措施?
5、煤直接燃烧会对环境产生哪些污染? 6、高效、清洁利用煤炭的重要途径有哪些?
化学上把有热量放出的化学反应叫做放热反应。 吸收热量的化学反应叫做吸热反应。
实验2-1
实验探究思考
锌片
实验2-2
(3)实验2-1 20mL2mol/L的盐酸和20mL2mol/L的NaOH溶 液混合,并用温度计测量溶液温度的变化。 思考:强酸与强碱反应的实质是 H+ + OH- = H2O , 中和反应是吸热反应还是放热反应? 结论:中和反应是放热反应。 中和热:酸与碱发生中和反应 生成1molH2O所释放的热量。
4、 如右图所示,把试管放入盛有25℃时 饱 和石灰水的烧杯中,试管中开始放入 几小块镁片,再用滴管滴入5mL盐酸于 试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是 (3)写出有关反应的离子方程式 (4)由实验推知,MgCl2 溶液和H2 的总能 量 (填“大于”、“小于”、“等于”) 镁片和盐酸的总能量.
高中化学 化学能与热能

①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) 574 kJ· mol
-1
ΔH=-
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) 160 kJ· mol
-1
ΔH=-1
则甲烷直接将NO2还原为N2的热化学方程式为 _________________________________________________________ _________________________________________________________ ______________________________。
盖斯定律
(1)概念:表示参加反应的物质的量和 反应热 的关系的化学方 程式。 (2)意义:表明了化学反应中的 物质 变化和 能量 变化。 如:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ· mol
-1
表示在25℃、101 kPa条件下, 2molH2(g)和1molO2(g)反应
答案:C
点拨:本题考查化学平衡和反应热知识,意在考查考生将实 际问题分解,通过运用相关知识,采用分析、综合的方法,解决 简单化学问题的能力。
5.(2013· 高考名校联考信息优化卷)1.01×105 Pa下,1.0 kg丁 烷在空气中完全燃烧生成CO2和液态水放出5×104 列判断正确的是( ) kJ的热量。下
-
的液态乙醇与气态乙醇完全燃烧生成稳定物质,后者放出的热量 多;D项,因反应为放热反应,故正反应的活化能小于逆反应的活 化能。
答案:B
Hale Waihona Puke 点拨:本题考查热化学知识,考查考生理解和应用能力。难 度中等。
高三化学化学能与热能

升高
反应 后 温度
结
论
1. 该反应是 放热 反应,酸 碱中和反应是 放热 反应; 2. 能转化为 能释放 化学 热 出来。
知识回顾
1、化学反应的基本特征是什么? 有新物质生成。同时伴随着 光和热以及气体或沉淀。 2、化学反应的实质: 旧化学键的断裂和新化学键的形成。
从化学键的角度分析
一个化学反应的过程,本质上就是 旧化学键断裂和新化学键形成的过程。
2、下列说法正确的是( C )
A.需要加热方能发生的反应一定是吸热反应 B.放热反应在常温下一定能进行 C.反应是放热还是吸热,必须看反应物和生 成物所具有的总能量的相对大小 D.化学反应释放的能量一定是热量
凤凰平台 / 凤凰平台
twd36twu
一定不会少给的!”耿正说:“倘若如此,我们一定认真履约!”老板听了很高兴,又说:“还有,在我们酒店献艺期间,你们每日上午来酒店 的时间不可以晚于午时初,午饭和晚饭酒店里免费提供,晚上离开酒店的时间通常不会晚于戌时中;如果晚于这个时间,酒店将现送数量不等的 小费。”耿正说:“谢谢,我们一定会在每日的午时初之前来酒店上班!”老板再次依次看过眼前这举止不俗的兄妹三人,非常有礼貌地问: “请问各位贵姓,怎么称呼啊!”耿正说:“免贵姓耿,我叫耿正,妹妹叫耿英,弟弟叫耿直。”老板连声说:“好名字,好名字啊!”耿英说: “请老板放心,我们一定会在贵酒店用心献艺的!”老板更高兴了,挥手招呼周围的伙计们:“你们都过来和这兄妹仨认识一下吧,以后可要多 照应他们啊!”事实上,老板对原先经常来该酒店献艺的几个艺人都不是十分满意,因此并不曾与哪一个艺人签署过任何形式的聘用契约。他们 只是随意来随意走,哪一个先到了就在这里做一次。后到的没有位置了,就转到其他的酒店另行招揽生意去了。至于酬金,虽然给得很够意思, 但也都只是以小费的形式当日交给就是了。此外,酒店里也从来不为他们提供任何饭菜,只不过吩咐伙计们给以茶水照顾和礼貌接待而已。今日 提出来要与耿正兄妹三人签署聘用契约,不过是该老板的突发奇想而已。这个独具慧眼的精明人看出来,这兄妹三人肯定能给自己的酒店带来丰 厚的回报,因此不但想要留住他们,而且还要约束他们没有机会再去其他的酒店展现才华。十天的试用期圆满结束了,耿正兄妹三人组成的拉奏 演艺说唱班取得了空前的好效果,“盛元酒店”的上座率日日增加!来这里吃饭的客人,一帮接着一帮在酒店门口排长队等候。老板对耿正兄妹 三人刮目相看,提出来愿意以每月三十两纹银的高薪,与他们签署长期聘用契约,并慎重地征求耿正的意见,看他们兄妹三人到底愿意与酒店签 署一份多长时间的契约。耿正和耿英商议后认为,在酒店献艺期间除了每日需要自掏腰包吃简单的早餐之外,再没有其他消费了。因此,只要做 满了三个月以后,积攒的银子就足够做一个小本的买卖了。虽然在这个大酒店献艺确实是无本大利,但他们不想长期做这个。于是,耿正郑重地 对老板说:“多谢老板器重,我们想先签署一份三个月的契约!您看如何?”老板有点儿不解地问:“只签三个月?”耿正说:“是,三个月!” 老板想一想,爽快地说:“行,那就先签三个月吧。三个月的契约期满后,咱们再商量续签的事情!”当下,老板就当着耿正兄妹三人的面,亲 自口授,让柜台的账房先生拟定,并誊写了完全相同的两份为期三个月的聘用契约,由他自己和耿正分别签字画押以后,双方各执一份。然后, 他又
高中化学知识点复习:化学能与热能

高中化学知识点复习:化学能与热能
高中化学知识点复习:化学能与热能
高中化学知识点复习:化学能与热能
【】为了帮助考生们了解高中学习信息,查字典化学网分享了高中化学知识点复习:化学能与热能,供您参考!
一、化学能与热能
1、在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。
化学键的断裂和形成是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
E反应物总能量E生成物总能量,为放热反应。
E反应物总能量
2、常见的放热反应和吸热反应
常见的放热反应:①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸、水反应制氢气。
④大多数化合反应(特殊:C+CO2 2CO是吸热反应)。
常见的吸热反应:①以C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g) = CO(g)+H2(g)。
②铵盐和碱的反应如
Ba(OH)2?8H2O+NH4Cl=BaCl2+2NH3+10H2O
③大多数分解反应如KClO3、KMnO4、CaCO3的分解等。
[练习]1、下列反应中,即属于氧化还原反应同时又是吸热。
高中化学 化学能和热能
化学反应和能量化学能和热能1、各种物质都储存有。
不同的物质组成不同、结构不同,化学能也不同。
2、化学反应的实质从化学键的角度看,在反应物转化为生成物的过程中经历了过程。
3、化学反应过程中旧键的断裂要能量,而新键的形成则要能量,从而使化学反应在发生物质变化的同时还伴随着变化。
4、放热反应:断键所吸收的能量成键所释放的能量反应物的总能量生成物的总能量常见的放热反应:吸热反应:断键所吸收的能量成键所释放的能量反应物的总能量生成物的总能量常见的吸热反应:化学能与电能一、化学能与电能的关系1.火电:化学能转化为电能。
2.原电池:将化学能为电能的装置。
3. 电解池:将转化为化学能的装置二、原电池的工作原理1、定义:凡是借助反应把转化为的装置叫原电池。
2、原电池中的两极、两极反应和总反应的确定(1)原电池中作负极,电子而发生氧化反应。
(2)原电池中或非金属导体作正极,电子而发生还原反应。
(3)将电池正、负极两电极反应式按照得失电子总数相等的原则相加即得总反应式。
(4)原电池中电子..方向与电子..的流向是由极→导线→极,而电流的流向相反。
如铜锌原电池中作负极,发生反应:作正极,发生反应:。
总反应式为:在外电路的电子由(极)经导线流向(极),而电流方向则是由。
3、原电池形成的一般条件:(1)(2)(3)(4)三、常见的化学电源1、干电池(一次电池):①锌锰普通干电池,②碱性锌锰电池;例如:锌锰普通干电池负极( ):,正极( ) 电解液:2、充电电池(二次电池):①铅蓄电池:负极正极电解液②镍镉电池:负极正极电解液③锂离子电池。
3.燃料电池:的发电装置,燃料电池和干电池或蓄电池的主要差别在于。
氢氧燃料电池(以KOH为电解质溶液,电极一般是惰性电极)负极:,正极:,电池总反应:4、原电池原理的应用:(1)应用原电池原理判断金属活动性(2)形成原电池使负极金属反应速率化学反应的速率与限度一.化学反应速率及其表示方法1.定义:2.表示方法:单位:3.注意:同一反应选用不同物质表示同一段时间内的反应速率时,其数值可能不同,但表达的意义相同,各物质的反应速率之比等于该反应方程式中相应的之比。
《化学能与热能》教案(优秀4篇)

《化学能与热能》教案(优秀4篇)《化学能与热能》教案篇一一、教学目标1.了解化学能与热能的相互转化;了解吸热反应、放热反应以及化学反应在提供热量上的重要作用;2.通过讨论交流,加强分析、综合的思维能力;3.体验科学探究的乐趣,树立节约能源的意识。
二、教学重难点【重点】化学能与热能的相互转化。
【难点】通过测定反应中的温度变化,理解化学能与热能的相互转化。
三、教学过程环节一:导入新课【提出问题】展示“自热饭盒”的图片,观察一下自热饭盒与普通饭盒有什么不同之处?【学生回答】有一个“加热包”。
【教师引导】这个小小的加热包就是利用了化学反应来提供热能。
其实在我们生活中经常会利用化学反应来提供能量,那今天就让我们共同来学习《化学能与热能》这节课的内容。
环节二:新课讲授【教师提问】回忆之前所做的化学实验,想一想化学反应中能量变化的主要表现形式是什么呢?【学生回答】化学反应中能量变化的主要表现形式:热量变化,即吸热或放热。
【教师引导】能否根据反应过程中的热量变化可将化学反应进行分类?【学生回答】根据反应过程中的热量变化可将化学反应分为放热反应和吸热反应。
【教师总结】放热反应即指反应过程中放出热量的反应,吸热反应即指反应过程中吸收热量的反应。
【过渡】接下来我们用实验的方式感受一下吸热反应和放热反应。
实验1:【演示实验】在一支试管中加入2~3mL 6mol/L的盐酸,再插入用砂纸打磨光的铝条,观察现象,并用温度计测量溶液温度的变化。
【学生思考】为什么要用砂纸打磨铝片?(因为铝片表面有氧化膜,打磨铝片能够除去表面的氧化膜。
)【描述现象】有气泡产生,温度计的示数上升,这是因为酸遇活泼金属反应生成氢气和盐,反应放热。
实验2:【演示实验】如图所示【小组讨论】为什么要将八水合氢氧化钡晶体磨成粉末?为什么混合后要立即用玻璃棒搅拌?反应后有什么气体产生?(磨成粉末、玻璃棒快速搅拌混合物是为了使反应迅速反应完全;有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝说明有NH3生成) 【描述现象,得出结论】1.将晶体混合后立即用玻璃棒快速搅拌混合物有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝说明有NH3生成。
第一课时 化学能与热能

玻璃棒的作用:搅拌, 玻璃棒的作用:搅拌,使混合物充分接触 反应物成糊状的原因: 反应物成糊状的原因:结冰粘结
实验2- 实验 -3 反应物 及用量
改为下列两组对比实验
酸 HNO3 2 mL 1 mol/L HCl 2 mL 1 mol/L
三、化学能的应用
1)利用热量进行生活、生产和科研。 )利用热量进行生活、生产和科研。 2)利用热能使很多化学反应得以发生。 )利用热能使很多化学反应得以发生。 如: 获取其中的能量 化学反应 获取生成物
【科学视野】 生物体中的能量转化 科学视野】
人体内发生的氧化还原反应与体外的燃烧本 人体内发生的氧化还原反应与体外的燃烧本 氧化还原反应 放热反应。 质相同,都是放热反应 只是二者条件不同, 质相同,都是放热反应。只是二者条件不同,且 合理有效。 前者更加合理有效 前者更加合理有效。
键能 越大
化学键 越稳定
含有该化学键的物 质的化学能越低 质的化学能越低
该物质 越稳定
练习: 练习: (1)某物质较活泼,即该物质所蕴藏的能量 )某物质较活泼, 较 较 高 (即所含化学能 即所含化学能 高 ),该物质 , 不稳定 ,该物质中的化学键 较易 断 小 。
裂,化学键的键能较
2、能量转化 (宏观 、 宏观) 宏观 反应物键能总和> 反应物键能总和>生成物键能总和 断键吸收的能量> 断键吸收的能量>成键释放的能量 反应物的总能量< 反应物的总能量<生成物的总能量 吸收能量
碱 NaOH 2 mL 1 mol/L NaOH 2 mL 1 mol/L 混合前温度 室温 室温 t1 t2 混合后温度 结 论 对实验进行 归纳和概括 HNO3与NaOH发生 发生 中和反应时放热 中和反应时放热 HCl与NaOH发生 与 发生 中和反应时放热 中和反应时放热
高一化学 化学能与热能
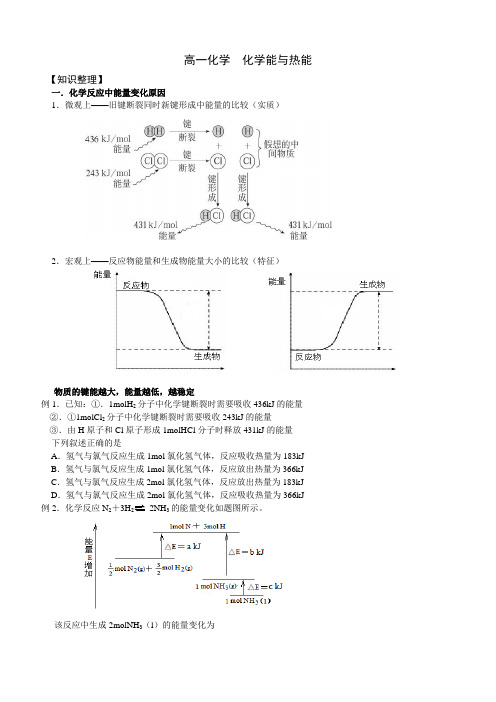
高一化学化学能与热能【知识整理】一.化学反应中能量变化原因1.微观上——旧键断裂同时新键形成中能量的比较(实质)2.宏观上——反应物能量和生成物能量大小的比较(特征)物质的键能越大,能量越低,越稳定例1.已知:①.1molH2分子中化学键断裂时需要吸收436kJ的能量②.①1molCl2分子中化学键断裂时需要吸收243kJ的能量③.由H原子和Cl原子形成1molHCl分子时释放431kJ的能量下列叙述正确的是A.氢气与氯气反应生成1mol氯化氢气体,反应吸收热量为183kJ B.氢气与氯气反应生成1mol氯化氢气体,反应放出热量为366kJ C.氢气与氯气反应生成2mol氯化氢气体,反应放出热量为183kJ D.氢气与氯气反应生成2mol氯化氢气体,反应吸收热量为366kJ 例2.化学反应N2+3H22NH3的能量变化如题图所示。
该反应中生成2molNH3(l)的能量变化为例3.下表中的数据是破坏1 mol 物质中的化学键所吸收的能量(kJ )。
这一数据的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热,反应热等于反应中断裂旧化学键消耗的能量之和与反应中形成(1)在HCl 、(2)对于反应X 2 + H 2=2HX (X 2代表Cl 2、Br 2、I 2),相同条件下,消耗等量氢气时,放出热量最多的是__________;(3)反应Br 2 + H 2=2HBr ,当生成2 mol HBr 时放出_________ kJ 能量。
二.化学能与热能的相互转化1.质量与能量是相互联系的,统称为质能守恒定律。
2.对放热反应和吸热反应的定义 (1)吸热反应(△H>0) Ba(OH)2·8H 2O + NH 4Cl = (2)放热反应(△H<0) ➢ 中和热H ++OH -= H 2O ➢ 燃烧热例4.已知H 2(g)和F 2(g)化合生成40gHF(g)放出热量为270kJ 。
化学能与热能(反应热)

7、利用途径有:
煤的气化(水煤气或干馏煤气)
将焦炭在高温下与水蒸气反应,则得到CO和H2 C(s) + H2O(g) H2(g)
高温
CO(g) +
煤的液化
盖斯定律及其应用
化学反应不管是一步完成还是分几步完 成,其反应热是相同的。 即:化学反应的反应热,只与反应的始态 (各反应物)和终态(各生成物)有关,而与反 应具体进行的途径无关。
应用: 间接计算一些无法直接测定的反应热
看下面的图理解盖斯定律
某人从山下A到达山顶B, 无论是翻山越岭攀登而上, 还是坐缆车直奔山顶,其所 处的海拔都高了300m 即山的高度与A、B点的海 拔有关,而与由A点到达B 点的途径无关 这里的A相当于反应体系的 始态,B相当于反应体系的 终态.山的高度相当于化学 反应的反应热
C(s)+ ½ O2(g)=CO(g)因为C燃烧 时不可能完全生成CO,总有一部分CO2生 成,因此这个反应的ΔH无法直接测得,请 同学们自己根据盖斯定律设计一个方案计 算该反应的ΔH。 提示(1) C (s) + O2(g) = CO2(g) △H1=-393.5 kJ/mol (2) CO (g) + ½O2(g) = CO2(g) △H3=-283.0 kJ/mol
4、足够多的空气并不意味空气越多 越好。 因为过量的空气会带走部分能 量,同样会造成浪费。
因此要适当控制。
6、会产生大量的烟尘和SO2造成大气 的污染,形成酸雨。
酸雨的形成: 工业上大量燃烧含硫燃料,产生SO2、 SO2与空气中的烟尘、氧化物等接触生成 SO3,SO3与水(H2O)生成硫酸(H2SO4), 对土壤、植物造成危害。
高一化学化学能与热能

第二章化学反应与能量第一节化学能与热能重难点一化学反应中的能量变化1.化学键断裂与形成角度(1)若E1>E2,化学反应表现为吸热反应。
(2)若E1<E2,化学反应表现为放热反应。
2.物质本身能量角度(1)若E′>E″,化学反应表现为放热反应。
(2)若E′<E″,化学反应表现为吸热反应。
特别提醒物质具有的能量与其稳定性之间的关系:(1)物质具有的能量越低越稳定,参加反应时,化学键断裂吸收的能量就越多,而如果是通过新键形成而生成该物质,则放出的能量就越多。
(2)物质具有的能量高,则其不稳定,参加反应时断键所需能量低,该物质性质活泼,而形成该物质时,放出的能量较少。
重难点二中和热及其测定1.中和热(1)概念:强酸与强碱稀溶液发生中和反应生成1 mol H2O时所释放的热量称为中和热。
(2)中和热的特点中和热只适用于中和反应时热效应判别,且数值为生成1 mol 水时所释放的热量,注意以下特点:①中和反应都放出热量。
②稀溶液中,强酸与强碱的中和热为定值:57.3 kJ/mol。
③弱酸与弱碱中和热偏低,因为弱酸或弱碱电离过程会吸热。
2.中和热测定装置图重难点三常见的吸热反应和放热反应1.吸热反应(1)大多数的分解反应、分子分解成原子,如NH 4Cl=====△HCl ↑+NH 3↑;(2)一些晶体的反应,如Ba(OH)2·8H 2O +2NH 4Cl===BaCl 2+2NH 3·H 2O +8H 2O ;(3)C +CO 2=====高温2CO ;(4)以C 、H 2、CO 为还原剂的氧化还原反应,如C +2CuO=====高温2Cu +CO 2↑,C +H 2O=====高温CO +H 2。
2.放热反应(1)一切燃烧反应;(2)活泼金属与酸或水的反应;(3)酸碱中和反应;(4)大多数化合反应(但有些化合反应是吸热反应,如N 2+O 2=====高温或放电2NO 等)、原子合成分子;(5)物质的缓慢氧化。
高中化学专题复习《化学能与热能》

自主排查定弱点
命题角度一
命题角度二
专题作业
3.催化剂能改变反应的焓变。( × ) 解析 催化剂不改变反应的焓变。
自主排查定弱点
命题角度一
命题角度二
专题作业
4.HCl 和 NaOH 反应的中和热 ΔH=-57.3 kJ·mol-1,则 H2SO4 和 Ca(OH)2 反应的中和热 ΔH=-114.6 kJ·mol-1。( × )
16.化合反应都是放热的。( × )
解析 如 C(s)+CO2(g)===2CO(g)是吸热反应。
自主排查定弱点
命题角度一
命题角度二
专题作业
17.旧键断裂需要吸收能量,新键形成会放出能量。( √ ) 18.ΔH1=-a kJ·mol-1,ΔH2=-b kJ·mol-1,若 a>b,则 ΔH1>ΔH2。( × )
自主排查定弱点
命题角度一
命题角度二
专题作业
1.反应热的计算
自主排查定弱点
命题角度一
命题角度二
专题作业
(1)从宏观角度分析 ΔH=H1(生成物的总能量)-H2(反应物的总能量) (2)从微观角度分析 ΔH=E1(反应物的键能总和)-E2(生成物的键能总和) (3)从活化能角度分析 ΔH=E1(正反应活化能)-E2(逆反应活化能)
自主排查定弱点
命题角度一
命题角度二
专题作业
自主排查定弱点
自主排查定弱点
命题角度一
命题角度二
专题作业
正误判断,正确的打“√”,错误的打“×”。
1.
如图表示燃料燃烧反应的能量变化。( × )
解析 燃料燃烧为放热反应。
自主排查定弱点
第一节化学能与热能

第一节 化学能与热能
复习
金属钠
化学反应的本质是什么? 旧键断裂
氯气
不稳定
电子转移
稳定 新键形成
更稳定
Na+
Cl-
一、化学键与化学反应中能量变化的关系 1、 断开反应物中化学键,吸收能量 形成生成物中化学键,放出能量
H + H → H–H 放出436kJ/mol H—H → H + H 吸收436kJ/mol F+F → F—F 放出155kJ/mol F—F → F + F 吸收155kJ/mol
放出能量
吸收能量
放出能量
吸收能量
(2)由键能相对大小来判断: 断开键吸收的总能量 > 形成键放出的总能量 吸收能量 断开键吸收的总能量 < 形成键放出的总能量 放出能量
【例1】断开1mol化学键所需吸收的能量称之为 键能。已知断开1molH-H键吸收能量436kJ,断 开1molCl-Cl键吸收能量243kJ,形成1molH-Cl键 释放能量432kJ。判断反应H2+Cl2=2HCl中发生 的变化: (1)断开键时吸收的总能量是 679kJ 。 (2)形成键时放出的总能量是 864kJ 。 (3)反应过程中 放出 (填“吸收”或“放出”) 能量 185kJ 。
二、化学能与热能的相互转化
1、两个守恒定律
质量守恒定律和能量守恒定律
2、能量变化的表现形式
热能
光能 电能 ……
吸热或放热
主 次
3、实验探究 (1)、铝条与盐酸的反应 现 象 结 论 有气泡产生,手摸试管感觉到热 ,溶液温度升高
反应放热
(2)、Ba(OH)2·8H2O与NH4Cl晶体的反应
现 象 结 论 有刺激性气味的气体产生,反应 物逐渐呈糊状。用手摸烧杯底, 有冰凉的感觉。
专题十二化学能与热能

专题十二 化学能与热能【教学目标】1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
【教学过程】知识点一 化学反应的焓变1.化学反应中的能量变化(1)化学反应中的两大变化:________变化和__________变化。
(2)化学反应中的两大守恒:________守恒和__________守恒。
(3)化学反应中的能量转化形式:__ __、光能、电能等。
通常主要表现为______的变化。
2.焓变 反应热【例1】化学反应N 2+3H 2 2NH 3的能量变化如图所示,该反应的热化学方程式是A .N 2(g)+3H 2(g) 2NH 3(l)ΔH =2(a-b-c ) kJ/molB .N 2(g)+3H 2(g) 2NH 3(g)ΔH =2(b-a ) kJ/molC .1/2N 2(g)+ 3/2H 2(g) NH 3(l)ΔH =(b+c-a )kJ/molD .1/2N 2(g)+ 3/2H 2(g) NH 3(g)ΔH =(a+b )kJ/mol【小结】1)化学键与化学反应中能量变化的关系发生化学反应时,断开反应物的化学键要________能量,形成生成物的化学键要________能量,这两个过程中的能量________,因此化学反应中必然伴随着能量的变化。
2)由化学键键能计算反应热:3.放热反应和吸热反应【例2】下列说法正确的是 A.B.C.D.吸热反应在一定条件下(如常温、加热等)也能发生【例3】下列变化过程,属于放热反应的是①酸碱中和反应 ②CO32-的水解 ③浓H 2SO 4④NH 4Cl 晶体与Ba(OH)2·8H 2O 混合搅拌 ⑤H 2在Cl 2中燃烧 ⑥氧化钙和水的反应 ⑦镁条与盐酸反应 ⑧碳和水蒸气反应 ⑨石灰石的分解【小结】知识点二中和热与燃烧热【例4】下列有关H+(aq)+OH-(aq)H2O(l)ΔH=-57.3 kJ/mol的离子反应说法正确的是A. B.反应C.D.代表稀的强酸与稀的强碱反应生成1 mol液态水时,放出热量57.3 kJ【例5】下列关于热化学反应的描述中正确的是A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/molB.CO(g)的燃烧热是283.0 kJ/mol,则2CO 2(g)2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/molC.已知中和热为ΔH=-57.3 kJ/mol,则醋酸和NaOH溶液反应生成1mol液态水时,放出热量57.3 kJD.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热【小结】1)燃烧热、中和热均是,ΔH____0,单位:______。
高中化学高考总复习 专题十一 化学能与热能

3.反应条件与放热反应、吸热反应的关系 不同的化学反应发生的条件不同,放热反应和吸热反应均能在一定条件下 发生。反应开始需要加热的反应可能是吸热反应,也可能是放热反应。吸 热反应开始时加热,反应后需要不断加热才能维持反应继续进行;放热反应 开始时加热,反应后会放出一定的热量,此热量能够使反应继续进行,则反 应过程中不需要再加热,如煤的燃烧,一旦热量足够使煤燃烧起来,之后煤 就可以继续燃烧下去,不再需要外界加热。由此可见,反应是吸热还是放热 与反应的条件没有必然的联系,而是取决于反应物和生成物具有的总能量 (或焓)的相对大小。
CH3CH2OH+3O2 2CO2+3H2O
(4)一些化合反应,例如: SO3+H2O H2SO4 CaO+H2O Ca(OH)2 CuSO4+5H2O CuSO4·5H2O 2.常见的吸热反应 (1)一些分解反应,例如: CaCO3 CaO+CO2↑
CuSO4·5H2O CuSO4+5H2O (2)一些复分解反应,例如: 2NH4Cl(s)+Ba(OH)2·8H2O(s) BaCl2+2NH3↑+10H2O (3)一些置换反应,例如:C+H2O(g) CO+H2 (4)一些化合反应,例如:CO2+C 2CO
A(g)+B(g) C(g) ΔH1<0 A(g)+B(g) C(l) ΔH2<0 C(g) C(l) ΔH3<0 因为ΔH3=ΔH2-ΔH1,ΔH3<0,所以ΔH2<ΔH1。 也可以按以下思路分析:
A(g)Biblioteka B(g) C(g)
C(l)
C(l)
因为ΔH1+ΔH3=ΔH2,ΔH1<0,ΔH2<0,ΔH3<0,所以ΔH2<ΔH1。 (2)同一反应的反应物状态不同时 S(g)+O2(g) SO2(g) ΔH1<0 S(s)+O2(g) SO2(g) ΔH2<0 S(g) S(s) ΔH3<0
化学能与热能

化学能与热能化学能与热能是两种重要的能量形式,它们在生产和生活中扮演着不可替代的角色。
本文将从定义、性质、转化等方面分别介绍化学能与热能。
一、化学能1. 定义化学能是指化学物质中含有的可供释放出来做功的能量。
一般来说,具有化学能的物质都是经过化学反应才能转化为其他物质,同时释放出能量。
2. 性质化学能的特点是容易储存,方便使用,且可以通过反应实现转化。
例如,化学电池就属于化学能的一种储存形式,可以通过电池反应来释放电能。
在这个过程中,化学能被转化为电能,然后再转化为为机械能、光能等不同形式的能量。
化学能的另一个性质就是能够释放出大量的热能。
例如,燃烧是一种常见的化学反应,其中燃料物质的化学能被迅速释放,同时放出大量的热能。
这种热能可以被用于加热房间、发动汽车等。
化学能的最后一个特点是容易受到化学物质、温度和压力等因素的影响。
例如,如果化学物质受到氧化或还原的作用,化学能就会发生改变;如果物质的温度和压力发生变化,化学反应的速度和效果也会发生变化。
3. 转化化学能可以被转化为其他形式的能量,例如电能、机械能、光能等。
以下是一些常见的化学能的转化方式:(1)电能:利用化学电池的反应将化学能转化为电能。
(2)机械能:利用发动机的化学反应将化学能转化为机械能。
(3)光能:利用光化学反应将化学能转化为光能。
(4)热能:利用燃烧反应将化学能转化为热能。
二、热能1. 定义热能是物体内部分子和原子的运动能量,也可以理解为物体温度上升的能量。
热能在自然和人类生活中起着重要作用,我们可以用它来制热、发电、炼钢、焊接等工作。
2. 性质热能的特点是容易传递和储存,且可以通过温度差实现转化。
例如,我们可以通过将热能在不同的物体和环境中传递来实现能量的储存和转化。
在这个过程中,热能可以被转化为电能、机械能等不同形式的能量。
热能的另一个性质就是可以被吸收和释放。
例如,我们可以使用太阳能板来吸收太阳辐射下的热能;我们也可以利用电子元件的热效应来产生电能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学能与热能
考点一 反应热与焓变
真题感悟——悟真题、明方向
1.(2018·北京)我国科研人员提出了由CO 2和CH 4转化为高附加值产品CH 3COOH
的催化反应历程。
该历程示意图如下。
下列说法不正确的是( D )
A .生成CH 3COOH 总反应的原子利用率为100%
B .CH 4→CH 3COOH 过程中,有
C —H 键发生断裂 C .①→②放出能量并形成了C —C 键
D .该催化剂可有效提高反应物的平衡转化率
[解析] CO 2和CH 4制备CH 3COOH 的化学方程式为CO 2+CH 4――→催化剂
CH 3COOH ,反应
中没有副产物生成,所以总反应的原子利用率为100%,A项正确;CH4分子中含有4个C—H 键,而CH3COOH分子中含有3个C—H键,显然CH4→CH3COOH过程中必有C—H键发生断裂,B项正确;观察反应的示意图可知,①→②过程中放出能量,且在此过程中形成了新化学键,即乙酸分子中的C—C键,C项正确;催化剂只能改变化学反应速率,而不影响化学平衡,不能提高反应物的平衡转化率,D项错误。
2.(2018·天津)CO2与CH4经催化重整,制得合成气:
CH4(g)+CO2(g)催化剂2CO(g)+2H2(g)
已知上述反应中相关的化学键键能数据如下:
化学键CH CO HH C O(CO)
键能/kJ·mol-1413 745 436 1 075
_+120_kJ·mol-__
[解析]化学反应的焓变等于反应物键能之和减去生成物键能之和,所以焓变为(4×413+2×745)kJ·mol-1-(2×1 075+2×436)kJ·mol-1=+120 kJ·mol-1。
核心突破——补知能、学方法
►知能补漏
1.反应热的理解和计算
(1)下图表示燃料燃烧反应的能量变化(×)
(2)在CO2中,Mg燃烧生成MgO和C。
该反应中化学能全部转化为热能(×)
(3)催化剂能改变反应的焓变(×)
(4)催化剂能降低反应的活化能(√)
(5)同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同(×)
(6)500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),
2NH3(g)ΔH=-38.6 kJ·mol-放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)催化剂
500 ℃、30 MPa
1(×)
2.热化学方程式正误判断的六个易错点。
