高中高一化学必修一:离子共存、离子的检验及推断考点汇总.doc
离子共存与离子推断知识点

离子共存与离子推断知识点
离子共存与离子推断,这可真是个奇妙的世界啊!就好像一个复杂而又充满魅力的谜题,等待着我们去揭开它神秘的面纱。
在这个世界里,各种离子相互交织,有的能和谐共处,有的却一见面就“打架”。
你说神奇不神奇?比如说,氢离子和氢氧根离子,那可真是水火不容啊,碰到一起就会发生反应,生成水。
这就好比两个脾气不对付的人,见面就掐!但有些离子呢,却能友好地呆在一起,就像好朋友一样。
离子共存有着严格的条件呢!比如溶液的酸碱性,某些离子在酸性环境中能愉快玩耍,到了碱性环境可能就不行啦。
这多像人换了个环境,有的适应得很好,有的就会水土不服。
再比如离子之间的反应,有些会生成沉淀,有些会产生气体,这些都会影响它们能不能共存。
这就如同生活中的各种规则和限制,决定了我们的行为和选择。
离子推断就更有意思啦!通过一些已知的信息,像侦探一样去推断出未知的离子。
这就像是拼图游戏,每一个线索都是一块拼图,我们要把它们拼凑起来,才能看到完整的画面。
有时候一个小小的实验现象,或者一个数据,都可能是关键的线索呢!难道这还不够让人兴奋吗?
我们来想想,如果没有对离子共存和离子推断的深入理解,那化学世界会变成什么样呢?很多化学反应可能就无法进行准确的分析和解释,就好像失去了方向的船只。
而且,在实际应用中,比如在环境监测、医学检测等领域,离子共存和离子推断可是起着至关重要的作用呢!难道我们不应该好好掌握它们吗?
总之,离子共存与离子推断是化学中非常重要且有趣的部分,它们就像一把钥匙,能打开化学世界的大门,让我们看到其中的精彩和奥秘。
我们要不断探索,不断学习,才能真正领略到它们的魅力啊!。
2022-2021学年高一化学必修1同步精品讲义:离子共存及离子检验与推断 Word版

离子共存及离子检验与推断【学问回顾】1.写出下列离子反应方程式:(1)在氢氧化钙溶液中滴加碳酸钠溶液(2)向氨水中滴加盐酸(3)氧化铜粉末加入稀硫酸(4)铁屑放入硫酸铜溶液2.水污染问题是当前全世界关注的焦点问题。
我们每一个人都应当自觉地爱护水资源,防止污水的任凭排放。
化学试验过程中往往会产生污水,污水中的重金属离子如Cu2+、Ba2+、Ag+对水的污染作用很强。
某次化学试验后,回收的废液中可能含有Cu2+、Ba2+、Ag+。
(1)请你用试验的方法检验该废液中是否含有这些离子,写出你的试验方案及相关反应的离子方程式。
(2)若废液中存在Cu2+、Ba2+、Ag+这三种离子,你认为该废液应当进行怎样的处理后才能够倒掉?写出你设计的废液处理方案及相关反应的离子方程式。
一、离子反应的应用(一)离子共存:同一溶液中若离子间能发生离子反应,则离子之间不能在溶液中大量共存;若离子间不反应,则可以大量共存。
1.“不共存”状况归纳:(1)在溶液中某此离子能相互反应生成难溶性物质时,这些离子就不能大量共存。
如SO42-与Ba2+、Pb2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;Ag+与Cl-、Br-、I-、CO32-、SO32-、S2-;Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等(2)离子间能结合生成难电离的物质时,则这些离子不能大量共存。
如H+与OH-、ClO-、CH3COO-、HPO42-、H2PO4-、F―、S2―OH-与HCO3-、HS-、HSO3-、H2PO4-、HPO42-、H+等不能大量共存。
(3)离子间能结合生成挥发性物质时,则这些离子不能大量共存。
如:H+与CO32-、SO32-、S2-、HCO3-、HSO3-、HS-OH-与NH4+等不能大量共存。
2.附加隐含条件的应用规律:(1)溶液无色透亮常见的有色离子:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4-(紫红色)等(2)强碱性溶液不能大量共存的有H+、NH4+、Mg2+、Al3+、Ca2+、Zn2+、Fe3+、Cu2+、Fe2+、Pb2+、Ag+、HCO3-等(3)强酸性溶液不能大量共存的有OH-、HCO3-、HS-、S2-、SO32-、HSO3- 、CO32-、CH3COO-等(二)离子检验与推断:1、常见离子的检验方法依据离子性质不同而在试验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
高考化学离子共存、离子的检验和推断考点全归纳

离子共存、离子的检验和推断[考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一离子共存1.离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.4(紫)、Cu2+(蓝)、Fe2+(浅绿)、Fe3+(黄)颜色MnO-3(H+)、Fe3+、Cr2O2-7氧化性ClO-、MnO-4、NO-3(HSO-3)、I-、Br-、Cl-、Fe2+还原性S2-(HS-)、SO2-水解显酸性NH+4、Mg2+、Al3+、Cu2+、Fe2+、Fe3+3、SiO2-3、ClO-、CH3COO-3、CO2-2、S2-、SO2-水解显碱性AlO-3、HPO2-4、H2PO-43、HS-、HSO-两性离子HCO-注意“两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.常见溶液酸、碱性的判断酸性溶液:pH<7(常温);能使pH试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液:pH>7(常温);能使pH试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al反应放出H2的溶液(注HNO3除外);能使甲基橙呈黄色的溶液;c(H+)水或c(OH-)水等于10-a mol·L-1(a>7)的溶液。
深度思考(1)OH-不能和________________________________________________________大量共存(填具体离子,下同)答案H+、NH+4、Fe2+、Fe3+、Zn2+、Mg2+、Al3+、Cr3+、HCO-3、HS-、HSO-3、4、HPO2-4H2PO-(2)H+不能和_____________________________________________________大量共存。
离子共存、离子的检验和推断

离子共存、离子的检验和推断在化学中,离子共存也是很常见的现象。
因此,对离子的检验和推断起着至关重要的作用。
下面我们将深入探讨离子共存、离子的检验和推断的相关知识。
离子共存的原因在实验化学中,离子共存较为常见。
离子在其溶液中相互作用,形成共存体系。
通常,离子共存有以下几个原因:1.离子的化学性质:具有相同化学性质的离子,在同一条件下,会倾向于在同一溶液中存在,形成离子共存体系。
2.溶质溶剂间的相互作用:离子与溶质、溶剂之间的相互作用也会导致离子的共存。
3.实验条件:控制不佳、实验条件差等原因,也可能导致离子的共存。
离子的检验离子检验指的是通过化学方法,检测出样品中是否存在某些特定的离子。
其中,常用的离子检验包括:阳离子1.铵离子:加入Nessler试液,若出现黄色,则存在铵离子。
2.钠离子:加入酸性铁氰化钠试液和苯酚红指示剂,若出现红色,则证明存在钠离子。
3.钙离子:加入硫酸铵试液和草酸试液,若出现白色沉淀,则存在钙离子。
4.铁离子:加入硫氰酸钾试液和苯酚红指示剂,若出现红色,则证明存在铁离子。
阴离子1.氯离子:加入银氨试液,若出现白色沉淀,则存在氯离子。
2.硫酸根离子:加入钡盐试液,若出现白色沉淀,则存在硫酸根离子。
3.硝酸根离子:加入密度较大的硝酸银试液,若出现白色沉淀,则存在硝酸根离子。
4.碳酸根离子:加入盐酸,若产生气体,则证明存在碳酸根离子。
离子推断离子推断指的是通过已知的离子检验结果,推测出未知物质样品中的离子种类和数量。
离子的推断通常按照递推法进行。
确定阳离子1.质量作用定律:根据它和阴离子的相对比例,从几个阳离子中确定一组可能的组合。
2.离子比例法:通过阳离子和阴离子的相对比例,推断出组成物质的阳离子的种类。
3.等电点法:根据相对质量和等电点,选择出可能存在的阳离子组合。
确定阴离子1.除去有机酸根离子、硝酸根离子、碳酸根离子:根据阳离子的推断结果,排除掉已知的有机酸根离子、硝酸根离子、碳酸根离子。
2022年高考化学总复习:离子共存 离子的检验和推断

2022年高考化学总复习:离子共存离子的检验和推断复习目标 1.掌握离子共存的条件,会判断溶液中离子能否大量共存。
2.掌握常见离子的检验,能根据实验现象推断溶液中的某些离子。
考点一离子共存1.离子共存的本质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色几种常见离子的颜色:离子Cu2+Fe3+Fe2+MnO-4溶液颜色蓝色棕黄色浅绿色紫红色(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸根阴离子(如CO2-3、SO2-3、S2-、CH3COO-等)不能大量存在。
②在强碱性溶液中,H+及弱碱阳离子(如NH+4、Al3+、Fe3+等)不能大量存在。
(3)三特殊——三种特殊情况:①AlO-2与HCO-3不能大量共存:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3。
②“NO-3+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO2-3等还原性的离子发生氧化还原反应而不能大量共存。
③NH+4与CH3COO-、CO2-3,Mg2+与HCO-3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)四反应——四种反应类型四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
①复分解反应:如Ba2+与SO2-4,NH+4与OH-,H+与CH3COO-等。
②氧化还原反应:如Fe3+与I-、S2-,NO-3(H+)与Fe2+等。
③相互促进的水解反应:如Al3+与CO2-3、HCO-3或AlO-2等。
④络合反应:如Fe3+与SCN-等。
指出下列离子组不能大量共存的原因。
(1)Na+、OH-、SO2-4、Fe3+____________________________________________________。
离子反应和离子方程式、离子共存、离子的检验和推断
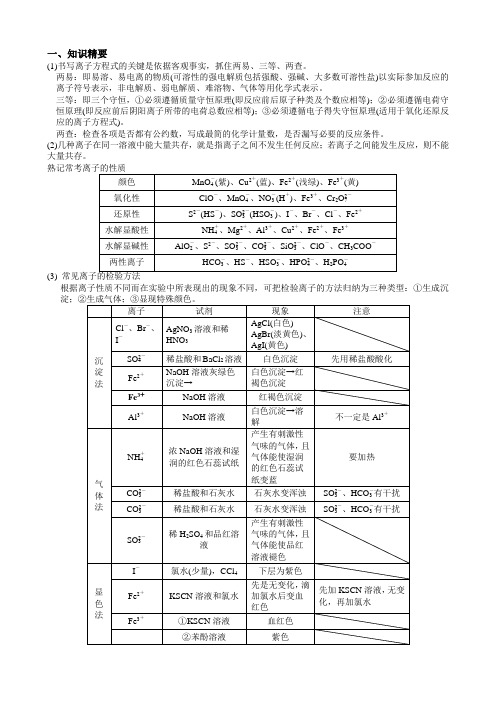
一、知识精要(1)书写离子方程式的关键是依据客观事实,抓住两易、三等、两查。
两易:即易溶、易电离的物质(可溶性的强电解质包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、弱电解质、难溶物、气体等用化学式表示。
三等:即三个守恒,①必须遵循质量守恒原理(即反应前后原子种类及个数应相等);②必须遵循电荷守恒原理(即反应前后阴阳离子所带的电荷总数应相等);③必须遵循电子得失守恒原理(适用于氧化还原反应的离子方程式)。
两查:检查各项是否都有公约数,写成最简的化学计量数,是否漏写必要的反应条件。
(2)几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
(3)根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉4Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。
二、典例精讲【例1】在如右图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液时,则灯光由亮变暗至熄灭后又逐渐变亮的是(C)A.盐酸中逐滴加入食盐溶液B.醋酸中逐滴加入氢氧化钠溶液C.饱和石灰水中不断通入CO2D.醋酸中逐滴加入氨水【例2】判断下列离子方程式的书写是否正确?并把错误的改正。
1.NaHCO 3溶液水解:HCO-3+H2O CO2-3+H3O+2.将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓3.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O4.F2与NaOH溶液反应:F2+4OH-===2F-+O2+2H2O答案:1.错;HCO-3+H2O≒H2CO3+OH-2.错;2Na+Cu2++2H2O===2Na++H2↑+Cu(OH)2↓3.错;2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O4.错;2F2+4OH-===4F-+O2+2H2O【例3】下列化学方程式中,不能用离子方程式H++OH-===H2O表示的是(D) A.HNO3+NaOH===NaNO3+H2OB.Ba(OH)2+2HCl===BaCl2+2H2OC.KOH+HCl===KCl+H2OD.Cu(OH)2+2HNO3===Cu(NO3)2+2H2O【例4】1.(2010·广东理综,7)能在溶液中大量共存的一组离子是() A.NH+4、Ag+、PO3-4、Cl-B.Fe3+、H+、I-、HCO-3C.K+、Na+、NO-3、MnO-4D.Al3+、Mg2+、SO2-4、CO2-32.下列各组离子,能在溶液中大量共存的是() A.Na+、Mg2+、Cl-、OH-B.H+、Ca2+、CO2-3、NO-3C.Cu2+、K+、SO2-4、NO-3D.Na+、HCO-3、OH-、Ca2+3.(2010·上海,9)下列离子组一定能大量共存的是() A.甲基橙呈黄色的溶液中:I-、Cl-、NO-3、Na+B.石蕊呈蓝色的溶液中:Na+、AlO-2、NO-3、HCO-3C.含大量Al3+的溶液中:K+、NO-3、Na+、ClO-D.含大量OH-的溶液中:CO2-3、Cl-、F-、K+4.下列各组离子一定能大量共存的是() A.在含有大量AlO-2的溶液中:NH+4、Na+、Cl-、H+B.在强碱溶液中:Na+、K+、CO2-3、NO-3C.在pH=12的溶液中:NH+4、Na+、SO2-4、Cl-D.在c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO-35.某溶液中含有较大量的Cl-、CO2-3、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次沉淀出来,下列实验操作顺序正确的是()①滴加Mg(NO3)2溶液②过滤③滴加AgNO3溶液④滴加Ba(NO3)2溶液A.①②④②③B.④②①②③C.①②③②④D.④②③②①6.(2010·福建理综,10)下列关于电解质溶液的正确判断是() A.在pH=12的溶液中,K+、Cl-、HCO-3、Na+可以常量共存B.在pH=0的溶液中,Na+、NO-3、SO2-3、K+可以常量共存C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH===B++OH-D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O HA+OH-7.(2010·江苏,6)常温下,下列各组离子在指定溶液中能大量共存的是() A.pH=1的溶液中:Fe2+、NO-3、SO2-4、Na+B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO-3C.c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、Cl-D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO2-4、SCN-8.某同学为检查某溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。
高一化学必修一:离子共存、离子检验及推断考点汇总

第 3 讲离子共存、离子的检验和推断[ 考纲领求 ]1.应用离子反应发生的条件,正确判断常有离子在溶液中可否大量共存。
2.利用离子的特色反应,能鉴别常有离子以及进行综合推断。
考点一离子共存1. 离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存, 就是指离子之间不发生任何反应; 若离子之间能发生反应,则不能够大量共存。
2. 熟记常考离子的性质颜色MnO 4-(紫 )、 Cu 2+(蓝 )、 Fe 2+(浅绿 )、 Fe 3+(黄 )氧化性ClO -、 MnO --+3+2-4 、 NO 3 (H )、 Fe 、 Cr 2O 7还原性 S2--2 -- -、 Br --2+(HS ) 、SO 3 (HSO 3 )、 I 、 Cl 、 Fe水解显酸性 NH4+、Mg2+、Al3+、 Cu 2+、Fe 2+、 Fe 3+水解显碱性[来 [Al(OH) -2-2-2-2---源 4] 、 S 、 SO 3 、CO 3 、 SiO 3 、 ClO 、 CH 3COOm]两性离子HCO 3-、 HS -、 HSO 3-注意 “ 两性离子 ” 指既能与酸反应又能与碱反应的离子, 一般为多元弱酸的酸式酸根 离子。
3. 常有溶液酸、碱性的判断酸性溶液: pH<7( 常温 );能使 pH 试纸呈红色的溶液; 能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液: pH>7( 常温 );能使 pH 试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出 H 2 的溶液 (HNO 3 除外 );能使甲基橙呈黄色的溶+)水或 c(OH ---1(a>7)的溶液。
液; c(H )水 等于 10 a mol L ·深度 思 考(1)OH -不能够和 ________________________________________________________ 大量共存 (填详尽离子,下同 )。
离子共存 离子的检验和推断

离子共存离子的检验和推断1.离子共存的本质几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色几种常见离子的颜色:离子Cu2+Fe3+Fe2+MnO-4溶液颜色蓝色棕黄色浅绿色紫红色(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸根阴离子(如CO2-3、SO2-3、S2-、CH3COO-等)不能大量存在。
②在强碱性溶液中,H+及弱碱阳离子(如NH+4、Al3+、Fe3+等)不能大量存在(3)三特殊——三种特殊情况:①AlO-2与HCO-3不能大量共存:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3。
②“NO-3+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO2-3等还原性的离子发生氧化还原反应而不能大量共存。
③NH+4与CH3COO-、CO2-3,Mg2+与HCO-3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)四反应——四种反应类型四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
①复分解反应:如Ba2+与SO2-4,NH+4与OH-,H+与CH3COO-等。
②氧化还原反应:如Fe3+与I-、S2-,NO-3(H+)与Fe2+等。
③相互促进的水解反应:如Al3+与CO2-3、HCO-3或AlO-2等。
④络合反应:如Fe3+与SCN-等。
问题思考指出下列离子组不能大量共存的原因。
(1)Na+、OH-、SO2-4、Fe3+_____________________________________________________。
(2)K+、Mg2+、I-、ClO-_______________________________________________________。
第3讲 离子共存、离子的检验和推断

误点点悟 有色离子不能大量存在
[来源: ][来源 :学+科+网 ][来源 :学. 科.网]
溶液显酸性或碱性 只能是氧化性离子和还原性离子不能 大量共存,不包括其他类型反应的离子
“透明”也可“有色” 易看成大量“共存” 溶液既可能显酸性也可能显碱性
常见的溶液中有颜色的离子有 MnO- 4 ——呈紫色, Cu2+——呈蓝色,Fe2+——呈浅绿色,Fe3+——呈黄色。
沉淀的颜色:Cu(OH)2——蓝色沉淀,Fe(OH)3——红褐色沉淀。 解题中特别注意题干条件是“无色透明”还是“澄清透明”。
深度思考
1.向某溶液中,加入 BaCl2 溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,能否判断溶液中
4
An evaluation version of novaPDF was used to create this PDF file. Purchase a license to generate PDF files without this notice.
2. 熟练掌握在溶液中有特征颜色的离子
条件类型 常见的限制条件
[来 源: ]
常见的易错点
常见的隐含条件
常见题干要求
高考中的常见表述 “无色”
[来源 :学科 网]
“pH=1”或“pH=13” “因发生氧化还原反应而不能 大量共存”
“透明” “不大量共存” “与 Al 反应放出 H2” “由水电离出的 c(H+)=1× 10-12 mol·L-1” “通入足量的 NH3”
S2-(HS-)、SO23-(HSO-3 )、I-、Br-、Cl-、Fe2+ NH+4 、Mg2+、Al3+、Cu2+、Fe2+、Fe3+
离子共存 离子的检验和推断

[解析] 溶液是无色溶液,Cu2+显蓝色,A项错误;水电离出c(H+)=10- 11mol·L-1<10-7mol·L-1,说明溶质对水的电离起到抑制作用,溶质可能是酸,也 可能是碱,这些离子既能在酸中共存,也能在碱中共存,B项正确;c(OH-)/c(H+) =1010,说明溶液显碱性,即Mg2+不能与OH-大量共存,生成Mg(OH)2沉淀,C 项错误;过氧化钠具有强氧化性,能把I-氧化成I2,不能大量共存,D项错误。
[解析] 0.1 mol/L的NH4HSO4溶液中含有SO24-,SO24-与Ba2+在同一溶液中不 能大量共存,生成白色沉淀,A项错误;遇KSCN溶液变红色的溶液中含有Fe3
+,此溶液中NH
+
4
、Al3+、SO
2- 4
、Cl-彼此间不发生离子反应,B项正确;
Hale Waihona Puke c(H+)/c(OH-)=1×1014的溶液pH=0,ClO-在强酸性溶解中不能大量存在,易生成
4.离子共存判断题中常见的限制条件
限制条件
分析解读
无色溶液
有色离子不能大量共存
使甲基橙呈红色 或pH=1
溶液显酸性,无大量的OH-及弱酸的酸根离子
遇酚酞呈红色 溶液呈碱性,无大量的H+及弱碱的阳离子、弱
或pH=13
酸的酸式根离子
与Al反应放出H2
由水电离出的c(H+) =1×10-13 mol·L-1
[解析]
能使石蕊试液变红的无色溶液中肯定存在H+,H+和CO
2- 3
、ClO-、
AlO
-
2
均能反应,离子不可能大量共存,
A项错误;与金属铝反应放出氢气的溶
液,为酸或强碱溶液,碱溶液中OH-与Fe2+、NH
高中化学 离子共存、离子检验和推断

课时6离子共存、离子检验和推断考点一离子共存的判断【考必备·清单】1.离子共存的含义所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.熟记常考离子的性质[名师点拨]①无色溶液中,有色离子不能存在;透明溶液中可能含有有色离子。
②既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。
3.熟记相互促进的水解反应4.离子共存判断中常见的限制条件加水稀释,c H+c OH-减小某溶液的lgc H+c OH-=12【提素能·好题】1.判断正误(正确的打“√”,错误的打“×”)。
(1)透明的溶液即无色溶液,不含有任何有颜色的离子()(2)Fe3+和Al3+在中性溶液中能大量存在()(3)加入铝粉能够发生反应产生氢气的溶液,一定是酸性溶液()(4)水电离出c(H+)=1×10-13 mol·L-1的溶液呈碱性()(5)次氯酸能电离产生H+,故在溶液中H+和ClO-能够大量共存()答案:(1)×(2) ×(3)×(4)×(5)×2.下列各组离子在溶液中因发生复分解反应而不能大量共存的是。
①K+、H+、CH3COO-、Br-②Ba2+、Na+、CO2-3、NO-3③Na+、HCO-3、H+、Cl-④Al3+、Fe3+、NO-3、SO2-4⑤Na+、K+、AlO-2、NO-3⑥Na+、H+、Cl-、OH-答案:①②③⑥3.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是。
①H3O+、NO-3、Fe2+、Na+②Na+、Fe3+、I-、Cl-③H+、S2-、SO2-3、SO2-4④SO2-4、NO-3、Na+、H+⑤I-、ClO-、K+、H+⑥Na+、K+、MnO-4、Cl-答案:①②③⑤⑥4.下列各组离子在溶液中因水解相互促进而不能大量共存的是。
高三化学一轮复习——离子共存、离子的检验和推断
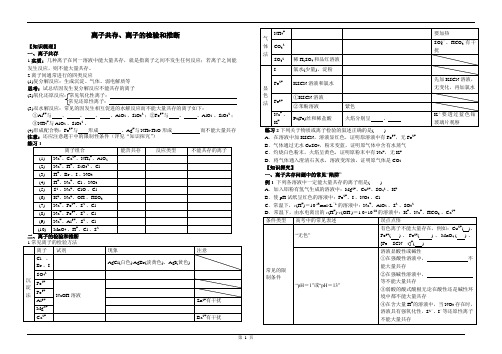
离子共存、离子的检验和推断【知识梳理】一、离子共存1.实质:几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.离子间通常进行的四类反应(1)复分解反应:生成沉淀、气体、弱电解质等思考:试总结因发生复分解反应不能共存的离子(2)氧化还原反应:常见氧化性离子:常见还原性离子:(3)双水解反应:常见的因发生相互促进的水解反应而不能大量共存的离子如下:①Al3+与、、、、AlO2-、SiO32-;②Fe3+与、、AlO2-、SiO32-;③NH4+与AlO2-、SiO32-。
(4)形成配合物:Fe3+与形成、Ag+与NH3·H2O形成而不能大量共存注意:还应注意题干中的限制性条件(详见“知识探究”)A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气C.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2【知识探究】一、离子共存问题中的常见“陷阱”例1 下列各溶液中一定能大量共存的离子组是()A.加入铝粉有氢气生成的溶液中:Mg2+、Cu2+、SO42-、K+B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl-C.常温下,c(H+)=10-13mol·L-1的溶液中:Na+、AlO2-、S2-、SO32-+--28的溶液中:K+、Na+、HCO-、Ca2+有色离子不能大量存在,例如:Cu2+( )、Fe3+( )、Fe2+( )、MnO4-( )、[Fe SCN2]+( )“因发生氧化还原反应而不能大量共存”只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子常见的易错点“透明”“透明”也可“有色”“与Al反应放出H2”溶液既可能显酸性也可能显碱性“由水电离出的c(H+)=1×10-12 mol·L-1”溶液既可能显酸性也可能显碱性“通入足量的NH3”与NH3·H2O反应的离子不能大量存在常见题干要求(1)“一定大量共存”(2)“可能大量共存”(3)“不能大量共存”审清关键字二、离子推断例2某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-。
高中化学离子共存知识点总结.doc

高中化学离子共存知识点总结1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、 Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、 C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。
如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如 Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。
这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。
如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、 HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生 2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。
H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 3 讲离子共存、离子的检验和推断[ 考纲要求 ]1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。
2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。
考点一离子共存1. 离子共存问题是离子反应条件和本质的最直接应用所谓几种离子在同一溶液中能大量共存, 就是指离子之间不发生任何反应; 若离子之间能发生反应,则不能大量共存。
2. 熟记常考离子的性质颜色MnO 4-(紫 )、 Cu 2+(蓝 )、 Fe 2+(浅绿 )、 Fe 3+(黄 )氧化性ClO -、 MnO --+3+2-4 、 NO 3 (H )、 Fe 、 Cr 2O 7还原性 S2--2 -- -、 Br --2+(HS ) 、SO 3 (HSO 3 )、 I 、 Cl 、 Fe水解显酸性 NH4+、Mg2+、Al3+、 Cu 2+、Fe 2+、 Fe 3+水解显碱性[来 [Al(OH) -2-2-2-2---源 :Zxxk.Co4] 、 S 、 SO 3 、CO 3 、 SiO 3 、 ClO 、 CH 3COOm]两性离子HCO 3-、 HS -、 HSO 3-注意 “ 两性离子 ” 指既能与酸反应又能与碱反应的离子, 一般为多元弱酸的酸式酸根 离子。
3. 常见溶液酸、碱性的判断酸性溶液: pH<7( 常温 );能使 pH 试纸呈红色的溶液; 能使甲基橙呈红色或橙色的溶液;能使石蕊试液呈红色的溶液。
碱性溶液: pH>7( 常温 );能使 pH 试纸呈蓝色的溶液;能使石蕊试液呈蓝色的溶液;能使酚酞试液呈红色的溶液。
呈酸性或碱性的溶液:和Al 反应放出 H 2 的溶液 (HNO 3 除外 );能使甲基橙呈黄色的溶+)水或 c(OH ---1(a>7)的溶液。
液; c(H )水 等于 10 a mol L ·深度 思 考(1)OH -不能和 ________________________________________________________ 大量共存 (填具体离子,下同 )。
答案H +、 NH +4、 Fe 2+ 、Fe 3+ 、Cu 2+ 、Zn 2+、 Mg 2+ 、Al 3+ 、Cr 3+、 HCO -3、 HS - 、HSO -3(2)H +不能和 ______________________________________________________ 大量共存。
答案 OH -2--2- -2--2--、ClO --、 、 CO 3 (HCO 3 ) 、S (HS )、 SO 3 (HSO 3 )、 SiO 3 、 [Al(OH) 4] 、 F CH 3COO -、NO 2-2 -不能和 ____________ ____________________________________ 大量共存。
(3)CO 3答案H+、 Mg 2+、 Ba 2+、 Ca 2+、 Fe 3+、Al 3+、 Fe 2+、Cu 2+(4)SO 23-不能和 __________________________________________ 大量共存。
答案H +、 MnO -、 NO -(H +)、 Mg 2+、 Ba 2+、 Fe 3+、 Al 3+、 Fe 2 +、 Cu 2+4 3(5)Fe 3+不能和 ______________________________________________ 大量共存。
]答案OH - - - - 、 CO 32 - - - - - 、 SCN -、 I 、 SO 32 、 ClO (HCO 3 )、 S 2(HS )、 [Al(OH) 4](6)Al 3+不能和 ______________________________________________ 大量共存。
答案OH ---、 CO 32 ---- -、 SO 32 、 ClO (HCO 3 )、 S 2 (HS )、 [Al(OH) 4](7)I -不能和 ____________________________________________ 大量共存。
答案3+- +--2-Fe 、NO 3 (H ) 、MnO 4 、 ClO 、 Cr 2O 7(8)NO -+ )不能和 ______________________________________ 大量共存。
3 (H答案CO 2--2- 、ClO - 、 CH -、 S 2- -2+2---3 (HCO 3 )、 SiO 3 3COO (HS )、 Fe 、 SO 3 (HSO 3 )、 I反 思 归 纳判断一些常见离子能否和其他离子大量共存时,一般从以下几个方面考虑:(1)CO23-考虑生成气体和沉淀;(2)SO 23-考虑生成气体、沉淀和其还原性;(3)Fe3+ 考虑生成 Fe(OH) 3、双水解及其氧化性;(4)Al3+考虑生成 Al(OH) 3、双水解;(5)I -只考虑其还原性;-(H +)考虑酸性及 -在酸性条件下的强氧化性。
(6)NO 3 NO 3题组一 无限制条件的离子大量共存的判断1. 在水溶液中能大量共存的一组离子是()-+-+A . HCO 3 、H 、 NO 3 、 NaB .Na +、 Cu 2+、OH -、 SO 42-C .Mg 2+、H +、 [Al(OH) 4] -、 SO 42-++ --D . NH 4 、 K 、 Br 、 NO 3 答案 D解析A 项,H +-反应; B 项,Cu 2+与 OH -反应; C 项,H +与 [Al(OH) 4 ] -反应。
与 HCO 3 2. 在水溶液中能大量共存的一组是()A . Ba 2+、 Na +、SO 42-、 Cl-- 2-+ 、 K +B .MnO 4 、 SO 3 、 HC .[Al(OH) 4 -+、K +-] 、 Mg 2、 HCO 3+ + - 2-D . K 、Na 、 NO 3 、 SO 4 答案 D解析 A 项, Ba2+与 SO 42-反应; B 项, MnO 4-、 H +、SO 32 -发生氧化还原反应;C 项,[Al(OH) 4] - 存在于强碱溶液中, Mg 2+、HCO -不能存在。
3题组二题干中有限制条件的离子大量共存的判断3. 将足量的 SO 2 通入下列各溶液中,所含离子还能大量共存的是()+- 、 Cl -- A . K 、 SiO 32、NO 3B .H +、 NH 4+、 Al 3+、 SO 42-+- 、 MnO -2- C .Na 、 Cl 4 、 SO 4+2---D . Na 、 CO 3 、 CH 3COO 、 HCO 3 答案 B解析2-2-22-A 中 SiO 3反应; C 中 MnO 4发生氧化还原反应; D 中 CO 3、能与 SO能与 SOCH COO -、 HCO - 均能与 SO 反应。
3 324. 在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是()A . Na +、 K +、 OH -、 Cl-++--B .Na 、 Cu 2 、SO 42、 NO 3C .Mg 2+、Na +、 SO 42-、 Cl-+ +-2-D . K 、Na 、 NO 3 、 CO 3 答案 C解析 A 项, H +与 OH -反应; B 项, Cu 2+有颜色; D 项, H +与 CO 32-反应。
题组三选项中有限制条件的离子大量共存的判断5. 下列各组离子在指定的溶液中,能大量共存的打“√”,不能大量共存的打“×”(1)含有大量 Fe 3+ 的溶液: Na +、 SCN -、 Cl -、 I --+ 、 Fe 2 + --(2)含有大量 NO 3 的溶液: H 、 Cl 、 SO 42(3)常温下, pH =12 的溶液: K +、Cl -、SO 42-+-1+ 、 NH +2-2-(4)c(H ) =0.1 mol L · 的溶液: Na 4 、 SO 4 、 S 2O 3 (5)使 pH 试纸显蓝色的溶液:Cu 2+、 NO 3-、 Fe 3+、SO 42-(6)与铝粉反应放出-+、 Na +-H 2 的无色溶液: NO 3 、 Al 3 、 SO 42(7)使红色石蕊试纸变蓝的溶液:2-2-+、 K +SO 4 、 CO 3 、 Na+c H- = 1× 10-12的溶液: K +、 [Al(OH)4-、CO 32-+(8)常温下 c OH]、 Na3+ 、 Al 3+ 、 NO -2-(9)中性溶液: Fe 3 、 SO 4(10)使甲基橙变红色的溶液: Mg 2++2- 、 SO 2-、 K 、 SO 4 3+- 12- 1+、 K +2-2-(11)c(H )水 = 10mol ·L 的溶液: Na 、 CO 3 、 SO 4(12)使酚酞变红色的溶液:+、 Cu 2 ++-Na 、 Fe 2、 NO 3(13)0.1 mol - 1 的 Na 2 3 溶液: Al 3+、 SO 42- -、 K +L · CO、 Cl ( ) 答案 (1)× (2) × (3) √ (4)×(5)× (6) ×()()()()()()()()()()()()(7)√ (8) √ (9)×(10)× (11)× (12)×(13) ×反思归纳警惕题干中的常见“陷阱”条件类型高考中的常见表述误点点悟有色离子不能大常见的限“ 无色 ”[ 来源 : 学科网 ][ 来量 存在 [来源 :学 &制条件源 : 学科网 ][ 来源 :]科 & 网 ][ 来源 :Z §“ pH = 1”或“ pH= 13”“ 因发生氧化还原反应而不能大量共存”“ 透明”常见的易错点“ 不能大量共存”“与 Al 反应放出H2”“由水电离出的c(H +)= 1×常见的隐10-12 mol ·L-1”含条件“通入足量的NH 3”NO-3常见题(1)“一定大量共存”干要求(2)“可能大量共存”xx §]溶液显酸性或碱性只能是氧化性离子和还原性离子不能大量共存,不包括其他类型反应的离子“ 透明” 也可“ 有色”易看成“大量共存”溶液既可能显酸性也可能显碱性,但不能是氧化性酸,如 HNO 3溶液既可能显酸性也可能显碱性与NH3·H2O 反应的离子不能大量存在在酸性条件下具有强氧化性审清关键字(3)“不能大量共存”考点二离子的检验和推断1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,型:①生成沉淀;②生成气体;③显现特殊颜色。
