实验19:表面张力及表面吸附量的测定
物化实验报告 溶液中的吸附作用和表面张力的测定

最大气泡压力法测量溶液中的吸附作用和表面张力摘要:本实验采用最大气泡法测量液体的表面张力。
通过测量不同浓度下正丙醇的表面张力,计算吸附量,求出正丙醇分子的横截面积。
并探讨了表面张力的性质、表面吸附,加深对表面自由能的理解和表面活性剂的了解。
关键词:最大气泡法 表面张力 吸附 横截面积0. 引言在日常生活中, 我们对见到的一些现象可能已经习以为常,比如, 下过雨后, 我们可以见到树叶、草上的小水珠都接近於球形;不小心打碎了体温计后, 里面的水银掉到地上, 小水银滴也呈球形.其实这些现象都与表面张力有关.液体与气体相接触时, 会形成一个表面层, 在这个表面层内存在着的相互吸引力就是表面张力, 它能使液面自动收缩.表面张力是由液体分子间很大的内聚力引起的.处於液体表面层中的分子比液体内部稀疏, 所以它们受到指向液体内部的力的作用, 使得液体表面层犹如张紧的橡皮膜, 有收缩趋势, 从而使液体尽可能地缩小它的表面面积.我们知道, 球形是一定体积下具有最小的表面积的几何形体.因此, 在表面张力的作用下, 液滴总是力图保持球形, 这就是我们常见的树叶上的水滴按近球形的原因.表面张力与我们生活息息相关。
1、实验部分1.1实验原理:物体表面的分子和内部分子所处的境况不同,因而能量也不同,如图11-1,表面层的分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面(∆A )所需耗费功(W )的量,其大小应与∆A 成正比。
-W =σ∆A (12-1) 如果∆A =1m 2,则-W =σ,即在等温下形成1m 2新的表面所需的可逆功。
故σ称为单位表面的表面能,其单位为N ·m -1。
这样就把σ看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
它表示表面自动缩小的趋势的大小。
物理化学-表面张力及表面吸附量的测定-175
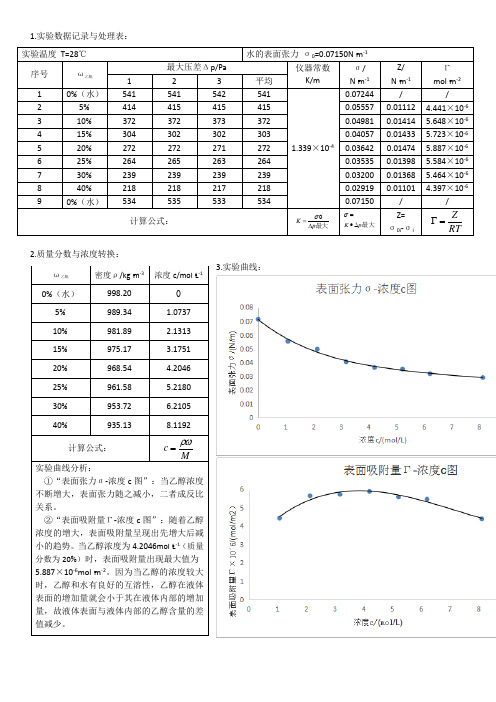
1.实验数据记录与处理表:2.质量分数与浓度转换:3.实验曲线:实验温度 T=28℃ 水的表面张力 σ0=0.07150N ▪m -1序号 ω乙醇 最大压差Δp/Pa仪器常数K/mσ/ N ▪m -1 Z/ N ▪m -1 Γmol ▪m -2 1 2 3 平均 1 0%(水) 541 541 542 541 1.339×10-40.07244 //2 5% 414 415 415 415 0.05557 0.01112 4.441×10-63 10% 372 372 373 372 0.04981 0.01414 5.648×10-6 4 15% 304 302 302 303 0.040570.01433 5.723×10-6 5 20% 272 272 271 272 0.03642 0.014745.887×10-66 25% 264 265 263 264 0.03535 0.01398 5.584×10-67 30% 239 239 239 239 0.03200 0.01368 5.464×10-6 8 40% 218 218 217 218 0.02919 0.01101 4.397×10-6 90%(水)5345355335340.07150/ /计算公式:最大p K ∆=σ最大p K ∆•=σZ= σ0i -σiRTZ=Γ ω乙醇 密度ρ/kg ▪m -3浓度c/mol ▪L -10%(水) 998.20 05% 989.34 1.0737 10% 981.89 2.1313 15% 975.17 3.1751 20% 968.54 4.2046 25% 961.58 5.2180 30% 953.72 6.2105 40%935.138.1192计算公式:Mc ρω=实验曲线分析:①“表面张力σ-浓度c 图”:当乙醇浓度不断增大,表面张力随之减小,二者成反比关系。
表面张力的测量和应用

表面张力的测量和应用表面张力是指液体表面上的分子间吸引力所产生的张力,是液体表面强度的度量。
通过测量表面张力,可以获得液体表面的物理和化学性质,从而为各种应用提供有效的参考。
一、表面张力的计算和测量表面张力可以通过两种方法进行计算和测量:接触角法和杂质提升法。
1. 接触角法接触角法是利用液体在固体表面上的接触角来计算表面张力。
接触角是液体与固体表面接触的角度,它可根据接触线和水平面形成的切线得出。
接触角的大小反映了液体与固体之间的相互吸引力大小。
一般来说,角度越小,液体越容易与固体相互吸附,表面张力越小。
2. 杂质提升法杂质提升法是通过往液体表面添加一定量的杂质,从而减小表面张力并测得表面张力大小。
添加的杂质通常为表面活性剂,如十二烷基硫酸钠、十二烷基苯磺酸钠等。
通过测量液体表面杂质提升前后的高度差,可以计算出表面张力的大小。
二、表面张力的应用表面张力主要应用于以下领域:1. 表面润湿性液体经过表面张力的影响,在固体表面上形成了一种液滴状结构。
这种液滴结构对于在固体表面上的液体润湿性有很大影响。
表面张力越小,液体在固体表面上的渗透性越强,润湿性越好。
在工业上,这种性质得到广泛应用,如涂料润滑剂等。
2. 微粒分散性表面张力对于微粒分散性的影响也很大。
在液体中添加适量的表面活性剂,可以减小液体表面张力,使得固体颗粒更容易分散在液体中,提高微粒分散度。
这种方法在制药、化工和材料科学等领域得到广泛应用。
3. 液滴稳定性表面张力对于液滴稳定性也有影响。
液滴稳定性可以用来判断液体的纯度和化学性质。
液滴不稳定的原因通常是表面张力不足或液滴大小不均。
因此,在制药和化学工业中,经常通过测量液滴大小和稳定性来测试化学反应、物质的纯度等。
总之,表面张力的测量和应用在各种领域都具有重要意义。
通过了解表面张力的大小和变化,可以更好地掌握物质的物理和化学性质,为工业生产和实验研究提供有效的依据。
溶液表面张力的测定实验报告

溶液表面张力的测定实验报告一、实验目的1、掌握最大气泡压力法测定溶液表面张力的原理和方法。
2、测定不同浓度正丁醇水溶液的表面张力,计算表面吸附量和表面活性剂分子的横截面积。
3、了解表面张力与溶液浓度之间的关系,加深对表面化学基本概念的理解。
二、实验原理1、表面张力在液体内部,每个分子都受到周围分子的吸引力,合力为零。
但在液体表面,分子受到指向液体内部的合力,使得液体表面有自动收缩的趋势。
要增大液体的表面积,就需要克服这种内聚力而做功。
在温度、压力和组成恒定时,增加单位表面积所做的功即为表面张力,用γ表示,单位为 N·m⁻¹或 mN·m⁻¹。
2、最大气泡压力法将毛细管插入待测液体中,缓慢打开滴液漏斗的活塞,让体系缓慢减压。
当压力差在毛细管端产生的作用力稍大于毛细管口液体的表面张力时,气泡就会从毛细管口逸出。
此时,气泡内外的压力差最大,这个最大压力差可以通过 U 型压力计测量得到。
根据拉普拉斯方程:\(\Delta p =\frac{2\gamma}{r}\)其中,\(\Delta p\)为最大压力差,\(r\)为毛细管半径,\(\gamma\)为液体的表面张力。
对于同一根毛细管,\(r\)是定值。
只要测出\(\Delta p\),就可以算出液体的表面张力\(\gamma\)。
3、表面吸附与吉布斯吸附等温式在一定温度下,溶液的表面张力随溶液浓度的变化而变化。
当溶质能降低溶剂的表面张力时,溶质在表面层中的浓度比溶液内部大,称为正吸附;反之,当溶质能升高溶剂的表面张力时,溶质在表面层中的浓度比溶液内部小,称为负吸附。
吉布斯吸附等温式为:\(\Gamma =\frac{1}{RT}\frac{d\gamma}{dC}\)其中,\(\Gamma\)为表面吸附量(单位:mol·m⁻²),\(R\)为气体常数(\(8314 J·mol⁻¹·K⁻¹\)),\(T\)为绝对温度,\(C\)为溶液浓度,\(\frac{d\gamma}{dC}\)为表面张力随浓度的变化率。
最大气泡压力法测定溶液中吸附作用和表面张力 实验报告

最大气泡压力法测定溶液中吸附作用和表面张力
PB10207071 阮亮
生命学院
【摘要】
表面张力是描述液体表面自动缩小趋势的大小的一种性质。 本实验通过最大气泡 压力法测量溶液表面张力, 根据吉布斯公式和朗格缪尔等温方程式研究吸附量 与溶液浓度及表面张力的关系研究吸附作用和溶液浓度的定量关系。结果表明, Γ与c 的关系曲线呈阶梯型走势。同时,实验还给出正丁醇分子横截面积的数值。
-3
仪器:
型号及名称 DMP-2C 型数字式微差测 量计 HK-2A 超级恒温水浴 恒温套管 毛细管 250mL 分液漏斗 100mL 容量瓶 2mL 移液管 滴管 生产厂家 南京大学应用物理研究所 南京大学应用物理研究所 (半径 0.15~0.20mm ) 容积 250mL 量程 100mL 仪器参数 数量 1台 1台 1支 1支 1个 7个 1支 1支
3.实验步骤
1.
毛细管常数的测定 打开恒温水浴,使其温度稳定于 30℃。取一直浸泡在洗液中的毛细管,依 次用洗液,蒸馏水反复清洗若干次,玻璃套管加上蒸馏水插上毛细管,用 套管下端的开关调节液面恰好与毛细管端面相切,使样品在其中恒温 10 分钟。在分液漏斗中加入适量的水并与吸滤瓶连接好。然后调节分液漏斗 下的活塞使水慢慢滴入吸滤瓶中,这时体系压力逐渐增加,直至气泡由毛 细管口冒出,细心调节出泡速度,使之在 5~10 秒内出一个。记录气泡爆
( ) T <0,Γ >0,称为表面活性物质,另一类 c
) T >0,Γ <0,称为非表面活性物质。正丁醇是表面活性物质,其水溶 c 液的浓度越大,表面张力越小,在它的σ -C 曲线中取各点斜率代入 Gibbs 吸附公式即得不同浓度下的Γ 值。 在一定温度下,吸附量与溶液浓度之间的关系由 Langmuir 等温式表示为: Kc 1 K c
物理化学实验报告-溶液表面张力的测定及等温吸附(2)

p最大 = p大气 − p系统 = ∆p
毛细管内气体压力必须高于大试管内液面上压力的附加压力以克服气泡的表面张力,此附加压力∆p与 表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:
2γ ∆p = R
如果毛细管半径很小,则形成的气泡基本上是球形的。随着气泡的形成曲率半径逐渐变小,直到形成
装
半球形。这时曲率半径R与毛细管内半径r相等,曲率半径达到最小值。
数字式微压差测量仪当表面张力仪的活塞使水缓慢下滴而减小系统压力这样毛细管内液面上受到一个比试管中液面上大的压力当此压力差在毛细管尖端产生的作用力稍大于毛细管管口液体的表面张力时气泡就从毛细管口逸出这一最大压力差可由数字式微压差测量仪测出
1.精密恒温水槽;2.带有毛细管的表面张力仪; 3.滴液漏斗;4.数字式微压差测量仪
答:实验中,气泡的速度对实验数据有很大的影响。速度过快,会使数据变大。因此,保持相同的气泡速
度对于实验的成败有很大的关系。而实验装置中,随着滴液漏斗中水的不断流出,滴液的速度会减慢,装
置的此处有待改进。另外,毛细管的竖直以及毛细管进入液面的深度,对于测定结果都有一定的影响,实
装
验中应该注意。实验的数据处理也是很关键的一步,对测量结果有较大影响。
=
71.97 280.7
=
0.2564
mN
∙
m−1
∙
Pa−1
2. 求出各浓度正丁醇溶液的表面张力。
γ溶液 = K∆p溶液
表 1 正丁醇溶液表面张力的测定数据记录表
c mol ∙ L−1
0
0.02 0.04 0.06 0.09 0.12 0.16 0.2 0.24
∆pm1 Pa ∆pm2 Pa ∆pm3 Pa ∆pm Pa γ mN ∙ m−1
溶液表面张力的测定及等温吸附

一、实验目的和要求1、加深理解表面张力、表面吸附等概念以及表面张力和吸附的关系。
2、掌握用最大气泡法测定溶液表面张力的原理和技术。
二、实验内容和原理最大气泡法是测定液体表面张力的方法之一,它的基本原理如下:当玻璃毛细管一端与液体接触,并往毛细管内加压时,可以在液面的毛细管口处形成气泡。
气泡的半径在形成过程中先由大变小,然后再由小变大。
设气泡在形成过程中始终保持球形,则气泡内外的压力差△p (即施加于气泡的附加压力)与气泡的半径r 、液体表面张力σ之间的关系可又拉普拉斯(Laplace )公式表示,即2p r σ∆=(1)显然,在气泡形成过程中,气泡半径由大变小,再由小变大,所以压力差△p 则由小变大,然后再由大变小。
当气泡半径r 等于毛细管半径R 时,压力差达到最大值max p ∆。
因此max 2p R σ∆=(2)由此可见,通过测定R 与max p ∆,即可求得液体的表面张力。
由于毛细管的半径较小,直接测量R 误差较大。
通常用一已知表面张力为0σ的液体(如水、甘油等)作为参考液体,实验测得其对应的最大压力差为0,maxp ∆。
可得被测液体的表面张力σ1=σ2*(△p1/△p2)=K △p1 (3)本实验中用DMP-2B 型数字式微压差测量仪测量,该仪器可直接显示以Pa 为单位的压力差。
对纯溶剂而言,表面层与内部的组成是相同的,但对溶液来说却不然。
当加入溶质后,溶剂的表面张力会发生变化。
根据能量最低原则,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部的大,反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
这种表面浓度与溶液内部浓度不同的现象叫做溶液的表面吸附。
显然,在指定的温度和压力下,溶液表面吸附溶质的量与溶液的表面张力和加入溶质的量(即溶液的浓度)有关,从热力学方法可知它们间的关系遵守吉布斯吸附方程:(4)式中:Γ吸附量(mol/m2);σ为表面张力(N/m );T 为绝对温度;c 为溶液浓度(mol/m3);R 为气体常数,R=8.314J ·mol -1·K -1。
表面吸附量的测定

实验十二 表面吸附量的测定一、 实验目的1、 用气泡最大压力法测定十六烷基三甲基溴化铵水溶液的表面张力。
从而计算溶液在某一浓度C 时的表面吸附量Γ; 2、 学会使用表面张力试验组合装置; 3、 学会σ对lnC 作图求Γ。
二、 实验原理1、 在指定温度下,纯液体的表面张力是一定的,如果在液体中加入溶质而成溶液时,情况就发生了变化。
我们说溶液的表面张力不仅与温度有关,而且也与溶液的种类,溶液浓度有关。
这是由于溶液中部分溶质分子进入到溶液表面,使表面层的分子组成发生了改变,分子间引力起了变化,因而表面张力也随着改变,根据实验结果证明,加入溶质以后表面张力发生改变的同时还发现溶液表面层的浓度与内部浓度有何差别,有些溶液表面层浓度大于溶液内部浓度,有些恰恰相反,这种现象称为溶液浓度表面吸附作用。
按吉布斯吸附等温式Cd d RTdcd RTC ln 1σσ∙-=∙-=Γ,其中Γ代表溶液浓度为C 时的表面吸附量(mol/cm 2),C 代表平衡时溶液浓度(mol/1),R 为气体常数(8315×107mol ·K ),T 为吸附时的温度。
由上(1)式可看出,在一定温度时,溶液表面吸附量Γ是与平衡时溶液浓度C 和表面活度dcd σ或cd d ln σ成正比关系。
当dcd σ<0时,Γ>0,表示溶液表面张力随浓度增加而降低,则溶液表面发生正吸附。
我们把能产生显著正吸附的物质(即有显著降低溶液表面张力的物质)称为表面活性物质。
本实验用表面活性物质十六烷基三甲基溴化铵配制成一系列不同浓度的水溶液,分别测定这些溶液的表面张力σ,然后以σ对lgC 作图,得一曲线,求曲线上某一点的斜率(d σ/dlgC ),可计算相应于该点浓度时溶液的表面吸附量Γ。
2、 本实验测定各溶液的表面张力采用气泡最大压力法,此法原理的当毛细管与液面相接触时,由毛细管内加压(或在溶液体系内减压)则可以在液面的毛细管出口处形成气泡。
(整理)表面张力的测定实验数据

实验十九 表面张力的测定一、实验目的1.掌握最大气泡法测定表面张力的原理和技术。
2.通过对不同浓度正丁醇溶液表面张力的测定,加深对表面张力、表面自由能和表面吸附量关系的理解。
3.学习用Origin 或Excel 处理实验数据。
二、实验原理在液体的内部任何分子周围的吸引力是平衡的。
可是在液体表面层的分子却不相同。
因为表面层的分子,一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,而且前者的作用要比后者大。
因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力(如图20-l 所示)。
这种吸引力使表面上的分子向内挤促成液体的最小面积。
要使液体的表面积增大就必须要反抗分子的内向力而作功增加分子的位能。
所以说分子在表面层比在液体内部有较大的位能,这位能就是表面自由能。
通常把增大一平方米表面所需的最大功A 或增大一平方米所引起的表面自由能的变化值ΔG 称为单位表面的表面能其单位为J ·m -3。
而把液体限制其表面及力图使它收缩的单位直线长度上所作用的力,称为表面张力,其单位是Nm -1。
液体单位表面的表面能和它的表面张力在数值上是相等的。
欲使液体表面积增加△S 时,所消耗的可逆功A 为:-A =△G =σ△S液体的表面张力与温度有关,温度愈高,表面张力愈小。
到达临界温度时,液体与气体不分,表面张力趋近于零。
液体的表面张力也与液体的纯度有关。
在纯净的液体(溶剂)中如果掺进杂质(溶质),表面张力就要发生变化,其变化的大小决定于溶质的本性和加入量的多少。
当加入溶质后,溶剂的表面张力要发生变化。
把溶质在表面层中与本体溶液中浓度不同的现象称为溶液的表面吸附。
使表面张力图11.1 分子间作用力示意图样品管滴液瓶压力计样品管恒温槽滴液瓶通大气玻璃管精密数字压力计图11.2 最大气泡法表面张力测定装置降低的物质称为表面活性物质。
用吉布斯公式(Gibbs)表示:Tc d RTdc σ⎛⎫Γ=⎪⎝⎭ (11-1) 式中:Γ为表面吸附量(mol ·m -2),σ为表面张力(J ·m -2)。
表面张力的测定

大学化学实验II实验报告——物理化学实验学院:化学和化工学院专业:班级:姓名实验日期实验时间学号指导教师实验项目名称表面张力的测定实验目的1.掌握最大泡压法测定液体表面的方法,了解表面张力测定的因素。
2.测定不同浓度正丁醇溶液的表面张力,计算吸附量,并由表面张力的实验数据求分子的表面积。
实验原理表面张力是液体的重要性质之一,它是因表面层分子受力不均衡所引起的。
如液体和其蒸气构成的系统:液体内部的分子和周围分子间的作用力是球形对称的,可以彼此抵消,合力为零,而表面层分子处于力场不对称的环境中,液体内部分子对它的作用力远大于液面上蒸气分子对它的作用力,从而使它受到指向液体内部的拉力作用,故液体都有自动缩小表面积的趋势。
从热力学观点来看,液体表面缩小是使系统总吉布斯函数减小的一个自发过程,如欲使液体产生新的表面ΔA,就需对其做功,其大小应和ΔA成正比:ΔG =W′= γΔA (1)比例系数γ从能量的角度被称为比表面吉布斯函数,即为恒温恒压下形成1m2新表面所需的可逆功,其单位为J•m-2。
从物理学力的角度看,γ可被理解为沿着表面、和表面相切、垂直作用于单位长度相界面线段上的表面紧缩力,即表面张力,其单位是N•m-1。
在定温下纯液体的表面张力为定值,当加入溶质形成溶液时,表面张力发生变化,其变化的大小决定于溶质的性质和加入量的多少。
根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低,这种表面浓度和内部浓度不同的现象叫做溶液的表面吸附。
在指定的温度和压力下,溶质的吸附量和溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(Gibbs)吸附方程:PTcRTc,⎪⎭⎫⎝⎛∂∂-=Γγ(2)式中,Г为溶质在表面层的吸附量;γ为表面张力;c为吸附达到平衡时溶质的浓度。
引起溶剂表面张力显著降低的物质叫表面活性物质,Г>0,即产生正吸附的物质;反之称为表面惰性物质,Г<0,即产生负吸附的物质。
溶液中的吸附作用和表面张力的测量__最大气泡法

=得:
c d RT dc T
由表格:
-0.29872C +1.65385 2C 2 5.38012 3C 3 6.64738 4C 4 RT
浓度 C (mol/L) 0.0437 0.0874 0.1311 0.1748 0.2185 0.2622 0.3059
Г(mol·m-2)
C/Г(m2/L)
3.1612E-06 13824.04 3.9301E-06 22238.57 4.0807E-06 32127.04 4.4633E-06 39163.85 5.0051E-06 43655.87 4.7096E-06 55673.22 1.6573E-06 184574.84
5 / 11
溶液中的吸附作用和表面张力的测量
表面活性溶质能降低溶液的表面张力,根据能量最低原理,溶质分子会尽量 往表面分布,表面层中溶质的浓度比溶液内部大。在表面达到形成单分子的饱和 吸附层之前,随着正丁醇浓度增加,表面的正丁醇也随之增加,且增加的速率快 于溶液内部,所以Γ增大。当表面刚好形成单分子的饱和吸附层时,此时浓度差 达到最大,界面的吸附量Γ达到最大。
2 / 11
溶液中的吸附作用和表面张力的测量
本实验的关键在于溶液浓度的正确性和所用毛细管、恒温套管的清洁程度。 因此除事先用热的洗液清洗它们以外,每改变一次测量溶液,必须用待测溶液反 复洗涤,以保证所测量的溶液表面张力与实际溶液的浓度相一致。并控制好出泡 速度,平稳的重复出现压力差。而不允许气泡一连串冒出。洗涤毛细管时勿碰破 尖端,影响测量。 温度对该实验的测量影响也比较大,实验中请注意观察恒温水浴的温度,溶 液须恒温 10min 再进行测量。 2.3 实验注意事项: (1) 测定用的毛细管一定要洗干净,否则气泡可能不能连续稳定的通过,而 使压力计的读数不稳定。 (2) 毛细管一定要垂直,管口要和液面刚好接触。 (3) 表面张力和温度有关,因此要等溶液恒温后再测量。 (4) 控制好出泡速度,读取压力计的压力差时,应取气泡单个逸出时的最大 压力差。
物理化学实验报告-溶液中的吸附作用和表面张力的测定实验报告

实验十二溶液中的吸附作用和表面张力的测定摘要:本实验采用最大气泡压力法测定了液体表面张力,通过对不同浓度下正丙醇溶液的表面张力研究其和浓度之间的关系。
初步探讨了表面张力的性质、表面能的意义以及表面张力和吸附作用的关系。
关键词:吸附作用、表面张力、最大气泡法The measurement of the adsorption effect andsurface tensionAbstract:In this experiment, according to Gibbs formula and Langmuir equal-temperature equation, we apply the biggest bladder pressure method to research the relationship between the amount of absorption and the consistency of a substance in the solution besides the surface tension. The phenomenon show that the consistency of a substance in the surface of the solution is different from that inside is called absorption.Keyword:Surface tension, The biggest bubble pressure method, Absorption effect1. 序言物体表面的分子和内部的分子所处的境况不同,因此能量也不同,表面张力就是内部分子对表面分子的作用力,它是液体的重要属性之一,与所处的温度、压力、液体的组成共存的另一面的组成等因素都有关。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
短链醇溶液表面张力及表面吸附测定的实验研究

短链醇溶液表面张力及表面吸附测定的实验研究周亭;陈俊峰;张志庆;张国栋;王芳珠【摘要】分别测定得到6种短链醇溶液在不同浓度下的表面张力,考察了分子结构对表面张力和吸附性能的影响,提出了适用于综合实验的醇类稀溶液浓度范围,并利用Origin软件分别基于传统数据处理方式和曲线拟合方式计算得到吸附分子的横截面积.通过此实验,力求针对最大压差测定方法、处理实验数据和理论知识点3个目标层次,使学生尽可能全面地掌握表面化学相关实验原理和技术、数据处理方法,加深影响表面张力和吸附测定的因素和相应的概念、理论的理解,努力培养和提高学生实际应用能力.【期刊名称】《实验室研究与探索》【年(卷),期】2019(038)001【总页数】5页(P27-30,68)【关键词】表面张力;饱和吸附量;最大压差;吸附等温式【作者】周亭;陈俊峰;张志庆;张国栋;王芳珠【作者单位】中国石油大学(华东)理学院,山东青岛266580;中国石油大学(华东)化学工程学院,山东青岛266580;中国石油大学(华东)理学院,山东青岛266580;中国石油大学(华东)理学院,山东青岛266580;中国石油大学(华东)理学院,山东青岛266580【正文语种】中文【中图分类】O6470 引言溶液表面吸附与表面张力测定实验是化学、化工、应用化学、环境和材料等专业开设的一个重要的物理化学基础实验,该实验的测定原理和数据处理过程几乎涉及到表面化学中所有重要的基本概念和公式[1-2],例如表面张力、表面过剩、饱和吸附量、覆盖度(或吸附率)、吸附分子的横截面积、Laplace方程、Gibbs吸附公式和Langmuir吸附等温式等等,而且许多现象,如毛细现象、润湿现象、吸附现象等与表面张力相关,3次采油、原油管道运输、化工传质分离、矿物浮选和环境监测等领域也都与液体的表面张力和吸附息息相关[1]。
目前,用以测定溶液表面张力和表面吸附的方法很多,如毛细管上升法、吊环法、最大压差法、滴体积法和悬滴法等[3-4]。
表面张力的测定实验报告

浙江万里学院生物与环境学院化学工程实验技术实验报告实验名称:溶液表面张力的测定(1)实验目的1、掌握最大气泡法测定表面张力的原理和技术2、通过对不同浓度正丁醇溶液表面张力的测定,加深对表面张力、表面自由能和表面吸附量关系的理解3、学习使用Matlab 处理实验数据(2) 实验原理1、 表面自由能:从热力学观点看,液体表面缩小是一个自发过程,这是使体系总的自由能减小的过程。
如欲使液体产生新的表面A ∆,则需要对其做功。
功的大小应与A ∆成正比:-W=σA ∆2、 溶液的表面吸附:根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大,反之,溶质使溶液的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
这种表面浓度与溶液里面浓度不同的现象叫“吸附”。
显然,在指定温度和压力下,吸附与溶液的表面张力及溶液的浓度有关。
Gibbs 用热力学的方法推导出它们间的关系式 T cRT c )(∂∂-=Γσ(1)当0<⎪⎭⎫ ⎝⎛∂∂Tc σ时,Γ>0,溶质能减少溶剂的表面张力,溶液表面层的浓度大于内部的浓度,称为正吸附,此类物质叫表面活性物质。
(2)当0>⎪⎭⎫ ⎝⎛∂∂Tc σ时,Γ<0,溶质能增加溶剂的表面张力,溶液表面层的浓度小于内部的浓度,称为负吸附,此类物质叫非表面活性物质。
由Tc RT c )(∂∂-=Γσ可知:通过测定溶液的浓度随表面张力的变化关系可以求得不同浓度下溶液的表面吸附量。
3、 饱和吸附与溶质分子的横截面积:吸附量Γ浓度c 之间的关系,有Langmuir等温方程式表示:cK cK ·1·+Γ=Γ∞4、 最大泡压法:(3) 实验装置与流程:将燃烧热实验的主要设备、仪器和仪表等按编号顺序添入图下面相应位置:图11-4最大气泡法测表面张力装置1. 恒温套管 2. 毛细管 3.数字式微压差测量仪 4. 滴液瓶 5. 烧杯 6.连接橡皮管(4) 简述实验所需测定参数及其测定方法:1、测定各浓度试剂在25℃的压强,2、根据s/DP=K ,可用蒸馏水的压强差求出K 值,也就是毛细管常数。
物化实验报告-表面张力的测定

溶液中的吸附作用和表面张力的测定一、实验目的1、 掌握最大气泡法和滴重法测定表面活性物质正丁醇的表面张力, 并且利用Gibbs 吸附公式和Langmuir 吸附等温式测定正丁醇分子的横截面积。
训练学生利用毛细管和数字式微压测量仪以及滴重管测定表面张力的方法, 并通过曲线及直线拟合处理得到不同数据。
培养学生在实验中严谨的实验作风和态度, 并对学生的科研兴趣进行初步的指导。
二、实验原理物体表面分子和内部分子所处的境遇不同, 表面层分子受到向内的拉力, 所以液体表面都有自动缩小的趋势。
如果把一个分子由内部迁移到表面, 就需要对抗拉力而做功。
在温度、压力和组成恒定时, 可逆地表面增加 所需对体系做的功, 叫表面功, 可以表示为:W dA δσ'-=式中σ为比例常数。
σ在数值上等于当T 、p 和组成恒定的条件下增加单位表面积所必须对体系做的可逆非膨胀功, 也可以说是每增加单位表面积时体系自由能的增加值。
环境对体系作的表面功转变为表面层分子比内部分子多余的自由能。
因此, σ称为表面自由能, 其单位是焦耳每平方米(J/m2)。
若把σ看作为作用在界面上每单位长度边缘上的力, 通常称为表面张力。
从另外一方面考虑表面现象, 特别是观察气液界面的一些现象, 可以觉察到表面上处处存在着一种张力, 它力图缩小表面积, 此力称为表面张力, 其单位是牛顿每米(N/m )。
表面张力是液体的重要特性之一, 与所处的温度、压力、浓度以及共存的另一相的组成有关。
纯液体的表面张力通常是指该液体与饱和了其本身蒸气的空气共存的情况而言。
2、 纯液体表面层的组成与内部层相同, 因此, 液体降低体系表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液则由于溶质会影响表面张力, 因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原则, 溶质能降低溶剂的表面张力时, 表面层中溶质的浓度应比溶液内部来得大。
反之溶质使溶剂的表面张力升高时, 它在表面层中的浓度比在内部的浓度来得低, 这种表面浓度与溶液内部浓度不同的现象叫“吸附”。
溶液表面张力的测定及等温吸附

溶液表面张力的测定及等温吸附周韬摘要:实验利用最大气泡法测定溶液的表面张力。
利用已知表面张力的溶液测定毛细管的仪器常数,然后利用测定的仪器常数测定含不同量溶质的溶液的表面张力,并且根据吉布斯吸附方程和Langmuir吸附等温式画出吸附等温线,求出了饱和吸附量等一系列数据。
关键词:表面张力;最大气泡发;附加压力;等温吸附;饱和吸附量。
1.前言贡雪东等人的“最大气泡法测溶液表面张力的改进”[1]实验中,采用在试管上做标记的方法来快速调节毛细管与液面相切。
由于实验的本身并不是非常耗时,并且相切步骤比较容易调节,所以本实验没有采用标记的方法。
)T的计算基本上都是通过γ对现在用气泡法测定正丁醇表面张力的实验(ðγðcc作图,然后运用切线法求得。
这种方法在实验数据的处理上显得非常的繁琐。
向明礼等人的“Origin 对溶液σ-c 关系的非线性拟合”[2]中提到了运用希斯科夫斯基经验公式法对其进行了求导计算。
这种方法在数据处理上占有一定的优势。
所以本实验的数据处理也采用了该经验公式的方法。
2.实验部分2.1原理一.表面张力的测定本次实验利用最大气泡法测定不同浓度正丁醇溶液的表面张力,并利用表面张力计算等温吸附的一系列数据。
图1为本次实验所用到的实验装图1最大气泡发实验装置置图。
当装置中毛细管(2)尖端与表面张力仪中的液面相切时,液体沿毛细管上升(毛细管现象)。
当打开滴液漏斗3的活塞使其中的液体缓慢滴出时,表面张力仪与外界气压形成一个压力差,压力差大于毛细管管口液体的表面张力时,气泡从毛细管中逸出,此时的压力差为最大压力差(也就是附加压力Δp),可由数字式微压测量仪测定。
此附加压力与毛细管内液体的表面张力γ成正比,与气泡的曲率半径R成反比,其关系式为:Δp=2γ/R 式1当毛细管的半径很小时,形成的最大气泡基本为球形。
在气泡刚开始形成的时候,表面几乎是一个平面,此时的曲率半径最大,随着气泡的增大,曲率半径逐渐减小。
最大泡压法测定溶液表面张力实验报告

最大泡压法测定溶液表面张力实验报告最大泡压法测定溶液表面张力实验报告一.实验目的1.明确表面张力、表面自由能和吉布斯吸附量的物理意义。
2.掌握最大泡压法测定溶液表面张力的原理和技术。
3.掌握计算表面吸附量和吸附质分子截面积的方法。
二.实验原理1.表面张力和表面吸附图1 液体表面与内部分子受力情况图液体表面层的分子一方面受到液体内层的邻近分子的吸引,另一方面受到液面外部气体分子的吸引,由于前者的作用要比后者大,因此在液体表面层中,每个分子都受到垂直于液面并指向液体内部的不平衡力,如图1所示,这种吸引力使表面上的分子自发向内挤促成液体的最小面积,因此,液体表面缩小是一个自发过程。
在温度、压力、组成恒定时,每增加单位表面积,体系的吉布斯自由能的增值称为表面吉布斯自由能(J·m-2),用γ表示。
也可以看作是垂直作用在单位长度相界面上的力,即表面张力(N·m-1)。
欲使液体产生新的表面ΔS,就需对其做表面功,其大小应与ΔS成正比,系数为即为表面张力γ:W’ = γ x S (1)在定温下纯液体的表面张力为定值,当加入溶质形成溶液时,分子间的作用力发生变化,表面张力也发生变化,其变化的大小决定于溶质的性质和加入量的多少。
水溶液表面张力与其组成的关系大致有以下三种情况:(1)随溶质浓度增加表面张力略有升高;(2)随溶质浓度增加表面张力降低,并在开始时降得快些;(3)溶质浓度低时表面张力就急剧下降,于某一浓度后表面张力几乎不再改变。
以上三种情况溶质在表面层的浓度与体相中的浓度都不相同,这种现象称为溶液表面吸附。
根据能量最低原理,溶质能降低溶剂的表面张力时,表面层中溶质的浓度比溶液内部大;反之,溶质使溶剂的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
在指定的温度和压力下,溶质的吸附量与溶液的表面张力及溶液的浓度之间的关系遵守吉布斯(Gibbs)吸附方程:= -(2)式中,Г为溶质在表层的吸附量,单位mol·m2,γ为表面张力,c溶质的浓度。
表面吸附量的测定

实验十九表面吸附量的测定预习题1 •为什么表面活性物质水溶液的表面张力随溶液浓度的变化而变化?2 •用气泡最大压力法测表面张力时,为什么气泡必须均匀缓慢冒出?3 •为什么毛细管端要刚好与液面接触?若毛细管端浸入溶液,则使最大压力差变大还使变小? 为什么?4 •毛细管常数如何测定?5 •表面吸附量r的物理意义是什么?6 .浓度为4.00 TO-4 mol L・-1时的溶液表面吸附量如何得到?此表面吸附量的单位是什么?7 •分析影响本实验结果的因素有哪些?一.实验目的1 •用气泡最大压力法测定十六烷基三甲基溴化铵水溶液的表面张力。
从而计算溶液在某一浓度时表面吸附量r2 •熟悉斜管压力计的使用方法。
二•实验原理1 •在指定的温度下,纯液体的表面张力是一定的,一旦在液体中加入溶质成溶液时情况就不同了,溶液的表面张力不仅与温度有关,而且也与溶质的种类,溶液浓度有关。
这是由于溶液中部分分子进入到溶液表面,使表面层的分子组成也发生了改变,分子间引力起了变化,因此表面张力也随着改变,根据实验结果,加入溶质以后在表面张力发生改变的同时还发现溶液表面层的浓度与内部浓度有所差别,有些溶液表面层浓度大于溶液内部浓度,有些恰恰相反,这种现象称为溶液的表面吸附作用。
根据吉布斯吸附等温式一如一1代(1)RTdc 2.303RT d lg c式中,r代表溶液浓度为c时的表面上溶质的吸附量(mol m-2), c代表平衡时溶液浓度(mol L-1), R为理想气体常数(8.314 J mol-1 K-1) , T为吸附时的温度(K)。
从(1)式可看出,在一定温度时,溶液表面吸附量与平衡时溶液浓度c和表面张力随浓度变化d -率——成正比关系。
dcd -当0时,r> 0表示溶液表面张力随浓度增加而降低,则溶液表面发生正吸附,此时溶液dc表面层浓度大于溶液内部浓度。
d :二当0时,r < 0表示溶液表面张力随浓度增加而增加,则溶液表面发生正吸附,此时溶dc液表面层浓度小于溶液内部浓度。
