有机化学《有机反应方程式》001检测
大学有机化学反应方程式总结烯烃的加成与聚合反应

大学有机化学反应方程式总结烯烃的加成与聚合反应烯烃是有机化学中一类重要的化合物,其分子结构含有碳碳双键。
在有机合成中,烯烃的加成与聚合反应是两种常见的反应类型。
本文将对这两种反应进行总结,并给出相应的反应方程式。
一、烯烃的加成反应烯烃的加成反应是指烯烃分子中的双键与另外的一个化合物(如氢气、卤素、水等)发生反应,使得原有的双键被打开,形成新的化学键。
烯烃的加成反应主要有以下几种类型:1. 氢化反应(氢加成)烯烃与氢气反应,双键上的一个碳原子与一个氢原子结合,形成碳碳单键。
其中,催化剂常用铂(Pt)、钯(Pd)或镍(Ni)。
例如,1-丁烯与氢气反应可以得到正丁烷,反应方程式为:CH3-CH=CH-CH3 + H2 → CH3-CH2-CH2-CH32. 卤素化反应烯烃与卤素(如溴、氯)发生反应,使得烯烃中的双键被卤素原子取代,形成稳定的卤代烷烃。
以1-丁烯与溴反应为例,生成1,2-二溴丁烷,反应方程式如下:CH3-CH=CH-CH3 + Br2 → CH3-CHBr-CHBr-CH33. 水化反应烯烃与水反应,双键中的一个碳原子与一个氢原子结合,另一个被一个氢原子和一个羟基(-OH)取代。
在酸性条件下,应用H2SO4或H3PO4作为催化剂。
以乙烯与水反应为例,可以生成乙醇,反应方程式如下:CH2=CH2 + H2O → CH3-CH2-OH二、烯烃的聚合反应烯烃的聚合反应是指两个或多个烯烃分子在特定条件下,双键相互相连,形成长链或支链聚合物的过程。
烯烃的聚合反应是合成塑料、橡胶等重要有机材料的基础。
1. 乙烯的聚合乙烯是最简单的烯烃,其聚合过程产生的聚合物聚乙烯是一种广泛应用的塑料。
乙烯的聚合反应需要催化剂,常用的催化剂有过渡金属催化剂(如Ziegler-Natta催化剂)和高压聚合法(如自由基聚合法)。
聚乙烯的聚合反应方程式为:nCH2=CH2 → (CH2-CH2)n2. 丙烯的聚合丙烯是另一种重要的烯烃,其聚合反应可以得到聚丙烯,也是一种常用的塑料材料。
有机化学反应方程式

有机化学反应方程式1. 烷烃的氧化反应2. 甲烷的氯代反应(游离基的链反应)3. 烷烃的卤代反应 (卤代反应活性:叔氢>仲氢>伯氢 F 2 > Cl 2 > Br 2 > I 2 )4. 环烷烃的自由基取代反应5. 环烷烃的加成反应1)催化加氢(催化加氢易到难:环丙烷>环丁烷>环戊烷。
≥6环烷烃更难。
)2)加卤素C H 2C CH 2+Br 2CH 2—CH 2—CH 2H 2BrBr3)加卤化氢环丙烷的烷基取代物与HX 开环加成, 环的开裂总是在含最多H 和最少H 的碳原子间进行, 氢加到含氢多的碳原子上。
6. 烯烃的亲电加成反应 1)加卤素卤素的活泼性次序:F 2>Cl 2>Br 2>>I 2 (不反应);烯烃与氟加成太剧烈,往往使反应物完全分解,与碘则难发生加成反应。
溴水褪色,可用于鉴别不饱和键:鉴别烷烃和烯、炔。
该加成反应一定是分步进行的 2)加卤化氢烯烃与卤化氢同样发生分步的、亲电性加成反应HX 对烯烃加成的相对活性:HI > HBr > HCl (与极化度有关)+Br2BrBr+ HBrCH 3CH 2CH 2Br+ HICH 3CH 2CH 2CH 2IC +X 2C C C X X C +C C C XHHX实验证明主要产物是(Ⅰ)不对称烯烃与卤化氢等极性试剂加成时,氢原子总是加到含氢较多的双键碳原子上。
这就是马尔可夫尼可夫最初提出的规则,简称马氏规则。
3)加硫酸将产物水解,是工业制备醇的一个方法(间接法)4)加水通常烯烃不易与水直接反应,但在硫酸等强酸存在下,烯烃可与水加成生成醇。
7. 烯烃的催化加氢主要得顺式加成产物。
用途主要有将汽油中的烯烃转化为烷烃;不饱和油脂的加氢;用于烯烃的化学分析8.烯烃的自由基加成反应主要产物是反马氏规则的这种现象又称为过氧化物效应,只局限于烯烃与溴化氢的反应。
这时烯烃与溴化氢发生是自由基加成反应。
高中经典有机化学反应方程式

章末回顾排查专练(十二)排查一、重要有机反应方程式再书写1.2.2C 2H 5OH +2Na →2C 2H 5ONa +H 2↑; 3.CH 3CH 2OH ―――――――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O ; 4.C 2H 5OH +HBr ――→△ C 2H 5Br +H 2O ;5.2C 2H 5OH +O 2―――――――――→Cu 或Ag △2CH 3CHO +2H 2O ;9.2CH 3CHO +O 2―――――――――→催化剂△2CH 3COOH ; 10.CH 3CHO +H 2――――――――――→催化剂△CH 3CH 2OH ; 11.CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O ;12.CH 3CHO +2Cu(OH)2――→△ CH 3COOH +Cu 2O ↓+2H 2O ;13.CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ;14.CH 3COOC 2H 5+H 2O 稀H 2SO 4△CH 3COOH +C 2H 5OH ;15.乙二醇和乙二酸生成聚酯16.排查二、常考易错再排查 1.按碳原子组成的分子骨架分,有机物可分为链状化合物和环状化合物,环状化合物又包括脂环化合物和芳香族化合物。
按官能团分,有机物可分为烃(烷烃、烯烃、炔烃、芳香烃)和烃的衍生物(卤代烃、醇、酚、醛、酸、酯等)。
( )2.具有相同分子式,不同结构的化合物互为同分异构体。
包括碳链异构(如CH 3CH 2CH 2CH 3与)、位置异构(如CH 3CH===CHCH 3与CH 3CH 2CH===CH 2)、官能团异构(如CH 3CH 2OH 与CH 3OCH 3)、顺反异构(顺2-丁烯与反2-丁烯)、手性异构等。
( )3.发生加成反应或加聚反应的有机物分子必须含有不饱和键。
有机化学方程式汇总烷烃的卤代反应

有机化学方程式汇总烷烃的卤代反应烷烃是有机化合物中最简单的一类,其分子中仅含有碳和氢原子。
烷烃的卤代反应是有机化学中的一类重要反应,它指的是将烷烃中的氢原子替换为卤素原子,如氯、溴或碘。
这类反应在工业生产和实验室合成中经常被使用,对合成具有特定功能的有机化合物具有重要意义。
本文将汇总和讨论一些典型的烷烃卤代反应。
一、氯代反应1. 单质氯与烷烃反应由于氯在常温下即可与烷烃反应,因此其反应速度较快。
例如,甲烷与氯气反应生成氯代甲烷(CH3Cl):CH4 + Cl2 → CH3Cl + HCl2. 亲电取代反应在亲电取代反应中,烷烃分子中的氢原子被一个亲电试剂取代。
典型的例子是环状烷烃的氯代反应。
例如,环己烷与氯化亚铁反应生成氯代环己烷:C6H12 + FeCl2 → C6H11Cl + FeCl3二、溴代反应1. 单质溴与烷烃反应单质溴与烷烃的反应速度相对较慢,但可以通过加热或紫外光照射来加快反应速度。
例如,乙烷与溴反应生成溴代乙烷:C2H6 + Br2 → C2H5Br + HBr2. 自由基取代反应自由基取代反应中,烷烃通过自由基反应生成卤代烷。
该反应通常需要引发剂的存在,并以光照或加热为触发条件。
例如,甲烷与溴反应生成溴代甲烷:CH4 + Br2 → CH3Br + HBr三、碘代反应碘化物对烷烃的取代反应速度较慢,通常需要高温或者催化剂的存在。
例如,正丁烷与碘反应生成碘代正丁烷:C4H10 + I2 → C4H9I + HI总结:烷烃的卤代反应是有机化学中重要的合成手段之一。
通过适当的方法和条件,可以将烷烃中的氢原子替换为卤素原子,得到具有特定功能的有机化合物。
其中,氯代反应、溴代反应和碘代反应是常见的烷烃卤代反应类型。
了解和掌握这些反应机理和适用条件,对于有机合成的设计和实践具有重要指导意义。
以上是有机化学方程式汇总烷烃的卤代反应的内容。
通过对单质氯、单质溴以及各种亲电试剂的应用,我们可以实现对烷烃的卤代取代反应。
大学有机化学反应方程式总结(较全)
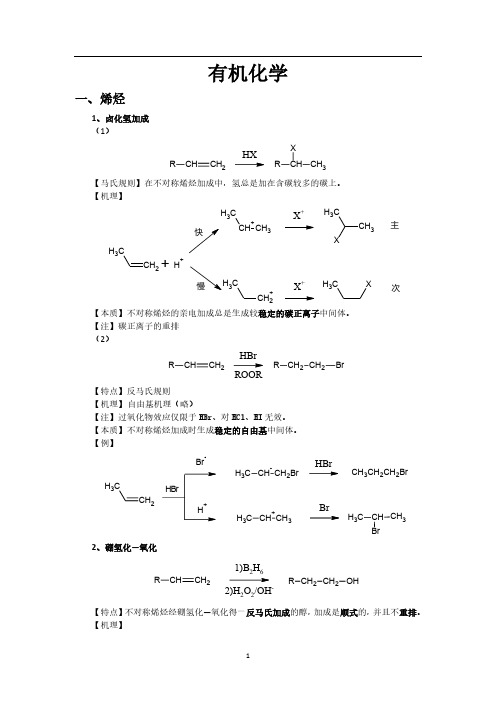
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3-B-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OCH 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOCH 2CH 2CH 3CH 2CH 2CH 3OCH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH3NaOH3HOCH 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH 3、X 2加成C CBr/CCl CC BrBr 【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
有机化学反应方程式总结氧化还原反应

有机化学反应方程式总结氧化还原反应氧化还原反应是有机化学中最常见的一类反应,也是有机合成和有机化工中重要的反应类型之一。
本文将总结常见的有机化学反应方程式,包括氧化反应和还原反应。
一、氧化反应1. 高价态氧化反应氧可以以不同的氧化态参与反应,其中最常见的是氧气(O2)和过氧化氢(H2O2)。
以下是一些常见的高价态氧化反应方程式:1) 醇氧化反应:醇+ [O] → 醛 + H2O2) 全氧氧化反应:碳氢化合物+ O2 → CO2 + H2O3) 羧酸氧化反应:羧酸+ O2 → 一般产物 + H2O2. 过氧化物氧化反应过氧化物是一类含有氧氧单键(O-O)的化合物,可以在氧化反应中作为氧化剂。
以下是一些常见的过氧化物氧化反应方程式:1) 过氧化氢氧化反应:过氧化氢 + 2H+ + 2e- → 2H2O2) 过氧化苯酚氧化反应:过氧化苯酚+ [O] → 苯醌 + H2O3) 过氧化乙酸氧化反应:过氧化乙酸+ [O] → 乙酸 + CO2 + H2O二、还原反应还原反应是氧化反应的逆过程,即被氧化物失去氧原子或获得氢原子。
以下是一些常见的有机化学还原反应方程式:1. 还原脱氧反应还原脱氧反应是有机化合物中含氧原子的官能团被还原为碳-碳键。
以下是一些常见的还原脱氧反应方程式:1) 脂肪酸还原脱氧反应:脂肪酸+ LiAlH4 → 醇 + Al(OH)32) 酮还原脱氧反应:酮+ NaBH4 → 醇3) 羧酸还原脱氧反应:羧酸+ LiAlH4 → 醇 + Al(OH)32. 氢化还原反应氢化还原反应是有机化合物中含氧或含氮官能团被还原为相应的醇或胺。
以下是一些常见的氢化还原反应方程式:1) 酮氢化反应:酮+ NaBH4 → 醇2) 醛氢化反应:醛+ NaBH4 → 醇3) 羧酸酯氢化反应:羧酸酯+ LiAlH4 → 醇结论:本文总结了有机化学中的氧化还原反应方程式,包括氧化反应和还原反应。
通过对这些反应方程式的了解,我们可以更好地理解氧化还原反应的原理和应用,为有机化学合成和化工工艺的设计提供指导。
大学有机化学反应方程式总结卤代烃的取代反应与消除反应

大学有机化学反应方程式总结卤代烃的取代反应与消除反应大学有机化学反应方程式总结——卤代烃的取代反应与消除反应有机化学是研究碳为主体的有机化合物及其反应性质的学科。
其中,卤代烃是有机化合物中的一类重要化合物,它们在有机合成和医药领域具有广泛的应用。
卤代烃的取代反应和消除反应是有机化学中的基础反应之一。
本文将对这两种反应进行总结,并列举相关的反应方程式。
一、卤代烃的取代反应1. 氢氧离子的取代反应:卤代烃在碱性条件下可以发生醇和醚的生成反应。
具体反应方程式如下:R-X + OH- → R-OH + X-R-X + OR' → R-OR' + X-这种反应称为亲核取代反应,其中OH-或OR'为亲核试剂,R和X分别代表有机基团和卤素原子。
2. 氨或胺的取代反应:卤代烃与氨或胺反应可以生成相应的胺或胺盐。
具体反应方程式如下:R-X + NH3 → R-NH2 + HXR-X + RNH2 → R-NHR' + HX这种反应可以通过控制反应条件和反应物的选择来对生成物进行调控。
3. 芳香化合物的取代反应:芳香化合物的取代反应是有机化学中的重要反应。
卤代烃作为芳烃的取代试剂,可以发生芳香取代反应。
具体反应方程式如下:Ar-X + Nu- → Ar-Nu + X-Ar-X + Ar'-ONa → Ar-Ar' + X- + Na+这种反应可以引入不同的官能团和基团,从而改变芳香化合物的性质。
二、卤代烃的消除反应1. 亲电质消除反应:卤代烃在鹰式消除剂的作用下,发生亲电质消除反应。
具体反应方程式如下:R-X + Z → R-Z + X-其中,Z为鹰式消除剂。
这种反应可以生成亲电质和卤素离子。
2. 氢氧化物消除反应:卤代烃在碱性条件下,通过内消除反应,发生氢氧化物消除。
具体反应方程式如下:R-X + OH- → R-H + X-这种反应可以生成烯烃或炔烃等不饱和化合物。
高考化学有机反应方程式

高考化学有机反应方程式在高考化学中,有机反应方程式是一个重要的考点,它不仅考查我们对有机化学基础知识的掌握程度,还检验我们运用知识解决问题的能力。
有机反应方程式的书写需要遵循一定的规则和原则。
首先,我们要明确反应物和生成物的结构和官能团。
官能团是决定有机化合物性质的关键部分,不同的官能团在反应中会有不同的表现。
比如,在加成反应中,常见的官能团有碳碳双键和碳碳三键。
以乙烯(CH₂=CH₂)和氢气(H₂)的加成反应为例,方程式为:CH₂=CH₂+ H₂ → CH₃CH₃。
这个反应中,氢气分子中的氢原子分别加到了乙烯分子的双键两端,使双键变成了单键。
再来看取代反应,甲烷(CH₄)和氯气(Cl₂)在光照条件下发生取代反应,生成一氯甲烷(CH₃Cl)、二氯甲烷(CH₂Cl₂)、三氯甲烷(CHCl₃)和四氯化碳(CCl₄)以及氯化氢(HCl)。
这个系列反应的第一步可以表示为:CH₄+ Cl₂ → CH₃Cl + HCl 。
在这个反应中,氯气分子中的氯原子取代了甲烷分子中的氢原子。
酯化反应也是高考中常考的类型之一。
例如,乙酸(CH₃COOH)和乙醇(CH₃CH₂OH)在浓硫酸催化和加热的条件下发生酯化反应,生成乙酸乙酯(CH₃COOCH₂CH₃)和水。
反应方程式为:CH₃COOH + CH₃CH₂OH ⇌ CH₃COOCH₂CH₃+ H₂O 。
另外,还有消去反应。
以乙醇(CH₃CH₂OH)为例,在浓硫酸的作用下,加热到 170℃时发生消去反应生成乙烯和水,方程式为:CH₃CH₂OH → CH₂=CH₂↑ + H₂O 。
在书写有机反应方程式时,要注意配平,确保方程式两边的原子种类和数目相等。
同时,还要注明反应条件,如温度、催化剂、光照等,这些条件对反应的发生和产物的生成有着重要的影响。
高考中,常常会出现一些复杂的有机合成题,需要我们根据给定的原料和目标产物,分析中间的反应步骤,写出相应的反应方程式。
这就要求我们对常见的有机反应类型和反应方程式非常熟悉,能够灵活运用。
有机化学反应方程式

有机化学化学反应方程式总结(一)烷烃1.甲烷燃烧: CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应:CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HClCH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷高温分解: CH4C + 2H2(二)烯烃乙烯的制取:CH3CH2OH H2C=CH2↑+H2O乙烯的燃烧:H2C=CH2+3O22CO2+2H2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
加成反应与加聚反应1.乙烯与溴的四氯化碳溶液反应:CH2=CH2 + Br2 CH2BrCH2Br2.乙烯与水反应:CH2=CH2 + H2O CH3CH2OH3.乙烯的催化加氢:CH2=CH2 +H2CH3CH34.乙烯的加聚反应:n CH2=CH25. 乙烯与氯化氢加成:H2C=CH2+HCl CH3CH2Cl6.乙烯与氯气加成:CH2=CH2 + Cl2 CH2ClCH2Cl浓硫酸170℃点燃(三)炔烃1.乙炔燃烧: 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应:CH≡CH + Br2 CHBr2CHBr2 3.乙炔与氢气催化加成:CH≡CH + 2H2CH3CH3 4.乙炔制聚氯乙烯:CH≡CH +HCl H2C=CHCl n H2C=CHCl(四)芳香烃1.苯的燃烧: 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢:+ 3H24.苯与液溴催化反应:+ Br2+ HBr5.苯的硝化反应:+HO-NO 2+ H2O 9.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯:+ 3HO—NO2+ 3H2O(五)、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应:CH3CH2Br + NaOH CH3CH2OH + NaBr 2.氯乙烷在氢氧化钠醇溶液中加热反应:CH3CH2Br +NaOHCH2=CH2↑+ NaBr + H2O(六)、醇类 1.乙醇与钠反应: 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑2.乙醇的燃烧:CH 3CH 2OH+3O 22CO 2+3H 2O3.乙醇的催化氧化:2CH 3CH 2OH + O 22CH 3CHO + 2H 2O4.乙醇制乙烯:CH 3CH 2OH CH 2=CH 2↑ + H 2O5.乙醇制乙醚:2CH 3CH 2OH CH 3CH 2OCH 2CH 3 + H 2O6. 乙醇与红热的氧化铜反应:CH 3CH 2OH+CuOCH 3CHO+H 2O7. 乙醇和浓的氢溴酸加热反应制溴乙烷: C 2H 5OH+ H BrC 2H 5Br + H 2O(七)、酚类1.苯酚与氢氧化钠反应:+ NaOH+ H 2O2.苯酚钠与CO 2反应:+CO 2+H 2O+NaHCO 33.苯酚与溴水反应:+3Br 2 ↓ + 3HBr—ONa—OH(八)、醛类1.乙醛的催化加氢:CH3CHO + H2CH3CH2OH2.乙醛的催化氧化:2CH3CHO + O22CH3COOH3.银氨溶液的配制:Ag++NH3·H2O===AgOH↓++4NHAgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O 4.乙醛与银氨溶液反应:CH3CHO + 2Ag(NH3)2OHCH3COONH4+ 2Ag↓ + 3NH3 + H2O 5.乙醛与新制氢氧化铜反应:CH3CHO + 2Cu(OH)2 +NaOHCH3COONa + Cu2O↓ + 3H2O (九)、羧酸1.乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OHCH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应:2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑(十)、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解:CH3COOCH2CH3+H218OCH3CO18OH + CH3CH2OH2.乙酸乙酯碱性水解CH3COOC2H5+NaOH H3COONa+C2H5OH (十一)、糖类NaOH1.葡萄糖燃烧:C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与银氨溶液反应:CH2OH(CHOH)4CHO + 2Ag(NH3)2OHCH2OH(CHOH)4COONH4+ 2Ag↓ + 3NH3↑ + H2O 3.葡萄糖与新制氢氧化铜反应:CH2OH(CHOH)4CHO + 2Cu(OH)2+NaOHCH2OH(CHOH)4COONa + Cu2O↓ + 3H2O4.葡萄糖在酒化酶作用下获得乙醇:C6H12O62CH3CH2OH + 2CO2↑5.蔗糖水解:C12H22O11(蔗糖) + H2O C6H12O6(葡萄糖) +C6H12O6(果糖) 6.麦芽糖水解:C12H22O11(麦芽糖) + H2O 2C6H12O6(葡萄糖) 7.淀粉水解:(C6H10O5)n(淀粉) + nH2O n C6H12O6(葡萄糖)8.纤维素水解:(C6H10O5)n(纤维素) + nH2On C6H12O6(葡萄糖)(十二)、油脂1.油脂的氢化(以油酸甘油酯加氢为例) :2.油脂的皂化反应(以硬脂酸甘油酯为例) :。
必修2-有机化学反应方程式

必修2 有机化学反应方程式:1、甲烷的主要化学性质(1)氧化反应 CH 4(g)+2O 2(g)−−→−点燃CO 2(g)+2H 2O(l) (2)取代反应2、乙烯的乙烯的主要化学性质(1)氧化反应:C 2H 4+3O 2 −−→−点燃 2CO 2+2H 2O (2)加成反应乙烯还可以和氢气、氯化氢、水等发生加成反应。
CH 2=CH 2 + H 2CH 3CH 3 CH 2=CH 2+HClCH 3CH 2Cl (一氯乙烷) CH 2=CH 2+H 2OCH 3CH 2OH (乙醇)(3)聚合反应:3、苯的主要化学性质 (1) 氧化反应 2C 6H 6+15O 2 −−→−点燃12CO 2+6H 2O (2) 取代反应①+ Br 2−−→−3FeBr + HBr② 苯与硝酸(用HONO 2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。
+ HONO 2 浓硫酸△+ H 2O (3) 加成反应Br —NO 2用镍做催化剂,苯与氢发生加成反应,生成环己烷。
+ 3H 2 −−→−催化剂4、乙醇的重要化学性质(1) 乙醇与金属钠的反应2CH 3CH 2OH+2Na2CH 3CH 2ONa+H 2↑ (2) 乙醇的氧化反应①乙醇的燃烧 :CH 3CH 2OH+3O 2−−→−点燃 2CO 2+3H 2O②乙醇的催化氧化反应2CH 3CH 2OH+O 2 −−→−Ag Cu 或 2CH 3CHO+2H 2O 乙醛③乙醇在常温下的氧化反应CH 3CH 2OH −−−−−−−−→−或酸性重铬酸钾溶液酸性4KMnO CH 3COOH 5、乙酸的重要化学性质(1) 乙酸的酸性①乙酸能使紫色石蕊试液变红②乙酸能与碳酸盐反应,生成二氧化碳气体利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO 3):2CH 3COOH+CaCO 3(CH 3COO )2Ca+H 2O+CO 2↑乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:2CH 3COOH+Na 2CO 32CH 3COONa+H 2O+CO 2↑上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(完整版)有机化学反应方程式汇总

浓硫酸△ 有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
有机化学反应方程式

高中化学方程式汇编******有机化学方程式********§1烷烃甲烷与氯气反应CH 4+Cl 2――→光照CH 3Cl+HCl CH 3Cl+Cl 2――→光照CH 2Cl 2+HCl CH 2Cl 2+Cl 2 ――→光照CHCl 3+HCl CHCl 3+Cl 2 ――→光照 CCl 4+HCl甲烷的高温分解 CH 4 ――→高温C +2H 2十六烷催化裂化C 16H 34 ――→催化剂△C 8H 18 (辛烯)+ C 8H 16(辛烷) §2烯烃乙烯与溴水的加成反应CH 2=== CH 2 + Br 2 ―→ CH 2BrCH 2Br 乙烯的HBr 的加成反应 CH 2=== CH 2 + HBr ――→催化剂△ CH 3CH 2Br 乙烯水化制乙醇CH 2=== CH 2 +H 2O ――→催化剂△ CH 3CH 2OH乙烯实验室制法CH 3CH 2OH ――→浓硫酸170 ℃CH 2==CH 2 ↑+H 2O1,3—丁二烯1,4加成反应CH 2=CH-CH=CH 2 + Br 2 ―→CH 2BrCH 2=CHCH 2Br *乙烯催化氧化反应2CH 2 === CH 2 + O 2 ――→催化剂△ 2CH 3CHO乙烯的加聚反应nCH 2 = CH 2 ――→催化剂△CH 2—CH 2丙烯的加聚反应 n CH 3–CH=CH 2 ――→催化剂△1,3—丁二烯的加聚反应nCH 2=CH-CH=CH 2 ――→催化剂△CH 2—CH=CH —CH 2丙烯和氯化氢的加成反应 CH 2=CH-CH 3+HCl ―→(主产物)*丙烯的高温α-H 取代反应CH 2=CH -CH 3+Cl 2 ――→高温CH 2=CH -CH 2Cl +HCl *丙烯与酸性高锰酸钾反应 CH 2=CH -CH 3―→CO 2+H 2O+CH 3COOH*丙烯与O 3(Zn/H 2O )反应 CH 2=CH -CH 3―→HCHO+CH 3CHO§3炔烃乙炔的实验室制取CaC 2 + 2H 2O ―→ Ca(OH)2 + CH ≡CH↑由乙炔制聚氯乙烯CH ≡CH + HCl ――→催化剂△CH 2=== CHCln CH 2 =CHCl ――催化剂△*乙炔与氢氰酸的加成反应 CH ≡CH + HCN ――→NaOH 溶液△CH 2=CH —CN§4苯及其同系物苯与液溴的取代反应苯的硝化反应*苯的磺化反应苯与氢气的加成反应甲苯的硝化反应甲苯与酸性高锰酸钾反应§5卤代烃溴乙烷的碱性水解反应CH 3CH 2Br + NaOH ――→H 2O△CH 3CH 2OH + NaBr 溴乙烷的消去反应 CH 3CH 2Br +NaOH ――→乙醇△CH 2=CH 2↑+ NaBr + H 2O*溴乙烷与氰化钠反应CH 3CH 2Br +NaCN ――→△CH 3CH 2CN +NaBr*溴乙烷与丙炔钠反应 CH 3CH 2Br+ CH 3C ≡CNa ―→ CH 3CH 2C ≡CCH 3 +NaBr§6 醇乙醇与金属钠反应2CH 3CH 2OH + 2Na ―→2CH 3CH 2ONa + H 2↑ 乙醇催化氧化2CH 3CH 2OH + O 2 ――→Cu 或Ag△2CH 3CHO + 2H 2O 乙醇的消去反应CH 3CH 2OH ――→浓硫酸170 ℃ CH 2=CH 2+ H 2O ↑ 乙醇的分子间脱水反应2CH 3CH 2OH ――→浓硫酸140 ℃ H 2O + CH 3CH 2OCH 2CH 3 乙醇和浓氢溴酸取代CH 3CH 2OH +HBr ――→△CH 3CH 2Br + H 2O 乙醇的酯化反应 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5 +H 2O乙醇与酸性高锰酸钾反应CH 3CH 2OH ―→CH 3COOH§7 酚苯酚与氢氧化钠溶液反应苯酚钠溶液中通入二氧化碳苯酚与浓溴水的反应酚醛缩聚§8 醛乙醛的还原反应CH 3CHO + H 2 ――→催化剂△ CH 3CH 2OH 乙醛的催化氧化反应2CH 3CHO + O 2 ――→催化剂△ 2CH 3COOH 乙醛的银镜反应CH 3CHO + 2Ag(NH 3)2OH ――→△2Ag↓+ 3NH 3 + CH 3COONH 4 +H 2O乙醛与新制氢氧化铜悬浊液反应 CH 3CHO + 2Cu(OH)2 +NaOH ――→△CH 3COONa + Cu 2O ↓+3H 2O甲醛的银镜反应HCHO + 4Ag(NH 3)2OH ――→△( NH 4)2CO 3 + Ag↓+6NH 3 +2H 2O*乙醛的羟醛缩合反应 CH 3CHO +CH 3CHO ――→OH-――→△CH 2=CHCH 2CHO§9 羧酸乙酸与氢氧化铜悬浊液反应2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O乙酸的酯化反应 CH 3COOH +CH 3CH 2OH 浓H 2SO 4△CH 3COOC 2H 5 +H 2O*羧酸α-H 取代反应RCH 2COOH+Cl 2 ――→催化剂△+ HCl乳酸的酯化反应 a.链酯b.环酯c.聚酯几种高级脂肪酸硬脂酸 (饱和) C 17H 35COOH软脂酸(饱和) C 15H 31COOH油酸(含一个碳碳双键) C 17H 33COOH亚油酸(含两个碳碳双键) C 17H 31COOH§10 酯乙酸乙酯的酸性水解反应 CH 3COOC 2H 5+H 2O 浓H 2SO 4△CH 3COOH +CH 3CH 2OH乙酸乙酯的碱性水解反应 CH 3COOC 2H 5 +NaOH ――→△CH 3COONa +C 2H 5OH硬脂酸甘油酯的皂化反应油酸甘油酯的氢化反应§11 糖类葡萄糖的银镜反应CH 2OH(CHOH)4CHO +2Ag(NH 3)2OH ――→△CH 2OH(CHOH)4COONH 4 + 2Ag↓+ 3NH 3+H 2O葡萄糖与氢氧化铜悬浊液反应CH 2OH(CHOH)4CHO +2Cu(OH)2 +NaOH ――→△CH 2OH(CHOH)4COONa + Cu 2O ↓+3H 2O蔗糖的水解反应C 12H 22O 11 + H 2O ――→催化剂C 6H 12O 6 +C 6H 12O 6葡萄糖 果糖麦芽糖的水解反应C 12H 22O 11+ H 2O ――→催化剂2C 6H 12O 6 麦芽糖 葡萄糖 淀粉的水解反应(C 6H 10O 5)n + nH 2O ――→催化剂nC 6H 12O 6淀粉 葡萄糖C 6H 12O 6――→酒化酶2CH 3CH 2OH + 2CO 2§12 蛋白质甘氨酸与盐酸反应甘氨酸与氢氧化钠反应甘氨酸与丙氨酸生成二肽甘丙二肽丙甘二肽甘氨酸的缩聚反应几种氨基酸甘氨酸丙氨酸苯丙氨酸谷氨酸缬(xiè)氨酸。
有机化学方程式最全总结答案

有机化学⽅程式最全总结答案有机反应⽅程式总结(⼀)烷烃1.甲烷与氯⽓在光照条件下反应⽣成氯仿:CH 4 + 3Cl 2CHCl 3+ 3HCl2.烷烃燃烧通式: (⼆)烯烃1.⼄烯的制取:CH 3CH 2OH CH 2=CH 2↑+H 2O2.⼄烯可以使酸性⾼锰酸钾溶液褪⾊,发⽣氧化反应:3.⼄烯与溴的四氯化碳溶液反应:CH 2=CH 2 + Br 2 CH 2BrCH 2Br4.⼄烯的催化加氢:CH 2=CH 2 +H 2CH 3CH 35.⼄烯的加聚反应:n CH 2=CH 26. 1,3-丁⼆烯与溴(1:1)的反应: 1,4加成:CH 2=CH —CH =CH 2+Br 2 CH 2BrCH=CHCH 2Br 1,2加成:CH 2=CH —CH =CH 2+Br 2CH 2BrCHBrCH=CH 27.丙烯加聚:n H 2C =CHCH 38. 2-甲基-1,3-丁⼆烯加聚:n9.丙烯与氯⽓加热条件下反应(α-H 的取代):CH 3CH =CH 2 +Cl 2 ClCH 2CH =CH 2 +HCl(三)炔烃1.⼄炔的制取:CaC 2+2H 2OCH≡CH↑+Ca(OH)22.⼄炔与⾜量溴的四氯化碳溶液反应:CH≡CH + 2Br 2 CHBr 2CHBr 23.⼄炔制聚氯⼄烯: CH≡CH +HClH 2C =CHCl n H 2C =CHCl浓硫酸170℃(四)芳⾹烃1.甲苯与酸性KMnO 4溶液反应:2.苯的催化加氢:+ 3H 23.苯与液溴催化反应: + Br 2+ HBr4.苯的硝化反应: +HO -NO 2+ H 2O5.苯的磺化反应:+ H 2SO 4SO 3H + H 2O苯磺酸6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:+ 3HO —NO 2 + 3H 2O(五)、卤代烃1.溴⼄烷在氢氧化钠⽔溶液中加热反应:CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr2.溴⼄烷在氢氧化钠醇溶液中加热反应:CH 3CH 2Br +NaOH CH 2=CH 2 ↑+ NaBr + H 2O3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴⼄烷制备丙酸:CH 3CH 2Br +NaCN CH 3CH 2CN+ NaBrCH 3CH 2CN CH 3CH 2COOH(六)、醇类1.⼄醇与钠反应:2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑2.⼄醇的催化氧化:2CH 3CH 2OH + O 22CH 3CHO + 2H 2O浓硫酸3.⼄醇制⼄烯:CH 3CH 2OH CH 2=CH 2↑ + H 2O4.⼄醇制⼄醚:2CH 3CH 2OHCH 3CH 2OCH 2CH 3 + H 2O5.⼄醇和浓的氢溴酸加热反应制溴⼄烷:C 2H 5OH+ HBr C 2H 5Br + H 2O(七)、酚类1.苯酚与氢氧化钠溶液反应:+ NaOH+ H 2O2.苯酚钠与CO 2反应: +CO 2+H 2O +NaHCO 33.苯酚与溴⽔反应:+3Br 2↓ + 3HBr4.制备酚醛树脂: (⼋)、醛类1.⼄醛的催化加氢:CH 3CHO + H 2 CH 3CH 2OH2.⼄醛的催化氧化:2CH 3CHO + O 22CH 3COOH3.⼄醛与银氨溶液反应:CH 3CHO + 2Ag(NH 3)2OHCH 3COONH 4 + 2Ag↓ + 3NH 3 + H 2O4.⼄醛与新制氢氧化铜反应:CH 3CHO + 2Cu(OH)2 CH 3COOH + Cu 2O↓ + 2H 2O5.⼄醛与HCN 溶液反应:CH 3CHO + HCN CH 3CH(OH) CN(九)、羧酸1.⼄酸与⼄醇发⽣酯化反应:CH 3COOH + CH 3CH 2OH CH 3COOCH 2CH 3 + H 2O2.⼄酸与氨⽓加热条件下发⽣反应:3.⼄酸发⽣还原反应⽣成⼄醇:4.⼄酸与氯⽓催化剂条件下反应(α-H 被取代):5.两分⼦乳酸脱去两分⼦⽔:2CH 3CHOHCOOH—ONa OH△稀硫酸(⼗)、酯类1.⼄酸⼄酯与H 218O 混合加⼊稀硫酸⽔解:CH 3COOCH 2CH 3 + H 218O CH 3CO 18OH + CH 3CH 2OH2.⼄酸⼄酯碱性⽔解CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH3.油脂的皂化反应(以硬脂酸⽢油酯为例) :(⼗⼀)、⾼分⼦化合物 1.苯⼄烯合成聚苯⼄烯:2.异戊⼆烯合成聚异戊⼆烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.⼰⼆酸与⼰⼆胺脱⽔缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分⼦乳酸成环附加:烃的衍⽣物的转化H 2O△△。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
及名称
反应类型
反应方程式
反应条件
官能团变化
酸式水解
碱式水解
1.酸碱中和
2.碳酸酸性大于苯酚
3.苯酚酸性大于碳酸氢根
取代
显色
8.烃的衍生物——醛(通式):乙醛
官能团结构简式
及名称
反应类型
反应方程式
反应条件
官能团变化
氧化
还原
银镜
新制氢氧化铜
9.烃的衍生物——羧酸:乙酸
官能团结构简式
及名称
反应类型
反应方程式
反应条件
官能团变化
弱酸性
酯化
10.烃的衍生物——酯:乙酸乙酯
氧化
取代
5.烃的衍生物——卤烃:溴乙烷
官能团结构简式
及名称
反应类型
反应方程式
反应条件
官能团变化
取代
消去
6.烃的衍生物——醇(通式):乙醇
官能团结构简式
及名称
反应类型
反应方程式
反应条件
官能团变化
氧化
消去
取代
置换
7.烃的衍生物——酚(通式):苯酚
官能团结构简式
及名称
反应类型
反应方程式
反应条件
官能团变化
弱酸性
1.烃——烷烃:甲烷
反应类型
反应方程式
官能团变化
氧化
取代
2.烃——烯烃:乙烯
反应类型
反应方程式
官能团变化
氧化
加成
加聚
3.烃——炔烃:乙炔
反应类型
反应方程式
官能团衍生物:苯
反应类型
反应方程式
官能团变化
氧化
取代
加成
4.2.烃——苯及其衍生物:甲苯
反应类型
反应方程式
官能团变化
