偶极矩,介电常数
偶极矩的测定教案

偶极矩的测定一、实验目的:1.了解电容、介电常数的概念,学会测定极性物质在非极性溶剂中的介电常数。
2.了解偶极矩测定原理,方法和计算,并了解偶极矩和分子电性质的关系。
二、实验原理:1.偶极矩与极化度概念:分子根据其正负电荷中心是否重合可分为极性和非极性分子,分子极性的大小常用偶极矩来衡量:μ=q*d。
极性分子具有永久偶极矩,在没有外电场存在时,分子的热运动导致偶极矩各方向机会均等,统计值为0。
当分子置于外电场中,分子沿着电场方向作定向转动,电子云相对分子骨架发生相对移动,骨架也会变形,叫做分子极化,极化程度由摩尔极化度(P)衡量。
P=P转向+P变形=P转向+(P电子+P原子)其中P转向=4/9*πNμ2/KT (1)对于非极性分子,P转向=0外电场若是交变电场,极性分子的极化与交变电场的频率有关。
当交变电场频率小于1010S-1时,极性分子的摩尔极化度为转向极化度和变形极化度的和。
若电场频率为1012S-1~1014S-1的中频电场(红外光区),因为电场交变周期小于偶极矩的松弛时间,转向运动跟不上电场变化,故而P转向=0,P=P电子+P原子。
若交变电场频率大于1015S-1(可见和紫外光区),连分子骨架运动也不上变化,P=P电子。
因为P原子只占P变形的5%到15%,限于实验条件,一般用高频电场代替中频电场,将低频下测的P减去高频下测得的P,就可以得到极性分子的摩尔转向极化度P转向,从而代入(1)就可以算出分子的偶极矩。
2.极化度与偶极矩测定:对于分子间作用很小的体系(温度不太低的气相体系),从电磁理论推得摩尔极化度P与介电常数ε的关系为:P = (ε-1)/(ε+2)*M/ρ上式中假定分子间无相互作用,在实验中,我们必须使用外推法来得到理想情况的结果。
在溶液中分别测定不同浓度下的溶质的摩尔极化度,作图外推至无限稀释的情况,就可以得出分子无相互作用时的摩尔极化度:P2= lim P2 = 3αε1/ (ε1+2)2 * M1/ρ1+(ε1-1) / (ε1+2)* (M2-βM1) /ρ1式中ε1、ρ1、M1为溶剂的值,M2为溶质的分子量。
偶极矩介电常数的测定-物理化学实验

一、实验目的(1) 了解分子偶极矩与电性质的关系;(2) 掌握测定液体电容的基本原理和技术;(3) 学习测定液体电容的基本原理与技术;(4) 用溶液法测定乙酸乙酯的介电常数和偶极矩。
二、实验仪器试剂:乙酸乙酯、环己烷;仪器:阿贝折射仪、PGM-Ⅱ数字小电容测试仪-介电常数实验装置、比重管、电吹风、25cm3容量瓶。
三、实验原理1、偶极矩与摩尔极化度的关系分子中正、负电荷中心有重合的两种情况,一种是非极性分子,另一种是极性分子。
用偶极矩表示极性分子的大小,定义为:μ=q·d极化分为电子极化、原子极化和转向极化,极化程度可用摩尔极化度P来表示。
在静电场或低频电场中,摩尔极化度为三者之和:摩尔极化度P=P e + P a + Pμ在高频电场中极化分子的转向运动和分子骨架变形跟不上电场频率的变化,P转向=0,P原子的值约只有P电子的5%-10%,可略去,所以P高频=P电子,则:P低频=P高频+P转向。
由波尔兹曼分布证明:P转向=4/3πN A(P2/3kT)=4/9πN A(P2/kT)其中,P为分子的永久偶极矩;k为玻尔兹曼常数;T为热力学温度。
2、低频与高频电场下摩尔极化度的测定在实验测定中,为避免气态下进行实验,常以非极性溶液为溶剂,在无限稀的溶液中,极性溶质的摩尔极化度P∞B表示P低频,溶液的介电场数ε、密度ρ与溶质摩尔分数X B关系可近似用直线方程表示。
实验报告内容:一实验目的二实验仪器三实验原理四实验步骤五、实验数据和数据处理六实验结果七.分析讨论八.思考题再考虑到溶液的加和性,可导得:式中,εA、ρA、M A、分别表示溶剂的介电常数、密度和摩尔质量;M B为溶质的摩尔质量;K1和K2分别是上面两式的ε对X B和ρ对X B所得直线斜率有关的常数。
在稀溶液中,n与X B之间成直线关系:n=n A(1+K3X B)由此可得:式中,R∞B为无限稀溶液中溶质的摩尔折射度;nA为溶剂的折射率;K3为与P低频=limP B直线斜率有关的常数。
偶极矩和介电常数的关系

偶极矩和介电常数的关系引言:偶极矩和介电常数是物理学中两个重要的概念,它们之间存在着密切的关系。
在本文中,我们将探讨偶极矩和介电常数的定义、性质以及它们之间的关系。
一、偶极矩的定义和性质:偶极矩是描述分子或物体极性的物理量。
它定义为正电荷和负电荷之间的电荷分布产生的电偶极矩。
偶极矩的大小和方向取决于电荷的大小和位置。
偶极矩的计算公式为:p = q * d其中,p表示偶极矩,q表示电荷的电量,d表示电荷之间的距离。
偶极矩具有以下性质:1. 偶极矩是矢量量,具有大小和方向。
2. 偶极矩的方向指向正电荷到负电荷的方向。
3. 偶极矩与电荷的距离成正比,与电荷的电量成正比。
二、介电常数的定义和性质:介电常数是描述物质对电场响应的物理量。
它定义为物质中电场强度和介电极化强度之间的比值。
介电常数是一个无量纲的常数,不同物质具有不同的介电常数。
介电常数的计算公式为:ε = ε0 * εr其中,ε表示介电常数,ε0表示真空中的介电常数,εr表示相对介电常数。
介电常数具有以下性质:1. 介电常数是一个无量纲的常数,用于描述物质对电场的响应能力。
2. 真空的介电常数ε0的数值为8.85 × 10^-12 C^2/N·m^2。
3. 相对介电常数εr是一个相对值,用于描述物质相对于真空的介电响应能力。
三、偶极矩与介电常数的关系:偶极矩和介电常数之间存在着密切的关系。
介电常数可以影响偶极矩的大小和方向。
1. 介电常数增大,偶极矩减小:当物质的介电常数增大时,物质对电场的响应能力增强,分子内部的电荷分布更加紧密。
因此,偶极矩的大小会减小。
2. 介电常数减小,偶极矩增大:相反地,当物质的介电常数减小时,物质对电场的响应能力减弱,分子内部的电荷分布更加松散。
因此,偶极矩的大小会增大。
3. 介电常数对偶极矩方向的影响:介电常数对偶极矩方向的影响比较复杂。
在某些情况下,介电常数的改变可能会导致偶极矩方向的改变;而在其他情况下,介电常数的改变可能不会影响偶极矩的方向。
偶极矩介电常数汇总

偶极矩介电常数汇总偶极矩是物质分子中两个相等但相反方向的电荷之间的距离乘以它们之间的电荷量,它是描述分子极性的重要物理量。
而介电常数则是描述电介质对电场的响应能力的量度,它是电介质中电场与电压之间关系的一个常数。
在分子中,偶极矩的计算可以通过两个方法得到:实验测量和理论计算。
实验测量中,可以通过测量分子在电场中的行为,例如分子的偏转角度或分子的旋转速度,来确定偶极矩的数值。
而理论计算方法则使用分子结构和分子电子态的信息来计算出偶极矩的数值。
以下是一些常见物质的偶极矩和介电常数的汇总:水(H2O):水是一种非常极性的分子,它具有比较大的偶极矩和介电常数。
其偶极矩是1.85 Debye(一种电荷分布的单位),介电常数在常温常压下是78.5乙醇(C2H6O):乙醇也是一种极性分子,但相较于水来说偶极矩和介电常数较小。
乙醇的偶极矩大约是1.69 Debye,介电常数在常温常压下是24.6二氧化碳(CO2):二氧化碳是一种非常非极性的分子,它的偶极矩很小,几乎为零。
因此,二氧化碳的介电常数也很小,大约是1.0左右。
苯(C6H6):苯是一种非常非极性的分子,由于其结构的特殊性,它没有永久性的偶极矩。
因此,苯的介电常数也很小,大约在2.3-2.7之间。
四氯化碳(CCl4):四氯化碳是一种非常非极性的分子,类似于二氧化碳,它的偶极矩几乎为零。
因此,其介电常数也很小,大约是2.2聚乙烯(CH2=CH2):聚乙烯是一种无极性的聚合物,因此它没有永久性的偶极矩。
其介电常数在常温常压下大约是2.2这只是一小部分物质的偶极矩和介电常数的汇总。
实际上,不同的物质具有不同的分子结构和电荷分布,因此它们的偶极矩和介电常数也会有所不同。
通过测量和计算可以获得更多物质的具体数值。
总之,偶极矩和介电常数是描述分子极性和电介质响应能力的重要物理量。
通过了解不同物质的偶极矩和介电常数,我们可以更好地理解它们在电场中的行为,并应用于各种实际应用中,如电子学、化学、生物学等。
偶极矩的测定实验报告

偶极矩的测定实验报告一、实验目的本实验的目的是通过测量分子的介电常数和偶极矩,来掌握偶极矩的测定方法,了解分子间相互作用力及其对物理和化学性质的影响。
二、实验原理1. 偶极矩偶极矩是描述分子极性的物理量,它是由电荷分布不均匀引起的。
在外电场作用下,带电粒子会发生位移,从而产生偶极矩。
偶极矩大小与分子内部原子之间距离、键长、键角以及原子电负性等因素有关。
2. 介电常数介电常数是描述介质中电场效应强弱程度的物理量。
当外电场作用于介质时,介质中存在着一个由分子团所组成的局部场。
这个局部场会使得外加电场在分子团周围产生扭曲,并且在空间上存在着一定程度上的非均匀性。
因此,在局部场内,外加电场与被扭曲后形成的局部场不完全重合,这就导致了一个相对位移。
这种相对位移所引起的感应电荷称为极化电荷,极化电荷的大小与外加电场强度成正比,与介质的介电常数成反比。
3. 测量偶极矩的方法测量偶极矩的方法有很多种,其中最常用的是测量分子在外电场中受到的力和扭矩。
根据库仑定律,带电粒子在外电场中受到的力与粒子所带电荷量和外加电场强度成正比。
而分子在外电场中所受到的扭矩则是由其偶极矩和外加电场强度决定。
通过测量分子所受到的力和扭矩,可以求出其偶极矩。
4. 测量介质的介电常数测量介质的介电常数通常采用平行板法或圆柱形法。
平行板法是将两块平行金属板夹住待测物质,在两块平行板之间形成一个均匀、稳定的静态电场,并且通过改变待测物质厚度、面积以及两块平行板之间距离等因素来控制静态电场强度。
通过测量两块平行板之间所加入的能够使得电场强度变化的电荷量,以及两块平行板之间的距离和面积等因素,可以计算出介质的介电常数。
三、实验步骤1. 实验装置:偶极矩测定装置、介质测定装置、数字万用表、计算机等。
2. 实验前准备:清洗实验器具,检查仪器是否正常工作。
3. 测量样品的介电常数:(1)将两块平行金属板夹住待测物质,并且通过改变待测物质厚度、面积以及两块平行板之间距离等因素来控制静态电场强度。
偶极矩,介电常数概要

溶液法测定极性分子的偶极矩一、实验目的了解电介质极化与分子极化的概念,以及偶极矩与分子极化性质的关系。
掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。
二、实验原理德拜(Peter Joseph William Debye )指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。
分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。
1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数)首先定义一个电介质的偶极矩(dipole moment )。
考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩p是一个矢量,其各个分量可以定义为 ∑∑∑===ii i z i i i y i ii x z q p y q p x q p 式中电荷i q 的坐标为),,(i i i z y x 。
偶极矩的SI 制单位是:m C ⋅。
将物质置于电场之中通常会产生两种效应:导电和极化。
导电是在一个相对较长的(与分子尺度相比)距离上输运带电粒子。
极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳定的、非刚性的带电粒子集合体中(比如一个中性的分子)。
一个物质的极化状态可以用矢量P 表示,称为极化强度(polarization )。
矢量P 的大小定义为电介质内的电偶极矩密度,也就是单位体积的平均电偶极矩,又称为电极化密度,或电极化矢量。
这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。
P的国际单位制度量单位是2-⋅m C 。
为P 取平均的单位体积当然很小,但一定包含有足够多的分子。
在一个微小的区域内,P 的值依赖于该区域内的电场强度E 。
在这里,有必要澄清一下物质内部的电场强度的概念。
在真空中任意一点的电场强度E的定义为:在该点放置一个电荷为dq 的无限微小的“试验电荷”,则该“试验电荷”所受到的力为dq E 。
实验13 分子介电常数和偶极矩的测定-操作步骤

实验13 分子介电常数和偶极矩的测定注意事项:1. 实验需要配制溶液摩尔分数以准确称量的数据计算得到,称量过程要迅速并且及时盖紧瓶塞以免溶液挥发。
2. 整个实验过程中每份溶液用完都要及时盖紧瓶塞以免溶液挥发。
3. 测电容时用滴管加入溶液,测量完后用注射器吸出溶液并用洗耳球或者电吹风吹干(避免用热风吹)。
加入待测样品至样品杯内的刻度线,每次加入的样品量必须严格相等。
4. 调节密度管内溶液刻度时要保证管内没有气泡,调节好刻度后迅速盖上磨口帽,此时管内若有气泡对测量没有影响。
5. 密度管称量时需擦干管外壁溶液并将密度管立于干净烧杯中进行称量。
实验步骤:1.打开小电容测量仪的开关,预热10分钟。
2.溶液的配制先将5个干洁的25mL 容量瓶分别称重得到w a 、w b 、w c 、w d 、w e ,然后依次加入20mL 环己烷再称重得到w a1、w b1、w c1、w d1、w e1,按照环己酮的摩尔分数分别约为0.01、0.02、0.03、0.06、0.09进行计算,再加入合适的环己酮,然后算出每个样品真实的摩尔分数。
环己酮极易挥发,所以实验中要随时关好瓶盖。
3.介电常数的测定(1)εS 的测定:以环己烷为标准物质,读取室温带入公式εS =2.023-0.0016(t /℃-20)计算出εS 。
(2)C air 和C d 的测定:先拔下鳄鱼夹再按一下“采零”键(实验中不用再校零),以清除仪表系统零位漂移,显示器显示“00.00”。
在电容池是干燥的条件下测定电容,三次取平均值即得到C air '。
用滴管吸取环己烷加到样品池中,测定电容三次取平均值即得到C S '。
代入公式 1S air s air -'-'=εC C C 和 1s S S air d -'-'=εεC C C 计算得出C air 和C d 。
(3)溶液电容C 样的测定把电容池及电极的溶液全部取出并用洗耳球吹干,重新测量C air ',同前面测得的C air '相差0.05PF 内就说明电容池干净了,用滴管加样,针管取样,依次加入不同浓度的溶液测定电容,两次取平均值即得到C X (注意测定不同浓度溶液的电容前,每次都要重复测C air '用来检查电容是否干净),代入公式C 样=C X -C d 即可求出C 样,代入公式ε样=C 样/C 0就可以得到各溶液的介电常数ε样。
常用溶剂的介电常数和偶极矩
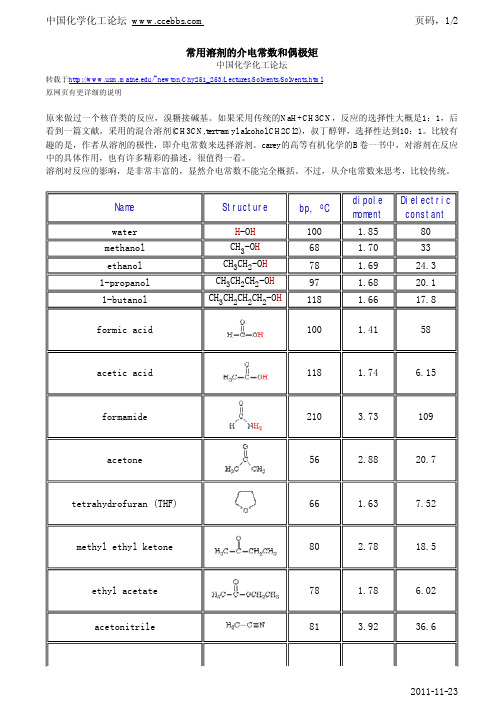
常用溶剂的介电常数和偶极矩中国化学化工论坛转载于/~newton/Chy251_253/Lectures/Solvents/Solvents.html 原网页有更详细的说明原来做过一个核苷类的反应,溴糖接碱基。
如果采用传统的NaH+CH3CN ,反应的选择性大概是1:1,后看到一篇文献,采用的混合溶剂(CH3CN,tert-amyl alcohol,CH2Cl2),叔丁醇钾,选择性达到10:1。
比较有趣的是,作者从溶剂的极性,即介电常数来选择溶剂。
carey 的高等有机化学的B 卷一书中,对溶剂在反应中的具体作用,也有许多精彩的描述,很值得一看。
溶剂对反应的影响,是非常丰富的,显然介电常数不能完全概括。
不过,从介电常数来思考,比较传统。
Name Structurebp, o C dipole moment Dielectric constant water H -O H 100 1.85 80 methanol CH 3-O H 68 1.70 33 ethanol CH 3CH 2-O H 78 1.69 24.3 1-propanol CH 3CH 2CH 2-O H 97 1.68 20.1 1-butanol CH 3CH 2CH 2CH 2-O H1181.6617.8formic acid661.63 7.52methyl ethyl ketone80 2.78 18.5ethyl acetate813.9236.62011-11-23N,N-dimethylformamide (DMF) 153 3.82 38.3 diemthyl sulfoxide (DMSO) 189 3.96 47.2 hexane CH3(CH2)4 CH369 ---- 2.02benzene。
偶极矩测定实验中介电常数的锁定测量法

准 最 精 确 , 设 备 复 杂 , 作 麻 烦 电桥 法 较 为 常 见 , 度 稍 低 , 操 作 上 也 有 一 定 难 度 但 操 精 且 因 此 , 们 设 计 了 一 种 采用 锁 定 测 量 介 电常 数 的 方 法 , 践 中取 得 了 良好 的效 果 。 由此 设 我 实 计 的仪 器 体 积 小 , 量 轻 , 量 精 确 , 作 更 为 简 便 。 重 测 操
图 2 前 置 电』 电流转 换 电 路 ,
c 2分 别 是 内外 极 板 的 对 地 分 布 电容 , 也
冀 一
无法 测量 。
包 括 测 量 回路 的 引 线 对 地 的 分 布 电 容 , 数 值 往往 大 与被 测 电容 C 。 因 此 , 采 用 对 双 端 E测 量 将 引 人 分 布 电 容 c 如 l 1和 c1影 响 而 12 电压 电 流 转 换 . 为 了消 除 分 布 电 容 影 响 , 锁 定 放 大 器 的 输 入 前 置 采 用 电压 电 流 转 在
的影 响 。
13 锁 定 相 位 放 大 .
除 了分 布 电 容 会 引 人 测 量 误 差 必 须 予 以 考 虑 以外 , 测 溶 液 漏 电 和 被
内 外 极 板 间 漏 电 影 响 必 须 被 排 除 。漏 电 影 响 可 以 等 效 为 一 个 并 联 在 被 测 电 容 上 的 电 阻 分 量 。 虽 然 等 效 为 电 阻 , 它 是 个 随 机 可
1 .测 量 原 理
1 1 电 容池
溶 液法 测 量 介 电 常 数 时 采用 电 容 池 测 量 . 测 量 用 电 容 池 如 图 1所 示 。 电 其
偶极矩,介电常数概要

溶液法测定极性分子的偶极矩一、实验目的了解电介质极化与分子极化的概念,以及偶极矩与分子极化性质的关系。
掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。
二、实验原理德拜(Peter Joseph William Debye )指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。
分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。
1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数)首先定义一个电介质的偶极矩(dipole moment )。
考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩p是一个矢量,其各个分量可以定义为 ∑∑∑===ii i z i i i y i ii x z q p y q p x q p 式中电荷i q 的坐标为),,(i i i z y x 。
偶极矩的SI 制单位是:m C ⋅。
将物质置于电场之中通常会产生两种效应:导电和极化。
导电是在一个相对较长的(与分子尺度相比)距离上输运带电粒子。
极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳定的、非刚性的带电粒子集合体中(比如一个中性的分子)。
一个物质的极化状态可以用矢量P 表示,称为极化强度(polarization )。
矢量P 的大小定义为电介质内的电偶极矩密度,也就是单位体积的平均电偶极矩,又称为电极化密度,或电极化矢量。
这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。
P 的国际单位制度量单位是2-⋅m C 。
为P 取平均的单位体积当然很小,但一定包含有足够多的分子。
在一个微小的区域内,P 的值依赖于该区域内的电场强度E 。
在这里,有必要澄清一下物质内部的电场强度的概念。
在真空中任意一点的电场强度E的定义为:在该点放置一个电荷为dq 的无限微小的“试验电荷”,则该“试验电荷”所受到的力为dq E 。
偶极矩的测定(精)

ε苯=2.283-0.00190(t-20)=2.28395
Cd=(ε标C空/- C标/)/(ε标-1) C溶液=C/溶液-Cd
12
C12 C0
C12 C空
C12
C
' 空
Cd
1.作d12—x2图,由直线斜率求值。
2.作n12—x2图,由直线斜率求值。
3.作12—x2图,由直线斜率求值。
4.由d1、1、、值,求算P2,∞。
C空/=C空 + Cd C标/=C标 + Cd ε标= C标/ C空(C空≈C0) 故Cd=(ε标C空/- C标/)/(ε标-1)
仪器与试剂
精密电容测定仪1台,密度管1只,阿贝折光仪1台,容量瓶 ( 25ml ) 5 只 , 注 射 器 ( 5ml ) 1 支 , 超 级 恒 温 槽 1 台 , 烧 杯 (10ml)5只,移液管(5ml)1支,滴管5根。
偶极矩的测定
目的要求
1.用溶液法测定CHCl3的偶极矩 2.了解介电常数法测定偶极矩的原理 3.掌握测定液体介电常数的实验技术
基本原理
1. 偶极矩与极化度
分子极性大小常用偶极矩来度量,其定义为:
qd
其中q是正负电荷中心所带的电荷,d为正、负电荷中心间距离,
为向量,其方向规定为从正到负。因分子中原子间距离的数量
W2 W1
W0 W0
dt ,H2O
以d12~X2作图,从直线斜率求得β。
4、介电常数的测定
(1)Cd的测定 测空气和苯的电容C/空和C/苯,由ε苯=2.283-0.00190(t-20)算出实
验温度时苯的介电常数ε标,代入公式Cd=(ε标C空/- C标/)/(ε标1)求得Cd。
(2)溶液电容的测定
偶极矩-介电常数

溶液法测定极性分子的偶极矩一、实验目的了解电介质极化与分子极化的槪念,以及偶极矩与分子极化性质的关系。
掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。
二、实验原理徳拜(Peter JoSePh William Debye)指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。
分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。
1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数)首先左义一个电介质的偶极矩Idipokmome心考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩0是一个矢量,其各个分量可以立义为P X = DiXi Py = Diyi PZ = DiZii i i式中电荷q,的坐标为(x i,y i,z i) o偶极矩的SI制单位是:C ∙ m o将物质置于电场之中通常会产生两种效应:导电和极化。
导电是在一个相对较长的(与分子尺度相比)距藹上输运带电粒子。
极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳左的、非刚性的带电粒子集合体中(比如一个中性的分子)。
一个物质的极化状态可以用矢量P表示,称为极化强度Jpolarization)。
矢量戸的大小泄义为电介质内的电偶极矩密度,也就是单位体枳的平均电偶极矩,又称为电极化密度, 或电极化矢量。
这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。
P的国际单位制度量单位是C ∙∕∕Γ2o为戶取平均的单位体积当然很小,但一定包含有足够多的分子。
在一个微小的区域内,P的值依赖于该区域内的电场强度E O在这里,有必要澄淸一下物质内部的电场强度的槪念。
在真空中任意一点的电场强度E的左义为:在该点放苣一个电荷为dq的无限微小的“试验电荷”,则该“试验电荷” 所受到的力为Edg。
电荷-偶极相互作用

电荷偶极相互作用:基本原理和性质
电荷偶极相互作用是指两个电荷之间的相互作用力,其中一个电荷被认为是偶极电荷,即由正负电荷组成的电荷系统。
这种相互作用力与两个电荷之间的距离和偶极电荷的取向有关。
电荷偶极相互作用的本质是电磁力。
根据库仑定律,两个点电荷之间的相互作用力与它们之间的距离成反平方关系,即F=k Q1Q2/r^2。
但是,当一个电荷系统被认为是偶极电荷时,它的相互作用力就不能简单地用库仑定律来描述。
在这种情况下,我们需要使用偶极子的电势和电场来描述相互作用力。
具体来说,一个偶极电荷可以看作是一个正电荷和一个负电荷的组合,并且这个组合的电场可以用一个电势来描述。
当另一个电荷处于这个电场中时,它会受到电场的作用力,这个作用力的大小取决于两个电荷之间的距离和偶极电荷的取向。
在电荷偶极相互作用中,有两个重要的参数,分别是电偶极矩和介电常数。
电偶极矩是描述偶极电荷强度的物理量,它等于偶极电荷系统中正负电荷的乘积。
介电常数是描述物质电导性和电容性的参数,它与电场强度和电位移有关。
电荷偶极相互作用在许多物理现象和实际应用中都起着重要作用。
例如,在电介质物理学中,电荷偶极相互作用是解释介电现象的基础。
在光学中,电荷偶极相互作用是解释光的散射和光学非线性效应的基础。
在纳米技术中,电荷偶极相互作用是实现纳米级操作和纳米级器件的重要物理机制之一。
总之,电荷偶极相互作用是一种基本的物理相互作用,它在许多物理现象和实际应用中都起着重要作用。
了解电荷偶极相互作用的原理和性质,对于深入理解物理现象和实际应用都具有重要意义。
偶极矩介电常数汇总

溶液法测定极性分子的偶极矩一、实验目的了解电介质极化与分子极化的概念,以及偶极矩与分子极化性质的关系。
掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。
二、实验原理德拜(Peter Joseph William Debye )指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。
分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。
1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数)首先定义一个电介质的偶极矩(dipole moment )。
考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩p 是一个矢量,其各个分量可以定义为∑∑∑===ii i z i i i y i ii x z q p y q p x q p 式中电荷i q 的坐标为),,(i i i z y x 。
偶极矩的SI 制单位是:m C ⋅。
将物质置于电场之中通常会产生两种效应:导电和极化。
导电是在一个相对较长的(与分子尺度相比)距离上输运带电粒子。
极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳定的、非刚性的带电粒子集合体中(比如一个中性的分子)。
一个物质的极化状态可以用矢量P 表示,称为极化强度(polarization )。
矢量P 的大小定义为电介质内的电偶极矩密度,也就是单位体积的平均电偶极矩,又称为电极化密度,或电极化矢量。
这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。
P 的国际单位制度量单位是2-⋅m C 。
为P 取平均的单位体积当然很小,但一定包含有足够多的分子。
在一个微小的区域内,P 的值依赖于该区域内的电场强度E 。
在这里,有必要澄清一下物质内部的电场强度的概念。
在真空中任意一点的电场强度E的定义为:在该点放置一个电荷为dq 的无限微小的“试验电荷”,则该“试验电荷”所受到的力为dq E 。
偶极矩和介电常数的测定

实验七偶极矩和介电常数的测定一、实验目的1.用电桥法测定极性物质(乙酸乙酯)在非极性溶剂(环已烷)中的介电常数和分子偶极矩。
2.了解溶液法测定偶极矩的原理,方法和计算,并了解偶极矩与分子电性质的关系。
二、实验原理1.偶极矩与极化度分子呈电中性,但由于空间构型的不同,正、负电荷中心可重合也可不重合,前者称为非极性分子,后者称为极性分子,分子极性大小常用偶极矩μ来度量,其定义为(1)式中q是正、负电荷中心所带的电荷量,d为正、负电荷中心间距离,为向量,其方向规定为从正到负,因为分子中原子间距离的数量级为10-10M,电荷数量级为10-20C,所以偶极矩的数量级为10-30C·M。
极性分子具有永久偶极矩,在没有外电场存在时,由于分子热运动,偶极矩指向各方向机会均等,故其偶极矩统计值为零。
若将极性分子置于均匀的外电场中,分子会沿着电场方向作定向转动,同时分子中的电子云对分子骨架发生相对移动,分子骨架也会形变,这叫分子极化,极化的程度可由摩尔极化度(p)来衡量。
因转向而极化称为摩尔转向极化度(p转向)。
由变形所致的为摩尔变形极化度(p变形)。
而p变形又是电子极化(p电子)和原子极化(p原子)之和。
显然:P=P转向+P变形=P转向+(P电子+P原子)(2)已知p转向与永久偶极矩μ的平方成正比,与绝对温度成反比。
即(3)式中K为玻尔滋曼常数;N为阿伏加德罗常数。
对于非极性分子,因μ=0,其p转向=0,所以p= p电子+ p原子。
外电场若是交变电场,则极性分子的极化与交变电场德频率有关。
当电场的频率小于1010S-1的低频电场下,极性分子产生摩尔极化度为转向极化度与变形极化度之和。
若在电场频率为1012 S-1~1014 S-1的中频电场下(红外光区),因为电场交变周期小于偶极矩的松弛时间,极性分子的转向运动跟不上电场变形,即极性分子无法沿电场方向定向,即p转向=0,此时分子的摩尔极化度p=p变形 =p电子+p原子。
偶极偶极相互作用大小

偶极偶极相互作用大小偶极偶极相互作用是指两个具有电荷分布不对称的分子之间由于电场引力而产生的相互作用力。
这种相互作用力通常非常微弱,但在一些特殊情况下,如分子之间的距离很近或者电荷分布极其不对称时,这种相互作用力会变得非常显著。
偶极矩是一个描述分子电荷分布不对称性的物理量,它是由两个相等但相对反方向的电荷分布组成的。
当分子处于一个电场中时,电场会使正负电荷分布发生位移,从而导致分子产生一个偶极矩。
偶极矩的大小与两个电荷的数量、电荷之间的距离以及电荷之间的角度有关。
偶极矩的大小可以通过以下公式计算:μ=q*d其中,μ表示偶极矩的大小,q表示电荷大小,d表示电荷之间的距离。
如果分子的电荷分布不对称性很大,那么偶极矩的大小也会很大。
当两个具有偶极矩的分子之间距离很近时,它们之间将会产生一个相互作用力,称为偶极偶极相互作用力。
这种相互作用力可以通过以下公式计算:F=(μ1*μ2)/(4πεr^3)其中,F表示相互作用力,μ1和μ2分别表示两个分子的偶极矩,ε表示真空介电常数,r表示两个分子之间的距离。
从以上公式可以看出,偶极偶极相互作用力与偶极矩的大小和两个分子之间的距离的立方成反比。
也就是说,偶极偶极相互作用力随着分子之间的距离增大而迅速减小。
这也解释了为什么通常情况下偶极偶极相互作用力非常微弱。
然而,当分子之间的距离非常近时,偶极偶极相互作用力会变得非常显著。
这种情况通常发生在气体或液体中,因为分子在这些相态下可以非常接近。
在这种情况下,偶极偶极相互作用力可以对分子之间的相互作用产生重要影响。
此外,偶极偶极相互作用力还可以通过分子之间的取向来调控。
当两个分子的偶极矩之间的角度为0度或180度时,偶极偶极相互作用力最大;当角度为90度时,偶极偶极相互作用力最小。
这种角度调控也是分子之间相互作用的一个重要因素。
总结起来,偶极偶极相互作用力是一种由于分子电荷分布不对称性产生的相互作用力。
它的大小与分子的偶极矩和分子之间的距离的立方成反比。
偶极偶极相互作用大小

偶极偶极相互作用大小偶极偶极相互作用是物理学中一个重要的概念,它描述了两个电荷之间由于电荷分布不均匀而产生的相互作用力。
在这篇文章中,我们将探讨偶极偶极相互作用的大小及其相关的内容。
偶极矩是描述电荷分布不均匀的物理量,它可以用来计算偶极偶极相互作用的大小。
一个偶极矩是由两个相等大小但方向相反的电荷构成的电偶极分子所产生的。
偶极矩的大小可以通过以下公式计算:p = qd其中,p表示偶极矩的大小,q表示电荷的大小,d表示电荷之间的距离。
当两个偶极矩相互作用时,它们之间的力可以通过以下公式计算:F = (1/4πε₀) * ((p₁·p₂)/r³) * (3cos²θ - 1)其中,F表示力的大小,ε₀表示真空中的介电常数,r表示两个偶极矩之间的距离,θ表示两个偶极矩之间的夹角。
从公式中可以看出,偶极偶极相互作用的大小与两个偶极矩的大小、距离以及夹角有关。
当两个偶极矩的大小越大,它们之间的相互作用力也越大。
当两个偶极矩之间的距离越近,相互作用力也越大。
而夹角的大小会影响力的方向,当夹角为0度或180度时,力的大小最大;当夹角为90度时,力的大小为0。
偶极偶极相互作用在许多物理现象中都起到关键的作用。
例如,在化学中,分子之间的相互作用力就可以通过偶极偶极相互作用来解释。
当分子中的正电荷与负电荷不均匀分布时,就会形成偶极矩,从而产生相互作用力。
这些相互作用力在分子间的吸引和排斥中起到重要的作用,影响着分子的性质和行为。
在物理学中,偶极偶极相互作用也被广泛应用于研究电磁辐射和介质的性质。
当一个偶极矩与电场相互作用时,会产生力矩,使得偶极矩发生旋转。
这种现象被称为偶极矩与电场之间的力矩作用。
这种作用在介质中的应用非常广泛,例如在液晶显示器中,就是利用了偶极偶极相互作用来控制液晶分子的排列方向,从而实现光的调节和显示。
偶极偶极相互作用是一种重要的物理现象,它描述了由于电荷分布不均匀而产生的相互作用力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液法测定极性分子的偶极矩一、实验目的了解电介质极化与分子极化的概念,以及偶极矩与分子极化性质的关系。
掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。
二、实验原理德拜(Peter Joseph William Debye )指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。
分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。
1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数)首先定义一个电介质的偶极矩(dipole moment )。
考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩p是一个矢量,其各个分量可以定义为 ii i z i i i y i ii x z q p y q p x q p 式中电荷i q 的坐标为),,(i i i z y x 。
偶极矩的SI 制单位是:m C 。
将物质置于电场之中通常会产生两种效应:导电和极化。
导电是在一个相对较长的(与分子尺度相比)距离上输运带电粒子。
极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳定的、非刚性的带电粒子集合体中(比如一个中性的分子)。
一个物质的极化状态可以用矢量P 表示,称为极化强度(polarization )。
矢量P 的大小定义为电介质内的电偶极矩密度,也就是单位体积的平均电偶极矩,又称为电极化密度,或电极化矢量。
这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。
P的国际单位制度量单位是2m C 。
为P 取平均的单位体积当然很小,但一定包含有足够多的分子。
在一个微小的区域内,P 的值依赖于该区域内的电场强度E 。
在这里,有必要澄清一下物质内部的电场强度的概念。
在真空中任意一点的电场强度E的定义为:在该点放置一个电荷为dq 的无限微小的“试验电荷”,则该“试验电荷”所受到的力为dq E 。
当将这个定义应用到物质内部时,在原子尺度上会引起巨大的电场涨落。
为此,物质内部某一点的宏观电场强度E 定义为在该点邻近的小区域内原子尺度电场强度的平均值,这个小区域当然比通常标准要小得多,但仍足以容纳足够多的分子。
在电磁学中,电介质响应外加电场而极化的程度可以用电极化率 (electric susceptibility )来度量,在各向同性、线性和均匀的电介质中,电极化率 的定义为E P 0 (18-1)式中11201085418782.8 m F ,为真空电容率(vacuum permittivity ),或真空介电常数(vacuum dielectric constant )。
可以用电位移矢量D 来表示电场E 如何影响电介质中电荷的重排(包括电荷迁移和电偶极转向等),D 矢量的定义为P E D 0 (18-2)由此得到电位移矢量D 正比于电场强度EE E D )1(0 (18-3)式中 为电介质的绝对电容率(absolute permittivity ),也称为介电常数(dielectric constant )。
定义相对电容率(relative permittivity )rr 也称为相对介电常数(relative dielectric constant )。
据此得到电极化率与相对电容率的关系为E D r r 01(18-4)在真空中,电极化率0 。
由此可见,电容率和介电常数其实是一个概念。
介电常数是在介质内部形成电场时遇到的阻碍程度的度量,也就是说,介电常数度量了外电场与电介质之间的相互影响。
介电常数越大,电介质中单位电荷产生的电场(或电流)也越大,在电介质内部的电场强度会有可观的下降。
此外,我们常用r 来表征电介质或绝缘材料的电性能,即在同一电容器中用介电常数随分子偶极矩和可极化性的增大而增大。
在化学中,介电常数是溶剂的一个重要性质,它表征溶剂对溶质分子溶剂化以及隔开离子的能力。
介电常数大的溶剂,有较大隔开离子的能力,同时也具有较强的溶剂化能力。
介电常数经常出现在许多与电介质有关的物理学公式中,如前面的电极化强度矢量P和电位移矢量D 等。
另外,电磁波在介质中传播的相速度为rr r r c n c v 0011 式中c 、n 、 、r 、0 分别是真空中的光速、介质的折射率、磁导率、相对磁导率和真空磁导率,真空电容率1200)( c 。
在相对磁导率1 r 时,折射率r n 。
对于各向异性介质(如某些晶体),P 与E 的方向不同,但它们的各分量间仍有线性关系,介电常数要用张量表示。
对于一些特殊的电介质(如铁电体),或者在电场很大(如激光)的条件下,P 与E 将呈现非线性关系,介电常数的表示式也是非常复杂的。
2、外电场在电介质中引起的变化从前面的讨论中可知,极化强度与偶极矩有关,而极化强度又可以通过测量介电常数获得,因此原则上可以通过介电常数的测定获得分子偶极矩的信息。
但是,介电常数除了由电介质本身的性质决定外,一般还与介质的温度及电磁场变化的频率有关。
在电磁波的频率很高进入光波范围时,介电常数也会随着频率的变化而变化,即出现色散现象。
一般来说,介质无法即时对外加电场作出响应,因此有关电极化强度的表达式应写作t dt t E t t t P ')'()'()(0 即电极化强度是电场与电极化率的卷积(convolution )。
电极化率 表征当电场E 在时间't 作用在某个物理系统后,电极化强度P 在时间t 的反应。
根据因果关系,P 不可能在E 作用前产生反应,因此当0 t 时,0)( t ,积分上限可至 。
这个因果关系的存在说明)(t 的傅立叶变换)( 在复平面的上半部分是可解析的,即所谓的克拉莫–克若尼关系式(Kramers –Kronig relations ),因此可以将电极化率更方便地写作为傅立叶变换的形式)()()(0 E P显然,电极化率的频率依赖关系导致介电常数的频率依赖关系,而电极化率对频率的关系表征了物质的色散特性。
由于物质具有质量,物质的电极化响应无法瞬时跟上外电场。
响应总是必须合乎因果关系,这可以用相位差来表达。
因此,电容率时常以复函数来表达(复数允许同步的设定大小值和相位),而这复函数的参数为外电场频率)(ˆ:。
这样,电容率的关系式为 t i t i e E e D0'0)(ˆ 式中00E D 、分别表示电位移矢量D 、电场强度E 的振幅。
一个电介质对于静电场的响应可以用电容率的低频极限来描述,也称为“静电容率”s ,即)(ˆlim 0s 在高频率极限,复电容率一般标记为 ,当频率等于或超过等离子体频率(plasma frequency) 时,电介质的物理行为近似理想金属,可以用自由电子模型来计算。
对于低频率交流电场,静电容率是个很好的近似;随着频率的增高,可测量到的相位差 开始出现在D 和E 之间,出现的频率与温度和介质种类有关。
在电场强度0E 中等大小时,D 和E 成正比i i e e E D 00ˆ 由于介质对于交流电场的响应特征是复电容率,为了更详细的分析其物理性质,很自然地,必须分离其实数和虚值部份,通常写为)sin (cos )('')(')(ˆ00 i E D i 式中虚值部份'' 关系到能量的耗散,而实值部份' 则关系到能量的储存。
图18.1 几种电极化机制:取向极化、离子极化、电子极化通常,电介质对于电磁能量有几种不同的吸收机制。
受到这几种吸收机制的影响,随着频率的改变,电容率函数也会有所改变:(1)弛豫 (relaxation ) 效应发生于永久偶极分子和感应偶极分子。
当频率较低的时候,电场的变化很慢。
这允许偶极子足够的时间,对于任意时候的电场,都能够达成平衡状态。
假若因为介质的黏滞性,偶极子无法跟上频率较高的电场,电场能量就会被吸收,由而导致能量耗散。
偶极子的这种弛豫机制称为电介质弛豫 (dielectric relaxation ) 。
理想偶极子的弛豫机制可以用经典的德拜弛豫 (Debye relaxation ) 来描述。
(2)共振效应是由原子、离子、电子等等的旋转或振动产生的。
在它们特征吸收频率的附近,可以观察到这些过程。
上述两种效应时常会合并起来,使得电容器产生非线性效应。
从量子力学的观点看,电容率可以用发生于原子层次和分子层次的量子作用来解释:在较低频率区域,极性介电质的分子会被外电场电极化,因而诱发出周期性转动。
例如,在微波频率区域,微波场促使物质内的水分子做周期性转动。
水分子与周边分子的相互碰撞产生了热能,使得含水分物质的温度增高。
这就是为什么微波炉可以很有效率的将含有水分的物质加热。
水的电容率的虚值部分(吸收指数)有两个最大值,一个位于微波频率区域,另一个位于远紫外线 (UV ) 频率区域,这两个共振频率都高于微波炉的操作频率。
中间频率区域高过促使转动的频率区域,又远低于能够直接影响电子运动的频率区域,能量是以共振的分子振动形式被吸收。
对于水介质,这是吸收指数开始显著地下降的区域,吸收指数的最低值是在蓝光频率区域(可见光谱段),这就是为什么日光不会伤害像眼睛一类的含水生物组织的原因。
在高频率区域(像远紫外线频率或更高频率),分子无法弛豫。
这时,能量完全地被原子吸收,因而激发电子,使电子跃迁至更高能级,甚至游离出原子。
拥有这频率的电磁波会导致电离辐射。
3、分子偶极矩的测量原理前面讨论的都是电介质的宏观参数和特性,如何将这些宏观物理量与物质的微观性质联系起来,进而获得这些微观物理量,是需要考虑的问题。
分子结构可以被看成是由电子和分子骨架所构成。
由于其空间构型各异,其正负电荷中心可以重合,也可以不重合,前者称为非极性分子,后者称为极性分子,分子的极性可用偶极矩来表示。
两个大小相等符号相反的电荷系统的电偶极矩的定义为r q式中r是两个电荷中心间距矢量,方向是从正电荷指向负电荷;q 为电荷量。
一个电子的电荷为 ...10803046581.41060217733.11019u s e C e而分子中原子核间距的数量级为cm m A 81010101,由此计算出的偶极矩数值为 m C Debyecm u s e 29181060217733.1803046581.4...10803046581.4偶极矩的静电制单位是德拜(Debye ,符号D ),m C cm u s e D 301810333572221.3...1011。
由于分子中电荷分离的数值小于一个电子电荷,因此分子的偶极矩的数量级为m C 3010。
电介质分子处于电场中,电场会使非极性分子的正负电荷中心发生相对位移而变得不重合,也会使极性分子的正负电荷中心间距增大,这些作用都导致分子产生附加的偶极矩,称为诱导偶极矩,这种现象称为分子的变形极化。
