化学平衡状态的建立
化学平衡(第1课时)教学设计 化学平衡优秀教学设计

化学平衡(第1课时)教学设计化学平衡优秀教学设计第三节化学平衡(第1课时)化学平衡贯穿高中必修与选修内容,主要体现在必修二“化学反应与能量”和选修四“化学反应速率与化学平衡”、“水溶液中的离子平衡”等主题中,承前而又启后,是学生认识化学、学习化学过程中不可缺少的一部分。
但是从化学平衡中抽象出的化学平衡模型往往是学生的认知难点,因此化学平衡这一节不仅是中学化学教学的重点也是难点。
一、单元课程理念分析本单元主题为“化学反应速率与化学平衡”,从化学反应速率入手,延伸到影响化学反应速率的影响因素,最后过渡到化学平衡。
化学反应速率与化学平衡不仅是高中化学学习的重点与难点,同时它也遍布在我们的日常生活中、工业生产中,在这一单元的学习中,教师应该注重引导学生进行实验探究,并进行归纳总结。
从课程基本理念来看,通过本单元的学习,教师应该引导学生进一步学习化学的基本原理与基本方法,形成科学的世界观;要从学生的已有经验和将要经历的社会生活实际出发,包括生活经验以及前面已经学习过的化学知识,帮助学生认识化学与人类生活的密切关系,关注人类面临的化学相关的社会问题,培养学生的责任感、参与意识和决策能力。
贯彻落实以化学实验为主的课程理念,使学生体验科学究过程,激发学生学习化学的兴趣,强化科学探究意识,促进学习方式的转变,培养学生的创新精神和实践能力。
同时,教师应该用更加多元化的评价方式对学生进行评价,学生也应该主动的进行自我评价。
二、内容标准分析在义务教育的化学学习过程中,已经学习过饱和溶液以及溶解度的概念,这对于学生理解蔗糖的溶解、结晶平衡很有帮助。
在必修二“化学反应与能量”的学习过程中,学生学习了化学反应速率的概念以及浅显的化学反应限度问题,并学习了催化剂温度对化学反应速率的影响,以及炼铁高炉尾气中存在的化学反应的限度问题。
但是前面学习的这些内容仅是学习化学平衡章节的铺垫内容,虽然有部分交叉,但却是螺旋式上升的知识结构,在内容标准的要求上也有很大不同,但是也有着紧密的联系。
化学平衡常数

[ H 2 ][ CO 2 ] x2 K = = 2 = 9 [ CO ][ H 2 O ] ( 0 . 02 - x ) x = ±3, x = 0 .015 ( mol dm - 3 ) 0 .02 - x
所以CO此时的转化率为: 此时的转化率为: 已转化掉的 [CO]为0.015mol ·dm-3,所以 为 此时的转化率为
化学平衡常数
(Equilibrium constant) )
一、化学平衡状态 (chemical equilibrium state ) 平衡状态
H 2 (g) + I 2 (g) 2HI(g)
化学平衡状态的建立
化学平衡状态的移动
旧的平衡破坏了,又会建立起新的平衡 旧的平衡破坏了,又会建立起新的平衡.
【例2】填写下表中所缺数据,并从中找出规律: 】填写下表中所缺数据,并从中找出规律: CO2 ( g ) + H2 ( g ) 1473K CO ( g ) + H2O ( g ) [CO][ H 2O] 平衡浓度 / mol·dm-3 [CO 2][ H 2] 起始浓度 / mol·dm-3
(1 ) (2 ) (3 ) (4 ) CO2 H2 CO H2 0.01 0.01 0 0 0.01 0.02 0 0 0.01 0.01 0.001 0 0 0 0.02 0.02 CO2 0.004 H2 0.004 CO 0.0078 0.0041 0.0041 0.0118 0.0118 H 2O 0.006 0.0078 0.0059 0.0118 H 2O 0.0078
Kθ 是无量纲的量; 是无量纲的量; Kθ 是温度的函数,与浓度、分压无关; 是温度的函数,与浓度、分压无关; 标准平衡常数表达式必须与化学反应计量式相对应; 标准平衡常数表达式必须与化学反应计量式相对应; pθ是标态压力,p是各气体的分压; 是标态压力, 是各气体的分压 是各气体的分压; Cθ是标态浓度,C是溶液中各物质浓度; 是标态浓度, 是溶液中各物质浓度 是溶液中各物质浓度; 纯物质(包括纯固体或纯液体)不写在平衡常数表达式中! 纯物质(包括纯固体或纯液体)不写在平衡常数表达式中!
化学平衡
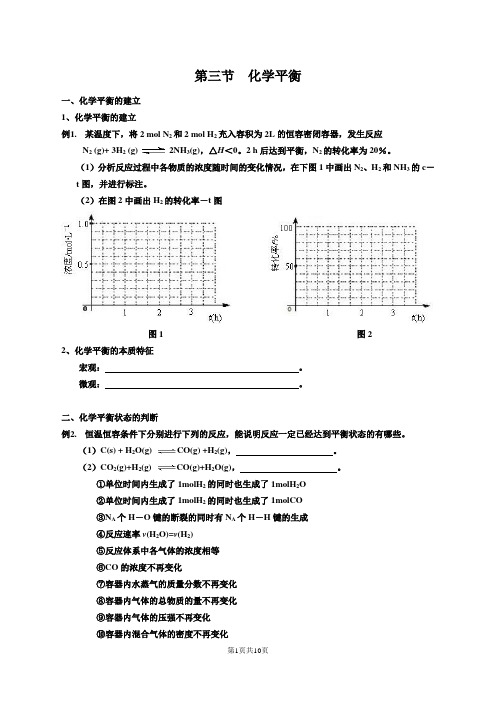
第三节化学平衡一、化学平衡的建立1、化学平衡的建立例1.某温度下,将2 mol N2和2 mol H2充入容积为2L的恒容密闭容器,发生反应(g)+ 3H2 (g) 2NH3(g),△H<0。
2 h后达到平衡,N2的转化率为20%。
N(1)分析反应过程中各物质的浓度随时间的变化情况,在下图1中画出N2、H2和NH3的c-t图,并进行标注。
(2)在图2中画出H2的转化率-t图图1 图22、化学平衡的本质特征宏观:。
微观:。
二、化学平衡状态的判断例2.恒温恒容条件下分别进行下列的反应,能说明反应一定已经达到平衡状态的有哪些。
(1)C(s) + H2O(g) CO(g) +H2(g),。
(2)CO2(g)+H2(g) CO(g)+H2O(g),。
①单位时间内生成了1molH2的同时也生成了1molH2O②单位时间内生成了1molH2的同时也生成了1molCO③N A个H-O键的断裂的同时有N A个H-H键的生成④反应速率v(H2O)=v(H2)⑤反应体系中各气体的浓度相等⑥CO的浓度不再变化⑦容器内水蒸气的质量分数不再变化⑧容器内气体的总物质的量不再变化⑨容器内气体的压强不再变化⑩容器内混合气体的密度不再变化例3.一定温度下,可逆反应2NO22NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是①单位时间内生成n molO2同时生成2n molNO2②单位时间内生成n molO2同时生成2n molNO③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1④混合气体的压强不再改变⑤混合气体的颜色不再改变⑥混合气体的密度不再改变⑦混合气体中NO2、NO、O2的物质的量浓度相等例4.在一定温度下的某容积不变的密闭容器中,进行下列化学反应:N2(g)+3H2(g)2NH3(g),不.能.确定上述可逆反应在一定条件下已达到化学平衡状态的是A.1 mol N≡N键断裂的同时断裂6 mol N—H键B.2v正(H2)=3v逆(NH3)C.消耗3n mol H2的同时生成2n mol NH3D.体系的压强不再发生变化三、化学平衡的移动1、浓度增大反应物浓度或减小生成物浓度,平衡向反应方向移动;减小反应物浓度或增大生成物浓度,平衡向反应方向移动。
2024届高考一轮复习化学教案(通用版):化学平衡状态 化学平衡移动

第23讲化学平衡状态化学平衡移动复习目标1.了解化学反应的可逆性及化学平衡的建立;2.掌握化学平衡的特征;3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律;4.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
考点一可逆反应与化学平衡状态的建立必备知识整理1.可逆反应(1)定义在__________既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点双向性指可逆反应分为方向相反的两个反应:正反应和逆反应双同性指正、逆反应是在________下,同时进行共存性指反应物的转化率________100%,________与________共存2.化学平衡状态(1)概念一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率________,反应物和生成物的浓度均保持不变,我们称为“化学平衡状态”,简称化学平衡。
2NH3”为例。
(2)建立:以“N2+3H2高温、高压催化剂①正反应开始进行的ct图如图(a)②逆反应开始进行的ct图如图(b)③反应过程中v正、v逆变化(3)平衡特点[正误判断](1)反应NH 4Cl=====△HCl ↑+NH 3↑、NH 3+HCl===NH 4Cl 互为可逆反应( ) (2)可逆反应到达平衡前的v 正一定大于v 逆( ) (3)可逆反应到达平衡时,各组分的浓度相等( )(4)在1 L 的密闭容器中发生反应:2NO(g)+O 2(g)⇌2NO 2(g),当容器中气体的颜色保持不变时,说明反应已达到平衡状态( )(5)对于反应H 2(g)+I 2(g)⇌2HI(g),当压强不变时,反应达到平衡状态( )(6)对于C(s)+H 2O(g) ⇌CO(g)+H 2(g)反应,当C(s)的质量不变时,化学反应达到平衡状态( )对点题组训练题组一 化学平衡状态的判定1.一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl 2(g)⇌2HCl(g)+I 2(s)。
2022化学第7章化学反应速率和化学平衡第2节化学平衡状态和平衡移动教案

第二节化学平衡状态和平衡移动考纲定位要点网络1。
了解化学反应的可逆性及化学平衡的建立。
2。
掌握化学平衡的特征.3.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。
4。
了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
可逆反应与化学平衡状态知识梳理1.可逆反应[辨易错](1)2H2+O22H2O为可逆反应。
()(2)Pb+PbO2+2H2SO42PbSO4+2H2O为可逆反应.()(3)2 mol SO2和2 mol O2在一定条件下的密闭容器中发生2SO2(g)+O2(g)2SO3(g),平衡时的O2物质的物质的量为1 mol。
()[答案](1)×(2)×(3)×2.化学平衡状态(1)概念一定条件下可逆反应进行到一定程度时,反应物和生成物的浓度不再随时间的延长而发生变化,正反应速率与逆反应速率相等,这种状态称为化学平衡状态。
(2)建立在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。
反应过程如下:以上过程可用如图表示:;若开始加入生成物,从逆反应建立平衡,则v -t图为.因此,化学平衡状态的建立可以从正反应建立,也可以从逆反应方向建立,也可以从正、逆两反应方向同时建立,即平衡建立与反应途径无关。
(3)特征注意:化学平衡状态的两种标志[辨易错](1)可逆反应达到平衡时,各组分浓度不变,反应停止。
()(2)从正反应建立平衡的过程中,平衡前v正大于v逆.()(3)对于N2(g)+3H2(g)2NH3(g)反应,当v正(N2)=v逆(NH3)时反应达到平衡状态。
()(4)在相同温度下,相同容器(恒容)发生2SO2(g)+O2(g)2SO3(g)反应,当分别向容器中充入2 mol SO2、1 mol O2与2 mol SO3平衡时,c(SO2)相同。
()(5)一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度。
高二化学《化学平衡状态的建立》知识点归纳以及典例解析

化学平衡状态【学习目标】1、了解化学平衡建立的过程,明白化学平衡常数的含义;2、理解化学平衡常数的含义,能利用化学平衡常数计算反应物的转化率、【要点梳理】要点一、化学平衡状态1、溶解平衡的建立。
在一定温度下,当把蔗糖晶体溶解于水时,一方面蔗糖分子不断离开蔗糖表面扩散到水中;另一方面,溶解在水中的蔗糖分子不断地在未溶解的蔗糖表面聚集成晶体,当这两个相反过程的速率相等时,蔗糖的溶解达到最大限度,即形成了饱和溶液,此时,我们说蔗糖达到了溶解平衡。
在溶解平衡状态下,溶解和结晶的过程并没有停止,只是速率相等罢了,故溶解平衡是一种动态平衡。
2、可逆反应、(1)定义:在同一条件下,既能向正反应方向进行同时又能向逆反应方向进行的反应叫做可逆反应,用“"表示、要点诠释:①在可逆反应中,把由反应物到生成物的反应叫正反应:把由生成物到反应物的反应叫逆反应、②在同一条件下,不能同时向两个方向进行的反应叫不可逆反应、不可逆反应是相对的,可逆反应是绝对的。
在一定条件下,几乎所有的反应均能够看做是可逆反应、③必须是“同一条件”。
在不同条件下能向两个方向进行的反应,不能称作可逆反应。
④同一化学反应在不同条件下估计为可逆反应或不可逆反应。
如敞口容器中,CaCO3(s)CaO(s)+CO2↑,反应产生的气体可及时脱离反应体系,反应不可逆;密闭容器中,CaCO3(s)CaO (s)+CO2,反应产生的气体不写“↑",气体物质不能从反应体系中逸出,与各反应物共存,反应可逆。
又如2H2+O22H2O。
(2)重要的可逆反应:如盐的水解、酯的水解、2SO2+O22SO3、N2+3H22NH3等、3、化学平衡的建立。
关于可逆反应aA (g)+bB(g)c C (g)+d D(g),若开始加入反应物,此时A和B的浓度最大,因而反应速率最大,由于C、D浓度为零,故此时逆反应速率为零,随着反应的进行,反应物浓度不断减少,生成物浓度不断增加,v正不断减小,v逆不断增大。
化学平衡状态及化学平衡常数(2篇)

化学平衡状态及化学平衡常数(2篇)一、引言化学平衡是化学中的一个重要概念,它描述了在一定条件下,化学反应达到的一种动态平衡状态。
在这种状态下,反应的正逆速率相等,反应物和生成物的浓度不再随时间变化。
理解化学平衡状态对于掌握化学反应的规律、预测反应结果以及在实际应用中优化反应条件具有重要意义。
二、化学平衡的定义化学平衡是指在一定条件下,可逆反应的正反应速率和逆反应速率相等,反应物和生成物的浓度保持恒定的状态。
需要注意的是,化学平衡是一种动态平衡,而不是静态平衡。
虽然宏观上反应物和生成物的浓度不再变化,但微观上正逆反应仍在进行,只是速率相等。
三、化学平衡的特征1. 动态平衡:在化学平衡状态下,正逆反应仍在进行,只是速率相等,导致宏观上浓度不变。
2. 可逆性:化学平衡只存在于可逆反应中,不可逆反应不会达到平衡状态。
3. 浓度恒定:在平衡状态下,各反应物和生成物的浓度保持恒定。
4. 温度依赖性:化学平衡状态受温度影响,改变温度会导致平衡位置的移动。
5. 压力和浓度依赖性:对于气体反应,压力的变化会影响平衡状态;对于溶液反应,浓度的变化也会影响平衡。
四、化学平衡的建立化学平衡的建立过程可以分为以下几个步骤:1. 反应开始:反应物开始反应,生成物浓度逐渐增加。
2. 速率变化:随着反应的进行,反应物浓度逐渐减少,生成物浓度逐渐增加,正反应速率逐渐减小,逆反应速率逐渐增加。
3. 达到平衡:当正逆反应速率相等时,反应达到平衡状态,各物质浓度不再变化。
五、化学平衡的移动化学平衡的移动是指在外界条件改变时,平衡位置发生改变的现象。
影响化学平衡移动的主要因素有:1. 温度变化:根据勒夏特列原理,升高温度会使平衡向吸热方向移动,降低温度会使平衡向放热方向移动。
2. 压力变化:对于气体反应,增加压力会使平衡向体积减小的方向移动,减小压力会使平衡向体积增大的方向移动。
3. 浓度变化:改变反应物或生成物的浓度,会使平衡向减少该物质浓度的方向移动。
2022-2023学年高一化学 苏教版教案:化学反应的限度 化学平衡状态

第3课时 化学反应的限度 化学平衡状态课程标准课标解读1.通过实验认识化学反应的限度、可逆反应和化学平衡的含义。
2.了解化学平衡的建立和特征,掌握化学平衡状态的判断方法。
3.了解化学平衡在生产和科学研究中的作用。
1.了解可逆反应的含义,知道可逆反应在一定条件下能达到化学平衡状态。
(宏观辨识与微观探析)2.能用一定的理论模型理解正、逆反应速率相等指反应达到化学平衡状态,通过分析推理认识化学平衡的特征。
(证据推理与模型认知)3.对于可逆反应,理解正、逆反应速率相等和组分含量一定是判断化学反应的平衡状态的依据,会根据压强、密度、相对分子质量等间接因素判断化学反应的平衡状态。
(变化观念与平衡思想)知识点01 可逆反应和化学反应的限度1.可逆反应(1)概念:在同一条件下,既能向正反应方向又能向逆反应方向进行的化学反应。
(2)特征:在一定条件下,可逆反应有以下特征: ①正反应和逆反应同时进行。
②反应物和生成物同时存在。
③反应没有完全进行到底。
(3)表示:在可逆反应的化学方程式中,用“”号代替“===”号。
2.化学反应的限度根据可逆反应的特征,可知可逆反应有一定的限度。
(1)说明Cl 2和H 2O 的反应是可逆反应的证据是:氯水既含有Cl 2、H 2O 、HClO 分子,也含有H +、Cl -、ClO -等离子。
化学方程式为Cl 2+H 2OHCl+HClO 。
目标导航知识精讲(2)化学反应限度的实验探究少量FeCl3溶液和过量KI溶液反应,从反应后的溶液中分离出I2的实验操作是向反应后的溶液中加入苯,振荡、静置,实验现象是溶液分为两层,上层为紫红色。
检验反应后的溶液中仍然存在Fe3+的操作和现象是取下层液体,滴加KSCN溶液,溶液变为红色。
【即学即练1】下列关于可逆反应的说法正确的是()A.正反应和逆反应在相同条件下同时进行B.氯化铵分解和氨气与氯化氢反应生成氯化铵属于可逆反应C.可逆反应达到一定限度后,反应就停止了D.同一可逆反应的正反应进行的程度一定大于逆反应的进行程度答案:A解析:正逆反应是在相同条件下同时进行的,A正确;氯化铵分解和氨气与氯化氢反应生成氯化铵是在不同条件下进行的,不是可逆反应,B错误;可逆反应达到一定限度后,反应没有停止,正反应速率和逆反应速率相等,C错误;同一可逆反应中,正反应进行的程度与逆反应进行的程度与反应物的性质有关,有的可逆反应正反应进行的程度大,有的可逆反应逆反应进行的程度大,D错误。
化学平衡理解化学反应的平衡状态

化学平衡理解化学反应的平衡状态化学平衡是指在封闭容器中,化学反应的反应物和生成物浓度保持在一个相对稳定的状态。
在这个状态下,反应物的转化速率与其逆反应的转化速率相等,即正反应和逆反应达到动态平衡。
理解化学平衡对于深入研究化学反应以及应用化学反应具有重要意义。
本文将深入探讨化学平衡的基本概念、化学平衡条件以及实现化学平衡的方法。
一、化学平衡的基本概念化学反应是物质之间发生的转化过程,如A与B反应生成C和D。
在反应初期,反应物A和B的浓度迅速下降,生成物C和D的浓度迅速增加,反应速率快。
随着反应进行,反应物和生成物的浓度逐渐接近一定数值。
当反应继续进行到一定时间后,反应物和生成物的浓度变化不再明显,达到化学平衡状态。
此时,正反应和逆反应同时进行,速率相等,并且化学反应的反应物和生成物浓度保持相对稳定。
二、化学平衡的条件要实现化学平衡,需要满足以下条件:1.封闭系统:化学反应必须在封闭容器中进行,防止反应物和生成物逸出或外界物质进入,从而保持反应物和生成物的浓度稳定。
2.恒温条件:化学反应过程中的温度保持不变,使得反应速率基本稳定。
3.反应物浓度:反应物的浓度是影响反应速率的重要因素。
为实现化学平衡,反应物浓度要满足一定比例关系。
根据Le Chatelier原理,浓度升高将推动逆向反应,浓度降低则推动正向反应。
4.反应物粒子与活化能:反应物粒子间的碰撞与活化能是决定化学反应速率的关键因素。
只有当反应物粒子碰撞能够克服活化能时,才可能发生有效碰撞并进一步转化为生成物。
三、实现化学平衡的方法为了实现化学反应的平衡状态,人们可以采取一些措施。
主要的方法有:1.改变反应物浓度:增加或减少反应物浓度,可以改变正反应和逆反应的速率,从而实现平衡。
2.改变温度:改变反应过程中的温度会对反应速率产生影响。
通过调节温度,可以改变化学反应平衡位置。
3.改变压力或浓度:对于气体反应而言,改变压力或浓度对于平衡位置的调节也非常有效。
化学平衡状态 以及判定

混合 ①各物质的物质的量或物质的质量分 物体 数一定 系中 ②各物质的质量或质量分数一定 各成 ③各气体的体积或体积分数一定 分的 含量 ④总体积、总压强、总物质的量一定
化学 反应 正、 逆反 应速 率之 间的 关系
mA(g)+nB(g) pC(g)+qD(g) ①在单位时间内消耗了m mol A,同时 也生成了m mol A ②在单位时间内消耗了n mol B,同时也 消耗了p mol C ③v(A)∶v(B)∶v(C)∶v(D)= m∶n∶p∶q ④在单位时间内生成了n mol B,同时也 消耗了q mol D
本 课 时 栏 目 开 关
解析
若 n=p+q, 压强不变时, 不能说明反应已达到平衡;
m气 根据 ρ= V ,随着反应的进行,m(气)变而 V 不变,故 ρ 是变量,当 ρ 不变时,反应已达到平衡。
自我· 检测区
3. 恒温恒容条件下, 发生化学反应 H2(g)+I2(g) 下列选项中不能作为达到平衡的标志的是 A.混合气体颜色不再变化
双基为本,基稳才能楼高
?
一
理清两个概念
1.可逆反应
2.化学平衡状态 一定条件下的可逆反应,当反应进行到一定程度时,正反 应速率和逆反应速率 相等,反应物的浓度和生成物的浓度不变 的状态,称为“化学平衡状态”,简称化学平衡。
掌握化学平衡状态的建立、 二 特点和判定标准
1.化学平衡的建立 (1)建立过程 在一定条件下, 把某一可逆反应的反应物加入固定容积的密 闭容器中。反应过程如下:
(4)对于 NO2(g)+SO2(g) SO3(g)+NO(g)反应,当每消耗 1 mol SO3 的同时生成 1 mol NO2 时,说明反应达到平衡状态 (5)化学平衡状态指的是反应静止了,不再发生反应了 (×) ( ×)
化学平衡教学设计

《化学平衡》教学设计第1课时化学平衡状态●课标要求描述化学平衡建立的过程。
●课标解读1.了解化学平衡过程的建立。
2.掌握可逆反应达化学平衡的标志。
●教学重难点重点:了解可逆反应,掌握化学平衡的概念及其特点。
难点:掌握化学平衡的概念及其特点。
●教学地位化学平衡状态的建立与判断,这部分知识是其他课时的基础,是解释一些平衡现象的基础。
鉴于学生的基础较差,本部分知识较难理解,所以在学习时将速度放慢一些。
●新课导入建议炼铁高炉尾气之谜高炉炼铁的主要反应是:2C(焦炭)+O2(空气)===2CO(放出热量),Fe2O3+3CO△,2Fe+3CO2。
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没有利用的CO气体,开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变,这是什么原因呢?【提示】Fe2O3+3CO△,2Fe+3CO2是一个可逆反应,在此条件下已达到该反应的最大限度,即达到化学平衡状态了。
●教学流程设计课前预习安排:(1)看教材P25页,完成【课前自主导学】中“知识1,可逆反应与不可逆反应”,并完成【思考交流1】;(2)看教材P26页,完成【课前自主导学】中“知识2,化学平衡状态”,并完成【思考交流2】。
⇒步骤1:导入新课、并分析本课时的教材地位。
⇒步骤2:建议对【思考交流】多提问学生,使80%以上的学生能掌握该内容,以利于下一步对该重点知识的探究。
步骤5:在老师的指导下,学生自主完成【变式训练1】和【当堂双基达标】中的2、3两题,验证学生对探究1掌握的情况。
⇐步骤4:教师通过【例1】和教材P25页的讲解,对“探究1”进行总结。
⇐步骤3:师生互动完成“探究1,可逆反应”可利用【问题导思】所设置的问题,由浅入深地进行师生互动。
步骤6:师生互动完成“探究2,化学平衡状态的标志”,可利用【问题导思】所设置的问题由浅入深的进行师生互动。
人教版高中化学选修4导学案:2.3化学平衡 第1课时 可逆反应与化学平衡状态 -含答案

第三节 化学平衡第1课时 可逆反应与化学平衡状态1.了解化学反应的可逆性,了解可逆反应的概念。
2.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。
3.能根据化学平衡状态的特征,判断化学平衡状态的标志。
可逆反应与不可逆反应1.可逆反应(1)概念:在相同条件下,既能向正反应方向进行同时又能向逆反应方向进行的化学反应。
(2)表示方法:采用“”连接,把从左向右进行的反应称作正反应,把从右向左进行的反应称作逆反应。
例如:SO 2和O 2的反应可表示为2SO 2+O 2催化剂△2SO 3。
2.不可逆反应有些反应的逆反应进行程度太小因而可忽略,把这类反应称作不可逆反应,用“===”连接。
例如:Ba 2++SO 2-4===BaSO 4↓。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)酯化反应属于可逆反应。
( )(2)NH 3和HCl 生成NH 4Cl 与NH 4Cl 分解生成NH 3和HCl 互为可逆反应。
( )(3)可逆反应中反应物的转化率能达到100%。
( )答案:(1)√ (2)× (3)×2.下列各组两个反应互为可逆反应的是( )①H 2+Cl 2=====点燃2HCl 与2HCl=====电解H 2↑+Cl 2↑②H 2SO 4(浓)+2HBr===2H 2O +Br 2+SO 2↑与Br 2+SO 2+2H 2O===2HBr +H 2SO 4③2NO 2===N 2O 4与N 2O 4===2NO 2④2SO 2+O 2=====催化剂△2SO 3与2SO 3=====催化剂△2SO 2+O 2 A .①②B .②③C .③④D .②④ 解析:选C 。
可逆反应必须是在相同条件下同时向正、逆两个方向都能进行的反应,③④互为可逆反应。
可逆反应的特征(1)双向性:可逆反应分为方向相反的两个反应:正反应和逆反应。
(2)双同性:正、逆反应在相同条件下是同时进行的。
化学平衡状态建立过程

化学平衡状态建立过程咱就说化学平衡状态建立过程啊,这可真是个奇妙的事儿。
你想啊,就好像一场激烈的比赛,两边的反应物和生成物在那较着劲呢。
一开始的时候,那反应可猛啦,就跟短跑选手刚起跑似的,蹭蹭地往前冲。
反应物们疯狂地相互作用,都想赶紧变成生成物。
这时候啊,就像是一阵风刮过,热闹得很呢!可慢慢地,生成物也多起来啦,它们可不干啦,开始反过来阻碍反应物啦。
这就好比跑步到一半,累了,速度就慢下来了。
这一来一往的,可不就逐渐达到一个平衡嘛。
这平衡可不是一下子就达成的哦,它是在这你来我往的过程中逐渐形成的。
就像拔河比赛,两边的力量此消彼长,最后达到一个僵持的状态。
你说这化学平衡状态多有意思啊,它不是静止不动的,而是动态的平衡呢。
反应物和生成物都还在那活动着,只是它们的变化速率相等啦。
比如说,在一个反应体系里,反应物 A 和 B 反应生成 C 和 D。
开始的时候,A 和 B 很多,它们反应得可快啦,C 和 D 就不断地产生。
可随着 C 和 D 的增多,它们就会反过来影响 A 和 B 的反应啦。
这就像两个人跳舞,开始跳得很起劲,后来累了,就跳得慢些,但还是在跳呀。
那怎么知道是不是达到化学平衡状态了呢?嘿,这就有一些特征啦。
比如各物质的浓度不再变化,就像那湖面平静得没有一丝涟漪。
反应速率也稳定啦,不忽快忽慢啦。
想想看,如果这世界上没有化学平衡状态,那得多乱套呀!反应一直进行下去,没个尽头,那可不行。
有了这个平衡,一切都变得有序起来。
咱再拿生活中的例子来类比一下,就像我们每天的生活,有工作的时候,也有休息的时候,这就是一种平衡呀。
如果一直工作不休息,那不得累垮啦?化学平衡状态建立过程,真的是充满了奥秘和趣味。
它让我们看到物质之间奇妙的相互作用和变化。
是不是很神奇呀?这就是化学的魅力所在呀!它让我们对这个世界有了更深的理解和认识。
所以啊,可别小看了这化学平衡状态建立过程哦,它可有着大大学问呢!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和溶液中溶质的溶解 过程完全停止了吗?
没有!以蔗糖溶解于水为例,蔗糖分子离开 蔗糖表面扩散到水中的速率与溶解在水中的蔗 糖分子在蔗糖表面聚集成为晶体的速率相等。
即:溶解速率 = 结晶速率
达到了溶解的平衡状态,一种动态平衡
那么,可逆反应的 情况又怎样呢?
即:溶解速率 = 结晶速率
达到了溶解的平衡状态,一种动态平衡
⑧对于同物质而言,断裂化学键的数目与生成化学的 数目相等。
例1.下列方法中可以证明A(s) + 2B2(g) 2C2(g) +D2(g) 已经达到平衡状态的是_________________ ⑴、单位时间内生成了2molC的同时也生成了1molA ⑵、一个B — B键的断裂的同时有一个C — C键的生成 ⑶、反应速率ひ(B2)=ひ(C2)=1/2ひ(D2) ⑷、C(B2):C(C2):C(D2) = 2:2:1
(6)气体的总物质的量不再变化
例 对于体积固定的密闭容器中进行的可逆反应:
A(固)+2B(气) C(气)+D(气)
在恒温下,当下列物理量不再变化时,表明上 述可逆反应已达到平衡状态的是( BC )。 (A)混合气体的压强
(B)混合气体的密度
(C)B的物质的量浓度
(D)气体的总的物质的量
思考:若上述可逆反应中,A的聚集状态是气态, 则能说明 该可逆反应达到平衡状态的是 ( ACD )?
1、化学平衡状态的本质标志:
①同一物质的V正=V逆(单位时间内生成与消耗某反
应物(生成物)的量相等) ②各成分的百分含量(物质的量浓度或体积分数) 保持不变
2、化学平衡状态的特征
(1)逆:只有可逆反应才能建立化学平衡 (2)动:动态平衡(正逆反应仍在进行) (3)等:正反应速率=逆反应速率 (4)定:反应混合物中各组分的浓度保持 不变,各组分的含量一定。 (5)变:条件改变,原平衡被破坏,在新 的条件下建立新的平衡。
【例3】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( AC ) A.1个N≡N键断裂的同时,有3个H-H键形成 B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂 D.1个N≡N键断裂的同时,有6个N-H键形成
化学平衡状态
一、什么是可逆反应?
在同一条件下,既能向正反应方向进 行,同时又能向逆反应方向进行的反应,叫 做可逆反应. NH3+H2O NH3· H 2O
注意:可逆反应总是不能进行到底, 得到的总是反应物与生成物的混合物
二、什么是饱和溶液?
在一定温度下,在一定量的溶剂里,不 能再溶解某种溶质的溶液,叫做这种溶质 的饱和溶液。
① 同一种物质:该物质的生成速率等于它的 消耗速率。 ② 不同的物质:速率之比等于方程式中各物 质的计量数之比,但必须是不同方向的速率。
(2)反应混合物中各组成成分的含 量保持不变(外部表现):
① 各组成成分的质量、物质的量、分子数、 体积(气体)、物质的量浓度均保持不变。 ② 各组成成分的质量分数、物质的量分数、 气体的体积分数均保持不变。 ③ 若反应前后的物质都是气体,且总体积不 等,则气体的总物质的量、总压强(恒温、恒 容)、平均摩尔质量、混合气体的密度(恒温、 恒压)均保持不变。 ④ 反应物的转化率、产物的产率保持不变。
那么,可逆反应的 情况又怎样呢?
在容积为1L的密闭容器里,加0.01molCO 和0.01molH2O(g),CO+H2O CO2+H2
开始时c(CO) 、c(H2O)最大,c(CO2) 、c(H2)=0 随着反应的进行,正反应速率逐渐减小, 逆反应速率逐渐增大 c(CO) 、c(H2O)逐渐减小 c(CO2) 、c(H2)逐渐增大 进行到一定程度,总有那么一刻,正反应速 率和逆反应速率的大小不再变化
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
E.容器中气体的密度保持不变。
F.混合气体的平均摩尔质量保持不变。
G.容器中气体的总压强保持不变。
12
[小结]化学平衡状态的标志:
• (1)υ正 = υ逆 (本质特征)
小结:化学平衡的标志
本 ① 正反应速率等于逆反应速率(ひ正=ひ逆) 质 标 ② 各成分的百分含量保持不变 志 ③ 各物质的浓度不变
④ 各物质的转化率不变
⑤ 对于气体计量数和前后不相等的反应, 压强保 特 持不变〃〃〃〃〃〃 征 ⑥对于有颜色物质参加或生成的可逆反应,颜色不变。
标 ⑦对于吸热或放热反应,绝热体系的温度不变。 志
例2. 在一定温度下,可逆反应:
A2(气)+B2(气)
பைடு நூலகம்
2AB(气)达到平衡的标志是(
)
(1) A2、B2、AB的浓度不再变化
(2) 容器中的压强不再随时间变化
(3) 单位时间内生成n mol的A2同时生成2n mol的AB
(4) A2、B2、AB的浓度之比为1:1:2
(5) 混合气体的密度不随时间变化
⑸、温度、体积一定时,[B2]、[C2]、[D2]浓度不再变化
⑹、温度、体积一定时,容器内的压强不再变化
⑺、条件一定时,混合气体的平均相对分子质量不再变化
⑻、温度、体积一定时,混合气体的密度不再变化 ⑼、百分组成 B2% = C2% = D2%
[例1] 在一定的温度下,可逆反应:A(g)+ 3B F (g)=== 2C(g)达到平衡的标志是(A、C、 ) A.C的生成速率与C的分解速率相等。
判断可逆反应达到平衡状态?
重要题型:
【例1】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( AC ) A. C的生成速率与C分解的速率相等 B. 单位时间内生成nmolA,同时生成3nmolB C. A、B、C的浓度不再变化 D. A、B、C的分子数比为1:3:2
【例2】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已 达平衡状态的是( B ) A. 反应容器内压强不随时间变化 B. P和S的生成速率相等 C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而 变化
且正反应速率=逆反应速率 这时,CO、H2O的消耗量等于CO2、H2 反应生成的CO、H2O的量,
速 率 正反应 速率 逆反应 速率
相等
时间
反应仍在进行,但是四种物质的浓度均保 持不变,达到动态平衡,这就是我们今天要 重点研究的重要概念—化学平衡状态
一、化学平衡状态
在一定条件下可逆反应里,当正反应速 率与逆反应速率相等时,反应混合物中 各成分的百分含量保持不变的状态。
