【化学】初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析
(化学)九年级化学化学方程式的计算解题技巧及练习题(含答案)及解析

(化学)九年级化学化学方程式的计算解题技巧及练习题(含答案)及解析一、中考化学方程式的计算1.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。
向一锥形瓶中加入100 g 该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO 3溶液120 g ,反应结束后溶液的总质量是215.6 g 。
试计算下列问题: (知识卡片)①洁厕灵有效成分是HCl ,洁厕灵中其它成分均不跟NaHCO 3反应。
②HCl 和NaHCO 3反应的化学方程式为HCl+NaHCO 3=NaCl+H 2O+CO 2↑ (1) 产生的二氧化碳质量为_________克。
(2) 该品牌洁厕灵中HCl 的质量分数是多少?_____(写出计算过程) 【答案】4.4 3.65% 【解析】 【分析】盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
【详解】(1) 由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故产生的二氧化碳质量为100g+120g-215.6g=4.4g 。
(2) 设100 g 该品牌洁厕灵中HCl 的质量为x322HCl +NaHCO =NaCl +H O +CO 36.544x4.4g↑ 36.544=x 4.4gx=3.65g该品牌洁厕灵中HCl 的质量分数为:3.65g100%=3.65%100g⨯ 答:该品牌洁厕灵中HCl 的质量分数为3.65%。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.一同学取来某品牌的钾肥(主要成分硫酸钾,还含少量的氯化钾)共200克,投入到908克的氯化钡溶液中恰好完全反应。
经过滤后得到硫酸钡沉淀233克和氯化钾的不饱和溶液。
请帮他计算:(注明:K 2SO 4+ BaCl 2= BaSO 4↓+2KCl ) (1)氯化钾的相对分子质量是_______。
初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

初三化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.称取5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应后气体全部逸出,所得剩余物质的质量为100.2g(生铁样品中的杂质不溶于水,也不与盐酸发生反应)。
试计算该生铁样品中铁的质量是多少_____。
【答案】5.6g【解析】【分析】铁与稀盐酸反应生成氯化亚铁和氢气。
【详解】根据质量守恒定律,生成氢气的质量为:5.8g+94.6g-100.2g=0.2g设该生铁样品中铁的质量是x,2442Fe+H SO=FeSO+H562x0.2g56x=20.2gx=5.6g答:该生铁样品中铁的质量是5.6g。
2.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为x3222CaCO 2HCl =CaCl CO H O7344x4.4g 73x =,x=7.3g 44 4.4g++↑+ 答:稀盐酸中溶质质量7.3g 【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量3.波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:2Cu+O 2+2H 2SO 4=2CuSO 4+2H 2O 来生产硫酸铜,若要制得 40kg 硫酸铜。
试计算: (1)硫酸铜中铜元素质量分数是_____。
(2)若恰好消耗稀硫酸的质量是 200kg ,则该稀硫酸溶质的质量分数是多少_____?【答案】40% 12.25%【解析】【分析】【详解】(1)CuSO 4中Cu 元素质量分数=6464100%=100%=40%6432416160⨯⨯++⨯。
(2)设消耗的硫酸的质量为x 。
22442H SO 2CuSO 2Cu O 2=2982160x 40kg2H O+++⨯⨯ x 29840kg 2160⨯=⨯ x=24.5kg则稀硫酸溶质的质量分数=24.5kg 100%=12.25%200kg⨯。
九年级化学化学方程式的计算解题技巧(超强)及练习题(含答案)及解析

九年级化学化学方程式的计算解题技巧(超强)及练习题(含答案)及解析一、中考化学方程式的计算1.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al2O3通电4Al+3O2↑。
请计算生成1.08t金属铝,理论上需要氧化铝的质量是多少____?【答案】2.04t【解析】【分析】【详解】解:设生成1.08t金属铝,理论上需要氧化铝的质量为x232 2Al O4Al+3O204108x 1.08t通电204x=108 1.08tx=2.04t答:生成1.08t金属铝,理论上需要氧化铝的质量为2.04t。
2.向 100 克 MgCl2和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,反应情况,如图所示。
(1)当滴加氢氧化钠溶液的质量至 N 点时所得溶液的 pH 值为_______(填编号);A大于 7 B等于 7 C小于 7(2)通过计算,确定 M 点时所得溶液中溶质的质量分数,写出计算过程____。
【答案】A 9.2%(详见解析)【解析】【分析】向 100 克 MgCl2和 HCl 的混合溶液中,逐滴加入 10%的氢氧化钠溶液,氢氧化钠先与盐酸反应,等盐酸完全反应后再与氯化镁反应。
【详解】(1)当滴加氢氧化钠溶液的质量至N 点时,氢氧化钠过量,溶液呈碱性,pH.>7,故选A ;(2)根据图示可知,反应过程中生成了5.8g 的氢氧化镁。
设恰好完全反应时,和氯化镁反应的氢氧化钠溶液的质量为x()222NaOH +MgCl =2NaCl +Mg OH 8058x 10%5.8g↓⨯ 80x 10%=58 5.8g⨯ x=80g所以反应的全部的氢氧化钠的质量为(80g+80g )×10%=16g ;设生成的氯化钠的质量为y ,由于钠元素最终转到氯化钠得关系式为: N 4058.516g yaOH NaCl~ 4016=58.5yy=23.4g 所得氯化钠溶液中氯化钠的质量分数为23.4g 100%9.2%100g+80g+80g-5.8g⨯≈。
【化学】九年级化学化学方程式的计算的基本方法技巧及练习题及练习题(含答案)及解析
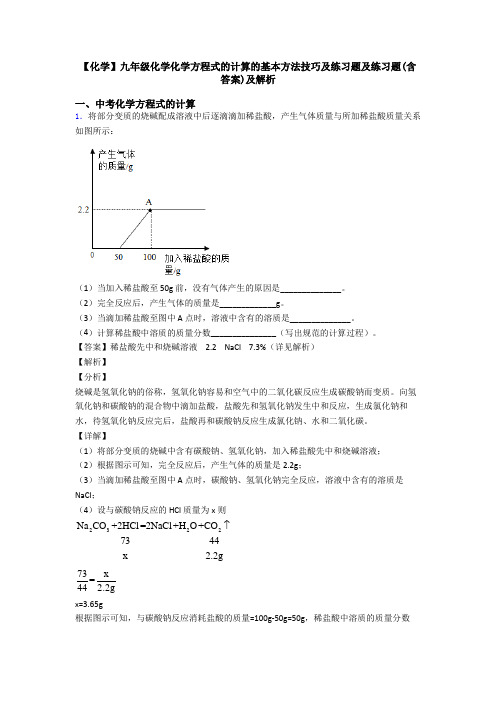
【化学】九年级化学化学方程式的计算的基本方法技巧及练习题及练习题(含答案)及解析一、中考化学方程式的计算1.将部分变质的烧碱配成溶液中后逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:(1)当加入稀盐酸至 50g 前,没有气体产生的原因是______________。
(2)完全反应后,产生气体的质量是_____________g。
(3)当滴加稀盐酸至图中 A 点时,溶液中含有的溶质是______________。
(4)计算稀盐酸中溶质的质量分数_______________(写出规范的计算过程)。
【答案】稀盐酸先中和烧碱溶液 2.2 NaCl 7.3%(详见解析)【解析】【分析】烧碱是氢氧化钠的俗称,氢氧化钠容易和空气中的二氧化碳反应生成碳酸钠而变质。
向氢氧化钠和碳酸钠的混合物中滴加盐酸,盐酸先和氢氧化钠发生中和反应,生成氯化钠和水,待氢氧化钠反应完后,盐酸再和碳酸钠反应生成氯化钠、水和二氧化碳。
【详解】(1)将部分变质的烧碱中含有碳酸钠、氢氧化钠,加入稀盐酸先中和烧碱溶液;(2)根据图示可知,完全反应后,产生气体的质量是2.2g;(3)当滴加稀盐酸至图中 A 点时,碳酸钠、氢氧化钠完全反应,溶液中含有的溶质是NaCl;(4)设与碳酸钠反应的 HCl 质量为x则Na CO+2HCl=2NaCl+H O+CO23227344x 2.2g73x=44 2.2gx=3.65g根据图示可知,与碳酸钠反应消耗盐酸的质量=100g-50g=50g,稀盐酸中溶质的质量分数=3.65g100%=7.3%50g⨯。
答:稀盐酸中溶质的质量分数为7.3%。
2.碳酸氢钠用于焙制糕点,在270℃时分解:323222NaHCO Na C ΔO H O CO ++↑。
现取3NaHCO 16.8g ,在敞口容器中加热到质量不再改变为止,减少的质量为( ) A .4.4g B .6.2gC .8.8gD .10.6g【答案】B 【解析】 【分析】 【详解】根据题意可知,在敞口容器中加热到质量不再改变为止,剩余物质为固体碳酸钠。
九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为6.7g(假设杂质不参与反应)。
请计算:(1)反应生成的CO2的质量______________。
(2)该石灰石样品中碳酸钙的质量分数____________。
【答案】3.3g 75%【解析】【分析】【详解】(1)由质量守恒定律,反应生成的CO2的质量为10g-6.7g=3.3g,故填:3.3;(2)解:设该石灰石样品中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x 3.3g10044=x 3.3g↑x=7.5g该石灰石样品中碳酸钙的质量分数为7.5g10g×100%=75%答:该石灰石样品中碳酸钙的质量分数为75%。
2.向盛有100g质量分数为8%的氧氧化钠溶液的烧杯中,逐滴加入193.8g硫酸铜溶液,二者恰好完全反应。
请计算:(化学方程式为 CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4)(1)恰好完全反应时生成沉淀的质量__________。
(2)恰好完全反应时溶液中溶质的质量分数__________。
【答案】9.8g 5%【解析】【分析】100g质量分数为8%的氧氧化钠溶液中溶质质量为:100g×8%=8g。
【详解】设恰好完全反应时,生成沉淀氢氧化铜质量为x,生成硫酸钠的质量为y。
42422NaOH+CuSO=Na SO+Cu(OH)80142988g y x8014298==8g y xx=9.8g,y=14.2g100g+193.8g-9.8g=284g恰好完全反应时溶液中溶质的质量分数14.2g100%=5% 284g⨯。
3.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:注:碳既不溶于水也不与稀盐酸发生反应。
(化学)九年级化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析

(化学)九年级化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析一、中考化学方程式的计算1.请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),回答下列问题:计算稀盐酸中溶质质量。
【答案】7.3g【解析】【分析】【详解】根据质量守恒反应前后物质总质量不变可得二氧化碳的质量等于12g+100g+100g-207.6g=4.4g设稀盐酸中溶质质量为xCaCO2HCl=CaCl CO H O++↑+32227344x 4.4g73x=,x=7.3g44 4.4g答:稀盐酸中溶质质量7.3g【点睛】根据质量守恒,求出二氧化碳质量,根据二氧化碳质量求稀盐酸中溶质质量2.某校学习小组测定酸碱中和反应。
他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液的pH=7。
请你计算,所得溶液溶质的质量分数是多少?【答案】3.9%【解析】【分析】氢氧化钠和盐酸发生中和反应,生成氯化钠和水。
【详解】解:设生成氯化钠的质量为x。
2NaOH +HCl=NaCl +H O4058.550g 8%x⨯ 4050g 8%=58.5xx=5.85g⨯ 所得溶液溶质的质量分数是 5.85g 100%=3.9%50g+100g⨯ 答:所得溶液溶质的质量分数是3.9%。
【点睛】本题考查的是溶液与化学方程式的综合计算,难度不算大,但要学会运用化学方程式先求出溶质的质量,再利用溶质质量分数计算公式进行解答。
3.工业上冶炼 150吨含杂质为 2%的生铁,需要含杂质 20%的赤铁矿石多少吨?【答案】262.5t【解析】【分析】【详解】解:设需要纯氧化铁的质量为 x232Fe O 2Fe +3CO 160112x 150t (1-2%)3CO+⨯高温 160x =112150t (12%)⨯- x=210t故需要含杂质为 20%的铁矿石的质量为:210t =262.5t 1-20%答:需要含杂质 20%赤铁矿石的质量为 262.5t 。4.为测定一瓶敞口放置的浓盐酸的溶质质量分数,某同学量取50g 的盐酸与大理石充分反应,共用去含碳酸钙80%的大理石12.5g 。
(化学)九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

(化学)九年级化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析一、中考化学方程式的计算1.欲测得某块大理石中所含碳酸钙的含量,现取该大理石加入到足量稀盐酸中(杂质不与稀盐酸反应),产生CO2的质量与稀盐酸的质量关系如图所示,请计算。
(1)该实验中最多制得CO2的质量为_____。
(2)该大理石中所含碳酸钙的质量_____(写出计算过程)。
【答案】8.8g 20g【解析】【分析】碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
【详解】(1)由图像可知,该实验中最多制得CO2的质量为8. 8g。
(2)设该大理石中碳酸钙的质量为xCaCO+2HCl=CaCl+H O+CO↑322210044x8.8g100x=448.8gx=20g答:大理石中所含碳酸钙的质量为20g。
2.某校学习小组测定酸碱中和反应。
他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液PH=7。
请你帮他们计算:所用稀盐酸溶质的质量分数是多少?【答案】3.65%【解析】设盐酸溶液中氯化氢的质量为xNaOH + HCl == NaCl + H2O40 36.550g ×8% x4036.5=⨯g x508%x=3.65g稀盐酸溶质的质量分数=3.65g÷100g×100%=3.65%答:所用稀盐酸溶质的质量分数是3.65%3.取碳酸钙和硫酸钡的混合物15.0g于烧杯中,将150.0g的稀盐酸平均分成三次加入烧杯中,加入稀盐酸与烧杯中固体的质量关系如图所示,请完成下列问题:(1)该混合物中硫酸钡的质量为________g;(2)求恰好完全反应时所得溶液中溶质的质量分数______。
(结果精确到0.1%)【答案】5 10.5%【解析】【分析】【详解】(1)碳酸钙能和稀盐酸反应生成氯化钙、水和二氧化碳。
而硫酸钡不能与稀盐酸反应。
所以最终剩余固体的质量是硫酸钡的质量。
故答案为:5;(2)由图分析可知,10g碳酸钙恰好和100g的盐酸反应。
【化学】初三化学《化学方程式》解题技巧及练习题含解析
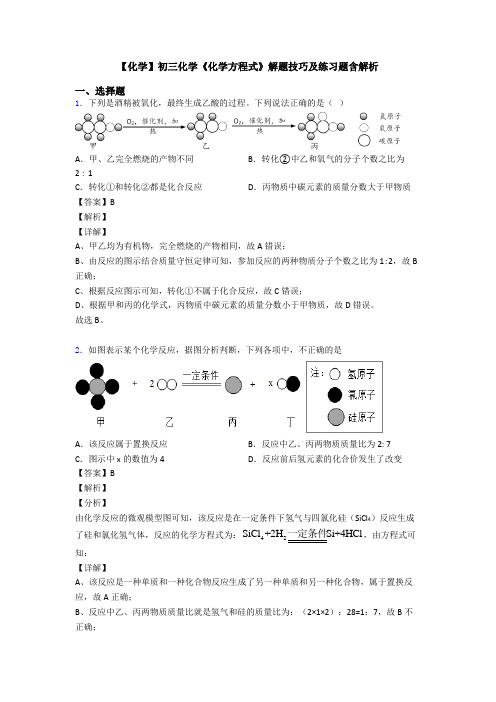
【化学】初三化学《化学方程式》解题技巧及练习题含解析一、选择题1.下列是酒精被氧化,最终生成乙酸的过程。
下列说法正确的是( )A .甲、乙完全燃烧的产物不同B .转化②中乙和氧气的分子个数之比为2∶1C .转化①和转化②都是化合反应D .丙物质中碳元素的质量分数大于甲物质 【答案】B 【解析】 【详解】A 、甲乙均为有机物,完全燃烧的产物相同,故A 错误;B 、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:2,故B 正确;C 、根据反应图示可知,转化①不属于化合反应,故C 错误;D 、根据甲和丙的化学式,丙物质中碳元素的质量分数小于甲物质,故D 错误。
故选B 。
2.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是A .该反应属于置换反应B .反应中乙、丙两物质质量比为2: 7C .图示中x 的数值为4D .反应前后氢元素的化合价发生了改变【答案】B 【解析】 【分析】由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件,由方程式可知: 【详解】A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;C 、由方程式可知,图示中x 的数值为4,故C 正确;D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。
故选B 。
3.长途运输鱼苗时,为了防止鱼苗缺氧,常在水中加入物质X ,发生反应的化学方程式为:2X+2H 2O=2Ca(OH)2+O 2↑,其中X 的化学式为 ( ) A .CaO B .CaO 2C .CaCO 3D .CaCl 2【答案】B 【解析】试题分析: 依据质量守恒定律可知:化学变化前后元素种类不变,每一种元素的原子个数不变;反应后Ca 、O 、H 的原子个数依次为:2、6、4,已知反应前O 、H 的原子个数分别为:2、4,则2X 中应含有Ca 、O 的原子个数分别为:2、4,则X 的化学式为CaO 2,故选B考点:质量守恒定律4.将CO 和CO 2的混合气体通入足量澄清的石灰水中,生成沉淀的质量与原混合气体的质量相等,则原混合气体中CO 和CO 2的质量比为 A .14:11 B .11:14C .11:7D .7:11【答案】A 【解析】 【分析】根据反应方程式:Ca (OH )2+CO 2═CaCO 3↓+H 2O ,分别设出CO 和CO 2的质量,利用生成的沉淀质量恰好等于原混合气体的质量的关系,列出等式,进行解答。
(化学)初中化学化学方程式的计算解题技巧讲解及练习题(含答案)及解析

(2)所用盐酸的溶质质量分数是多少?____(结果保留到0.1%)
【答案】7.5克5.5%
【解析】
【详解】
(1)设石灰石中碳酸钙的质量为x,所用盐酸的溶质质量为y,
解得x=7.5g,y=5.475g
答:石灰石中碳酸钙的质量是7.5g。
(2)所用盐酸的溶质质量分数为:
150.2g
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为_____g;
(2)样品中碳的质量分数_____(计算结果保留到0.1%);
【答案】0.2g3.4%
【解析】
【分析】
【详解】
(1)根据质量守恒定律可知,恰好完全反应时,生成氢气的质量:50g+5.8g+94.6g-150.2g=0.2g,故填0.2;
【答案】1.17g
【解析】
【分析】
根据化学方程式进行计算即可。
【详解】
设氯化钠的质量为x。
x=1.17g
答:氯化钠溶液中溶质的质量为1.17g。
8.将10克的石灰石放入烧杯中,加入一定质量的稀盐酸恰好完全反应,生成3.3克气体。(杂质不溶解,也不参加反应。)反应后称量烧杯中剩余物质的总质量为106.7克。试求
答:所用盐酸的溶质质量分数为5.5%。
9.Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g)
3.生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
(化学)九年级必备化学化学方程式的计算技巧全解及练习题(含答案)及解析

(化学)九年级必备化学化学方程式的计算技巧全解及练习题(含答案)及解析一、中考化学方程式的计算1.高铁快速发展方便了人们的出行。
工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。
若用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是多少?【答案】33.6kg【解析】【分析】【详解】解:理论上可制得铁的质量为x。
23232Al+Fe O=Al O+2Fe16011248kg x高温16048kg=112xx=33.6kg答:用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是33.6kg。
2.利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。
每次取100 g样品配制成溶液,向其中加入质量分数为10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:(1)求粗盐的纯度________。
(2)当样品与所加氢氧化钠溶液恰好完全反应时,求溶液中氯化钠的质量________。
(写出解题过程)【答案】90.5% 102.2 g【解析】【分析】【详解】解:根据题意设样品中MgCl2的质量为x,反应生成NaCl的质量为y。
22 MgCl2NaOH=2NaCl+Mg(OH)9511758x y 5.8g+95x=58 5.8gx=9.5g117y=58 5.8gy=11.7gx=9.5 g,y=11.7 g(1)该粗盐纯度为:100g-9.5g100%=90.5% 100g⨯(2)当恰好完全反应时,溶液中氯化钠的质量为:100 g-9.5 g+11.7 g=102.2 g答:(1)样品中粗盐的纯度为90.5%;(2)恰好完全反应时,溶液中氯化钠的质量为102.2 g。
3.(1)化学实验室现有质量分数为98%的浓硫酸,但实验中常需要用较稀的硫酸。
若要把20.0 g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是________ g。
(2)过氧化钙(CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑。
九年级化学化学方程式的计算技巧和方法完整版及练习题及解析

九年级化学化学方程式的计算技巧和方法完整版及练习题及解析一、中考化学方程式的计算1.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。
向一锥形瓶中加入100 g 该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO 3溶液120 g ,反应结束后溶液的总质量是215.6 g 。
试计算下列问题:(知识卡片)①洁厕灵有效成分是HCl ,洁厕灵中其它成分均不跟NaHCO 3反应。
②HCl 和NaHCO 3反应的化学方程式为HCl+NaHCO 3=NaCl+H 2O+CO 2↑(1) 产生的二氧化碳质量为_________克。
(2) 该品牌洁厕灵中HCl 的质量分数是多少?_____(写出计算过程)【答案】4.4 3.65%【解析】【分析】盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量。
【详解】(1) 由质量守恒定律可知,反应物的总质量等于生成物的总质量,减少的是生成的气体或沉淀的质量,故产生的二氧化碳质量为100g+120g-215.6g=4.4g 。
(2) 设100 g 该品牌洁厕灵中HCl 的质量为x322HCl +NaHCO =NaCl +H O +CO 36.544x4.4g↑36.544=x 4.4g x=3.65g该品牌洁厕灵中HCl 的质量分数为:3.65g 100%=3.65%100g⨯ 答:该品牌洁厕灵中HCl 的质量分数为3.65%。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.海洋是地球上最大的聚宝盆,浩瀚的海洋蕴含着丰富的化学资源,海水中化学资源的利用具有非常广阔的前景,目前世界上60%的镁是从海水中提取的,主要步骤如下图(1)在第①步中观察到的实验现象是_____。
(2)步骤②产生的氯化镁的质量与原卤水中氯化镁的质量相比_____(填“增大”、“减小”或“不变”之一)。
初中化学化学方程式的计算解题技巧和训练方法及练习题(含答案)

初中化学化学方程式的计算解题技巧和训练方法及练习题(含答案)一、中考化学方程式的计算1.为测定石灰石样品中碳酸钙的质量分数,某学习小组进行了如下实验探究,取10g石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体质量的坐标图,见图.(1)碳酸钙完全反应用去稀盐酸的质量为______g.(2)计算该石灰石样品中碳酸钙的质量分数______.【答案】84.32 80%【解析】【分析】根据图象可知反应消耗盐酸的质量和生成二氧化碳气体的质量,利用化学方程式根据二氧化碳的质量可计算出样品中碳酸钙的质量,进而计算样品中碳酸钙的质量分数。
【详解】(1)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为84.32g;(2)解:根据图象可知:该样品最多与盐酸反应生成二氧化碳3.52g;设10g石灰石样品中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x 3.52g10044=x 3.52g↑x=8g石灰石样品中碳酸钙的质量分数为8g10g×100%=80%答:石灰石样品中碳酸钙的质量分数为80%。
答案:(1)84.32(2)80%。
2.为测定某氢氧化钾溶液的溶质质量分数,兴趣小组向盛有 20g 该氢氧化钾溶液的烧杯中逐滴加入7.3%的盐酸,下图是溶液总质量随盐酸加入质量而变化的关系图(Q点表示恰好完全反应)。
请计算该氢氧化钾溶液的溶质质量分数__________。
(写出计算过程)【答案】11.2%【解析】【分析】根据恰好完全反应时溶液的总质量求算盐酸溶液的质量,进而结合对应的化学方程式求算该氢氧化钾溶液的溶质质量分数。
【详解】设该氢氧化钾溶液的溶质质量分数为x反应的稀盐酸溶液的质量为40g-20g=20g2KOHHCl =KCl H O5636.520g x 20g 7.3%5636.5=20g x 20g 7.3%++⨯⨯⨯⨯ x=11.2%答:该氢氧化钾溶液的溶质质量分数为11.2%。
(化学)九年级化学化学方程式的计算答题技巧及练习题(含答案)及解析

(化学)九年级化学化学方程式的计算答题技巧及练习题(含答案)及解析一、中考化学方程式的计算1.某化学兴趣小组为了测定实验室用大理石和稀盐酸制备CO2后溶液的组成,取50g反应后的溶液,向其中加入10%的Na2CO3溶液,反应过程中加入Na2CO3溶液质量与生成的气体及沉淀质量关系如图。
(1)生成沉淀的质量是_____g。
(2)50g溶液中CaCl2的质量分数是多少?_____(写出计算过程)(3)y=_____。
(4)a点对应的溶液的溶质是(填化学式)_____。
【答案】5 11.1% 2.2g NaCl和CaCl2【解析】【分析】碳酸钙和稀盐酸反应氯化钙、水和二氧化碳,稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,稀盐酸反应完,碳酸钠再与氯化钙溶液反应生成碳酸钙沉淀和氯化钠。
【详解】(1)实验室用大理石和稀盐酸制备二氧化碳后溶液为稀盐酸与氯化钙的混合溶液,向其中加入10%的碳酸钠溶液,稀盐酸先与碳酸钠溶液反应生成氯化钠、水和二氧化碳,稀盐酸反应完,碳酸钠再与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,故生成沉淀的质量是5g。
(2)设溶液中CaCl2质量为x2233CaCl+Na CO=2NaCl+CaCO111100x5g↓111100=x5gx=5.55g故溶液中CaCl2的质量分数为5.55g100%11.1% 50g⨯=(3)设生成二氧化碳的质量为y2322Na CO +2HCl =2NaCl +H O CO 1064453g 10%y+↑⨯ 10644=53g 10%y ⨯ y=2.2g(4)在a 点,稀盐酸与碳酸钠溶液恰好完全反应生成氯化钠、水和二氧化碳,故a 点对应的溶液的溶质是生成的氯化钠和大理石和稀盐酸制备二氧化碳得到的氯化钙,化学式为NaCl 和CaCl 2。
【点睛】=100%⨯溶质质量溶质质量分数溶液质量2.硝酸铵是农业生产中常用的化学肥料。
为测定某含有少量NaNO 3的硝酸铵样品中 NH 4NO 3的纯度,取2.0g 该硝酸铵样品于容器中,滴入5.0g 20%的NaOH 溶液。
【化学】初三化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析

【化学】初三化学化学方程式的计算解题技巧和训练方法及练习题(含答案)含解析一、中考化学方程式的计算1.为测定某过氧化钠样品的纯度,将2g 该样品与足量水发生如下反应(杂质不参与反应) :22222Na O + 2H O=4NaOH+O ↑ 。
生成气体质量与时间的关系如图所示。
计算该样品中过氧化钠的质量分数。
____________【答案】78% 【解析】 【分析】=100%⨯过氧化钠的质量样品中过氧化钠的质量分数样品的质量【详解】由生成气体质量与时间的关系图可知,完全反应生成的氧气的质量为0.32g 。
设样品中过氧化钠的质量为x22222Na O +2H O =4NaOH +O 15632x 0.32g ↑ 15632=x 0.32gx=1.56g该样品中过氧化钠的质量分数为1.56g100%78%2g⨯= 答:该样品中过氧化钠的质量分数为78%。
2.某实验小组的同学为了测定实验室中高锰酸钾样品的质量分数,取7g 该样品,加热该混合物,完全反应后产生氧气的质量为0.64g ,求该样品中高锰酸钾的质量分数___________。
(精确到0.1% ) 【答案】90.3% 【解析】 【分析】高锰酸钾加热生成锰酸钾、二氧化锰和氧气。
【详解】设样品中高锰酸钾的质量为x42422Δ2KMnO K MnO +MnO +O 31632x0.64g↑31632=x 0.64gx=6.32g故样品中高锰酸钾的质量分数为6.32g100%7g90.3%⨯≈。
【点睛】=100%⨯高锰酸钾的质量样品中高锰酸钾的质量分数样品的质量3.钛(Ti )被誉为21世纪的“明星金属”,我国深海探测器“蛟龙”号的耐压球壳由钛合金制造。
工业上生产钛的化学方程式为4Na +TiCl 4800℃ Ti +4NaCl 。
(1)四氯化钛中氯元素的质量分数。
_____(结果保留到一位小数) (2)现消耗46吨钠,可生产钛的质量为多少_____? 【答案】74.7% 24t 【解析】 【分析】(1)根据物质的化学式计算组成元素的质量分数;(2)根据反应的化学方程式及其提供的数据进行相关方面的计算。
【化学】初三化学化学方程式的计算解题技巧及练习题(含答案)及解析

【化学】初三化学化学方程式的计算解题技巧及练习题(含答案)及解析一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6%【解析】【分析】【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl 208142233117104g 20%y z x 208104g 20%208104g 20%208104g 20%===117x 142y 233zx=11.7g y=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g 100%10.6%205g ⨯≈ 答:溶质质量分数为10.6%2.称取5.8g某生铁样品放入94.6g稀盐酸中,恰好完全反应后气体全部逸出,所得剩余物质的质量为100.2g(生铁样品中的杂质不溶于水,也不与盐酸发生反应)。
【化学】九年级化学化学方程式的计算解题技巧及经典题型及练习题(含答案)及解析

【化学】九年级化学化学方程式的计算解题技巧及经典题型及练习题(含答案)及解析一、中考化学方程式的计算1.小明想测量某氧化铜样品中氧化铜的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:将5g 粉碎后的样品加入烧杯中再加入98g 5%的稀硫酸恰好完全反应。
该样品中氧化铜的质量分数是多少_____?【答案】80%【解析】【分析】根据氧化铜和硫酸反应其他杂质不和硫酸反应进行分析,并化学方程式进行计算。
【详解】解:设样品中氧化铜的质量为X 。
2442CuO +H SO CuSO +H O8098X 98g 5%⨯= 80X=9898g 5%X=4g⨯样品中氧化铜的质量分数为:100%4g 5g=80%⨯ 答:样品中氧化铜的质量分数为80%。
2.某化学实验室用稀硫酸处理含有氢氧化钠的废水。
现取废水样品80g 倒入烧杯中,加入几滴无色酚酞溶液,然后逐滴加入9.8%的稀硫酸,反应过程中溶液的pH 变化如图所示。
(1)当恰好完全反应时,溶液的颜色变化是____________。
(2)求废水中氢氧化钠的质量分数_______ (写出计算过程)。
(3)往上述80g 废水中逐渐加入稀硫酸至过量,请在答题卡中画出Na 2SO 4质量随加入稀硫酸质量变化的曲线_______。
(4)下表为市面上浓硫酸和浓盐酸的有关数据:物质 纯度 价格(元/kg)浓硫酸(工业级)98% 0.6 浓盐酸(工业级) 98% 0.4若工厂每天需处理上述废水8吨,选用__________(填“浓硫酸”或“浓盐酸”)更合算,每天可节约________元(保留整数)。
【答案】红色变为无色 10% 浓硫酸 373【解析】【分析】【详解】(1)当恰好完全反应时,为中性,而酚酞在中性环境为无色,所以溶液的颜色变化是无色;(2)根据图可知,加入100g 硫酸时恰好完全反应,消耗的硫酸的质量为100g×9.8%=9.8g ,设废水中氢氧化钠的质量分数为x ,生成的硫酸钠的质量为y ,24242=809814280gx 92NaOH +H SO Na SO 8g y+2H .O80gx y 9.8g ==8014298x=10%,y=14.2g ,(3)往上述80g 废水中逐渐加入稀硫酸至过量,加入硫酸之前,硫酸钠为0,所以七点为0,至加入硫酸溶液100g ,硫酸钠质量达到最大为14.2g ,之后不再变化,Na 2SO 4质量随加入稀硫酸质量变化的曲线如图:;(4)设若工厂每天需处理上述废水8吨,需要的98%硫酸的质量为a ,需要的30%的盐酸的质量为b ,根据化学方程式NaOH+HCl=NaCl+H 2O ,2NaOH+H 2SO 4=Na 2SO 4+2H 2O 可得:24738098b 8t 2HCl 2NaOH H 108SO %9%a→→⨯ 98%a b 8t 10%==987380⨯ a=1t ,b=0.73t ,所用硫酸的价值为1t×1000kg/t×0.6元/kg=600元,所用盐酸的价值为0.73t×1000kg/t×0.4元/kg=292元,若工厂每天需处理上述废水8吨,选用 浓盐酸更合算,每天可节约600元-292元=308元。
(化学)九年级化学化学方程式的计算的技巧及练习题及练习题(含答案)含解析

(化学)九年级化学化学方程式的计算的技巧及练习题及练习题(含答案)含解析一、中考化学方程式的计算1.要用溶质质量分数为19.6%的稀硫酸与金属锌反应制取氡气,请回答下列问题(1)用水和浓硫酸来配制500g 溶质质量分数为19.6%的稀硫酸。
需溶质质量分数为98%的浓硫酸的质量为__________g ;(2)配制溶液时,用玻璃棒不断搅拌,玻璃棒的作用是_______________; (3)取配制后的溶液50g 与足量的金属锌反应,生成氢气的质量为_________g 。
【答案】100 散热,以免水沸腾造成液滴飞溅 0.2 【解析】 【分析】 【详解】(1)设需溶质质量分数为98%的浓硫酸的质量为x ,根据溶液稀释前后溶质的质量不变,则500g ×19.6%=x ×98% x=100g 。
(2)配制溶液时。
用玻璃棒不断搅拌,玻璃棒的作用是散热,以免水沸腾造成液滴飞溅。
(3)设生成氢气的质量为x2442Zn+H SO =ZnSO +H 98250g 19.6%x982=50g 19.6%x⨯⨯↑x=0.2g 故答案为: (1)100;(2)散热,以免水沸腾造成液滴飞溅; (3)0.2。
2.如图是某胃药标签的部分内容,某校同学测定该药品 中 NaHCO 3 含量的过程如下:取 10 粒该药剂研碎后放入烧杯中,加入 50g 水后充分搅拌,再向其中滴加稀盐酸至恰好完全反应(已知药品中的其它成分既不溶于水,也不与稀盐酸反应),共消耗稀盐酸 11.5g 。
然后微热,使生成的CO 2 气体全部逸出,称得反应后烧杯内物质的总质量为 64.3g 。
(假设没有水蒸气逸出,发生的反应为 NaHCO 3+HCl=NaCl+H 2O+CO 2↑)请计算:(1)反应完成后生成气体的质量是多少________? (2)这种胃药中 NaHCO 3 的质量分数是多少__________?【答案】2.2g 84% 【解析】 【分析】由质量守恒定律可知,反应物的总质量等于生成的总质量,减少的为生成的气体的质量。
九年级化学化学方程式的计算及其解题技巧及练习题(含答案)及解析

九年级化学化学方程式的计算及其解题技巧及练习题(含答案)及解析一、中考化学方程式的计算1.高铁快速发展方便了人们的出行。
工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。
若用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是多少?【答案】33.6kg【解析】【分析】【详解】解:理论上可制得铁的质量为x。
高温2Al+Fe O=Al O+2Fe232316011248kg x16048kg=112xx=33.6kg答:用足量铝与48 kg氧化铁反应,理论上可制得铁的质量是33.6kg。
2.某厂生产的纯碱中含有少量氯化钠.取12g该样品于烧杯中,并滴加稀盐酸至73g时,气泡不再冒出,此时称得烧杯内溶液的总质量为80.6g.请计算:(1)产生二氧化碳气体的质量是_____________________ g?(2)样品中碳酸钠的质量?_____________________(3)反应后所得溶液中溶质的质量分数?(结果保留到 1%)_____________________【答案】4.4 10.6g 16%【解析】【分析】(1)烧杯中的物质前后减少的质量为二氧化碳的质量;(2)根据二氧化碳的质量可求出碳酸钠的质量,进而可求出纯碱样品中碳酸钠的质量分数;(3)依据反应方程式可求生成的氯化钠质量,同时可依据碳酸钠的质量求出原混合物中氯化钠的质量,进而依据反应后溶液的质量求出所得溶液的溶质质量分数。
【详解】(1)二氧化碳的质量=12g+73g-80.6g=4.4g(2)设样品中Na2CO3的质量为x,生成NaCl的质量为yNa CO+2HCl2NaCl+CO+H O↑232210611744x y 4.4g10611744==x y 4.4gx=10.6g y=11.7g答:该纯碱样品中碳酸钠的质量是10.6g。
(3)纯碱样品中NaCl的质量=12g-10.6g=1.4g ∴溶液中NaCl的总质量=11.7g+1.4g=13.1g反应所得溶液中溶质质量分数=13.1g80.6g×100%≈16%答:反应后所得溶液中溶质的质量分数是16%。
最新九年级化学化学方程式的计算解题技巧分析及练习题(含答案)

最新九年级化学化学方程式的计算解题技巧分析及练习题(含答案)一、中考化学方程式的计算1.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为6.7g(假设杂质不参与反应)。
请计算:(1)反应生成的CO2的质量______________。
(2)该石灰石样品中碳酸钙的质量分数____________。
【答案】3.3g 75%【解析】【分析】【详解】(1)由质量守恒定律,反应生成的CO2的质量为10g-6.7g=3.3g,故填:3.3;(2)解:设该石灰石样品中碳酸钙的质量为x3222CaCO+2HCl=CaCl+H O+CO10044x 3.3g10044=x 3.3g↑x=7.5g该石灰石样品中碳酸钙的质量分数为7.5g10g×100%=75%答:该石灰石样品中碳酸钙的质量分数为75%。
2.某中学化学课外实验兴趣小组欲测定一瓶混有氯化钠的苏打中碳酸钠的质量分数。
从该瓶试剂中取出100克样品,放在锥形瓶中加水至全部溶解,再加入稀盐酸,实验相关数据如图。
(1)产生的二氧化碳气体是__________克;(2)该瓶苏打中碳酸钠的质量分数是_________?(写出计算过程)【答案】4.4 10.6%【解析】【分析】【详解】(1)根据图像可知生成二氧化碳的质量为4.4g ;(2)设该瓶苏打中碳酸钠的质量分数为x ,2322=Na CO +2HCl 2NaCl +H O +CO 10644100g x4.4g↑⨯100gx 106=4.4g 44x=10.6%。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
3.(1)化学实验室现有质量分数为98%的浓硫酸,但实验中常需要用较稀的硫酸。
若要把20.0 g 上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是________ g 。
(2)过氧化钙(CaO 2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为:2CaO 2+2H 2O=2Ca(OH)2+O 2↑。
(化学)初三化学化学方程式的计算及其解题技巧及练习题(含答案)

(化学)初三化学化学方程式的计算及其解题技巧及练习题(含答案)一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6% 【解析】 【分析】 【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠 设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl208142233117104g 20%yzx208104g 20%208104g 20%208104g 20%===117x 142y 233z x=11.7gy=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g100%10.6%205g⨯≈ 答:溶质质量分数为10.6%2.为测定某石灰石矿中碳酸钙的含量,进行了如下实验:称取10g石灰石样品,高温煅烧至质量不再改变,称得剩余固体质量为6.7g(假设杂质不参与反应)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【解析】
【分析】
【详解】
(1)过氧化钙中氧元素的质量分数为:
32 100% 44.4% 40+32
(2)解:设理论上可以制得氧气的质量为 X。
2CaO2 +2H2O=2Ca(OH)2+O 2
144
32
150g 96%
X
144 150g 96%
=
32
X
X=32g
答:理论上可以制得氧气的质量为 32 g。
请回答 : (1)用质量分数为 30%的浓盐酸配制 10%的稀盐酸 100g,需要水 ________________g (结果精 确到 0.1)。 (2)当 a 为 160g 时,消耗盐酸多少克 ?_______________ 【答案】 66.7g 73g
【解析】 【分析】 【详解】 设需要水的质量为 x。 (100g-x)× 30%=100g× 10%
7. 为检测市场销售的小苏打 (主要成分是碳酸氢钠 )的含量,取 5.0g 样品加热到质量不再减
少为止,收集到干燥的气体 0.88g。(碳酸氢钠受热分解的化学方程式为: 2NaHCO3= Na2CO3 +H2O+ CO2↑,杂质不参加反应 )。求该样品中碳酸氢钠的质量分数。 _____ 【答案】 67.2%
80 98
142
80gx 9.8g
y
80gx y 9.8g ==
80 142 98
x=10%, y=14.2g,
(3)往上述 80g 废水中逐渐加入稀硫酸至过量,加入硫酸之前,硫酸钠为
0,所以七点为
0,至加入硫酸溶液 100g,硫酸钠质量达到最大为 14.2g,之后不再变化, Na2SO4 质量随加
CaO + CO2
100
44
m
22t
100 m
44 22t
m=50t
碳酸钙质量
50t
石灰石中碳酸钙质量分数 =
100%=
100%=50%
石灰石质量
100t
答:石灰石中碳酸钙的质量分数为 50%。
9. 用质量分数为 5%的氢氧化钠溶液中和 10%的稀盐酸,反应过程中溶液的酸碱度变化如 图 25 所示。
2NaOH + H 2SO4 = Na 2SO4 + 2H 2O
80
98
25g 20% x
80 25g 20%
98
x
x=6.125g 稀硫酸中溶质的质量分数为:
6.125g 100% 30.6%
20g
答:稀硫酸中溶质的质量分数为 30.6%。
4. 过氧化钙( CaO2)常用于活鱼运输时的增氧剂,过氧化钙与水反应方程式为: 2CaO2+2H2O═2Ca( OH) 2+O2↑.某过氧化钙样品中含有少量不溶于水且不与水反应杂 质,取该样品 15.0g 投入盛有 108.0g 水的烧杯中,缓慢搅拌,充分反应,最终收集到氧气 质量为 3.20g,计算该样品中过氧化钙的质量分数 ____(写出计算过程)。 【答案】 96% 【解析】 【分析】 【详解】 解:设过氧化钙质量为 x,
【详解】
解:理论上可制得铁的质量为 x。
高温
2Al+ Fe2O3 = Al 2O3 + 2Fe
160
112
48kg
x
160 48kg =
112 x
x=33.6kg 答:用足量铝与 48 kg 氧化铁反应,理论上可制得铁的质量是
33.6kg。
2. 铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。反应的化学方程式
入稀硫酸质量变化的曲线如图:
;
(4)设若工厂每天需处理上述废水 8 吨,需要的 98%硫酸的质量为 a,需要的 30%的盐酸的
质量为 b,根据化学方程式 NaOH+HCl=NaCl+H2O,2NaOH+H2SO4=Na2SO4+2H2O 可得:
2HCl 2NaOH H 2SO4
73 80
98
b 8t 10% 98%a
6. 某化学实验室用稀硫酸处理含有氢氧化钠的废水。现取废水样品
80g 倒入烧杯中,加入
几滴无色酚酞溶液,然后逐滴加入 9.8%的稀硫酸,反应过程中溶液的 pH 变化如图所示。
(1)当恰好完全反应时,溶液的颜色变化是 ____________。 (2)求废水中氢氧化钠的质量分数 _______ (写出计算过程 )。 (3)往上述 80g 废水中逐渐加入稀硫酸至过量,请在答题卡中画出 质量变化的曲线 _______。 (4)下表为市面上浓硫酸和浓盐酸的有关数据 :
通电
为 2Al2O3
4Al+ 3O2↑。请计算生成 1.08t 金属铝,理论上需要氧化铝的质量是多少
____?
【答案】 2.04t
【解析】
【分析】
【详解】
解:设生成 1.08t 金属铝,理论上需要氧化铝的质量为 x
通电
2Al 2O3
4Al +3O 2
204
108
x
1.08t
204 x =
108 1.08t
98%a b 8t 10% ==
98 73 80
a=1t, b=0.73t , 所用硫酸的价值为 1t ×1000kg/t ×0元.6 /kg=600 元,所用盐酸的价值为
0.73t ×1000kg/t ×0元.4
/kg=292 元,若工厂每天需处理上述废水 8 吨,选用 浓盐酸更合算,每天可节约 600 元 292 元 =308 元。 【点睛】 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算 过程要完整。
(4)配制 100g 该浓度的稀硫酸需要质量分数为 98%浓硫酸的质量是多少 ____?
【答案】 Cu 17.4 44% 9.8% 10g
【解析】
【详解】
(1)由金属活动性可知,合金中只有锌可以与硫酸反应;由表中的数据可知:第
4 次再加
入 40g 稀硫酸时。第三次剩余固体还能在减少,说明前三次加入的硫酸完全参加了反应;
8. 将 100t 的石灰石高温条件下煅烧使其完全分解,剩余固体质量是
78t,求 : 石灰石中碳
酸钙的质量分数。 _________
【答案】 50%
【解析】
【分析】
【详解】
根据质量守恒定律,固体减少的质量为生成二氧化碳质量,所以生成二氧化碳质量
=100t-
78t=22t 。设碳酸钙质量为 m,
高温
CaCO3
【化学】初三化学化学方程式的计算解题技巧讲解及练习题 ( 含答案 ) 及解析
一、中考化学方程式的计算
1. 高铁快速发展方便了人们的出行。工业上可利用铝和氧化铁在高温下发生置换反应制得
铁来焊接钢轨。若用足量铝与 48 kg 氧化铁反应,理论上可制得铁的质量是多少?
【答案】 33.6kg
【解析】
【分析】
20g
(3)设 40g 稀硫酸中硫酸的质量为 X,
H 2SO4 +Zn = ZnSO4 +H 2 98 65 X 2.6g
X 98 =,
2.6g 65
X=3.92g,
3.92g
稀硫酸中硫酸的质量分数 =
×100%=9.8%;
40g
(4)设需要质量分数为 98%浓硫酸的质量为 Y,则: 100g×9.8%=Y×98%,Y=10g。
HCl 的质量为 y。
10. Cu 与 Zn 的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化
学兴趣小组的同学为了测定某黄铜的组成,取
20g 该黄铜样品于烧杯中,向其中分 5 次加
入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量
记录于下表:
加入稀硫酸的质量( g)
______。
【答案】 Na2SO4、 NaOH 30.6% 【解析】
【分析】 【详解】
(1)氢氧化钠和硫酸反应生成硫酸钠和水,反应后的溶液中一定有硫酸钠,可能有氢氧化
钠或硫酸,在 a 点 pH 大于 7,所以氢氧化钠过量,在溶液中的溶质有: (2)设 20g 稀硫酸中溶质的质量为 x
Na2SO4、 NaOH;
充分反应后剩次
40
14.8
第 3次
40
12.2
第 4次
40
11.2
第 5次
40
11.2
试回答下列问题: (1)从以上数据可知,最后剩余的 11.2g 固体的成分是 ______;表格中, m=______。 (2)黄铜样品中锌的质量分数为 ______。 (3)计算所用稀硫酸中硫酸的质量分数是多少 ____?
x≈ 66.7g 答:需要水的质量为 66.7g。 (2)设氢氧化钠和盐酸恰好完全反应时,消耗
NaOH
HCl = NaCl
40
36.5
160g 5% x
40
36.5
=
160g 5% x
H 2O
y=7.3g 消耗稀盐酸的质量为: 7.3g÷ 10%=73g 答:当 a 为 160g 时所消耗稀盐酸 73g。 故答案为: (1) 66.7; (2) 73g。
x=2.04t 答:生成 1.08t 金属铝,理论上需要氧化铝的质量为
2.04t 。
3. 为测定某未知浓度的稀硫酸溶液的溶质质量分数,取
20g 该稀硫酸溶液,逐滴加入 20%
氢氧化钠溶液 30g,同时用 pH 计测定并记录反应过程中混合溶液 pH 变化情况。请回答下
列问题。
(1) a 点溶液中的溶质的化学式是 ______。 (2)通过计算求出稀硫酸中溶质的质量分数(计算过程中保留一位小数)
物质
纯度 价格 (元 /kg)
