人生长激素(hGH)测定试剂盒(化学发光免疫分析法)产品技术要求科美
促黄体生成素(LH)测定试剂盒(光激化学发光法)产品技术要求kemei

促黄体生成素(LH)测定试剂盒(光激化学发光法)适用范围:本试剂盒用于体外定量测定人血清中促黄体生成素(LH)的含量。
说明:1. 校准品靶值批特异,详见定值单。
2. 质控品质控范围批特异,详见定值单。
2.1 外观试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2 最低检出限试剂盒最低检出限应不高于1.0 IU/L。
2.3 准确性试剂盒内校准品与相应浓度的国家标准品150531同时进行测定,用三次样条插值模型拟合,要求两条剂量-反应曲线不显著偏离平行;以LH国家标准品为对照品,试剂盒内校准品的实测值与标示值的效价比应在0.900~1.100之间。
2.4 剂量-反应曲线的线性在[2.0,200 ]IU/L区间内,用三次样条插值模型拟合,剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度质控品测定结果的变异系数(CV)应不大于8.0%。
2.5.2 批间精密度在3批产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.6 质控品测定值同一套质控品的测定结果应在试剂盒规定的范围内。
2.7 特异性2.7.1 与促卵泡生成素(FSH)浓度为200IU/L的FSH,在本试剂盒上的测定结果应不高于最低检出限。
2.7.2 与促甲状腺素(TSH)浓度为200mIU/L的TSH,在本试剂盒上的测定结果应不高于最低检出限。
2.7.3 与人绒毛膜促性腺激素(hCG)浓度为1000 IU/L的hCG,在本试剂盒上的测定结果应不高于最低检出限。
2.8 稳定性试剂盒在2℃~8℃保存至效期末后3个月内,检验结果应符合2.1、2.2、2.3、2.4、2.5.1、2.6 规定。
2.9 溯源性依据GB/T 21415-2008及有关规定提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准品溯源至国家标准品150531。
人生长激素HGHELISA试剂盒

人生长激素(HGH)ELISA试剂盒(用于血清、血浆、细胞培养上清液和其它生物体液内)本实验采用双抗体夹心ABC-ELISA法。
用抗人HGH 单抗包被于酶标板上,标准品和样品中的HGH 与单抗结合,加入生物素化的抗人HGH,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin 与生物素结合,加入底物工作液显蓝色,最后加终止液硫酸,在450nm处测OD值,HGH浓度与OD值测,2-8℃保存48小时;更长时间须冷冻(-20℃或-70℃)保存,避免反复冻融。
2.标准品液配制:使用前加入1ml蒸馏水混匀,配成40ng/ml的溶液。
设标准管8管,第一管加标本稀释液900ul,第二至第八管加入标本稀释液500ul。
在第一管中加入40ng/ml的标准品溶液100ul混匀后用加样器吸出500ul,移至第二管。
如此反复作对倍稀释,从第七管中吸出500ul弃去。
第八管为空白对照。
3.10×标本稀释液用蒸馏水作1:10倍稀释(示例:1ml浓稀释液+9ml蒸馏水)。
4. 洗涤液:用重蒸水1:20稀释(示例:1ml浓缩洗涤液加入19ml的重蒸水)检测程序1.加样:每孔各加入标准品或待测样品100ul,将反应板充分混匀后置37℃120分钟。
2.洗板:用洗涤液将反应板充分洗涤4-6次,向滤纸上印干。
3.每孔中加入第一抗体工作液100ul。
将反应板充分混匀后置37℃60分钟。
4.洗板:同前。
5.每孔加酶标抗体工作液100ul。
将反应板置37℃30分钟。
6.洗板:同前。
7.每孔加入底物工作液100ul,置37℃暗处反应15分钟。
8.每孔加入100ul终止液混匀。
9.30分钟内用酶标仪在450nm处测吸光值。
结果计算与判断1.所有OD值都应减除空白值后再行计算。
2.以标准品4000、2000、1000、500、250、125、62.5、0 pg/ml为横坐标,OD值为纵坐标,在坐标纸上作图,画出标准曲线。
生长激素(hGH)测定试剂盒(化学发光免疫分析法)产品技术要求深圳雷杜
1.性能指标1.1外观1.1.1M:免疫磁珠应为棕褐色或黄褐色悬浊液,静置久后,棕(黄)褐色磁珠沉于底部,上清应为澄明液体;1.1.2R:酶结合物应为无色或乳白色澄明液体;1.1.3校准品和质控品应为无色或乳白色澄明液体。
1.2净含量液体试剂的净含量应不少于标示值,具体标示值见下表。
1.3空白限应不大于0.015ng/mL。
1.4线性试剂盒在0.02~35ng/mL 浓度区间内,其相关系数r 应不低于0.9900。
1.5准确度用生长激素国家标准品配制成要求的浓度进行检测,其测量结果的相对偏差不超过±10 .0%。
1.6重复性变异系数CV≤8.0%。
1.7批间差变异系数CV≤15.0%。
1.8分析特异性1.8.1类似物试验测定浓度不低于2000mIU/L 的泌乳素样本,其测定结果应不大于0.5ng/mL。
1.8.2干扰物试验样本中添加以下浓度的化合物,测定结果较对照样本偏差不超过±10% 。
检测物质检测浓度胆红素400μmol/L血红蛋白 4.0g/L甘油三酯800mg/dL生物素20ng/mL1.9质控品准确度质控品测定值应在试剂盒规定的质控范围内。
1.10质控品瓶内均一性≤10%。
变异系数CV瓶内1.11质控品瓶间均一性变异系数CV≤15%。
瓶间1.12校准品准确度相对偏差不超过±10%。
1.13校准品瓶内均一性变异系数CV≤10%。
瓶内1.14校准品瓶间均一性变异系数CV≤15%。
瓶间。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204(可编辑修改word版)

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017 版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242 号)化学发光免疫类体外诊断试剂(盒)产品分类代号为 6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第44 号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
生长激素(GH)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求runnuosi
生长激素(GH)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人血清中生长激素的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒。
1.2主要组成成分表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度检测浓度为5 ng/ml(允许偏差为±20%)的国家药品标准物质(编号:140635),其检测结果的相对偏差应在±10%范围内;2.3空白检测限应不大于0.01 ng/ml。
2.4线性在(0.05,40)ng/ml的检测范围内,试剂盒的相关系数r应≥0.99。
2.5重复性用两个质控品作为样本各重复检测10次,其变异系数(CV)均应≤10%。
2.6质控品测值质控品检测结果均应在质控范围内。
2.7批间差用三个批号试剂盒分别检测质控品1和质控品2,两个质控品检测结果的批间变异系数(CV)均应≤15.0%。
2.8分析特异性将潜在交叉物质添加到含有18ng/ml(允许偏差为±15%)生长激素(GH)的基础样本中使其达到下表浓度,添加前后检测值偏差在±15%范围内,则认为本试剂盒与该物质没有明显交叉。
表2 潜在交叉物质浓度及交叉率要求2.9溯源性根据GB/T21415-2008及有关规定提供所用生长激素(GH)校准品的来源、赋值过程及测量不确定度等内容,溯源至生长激素(GH)国际参考物质(WHO98/574)。
2.10稳定性试剂盒2℃~8℃储存,避免阳光直射,有效期为12个月,取失效后两个月内的样品进行检测,应符合2.1~2.6的要求。
促肾上腺皮质激素(ACTH)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于1 pg/mL。
2.5线性
试剂盒在1 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。
生长激素(GH)测定试剂盒(化学发光法)产品技术要求新产业
生长激素(GH)测定试剂盒(化学发光法)
型号、规格
100测试/盒、50测试/盒
结构及组成
由磁性微球溶液、发光标记物、荧光素标记物、低点校准品、高点校准品和质控品组成。
产品适用范围/预期用途
本试剂用于定量测定人血清内生长素(GH)的含量。
2.性能指标
2.1外观
a)试剂盒的外观应整洁,标识应清晰、准确、牢固;
2.3.1批内精密度
批内变异系数(CV)应≤5%。
2.3.2批间精密度
批间变异系数(CV)应≤10%。
2.4准确度
相对偏差应在±10 %范围内。
2.5空白限
试剂盒的空白限应小于0.05 ng/mL。
2.6线性
在(1.0-50.0) ng/mL浓度范围内,线性相关性系数(r)绝对值应大于0.9800。
1 /5
b)试剂盒内液体(除磁球外)应清晰,无沉淀及絮状物。
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表1
名称
数量
mL/瓶
100测试/盒
50测试/盒
磁性微球溶液Байду номын сангаас
1
2.5
2.0
发光标记物
6.5
4.0
荧光素标记物
6.5
4.0
低点校准品
2.5
2.0
高点校准品
2.5
2.0
质控品
1.0
1.0
2.3精密度
人生长激素测定试剂盒(化学发光免疫分析法)产品技术要求mairui

1 性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量应不少于试剂的标示装量值。
2.3准确度2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限应不大于0.02 ng/mL。
2.5线性试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性变异系数CV 应≤ 5%。
2.7批间差变异系数CV 应≤ 10%。
2.8校准品均一性2.8.1校准品瓶内均一性C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II1型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
2。
科美光激发化学发光试剂说明书光激化学发光法

科美光激发化学发光试剂说明书光激化学发光法光激化学发光法(Luminescence)是一种测量化学反应释放的能量或激发的光的方法。
科美光激发化学发光试剂通常用于生物检测、化学分析、环境监测等领域。
以下是关于科美光激发化学发光试剂的一般说明:1. 原理:光激化学发光法基于化学反应释放的能量或激发的光。
这些能量或光可以通过特定的检测器进行测量,以确定反应是否发生或反应的程度。
2. 试剂组成:科美光激发化学发光试剂通常包含反应所需的化学物质、激发剂和可能的缓冲液。
这些试剂被设计成在特定的光激发下产生化学发光。
3. 使用方法:根据具体的应用和实验设计,使用科美光激发化学发光试剂的方法可能会有所不同。
一般而言,用户需要按照试剂说明书进行操作,将试剂与待测样品混合,然后通过测量产生的光来确定待测样品的浓度或活性。
4. 注意事项:使用科美光激发化学发光试剂时,需要注意避免直接接触试剂,以免可能对皮肤或眼睛造成刺激。
此外,应确保试剂储存于避光、干燥的地方,并按照说明书规定的温度和条件进行保存。
5. 优点与局限性:光激化学发光法的优点包括高灵敏度、高特异性以及相对较低的成本。
然而,这种方法可能受到背景噪声和其他潜在干扰的影响,因此在使用前应进行充分的验证和优化。
6. 应用范围:科美光激发化学发光试剂广泛应用于各种领域,如生物学、医学、环境科学等。
它们可用于检测生物标记物、药物、污染物以及其他目标物质。
由于不同版本的试剂说明书可能会有所不同,建议在具体使用前仔细阅读科美光激发化学发光试剂的说明书,并遵循制造商提供的操作建议和注意事项。
如有任何疑问,建议咨询相关领域的专家或与制造商联系以获取更多指导。
生长激素检测标准操作规程

生长激素检测标准操作规程一、目的:规范人生长激素测定的标准操作程序,确保人生长激素测定的结果准确有效。
二、适用范围:在AutoLumo A20化学发光检测仪上定量测定人血清中的人生长激素。
三、临床意义HGH是由垂体前叶细胞分泌的一种多肽激素,在人体内可以刺激生长和促进细胞增殖。
它是一个包含191个氨基酸的单链多肽激素,分子量为22124道尔顿。
由脑垂体前叶的生长激素细胞合成,储存和分泌[1]。
HGH病理性增高常见于:(1脑垂体腺瘤、癌或HGH分泌细胞增生;(2)脑垂体以外的组织分泌异源性HGH,如胰腺癌、支气管类癌等癌组织;(3)生长发育期HGH分泌过多导致巨人症,成人HGH分泌过多导致肢端肥大症。
HGH病理性降低常见于:(1冼天性HGH缺乏症,若不能及时治疗,多发展为侏儒症;(2)继发性HGH缺乏症,如肿瘤压迫、感染、手术、外伤等原因损伤下丘脑一垂体及其周围组织,致HGH分泌不足,此症可随发病年龄不同而轻重表现不同;(3)生长激素缺乏症又称垂体性侏儒症2-3]。
检测HGH在血清及血浆中的含量对诊断儿童HGH缺乏导致的生长迟缓,成人HGH过高导致的肢端肥大症具有重要的意义,同时可帮助诊断能引起HGH分泌异常的垂体肿瘤。
四、方法原理本试剂盒采用夹心法原理进行检测。
用HGH抗体包被磁微粒,辣根过氧化物酶标记HGH抗体制备酶结合物。
通过免疫反应形成抗体-抗原-酶标抗体复合物,该复合物催化发光底物发出光子,发光强度与HGH的含量成正比。
五、标本的采集与处理5.1.采用正确医用技术收集血清或血浆样本(血浆样本推荐使用肝素钠抗凝血浆,避免使用枸橼酸钠和EDTA抗凝剂)。
5.2.样本中的沉淀物和悬浮物可能会影响试验结果,应离心除去。
5.3.严重溶血、脂血或浑浊的样本不能用于测定。
5.4.样本收集后在室温放置不可超过8小时;如果不在8小时内检测需将样本放置在28C的冰箱中;若需48小时以上保存或运输,则应冻存于-20C以下,避免反复冻融。
9生长激素生物活性的测定方法中国药品检验标准操作规范

生长激素生物活性的测定方法一、去垂体大白鼠体重法1 实验材料及用具1.1 天平精度0.01mg 供试品称量用精度1mg 试剂称量用精度0.1g 大鼠称重用1.2 实验用具手术板、注射器(1ml,精度0.01ml)、吸管、移液管、带塞玻璃小瓶、烧杯、玻璃棒、量筒、脱脂棉。
1.3 手术器械手术剪、直镊、眼科剪、眼科直镊、眼科弯剪、牙科钻、钻头、抽滤瓶、真空泵、牙科刮勺、止血钳。
1.4 试剂氯化钠、牛血清白蛋白、乌拉坦。
2 溶液配制2.1 生理盐水称取氯化钠适量,加水配成0.9%的溶液。
2.2 牛血清白蛋白的生理盐水溶液,称取牛血清白蛋白适量,加生理盐水配成0.1%的牛血清白蛋白的生理盐水溶液,简称溶媒。
2.3 乌拉坦溶液称取乌拉坦适量,加生理盐水配成25%的乌拉坦溶液。
2.4 标准品溶液2.4.1 实验当日,取生长激素标准品,放置至室温。
2.4.2 割开安瓶(注意勿使内容物损失)立即按标示效价精确加以定量溶媒将全部内容物洗出,使成1.0IU/ml的标准品溶液;亦可精密加入适量溶媒使溶解,混合均匀,精密吸取适量,用溶媒配制成1.0IU/ml的标准品溶液。
2.5 标准品稀释液2.5.1 按《中国药典》附录生长激素生物检定法的要求,选择标准品高(d S2)、低(d S1)2组剂量及剂距。
2.5.2 计算2组剂量稀释液浓度及大鼠6天内皮下注射的总毫升数,一般高浓度稀释液可配成每1ml中含0.10~0.25IU(随季节、动物品系和来源不同),低浓度稀释液可配成每1ml中含0.025~0.06IU,高、低两浓度比值r=1:0.25,每鼠皮下注射每天0.5ml/次,连续6天,每组至少8只,例如:高浓度稀释液d S2=0.1IU/ml×0.5ml/(天.鼠)×6天×8鼠/组=2.4IU/组,即0.1IU/ml高浓度稀释液24ml低浓度稀释液d S1=0.025IU/ml×0.5ml/(天.鼠)×6天×8鼠/组=0.6IU/组,即0.025IU/ml低浓度稀释液24ml2.5.3 精密量取1.0IU/ml标准品溶液适量,置50ml烧杯中,加入溶媒适量成标准品d S2稀释液(如0.1IU/ml)。
HGH质量检定实验
产品质量研究对于rHGH产品的质量研究贯穿整个实验室研究、中试研究过程,并对工艺各阶段进行严格的质量控制,确保产品的高质量。
对中试产品的质量控制分两方面进行:1. 半成品/成品的质量控制;2. 成品的质量控制。
均严格按照《中国生物制品检定规程》(2000版)中各相关规定与程序进行。
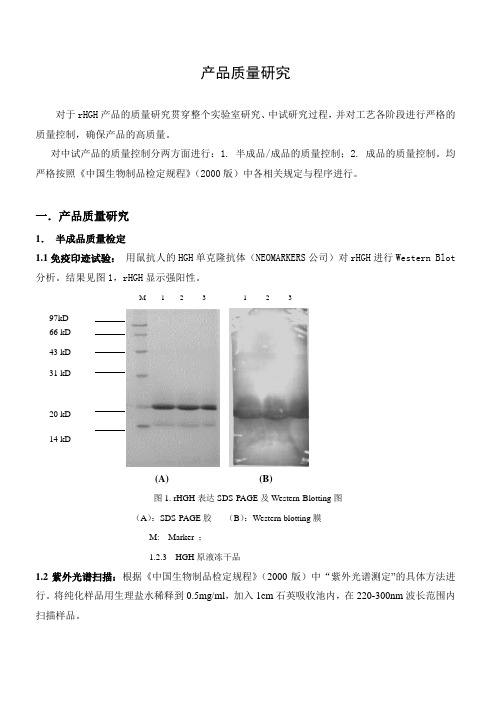
一.产品质量研究1.半成品质量检定1.1免疫印迹试验:用鼠抗人的HGH单克隆抗体(NEOMARKERS公司)对rHGH进行Western Blot 分析。
结果见图1,rHGH显示强阳性。
M 1 2 3 1 2 397kD66 kD43 kD31 kD20 kD14 kD(A) (B)图1. rHGH表达SDS-PAGE及Western-Blotting图(A):SDS-PAGE胶(B):Western blotting膜M: Marker ;1.2.3 HGH原液冻干品1.2紫外光谱扫描:根据《中国生物制品检定规程》(2000版)中“紫外光谱测定”的具体方法进行。
将纯化样品用生理盐水稀释到0.5mg/ml,加入1cm石英吸收池内,在220-300nm波长范围内扫描样品。
图2-1 批号rHGH扫描图图2-2: 20020902批号rHGH半成品扫描图同时还扫描另外2个批号半成品,特征波长如下:样品特征峰波长nm 吸光值20020901 2790.42417200209022790.41222200209032790.43200可见,本产品蛋白质特征峰在277±3nm范围内1.3 纯度及分子量检测a. SDS-PAGE电泳:用非还原型SDS-PAGE法检测样品的纯度,还原型SDS-PAGE法检测样品的分子量,将待检样品加上样品缓冲液,加热5分钟,上样,使加样量不低于5μg(银染法)或10μg (考马氏亮蓝R-250染色法),经Pharmacia VDS扫描分析。
a b c a b‘c‘ a b‘’c’’图3-1.半成品还原、非还原SDS-PAGE电泳a.Markerb.2012011批号rHGH还原处理c.2012011批号rHGH非还原处理b’ . 2012012批号rHGH还原处理c’2012012批号rHGH非还原处理b’’2012017批号rHGH还原处理c’’2012017批号rHGH非还原处理扫描结果如下:样品名称主带扫描面积%分子量(Da)20121011 98.5 2201520121012 97.9 2220420121017 99.5 22125可见,半成品迁移位置一致,连续3批半成品扫描纯度达到95%以上,连续3批半成品分子量为22125±205.92,说明用非还原电泳检测蛋白纯度和用还原电泳检测蛋白分子量方法可信。
人体生长激素hGH测定标准操作规程

人体生长激素hGH测定标准操作规程1 检验目的规范本实验室的检验操作,确保人体生长激素(hGH)检测结果及报告的准确性、可靠性和有效性。
2 标本采集与处理2.1 标本采集2.1.1 常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2 检验申请单和血标本试管标上统一且唯一的标识符(条码)。
2.1.3 急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4 标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1 标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2 对于测定和吸样有干扰的标本:如近期使用鼠源性单克隆抗体诊断后采取。
2.1.5.3 无法确认标本与申请单对应关系的。
2.1.5.4 其他如标识涂改、标本试管破裂等。
2.2 标本保存2.2.1 接收标本后在30min内将标本离心分离出血清, 避免溶血。
离心必须达到4000rpm×15min,离心后的血清中不能含有颗粒物或微量纤维蛋白。
2.2.2 标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定48h。
需较长时间保存应将血清存放于-20℃。
冰冻标本仅可冻融一次。
2.2.3 已完成测试的标本保持完整的识别号,置2~8℃冰箱内保存7d。
2.3 标本采集的注意事项2.3.1 采血前使受检者保持平静、松弛、避免剧烈活动。
2.3.2 采血后应使血液充分凝固,不建议使用抗凝的血液标本。
3 方法原理一步酶免法(“夹心法” )测定。
将样本与多克隆山羊抗hGH碱性磷酸酶结合物和包被着小鼠单克隆抗hGH 抗体的顺磁性微粒添加到反应管中。
血清或血浆(肝素) hGH和单克隆抗 hGH在固相上结合,而山羊抗hGH碱性磷酸酶结合物和血清或血浆hGH上的不同抗原位点反应。
在反应管内温育完成后,结合在固相上的物质将置于一个磁场内被吸住,而未结合的物质将被冲洗除去。
人生长因子(HGH)酶联免疫分析试剂盒使用说明书

人生长因子(HGH)酶联免疫分析试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定大鼠血清,血浆及相关液体样本中生长因子(HGH)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人生长因子(HGH)水平。
用纯化的人生长因子(HGH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入生长因子(HGH),再与HRP 标记的生长因子(HGH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品的生长因子(HGH)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人生长因子(HGH)浓度。
试剂盒组成:试剂盒组成 48 孔配置 96 孔配置保存说明书 1 份 1 份封板膜 2 片(48) 2 片(96)密封袋 1 个 1 个酶标包被板 1×48 1×96 2-8℃保存标准品:45ng/L 0.5ml×1 瓶 0.5ml×1 瓶 2-8℃保存标准品稀释液 1.5ml×1 瓶 1.5ml×1 瓶 2-8℃保存酶标试剂 3 ml×1 瓶 6 ml×1 瓶 2-8℃保存样品稀释液 3 ml×1 瓶 6 ml×1 瓶 2-8℃保存显色剂A 液 3 ml×1 瓶 6 ml×1 瓶 2-8℃保存显色剂B 液 3 ml×1 瓶 6 ml×1 瓶 2-8℃保存终止液 3ml×1 瓶 6ml×1 瓶 2-8℃保存浓缩洗涤液(20ml×20 倍)×1 瓶(20ml×30 倍)×1 瓶 2-8℃保存样本处理及要求:1. 血清:室温血液自然凝固10-20 分钟,离心20 分钟左右(2000-3000 转/分)。
HGH产品介绍

HGH产品介绍一、HGH是什么?生长激素HGH是由脑下垂体前叶所分泌,分泌HGH的细胞叫Somatotrophes。
脑下垂体前叶有50%的细胞是Somatotrophes。
它所分泌出来最多的Hormone是HGH,当HGH分泌出来后,就进入血液,接着被肝脏所吸收,再于肝脏中转变成不同的生长激素来进行各种生化作用,其中以类生长因子1型(IGF-1)最重要;身体内每一个器官的发育生长,都需要HGH和各种的生长激素。
HGH的分泌是依照生理时钟变化来进行;以晚上分泌最多(11:00PM 到l:00AM)。
其它许多因素也可刺激HGH的分泌,像运动,压力,情绪、兴奋以及饥饿,包括节食等;而肥胖及游离脂肪酸与糖份能抑制它的分泌。
HGH的分泌随着年龄而减少,从21到31岁以后,每十年减少14%,因此60岁时只有年轻人的一半;80岁时只有年轻人的五分之一。
二、你是否也缺乏HGH?1.工作时会不会常常觉得疲倦,没有力气?2.是不是常常觉得紧张,容易沮丧,或是容易有情绪不稳定?3.你常作运动也注意饮食,但仍然体重过重,肚子和臀部仍然不断的增加脂肪?4.你走不是常觉得工作负担太重?5.你的皮肤是否太干燥,开始有皱纹?6.你是否容易忘记事情;是否常常需要借助记忆标签来协助你记忆?7.你觉得你看起来比你实际的年龄老吗?8.你对异性的兴趣有没有减低?你的性生活如何?9.你的头颈部、上臂内侧及腹部,是否开始突出?10.你是否常觉得运动乏力?运动时喘得厉害?11.你是否常容易失眠或睡不安稳?或醒来后仍然疲惫?12.你有没有胆固醇过高的毛病?或高血压的毛病?13.你是否很容易生病?14.你是否不容易集中注意力?或不容易专心思考?如果你对这些问题的回答大部分是“是”,那么你已经很可能缺乏HGH,但是最可靠的方法还是检查血液中IGF-l的含量。
(查血中HGH的含量,比较麻烦,要连续查2~4小时,每20分钟检验一次。
)HGH如何恢复青春,生长激素有下列与许多好处。
人生长激素(hGH)测定试剂盒(电化学发光免疫分析法)产品技术要求lianda

人生长激素(hGH)测定试剂盒(电化学发光免疫分析法)产品技术要求lianda人生长激素(hGH)测定试剂盒(电化学发光免疫分析法)组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(hGH-Cal)(选配)组成。
组成及含量见下表:适用范围:本试剂盒用于体外定量测定人体血清样本中人生长激素(hGH)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.03 ng/mL。
2.3 准确度用hGH国家标准品(150534)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[0.10,50.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 重复性在试剂盒的线性范围内,测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6特异性测定浓度不低于2000mIU/L的泌乳素样本,其测定结果不大于0.5ng/ml。
2.7效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供人生长激素(hGH)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至国家标准品(150534)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人生长激素(hGH)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人血清中人生长激素(hGH)的含量。
2.1外观
组分齐全、完整;标签清晰,无磨损;液体试剂无渗漏,无混浊、沉淀或絮状物;包被板包装袋无破损、漏气现象。
2.2准确性
试剂盒校准品与国家标准品(534)同时测定,以国家标准品为标准,试剂盒校准品的实测值与标示值之比应在0.90~1.10的范围内。
2.3剂量反应曲线的线性
用双对数数学模型拟合,在校准浓度范围(5~100mIU/mL)内,剂量反应曲线的相关系数r(绝对值)应不小于0.9900。
2.4 空白检出限
不大于0.5mIU /mL。
2.5 重复性
用低、高两个浓度水平的质控血清,各重复检测10次,其变异系数(CV)应满足:仪器自动操作法应不大于10.0%,手工操作法应不大于15.0%。
2.6 批间差
用三个批号试剂盒,分别检测同一质控血清,三个批号试剂盒之间的变异系数(CV)应不大于15.0%。
2.7质控血清测定值
质控血清测值应在允许的质控范围内(±2SD)。
2.8 稳定性
2℃~8℃保存,有效期12个月。
