组蛋白磷酸化涉及的酶
表观遗传:组蛋白甲基化、磷酸化解决方案

表观遗传:组蛋白甲基化、磷酸化解决方案组蛋白修饰(histone modification)是指组蛋白在相关酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化、泛素化、ADP核糖基化等修饰的过程。
今天我们来重点说说组蛋白甲基化、组蛋白磷酸化。
一、组蛋白甲基化组蛋白甲基化是由组蛋白甲基化转移酶(histonemethyl transferase,HMT)完成的。
甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够发生单、双、三甲基化,而精氨酸残基能够单、双甲基化,这些不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性。
甲基化的作用位点在赖氨酸(Lys)、精氨酸(Arg)的侧链N原子上。
组蛋白H3的第4、9、27和36位,H4的第20位Lys,H3的第2、l7、26位及H4的第3位Arg都是甲基化的常见位点。
研究表明·,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关,而H3和H4精氨酸的甲基化丢失与基因沉默相关。
相反,赖氨酸甲基化似乎是基因表达调控中一种较为稳定的标记。
例如,H3第4位的赖氨酸残基甲基化与基因激活相关,而第9位和第27位赖氨酸甲基化与基因沉默相关。
此外,H4—K20的甲基化与基因沉默相关,H3—K36和H3—K79的甲基化与基因激活有关。
但应当注意的是,甲基化个数与基因沉默和激活的程度相关。
【1】组蛋白甲基化定量组蛋白甲基化位点主要发生在H3和H4上面赖氨酸(K)和精氨酸(R)上,且能够发生单、双、三甲基化等。
要按照数学的排列组合,那也是蛮多类型了,举例EpiQuik 组蛋白H3修饰多重检测试剂盒(比色法)(96 次),P-3100-96,EpiQuik组蛋白H3修饰定量试剂盒(比色法)是一组完全的、优化的试剂组合,可以同时定量H3上面21个修饰方式,是一个简单的Elisa检测方法。
【2】组蛋白甲基转移酶(HMTs)分析测定组蛋白甲基化修饰的时候,需要甲基转移酶来进行催化。
景杰生物:磷酸化修饰蛋白质组学

16
磷酸化蛋白质组学分析
降低样品复杂度
规模化分析
特异性富集方法 有效预分级方法 IMAC/MOAC C18/SCX/HILIC
Nat. Protocol, 2013, 8, 461-480.
17
磷酸化蛋白质组学分析策略
常用 定量 方法
绝对定量 MRM
Spectral counts
无标记定量
色谱峰面积
calcium calmodulin kinase IV (CaMKIV)
Annu. Rev. Biochem. 2011, 80:825–858.
钙调蛋白激酶4
12
Cross-talk with Ubiquitination
Mol. Cell, 2007, 28(5), 730-738.
13
Cross-talk with Ubiquitination and Acetylation p53 stabilization
Tauopathy (Tau蛋白病) Alzheimer’s disease
Trends Mol. Med., 2009, 15(3), 112-119.
10
mTOR磷酸化和细胞自噬
mTORC1复合体
Nat. Cell. Biol., 2011, 13(2), 132-141.
11
Cross-talk with O-GlcNAc
20
肝脏组织的磷酸化蛋白质组
J. Proteomics, 2014, 96, 253–262.
21
PTM-Biolabs
谢谢!
18
三、磷酸化蛋白质组学的应用
样品类型
某细胞 某细胞
项目类型
SILAC SILAC
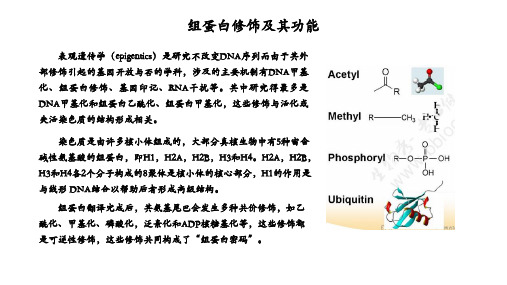
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯讲解学习

表观遗传学(epigentics)是研究不改变DNA序列而由于其外 部修饰引起的基因开放与否的学科,涉及的主要机制有DNA甲基 化、组蛋白修饰、基因印记、RNA干扰等。其中研究得最多是 DNA甲基化和组蛋白乙酰化、组蛋白甲基化,这些修饰与活化或 失活染色质的结构形成相关。
染色质是由许多核小体组成的,大部分真核生物中有5种富含 碱性氨基酸的组蛋白,即H1,H2A,H2B,H3和H4。H2A,H2B, H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是 与线形 DNA结合以帮助后者形成高级结构。
组蛋白翻译完成后,其氨基尾巴会发生多种共价修饰,如乙 酰化、甲基化、磷酸化,泛素化和ADP核糖基化等,这些修饰都 是可逆性修饰,这些修饰共同构成了“组蛋白密码”。
1. 组蛋白乙酰化
核心组蛋白乙酰化反应多发生在核心组蛋白 N端碱性氨基 酸集中区的特定 Lys 残基。组蛋白乙酰化由组蛋白乙酰转移酶 (histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)协调进行。HAT通过将乙酰辅酶 A 的乙酰 基转移到 Lys 的NH+,中和掉一个正电荷。 HDAC使组蛋白去乙 酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因的 转录受到抑制。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色 体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心 组蛋白乙酰化,进而使DNA与组蛋白结合减弱,核小体释放,转录因子和RNA聚合酶可以 与DNA上特异的启动子结合,启动靶基因的转录。
蛋白质磷酸化与非磷酸化

改变靶蛋白质的活性。如:糖原合成酶磷酸化后,停止合成 糖原。
3、DAG与IP3的协调作用 IP3- →细胞质中Ca2 + ↑-→ 糖原合成酶活性↑ 蛋白激酶C- →使IP3 诱导增高糖原磷酸化酶活性的过
程终止。
4、DAG的激活机理 DAG-→ 增加蛋白激酶C对Ca2 + +的亲合性-→ 在Ca2
结构与功能
2个调节亚基(R)+2个催化亚基(C)→PKA全酶复合体 (R2C2)(无cAMP时,无活性)
cAMP与特异R亚基结合→构象变化→成为R亚基二聚体+2个有活 性C亚基,各种哺乳动物细胞可不同水平表达3种C亚基亚型 (CαCβCγ)和4种R亚基亚型(RⅠ α RⅠ β RⅡ α RⅡ β) →结 合成全酶PKA Ⅰ型和 Ⅱ型.
根据是否有调节物来分又可分成两大类: 信使依赖性蛋白质激酶(messenger-dependent protein
kinase),包括胞内第二信使或调节因子依赖性蛋白激酶及激 素(生长因子)依赖性激酶两个亚类;非信使依赖型蛋白激酶。
蛋白激酶的催化作用: 调节酶磷酸化 (1)磷酸化酶激酶P—激活 (2)糖原合成酶P—失活
+生理水平上被活化。蛋白激酶C为 77kd , 催化区抑制调节区, 当DAG结合到蛋白激酶C上,解除酶的调节区的抑制作用,使酶 发挥催化活性。
4)cGMP依赖的蛋白激酶 (cGMP dependent protein kinase,,GPK)
1963年从肾脏首次发现cGMP
5)DNA依赖的蛋白激酶( DNA dependent protein kinase,DNA-PK)
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯
组蛋白密码学说的完善: 1. 更好地开发新药。研究组蛋白密码对药物开发具有战略
意义,多种组蛋白修饰酶已成为相关疾病治疗的靶目标。比如,组蛋白去乙酰酶
(HDACs)抑制剂已应用于临床治疗多种肿瘤; 2. 深入探讨遗传调控和表观遗传调控相互作用的网络与不同生物学表型之间的关系;
3. 在控制真核基因选择性表达的网络体系内进一步深入理解染色质结构、调控序列以
②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核
小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管);
③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表
达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用;
及调控蛋白之间交互作用的内在机制; 4. 建立基因表达的调控网络数据库及其分析系统。总之,随着越来越多组蛋白核心结
构区域和修饰方式的确定,组蛋白密码在基因调控过程中的作用会越来越明确。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色
体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心
组蛋白修饰酶对基因转录的调控_邢欣荣

生理科学进展 2008年第 39 卷第 4期
组蛋白修饰酶对基因转录的调控 *
邢欣荣 刘宇博 程智逵 伍会健 ■
(大连理工大学 环境与生命学院 , 辽宁大连 116024)
摘要 基因在转录过程中 , 需招募多种组蛋白修饰酶来对组蛋白进行化学修饰 , 这些化学修饰包 括 :组蛋白的甲基化 、乙酰化 、磷酸化 、泛素化和 SUMO化等 。 大多数组蛋白修饰酶能与不同的转 录因子形成复合物 , 并引起组蛋白和 DNA之间相互作用的改变 , 从而调控基因的转录 。 本文总结 了各种组蛋白修饰酶复合物的组成 、结构及功能方面的研究进展 。 关键词 组蛋白修饰酶 ;基因转录 ;转录调控 中图分类号 R73
一 、组蛋白乙酰转移酶 、去乙酰化酶对基因转录 的调控
组蛋白是碱性蛋白质 , 通常带正电荷 , 能与带负 电荷的 DNA分子结合 , 从而遮蔽了 DNA分子 , 妨碍 了转录 。近年来 , 发现大量与转录有关的调控因子 能修饰组蛋白 , 其中 p300/CBP、Gcn5、p/CAF、SRC1、TIF2、p/CIP、TAFⅡ 250等都具有组蛋白乙酰转移 酶 (HAT)的活性 [ 1] 。
TAFⅡ 250 是基因转 录过程的 辅激活因 子 , 是 TFⅡ D复合物中最大的构成因子 。 TFⅡ D具有 TATA盒结合蛋白 (TBP)功能域 。 当其与 TATA盒结 合时 , 随即与 TFⅡ A~ TFⅡ H形成前起 始复合物 (preinitiationcomplex)。 TAFⅡ 250 具有激酶活性 , 能磷酸化自身和 TFⅡ F。此外 , 其还有 HAT酶活性 和两个 Bromo结构域 , 能识别和结合到乙酰化的组 蛋白 H4上 [ 2] 。
近年来 , 表观遗传学 (epigenetics)已成为生物 医学领域研究的热点 , 而组蛋白修饰因其形式多样 、 涉及的酶十分丰富被认为是研究的难点 。 组蛋白修 饰酶广泛存在于真核生物的基因转录过程中 , 是由 多种蛋白质组成的 , 在组蛋白和 RNA聚合酶 II之 间发挥修饰 、调控和桥梁的作用 。 在转录调控过程 中 , 组蛋白修饰酶的作用极其重要 , 这些不同形式的 酶复合物 , 其修饰有的能促进基因转录的激活 , 而有 的则起抑制作用 。 因此 , 弄清这些组蛋白修饰酶复 合物的组成成分和功能 , 对了解基因转录调控的机 制具有非常重要的意义 。
蛋白磷酸化与蛋白激酶

蛋白激酶、蛋白磷酸酶与信号转导
一、 蛋白激酶
蛋白磷酸化是多种信号转导途径中 的重要环节,细胞内大部分重要的生命过 程都涉及蛋白磷酸化。
可逆的蛋白质磷酸化:
ATP 蛋白激酶 蛋白质 蛋白磷酸酶 Pi H2O 蛋白质 P ADP
蛋白激酶(protein kinase,PK):
是一类磷酸转移酶,其作用是将 ATP 的 - 磷酸基转移到底物特定的氨基 酸残基上,使蛋白质磷酸化, 发挥其生理 生化功能。
SH2能特异地识别磷酸化的酪氨酸残 基以及磷酸化残基的羧基端氨基酸序列并 与其相互结合。 SH2的主要功能是介导胞质内多种信 号蛋白的相互连接,形成蛋白异聚体复合 物,从而调节信号传递。
Cterminal PLC SH2 domain
c)SH3结构域
可见于多种胞质信号蛋白及肌动蛋白 结合蛋白中。 SH3识别的部位是一些富含脯氨酸的 区域PXXP。 功能:参与PTK介导的蛋白质间的相 互作用,可能在亚细胞定位和细胞骨架蛋 白相互作用中起作用。
(一)蛋白激酶的结构
共同的结构特征:
• 保守的催化结构域/亚基
• 调节结构域/亚基
• 其他功能结构域
PKC
1. 催化结构域/亚基
催化核心含有12个高度保守的亚区。
功能: • 与蛋白质或多肽底物结合; • 与磷酸供体ATP/GTP结合; • 转移磷酸基到底物相应的氨基酸残基上。
2. 调节结构域/亚基
NH HC CH2 O C OH NH HC CH2 O C O O P O O
(1)蛋白激酶A(protein kinase A,PKA)
即cAMP依赖性蛋白激酶。
全酶存在胞浆,被cAMP激活后,催化亚 基可① 调节代谢;②调节离子通道;③调 节其他信号转导途径的蛋白;④ 进入细胞 核调节基因表达。
蛋白质磷酸化修饰在多聚谷氨酰胺疾病中的研究进展

蛋白质磷酸化修饰在多聚谷氨酰胺疾病中的研究进展周亚芳△江泓△汤建光△唐北沙【摘要】多聚谷氨酰胺(polyglutamine,polyQ)疾病是一大组常见的神经退行性疾病,疾病的发生源于致病基因编码区CAG三核苷酸重复扩展突变导致基因的编码蛋白——p01yQ蛋白产生多聚谷氨酰胺扩展突变。
p0№疾病的发病机制目前虽然尚未得到完全阐明,但越来越多的研究表明蛋白质的磷酸化修饰在亨廷顿舞蹈病、齿状核红核苍白球路易氏体萎缩症、延髓脊肌萎缩症、遗传性脊髓小脑型共济失调1型、遗传性脊髓小脑型共济失调3型/马查多.约瑟夫病等疾病的发生发展中发挥了重要的作用。
【关键词】多聚谷氨酰胺疾病;蛋白质磷酸化;核内包涵体Theadvancesinresearchphosphorylationofpolyglutaminedisease。
ZHOUYa-fan91△,Jb“VGllon91△,TANG励卜班矿,TANGBei-shal.1(玖妒删ofNeurology,Xio哪aHospital,GerardSD砒University,Cha增sha,Hunan,410008P.R.Ch/na);2(TheSecondXio愕,yaHospital,CentralSouthUniversity,Changsha,Hunan,410008P.R.China)ZHOUYa-fo阢g,JIANGHongandTANGJian-guangcontributedequallytothisworkCorrespondingauthor:TANGBei-sha。
Ema//:baan97398@yahoo.com.cn【Abstract】Polyglutamine(polyQ)diseasesgroupofhereditaryneurtMegenerativedisorderscausedbypamionofglutⅢninerepeatinresponsiblegenepln(1ucts.Todate,thepathogenesisofpolyQdiseasesisstillnotveryclear,butmanyresearchessuggestthatphosphorylationofmutantproteinsplayscriticalroletheprocessofHu血ng—ton’8disease,dentatorubral-pallidoluysianatrophy,spinalbulbarmuscularatrophy,spinocerebellarataxia1andspinocerebellarataxia3/Machado-Josephdisease.【Keywords】polyglutaminediseases;phosphorylation;nuclearinclusion*SupportedbytheNationalNaturalScienceFoundationofChina(喇.No.30670720,30400262,30710303061)多聚谷氨酰胺(polyglutamine,polyQ)疾病是一大组常见的神经退行性疾病,疾病的发生源于致病基因编码区CAG三核苷酸重复扩展突变导致基因的编码蛋白——凼rQ蛋白产生多聚谷氨酰胺扩展突变。
蛋白质磷酸化及其研究方法

首都师范大学学报(自然科学版)第27卷 第6期2006年12月Journal of Capital N ormal University(Natural Science Edition )V ol.27,N o.6Dec. 2006蛋白质的磷酸化修饰及其研究方法张 倩 杨 振 安学丽 王爱丽 李巧云 晏月明3(首都师范大学生命科学学院,北京 100037)摘要 蛋白质磷酸化是一种重要的翻译后修饰,它参与和调控生物体内的许多生命活动。
随着蛋白质组技术的不断发展,蛋白质磷酸化的研究越来越受到广泛的重视。
本文介绍了蛋白质磷酸化修饰的主要类型与功能、磷酸化蛋白质及磷酸化肽的标记和分离与富集、磷酸化肽及磷酸化位点分析以及蛋白质的磷酸化改性等方法,并综述了近年来国内外的主要研究进展。
关键词:磷酸化,磷酸化蛋白质,磷酸化肽,磷酸化改性,质谱.中图分类号:Q 753收稿日期:20052092273通讯作者 蛋白质磷酸化(Protein phosphorylation )是生物界最普遍,也是最重要的一种蛋白质翻译后修饰(P ost 2translational m odifications ,PT Ms ),20世纪50年代以来一直被生物学家看作是一种动态的生物调节过程.在细胞中,大约有1/3的蛋白质被认为是经过磷酸化修饰的[1].在人类基因组中,大约有2%的基因编码了500种激酶和100种磷酸酶[2].蛋白质磷酸化和去磷酸化是原核和真核生物细胞表达调控的关键环节,对许多生物的细胞功能起开关调控作用,是一种普遍的重要调节机制.因此,蛋白质磷酸化的分析和磷酸化位点的鉴定已成为目前蛋白质组学研究的焦点之一.1 蛋白质磷酸化的主要类型与功能磷酸化蛋白质根据其磷酸氨基酸残基的不同大致可分为四类,即:O 2磷酸盐、N 2磷酸盐、酰基磷酸盐和S 2磷酸盐.O 2磷酸盐是通过羟氨基酸的磷酸化形成的,如丝氨酸、苏氨酸或酪氨酸,羟脯氨酸或羟赖氨酸磷酸化仍不清楚;N 2磷酸盐是通过精氨酸、赖氨酸或组氨酸的磷酸化形成的;酰基磷酸盐是通过天冬氨酸或谷氨酸的磷酸化形成;而S 2磷酸盐通过半胱氨酸磷酸化形成.蛋白质磷酸化具有以下功能:(1)磷酸化参与酶作用机制,在此过程磷酸化为反应性中间产物(多为S 2或N 2磷酸盐),如在磷酸烯醇型丙酮酸羧激酶依赖的磷酸转移酶系统(PTR )的组氨酸蛋白激酶(HPr );(2)磷酸化介导蛋白活性,蛋白分子通过蛋白激酶发生磷酸化,如蛋白激酶A (丝氨酸和苏氨酸残基)或不同的受体酪氨酸激酶(酪氨酸残基);(3)天冬氨酸、谷氨酸和组氨酸的磷酸化在细菌趋化反应的感觉性传导中发生解离.2 磷酸化蛋白质及磷酸化肽的标记传统磷酸化蛋白质分析大多利用32P 放射性标记.Lees 2Miller 和Anders on [3]利用放射性32P 对人体内的两种热休克蛋白进行了标记,最终鉴定出保守的丝氨酸磷酸化位点.de Carvalho 等[4]在昆虫细胞表达了人的单核细胞中的细胞质磷脂酶A2,并采用放射性32P 标记法鉴定出磷酸化蛋白及其磷酸化位点.尽管人们至今仍广泛地运用放射性同位素标记法分析蛋白质磷酸化,但是这种方法的固有缺点是显而易见的.首先,这种方法存在放射性污染问题;其次,在某一专一蛋白激酶或者蛋白质体外磷酸化条件还不清楚的情况下,需要分析内源性蛋白质磷酸化时,这种方法就无能为力了.从20世纪80年代起,人们开始研究蛋白质磷酸化分析的非放射性方法.Meyer等[5]报道了用ABI 470气相蛋白质顺序仪固相法非放射分析磷酸化酪氨酸,并采用毛细管电泳鉴定从顺序仪上收集得到的流出液中的磷酸化酪氨酸PTH衍生物.车发云等[6]进一步建立了运用毛细管电泳同时非放射性分析蛋白质或多肽中的各种O2磷酸化氨基酸的方法,可以在低pm ol范围同时分析所有3种PTH2磷酸化氨基酸,进而可分析蛋白质或多肽中磷酸化氨基酸残基,运用此方法他们对3个模型磷酸化肽及天然的磷酸化蛋白β2酪蛋白和卵黄高磷蛋白的磷酸化位点进行了分析.车发云和夏其昌[7]还对磷酸化底物肽的硫代磷酸化及荧光标记进行了报道,他们以七肽LRRAS LG(肯普肽K em ptide)为蛋白激酶A的底物模型,研究硫代磷酸化和荧光标记反应条件,以及标记产物的性质,为荧光标记分析蛋白质磷酸化和蛋白激酶的专一性研究提供了一种新的方法.杨琴等[8]利用免疫荧光标记技术对磷酸化组蛋白H3在乳腺癌细胞中的分布进行了研究.同位素编码亲和标签(IC AT)[9]作为蛋白水平定量的质量标签,已被进一步扩展用于蛋白质磷酸化研究.磷酸同位素标记亲和标签[10](PhI AT)是一种含两个不同质量的生物素亲和标签,实际上就是用不同的化学方法处理磷酸肽,从而标记出修饰位点.现已建立了两种从复杂混合物中专一分离磷酸化蛋白Π肽的方法.G oshe等[10]将肽或蛋白混合物置于碱性硫代二乙醇溶液中,通过β消除从磷酸化丝氨酸或苏氨酸中去掉H3PO4,形成的双键受到硫代二乙醇的作用,巯基取代磷酸根.生物素与巯基相连,标记过的蛋白肽用色谱分离.Zhou等[11]用另外一种方法修饰磷酸化肽,用碳二亚胺浓缩反应将半胱氨酸加在磷酸盐部分,修饰过的肽段以共价键与碘乙酰胺树脂结合,酸洗涤释放.此方法既可用于标记富集磷酸化酪氨酸也可用于标记富集磷酸化丝氨酸和磷酸化苏氨酸.3 磷酸化蛋白质及磷酸化肽的分离与富集 目前,在磷酸化蛋白质及磷酸化肽的分离与富集的研究中经常使用的方法有以下几种:311 固相金属亲和色谱固相金属离子亲和色谱最初用于磷蛋白的亲和纯化[12],磷酸基团与固相化的金属离子有高亲和力,可被选择性地吸附在上面,现在微升级的I M AC 柱被用来富集微量磷酸肽样品[13,14].在此方法中,键合在鳌合底物上的金属离子(通常是Fe3+或G a3+)选择性地与磷酸化肽中的磷酸部分相结合,并且在高pH或磷酸缓冲液中磷酸化肽可以释放出来.此方法的优点在于每一个可溶磷酸化肽,不管其长度如何都能被富集,而且I M AC柱洗脱下的样品可直接用于RP2HP LC分析.这种方法的局限性在于不能与I M AC相结合的磷酸化肽和难于洗脱的磷酸化肽可能会丢失.312 免疫沉淀高亲和性抗体可以从复杂混合物中免疫沉淀特定的蛋白.选择性分离磷酸化蛋白通用的方法是找到能免疫沉淀任何含有磷酸化残基蛋白的抗体.酪氨酸磷酸化蛋白质的单克隆抗体是已知的较好的检测磷酸化蛋白质的抗体,它具有较强的亲和力,可以有效地免疫沉淀酪氨酸磷酸化的蛋白质[15].T illey和Schofieldt[16]利用磷酸化酪氨酸抗体对小麦的高分子量谷蛋白进行了Western2blotting分析,发现了酪氨酸磷酸化的高分子量谷蛋白亚基. Pandey等[17]用两种检测酪氨酸磷酸化蛋白质的单克隆抗体混合物,免疫沉淀表皮生长因子(EG F)刺激后的HeLa细胞总蛋白质和未处理的HeLa细胞总蛋白质,通过MS分析共鉴定出7个已知的EG F激酶底物和一个新的EG F激酶底物.为了深入探索在细胞信息传递中蛋白质酪氨酸磷酸化研究的较佳方法,陈沙力等[18]采用免疫沉淀法及Western印迹法对电离辐射诱导的小鼠胸腺细胞蛋白质磷酸化进行了比较分析.结果表明在蛋白质酪氨酸磷酸化的研究中,免疫沉淀法优于Western印迹法.王天然等[19]还初步探讨了酶联免疫试验检测磷酸化酪氨酸蛋白的可行性.抗磷酸化丝氨酸和苏氨酸抗体特异性不高,但G ronborg等[20]用6种不同的检测丝氨酸和苏氨酸磷酸化蛋白质的抗体对细胞总蛋白质进行免疫沉淀.其中3种抗体可对丝氨酸和苏氨酸发生磷酸化的蛋白质进行免疫沉淀.共鉴定出7个丝氨酸和苏氨酸发生磷酸化的蛋白质,其中5个是已知的丝氨酸和苏氨酸磷酸化的蛋白质,1个是已知蛋白质,但以前并不知道其发生磷酸化。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯资料

组蛋白修饰的生物学意义
尤其是组蛋白乙酰化、甲基化修饰能为相关调控蛋白提供其在组蛋白上的附着位点,改变染色质结 构和活性。一般来说,组蛋白乙酰化能选择性的使某些染色质区域的结构从紧密变得松散,开放某 些基因的转录,增强其表达水平。而组蛋白甲基化既可抑制也可增强基因表达。乙酰化修饰和甲基 化修饰往往是相互排斥的。在细胞有丝分裂和凋亡过程中,磷酸化修饰能调控组蛋白共价修饰间的关系
组蛋白的其他修饰方式 相对而言,组蛋白的甲基化修饰方式是最稳定的,所以最适合作为稳定的表观遗传信息。而 乙酰化修饰具有较高的动态,另外还有其他不稳定的修饰方式,如磷酸化、腺苷酸化、泛素 化、ADP核糖基化等等。这些修饰更为灵活的影响染色质的结构与功能,通过多种修饰方式 的组合发挥其调控功能。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化 等)-于凯
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用; ②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核 小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管); ③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表 达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
蛋白质可逆磷酸化

蛋白可逆磷酸化——1992年诺贝尔生理和医学奖简介龚祖埙(中科院上海生物化学研究所)由于在蛋白质可逆磷酸化研究方面的贡献,1992年诺贝尔生理和医学奖授予美国西雅图华盛顿大学的两位生物化学家——克雷布斯(Edwin Krebs)和费歇尔(Edmon Fisher),诺贝尔奖委员会在宣布授予他们诺贝尔奖时宣称:“我们现在已确定在整个基因组内大约有1%的基因编码蛋白质激酶,这些激酶调节至细胞内成千上万蛋白质的功能”。
的确,蛋白质可逆磷酸化及其有关的第二信使调控,蛋白质激酶和磷酸脂酶的研究已经成为当代生物化学、生理学、细胞生物学、分子生物学研究的一个最活跃最吸引人的研究领域。
蛋白质可逆磷酸化和如此众多的生命过程相联系,诸如细胞生长,组织分化,基因表达,肌肉收缩,能量利用和肿瘤转化等,可以毫不夸张的说,它参与了每一个生物的“生”和“死”的过程。
50年代初,克雷布斯从事肌肉代谢的研究,当时对肌肉收缩的能量代谢很感兴趣,因此对肌肉内糖原酵解过程的调节给以特别注意。
费歇尔博士当时在瑞士日内瓦大学从事植物酶学的研究。
从1953年开始,由于共同的兴趣,他们在美国西雅图华盛顿大学开始携手合作,并且很快发现,磷酸酶在从高能化合物——腺苷三磷酸(ATP)处获得无机磷后,由非活性转化为火星状态。
如果该酶在去磷酸化后,即蛋白质分子失去与其共价键结合的无机磷后,酶的活性又消失。
正如细胞内其它所有的生物化学反应一样,蛋白质的可逆磷酸化反应也是由酶来调控的。
因此他们的下不宜目标是寻找相应的酶,他们两人发现了第一个这样的酶,并称之为激酶(kinase)。
激酶是负责蛋白质磷酸化的酶,以后他们又发现了去磷酸化的酶,并称之为磷酸酯酶。
回顾历史,在同一个研究方向或领域内,先后获得三次诺贝尔奖的可以说是绝无仅有的,而糖原酵解和蛋白质磷酸化的研究则是唯一的例外克雷布斯在40年代末期曾在美国圣路易斯的华盛顿大学医学院科里(Gerty Cori)实验室工作。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯

1
1. 组蛋白乙酰化
核心组蛋白乙酰化反应多发生在核心组蛋白 N端碱性氨基 酸集中区的特定 Lys 残基。组蛋白乙酰化由组蛋白乙酰转移酶 (histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)协调进行。HAT通过将乙酰辅酶 A 的乙酰 基转移到 Lys 的NH+,中和掉一个正电荷。 HDAC使组蛋白去 乙酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因 的转录受到抑制。
7
3. 组蛋白的磷酸化
8
组蛋白共价修饰间的关系
组蛋白的其他修饰方式 相对而言,组蛋白的甲基化修饰方式是最稳定的,所以最适合作为稳定的表观遗传信息。而 乙酰化修饰具有较高的动态,另外还有其他不稳定的修饰方式,如磷酸化、腺苷酸化、泛素 化、ADP核糖基化等等。这些修饰更为灵活的影响染色质的结构与功能,通过多种修饰方式 的组合发挥其调控功能。
通常,异染色质结构域组蛋白呈低乙酰化,常染色质结构 域组蛋白呈高乙酰化。
酵母组蛋白乙酰化与去乙酰化的调节
2
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用; ②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核 小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管); ③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表 达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
组蛋白修饰在基因表达中的作用

组蛋白修饰在基因表达中的作用组蛋白是由碱性蛋白质与DNA缠绕而成的核小体的主要成分,是基因调控的一个重要层次。
组蛋白修饰是指对组蛋白进行的各种化学修饰,包括甲基化、酰化、磷酸化等。
这些修饰可以调节染色质的紧密程度,影响基因的活性,从而在基因表达中起到重要作用。
1. 组蛋白甲基化组蛋白甲基化是最为常见的组蛋白修饰形式,通常在赖氨酸残基上加上一个甲基,形成甲基赖氨酸。
甲基化作用可以抑制染色质的松弛和一些基因的表达。
一种特殊的组蛋白甲基化方式是在组蛋白H3赖氨酸第9位进行的,这被称为H3K9甲基化。
H3K9甲基化往往伴随基因沉默,而且已经被证明是一种重要的表观遗传机制。
2. 组蛋白乙酰化组蛋白乙酰化是另一种常见的组蛋白修饰方式,它通常在赖氨酸残基上加上一个乙酰化基团。
组蛋白乙酰化能够使得染色质松弛,从而增加基因的表达。
这是因为乙酰化可以阻止DNA与组蛋白的紧密结合,使得转录因子可以很容易地进入基因序列,与DNA结合,从而促进基因的转录。
3. 组蛋白磷酸化组蛋白磷酸化是一种罕见的组蛋白修饰方式,它通常发生在苯丙氨酸残基上。
组蛋白磷酸化能够影响染色质的收缩和松弛,从而对基因表达的调控起到重要作用。
特别地,H3T6磷酸化的出现是与细胞分裂有关的。
4. 组蛋白甲酰化组蛋白甲酰化是组蛋白被甲酰基化的过程。
它涉及到一种甲酰转移酶,该酶可以将一个甲酰基转移到组蛋白上。
组蛋白甲酰化通常发生在组蛋白H4中。
虽然它的功能不太清楚,但已经有一些证据表明,组蛋白甲酰化可能是与基因表达有关的。
总的来讲,组蛋白修饰在基因表达中起到了至关重要的作用。
不同的组蛋白修饰方式可以产生不同的影响,可以调节染色质的松弛程度和基因的活性。
尽管我们还需要对这些修饰的机制有更深入的了解,但我们已经知道,它们是众多基因调控机制中至关重要的一部分,为我们提供了更深入的了解基因调控的机制。
组蛋白h3相关蛋白激酶

组蛋白h3相关蛋白激酶
组蛋白H3相关蛋白激酶(H3K)是一类酶,它在细胞核中催化组蛋白H3上的特定氨基酸残基的磷酸化作用。
这些特定氨基酸残基的磷酸化状态对基因表达和染色质结构起着重要的调控作用。
H3K 激酶可以分为多种类型,包括激酶和去乙酰化酶等。
这些酶通过添加或去除乙酰基、甲基或磷酸基团来改变组蛋白H3的化学修饰,进而调控基因的转录活性和染色质的结构。
H3K激酶在细胞分化、增殖、凋亡等生命活动中发挥着重要作用。
研究表明,H3K激酶在肿瘤发生发展中也扮演着关键角色,因此成为肿瘤治疗的潜在靶点。
另外,H3K激酶还参与了一些疾病的发生发展,如神经系统疾病和心血管疾病等。
从分子生物学角度来看,H3K激酶与转录因子、染色质重塑蛋白等一起构成了染色质修饰网络,共同调控基因表达。
这种网络的平衡和稳定对于细胞的正常功能至关重要。
总的来说,组蛋白H3相关蛋白激酶在细胞内起着重要的调控作用,涉及到基因表达调控、染色质结构调整等多个方面,对于细胞
的功能和生命活动具有重要意义。
对于这一领域的研究有助于深入
了解细胞内的调控机制,并为相关疾病的治疗提供新的思路和靶点。
磷酸化激活的酶

磷酸化激活的酶
磷酸化激活的酶是指一类在生物体内通过磷酸化作用而激活的酶。
磷酸化是一种常见的后转译修饰方式,通过在酶蛋白的特定氨基酸上添加磷酸基团,可以改变蛋白质的构象和活性,从而调节酶的活性和功能。
磷酸化激活的酶的工作原理:
1. 激酶的作用:激酶是一类能够在酶蛋白上催化磷酸化反应的酶。
当细胞内的信号通路被活化时,激酶可以磷酸化特定的酶蛋白,从而改变其活性状态。
2. 磷酸化作用:在酶蛋白的特定位点上添加磷酸基团可以改变蛋白质的构象,影响其与底物的结合能力或催化活性,从而调节酶的活性。
3. 活化机制:磷酸化可以使酶蛋白的构象发生变化,使其处于活化状态。
这种构象变化可能会导致酶蛋白的活性中心暴露出来,增加与底物结合的亲和力,或者改变催化部位的电荷分布,从而增强催化活性。
举例:
- 蛋白激酶A(Protein Kinase A,PKA):PKA是一种激酶,在细胞内可以磷酸化多种底物蛋白,包括其他酶。
通过磷酸化作用,PKA可以激活或抑制这些底物蛋白的活性,从而调节细胞内的信号传导通路。
应用和意义:
- 信号转导调节:磷酸化激活的酶在细胞内的信号传导通路中起着关键作用,通过调节酶的活性,可以精确地调控细胞的代谢、生长和分化等生理过程。
- 药物靶点:许多药物的作用机制涉及到调节磷酸化激活的酶的活性,因此了解和研究这类酶对于药物研发具有重要意义。
磷酸化激活的酶是细胞内信号转导和调控的关键调节因子,对于细胞功能和生物体内平衡的维持具有重要作用。
h1组蛋白磷酸化

h1组蛋白磷酸化
H1组蛋白磷酸化是指H1组蛋白上的磷酸基团被添加到其氨
基酸残基上的化学修饰过程。
H1组蛋白是染色质中最丰富的
一类组蛋白,参与了染色质的结构和功能调控。
磷酸化是一种常见的蛋白质修饰方式,它可以改变蛋白质的结构和功能。
H1组蛋白磷酸化可以通过激酶酶将磷酸基团添加到H1组蛋
白上。
磷酸化后的H1组蛋白具有两个重要的功能。
首先,磷
酸化可以改变H1组蛋白的结构,使得染色质更易于解缠和松弛,从而有利于DNA的复制、转录和修复。
其次,磷酸化还
可以作为信号传导的调节机制,参与细胞命运决定、基因表达的调节等生物学过程。
研究发现,H1组蛋白磷酸化在细胞周期、器官发育、细胞分
化以及肿瘤发生等过程中扮演重要的角色。
通过调控H1组蛋
白的磷酸化水平,可以影响染色质的结构和功能,进而影响细胞的基因表达和生物学行为。
总之,H1组蛋白磷酸化是一种重要的蛋白质修饰方式,参与
了染色质的结构和功能调控,对细胞生物学过程具有重要影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组蛋白磷酸化涉及的酶
组蛋白磷酸化是一种重要的细胞内信号转导过程,涉及多种酶的作用。
这些酶能够在细胞中精确调节组蛋白的磷酸化水平,从而调控基因表达、细胞周期、细胞分化和发育等生物学过程。
本文将介绍一些与组蛋白磷酸化密切相关的酶,旨在为读者提供有关磷酸化酶的综合了解。
1. 磷酸化酶:磷酸化酶是一类具有磷酸化底物特异性的酶,可以从组蛋白上去除磷酸基团。
其中最知名的磷酸化酶是蛋白磷酸酶(protein phosphatase),该类酶能够通过水解反应去除磷酸基团。
常见的蛋白磷酸酶包括蛋白磷酸酶1(PP1)、蛋白磷酸酶2(PP2)以及蛋白磷酸酶2A(PP2A)等。
这些磷酸酶的活性受到细胞内多种调控机制的影响,确保组蛋白磷酸化水平的准确调控。
2. 激酶:激酶是组蛋白磷酸化过程中的关键酶,能够在组蛋白上增加磷酸基团。
一些重要的激酶包括激酶A(PKA)、激酶B
(PKB/Akt)、激酶C(PKC)和激酶D(PKD)等。
这些激酶能够被特定的信号途径或细胞内环境激活,并通过磷酸化作用调节特定的组蛋白底物,参与细胞发育、增殖和转录调控等生物学过程。
3. 激酶激酶:激酶激酶是一类可以磷酸化和激活其他激酶的酶。
其中最著名的是激酶激酶激酶(MAPK激酶激酶,MAPKKK),它可以通过磷酸化和激活MAPK激酶激酶(MAPKK)来启动整个MAPK信号传导级
联反应。
MAPK信号通路在细胞的生长、分化和凋亡等过程中发挥重要
作用,其调控组蛋白磷酸化是其中的关键一环。
4. 组蛋白激酶:组蛋白激酶可以磷酸化组蛋白蛋白质,从而调节
组蛋白的结构和功能。
最为典型的组蛋白激酶是CDK(细胞周期调节蛋白激酶),它可以在细胞周期不同阶段磷酸化不同的组蛋白底物,从
而参与细胞周期的调控。
此外,其他组蛋白激酶如JNK(c-Jun N-端激酶)和ERK(外源性信号调节激酶)等也能够磷酸化组蛋白,并影响细胞的生长、分化和转录调控等生理过程。
综上所述,组蛋白磷酸化是一个复杂而重要的细胞信号转导过程,涉及多种酶的调控作用。
磷酸化酶、激酶、激酶激酶和组蛋白激酶等
酶通过磷酸化和去磷酸化反应的调控作用,精确地调节细胞内组蛋白
的磷酸化水平,进而调控基因表达和细胞功能。
对于深入理解细胞生
物学过程并为疾病治疗提供新的靶点,研究这些酶的功能和调控机制
具有重要的指导意义。
