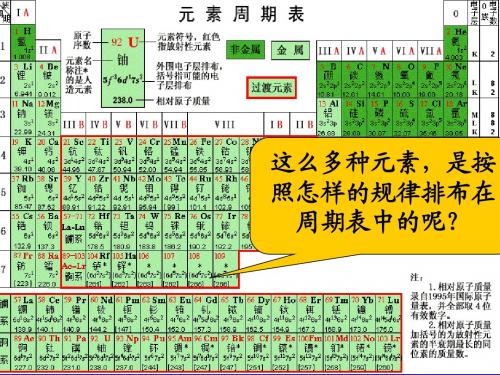
门捷列夫与1869年化学因素周期表
第一节元素周期表
碱金属的物理性质的比较
颜色 硬度 密度 Li Na K Rb Cs 均为银白色(Cs略带金色) 柔软 较小
相 似
点
熔沸点
ⅠA
0
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族序数=最外层电子数
注 意
周 七 —— 2 种 第 1周期 总结: 期 主 短周期 第 2周期 —— 8 种 表 七 副 —— 8 种 里 和 第 3周期 —— 18 种 数 零 周期 第 4周期 周 族 (7个) —— 18 种 第 5周期 期 , 长周期 —— 32 种 第 6周期 , 最 后 第 7周期 —— 26 种 1 莫 2 忘 共 7 个主族,包括短周期和长周期元素 主族 3 第 副族 共 7 个副族,只包括在长周期中 4 族 5 族 第VIII族 包括第8、9、10 纵行 。 (16个) 6 0族 稀有气体元素 7 Ⅷ
(A) 2
3 11 19ຫໍສະໝຸດ 4(B)2 10 11 18 19
(C)
6 11 12 13 24
(D)
6 14 31 32
7
练习与思考:
3.在短周期元素中,原子最外电子层只 有1个或2个电子的元素是 (D ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
4.下列说法中正确的是(C ) A.每一周期的元素都是从碱金属开始, 最后以稀有气体结束 B.同一周期中(除第一周期外),从左 到右,各元素原子核的电子数都是从1 个逐渐增加到8个 C.第二、三周期上下相邻元素的原子 核外电子数相差8个 D.第七周期只有23种元素
元素周期表助记词
横行叫周期,共有七周期; 三四分长短,第七不完全。 纵行称作族,共有十六族; 二、三分主副,先主后副族; VIII族最特殊,三行是一族; 二次分主副,副后是主族。 一、八依次现,一、零再一遍。 锕、镧各十五,均属IIIB族。
门捷列夫和他的元素周期表

CULTURE文化·赏心门捷列夫和他的元素周期表■高荣伟 /文为纪念俄国化学家德米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”(IYPT 2019)。
是的,念初中时那张你怎么也背不下来的经典化学元素周期表今年已经150岁啦!那么,你知道吗,当年,门捷列夫是怎么发现和制作出世界上第一张元素周期表的?他是否是像有些人所言,在梦中发现了元素周期表的?抑或是,门老先生坐在实验室里,经过了一阵苦思冥想,于是向全世界宣告:“俺发现了化学元素根据原子量的大小而呈周期性变化的规律”?事实上,任何科学真理的发现,都不会是一帆风顺的。
门捷列夫生活在化学界探索元素规律艰苦卓绝的时期,他在探索化学元素变化的内在联系规律方面,同样经历了艰辛的探索。
德米特里·门捷列夫,1834年2月7日出生于俄国西伯利亚的托博尔斯克。
他出生不久,父亲就因双目失明出外就医,失去了得以维持家人生活的教员职位。
然而,祸不单行。
门捷列夫14岁那年父亲去世,接着火灾又吞没了他家中的所有财产。
1850年,家境困顿的门捷列夫藉着微薄的助学金,进入彼得堡师范学院学习化学。
1857年,门捷列夫担任彼得堡大学化学系副教授。
当时,各国化学家都在探索已知的几十种化学元素的内在联系规律。
虽然现代化学早就诞生,但那个时代没有权威的化学教科书,人们对于元素的认识支离破碎,原子量的精确测量更是难题,这些问题都限制了人们对于元素整体关系的探索。
作为化学老师,门捷列夫也以惊人的洞察力,毫无畏惧地投入到了这个领域。
门捷列夫担任化学副教授以后,负责讲授《化学基础》课。
在课堂上,老师应该讲明:自然界到底有多少元素?元素之间有什么异同和存在什么内部联系?新的元素应该怎样去发现?然而,在理论化学里,这些问题尚处在探索阶段。
攀登科学高峰的路,注定是一条艰苦而又曲折的路。
门捷列夫立志当一名好老师。
年轻的门捷列夫在探索元素周期律这条路上,吃尽了苦头。
化学元素周期表的发展历史

化学元素周期表的发展历史化学元素周期表是化学领域中非常重要的一种工具,它的发展历史见证了人类对化学元素的认识和理解的不断深入。
以下是化学元素周期表的发展历史的知识点介绍:1.早期元素发现:早在古代,人们就已经开始发现并使用一些元素,如金、银、铜、锡、铅等。
到了17世纪和18世纪,随着化学的兴起,科学家们开始系统地研究元素,陆续发现了更多的元素。
2.门捷列夫的周期表:1869年,俄国化学家门捷列夫发表了第一个元素周期表。
他根据元素的原子量和化学性质,将已知元素排列成一个表格。
这个周期表初步展现了元素之间的关系,并预测了一些尚未发现的元素。
3.周期表的改进:在门捷列夫的周期表基础上,科学家们不断进行改进。
1913年,丹麦物理学家玻尔提出了玻尔模型,对原子的内部结构有了更深入的理解,为周期表的改进奠定了基础。
4.长式和短式周期表:随着元素种类的增加,周期表也不断演变。
目前常用的周期表有两种形式:长式和短式。
长式周期表将元素按照原子序数递增的顺序排列,短式周期表则将元素按照电子排布的规律排列。
5.周期表的现代结构:现代周期表共有7个周期和18个族。
周期表示元素原子的电子层数,族表示元素原子的最外层电子数。
周期表的这种结构反映了元素的原子结构和化学性质的周期性变化。
6.周期表的新元素:随着科学技术的不断发展,人类对元素的认识也在不断拓展。
截至2021年,周期表已知的元素达到118种,其中大部分是在20世纪发现的。
新元素的发现往往是通过粒子加速器等高精尖设备实现的。
7.周期表的应用:周期表在化学、物理学、材料科学等领域具有广泛的应用。
它不仅有助于科学家们预测元素的性质和反应,还有助于我们了解宇宙中元素的分布和地球资源的开发利用。
综上所述,化学元素周期表的发展历史见证了人类对化学元素的认识的不断深化,为我们了解元素的世界提供了重要的工具。
习题及方法:1.习题:门捷列夫是哪个国家的化学家?解题方法:通过查阅相关资料,可以得知门捷列夫是俄国的化学家。
门捷列夫元素周期表

门捷列素周期表的起源
1829 年,德国的柏莱纳根据元素的性质,提出三色组的分 类方法,指出每组中间元素的原子量等于两端元素原子量的平 均值。 1864年,德国的迈耶按照元素的原子量顺序把元素分成六组, 使化学性质相似的元素排在一个纵行里。 1868年,英国的纽兰茨把元素按原子量增加的顺序排列,发
现它位置前后的七个元素有相似的性质,他将这个规律成为
“八音律”。 1868年,迈耶发表了著名的原子周期性图解。
1869年,门捷列夫编成了第一张元素周期表。
他指出,元素的物理和化学性质随着原子量的
递增而作周期性的变化。
1871年,他果断修正了前一个元素周期表。在 新表中,族是竖排,周期是横排,这样各族元素 的化学性质变化就更为清晰,那些性质尚不明确 的元素在表格的右侧,形成各族元素的副族。尚 未发现的元素有六个空格。
元素周期表的内在性质
在《元素性质和原子量的关系》一文中,门捷列夫指出: • (1)按照原子量大小排列起来的元素,在性质上呈现明显的 周期性变化。 • (2)化学性质相似的元素,或者是原子量相近(如Pt,Ir, Os),或者是依次递增相同的数量(如K,Rb,Cs)。 • (3)各族元素的原子价(化合价)一致。 • (4)分布在自然界的元素都具有数值不大的原子量值,具有 这样的原子量值的一切元素都表现出特有的性质,因此可 以称它们是典型的元素。
• (5)原子量的大小决定元素的特征。
• (6)应该预料到许多未知元素将被发现,例如排 在铝和硅后面的、性质类似铝和硅的、原子量位 于65~75之间的两种元素。
• (7)当我们知道了某些元素的同类元素的原子量 后,有时可借此修正该元素的原子量。
门捷列夫和他的元素周期表

门捷列夫和他的元素周期表门捷列夫俄国化学家。
1834年2月7日生于西伯利亚托博尔斯克,1907年2月2日卒于彼得堡(今列宁格勒)。
1850年入彼得堡师范学院学习化学,1855年毕业后任敖德萨中学教师。
1857年任彼得堡大学副教授。
1859年他到德国海德堡大学深造。
1860年参加了在卡尔斯鲁厄召开的国际化学家代表大会。
1861年回彼得堡从事科学著述工作。
1863年任工艺学院教授,1865年获化学博士学位。
1866年任彼得堡大学普通化学教授,1867年任化学教研室主任。
1893年起,任度量衡局局长。
1890年当选为英国皇家学会外国会员。
门捷列夫的最大贡献是发现了化学元素周期律。
他在批判继承前人工作的基础上,对大量实验事实进行了订正、分析和概括,总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着原子量(现根据国家标准称为相对原子质量)的递增而呈周期性的变化。
这就是元素周期律。
他根据元素周期律编制了第一个元素周期表,把已经发现的63种元素全部列入表里,从而初步完成了使元素系统化的任务。
他还在表中留下空位,预言了类似硼、铝、硅的未知元素(门捷列夫叫它类硼、类铝和类硅,即以后发现的钪、镓、锗)的性质,并指出当时测定的某些元素原子量的数值有错误。
而他在周期表中也没有机械地完全按照原子量数值的顺序排列。
若干年后,他的预言都得到了证实。
门捷列夫工作的成功,引起了科学界的震动。
人们为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫元素周期表。
元素周期律的发现激起了人们发现新元素和研究无机化学理论的热潮,元素周期律的发现在化学发展史上是一个重要的里程碑,它把几百年来关于各种元素的大量知识系统化起来形成一个有内在联系的统一体系,进而使之上升为理论。
门捷列夫因发现周期律而获得英国皇家学会戴维奖章(1882年)。
他还曾获英国科普利奖章(1905年)。
1955年科学家们为了纪念元素周期律的发现者门捷列夫,将101号元素命名为钔。
第一节元素周期表

物质结构、元素周期律 元素周期表
第一节
门捷列夫与元素周期表
第一张元素周期 表是俄国化学家 门捷列夫于1869 年绘制完成的。 他将元素按相对 原子质量由小到 大排列,化学性 质相似的元素放 在一个纵行。
第一章
物质结构、元素周期律
元素周期表
第一节
一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种 编号叫原子序数。
七个横行为七个周期
周期序数 = 原子电子层数 第1周期 2 种元素 短周期 (3个) (2)周期的分类 第2周期 8 种元素 第3周期 8 种元素 第4周期 18 种元素 第5周期 18 种元素
(若排满也 是32种)
第6周期 32 种元素 不完全周期 第7周期 26 种元素
长周期 (3个)
三长三短一不全
(二)卤族元素
Br2 I2
1、卤素单质的物理性质 递 变 性
颜色
F2 Cl2
状态
熔沸点 密度
相 似 性 都有颜色 熔沸点较低 不易溶于水(除F2) 易溶于有机溶剂
气
浅 → 深 低 →
小 →
→ 液 → 固
Br2
I2
高
大
注意:溴、碘单质在不同溶剂中的颜色 Br2 I2 水溶液 黄(稀)→ 橙色(浓) 深黄(稀)→褐色(浓) 油(CCl4、苯等)溶液 橙红色 紫红色
(2)卤素与水反应
与水反应 F2 Cl2 Br2
剧烈反应,生成氟化氢和氧气 2F2+2H2O=4HF+O2
与水缓慢反应 Cl2+H2O=HCl+HClO 与水反应更弱 Br2+H2O=HBr+HBrO 与水只微弱反应 I2+H2O=HI+HIO
化学元素周期表的历史演变

化学元素周期表的历史演变化学元素周期表是化学家们用来系统组织和分类元素的重要工具。
它的发展经历了多年的演变和完善。
本文将从周期表的起源开始,介绍其历史演变的重要里程碑。
起源元素周期表最早的雏形可以追溯到19世纪初。
1803年,英国化学家道尔顿提出了最早的原子理论,认为所有物质由不可再分割的微粒组成,被称为原子。
随后,法国化学家贝尔特洛提出了贝尔特洛定律,指出元素的化合物中元素的质量比是简单整数的比例。
这两个理论为元素周期表的建立奠定了基础。
第一个周期表1869年,俄罗斯化学家门捷列夫发表了一份命名为《化学元素周期系统》的论文,其中提出了一个对元素进行分类的方法。
这被认为是第一个真正意义上的周期表。
门捷列夫的周期表按照元素的原子质量排列,将类似性质的元素放在了同一列。
他将元素分为三个周期,分别是两个元素的周期、三个元素的周期和四个元素的周期。
门捷列夫的周期表被后来的科学家广泛接受,为后续的研究提供了基础。
然而,随着科学的进展,研究者们发现了一些不能仅仅通过原子质量来解释的现象。
基于周期定律的修正20世纪初,英国化学家门德莱夫提出了基于周期定律的修正方案。
他将周期表的排列方式改为按照元素的原子序数进行排序。
原子序数是元素的核中质子的数量,也就是元素在元素周期表中的位置。
这种排列方式更加符合元素的性质规律。
此外,门德莱夫还将化学元素按照周期性的变化特征划分为八个周期。
门德莱夫的周期表修正方案被广泛接受,对元素的研究和分类产生了深远的影响。
它不仅为元素的周期性规律提供了解释,还为后续的元素发现和研究打下了基础。
完善周期表20世纪初至今,科学家们不断努力完善和拓展元素周期表。
随着化学实验技术的发展,越来越多的元素被发现和合成。
随之而来的是周期表的不断更新和扩展。
经过多年的努力,目前我们熟知的周期表共有118个元素。
这些元素按照门德莱夫的排列方式,分为7个周期和18个族。
周期表的排列不仅是按照元素的原子序数进行排序,还根据元素的性质和电子排布进行了详细的划分。
元素周期律是1869年俄国科学家门捷列夫(DmitriMendeleev)首创的

元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
[1]德米特里·伊万诺维奇·门捷列夫在化学教科书中,都附有一张“元素周期表(英文:periodic table of elements)”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。
元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。
原子序数跟元素的原子结构有如下关系:原子数=原子序数=核外电子数=核电荷数利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。
门捷列夫第一份英文版本的元素周期表.元素周期表中共有119种元素。
将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。
化学元周期表的创立者

1856年,他带上《论比容》一文重返彼得堡,获得了硕士学位。22岁被该校任命为副教授。后来,他到德国深造,1865年获得博士学位,成为彼得堡大学的教授,那时年仅31岁。门捷列夫原来是教有机化学的,后来改教无机化学。他认为当时的教科书都不能反映化学发展的最新的成果,准备重新编一本教科书。谁知,还未动笔,就碰到了一大堆困难,因为化学发展较快,又因长期以来无人很好地加以总结,整个无机化学一团糟,使他无从着手。怎么办呢?他想,要想编书,首先得理出个头绪来。当时发现的化学元素已达60多种,这些元素间有没有内在联系?能否从中找出什么规律?他决心由此人手,编书一事只得暂时搁置一旁。一入手才知道,原来早就有不少化学家开始探索化学元素之间的联系了。门捷列夫很高兴,说明自己这样做是抓住了问题的关键。
1875年,法国化学家布瓦博德朗发现了“镓”这种新元素,并测得其密度为4.7,门捷列夫看了布瓦博德朗的论文后,立即写信说:“镓是我四年前就预言到的一种类铝元素……但您测得的密度与我预言的相差较大,我推测的为5.9到6,您测得的为4.7,建议您最好重测一下镓的密度。” 布瓦博德朗收信后觉得非常奇怪:镓是我最先发现的,全世界只有我有一毫克镓。你见都未见过,怎能说我把密度测错了,简直是莫名其妙!他马上回信:肯定没错!不过。他还是重新测了镓的密度,但几次测得的结果均为5.94。布瓦博德朗惊叹不已:真是神机妙算啊,怎么恰好在门捷列夫预言的5.9到6之间呢?这一消息,很快传遍欧洲,科学界震惊了。与此同时,门捷列夫也因发现元素周期表而闻名全球。门捷列夫成了大名人,不少人想知道成功的秘诀。彼得堡一家小报的记者曾问他:“请问您是怎样想到元素周期规律的?”门捷列夫回答:“这个问题我大约考虑了20年,而您却认为:坐着不动,五个戈比一行,五个戈比一行地写着,突然就成了。事情并不是这样。” 是啊,纵然发明者是一位天才,发明创造也不是那么简单的,但怎样才能成为天才呢?门捷列夫认为:“什么是天才?终生努力,便成天才!”
化学元素周期表是1869年俄国科学家

化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
起源简介化学元素周期表现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序数越大,X射线的频率就越高,因此他认为原子核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年元素周期表修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序数排列,最小的排行最先。
表中一横行称为一个周期,一纵列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益精确和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。
元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的

元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
[1]德米特里·伊万诺维奇·门捷列夫在化学教科书中,都附有一张“元素周期表(英文:periodic table of elements)”。
这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。
元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。
原子序数跟元素的原子结构有如下关系:原子数=原子序数=核外电子数=核电荷数利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列.后来又经过多名科学家多年的修订才形成当代的周期表。
门捷列夫第一份英文版本的元素周期表.元素周期表中共有119种元素。
将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。
门捷列夫元素周期律

门捷列夫元素周期律门捷列夫元素周期律指的是化学家门捷列夫在1869年提出的关于元素周期性的理论。
这一理论为化学的发展提供了重要的指导,并被广泛应用于现代化学研究和实践中。
元素周期律的提出,极大地促进了元素和化合物的分类、研究和发展,为化学科学的进展作出了重要贡献。
元素周期表是将元素按照原子序数和化学性质进行分类的一种表格。
在元素周期表中,水平排列的称为周期,垂直排列的称为族。
元素周期表的第一周期是氢和氦,第二周期是锂、铍、硼等,以此类推。
元素周期表中元素的位置反映了其原子结构和化学性质。
门捷列夫元素周期律的形成和演变过程可以追溯到19世纪前期,当时化学家就开始尝试对元素进行分类。
门捷列夫在进行元素分类的研究时,发现了元素的周期性规律。
他注意到,元素的物理和化学性质在周期表中有规律地重复出现。
例如,周期表中的第8族元素都是惰性气体,具有相似的化学性质。
除了周期性规律,门捷列夫元素周期律还为元素之间建立了相互关系。
例如,位于同一周期的元素通常具有相似的性质,因为它们具有相似的电子结构。
此外,周期表中纵向的族(或列)也体现了元素之间的相似性。
门捷列夫元素周期律在化学领域的应用也非常广泛。
通过周期表,我们可以了解元素的基本特性,包括其原子结构、元素符号、相对原子质量等。
这些信息对于理解和研究元素的物理和化学性质非常重要。
周期表还为研究元素的反应性、性质和用途提供了一个基础。
在现代化学研究和应用中,门捷列夫元素周期律的理论仍然发挥着重要的作用。
通过对元素的分类和周期性规律的研究,科学家们能够预测新元素的性质,并进一步探索更多有关元素的奥秘。
总之,门捷列夫元素周期律是一个对元素分类和性质进行系统研究的科学理论。
它为化学的发展提供了重要的指导,并深刻地影响了现代化学研究和实践。
周期表成为了化学研究和教学中不可或缺的工具,帮助我们更好地理解和应用元素的性质。
门捷列夫与1869年化学元素周期表ppt讲解稿

第一张:主题解释1869 1871 1879 1906(序章发展高潮反思总结)第二张:1869年俄国化学家Mendeleev在元素研究中,将元素按一定顺序排列起来,使其化学性质呈现周期性的变化,成为元素周期率,其表格形式称为元素周期表(periodic table of the elements)。
在从前,人们一提到化学元素周期表,马上就联想到俄国化学家Mendeleev,甚至有些时候,人们干脆就把二者连在一起,称之为门捷列夫周期表。
其实,第三张:在化学元素周期表的整个发展过程中,门捷列夫既不是元素周期表的创始人,也不是诸多制表人中的最优秀者,他只是制表次数最多和享有的声望最高。
第四张:这些是门捷列夫的前辈们,时间皆早于门捷列夫的1869年。
第五张:周期王国第一位制图人德国化学家约翰德贝赖纳于1817年提出的元素三元组合。
第六张:这是由法国地质学家贝古耶德尚库尔托伊斯于1862年提出的第一个总体模式第七张:英国化学家John Newlands于1864年提出一种更好的排列模式,每8个元素出现一次性质上的“和声”。
第八张:几乎就在同一时期,德国的朱利叶斯洛萨尔迈耶证明,元素的相互形成化合物的能力随原子量而呈现周期性的变化。
这些照片和资料都来自书中,网络上很难找到有关以上这些科学家以及他们所作出的贡献的资料。
若不是为了课题去查书,我可能至今还认为Mendeleev首创化学元素周期表。
第九张:据说,门捷列夫在撰写化学教科书时,打了一个短暂的瞌睡,梦中还为解决元素排列问题而冥思苦想。
醒来,他立刻按照梦中假想的最后模式,匆匆地画下了他的元素排列草图。
第十张:1869年2月,俄国彼得堡大学化学教授门捷列夫发表文章,第一次明确提出了化学元素周期律,即元素的性质随着原子量的递增出现周期性变化。
他把自己制作的能反映这种规律的无框架式元素表称为元素体系,并详细介绍了自己的具体制作过程:Mendeleev按原子量从小到大的顺序排列元素,发现它们的性质有着周期性的变化。
元素周期表的前世今生

元素周期表的前世今生元素周期表是化学领域中的重要工具,它整合了所有已知元素,并以一种有序、可预测的方式呈现。
本文将探讨元素周期表的起源、发展和影响,并解释它在化学研究和教育中的重要性。
1. 元素周期表的起源元素周期表的历史可以追溯到19世纪。
当时,科学家开始发现越来越多的化学元素,并希望将它们分类和有序地组织起来。
1869年,俄罗斯化学家德米特里·门捷列夫首次提出了元素周期表的基本概念。
他将已知的63个元素分为八个组,并按照原子质量递增的顺序排列。
2. 元素周期表的发展随着科学家对元素的研究的不断深入,元素周期表也在不断发展和完善。
后来,英国化学家亨利·莫塞里、奥地利化学家乌杜瓦和德国化学家门德莱夫分别提出了独立的周期表,对元素的分类和排列进行了改进。
最终,门德莱夫的周期表成为现代元素周期表的基础,影响深远。
3. 元素周期表的结构现代元素周期表由水平行(周期)和垂直列(族)组成。
水平行表示了元素的周期性质,原子序数递增;而垂直列则表示元素的化学性质和原子结构的相似性。
周期表将相似性元素放在相同的列中,使得科学家能够快速理解和预测元素的行为。
4. 元素周期表的应用元素周期表在化学研究和教育中起着关键作用。
首先,它帮助科学家了解元素之间的关系,预测其性质并设计新的化合物。
其次,周期表为化学教育提供了一个基础,使学生能够系统地学习不同元素的特性和反应。
此外,元素周期表也被广泛应用于材料科学、能源研究和环境保护等领域。
5. 元素周期表的未来随着科学技术的不断发展,元素周期表也在不断扩展和改进。
新的元素不断被发现和合成,而元素周期表也需要进行相应的更新和调整。
除此之外,科学家还在探索更深层次的元素间关系和化学行为,并努力将这些知识应用到实际问题的解决上。
结语元素周期表是化学领域的重要工具,它的起源、发展和应用对于我们理解和探索元素世界具有重要意义。
通过理解元素周期表的前世今生,我们能够更好地认识化学的基本原理和应用价值,促进科学的发展和进步。
元素周期表的演变历程

元素周期表的演变历程近代化学的发展离不开元素周期表,它是化学领域研究的基石之一。
元素周期表的演变历程可以追溯到18世纪末的尝试,经过多次改良和完善,逐渐演变成现代的形式。
本文将简要介绍元素周期表的演变历程。
1. 早期的尝试在18世纪末,化学家们意识到一些元素有相似的性质,并试图将它们分类。
例如,经过一系列实验,亨利·卡文迪什(Henry Cavendish)发现了氢气,并认识到它具有独特的性质。
这些早期的发现为后来的元素分类奠定了基础。
2. 德米特里·门捷列夫的周期律俄国化学家德米特里·门捷列夫(Dmitri Mendeleev)于1869年首次提出了现代意义上的元素周期表。
他将已知的元素按其物理化学性质进行分类,并预测了一些尚未发现的元素。
门捷列夫的周期律为化学家们提供了一种系统性研究元素的方法。
3. 门捷列夫周期表的改进门捷列夫的周期表在随后的几十年里经过多次改进和完善。
包括亨利·莫西里(Henry Moseley)在内的多位科学家通过对元素的原子结构进行研究,发现了一些周期表中的不准确之处,并进行了修正。
这些改进使得元素周期表更加准确和可靠。
4. 新的分类方式除了门捷列夫的周期表之外,还有其他一些基于元素性质的分类方式被提出。
例如,威廉·拉姆齐(William Ramsay)根据元素的化学性质,将其分为惰性气体和其他元素。
这种分类方式为研究元素和化学反应提供了重要的线索。
5. 元素周期表的扩展和发展随着科学技术的进步,越来越多的元素被发现并被纳入周期表中。
现代的元素周期表已经扩展到118个元素,包括各类金属、非金属和过渡金属等。
化学家们不断地研究新的元素,并将它们的性质与已知元素进行比较,以便更好地理解和应用。
6. 元素周期表的应用元素周期表不仅是化学研究的基础,还在众多领域有着广泛的应用。
例如,在材料科学中,通过研究元素周期表可以设计和合成新的材料,满足各种需求。
化学元素周期表的演化历程

化学元素周期表的演化历程化学元素周期表是化学中的核心元素之一,是指化学元素按照一定规律分成一系列相似的元素,这种分组能够清晰地反映出元素的周期性特征。
周期表的发明者是俄罗斯化学家季莫费耶夫,他在1869年首次提出了元素周期性律。
由于周期表的重要性,许多其他的化学家和科学家也在积极地研究和完善这一表格。
本文将分为三部分来介绍化学元素周期表的演化历程,分别是元素周期性律的提出者、他人关于周期表的贡献以及后来的发现和调整。
一、元素周期性律的提出者1869年,季莫费耶夫在发表论文之前,已经开始研究元素周期性问题十年之久。
在这十年里,他试图研究元素在原子量的变化下所呈现的规律性。
季莫费耶夫首次提出的元素周期性律表述为:当元素按照质量升序排列时,其化学性质会出现周期变化,即一定数量元素的性质会周期性地相似。
季莫费耶夫进一步转变或完善了这一表格的形式,将元素按照周期性地排列。
这个时候,元素周期性律被称为季莫费耶夫律。
周期表于是形成了一种结构,其中横行被称为周期,纵列则称为族。
最初,周期表中的元素被安排在固定的周期表中的。
如今,周期表已经成为学生们必修的知识点之一,但是季莫费耶夫律的重要贡献却不够被重视。
二、其他科学家对周期表的贡献随着季莫费耶夫提出元素周期性律的提出,其他科学家也逐渐加入了对周期表的研究。
最值得一提的科学家当属德国化学家门克里和英国化学家门德来。
门克里作为现代元素周期表的奠基者之一,充分理解了周期律的真正意义。
门德来则在季莫费耶夫律的基础之上,提出了更加完整的周期规律性理论。
门德来将元素周期性律的基础推向了极致。
他根据在大量实验研究的基础上,严谨地总结出了八个化学族,并且确定了每个元素属于何种族。
这个时候的周期表一下子变得规范化了很多。
不仅如此,门德来还在研究中较为全面地研究了元素的物理化学性质。
这使得人们对元素周期表有了更深入的理解和认识。
三、后来的发现和调整随着科技和研究水平的不断提升,周期表中的元素数量不断增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
朱利叶斯 洛萨尔 迈耶-1864年
门捷列夫揭示元素周期
参考资料: 《基础化学》山东人民出版社 阎芳 马丽英 孙勤枢 主编 《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
镓
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
钪
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
锗
《华二化学(创新班和理科班用)》上海教育出版社
元素周期律的4个基本观点
• 原子量的大小决定元素的性质。
• 按原子量由小到大排列起来的元素,化学 性质呈现周期性的变化。
参考资料: 《周期王国》上海世纪出版社 [英] Peter Atkins 《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
约翰 德贝赖纳-1817年
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
贝古耶 德 尚库尔托伊斯 -1862年
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
科学立场的坚定性 or 囿于成见的固执性?
• 原子量决定元素性质
• 自然界的规律是没有例外的
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
感谢这些科学家们作出的伟大贡献
• • • • • • • • • • J. Dalton J.H. Gladstone Béuyer de Chancourtois J.L. Meyer J.A.R. Newlands D. I. Mendeleev J.J. Thomson W. Ramsay J. Chaddwick J. Mattauch • • • • • • • • • • F.D. Walker B. Brauner A. Werner E. Rutherfovd Van de Broek H.G.J Moseley M. Siegbahn W. Kossel F. Soddy N.H.D. Bohr
进步
• 收录的元素增加很多 • 增加了号称次副族的f区的一类元素 镧系,锕系 • 为未知元素留下了空位,给出原子量
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
门捷列夫声名大噪
参考资料: 《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编 《华二化学(创新班和理科班用)》上海教育出版社
参考资料: 《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编 《周期王国》上海世纪出版社 [英] Peter Atkins 《华二化学(创新班和理科班用)》上海教育出版社
门捷列夫的前辈们
• 德国化学家约翰 德贝赖纳(Johann Dobereiner)-1817年 • 法国地质学家贝古耶 德 尚库尔托伊斯 (Béuyer de Chancourtois)-1862年 • 英国化学家约翰 纽兰兹(John Newlands) -1864年 • 德国的朱利叶斯 洛萨尔 迈耶(Julius Lothar Meyer)-1864年
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
留下的思考
谢谢^o^
• 根据相邻元素原子量出现太大差值的程度, 预言二者之间还有几个未被发现的元素。
• 某些元素的可疑原子量,能够利用几个邻 接元素的原子量进行修正。
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
“原子量颠倒”问题
• 原子量的大小决定元 素的性质。
修正“可疑原子量”
*钴和镍 *氩和钾
发现过程
*化学元素周期律
元素的性质随着原子量的递增出现周期性变化
*元素的化学性质是否决定了它们的原子量? *可否根据它们的原子量建立元素体系?
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
结论:
原子量是元素 唯一的最基本特 征
参考资料:《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
门捷列夫和1869年 化学元素周期表
20171120 胡海琛
1869年
参考资料: 《基础化学》山东人民出版社 阎芳 马丽英 孙勤枢 主编 《化学元素周期表漫谈》 化学工业出版社 李昭山 等主编
他不是第一个!?
• 元素周期表的创始人? • 诸多制表人中的最优秀的?
• 制表次数最多 ✔ • 享有声誉最高 ✔
