4化学键和分子结构
化学键与分子结构

PART 2
化学键的类型
化学键的类型
化学键主要分为 共价键、离子键 和金属键三种类
型
共价键
共价键是指两个或多 个原子通过共享电子 对形成的相互作用。 这种相互作用使得原 子能够稳定地结合在 一起,形成稳定的分 子。共价键的形成主 要是由于原子之间的 电子云重叠
化学键的类型
离子键
离子键是指由正离子 和负离子之间形成的 相互作用。正离子失 去电子,负离子得到 电子,从而形成稳定 的离子。离子键的形 成主要是由于静电相 互作用
化学键与分子结构
-
1 化学键的定义 3 分子结构与化学键的关系 5 化学键的断裂与形成 7 总结
2 化学键的类型 4 总结 6 化学键与生命活动
PART 1
化学键的子或晶体中原 子或离子之间的相互作用, 这种相互作用使得原子或离 子能够稳定地结合在一起
化学键的形成是化学反应的 基础,也是生命活动的基础
分子结构与化学键的关系
分子的物理性质
分子的物理性质如熔点、沸点、导电性和透 明度等主要由其化学键的类型和强度决定。 例如,共价化合物的熔点和沸点通常比离子 化合物要高,而金属化合物的导电性和透明 度则受到金属原子的种类和数量的影响
分子结构与化学键的关系
分子的化学性质
分子的化学性质如反应活性、氧化还原性质等主要由其 化学键的类型和强度决定。例如,共价化合物的反应活 性通常比离子化合物要低,而金属化合物的氧化还原性 质则受到金属原子的种类和数量的影响
化学键的类型
化学键的类型
金属键
金属键是指金属原子之间形成的相互作用。 金属原子最外层电子很容易失去,从而形成 自由电子。这些自由电子在金属原子之间流 动,形成了金属键。金属键的形成主要是由 于自由电子的流动
第四章化学键与分子结构

B2
1 2py 2 2 2 2 10e:(1s ) (1s ) ( 2s ) ( 2s ) 1 2pz
1 2 py 2 2 或: KK ( ) ( ) 1 2s 2s 2pz
键级为1,2个单电子 键,分子有单电子,有顺磁性。 18
思考:为什么会有二套轨道? (书 p173-174 )
遵循:能量近似、最大重叠、 对称性匹配原则。p171-172 15
第二周期,同核双原子分子的分子轨道能级图 p175
16
第二周期,同核双原子分子的分子轨道
Li2,Be2,B2,C2,N2 分子轨道排布顺序:
2py 2py (1s )(1s )( 2s )( 2s ) ( 2px ) ( 2px ) 2pz 2pz
(4) 画出结构图 (5) 确定排斥力最小的稳定结构。
请大家练习: H2O,NH3 等。
5
举例:p162-163
价 电 子 对 数 是 4
E 指孤对电子
6
价 电 子 对 数 是 5
价 电 子 对 数= 4
孤对电子优先 代替平伏位置上 的原子和键对电 子(见后说明)
7
自上而下,数目 越小越好
8
X
⑶ 通常采取对称结构。
1
2. 推断分子空间构型的原则
夹角越小,排斥力越大
p160
孤对电子-孤对电子的排斥力 >> 孤对电子-成键电子对的排斥力 > 成键 - 成键
电子对的排斥力 在包括有多重键的分子中,多重键作单键处理,多重键对成键电子对的排斥 力大小次序为: 叁键 > 双键 > 单键 中心原子相同时,配体电负性越大,键角越小 (由于对成键电子对吸引力较大,使共用电子对偏离中心原子较远,占据空间 角度较小) NF3和 NH3 SCl2 和 SF2 配位原子相同时,中心原子电负性越大,键角越大 NH3 > PH3 H2O > H2S
化学原理[4]化学键与分子结构-2
![化学原理[4]化学键与分子结构-2](https://img.taocdn.com/s3/m/2b692b22c77da26924c5b049.png)
4.3 等性杂化和不等性杂化
等性杂化:参与杂化的原子轨道都为具有不成 对电子的轨道。
sp3杂化轨道中,每个sp3杂化轨道都是等 同的,都含有1/4的s和3/4的p轨道的成分。
不等性杂化:参与杂化的原子轨道不仅包含不 成对电子的轨道,也包含成对电子的轨道。
NH3,H2O
4.4 杂化轨道理论的应用
杂化轨道理论可以解释分子的空间构型, 但是一个分子究竟采取哪种类型的杂化轨道, 多数情况下难以预言。
ClO3- 离子,Cl原子的杂化类型? PCl6-离子,P原子的杂化类型?
1940年西奇威克(N. V. Sidgwick) 和鲍威 尔(H. W. Powell) 提出了价层电子对互斥理论 (VSEPR)。
sp3杂化:CH4分子的形成 1个ns轨道与3个np轨道组合产生4个sp3杂
化轨道,每个sp3轨道含1/4 s,3/4 p轨道成分。
激发 2p 2s
杂化
成键 + 4H sp3 杂化轨道
2p 2s
CH4分子
4个sp3轨道间的夹角为109.5
注意点:
1. 原子轨道的杂化,只有在形成分子的过程 中才会发生,孤立的原子不可能发生杂化。
根据斥力规则确定孤对电子的位置,分 子的空间构型为成键电子对的空间构型。
由于孤对电子只受一个原子的吸引,电 子云偏向中心原子,对其它价电子有更强的 排斥作用,而使键角和分子构型有所改变。
例: CH4 NH3 H2O
C N:
(2s22p3) O (2s22p4)
::
例题:试用VSEPR理论推断下列离子的几何构型: I3-、ICl2+、TlI43-、CO32-、ClO3-、SiF5-、PCl6-
C2H4(sp2杂化)
化学键与分子结构的关系

化学键与分子结构的关系化学键是在化学反应中形成的一种化学结合。
它对于构建分子结构和决定物质的性质至关重要。
在化学中,共价键、离子键和金属键是最常见的三种化学键。
本文将讨论这些化学键与分子结构之间的关系。
1. 共价键与分子结构共价键是由两个非金属原子之间的电子共享形成的。
电子共享能力的不同可以导致不同类型的共价键,如单、双或三重共价键。
共价键的形成决定了分子的几何结构和空间构型。
例如,水分子(H2O)由两个氢原子和一个氧原子组成。
每个氢原子与氧原子之间通过共用电子配对形成共价键。
由于氧原子比氢原子更电负,它的电子云更集中,在分子中形成了两个类似于“V”形的共价键角度约为104.5度。
这种几何结构使水分子呈现出极性,并导致了一系列特殊的性质,如高沸点、高表面张力和溶解度。
2. 离子键与分子结构离子键是由一个阴离子和一个阳离子之间的电荷吸引力形成的。
在离子键中,电子从金属原子转移到非金属原子,形成正负电荷,从而吸引彼此。
离子键的强度比共价键高得多,因此离子化合物通常具有高熔点和硬度。
例如,氯化钠(NaCl)是一个由钠离子和氯离子组成的晶体。
钠离子失去一个电子成为正离子,氯离子获得一个电子成为负离子,通过电的吸引力形成了离子键。
这种离子结构使得氯化钠在固态下是一个晶体,但在溶液中则以离散的离子存在。
3. 金属键与分子结构金属键是由金属原子间的电子云共享形成的。
金属键在金属中形成一个连续的电子海,并对金属的性质产生重要影响。
金属键具有高导电性(电子在金属中的自由移动),高热导率和可塑性。
例如,铁(Fe)是一个典型的金属元素。
铁原子通过金属键形成一个紧密排列的网络,在其中电子可以自由移动。
这种金属结构使铁具有特殊的性质,如高强度、高熔点和良好的导电性。
总而言之,化学键的类型直接决定了分子结构的几何形状和物质的性质。
共价键决定了分子的形状和极性,离子键导致形成离子晶体,而金属键形成具有特殊物理性质的金属结构。
4化学键与分子结构

三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空间构型与分子的空间构型。 4)sp3d杂化: 如PCl5:P原子的外层电子分布:3S23P3
36
三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空 间构型与分子的空间构型。 4)sp3d杂化: 如PCl5:∴ PCl5分子 的空间构型为三角 双锥,如右图所示:
4
• 讨论共价键的理论有价键理论、杂 化轨道理论(改进后的价键理论)、 价层电子对互斥理论、分子轨道理 论。本节主要运用价键理论讨论共 价键的形成、特点和键型;应用杂 化轨道理论讨论分子的空间构型。
5
一.共价键的本质与特点 1.共价键的形成:
(1)量子力学处理Hz: 1927年W.Heitler(海特勒)和F.Lodon(伦敦)
在原子结构中,电子分布符合能量最 低原则。基态是原子最稳定状态。
但是自然界中却发现,绝大多数元素 不以原子形式存在,而以化合物形 式存在,并且的原子数总是符合一 定比例的结合 Na - Cl , H2 - O ,
说明化合物中的元素之间,存在着内 在地关系;说明原子并非是最稳定 的状态。
1
同时注意到唯独稀有气体,总是以单 原子存在于自然界。
cos
1
1 4
11
1 3
4
θ=109028`
29
三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空间构型与分子的空间构型。 3)sp3杂化: – CH4、CCl4: CH4、CCl4为正四面体,如下图所示:
30
三.杂化轨道与分子的空间构型:
3.杂化轨道类型与分子的空间构型与分子的空间构型。 3)sp3杂化: –CHCl3: CHCl3为四面体形:
化学键与分子结构

化学键与分子结构化学键是指原子间的相互作用力,它决定了分子的结构和性质。
在化学中,常见的化学键包括共价键、离子键和金属键。
本文将分别介绍这些化学键以及它们对分子结构的影响。
一、共价键共价键是两个或多个原子通过电子的共用而形成的化学键。
共价键的强度取决于原子之间电子的共享程度和电子云的重叠程度。
共价键的形成使得原子能够达到稳定的电子结构,从而形成分子。
共价键可以进一步分为单键、双键和三键。
1. 单键单键是一对原子间共享一个电子对形成的共价键。
它们通常是通过轨道的重叠来实现电子的共享。
单键的键能较低,结构松散,所以分子在空间上具有较高的自由度。
2. 双键双键是两对原子间共享两个电子对形成的共价键。
它们相较于单键更强,键能更高,分子更加稳定。
双键结构比单键结构更为刚性,分子一般比较扁平。
3. 三键三键是三对原子间共享三个电子对形成的共价键。
它们是最强的共价键,键能最高,分子最为稳定。
由于三键的存在,许多分子呈线性结构。
二、离子键离子键是由带正电的金属离子和带负电的非金属离子之间的静电相互作用形成的化学键。
离子键的强度通常比共价键更大,因此离子化合物具有高熔点和高沸点。
离子键的结构比共价键更加有序和紧密,离子排列规则。
三、金属键金属键是由金属原子通过电子的共享形成的化学键。
在金属中,原子间的外层电子形成共同的电子云,这种共享形成一种特殊的金属键。
金属键的存在使得金属具有良好的导电性和热导性。
化学键的类型决定了分子的结构和性质。
共价键使得分子具有较高的自由度和灵活性,而离子键使得分子有序排列,具有较高的熔点和沸点。
金属键使金属具有特殊的性质,如导电和热导。
总结起来,化学键的类型与分子结构有密切关系,不同类型的化学键决定了分子的稳定性、形状以及物理化学性质。
深入理解化学键与分子结构对于研究化学反应机理和合成新材料具有重要意义。
2023届高考化学一轮复习 第4讲 元素周期表 化学键 分子结构与性质 课件(103张PPT)

逐渐__增_强___
逐渐__减_弱___
酸性_增__强___
酸性_减__弱___
碱性_减__弱___
碱性_增__强___
_增_强__
_减_弱__
(1) 元素主要化合价 ①F 无正价,O 无最高正价。 ②主族元素最高正价=原子核外最外层电子数(O、F 除外)。 ③非金属元素的最低化合价=原子核外最外层电子数-8(H 除外);最高正化合价 +|最低负化合价|=8(H、B 除外)。
族序数等于周期序数 3 倍的元素 根据金属性、非 金属性最强的元素
金属性推断
非金属性最强的元素
空气中含量最多的元素
根据含量推断 地壳中含量最多的元素
地壳中含量最多的金属元素
元素 _____H_、_B_e_、__A_l ______
___C_、_S_____ __O____
___N_a____ ___F___ ___N___ ___O___
类型 6 利用元素在周期表中的位置推断元素 (2021·南京、盐城一模)图为元素周期表中短周期的一部分,下列说法不正
确的是( A ) A. 离子半径:M->Z2->Y- B. 电负性:Y>M>Z C. 简单气态氢化物的稳定性: Y>M>Z D. Y 元素基态原子的简化电子排布式:[X]2s22p5
逐渐_减__弱___
逐渐__增_强___
非金属性
逐渐__增_强___
逐渐__减_弱___
元素性质 化合物性质
内容 第一电离能 电负性
最高价氧化物对应水化物 氢化物稳定性
同周期(从左到右) 同主族(自上而下)
总体呈现__增__大____的
趋势,但__Ⅱ_A___族和 逐渐__减__小__
化学原理[4]化学键与分子结构4
![化学原理[4]化学键与分子结构4](https://img.taocdn.com/s3/m/725608ea551810a6f524865d.png)
(7) 钙钛矿型 (CaTiO3)
CaTiO3, BaTiO3, SrTiO3, ……
立方晶系,Ca2+周围有12个O2-,Ti4+周围有6 个O2-
9.3 离子半径与配位数 r+ / r- 与配位数的关系 NaCl 六配位,CsCl 八配位,ZnS 四配位。 均为立方晶系 AB 型晶体,为何配位数不同 ?
复杂离子的极化力较小。
离子的变形性 极化率:某离子变形能力的量度 对于不同电子层结构的阳离子,极化率的大小:
8电子构型 < 9~17电子构型 < 18和18+2电子构型
结构相同的离子,正电荷越高,极化率越小:
Si4+ < Al3+ < Mg2+ < Na+ < F- < O2-
电子层构型相同的离子,电子层越多,极化率 越高:
Cl- 形成简单立方晶格 Cs+填入立方体空隙
配位比 8:8 晶胞形状为立方体,简单立方晶格。每个晶 胞中有1个Cs+和Cl-
(3) 立方 立方ZnS型 (闪锌矿型 闪锌矿型) 型 闪锌矿型
ZnS, CuCl, CdS, HgS, ……
S2-形成面心立方晶格 Zn2+填入半数的四面体空隙
配位比 4:4 晶胞形状为立方体,面心立方晶格。每个晶 胞中有4个S2-和Zn2+
(2) 能带理论(分子轨道理论在金属键中的应用) 以金属Li为例:1s22s1 在金属Li中,N个Li的原子轨道组合成N个分子 轨道,分子轨道间能级差很小,可看成连续能 级而形成能带,电子按充填规则填入能带中。 能带 (连续能级) N个1s原子轨道组合成N个分子轨道,形成1s能 带,每个能级充入2个电子,1s能带全充满,称 为满带。
四化学键理论与分子几何构型
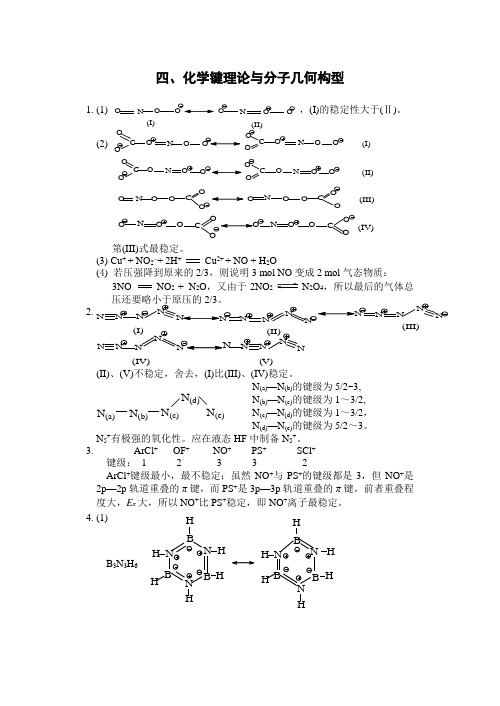
四、化学键理论与分子几何构型1. (1),(I)的稳定性大于(Ⅱ)。
(2)C OOO N O C OO O N O O (I)O C OO N OOCOO ONOO(II)O N O O CO OO NOOC O O (III)ONOOC ON OOCO O(IV)第(III)式最稳定。
(3) Cu + + NO 2–+ 2H + Cu 2+ + NO + H 2O(4) 若压强降到原来的2/3,则说明3 mol NO 变成2 mol 气态物质:3NO NO 2 + N 2O ,又由于2NO 2N 2O 4,所以最后的气体总压还要略小于原压的2/3。
2. N NN N NNNN N(IV)(V)(II)、(V)不稳定,舍去,(I)比(III)、(IV)稳定。
N (a)N (b)N (c)N (d)N (e) N (a)—N (b)的键级为5/2~3,N (b)—N (c)的键级为1~3/2,N (c)—N (d)的键级为1~3/2,N (d)—N (e)的键级为5/2~3。
N 5+有极强的氧化性。
应在液态HF 中制备N 5+。
3. ArCl + OF + NO + PS + SCl + 键级: 1 2 3 3 2ArCl +键级最小,最不稳定;虽然NO +与PS +的键级都是3,但NO +是2p —2p 轨道重叠的π键,而PS +是3p —3p 轨道重叠的π键。
前者重叠程度大,E π大,所以NO +比PS +稳定,即NO +离子最稳定。
4. (1)B 3N 3H 6N H H H H H N B N B B H H H H H H NB B H N BNO N O O O N O O (I)(II)N N N N N N N N N N (I)(II)N N N N N(III)(2) HH H HH H Cl HH H ClCl B 3N 3H 6 3HCl N N N B B B(3) 无机苯的三甲基取代物有:B N B N B N HHHCH 3H 3CCH 3B NB N B N CH 3CH 3H 3CH HHB B N B N CH 3HHHCH 3CH 3(I)(Ⅱ)(III)B N B N B N CH 3HCH 3HCH 3H B N B N B N CH 3H H CH 3HH 3CB NB N B N CH 3H 3CH 3HH(IV) (V) (Ⅵ)实际上只有四种类型,因为II 、IV ;IV 、VI 属于同类型中的几何异构体。
第2章 化学键与分子结构(4)

HCl
键的极性 多原子分子 分子的极性 分子的几何构型 例 H2O H H
+ _
O
+ _ _ + _+
极性分子
CO2
O
_+
C
O
_ 非极性分子 +
极性分子 (Polar molecules)
A diatomic molecule is polar if its bond is polar. A polyatomic molecule is polar if it has polar bonds arranged in space in such a way what their dipoles do not cancel.
分子间力的影响因素:
分子间距离:分子间距离越大,分子间力越弱。
取向力:温度越高,取向力越弱;分子的偶极矩越大, 取向力越强。
诱导力:极性分子的偶极矩越大、非极性分子的极化率越大,诱导 力越强。
色散力:分子的极化率越大, 色散力越强。
一般来说,结构相似的同系列物质,相对分子质量越大,分子变 形性越大,分子间力越强,熔、沸点越高。溶质或溶剂分子的 变形性越大,分子间力越大,溶解度越大。
不同元素的原子形成化学键时,由于正负电荷重心不重合, 形成极性共价键。两元素之间的电负性差越大,键的极性就 越大;两元素之间的电负性差越小,键的极性也越小。 HF、HCl、HBr、HI 自左至右分子的极性逐渐减小
§4
分子间作用力(Intermolecular Forces)
分子内原子间的结合靠化学键,物质中分子间存在着分子间 作用力。 一、分子的偶极矩(Dipole Moment, ) 1. 永久偶极 分子的正电重心和负电重心不重合,则为 极性分子,其极性的大小可以用偶极矩 μ来度量。
分子结构与化学键

分子结构与化学键分子是由两个或多个原子通过化学键连接在一起形成的,是构成物质的基本单位。
分子结构及其中的化学键种类和性质对物质的性质和反应起着重要作用。
本文将介绍分子结构的基本概念、化学键的种类以及它们的特点和重要性。
一、分子结构的基本概念分子结构是指分子中原子的相对排列方式和连接方式。
分子结构的确定有助于我们理解分子的性质和化学反应的机制。
分子结构的研究可以使用各种实验技术和理论模型,如X射线衍射、核磁共振、质谱等。
二、化学键的种类化学键是连接原子的力,可以根据电子的相互作用类型来分类。
以下是几种常见的化学键:1. 共价键:共价键是通过原子间的电子共享而形成的化学键。
电子在原子核附近的空间中移动,并在原子之间形成稳定结构。
共价键可以是单键、双键或三键,取决于原子之间共享的电子对数目。
2. 金属键:金属键主要存在于金属元素之间。
金属中的原子通过自由移动的电子形成金属键。
金属键具有高导电性和高热导性,是金属的特有性质之一。
3. 离子键:离子键是由正负电荷之间的强电吸引力形成的化学键。
通常情况下,金属和非金属元素之间形成离子键,非金属元素得到电子形成负离子,金属元素失去电子形成正离子,形成电中性的化合物。
4. 氢键:氢键是一种特殊的化学键,主要存在于氢原子与较电负性的原子(如氧、氮、氟)之间。
氢键的强度较弱,但却在生物分子和许多化合物的结构和性质中起到重要作用。
三、化学键的特点和重要性1. 化学键稳定性:化学键的稳定性直接影响物质的性质和化学反应的进行。
共价键通常稳定性较高,而离子键和氢键较脆弱。
金属键的特点是高导电性和高热导性。
2. 化学键的长度和键能:化学键的长度和键能是描述键强度和键的特性的重要参数。
键长和键能与原子种类、电子共享程度、电负性等因素相关。
3. 化学键的影响:化学键的种类和性质直接影响物质的热学性质、电学性质、光学性质等。
例如,共价键的特性决定了分子的稳定性和化学反应的方式;离子键的强度和离子半径决定了固体的结晶结构和性质。
化学键与分子的结构

化学键与分子的结构化学键是指原子之间形成的各种相互作用力,它在化学反应中起到了重要的作用。
化学键的类型多种多样,包括离子键、共价键和金属键等。
通过不同类型的化学键,原子能够结合形成分子,从而构建出各种物质的结构。
一、离子键离子键是由正负电荷之间的相互作用力所形成的化学键。
它通常发生在金属和非金属之间或者非金属之间。
离子键的形成过程涉及到原子的电离和电子的转移。
在一个化学反应中,一个原子失去一个或多个电子,成为正离子;另一个原子获得这些电子,成为负离子。
正离子和负离子之间的静电吸引力就形成了离子键。
离子键通常具有较高的熔点和沸点,因为它们之间的相互作用力较强。
二、共价键共价键是由共享电子对形成的化学键。
它通常发生在非金属原子之间。
共价键的形成过程涉及到原子之间电子的互相吸引力。
原子通过共享电子对来实现稳定的电子配置。
共价键的强度通常取决于原子间的电负性差异。
电负性较大的原子对电子的吸引力较强,形成的共价键也较强。
共价键可以分为单键、双键和三键等,取决于原子间共享的电子对数目。
三、金属键金属键是在金属原子之间形成的化学键。
金属键的特点是原子之间的电子云相互重叠,形成一个大的电子云。
金属原子之间的吸引力主要来自于这个共享的电子云中的自由电子。
这种形成方式使得金属键具有很好的导电性和热导性。
金属键通常是非局域化的,也就是不局限于特定的两个原子之间,而是在整个金属中形成。
不同类型的化学键在分子的结构中起到了不同的作用。
离子键常见于离子晶体的结构中,如氯化钠。
共价键通常构成了有机物和分子化合物的基本结构,如甲烷分子。
金属键则是金属晶体的基础,如铜。
通过这些化学键的组合和排列,我们可以构建出多样化的分子结构,从而实现了丰富多样的化学反应和性质。
总结起来,化学键是分子结构的重要组成部分。
离子键、共价键和金属键等不同类型的化学键在分子中起到了不同的作用。
通过理解和研究化学键与分子结构之间的关系,我们可以深入探索物质的性质和化学反应的机理,从而推动化学科学的发展。
化学键与分子结构的空间构型与实例解析

化学键与分子结构的空间构型与实例解析化学键是构成分子的基本元素之一,它决定了分子的结构和性质。
化学键的类型和结构对于分子的空间构型具有重要影响。
本文将围绕化学键的概念展开讨论,并通过实例解析不同类型化学键与分子结构之间的关系。
一、共价键的空间构型与实例解析共价键是指通过原子间共享电子而形成的化学键。
共价键的长度、角度和构型对于分子的空间形态具有重要影响。
下面以水分子(H₂O)为例进行分析。
水分子由两个氢原子和一个氧原子组成,氧原子与两个氢原子之间形成的两条共价键呈V字形。
这种空间构型使得水分子在三维空间呈现出角度为104.5°的“V”字形状。
共价键的构型对水分子的性质产生了重要影响,使得水具有极性,能够形成氢键和其他分子相互作用。
二、离子键的空间构型与实例解析离子键是通过正负离子间的相互吸引力而形成的化学键。
离子键的空间构型与各离子之间的排列方式密切相关。
以氯化钠(NaCl)为例进行讨论。
氯化钠是由氯离子和钠离子通过离子键结合而形成的晶体。
在晶体中,钠离子和氯离子按照等间距排列,并形成六方最密堆积结构。
离子键的空间构型使得氯化钠晶体具有高熔点、良好的溶解性和电导性等特点。
三、金属键的空间构型与实例解析金属键是指金属原子通过电子云的共享而形成的化学键。
金属键的特点是具有自由移动的电子云,对分子的空间构型具有一定影响。
以金属铝(Al)为例进行分析。
金属铝由一个原子间的金属键构成。
在金属键中,金属原子的外层电子形成共享电子云,使得金属具有良好的导电性和延展性。
金属键的空间构型对金属的热膨胀性也有影响。
综上所述,化学键的类型和结构对于分子的空间构型产生重要影响。
不同类型的化学键以及它们的空间构型所带来的特性和性质,使得分子和物质表现出多样化的现象。
因此,对于化学键与分子结构的空间构型与实例的分析和理解,有助于我们更好地理解和研究分子的结构和性质。
(以上内容为参考,请根据实际情况和需要进行修改。
无机化学第四章化学键与分子结构补充习题

第四章化学键与分子构造增补习题【选择题】1.以下卤化物中,离子键成分大小次序正确的选项是()。
A.CsF>RbCl>KBr>NaI B.CsF>RbBr>KCl>NaFC.RbBr>CsI>NaF>KCl D.KCl>NaF>CsI>RbBr2.以下物质中沸点高低次序正确的选项是()。
A.H2Te>H2Se>H2S>H2O B.H2Se>H2S>H2O>H2Te;C.H2O>H2S>H2Se>H2Te D.H2O>H2Te>H2Se>H2S3.既能权衡元素金属性强弱,又能权衡其非金属性强弱的物理量是()。
A.电负性B.电离能C.电子亲和能D.偶极矩4.Pb2+、Bi3+离子均属何种电子构型()。
A.18B.18+2C.8D.9~175.以下离子型化合物熔点最低的是()。
A.NaF B.BaO C.SrO D.MgO 6.以下各化学键中极性最大的是()。
A.B-Cl B.Ba-Cl C.Be-Cl D.Br-Cl7.以下分子中属于非极性分子的是()。
A.CHCl3B.PCI3C.CO2D.HCl8.以下分子中,空间构型不是直线的是()。
A.CO B.H2O C.CO D.HgCI229.以下说法中错误的选项是()。
A.杂化轨道有益于形成σ键B.杂化轨道均参加成键C.采纳杂化轨道成键,更能知足轨道最大重迭原理D.采纳杂化轨道成键,能提升原子成键能力10.BF4-离子中,B原子采纳的杂化轨道是()。
A.spB.sp2C.sp3D.不等性sp3 11.以下分子中,构型是平面三角形的分子是(A.CO2 B.PCl3)。
C.BCl3D.NH312.以下分子中键角最大的是()。
A.PCl3 B.NH3C.SiCl4D.CO2 13.以下对于杂化轨道理论的说法中正确的选项是()。
化学键与分子结构

化学键与分子结构化学键是指原子之间通过电荷的吸引力而形成的结合力。
它决定了分子的性质和化学反应的进行方式。
在化学中,分子结构又是指分子中原子之间的相对位置和关联方式。
化学键和分子结构是化学研究中的重要概念,对于理解物质的性质和相互作用具有关键性的作用。
一、离子键离子键是一种通过离子之间的电荷相互吸引形成的化学键。
通常涉及到金属和非金属原子的相互作用。
金属原子往往失去电子而形成正离子,非金属原子则接受这些电子而形成负离子。
正负离子之间的相互吸引力就构成了离子键。
离子键的典型例子是氯化钠(NaCl),其中钠离子(Na+)和氯离子(Cl-)通过离子键相互连接。
二、共价键共价键是一种通过两个或多个原子共享电子而形成的化学键。
共价键通常涉及到非金属原子之间的相互作用。
在共价键中,原子通过共享电子以使得每个原子达到稳定的电子结构。
共价键的强度取决于所共享电子对的数量和共享电子对的距离。
当两个原子间的电子对数量越多、距离越近时,共价键越稳定。
典型的共价键化合物包括水分子(H2O)和甲烷分子(CH4)。
三、极性键与非极性键化学键可以根据电子的相对吸引程度分为极性键和非极性键。
极性键是指在化学键中,电子的共享不平均,其中一个原子对电子的吸引力更强,而另一个原子对电子的吸引力较弱。
结果,形成了带有正电荷的极性原子和带有负电荷的极性原子。
非极性键则是指在化学键中,电子的共享非常均匀,两个原子对电子的吸引力相等。
极性键的典型例子是水分子中的氧-氢键,而非极性键的典型例子是氧气分子(O2)中的氧氧键。
四、分子结构分子结构是指分子中原子之间的相对位置和关联方式。
它涉及到原子间的键长、键角和立体构型。
分子结构不仅关系到分子的化学性质,也对分子的物理性质产生影响。
分子结构的确定通常通过实验方法,如X射线晶体学、核磁共振(NMR)等技术。
分子结构的研究对于理解化学反应机理、药物设计和材料科学具有重要意义。
总结:化学键和分子结构是化学研究中不可或缺的重要概念。
分子与分子键:分子结构和化学键的类型

分子与分子键:分子结构和化学键的类型分子是由两个或多个原子通过化学键连接而成的,它们以一定的方式排列在一起,形成了不同种类的分子结构。
分子结构的形成与分子间的化学键类型有着密切的关系。
本文将从分子结构和化学键的类型两个方面来介绍分子与分子键的关系。
一、分子结构分子结构描述了分子中各个原子的排列方式和相互之间的关系。
根据分子中原子之间的连接方式,可以将分子结构分为线性结构、分支结构和环状结构。
1. 线性结构线性结构的分子由一条直线上的原子构成,原子间通过共价或离子键相连接。
例如,氢气(H2)的分子结构就是线性的,两个氢原子通过共价键连接在一起。
2. 分支结构分支结构的分子由一个或多个支链与主链相连而成。
支链与主链的连接点被称为侧基。
例如,异丙醇(C3H8O)的分子就是分支结构,它由三个碳原子和一个氧原子构成,其中一个碳原子上连接着一个甲基。
3. 环状结构环状结构的分子由一个或多个原子形成一个环状结构。
例如,蔗糖(C12H22O11)的分子就是环状结构,它由12个碳原子、22个氢原子和11个氧原子构成一个环。
二、化学键的类型化学键是用来连接原子的强力化学键。
根据原子间的电荷差异、共享电子对数目和电子云重叠程度,可以将化学键分为共价键、离子键和金属键。
1. 共价键共价键是由两个原子之间共享电子对而形成的。
它主要存在于非金属元素之间,在分子中连接了原子之间的化学键。
共价键可以进一步分为单键、双键和三键,取决于原子间共享的电子对数目。
例如,氨气(NH3)中氮原子与三个氢原子之间通过共价单键连接。
2. 离子键离子键是由正负电荷相互吸引而形成的键。
它主要存在于金属元素和非金属元素之间,形成了离子晶体的结构。
离子键是通过转移电子形成的,阳离子和阴离子之间通过吸引力相互连接。
例如,氯化钠(NaCl)的晶体结构由钠阳离子和氯阴离子通过离子键连接。
3. 金属键金属键是存在于金属元素之间的键。
它的形成是由于金属元素中的自由电子形成了电子海,多个金属原子通过共享这些自由电子而连接在一起。
大学化学(无机类)第4化学键与分子结构(授课讲义)

键
Lb/pm E /kJ· mol-1
键
Lb/pm E /kJ· mol-1
4-1-3 键角
已知分子的键长和键角 , 键角:在分子中两个相邻化学键之间的夹角 ′ 就可确定分子的几何构型。 V形
′
6-1-3键角 直线形
′
三角锥形
正四面体形
第二节价键理论
第二节 共价键理论
4-2-1 路易斯理论
Lewis 认为,同种原子之间以及电负性相近的 原子之间可以通过共用电子对形成分子,通过共用
F F \ / ¨ →F–S–F [¨ ·S·] + 6[·F:] / \ ¨ ¨ F F
3s
3p
3d
3s
3p
3d
共价键特征
方向性:为满足最大重叠原理,成键时原 子轨道只能沿着轨道伸展的方向重叠。
+
+ +
-
+
-
+ +
原子轨道的重叠
原子轨道重叠的对称性原则
只有当原子轨道对称性相同的部分重叠,原子 间的概率密度才会增大,形成化学键。
键 Lb/pm C-C 154 金刚石 153 乙烷 154 丙烷 155
同一种键在不同分子中,键长基本是个定值。
键长越短,键能越大,化学键越牢固 。 C-C C=C C≡C 键
Lb/pm E /kJ· mol-1 154 356 N-N 146 160 C-N 147 285 134 598 N=N 125 418 C=N 132 616 120 813 N≡N 109.8 946 C≡N 116 866
+ _
+ _
杂化类型
sp杂化——1个s 轨道+1个p 轨道
(复习指导)第4章第3节化学键与分子结构及性质Word版含答案
第三节化学键与分子结构及性质考试评价解读核心素养达成1.了解粒子间作用(离子键、共价键、配位键、分子间作用力等)的类型、特征与实质。
了解共价键的极性与类型(σ键、π键)。
2.能利用电负性判断成键类型、共价键的极性,能结合分子结构特点判断分子的极性、手性,并据此解释分子的一些典型性质。
3.了解杂化轨道理论及杂化轨道类型,能结合杂化轨道理论、价层电子对互斥模型推测分子或离子的空间结构,能利用键参数(键能、键长、键角)解释简单分子的某些性质。
4.了解分子间作用力(含氢键)对物质性质的影响,能列举含氢键的物质与其性质特点。
宏观辨识与微观探析认识离子键、共价键的本质,能多角度、动态地分析化学键、分子的空间结构及性质,并运用相关理论解决实际问题。
证据推理与模型认知能运用价层电子对互斥模型和杂化轨道理论等,解释分子的空间结构及性质,揭示现象的本质和规律。
科学探究与创新意识能发现和提出有探究价值的分子的结构、性质的问题,设计探究方案进行探究分析,面对“异常”现象敢于提出自己的见解。
化学键与物质构成[以练带忆]1.下列化合物中,既有离子键,又有共价键的是()A.MgCl2B.Na2O2C.Cl2D.NH3·H2OB解析:A项中两个Cl-与Mg2+之间以离子键结合;B项中Na+与O2-2之间以离子键结合,O2-2中两个氧原子之间以共价键结合;C项中Cl2是单质,两个氯原子之间以共价键结合;D项,NH3·H2O是共价化合物,不含离子键。
2.下列关于NaHSO4的说法中正确的是()A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电B.NaHSO4固体中阳离子和阴离子的个数比是2∶1C.NaHSO4固体熔化时破坏的是离子键和共价键D.NaHSO4固体溶于水时破坏的是离子键和共价键D解析:虽然NaHSO4是离子化合物,但其固体中不存在能自由移动的阴、阳离子,因而不能导电;NaHSO4固体中阳离子和阴离子(HSO-4)的个数比是1∶1;NaHSO4固体熔化时破坏的只是离子键,而溶于水时电离出Na+、H+和SO2-4,破坏的是离子键和共价键。
化学键与分子结构

2s
2s
sp sp杂化
Be采用sp杂化 生成BeCl2
两个sp杂化轨道
sp2杂化 B: 2s22p1
2p
2s
BF3的空间构型 为平面三角形
F
B
F
F
2s
2p 激发 2s 2p
sp2 sp2杂化
BF3的形成
三个sp2杂化轨道
sp3杂化 C:2s22p2
2p
2s
CH4的空间构 型为正四面体
2s
n —— 未成对电子数 顺磁性:被磁场吸引 µ> 0 , n > 0
如:O2,NO,NO2等 反磁性:被磁场排斥 µ= 0 , n =0 (大多数物质) 铁磁性:被磁场强烈吸引。如:Fe,Co,Ni
根据 n(n 2) 可用未成对电子 数目n估算磁矩µ 。
n 01 2 3 4 5
µ/B.M. 0 1.73 2.83 3.87 4.90 5.92 实例: [Ti(H2O)6]3+ Ti3+: 3d1 µ=1.73 n=1 K3[Mn(CN)6] Mn3+: 3d4 µ=3.18 n=2
432
366
298
159
243
193
151
共价键
H-H C-C C--C C---C N-N N---N C-H O-H
键长 l/pm
74 154 134 120 145 110 109 96
键
能
E/(kJ·mol-1)
436
346
602
835
159
946
414
464
由表数据可见,H-F, H-Cl, H-Br, H-I 键长依次递增,而键能 依次递减;单键、双键及叁键的键长 依次缩短,键能依次增大,但与单键 并非两倍、叁倍的关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020/4/24
4.1.3 离子特征
离子半径的变化规律
a ) 同主族从上到下,电子层增加,具有相同电荷数的离子半径增加。 Li + < Na + < K + < Rb + < Cs + F- < Cl- < Br- < I-
2020/4/24
4.1.4 离子晶体
硬度高 延展性差
因离子键强度大,所以硬度高 。但受到外力冲击时,易发生位错, 导致破碎 。
F
+-+-+-+- -+-+-+-+
位 错 +-+-+-+- -+-+-+-+
受力时发生错位,使正正离子相切,负负离子相切,彼此排斥,离子键失去 作用,故离子晶体无延展性 。如 CaCO3 可 用于雕刻,而不可用于锻造,即 不具有延展性 。
2020/4/24
基本内容和重点要求
4.1 离子键理论 4.2 共价键理论 4.3 金属键理论 4.4 分子间作用力
理解共价键的饱和性和方向性及σ键和π键的区别;
掌握杂化轨道理论的要点,并说明一些分子的构型;掌握分
子轨道理论的基本要点,同核双原子分子和异核双原子分子
的分子轨道式及能级图;掌握分子的极化,分子间力及氢键
(1)共价键的本质
E
计算表明,若两个 1s 电子以相同自 0
旋的方式靠近,则r 越小,V 越大。
此时,不形成化学键。 如图中上方
红色曲线所示,能量不降低 。
-D
ro
R
2020/4/24
4.2.1 价键理论
H2 中的化学键,可以认为是电子自旋相反成对,结果使体系的能量 降低 。
从电子云的观点考虑,可认为 H 的 1s 轨道在两核间重叠,使电子在 两核间出现的几率大,形成负电区。两核吸引核间负电区,使 2 个 H结 合在一起。
2020/4/24
4.1.2 离子键特点
(1)离子键的本质是静电引力
F
q1 q2 r2
q1 ,q2 分别为正负离子所带电量 , r 为正负离子的核间距离,F为静电引力。
(2)离子键没有方向性 与任何方向的电性不同的离子相吸引,所以无方向性
(3)离子键没有饱和性 只要是正负离子之间,则彼此吸引,即无饱和性。
2020/4/24
4.2 共价键理论 4.2.1 价键理论 4.2.2 杂化轨道理论 4.2.3 价层电子对互斥理论 4.2.4 分子轨道理论 4.2.5 键参数与分子的性质 4.2.6 分子晶体与原子晶体
2020/4/24
4.2.1 价键理论
1927年,德国化学家W.Heitler和F.London首先把量子力学用 于研究H2分子结构,后由美国L.Pauling发展,提出杂化轨道 法,建立了现代价键理论。
2. 易形成稳定离子
Na + 2s 2 2p 6,Cl- 3s 2 3p 6 , 只转移少数的电子就达到稀有气体式稳定结构。
3. 形成离子键时释放能量多
Na ( s )
1
+
1/2 Cl 2 ( g )
=
NaCl (
s)
H = -410.9 kJ·mol-
在形成离子键时,以放热的形式,释放较多的能量。
d ) 负离子半径一般较大;正离子半径一般较小 。
e ) 周期表中对角线上,左上的元素和右下的元素的离子半径 相近 。
2020/4/24
4.1.4 离子晶体
(1) 离子晶体的特性 构造:正负离子在空间呈规则排列,具有周期性。
➢ 阴离子:大球,密堆积,形成空隙。
➢ 阳离子:小球,填充空隙。
➢ 规则:阴阳离子相互接触稳定;配位数大,稳定。
定义---互相远离的气态正、负离子结合生成1 mol 离
子晶体时所释放的能量,用 U 表示。
Na + ( g ) + Cl- ( g ) = NaCl ( s )
U = -△rHm ø
晶格能 U 越大,则形成离子键得到离子晶体时放出
的能量越多,离子键越强。
晶格能测定:玻恩 -哈伯循环 ( Born - Haber Circulation ) Born 和 Haber 设计了一个热力学循环过程,从已知 的热力学数据出发,利用Hess定律计算晶格能。
等 2020/4/24
返回
4.1 离子键理论
4.1.1 离子键的形成 4.1.2 离子键特点 4.1.3 离子特征 4.1.4 离子晶体 4.1.5 晶格能
2020/4/24
返回
4.1.1 离子键的形成
1916 年德国科学家 Kossel ( 科塞尔 ) 提出离子键理论 ❖ 电负性相差大的金属和非金属原子相遇时,有达到稳定结构倾向,容
2020/4/24
4.2.1 价键理论
(3)共价键的特点 (a)结合力的大小决定于共用电子的数目和重叠方式 (b)共用电子对在两核间几率密度最大 (c)具有饱和性 (d)具有方向性 (e)共价键具有不同的键型
2020/4/24
4.2.1 价键理论
共价键的方向性和饱和性
共价键的数目由原子中单电子数决定,包括原有的和激发而生成的。 例如氧有两个单电子,H 有一个单电子,所以结合成水分子时,只 能形成 2 个共价键。C 最多能与 4 个 H 形成共价键。原子中单电 子数决定了共价键的数目。即为共价键的饱和性。 各原子轨道在空间分布方向是固定的,为了满足轨道的最大 程度重叠,原子间成的共价键,当然要具有方向性。
2020/4/24
4.1.4 离子晶体
(2)离子晶体的类型
AB型离子化合物的三种晶体结 构类型
)a(CsCl型晶体
属简单立方晶格
配位比8 ׃8 晶胞中离子的个数:
个1 :+Cs
个 1 = )1/8(8 :‾
Cl
(a)
2020/4/24
4.1.4 离子晶体
)b(NaCl型晶体 属立方面心晶格
n Cl(3s23p5) n Cl-(3s23p6)↗
❖原子间发生电子的转移,形成正、负离子,并通过静电作用形成的化
学键称为离子键。
❖ 生成离子键的条件是原子间电负性差较大,一般大于2. 0左右,由离子 键形成的化合物称为离子化合物。如碱金属和碱土金属的卤素化合物
2020/4/24
4.1.1 离子键的形成
(4)键的离子性与元素的电负性有关
X > 1.7,发生电子转移,形成离子键; X < 1.7,不发生电子转移,形成共价键。
2020/4/Βιβλιοθήκη 44.1.3 离子特征(1)离子的电荷 电荷高,离子键强
(2)离子的电子层构型 正离子的电子层构型大致有5种 (1) 2电子构型 (2) 8电子构型 (3) 18电子构型 (4)(18+2)电子构型 (5) 8 — 18电子构型
1/2D
I Na (g) + Cl (g)
2020/4/24
4.1.5 晶格能
2. 影响晶格能的因素 ① 离子的电荷(晶体类型相同时)
Z↑,U↑ 例:U(NaCl)<U(MgO) ② 离子的半径(晶体类型相同时)
R↑,U↓ 例:U(MgO)>U(CaO) ③ 晶体的结构类型 ④ 离子电子层结构类型
就意味着形成了离子键。 r0 和键长有关,而 V 和键能 有关。
2020/4/24
4.1.1 离子键的形成
离子键的形成条件 1. 元素的电负性差比较大
X > 1.7,发生电子转移,产生正、负离子,形成离子键;
X < 1.7,不发生电子转移,形成共价键。(X > 1.7 ,实际 上是指离子键的成分大于 50 %)
特点:熔点、沸点较高 正负离子间的静电作用力较强 硬度高 延展性差 因离子键强度大,所以硬度高 。但受
到外力冲击时,易发生位错,导致破碎 。
导电性 水溶液或熔融态通过离子的定向迁移而导电 无确定的分子量
NaCl 晶体是个大分子,晶体中无单独的 NaCl 分子存在。 NaCl 是化学式,因而 58.5 可以认为是式量,不是分子量 。
(2)成键的原理 (a) 电子配对原理
A、B两原子各有一个自旋相反的未成对电子,它们可以互相配 对形成稳定的共价单键,这对电子为两个原子所共有。同理, 可形成共价双键、叁键等。如N2、H2O等。
(b) 能量最低原理 (c) 原子轨道对大重叠原理
成键时成键电子的原子轨道尽可能按最大程度的重叠方式进行, 重叠越大,共价键越牢固,分子越稳定。成键原子轨道的重叠部 分波函数Ψ的符号必须相同。
配位比6 ׃6 晶胞中离子的个数:
个4=1+)1/12(4 :+Na
个 4 = )1/2(6 )1/8(8 :‾
Cl
)c(立方ZnS型 属立方面心晶格
晶胞中离子的个数:
配位比6 ׃6
个4=1+)1/12(4 :+2Zn
4 = )1/8(8 + )1/2( 6 :‾2
S
个 2020/4/24
2020/4/24
4.1.1 离子键的形成
r = r0 ,V 有极小值,此时体系 最稳定,表明形成离子键。
V
0
r < r0 ,当 r 减小时,V 急剧上升。 因为 Na+ 和 Cl- 彼此再接近时,电 Vr0
子云之间的斥力急剧增加,导致势能
r0
r
骤然上升。
因此,离子相互吸引,保持一定距离时,体系最稳定。这
2020/4/24
4.1.3 离子特征
