BINAP,BINOL配体预测产物手性
不对称催化氢化

手性是自然界的基本属性,构成生命 体系生物大分子的基本单元例如碳水化合 物、氨基酸等大部分物质都是手性分子。 生物体内的酶和细胞表面的受体也是手性 的,因而具有生物活性的物质例如香精、 香料、农药、医药等,当它们与其受体相 互作用时大多以手性方式进行。这种授体 与受体之间的手性作用,使得很多手性药 物的对映体都以不同方式参与作用并产生 不同的效果。
官能化烯烃的立体选择性氢化反应取 得了很好的结果.
取代基对氢化反应的影响
• 其它的反应情况
(5)一些有用的实例
a、美国孟山都公司在20 世纪70 年代中期就成功应 用不对称氢化反应合成L- 多巴, 使用的催化剂为Rh /DIAMP+, n ( 底物) ∶n ( 催化剂) =20 000 ∶1, 得到 94%单一对映体。
1980 年Noyori等发展的BINAP 配体, 不 仅具有轴手性的结构特征,而且在不对称氢 化之外, 还适用于多个不对称反应过程, 如不 对称异构化反应用于光学活性薄荷醇的工 业化生产, 这也是Noyori 获得Nobel 奖的主 要原因之一。
1991年M.J. Burk发现了二膦配体DuPhos
(3)α-和β-羰基羧酸衍生物的不对称氢 化反应:
• α-和β-羰基羧酸衍生物可以是α-和β-羰基酸 酯、羰基酰胺及羰基内酯等。这些化合物 的不对称氢化反应,生成相应的具有光学 活性的α-和β-羟基基酸酯、羟基酰胺及羟基 内酯等。它们是合成许多重要化合物的中 间体。
• 利用β-羰基酰胺的不对称氢化反应,成功合 成了抗抑郁药物Fluoxetine的重要中间体— 手性β-羟基酰胺
• 近年来,对酮的不对称氢转移反应做 了很多研究。人们发现Rb、Ru、Ir等 金属配合物是芳基、烷基酮不对称氢 转移反应的有效催化剂。
路易斯酸催化下不对称烯反应的研究进展

路易斯酸催化下不对称烯反应的研究进展汪丹杰;项斌【摘要】烯反应是一类有效构建碳碳键、碳杂键的方法,特别是对不活泼的烯烃。
它是由一个含有重键的化合物作为亲烯体和一个含有烯丙基氢的烯烃作为烯组分的加成反应。
本文将按照亲烯体的分类分为全碳化合物、氮杂化合物、氧杂化合物等进行综述。
%Ene reaction is a highly efficient method to construct carbon-carbon bond and carbon-hetero bond,especially for unactive alkene. It isan addition reaction composed of a containing multiple bonds com-pounds as enophile and a containing allylic hydrogen compound as ene component. This article summarized the classification under the enophile was divided into all-carbon compounds,aza compounds,oxygen com-pounds.【期刊名称】《浙江化工》【年(卷),期】2015(000)006【总页数】5页(P38-42)【关键词】路易斯酸;不对称;烯反应【作者】汪丹杰;项斌【作者单位】浙江工业大学化学工程学院,浙江杭州 310032;浙江工业大学化学工程学院,浙江杭州 310032【正文语种】中文烯反应是一种有效的构建C-C键的方法,特别是对不活泼的烯烃。
因此烯反应是一种可以作为一种有效的合成方法合成各种具有重要作用的有机分子例如:樟脑、红蛾的雌性激素中间体和具有抗生活性的8-羟基-5,6-辛二烯酸甲酯[1]。
烯反应是Alder在1943年首次提出,又称Alder-烯反应,它由一个含有重键的缺电子化合物如亚胺、羰基等和一个含有烯丙基氢的烯烃通过六元环过渡态并且将双键移至原烯丙基位置和1,5-氢迁移有效构建碳碳键的方法[2](Eq.1)。
实验二十九 1,1’-联-2-萘酚(BINOL) 的合成及拆分

实验二十九1,1’-联-2-萘酚(BINOL) 的合成及拆分一、实验目的1.了解氧化偶联的实验原理。
2.了解分子识别原理及其在手性拆分中的应用。
3.掌握制备光学纯( R)-BINOL 和( S )-BINOL 的方法。
二、实验原理手性是构成生命世界的重要基础,而光学活性物质的合成则是合成化学家为创造的有功能价值物质(如手性医药、农药、香料、液晶等) 所面临的挑战,因此手性合成已经成为当前有机化学研究中的热点和前沿领域之一。
在各种手性合成方法中,不对称催化是获得光学物质最有效的手段之一,因为使用很少量的光学纯催化剂就可以产生大量的所需要的手性物质,并且可以避免无用对映异构体的生成,因此它又符合绿色化学的要求。
在众多类型的手性催化剂中,以光学纯1 ,1′-联-2-萘酚(BINOL) 及其衍生物为配体的金属络合物是应用最为广泛和成功的一例。
但是商品化的光学纯BINOL 价格昂贵,成为制约国内有机合成化学工作者进行这方面研究的瓶颈。
外消旋BINOL的合成主要通过2-萘酚的氧化偶联获得, 常用的氧化剂有Fe3+、Cu2+、Mn3 +等, 反应介质大致包括有机溶剂,水或无溶剂3 种情况。
利用FeCl3 ·6H2O 作为氧化剂,使2-萘酚固体粉末悬浮在盛有Fe3+水溶液的三角瓶中, 在50~60 ℃下搅拌2h , 收率可达90 % 以上。
此反应不需要特殊装置, 且比在有机溶剂中均相反应时速度更快、效率更高,以FeCl3·6H2O 为氧化剂,水作为反应介质的特点主要是FeCl3·6H2O 和水价廉易得、反应产物分离回收操作简单,无污染。
考虑到2-萘酚不溶于水, 反应可能通过固-液过程发生在2-萘酚的晶体表面上。
2-萘酚被水溶液中的Fe3+氧化为自由基后与其另一中性分子形成新的C—C 键,然后消去一个H,恢复芳环结构, H可被氧化为H+。
由于水中的Fe3+可以充分接触高浓度的2-萘酚的晶体表面,所以在水中反应比在均相溶液中效率更高、速度更快。
手性MOF与不对称催化

3、如何获得对映体纯的化合物?
为了获得对映体纯的化合物,我们通 常采用如下几种方法:
(1) 拆分法
即:
消旋 化合
物
拆分
和
1、化学法 化学拆分是利用手性试剂与外消旋
体反应,生成两个非对应异构体,再利 用其物理性质的差异将其拆分。缺点是 操作过程复杂且需要消耗大量手性试剂。
2、酶法 因为酶的活性中心是一个不对称的
氮膦配体在不对称烯丙基化、氨化、Michael加成、硼氢化、 氢转移、Heck反应、偶联反应、氢化反应、1,3-偶极环加成 反应中得到广泛的应用
4、 氮配体
以双恶唑啉为代表的一系列配体,应用在许多不对称反应中,如Diels-Alder, Friedel-Crafts, Hetero-Diels-Alder, Michael加成,分子内烯炔环化等……
手性与人类健康: “反应停”悲剧
O
N
O
NH
OO
(R)-thalidomide
O
O
N
N H OO
(S)-thalidomide
它的( R) 构型异构体是强力镇定剂,而( S) 构型异构体却是强烈的致畸剂。
当时这个药物是以消旋体形式,即等量的 ( R) 构型化合物和( S) 构型化合物的混合物出 售的。对映异构体的不同生理性质,是由于它 们分子的立体结构在生物体内引起不同的分 子识别造成的。
二、手性MOF在不对称催化中的 应用
(一)、MOF不对称催化的发展历程 (二)、 MOF不对称催化的一般要求
(三)、MOF不对称催化剂的分类 (四)、手性MOF不对称催化剂的优点
(一)、MOF不对称催化的发展历程
由上图可见MOF
在不对称催化中应用
手性亚砜合成

光学纯的亚砜化合物具有广泛而重要的应用价 值 ,它的用途大致可分为 3 类 : 手性中间体和辅剂 、
手性配体和催化剂及手性药物 。 111 手性中间体和辅剂
手性亚砜具有良好的手性传递能力 ,广泛用作 手性辅剂 。自从 Corey 开创手性亚砜用于美登素的 全合成后 ,手性亚砜频频用于各种天然产物的全合 成 ;也用于重要手性胺类和手性氨基酸类等化合物 的合成[1 —4] 。我国黄量 、周维善 、李焰 、白东鲁 、曾志
第5期
曾庆乐 手性亚砜合成
·747 ·
411 钛催化的不对称亚砜化反应 1984 年 Kagan[19] 首次报道了水改性的 TiΠ酒石
酸酯催化体系[ Ti (O2i2Pr) 4Π( + ) 2DETΠH2O = 1∶2∶1 ] 在亚砜化反应可以取得 90 %ee 以上高对映选择性 。 Kagan[20] 后来发现在 4 ! 分子筛存在下 , 以 Ti (O2i2 Pr) 4Π( R , R) 2DETΠi2PrOH (1∶4∶4) 为催化体系 ,只需 要 10 %催化剂量 。
宏等课题组在这方面已经做了不少工作[4] 。手性亚 砜及其衍生物还是很重要的手性中间体 ,如手性亚 磺酰亚胺 1 (图 1) 。 112 手性配体和催化剂
手性亚砜及其衍生物近年来迅速发展为一类新
收稿 : 2006 年 7 月 , 收修改稿 : 2006 年 8 月 3 国家自然科学基金项目 (No. 20672088) 和成都理工大学自筹经费项目资助 3 3 通讯联系人 e2mail :qlzeng @cdut. edu. cn
现在用于制备手性亚砜和亚磺酰胺的手性辅剂 很多[7] 。最近 Lu[11] 采用奎宁作手性辅剂用于合成 亚磺酰亚胺和亚砜 。秦勇[12] 则用 1 , 22二苯基氨基 醇作辅剂通过手性诱导得到叔丁基亚磺酰胺 。 312 手性氧化剂方法
有机合成-不对称合成

三、不对称反应的原理和基本方法 一个不对称合成反应中必须至少有一种的不对称因素 存在,这种不对称因素可来自于底物、试剂、催化剂 (化学的或生物的)、溶剂或物理))(光、电磁场)等。根 据不对称因素的来源, 可将不对称反应分为: (1)手性底物控制; (2)手性辅助基团控制; (3)手性试剂控制 (4)手性催化剂控制的四个主要反应类型。
Ph 2P PPh 2
F F O N Me
N COOBu' BiI 3 ( 碘化铋)
F F O NH S Me
Me N
O F N O Me COOH
N
(1) (2) (3) 环状烯胺(1)以(2S,4S)-BPPM与碘化铋(III)催化氢 化以96%产率得到(2)。 从(2)很容易经六步反应制 备到(3)左氟砂星。
其中S为含潜手性基团的底物,A*为光学纯的手性辅助试剂, S—A*为连上辅助基团的底物,P*—A*为连着辅助基团的产物, 而P*则为去除辅助基团后的最终产物。其中手性辅助试剂A* 一般可回收再使用。
以(S)—1—氨基—2—甲氧甲基吡咯烷(SAMP,8)为手性辅助基团合 成高光学纯度的食叶蚁警戒 信息素9就是这类不对称反应的一个典型例子
由光学纯1,1‘-联萘-2,2’-二酚
是手性氢负离子还原剂。
(2) 过渡金属络合物催化的 羰基化合物的氢化
Noyori等发现手性联二萘膦(BINAP)与过渡金属 形成配合物还可以还原羰基得到醇。
酮的不对称氢化是制备手性醇的一个有 效方法,BINAP-Ru (II)催化剂对于官能 化酮的不对称氢化是极为有效的:
一个好的不对称合成反应首先应具有好的立体选择性, 即高的对映或非对映过量。此外,温和的反应条件、高 的收率、两种立体异构体合成的通用性、原料经济性等 亦是衡量其优劣的指标。
有机催化导论第四章不对称催化

a) 不对称毒化 1986年由研究小组提出。采用光学活性分子作为毒化剂,通过分子识别使外消旋催化剂中的一种对映异构体,选择性中毒,失去活性,而另一种对映异构体成为催化反应的活性成分,因而生成光学活性产物。 局限性: 产物的光学纯度不可能超过使用光学纯催化剂时所得产物的光学纯度 b) 不对称活化 1997年由K. Mikami在Nature提出。一种外消旋催化剂或者光学纯催化剂可以被另一种手性活化试剂(Chiral activator)通过分子识别对映选择性活化,从而催化反应生成光学活性产物。 不对称毒化和不对称活化概念的提出,为手性催化的设计提供了一条更经济的途征,因为外消旋体催化剂的获得,比光学纯催化剂要容易得多。 优点:活化的催化剂比单独使用光学纯催化剂,可催化产生更高对映体过量的产物。
以15%ee(-)DAIB可以得到95%ee手性产物,表现出明显的不对称放大作用
例:烷基锌与苯甲醛的加成反应
不对称自催化(asymmetric auto-catalysis)
产物本身作为手性催化剂促进反应,完成产物的转化。 在不对称自催化反应中,手性催化剂和产物是相同的,反应后,无需分离产物和催化剂 例:2-烷基-5-甲醛基-嘧啶催化还原为嘧啶基烷醇
4.2.4 手性碳含N ,O,S等杂原子配体 ⅰ)氮,膦手性配体: 结构特点:含手性碳,配位原子为N(P)和P原子,分子含N,P原子 ⅱ)氮,氮手性配体: 结构特点:含手性碳,配位原子为N和N原子,分子含氮双齿配体
4.2.5 C2对称性配体
结构特点: SP2杂化成键的芳香环骨架,与脂肪族相比具有较高的稳定性 有卓越的空间效应 配位后生成七元环具有较大的刚性和高度扭曲构象
2001诺贝尔奖不对称催化工业化典型案例讲解

Pd/C
MeO
MeO
HOOC
HOOC
HO
NHCOC6H5 HO
NH2
拆分 去保护
MeO
HO
3 of 20
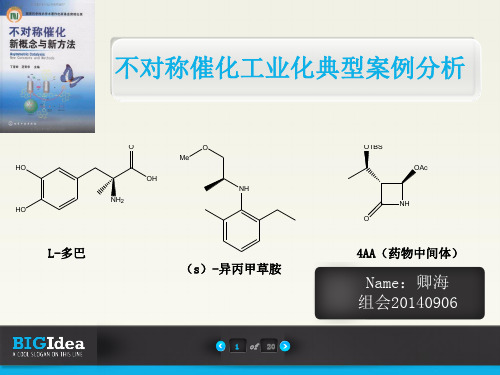
Knowles等将他们发展的不对称氢化应用到L-多巴的合成上,通过手性膦配体的改进, 底物的设计以及氢化条件的优化,成功地实现了L-多巴的不对称氢化制备。以二齿 膦配体DIPAMP与铑生成的配合物催化氢化烯酰胺底物,达到95%的ee值及20000:1的 催化比。这条路线被Monsanto公司商业化,开创了通过催化方法大量制备手性化合 物的纪元,Knowles因此获得2001年诺贝尔化学奖。
5 of 20
案例2 (S)-异丙甲草胺的不对称催化合成
(S)-异丙甲草胺是目前通过不对称催化氢化生成的产量最大的一个化合物。 异丙甲草胺是20世纪70年代中期开发的一个非常重要的除草剂,其中95%的活性是由 其两个(1s)-构型产物提供的。Blaser等先后使用了铑-Cycphos配合物(65%ee)、 铱-Diop-碘化物为催化剂都得到了很好的效果。
8 of 20
共同结构:连续的三个手性中心的杂环酮化合物4AA
9 of 20
第一代催化剂
日本高沙(Takasago)公司生产4AA工艺
1989年,Noyori等与之合作的日本高沙公司首次报道了通过结合不对称催化氢 化和动态动力学拆分的方法,以BINAP(联萘二苯磷)-钌配合物为催化剂,不 对称催化还原α-官能化的β-酮酸酯,获得了98%的对映选择性和88%的非对映选 择性的顺势产物。1992年就通过该路线实现了年产量50t规模的4AA的工业生产。
6 of 20
后来发现基于二茂铁双膦(PPF)配体对铱的配合物能够有效地催化氢化MEA-亚 胺,通过结构的调整,发现Xyliphos配合物能够在催化比100w:1的条件下得到79% 的ee值(即近90%的(s)-构型含量)。该工艺已经在Solvias公司实现了年产量1w 吨的(S)-异丙甲草胺生产规模。
几类重要的不对称反应及新型手性配体

几类重要的不对称反应及新型手性配体欧阳志强1 欧阳迎春2(1.南昌大学材料科学与工程学院 南昌330047 2.江西师范大学理电学院南昌330027)摘 要:不对称合成是有机合成领域的热点,本文综述了以有机配体———金属配合物为手性催化剂的不对称合成的最新进展。
关键词:不对称合成 手性催化剂 手性配体 引 言自1968年美国孟山都公司的K nowlex和德国的H omer 分别发表了手性膦配体与铑配合物组成的手性催化剂进行的不均相催化氢化以来,人们相继研究开发了一大批具有立体选择性和高催化活性的新型手性配体,本文将就这方面的最新进展作一综述。
1 C =C 双键的不对称氢化反应2,2′一二(二苯基磷)一1,1′—联萘(BI NAP )的Ru络合物还年广泛用于C =C 双缝的不对称氢化。
主要有1,1′一二取代的不含杂原子的烯的不对称氢化;α,β—不饱和和β,γ—不饱和酸的不对称氢化———这类底物的不对称氢化应用于非麻醉性消炎药萘普森和异丁基布洛芬的工业生产上,潜力极大;以及前手性烯丙基醇的不对称氢化:产物为(R )一或(S )一香茅醇,ee 值高达96%-99%,香茅醇是合成L —薄荷醇的中间体。
结构与BI NAP 相似的2,2′—二氨基—1,1′一联萘(BI 2NAM )或其衍生物配体的Rh 配合物可以以36%-95%的光学收率催化a 一酰胺基丙烯酸与H 2的加成,以及前手性烯酰胺的不对称氢化,前手性酮的不对称还原。
Perea 等对平面手性二茂铁的双膦配体、氮膦配体、硫膦配体与Rh ,Ir 或Ru 形成的催化剂对C =C 的不对称氢化进行了考察,指出Rh 催化剂效果最好。
并对其反应底物的结构,溶剂效应及反应动力学等方面进行研究。
2 C =0双键的不对称还原加氢反应。
前手性酮的不对称还原得到光学活性的仲醇,2,2′—二羟基一1,1—联萘(BI NO L )改造的LiAIH 4还原剂(BI NO L -H )用于前手性不饱和酮的还原可得100%ee的相应仲醇,立体选择性依赖于温度、底物、溶剂、配位体等。
手性配体设计在有机合成中的应用

手性配体设计在有机合成中的应用概述手性配体是一种具有不对称结构的有机分子,可以与金属离子形成配合物。
由于手性配体可以选择性地与金属离子形成单一对映体,因此在有机合成中具有重要的应用价值。
本文将从手性配体的定义、应用范围、设计原则以及具体应用案例等方面,阐述手性配体在有机合成中的重要性和应用。
一、手性配体的定义和分类手性配体在有机化学中是一种不对称的有机分子,可以与金属离子形成配合物。
配位键的形成使得手性配体和金属离子的整体复合物呈现手性结构。
根据配体中手性中心的个数,手性配体可以分为双手性配体和单手性配体两类。
双手性配体含有两个手性中心,可以形成四个对映异构体。
这类配体包括双异构体、螺环配体和双双移位配体等。
单手性配体只含有一个手性中心,可以形成两个对映异构体。
这类配体包括BINAP、BOX和BINOL等。
不同类型的手性配体在有机合成反应中具有不同的应用特点和反应选择性。
二、手性配体的应用范围手性配体在有机合成中有广泛的应用范围,可以用于催化剂、识别分离剂和药物等领域。
1. 催化剂:手性配体可以与金属离子形成手性配合物,修饰催化剂表面的性质。
这些手性修饰的催化剂在不对称催化反应中具有高效、高选择性和环境友好的特点。
例如,采用手性配合物修饰的催化剂可以在不对称加氢、不对称氢化和不对称亲核取代等反应中实现对产物立体选择性的控制。
2. 识别分离剂:手性配体可以与化学物质发生特异的分子识别作用。
利用手性配体构建的识别分离剂可以实现对手性化合物的高效分离和纯化。
这对于合成手性药物和农药等具有重要意义。
3. 药物:由手性配体构建的手性药物具有较高的生物活性和选择性,能够减少药物的副作用和毒性。
手性配体在药物合成中可以用于确定立体构型、调节活性和提高药物代谢稳定性。
三、手性配体设计的原则手性配体设计需要考虑其立体构型、化学稳定性和生物相容性等因素。
以下是几个重要的手性配体设计原则:1. 对映选择性:手性配体应具有高度的对映选择性,能够与金属离子形成单一对映体。
(完整)2001诺贝尔奖不对称催化工业化典型案例讲解

Pd/C
MeO
MeO
HOOC
HOOC
HO
NHCOC6H5 HO
NH2
拆分 去保护
MeO
HO
3 of 20
Knowles等将他们发展的不对称氢化应用到L-多巴的合成上,通过手性膦配体的改进, 底物的设计以及氢化条件的优化,成功地实现了L-多巴的不对称氢化制备。以二齿 膦配体DIPAMP与铑生成的配合物催化氢化烯酰胺底物,达到95%的ee值及20000:1的 催化比。这条路线被Monsanto公司商业化,开创了通过催化方法大量制备手性化合 物的纪元,Knowles因此获得2001年诺贝尔化学奖。
4 of 20
另一条路线是,由Flother等提供的路线,以苯基β-D-吡喃葡萄糖苷衍生物的 膦配体Ph-β-glup与铑(I)生成的配合物对α-酰胺-β-芳基丙烯酸进行不对称催 化获得大于90%的对映选择性,催化比可达到20000:1。该工艺于1985-1990年间由 Zwickau公司进行了年产量1t的L-多巴的工业生产。
• 来自美国加利福尼亚Scripps研究学院。 • 1941年出生于美国宾西法尼亚州费城。 • 1968年获斯坦福大学博士学位。 • 1990年起,任美国Scripps研究学院化学
教授。
5 of 20
案例2 (S)-异丙甲草胺的不对称催化合成
(S)-异丙甲草胺是目前通过不对称催化氢化生成的产量最大的一个化合物。 异丙甲草胺是20世纪70年代中期开发的一个非常重要的除草剂,其中95%的活性是由 其两个(1s)-构型产物提供的。Blaser等先后使用了铑-Cycphos配合物(65%ee)、 铱-Diop-碘化物为催化剂都得到了很好的效果。
10 of 20
第二代催化剂: 第三代催化剂:
6,6'-二溴-1,1'-联-2-萘酚的偶联合成与手性拆分——对一个有机化学综合实验的改进与发展

大 学 化 学Univ. Chem. 2024, 39 (1), 287收稿:2023-07-19;录用:2023-09-18;网络发表:2023-10-18*通讯作者,Emails:**********************(邸士睿);*************.cn(朱红平)基金资助:国家自然科学基金面上项目(21972112)•化学实验• doi: 10.3866/PKU.DXHX202307042 6,6'-二溴-1,1'-联-2-萘酚的偶联合成与手性拆分——对一个有机化学综合实验的改进与发展邸士睿*,王帅,刘鑫,朱红平*厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005摘要:6,6'-二溴-1,1'-联-2-萘酚是1,1'-联-2-萘酚(BINOL)的衍生物,两者同为典型的轴手性有机物分子,这类分子的合成与拆分研究对于本科生深入认识和理解轴手性类化合物具有重要意义,本实验考虑到(±)-BINOL 及其衍生物的价格较为高昂,不适合开展大批量合成和拆分的教学实验,因此采用了微波合成的方式实现6,6'-二溴-1,1'-联-2-萘酚的偶联合成。
除此之外,本实验还开发了拆分剂N -苄基氯化辛可尼丁的微波合成方法,并用合成的N -苄基氯化辛可尼丁直接对6,6'-二溴-1,1'-联-2-萘酚进行化学拆分。
本实验通过引入微波合成、改良合成反应用溶剂以及回收拆分剂等方式使实验更加符合绿色化学的宗旨。
在教学效果上,本实验涉及的操作较多,有助于考查学生的综合实验水平,更富教学价值,具有强的实践意义。
关键词:BINOL 及其衍生物;微波合成;手性拆分;化学实验教学中图分类号:G64;O6Coupling Synthesis and Chiral Splitting of 6,6’-Dibromo-1,1’-Bi-2-Naphthol: Improvement and Development of a Comprehensive Organic Chemistry ExperimentShirui Di *, Shuai Wang, Xin Liu, Hongping Zhu *National Demonstration Center for Experimental Chemistry Education (Xiamen University), College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, Fujian Province, China.Abstract: 6,6'-Dibromo-1,1'-bi-2-naphthol is a derivative of 1,1'-bi-2-naphthol (BINOL), both of which are archetypal axially chiral organic molecules. The study of the synthesis and separation of such molecules is crucial for undergraduates to deepen their understanding of axially chiral compounds. Considering the high cost of (±)-BINOL and its derivatives, which hinders extensive synthesis and separation experiments for educational purposes, this study employs microwave-assisted synthesis for the coupling of 6,6'-ibromo-1,1'-bi-2-naphthol. In addition, we have developed a microwave synthesis method for the chiral separating agent, N -benzylcinchonidine chloride, and used it directly for the chemical separation of 6,6'-dibromo-1,1'-bi-2-naphthol. By introducing microwave-assisted synthesis, optimizing the solvents for the synthetic reactions, and recycling the separating agent, this experiment aligns more closely with the principles of green chemistry. Pedagogically, the experiment involves multiple operations, serving as a comprehensive test of students ’ experimental skills and offering significant educational value.Key Words: BINOL and its derivatives; Microwave synthesis; Chiral disassembly;Chemical experimental teaching1 引言手性合成是当前有机化学研究中的热点和前沿领域之一,由于使用很少量的光学纯催化剂就可以产生大量所需的手性物质,并避免对映异构体的生成,因此符合绿色化学的要求。
不对称催化在有机化学中的应用-推荐下载

不对称催化在有机化学中的应用1110712胡景皓不对称催化反应是使用非外消旋手性催化剂进行反应的,仅用少量手性催化剂,可将大量前手性底物对映选择性地的转化为手性产物,具有催化效率高、选择性高、催化剂用量少、对环境污染小、成本低等优点。
经过40年的研究,不对称催化已发展成合成手性物质最经济有效的一种方法。
不对称催化领域最关键的技术是高效手性催化剂的开发,因为手性催化剂是催化反应产生不对称诱导和控制作用的源泉。
美国孟山都公司的Knowles和德国的Homer在1968年分别发现了使用手性麟一锗催化剂的不对称催化氢化反应,从此不对称催化反应迅速发展。
近几十年来手性配体的开发是不对称催化领域最为关注的焦点,并已合成出上千种手性配体,其中BINAP和(DHQD)2PHAL等已实现工业化应用,对映选择性已达到或接近100%,在氢化、环氧化、环丙烷化、烯烃异构化、氢氰化、氢硅烷化、双烯加成、烯丙基烷基化等几十种反应中取得成功,同时在均相催化剂负载化、水溶性配体固载化等研究中也取得了突出成果。
以下是不对称催化研究的一些实例。
一、脯胺酸及其衍生物催化的不对称Michael加成反应Listd、组在2001年首次用脯氨酸作催化剂研究了不对称Michael成反应。
以DMSO为溶剂进行催化反应,获得了较好的收率,但是选择性却很差。
这与之前报道的脯氨酸催化的不对称Aldol反应相比,e.e值明显降低。
随后,2002年Endersd、组对该反应进行了进一步的探索。
在筛选L.脯氨酸用量时,发现反应中实际起催化作用的是溶解于溶剂DMSO中的L.脯氨酸,为此于体系中加入一定量甲醇或以甲醇为溶剂来增大L.脯氨酸的溶解度,同时加大催化剂的用量,该反应的e.e.能够提高到57%,但是反应时间大大延长。
Leyd小组用脯氨酸衍生的四氮唑为催化剂17进行的不对称Michael反应,不仅克服了脯氨酸需要使用大极性的DMSO溶剂,而且还使e.e.值明显提高。
联二萘类配体的手性催化剂在

HR Hs N (C 2H 5)2
[R h((S )-B IN A P )]+
m yrcene
g eranyld ieth ylam ine
Hs HR N (C 2H 5)2
H3O+
CHO
Z n B r2
(R )-citrone lla l en am ine 96% ee~99% ee
(R )-citronellal
.
.
2.烯烃的不对称氢硅烷化反应
20世纪70年代初,人们利用手性膦-钯催化剂催化前 手性烯烃的不对称氢硅烷化反应生成手性的烷基硅 烷,但反应的对映选择性较差,最好的只有50%左 右。进入90年代以后才有了突破性的进展。1991年, 首次报道了单齿膦配体MOP和钯组成的催化剂在末 端烯烃的不对称氢硅烷化反应中获得97%的高对映 选择性。在此之后,MOP成为催化烯烃不对称氢硅 烷化反应的一个重要手性配体。
D iels-A lder 反应是构建复杂分子的一方法, 特 别是杂D iels-A lder 反应。此反应的几个重要 特征是: 协同性、区域选择性及由此产生的手 性中心的立体化学。以BINAL 2H 衍生物作为 不对称合成的催化剂,首次解决了D iles-A lder 反应中的立体化学问题[17 ] (图8)。
R3
R2
R1
R2 R3CONH
COOR1
PO(OCH3)2 R NHCHO
R3
R2
R1
R2 R3CONH
COOR1
PO(OCH3)2
R
NHCHO
.
1.2烯胺的不对称氢化
在下烯胺的不对称氢化反应中,,反应产物α-
芳基(Ar=Ph)-α-乙酰胺基乙烷的官学产率最
binap配体结构式

binap配体结构式
近年来,BINAP配体结构式得到了越来越多的关注,它已经成为许多化学实验和研究中不可或缺的重要组成部分。
BINAP配体结构式,也称为双酰胺配体结构式,即两个双酰胺基团配体的结构式。
它是一种多功能的配体,可用于铁的分析和合成、金属离子的选择性排除、螯合剂的结合和分离、硅铜催化剂的研究等,是药物研究的重要参考物质。
BINAP配体结构式是一种双膦配体的结构式,由两个含膦官能团的平行键构成。
它是以C 20 H 27 N 3 O 4 P为原料合成的,由双膦基团、烷基、氨基和羧基组成。
由于双膦配体构形独特,具有双膦配体构形自由度,这使得它具有良好的分子对称性和化学稳定性,且可以调节结合和分离金属离子的力学。
双膦配体的体系能够有效地处理金属离子的取向性,从而实现高效的结合和分离。
此外,BINAP配体结构式还具有良好的加热稳定性、低氧化性和易于操作的特性,使其成为药物研究的重要参考物质。
BINAP配体结构式可以用来进行螯合反应,因为它具有两个烷基双键,可以形成双酰胺配体,从而与金属离子结合,实现金属离子的选择性排除、分离和分析。
BINAP配体结构式也应用于硅铜催化剂的研究。
其中,烷基/双酰胺配体结构式是硅铜催化剂的一种重要组成部分,可以提高催化剂的活性,提高反应的效率。
烷基/双酰胺配体结构式可以与硅铜催化剂紧密结合,从而达到提高催化转化率的目的。
可以总结,BINAP配体结构式在药物研究和硅铜催化剂研究中都具有重要作用,其特性使用十分广泛,是分离、合成、分析和探索新药物的重要参考物。
未来,BINAP配体结构式在这些领域的应用仍将发挥重要作用,值得期待。
过渡金属催化的金属试剂的不对称偶联反应及其在合成轴手性 分子和面手性分子

过渡金属催化的金属试剂的不对称偶联反应及其在合成轴手性分子和面手性分子中的应用摘要C—C键的形成是药物合成过程中重要的研究内容之一,偶偶联反应是构建C-C 键、最有效的方法之一,是构建新的碳-碳键简洁、高效的合成路径,具有重大的理论意义和应用价值,本文介绍了目前过渡金属催化的金属试剂的不对称偶联反应,重点阐述了利用对映控制的偶联反应合成具有轴手性或者面手性的分子。
关键词不对称催化;偶联反应;轴手性;面手性1、简介过渡金属催化的偶联反应是形成C-C键的重要方法。
2010年诺贝尔化学奖授给了Richard Heck,Ei-ichi Negishi and Akira Suzuki来表彰他们在Pd催化的偶联反应中的开创性的贡献。
有机金属试剂( R-M)与芳基( 或烯基) 卤化物( R1-X ) 的交叉偶联反应可以使两个小分子通过C-C键结合成结构较复杂的大分子( R-R1),因而成为有机化学家高度重视的重要合成反应。
1972年M.Kumad和R.J.P.corriu几乎同时报导了卤代烯烃或卤代芳烃在镍的催化下同格式试剂的交叉偶联反应,引起了化学家对其他一些金属如镁、锌、铜、锡等有机金属化合物和有机亲电试剂交叉偶联反应的极大兴趣。
2、过渡金属催化的金属试剂的不对称偶联反应钯是偶联反应中使用最为广泛的过渡金属催化剂。
由于钯适中的电负性(电负性值2.20),使其具有温和的得失电子的能力。
也正因为此,钯催化剂在偶联反应中既可以丢失电子和卤代烃发生氧化加成反应,也可以获得电子发生还原消除反应生成新的化学键。
由于钯催化剂温和的活性,使其在有机合成反应中能够实现高选择性、高产率的得到单一的目标产物。
另外,镍催化剂也是偶联反应中常用的过渡金属催化剂,但是镍催化剂往往活性比钯催化剂高。
镍的电负性值为1.91,因此,它的失电子能力更强,也就是说,镍催化剂在氧化加成步骤中更加活泼。
镍催化剂可以实现一些钯催化剂难以实现的偶联反应。
2001诺贝尔奖不对称催化工业化典型案例
11 of
20
案例4 金属催化硫醚的不对称氧化:左旋奥美拉唑的工业制备
奥美拉唑是Astra Zeneca公司开发的一种质子泵抑制剂,主要用于治疗胃溃疡。 前期主要以消旋体上市,后来发现左旋即(S)-构型奥美拉唑具有更好的临床疗效。 2006年奥美拉唑的全球销售额就达到了53亿美元。而其中的左旋奥美拉唑的生产技 术一直被Astra Zeneca公司垄断。 最初, Astra Zeneca公司通过以(S)-BINOL(联萘酚)为拆分剂,两个光学
8
of
20
共同结构:连续的三个手性中心的杂环酮化合物4AA
9
of
20
日本高沙(T989年,Noyori等与之合作的日本高沙公司首次报道了通过结合不对称催化氢 化和动态动力学拆分的方法,以BINAP(联萘二苯磷)-钌配合物为催化剂,不 对称催化还原α-官能化的β-酮酸酯,获得了98%的对映选择性和88%的非对映选 择性的顺势产物。1992年就通过该路线实现了年产量50t规模的4AA的工业生产。
15 of
20
读后感: 从20世纪六十年代Knowles等人以手性甲基丙基膦为配体,对α -苯基丙烯酸的 不对称催化得到15%的ee值开始,不对称催化开始进入研究者们的领域中,并一步步 发展起来,仅仅四年后Knowles就实现了L-多巴的工业化,并得到诺贝尔奖。Astra
公司对奥美拉唑生产工艺的改进也是从Kagan体系的5%的ee值经过6年的时间提高到
美国孟山都公司的威廉 S.诺尔斯(William S.Knowles)
日本名古屋大学的野依良治 (Ryoji Noyori) 美国斯克里普斯研究所的夏普雷斯(K.BarrySharpless) 以表彰他们在不对称催化反应研究领域取得的突出贡献。 自1968年Knowes等首次实现不对称催化反应以来,这一领域已经取得了巨大的 进展,尤其是已经成为了在制药工业上合成手性物质的重要方法。世界手性药物市 场在迅猛发展,1999年的全球销售额超过1000亿美元,2005年超过1700亿美元,甚 至2010年超过2500亿美元。
手性催化剂..

手性催化研究的新进展与展望手性是自然界的基本属性之一,与生命休戚相关。
近年来,人们对单一手性化合物(如手性医药和农药等)及手性功能材料的需求推动了手性科学的蓬勃发展。
手性物质的获得,除了来自天然以外,人工合成是主要的途径。
外消旋体拆分、底物诱导的手性合成和手性催化合成是获得手性物质的三种方法,其中,手性催化是最有效的方法,因为他能够实现手性增殖。
一个高效的手性催化剂分子可以诱导产生成千上万乃至上百万个手性产物分子,达到甚至超过了酶催化的水平。
2001年,诺贝尔化学奖授予了三位从事手性催化研究的科学家Knowles、Noyori 和Sharpless,以表彰他们在手性催化氢化和氧化方面做出的开拓性贡献,同时也彰显了这个领域的重要性以及对相关领域如药物、新材料等产生的深远影响。
我国对于手性催化合成的研究始于上世纪80年代,从90年代逐渐引起重视。
1995年戴立信、陆熙炎和朱光美先生曾撰文呼吁我国应对手性技术特别是手性催化技术的研究给予重视[1]。
国家自然科学基金委员会九五和十五期间分别组织了“手性药物的化学与生物学研究”(戴立信院士和黄量院士主持)[2]、“手性与手性药物研究中的若干科学问题研究”(林国强院士主持)[3]重大研究项目,同时中国科学院和教育部等也对手性科学与技术的研究给予了重点支持,极大地推动了我国手性科学和技术领域特别是在手性催化领域的发展,取得了一批在国际上有较大影响的研究成果,并培养了一支优秀的研究队伍,在手性催化研究领域开始在国际上占有一席之地。
本文结合国际上手性催化研究的最新进展,主要回顾了我国科学家近年来在新型手性配体、金属配合物手性催化、生物手性催化、有机小分子手性催化、负载手性催化剂、以及新概念与新方法等方面取得的重要研究进展[4],并展望了手性催化的未来发展趋势。
一、新型手性配体的设计合成手性配体和手性催化剂是手性催化合成领域的核心,事实上手性催化合成的每一次突破性进展总是与新型手性配体及其催化剂的出现密切相关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1,判断BINAP配体(其他BINAP配体衍生物,BINOL配体)对于反应的选择性(关注微信公众号了解更多:“天然产物有机化学全合成”)
2,以(S)-BINAP配体为例子,我们讲述一下(S)-BINAP配体对于反应的选择性(其他的配体照样)。
以下面的反应为例。
从观察方向我们知道(S)-BINAP配体在空间上排布情况如下,中间点是金属催化剂的观察点(以Rh为例子),
上面是(S)-BINAP的空间分布特点。
那么,我们将该反应的Rh-H过渡态代入到上述方块中。
如下图:当R位于“下”,H位于“上”,如TS1所示,这样的空间位阻最小(H比R基团小)。
当R位于“上”时,R基团会与配体产生较大的空间位阻,如TS2所示,该过渡态不利于反应的进行。
所以Rh-H从空间上方(如TS1)加成至双键上,得到上述产物。
