高三化学常见推断题(含答案中)精选
高三化学一轮复习——元素或物质推断题
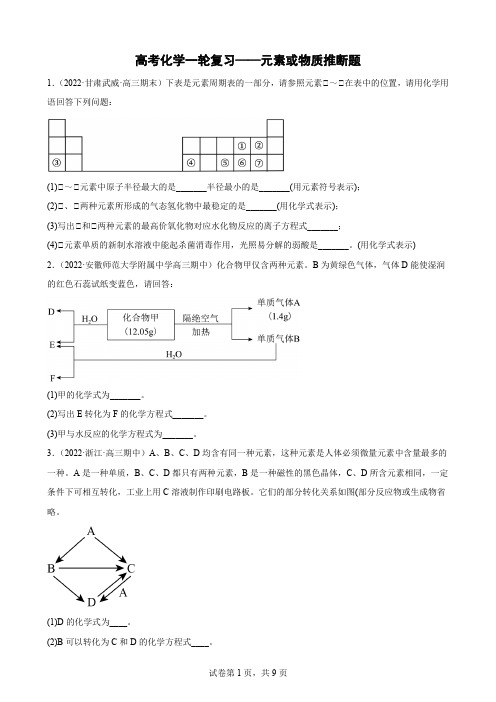
高考化学一轮复习——元素或物质推断题1.(2022·甘肃武威·高三期末)下表是元素周期表的一部分,请参照元素①~①在表中的位置,请用化学用语回答下列问题:(1)①~①元素中原子半径最大的是_______半径最小的是_______(用元素符号表示);(2)①、①两种元素所形成的气态氢化物中最稳定的是_______(用化学式表示);(3)写出①和①两种元素的最高价氧化物对应水化物反应的离子方程式_______;(4)①元素单质的新制水溶液中能起杀菌消毒作用,光照易分解的弱酸是_______。
(用化学式表示) 2.(2022·安徽师范大学附属中学高三期中)化合物甲仅含两种元素。
B为黄绿色气体,气体D能使湿润的红色石蕊试纸变蓝色,请回答:(1)甲的化学式为_______。
(2)写出E转化为F的化学方程式_______。
(3)甲与水反应的化学方程式为_______。
3.(2022·浙江·高三期中)A、B、C、D均含有同一种元素,这种元素是人体必须微量元素中含量最多的一种。
A是一种单质,B、C、D都只有两种元素,B是一种磁性的黑色晶体,C、D所含元素相同,一定条件下可相互转化,工业上用C溶液制作印刷电路板。
它们的部分转化关系如图(部分反应物或生成物省略。
(1)D的化学式为____。
(2)B可以转化为C和D的化学方程式____。
试卷第1页,共9页(3)工业上用C制作印刷电路板的原理用离子方程式表示为_____。
(4)检验C中阳离子的离子方程式_____。
4.(2022·浙江·高三期中)某兴趣小组对物质X(仅含2种常见元素)进行如下探究分析已知:溶液A的焰色试验为黄色,且A溶液恰好被含0.1molHCl的盐酸中和;红棕色粉末B是某铁矿石的主要成分。
请回答以下问题:(1)X中所含的金属元素是_______(填元素符号),X的化学式为_______。
高三化学一轮复习 训练题:元素或物质推断题

高考化学一轮训练题:元素或物质推断题1.(2022·江西省丰城中学高三期中)已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,物质A由原子序数依次增大的元素X、Y、Z组成,其中Z的简单离子半径在同周期中最小,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:回答下列问题:(1)请写出YM的电子式:_______。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______。
(3)在YZO2与YX的混合液中,通入足量CO2,是工业制取A的一种方法,写出该反应的化学方程式:_______。
(4)镓(31Ga)与Z为同主族元素,氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
下列有关说法正确的是_______。
a. Ga位于元素周期表第四周期IV A族b. GaN为新型无机非金属材料c. Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强d. 酸性:H3AsO4>H3PO4>HNO3(5)YZM4是有机合成的重要还原剂,其合成路线如图所示利用YZM4遇水反应生成的氢气的体积测定YZM4样品纯度。
①其反应的化学方程式为_______。
①现设计如图四种装置测定YZM4样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是_______(填编号)。
①取样品ag,若实验测得氢气的体积为V L(标准状态),则YZM4样品纯度为_______(用代数式表示)。
2.(2022·上海交大附中高三期中)A、B、C、D、E五种元素的原子序数均小于18,其原子的电子层结构的信息如下表,请根据信息回答下列问题:(1)C 的元素名称是_______。
(2)元素B 形成的正离子的结构示意图_______。
(3)元素E 负离子的电子式可能是_______、_______(4)写出比A 离子的电子少8个的两核负离子和五核正离子的化学式_______、_______(5)元素D 与氮元素形成化合物的化学式32D N ,将此化合物投入水中,发生复分解反应,此反应的化学方程式是_______。
2023年高三化学高考备考一轮复习 专题练习——有机推断题(含答案)

2023届高考化学一轮专题练习题——有机推断题1.(2022·北京市第一六六中学三模)药物Q 能阻断血栓形成,它的一种合成路线。
已知:i.ii.R 'CHO 2R "NH弱酸−−−−−→R 'CH=NR " (1)→A 的反应方程式是_______。
(2)B 的分子式为11132C H NO 。
E 的结构简式是_______。
(3)M→P 的反应类型是_______。
(4)M 能发生银镜反应。
M 分子中含有的官能团是_______。
(5)J 的结构简式是_______。
(6)W 是P 的同分异构体,写出一种符合下列条件的W 的结构简式:_______。
i.包含2个六元环,不含甲基ii.W 可水解。
W 与NaOH 溶液共热时,1mol W 最多消耗3 mol NaOH(7)Q 的结构简式是,也可经由P 与Z 合成。
已知:Fe 粉、酸−−−−−−→,合成Q 的路线如下(无机试剂任选),写出X 、Y 、Z 的结构简式:_______。
2.(2022·陕西西安·模拟预测)叶酸是一种水溶性维生素,对贫血的治疗非常重要。
叶酸的一种合成方法如下:已知:R−COOH+SOCl2→R−COCl+HSO2Cl;R-COCl+H2N-R′→R-CONH-R′+HCl(1)B的结构简式为_______,D的名称为_______。
(2)⑤的反应类型为_______。
(3)E中的含氧官能团名称为_______。
(4)写出⑤的化学反应方程式_______。
(5)D的同分异构体中,属于α—氨基酸、含有羟基、且能发生银镜反应的有_______种。
(6)根据题中的相关信息,设计以对二甲苯与对苯二胺为主要原料,经过三步反应合成防弹材料的路线_______。
3.(2022·北京·模拟预测)有机物F是合成抗肿瘤药物吉非替尼的重要中间体,其合成路线如下:已知:i.RNH 2+ii.R 1-COOR 2+H 2N -R 3→+R 2OH(1)A 分子中含氧官能团有醚键、___________和___________。
2023届高三化学二轮复习题—元素或物质推断题及解析

2023届高三化学二轮复习题—元素或物质推断题1.(2022·云南德宏·统考一模)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。
A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3.试回答下列问题:(1)E元素在周期表中的位置是_______;(2)已知101KPa时,A单质的燃烧热为285.8 kJ/mol,请写出A单质完全燃烧生成液态水时的热化学方程式:_______;(3)E单质在足量D单质中燃烧生成的化合物的电子式是_______;(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于_______化合物(填“离子”或“共价”):②X与Y的水溶液相混合发生反应的离子方程式为_______;(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。
其离子反应方程式为:_______。
2.(2022·河南·河南省实验中学校考三模)Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1C溶液的pH=13,则该反应的离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为___________。
Ⅱ.(4)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。
请写出该反应的离子反应方程式:___________。
(5)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO3∙3H2O2,它具有Na2CO3和H2O2的双重性质。
高三化学一轮专题复习---元素或物质推断题

高考化学一轮专题复习---元素或物质推断题1.一澄清溶液中可能含有的离子如表所示,为测定其含有的离子的种类,取该溶液进行实验:阳离子K+、Mg2+、Ba2+、Al3+、H+阴离子I-、Br-、CO23-、SO24-、OH-实验①:用pH试纸检验,测得溶液呈强酸性。
实验①:取2 mL原溶液于试管中,加入少量CCl4及数滴新制氯水,经振荡,CCl4层呈紫红色。
实验①:取2 mL原溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,滴加过程中和滴加完毕后,均无沉淀产生。
实验①:另取部分上述实验①中的碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
已知:Br2、I2易溶于CCl4,且Br2的CCl4溶液呈橙红色,I2的CCl4溶液呈紫红色。
根据所学知识,回答下列问题:(1)根据实验①,可排除___________的存在。
(填离子符号,下同)(2)根据实验①,可证明含有的离子为___________,写出氯水中的氯气与溶液中的离子反应的离子方程式___________。
该反应中被还原的物质为___________ (填离子符号或化学式)。
(3)根据实验①,可确定肯定不含的离子为___________。
(4)根据实验①,可证明___________的存在,又排除___________的存在。
(5)综上所述,该溶液中上述离子尚不能确定是否存在的是___________。
2.现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见的无色无味液体,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。
请回答下列问题:(1)写出H的化学式:___________。
F的俗名是___________。
(2)①写出反应①的化学方程式:___________。
①写出反应①的化学方程式:___________。
高三化学常见推断题

21 .【化学-选修3:物质结构与性质】(15分)X、Y、Z、W四种元素原子序数依次增大且均小于36。
Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与丫、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。
回答下列问题(以下问题均以推知元素符号作答):(1)若YX3与X2Z、YX「与ZX「、丫1 2 3 4 5「与亡性质相似,请写出Mg(YX)2在一定条件下分解的化学反应方程式3⑵已知0C时X2Z的密度为a g/cm,其晶胞中分子的空间排列方式与金刚石晶胞类似,相似的原因是____________________________________________________________ 。
两个X2Z分子间的最近距离为pm(用a和N A表示)。
已知XY的升华热是51 kJ/mol ,除氢键外,X a Z分子间还存在范德华力(11 kJ/mol ),则X a Z晶体中氢键的“键能” 是kJ/mol 。
⑶WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。
工业上常以W(YZ>)2・6%Z和尿素[CO(NH)2]为原料制备。
①W的基态核外电子排布式为_______________________ ,其核外电子有 _______ 种运动状^态。
②尿素分子中碳原子的杂化方式为______________ , 1 mol尿素分子中含有的d键数为_______ 。
③YZT的空间构型______________ 。
④WZ晶体的结构与NaCI相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个代空缺,另有两个W+被两个诩+所取代。
其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。
经测定某样品中冈与W+的离子数之比为6 : 91。
若该晶体的化学式为WZ,则x= ____________ 。
高三化学有机合成、有机推断综合练习题(附答案)
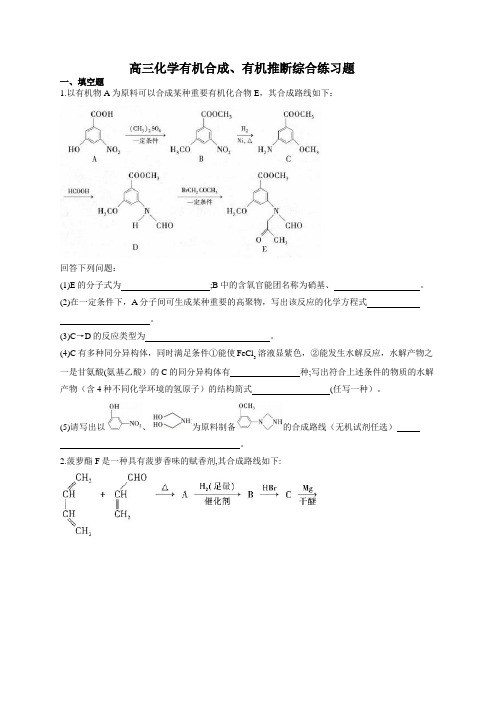
高三化学有机合成、有机推断综合练习题一、填空题1.以有机物A为原料可以合成某种重要有机化合物E,其合成路线如下:回答下列问题:(1)E的分子式为;B中的含氧官能团名称为硝基、。
(2)在一定条件下,A分子间可生成某种重要的高聚物,写出该反应的化学方程式。
(3)C→D的反应类型为。
(4)C有多种同分异构体,同时满足条件①能使FeCl溶液显紫色,②能发生水解反应,水解产物之3一是甘氨酸(氨基乙酸)的C的同分异构体有种;写出符合上述条件的物质的水解产物(含4种不同化学环境的氢原子)的结构简式(任写一种)。
(5)请写出以、为原料制备的合成路线(无机试剂任选)。
2.菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如下:已知:(1)A 的结构简式为__________,A 中所含官能团的名称是__________。
(2)由A 生成B 的反应类型是__________,E 的某同分异构体只有一种相同化学环境的氢,该同分异构体的结构简式为_____________________。
(3)写出D 和E 反应生成F 的化学方程式____________________________。
(4)结合题给信息,以溴乙烷和环氧乙烷为原料制备1-丁醇,设计合成路线(其他试剂任选)。
合成路线流程图示例:324CH COOH NaOH 3232323H SO ,CH CH Cl CH CH OH CH COOCH CH ∆∆−−−−→−−−−→溶液浓。
3.[化学—选修5:有机化学基础]以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。
E 是一种治疗心绞痛的药物。
有葡萄糖为原料合成E 的路线如下:回答下列问题:(1)葡萄糖的分子式为__________。
(2)A 中含有的官能团的名称为__________。
(3)由B 到C 的反应类型为__________。
(4)C 的结构简式为__________。
新高考化学离子的检验与推断

离子推断题能够有效考查考生推理能力,是物质推断的一种重要的题型,它既考查常见离子的典型性质,又考查考生的推理能力,具有综合性强、能力要求高的特点,近几年高考试题不断由单一向综合、定性向定量转化。
【例1】(2022•全国乙卷)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。
取少量样品进行如下实验:①溶于水,得到无色透明溶液②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。
离心分离。
③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )A.Na2SO4、Na2S2O3B.Na2SO3、Na2S2O3C.Na2SO4、Na2CO3D.Na2SO3、Na2CO3【答案】A【解析】由题意可知,①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能共存,②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应S2O32-+2H+=S↓+H2O+SO2↑,离心分离,③取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象覆盖掉,综上分析,该样品中确定存在的是:Na2SO4、Na2S2O3,故选A。
【例2】(2020•浙江1月选考)某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;②沉淀Y与NaOH溶液作用,无变化。
下列说法不正确...的是( )A.混合物X中必定含有Na2CO3,不含Al2(SO4)3B.溶液Z中溶质主要是钠盐,且必含NaHCO3C.灼烧沉淀Y,可以得到黑色物质D.往溶液Z中加入Cu粉,若不溶解,说明X中不含FeCl3【答案】D【解析】某固体混合物X,含有Al2(SO4)3、FeCl3、Na2CO3和CuSO4中的几种,进行如下实验:①X 与水作用有气泡冒出,四种物质中能生成气体的只有Na2CO3,所以一定有Na2CO3,而几种物质中没有酸,可知推测因为发生双水解生成了二氧化碳,能与Na2CO3在溶液中双水解的有Al2(SO4)3、CuSO4和FeCl3;得到有色沉淀Y,则Fe(OH)3、Cu(OH)2中至少有一种Al(OH)3不确定;弱碱性溶液Z,说明溶液中不存在铝离子、铁离子和铜离子;②沉淀Y与NaOH溶液作用,无变化说沉淀中没有Al(OH)3,则X中一定没有Al2(SO4)3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学常见推断题(含答案中)X 、Y 、Z 、W 四种元素原子序数依次增大且均小于36. Z 基态原子最外层电子数是其内层电子总数的3倍,Y 基态原子是同周期元素中未成对电子数最多的原子,X 分别与Y 、Z 元素组合均可形成10电子微粒, W 基态原子有10个价电子.回答下列问题(以下问题均以推知元素符号作答):(1)若 YX 3与X 2Z ﹑YX 2-与ZX -﹑Y 3-与Z 2-性质相似,请写出Mg(YX 2)2在一定条件下分解的化学反应方程式 ⑵已知0℃时X 2Z 的密度为a g/cm 3,其晶胞中X 2Z 分子的空间排列方式与金刚石晶胞类似,相似的原因是 .两个X 2Z 分子间的最近距离为 pm(用a 和N A 表示). 已知X 2Y 的升华热是51 kJ/mol ,除氢键外,X 2Z 分子间还存在范德华力(11 kJ/mol ),则X 2Z 晶体中氢键的“键能”是 kJ/mol.⑶ WZ 是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面.工业上常以W(YZ 3)2·6X 2Z 和尿素[CO(NH 2)2]为原料制备.①W 2+的基态核外电子排布式为 ,其核外电子有 种运动状态. ②尿素分子中碳原子的杂化方式为 ,1 mol 尿素分子中含有的σ键数为 . ③YZ 3-的空间构型 .④WZ 晶体的结构与NaCl 相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ 晶体中就存在如图所示的缺陷:一个W 2+空缺,另有两个W 2+被两个W 3+所取代.其结果晶体仍呈电中性,但化合物中W 和Z 的比值却发生了变化.经测定某样品中W 3+与W 2+的离子数之比为6∶91.若该晶体的化学式为W x Z ,则x= .【答案】(15分)(1)3 Mg(NH 2)2==Mg 3N 2+4NH 3↑ (2分)(2) 水中的O 和金刚石中的C 都是sp 3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键(2分)314443AaN ×1010(2分) 20(1分)(3)①1s22s22p63s23p63d8(2分) 26 (1分)②sp2杂化(1分) 7N A(1分)③平面三角(1分)④0.97 (2分)22.(12分)【化学—物质结构与性质】已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列.回答下列问题:(1)Z+的核外外围电子排布式是_________________________________________________.(2)X以及与X左右相邻的两种元素,其第一电离能由由大到小的顺序为____________(填元素符号).(3)Q元素最高价氧化物的水化物分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________________.(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是________________________;Q的氯化物、T 的氯化物、X的氯化物的熔点由低到高的顺序是___(填化学式).(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示.晶体中距每个X原子周围距离最近的Q原子有个【答案】(1) 3d10 (2分)(2) Mg> Al > Na (2分)(3) sp2N2O(或CS2等)(各1分)(4) O的非金属性比S强(或H2O的键能比H2S大)(2分) CCl4 < NaCl < MgCl2 (2分)(5) 2(2分)23.今有a X、b Y、c Z三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2np n+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:(1)X________,Y________,Z________(写元素符号).(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用).(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________.【答案】(1)Na O C(2)离子Na+、O22-离子键、非极性键(3)直线形正四面体形sp1sp32个σ键和2个π键24.(14分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系.根据要求回答问题:I、已知:甲是常见单质,丙为氢气.(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为 .(2)若甲为碳,则产物乙、丙可合成甲醇.①已知:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1CH 4(g)+H2O(g)CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:__________________.②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表.则T1 ______ T2(填“>”、“<”、“=”).温度/℃T1T2K 2.0410.012③乙可做某碱性燃料电池的燃料,该电池的负极反应式为_________________.II、已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性.(3)若构成甲的阴、阳离子个数比为2:3,丙是气体.则构成甲的阴、阳离子半径大小关系为(用具体的微粒表示).(4)若乙是O2,则甲的一种重要用途是;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 .【答案】(1)3Fe3O42O3(2)①CO(g)+2H2(g)=CH3OH △H=-129 kJ·mol-1,② < ③CO-2e-+4OH-=CO32- +2H2O(3)N>Mg(4)生氧剂或漂白剂 C(Cl-)>C(ClO-)>C(OH-)25.(9分)已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式_____________.将气体D作为燃料电池的燃料源可以制成D—空气燃料电池系统,总反应式为:D+O2 A+H2O(未配平),写出此碱性燃料电池的负极反应式:________________.(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为____________(写化学式).(3)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E 的稀溶液反应的离子方程式:_________________________________.已知常温下1molC与H2O反应生成气体D和E溶液放出46kJ热量,写出C与水反应生成D和E的热化学方程式:________________________.【答案】(9分)(1) Mg3N2+6H2O=3Mg(OH)2↓+ 2NH3↑(2分) ;2NH3 - 6e-+6OH-=N2+6H2O (2分)(2) Al2S3(1分;(3) Fe + 4H+ + NO3—=Fe3+ + NO↑+ 2H2O;(2分)3NO2(g)+ H2O (l)=2HNO3(aq)+ NO(g) △H=-138KJ/mol (2分)26.(12分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一.请回答下列问题:(1)H中含有的化学键类型是________________________.(2)上述框图所示的反应中,既属于化合反应,又属于氧化还原反应的反应共有______个;反应③的离子方程式____________________________.(3)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在溶液变红的一极收集到0.2 g气体,则此时溶液的pH是_______(假设溶液的体积为2 L且不考虑电解后溶液体积的变化).(4)J溶液显_______(填“酸”、“碱”或“中”)性,原因是_________________________.(用离子方程式表示)【答案】(12分)(1)共价键、离子键(2分)(2)3(2分);Al2O3+2OH-+3H2O=2[Al(OH)4]-(2分)(3)13(2分)(4)酸(2分); Fe3++3H 2O Fe(OH)3+ 3 H+(2分)27.(14分)如下图中A~J分别代表有关反应中的一种中学化学常见单质或化合物,其中B、C、D、I均为无色气体,G为白色沉淀.(部分产物和反应条件已略去)(1)若A加热后得到等物质的量的B和C,则A的化学式为 .(2)实验室检验B的方法是 .(3)写出上述由I生成J的化学方程式: .(4)写出C和少量Na[Al(OH)4]溶液反应的离子方程式: .(5)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择 (填代号).A.石灰石B.稀硝酸C.稀硫酸D.稀盐酸E.纯碱所需气体发生装置是 (填代号);所选装置中涉及的玻璃仪器的名称为________________________.【答案】(14分) (1) NH4HCO3(2)用蘸有浓盐酸的玻璃棒靠近,若出现白烟,证明是NH3或用湿润的红色石蕊试纸靠近,若试纸变蓝,证明是NH3(3)4NO+3O2+2H2O4HNO3(4)CO2+[Al(OH)4]-Al(OH)3↓+ HCO3-(5)C、E A 分液漏斗、圆底烧瓶28.(10分)K2EO4(E代表某种元素)在工业上有重要的应用,以下是制备该物质的工艺流程图:已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料.请回答以下问题:(1)x的化学式是,H的化学式是 .(2)写出F→G的离子反应方程式 .(3)要工业上实现B→E的转化,y的化学式可能是 .(4)1molH转化为K2EO4时需H2O2的物质的量是 .【答案】(1)FeS2(2分) Fe(OH) 3(2分)(2)2Fe2++2H++H2O2=2Fe3++2H2O(2分)(3)CO (2分)(4)1.5mol(2分)29.(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.ABCDEH MN QRR T②足量T①盐酸潮湿空气水B点燃△ABC D EHMN Q RRT②足量T①盐酸潮湿空气水B点燃△W(1)写出下列物质的化学式:D :____________,R :_______________; 写出下列物质的电子式A : ; (2)按要求写下列反应方程式:H 在潮湿空气中变成M 的过程中的化学方程式:__________________; B 与R 反应的化学方程式:___________________________ ; D 与盐酸反应的离子方程式:________________________.(3)向沸水中加入W 饱和溶液,可制得一种红褐色胶体,该反应的离子方程式为:_________.【答案】(1)D :Fe 3O 4 R :Al A :(2) 4Fe(OH)2 +O 2+2H 2O=4Fe(OH)32Al +2NaOH +2H 2O =2NaAlO 2+3H 2↑ Fe 3O 4 + 8H += Fe 2++ 2Fe 3++ 4H 2O (3)Fe 3++3H 2OFe(OH)3 (胶体)+3H +30.(15分)下列框图所示的转化关系中,A 、C 均为常见的金属单质,A 、C 在冷的H 的浓溶液中均会发生钝化;E 为固体非金属单质.B 为红色固体氧化物,X 为常见的无色液体.L 焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)请回答以下问题:(1)含碳量在0.03 %~2 %之间的C 的合金,是目前世界上使用量最大的合金,这种合金是 ; A .铝合金 B .青铜 C .镁合金 D .钢铁(2)F的化学式为;(3)I与氯气反应的离子方程式为;(4)A与B生成C和D的反应是(填“放出”或“吸收”)大量热量的反应;(5)D与L反应的离子方程式为 .【答案】(1)D (3分)(2)SO2(3分)(3)2Fe2+ + Cl2 = 2Fe3+ + 2Cl (3分)(4)放出(3分)(5)Al2O3 + 2OH—=2AlO2— + H2O (3分)31.(12分) A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出).已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F 六种物质中均含同一种元素.请填写下列空白:(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是 .(2)写出C、H物质的化学式:C ,H .(3)写出反应①、⑦的化学方程式:反应①:;反应⑦: .(4)反应⑥过程中的现象是 .【答案】(每空2分,共12分)(1)铁元素(2)FeCl2Al2O3(3)8Al+3Fe3O44Al2O3+9Fe2Al+2NaOH+2H2O===2NaAlO2+3H2↑(4)生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色高温32.(14分)有A、B、C、D四种物质,B的焰色反应为黄色.C是酸式盐,C加入硝酸酸化的Ba(NO3)2溶液中有白色沉淀生成.D和G相遇有大量白烟生成,D通入硝酸酸化的AgNO3溶液有白色沉淀生成.对A、B、C、D四种物质的水溶液进行下列实验,过程和现象如下图所示(图中部分产物未列出),请回答下列问题:(1)B的电子式为____________________.(2)H生成I的化学方程式为 .(3)G在同主族同类物质中稳定性最强____,也是沸点最高的 .(判断正误填“是”或“否”)(4)A溶液中加入D,A溶液的颜色由浅绿色变黄,则A的化学式为__________ .(5)写出C与过量B反应(加热)的离子方程式 .(6)C与D溶液恰好反应,假设生成气体全部逸出,所得溶液中离子浓度从大到小的顺序 .(7)25℃时pH=9的B溶液和pH=9的G溶液中,水的电离程度B___________G(填>,<或=).【答案】(1)略(2)2SO2+O22SO3(3)是;否(4)Fe(NO3)2(5) NH4++HSO3-+2OH- NH3 ↑+SO32-+2H2O(6) [Cl-]>[NH4+]>[H+]>[OH- ] (7) =33.单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:请回答下列问题:(1)组成A单质的元素在周期表中处于第__________周期__________族.(2)化合物B的电子式为_____________________________.(3)D与G两溶液混合后发生反应的离子方程式为____________________(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示).(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g.(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________.以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol.【答案】 (1)三ⅢA(2)(3)Al3++3+6H 2O=4Al(OH)3↓(4)<Al3++3H 2O Al(OH)3+3H+(5)21.6(6)O2+4H++4e-=2H2O67.2 434.(12分)下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,图中有部分生成物未标出.请填写以下空白:(1)A的化学式为,B的电子式为 .(2)写出下列反应的化学方程式:D+G→H .F+J→B+C+I .(3)0.3 mol I与足量C反应转移电子的物质的量为 mol.(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL.【答案】(1) NH4HCO3(2分),(2分)11 / 11 (2)4NH 3+5O 24NO+6H 2O (2分) C+4HNO 3(浓) =CO 2↑+4NO 2↑+2H 2O(2分)(3)0.2(2分)(4)8(1分)2(1分) 35.下图中A ~J 分别代表相关反应的一种物质.已知A 分解得到等物质的量的B 、C 、D ,图中有部分生成物未标出.请填写以下空白:(1)A 的化学式 . (2)定出反应①②的化学方程式:① ,② .(3)写出反应③的离子方程式: .(4)J 与F 反应的化学方程式: .(5)在反应④中,当生成标况下2.24 L G 时,转移电子数为 mol.【答案】(1)NH 4HCO 3(2)①2Mg +CO 2 2MgO +C②4NH 3+5O 24NO +6H 2O (3)NH 4++HCO 3-+2OH-NH 3↑+CO 32-+2H 2O (4)C +4HNO 3(浓)CO 2↑+4NO 2↑+2H 2O (5)0.2催化剂=点燃 催化剂=。
