高中化学铝三角总结
镁和铝重要知识点总结
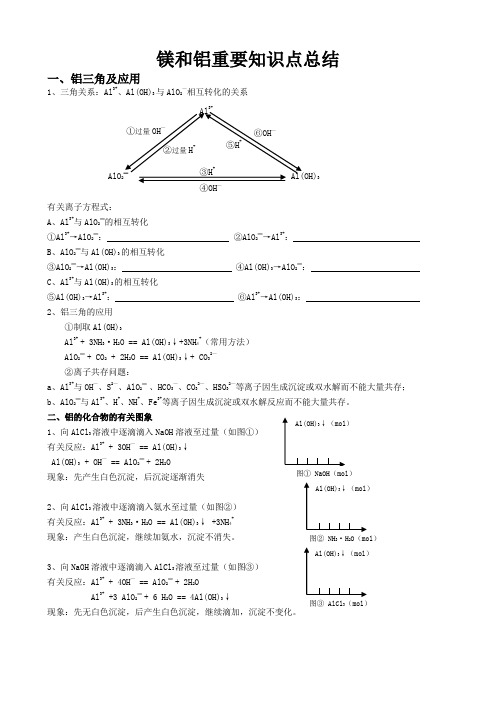
①过量OH —②过量H +③H +④OH —⑤H +⑥OH —镁和铝重要知识点总结一、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式: A 、Al3+与AlO 2—的相互转化①Al 3+→AlO 2—: ②AlO 2—→Al 3+: B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3++ 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法) AlO 2—+ CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2—、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存; b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
二、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3++ 3OH —== Al(OH)3↓ Al(OH)3 + OH —== AlO 2—+ 2H 2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3++ 3NH 3·H 2O == Al(OH)3↓ +3NH 4+现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3++ 4OH —== AlO 2—+ 2H 2OAl 3++3 AlO 2—+ 6 H 2O == 4Al(OH)3↓Al 3+Al(OH)3AlO 2—4、向AlCl 3溶液中逐滴滴入NaAlO 2有关反应: Al 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓ 现象:产生白色沉淀,继续滴加,沉淀不变化。
高中化学铝知识点归纳总结

高中化学铝学问点归纳总结高中化学铝学问点归纳总结铝及其铝的化合物(1)铝及其铝的化合物的学问体系(2)铝①铝在周期表中的位置和物理性质铝在周期表中第三周期ⅢA族,是一种银白色轻金属,具有良好的导电性、导热性和延展性。
它可应用于制导线、电缆、炊具,铝箔常用于食品和饮料的包装,铝还可以用于制造铝合金。
②化学性质与非金属反响4Al+3O22Al2O3(常温生成致密而结实的氧化膜)4Al+3O22Al2O3(铝箔在纯氧中燃烧发出刺眼的白光)与酸反响2Al+6HCl2AlCl3+3H2↑(Al与非氧化性酸反响产生氢气)Al+4HNO3(稀)Al(NO3)3+NO↑+2H2O常温时遇浓HNO3 发生钝化,但加热可反响与碱溶液反响2Al+2NaOH+2H2O2NaAlO2+3H2↑与氧化物反响2Al+Fe2O32Fe+Al2O3(铝热反响可用于焊接钢轨、冶炼某些金属)(3)氧化铝①是一种白色难溶的固体,不溶于水。
是冶炼铝的原料,是一种比较好的耐火材料。
②氧化铝是两性氧化物。
与酸反响:Al2O3+6HCl2AlCl3+3H2O与碱反响:Al2O3+2NaOH2NaAlO2+H2O既能与强酸反响,又能与强碱反响的物质:Al、Al2O3、Al(OH)3、弱酸的酸式盐(NaHCO3、NaHSO3)、弱酸的铵盐[(NH4)2CO3、(NH4)2SO3]、氨基酸等。
(4)氢氧化铝制备AlCl3+3NH3·H2OAl(OH)3↓+3NH4Cl与酸反响Al(OH)3+3HClAlCl3+3H2O与碱反响Al(OH)3+NaOHNaAlO2+2H2O加热分解2Al(OH)3Al2O3+3H2O(5)A l3+、、Al(OH)3 间的相互转化关系Al3+Al(OH)3在AlCl3 溶液中逐滴参加NaOH 溶液的现象:先消灭白色沉淀,NaOH 溶液过量白色沉淀又渐渐消逝。
AlCl3+3NaOH=Al(OH)3↓+3NaCl;Al(OH)3+NaOH=NaAlO2+2H2O(两瓶无色的溶液其中一瓶是AlCl3 溶液,另一瓶是NaOH 溶液,承受互滴法可以对这两瓶无色溶液进展鉴别)在NaAlO2 溶液中逐滴参加盐酸的现象:先消灭白色沉淀,盐酸过量白色沉淀又渐渐消逝。
铝三角专题

2)向AlCl3溶液中逐滴加入氨水至过量 ) 现象:出现白色沉淀, 现象:出现白色沉淀,且沉淀不消失 Al 方程式: 方程式: 3++3NH3·H2O = Al(OH)3↓+3NH4+
Al(OH)3/mol
0
NH3·H2O/mol
3)向NaOH溶液中滴加 ) 溶液中滴加AlCl3溶液至过量 溶液中滴加 现象:先无现象,后出现沉淀, 现象:先无现象,后出现沉淀,且沉淀不消失 方程式: 方程式: Al3++4OH- = AlO2- +2H2O Al3++3Al02- +6H2O=4Al(OH)3↓
3).Na2CO3溶液和盐酸溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中 将其中一种溶液 逐滴加入另一种溶液b中, 逐滴加入另一种溶液 若立即有气泡,则 溶液、 为 若立即有气泡 则a Na2CO3溶液、b为盐酸 溶液; 若开始没有现象,后有气泡 则 为盐酸溶液、 若开始没有现象,后有气泡,则a为盐酸溶液、 b为Na2CO3溶液; 溶液; 为
9)向含有物质的量相等的MgCl2 、AlCl3、 )向含有物质的量相等的 滴加入NaOH至过量 混合溶液中逐 滴加入 至过量
4.互滴法鉴别的物质举例 互滴法鉴别的物质举例 1)AlCl3 溶液和 ) 溶液和NaOH溶液的鉴别 溶液的鉴别: 溶液的鉴别 将其中一种溶液a逐滴加入另一种溶液 中, 将其中一种溶液 逐滴加入另一种溶液b中 逐滴加入另一种溶液 若立即产生沉淀,后来沉淀溶解 则 若立即产生沉淀 后来沉淀溶解,则aNaOH 后来沉淀溶解 溶液、 为 溶液、b为AlCl3溶液; 若开始没有沉淀,后来有沉淀 则 为 若开始没有沉淀 后来有沉淀,则a为AlCl3溶 后来有沉淀 溶液; 液、b为NaOH溶液; 为 溶液
重难点九 铝的化合物之间的相互转化—“铝三角”

重难点九 铝的化合物之间的相互转化----“铝三角”【要点解读】 1.Al 3+―→Al(OH)3(1)可溶性铝盐与少量NaOH 溶液反应: (2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al 3+:Al(OH)3溶于强酸溶液: 3.Al 3+―→AlO 2-:可溶性铝盐与过量的强碱反应: 4.AlO 2-―→Al 3+:偏铝酸盐溶液与足量的盐酸反应: 5.AlO 2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸: 6.Al(OH)3―→ AlO 2- :Al(OH)3溶于强碱溶液: 【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】 1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO 2-→Al(OH)3最好通入CO 2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质 (1)金属单质:Al 等; (2)两性氧化物:Al 2O 3等; (3)两性氢氧化物:Al(OH)3 等;(4)弱酸的铵盐:(NH 4)2CO 3、CH 3COONH 4、(NH 4)2S 等; (5)弱酸的酸式盐:NaHCO 3、KHS 、NaHSO 3等。
【重难点指数】★★★★【重难点考向一】氢氧化铝的制取和性质探究【例1】实验室制取氢氧化铝的最佳方案是( )A.Al+H2O B.Al2O3+H2O C.AlCl3+NaOH D.Al2(SO4)3+NH3•H2O【重难点考向二】铝及其化合物性质探究【例2】某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的是( ) A.向氯化铝溶液中滴加过氨水,最终得到澄清溶液B.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气C.常温下铝与浓硝酸反应制得大量的NO2D.AlCl3溶液加热蒸干得到无水氯化铝晶体【重难点考向三】铝三角之间的转化【例3】A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)(1)写出化学式:A______,B________,C________,D________,E________;(2)写出下列反应的离子方程式:A→B:___________________________________________________;A→D:___________________________________________________。
重难点九 铝的化合物之间的相互转化—“铝三角”

重难点九 铝的化合物之间的相互转化----“铝三角”【要点解读】 1.Al 3+―→Al(OH)3(1)可溶性铝盐与少量NaOH 溶液反应: (2)可溶性铝盐与氨水反应:2.Al(OH)3―→Al 3+:Al(OH)3溶于强酸溶液: 3.Al 3+―→AlO 2-:可溶性铝盐与过量的强碱反应: 4.AlO 2-―→Al 3+:偏铝酸盐溶液与足量的盐酸反应: 5.AlO 2-―→Al(OH)3:偏铝酸钠溶液中加入少量盐酸: 6.Al(OH)3―→ AlO 2- :Al(OH)3溶于强碱溶液: 【温馨提示】三种物质相互转化注意反应条件,特别是Al(OH)3既能溶于强酸,又能溶于强碱。
【特别提醒】 1.两性化合物的概念指既能与酸反应,又能与碱反应的化合物。
与酸或碱反应生成的产物是盐和水的化合物才是两性化合物。
弱酸的铵盐、弱酸的酸式盐不属于两性化合物。
2.Al(OH)3的三种制备方法(1)用铝盐和氨水制备Al(OH)3,不选用强碱(如NaOH)溶液,是由于Al(OH)3溶于强碱溶液,而不溶于弱碱(如氨水)溶液。
(2)溶液中AlO 2-→Al(OH)3最好通入CO 2,而不是选用强酸,因为氢氧化铝溶于强酸,而不溶于较弱的酸。
3.常见的既能与酸反应又能与碱反应的物质 (1)金属单质:Al 等; (2)两性氧化物:Al 2O 3等; (3)两性氢氧化物:Al(OH)3 等;(4)弱酸的铵盐:(NH 4)2CO 3、CH 3COONH 4、(NH 4)2S 等; (5)弱酸的酸式盐:NaHCO 3、KHS 、NaHSO 3等。
【重难点指数】★★★★【重难点考向一】氢氧化铝的制取和性质探究【例1】实验室制取氢氧化铝的最佳方案是( )A.Al+H2O B.Al2O3+H2O C.AlCl3+NaOH D.Al2(SO4)3+NH3•H2O【重难点考向二】铝及其化合物性质探究【例2】某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的是( ) A.向氯化铝溶液中滴加过氨水,最终得到澄清溶液B.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气C.常温下铝与浓硝酸反应制得大量的NO2D.AlCl3溶液加热蒸干得到无水氯化铝晶体【重难点考向三】铝三角之间的转化【例3】A、B、C、D、E五种化合物均含有同一种短周期常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E易溶于水.若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片)(1)写出化学式:A______,B________,C________,D________,E________;(2)写出下列反应的离子方程式:A→B:___________________________________________________;A→D:___________________________________________________。
铝三角及应用

①过量OH —②过量H +③H + ④OH —⑤H + ⑥OH —“铝三角”的图像分析及计算一、镁、铝的工业制法 1、镁的工业制法:(从海水中提取镁)2、铝的工业制法:(以铝土矿为原料) 二、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—:②AlO 2—→Al 3+:B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法)AlO 2— + CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2— 、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存;b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
三、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3+ + 3OH —== Al(OH)3↓Al(OH)3 + OH —== AlO 2—+ 2H 2O现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓ +3NH 4+ 现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3+ + 4OH —== AlO 2—+ 2H 2OAl 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓现象:先无白色沉淀,后产生白色沉淀,继续滴加,沉淀不变化。
高三化学一轮复习 铝三角

证对市爱幕阳光实验学校市惠第一高三化学一轮复习铝三角【学习目标】1、记住铝三角转化的条件与用量。
2、建立数形结合的思维【难点】:铝三角转化的条件与用量。
难点:建立数形结合的思维【使用说明及学法指导】1、完成预习案,形成铝三角完整的知识体系。
2、熟记铝三角转化的条件与用量。
3、建立数形结合的思维预习案知识梳理1. Al3+、Al(OH)3、AlO-2之间的转化关系写出上述转化的离子方程式。
2.与Al(OH)3沉淀生成有关的计算及图像分析(1)把强碱溶液逐滴参加到铝盐(Al3+)溶液中至过量①现象:先有白色沉淀产生,然后沉淀逐渐溶解。
②有关反:A→B:Al3++3OH-===Al(OH)3↓B→D:Al(OH)3+OH-===AlO-2+2H2O③图像④有关计算a.根据AlCl3和NaOH的量计算生成Al(OH)3的量b.根据AlCl3和Al(OH)3的量计算需要NaOH的量(2)把铝盐(Al3+)溶液逐滴参加到强碱溶液中至过量①现象:先无明显现象,然后逐渐产生大量的白色沉淀。
②有关反:A→B:Al3++4OH-===AlO-2+2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓③图像(3)把强酸溶液逐滴参加到AlO-2溶液中至过量①现象:先生成白色沉淀,随后沉淀逐渐溶解。
②有关反:A→B:AlO-2+H++H2O===Al(OH)3↓B→D:Al(OH)3+3H+===Al3++3H2O③图像④有关计算a.根据NaAlO2和HCl计算生成Al(OH)3的量b.根据Al(OH)3和NaAlO2的量计算需要参加HCl的量(4)向强酸溶液中逐滴参加AlO-2溶液至过量①现象:先无明显现象,反一段时间后逐渐产生白色沉淀。
②有关反:A→B:4H++AlO-2===Al3++2H2OB→C:Al3++3AlO-2+6H2O===4Al(OH)3↓③图像(5)矾溶液中逐滴参加Ba(OH)2溶液至过量①现象:先有白色沉淀生成,然后沉淀溶解。
铝三角

元素化合物知识作为其他化学知识的载体,在中学化学中占有举足轻重的地位。
纵观近几年的高考试题,铝、氧化铝、氢氧化铝、常见的铝盐(如氯化铝、明矾等)一直是命题的热点。
Al3+、Al(OH)3、AlO2-的相互转化,应用在离子分离(如Mg2+、Al3+的分离)、共存及推断中的试题屡屡出现。
Al与酸反应、Al3+与碱反应,AlO2-与酸反应的离子方程式书写以及计算、图象分析等.传统的教学方式中,往往习惯于采用“铝三角”来教学。
铝三角可以表明Al3+、Al(OH) 3、AlO2-之间存在一定关联,三者之间可以通过加入酸或者碱相互转化。
然而关键的定量关系(Al3+与OH-相互滴加产物的讨论等)不能通过“铝三角”得以体现。
因为,铝三角忽略了最为关键的一点:AlO2-是Al(OH)3在OH-过量时产生的。
为了解决这一问题,笔者大胆提出“线型”学铝策略。
一.线型学铝概念的提出“线型学铝”策略中所谓的“铝线”,其实就是由H+ Al3+ Al(OH)3 AlO2- OH-五个粒子所构成的一条关系线。
出于H+、OH-与Al3+、Al(OH)3、AlO2-的紧密关系考虑,与“铝三角”不同,“铝线”中加入了H+、OH-这两种离子。
感觉上,粒子数的增加,使问题变的更为复杂;而实际上,只是将原本转换关系中隐藏的粒子更直观、更清晰表现出来。
二.线型学铝概念的剖析“线型学铝”基本内容可以由四句话来概括——相邻粒子不反应,相隔粒子聚中间,隔之越远越易行,所带电荷是关键。
(一)相邻粒子不反应——解决粒子间共存问题有铝元素参加的粒子间共存问题的讨论一直是会考、高考的热点,2004年的浙江省会考试卷中就有两题(第4题、第23题)涉及这一内容。
例:下列物质中,既能跟NaOH溶液反应,又能跟盐酸反应的是( )A.Al(OH)3B.Na2CO3C.NH4ClD.CH3COONa该题考查了“铝线”中的粒子的共存关系。
只要明确“铝线”上相邻粒子是不反应的,不相邻粒子间可以反应,那么选答案A也就十分明确了。
“铝三角”及其应用

见步步高P42 深度思考11题
- CO2 ② AlO2 适量
途径3:铝盐与偏铝酸盐反应
Al3+
AlO2-
Al(OH)3
3.图像问题 试写出各阶段离子方程式,并作出下列反应图像。
【以所加溶液的物质的量为横坐标,n【 Al(OH)3】为纵坐标)】
①向AlCl3溶液中滴加NaOH溶液直至过量
n[Al(OH)3]
y
y
y
0
a
x
b
0
c
x 0
d
x
实验与图像对应关系正确的是 ( C D )
A. ①和c B. ②和a C. ③和b D. ④和d
点击高考
1.有MgCl2和Al2(SO4)3的混合溶液,向其中 不断加入NaOH溶液得到沉淀的物质的量与 加入NaOH溶液体积的关系如图所示,则溶 液中Mg2+与Al3+的物质的量浓度之________ 1:2
1.离子共存问题
知识归纳: Al3+ 与 OH-、CO32-、HCO3-、AlO2-、S2-、HS-、ClO-、SiO32等不能大量共存 AlO2-与 H+、Al3+、Fe3+、NH4+、 HCO3-等不能大量共存
例:在某化工厂生产中要用到一种无色、可溶于水的晶体——铝 铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。 向该复盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。 已知 NH4+与AlO2-在水溶液中不能大量共存,会发生如下反应: NH4++AlO2-+H2O=Al(OH)3↓+NH3↑ 试回答:(1)在硫酸铝铵水溶液中滴入石蕊试液,观察到的现 象______________,其原因是___________________________。 溶液变红 NH4+和Al3+水解使溶液呈酸性 (2)在逐滴加入浓NaOH溶液的过程中,产生的现象有: ①溶液中出现白色沉淀;②有刺激性气味的气体逸出; ③白色沉淀量逐渐增多;④白色沉淀完全消失; ⑤白色沉淀量逐渐减少。 请答出各种现象由先到后出现的顺序(用序号回答): _____→_____→_____→______→______。 ① ③ ② ⑤ ④ (3)写出滴入NaOH溶液的过程中,有关反应的离子方程式:
三角关系
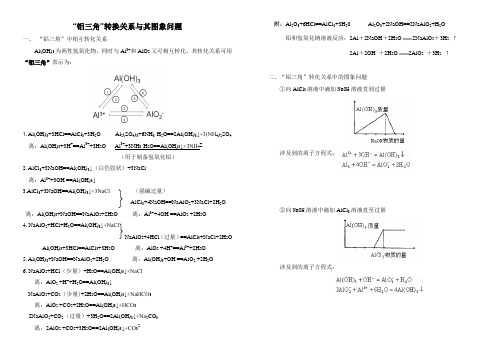
“铝三角”转换关系与其图象问题一、“铝三角”中相互转化关系Al(OH)3为两性氢氧化物,同时与Al3+和AlO2-又可相互转化,其转化关系可用“铝三角”表示为:1. Al(OH)3+3HCl==AlCl3+3H2O Al2(SO4)3+6NH3·H2O==2Al(OH)3↓+3(NH4)2SO4离:Al(OH)3+3H+==Al3++3H2O Al3++3NH3·H2O==Al(OH)3↓+3NH4+(用于制备氢氧化铝)2. AlCl3+3NaOH==Al(OH)3↓(白色胶状)+3NaCl离:Al3++3OH-==Al(OH)3↓3.AlCl3+3NaOH==Al(OH)3↓+3NaCl(强碱过量)AlCl3+4NaOH==NaAlO2+3NaCl+2H2O 离:Al(OH)3+NaOH==NaAlO2+2H2O 离:Al3++4OH-==AlO2-+2H2O4. NaAlO2+HCl+H2O==Al(OH)3↓+NaClNaAlO2+4HCl(过量)==AlCl3+NaCl+2H2O Al(OH)3+3HCl==AlCl3+3H2O 离:AlO2-+4H+==Al3++2H2O5. Al(OH)3+NaOH==NaAlO2+2H2O 离:Al(OH)3+OH-==AlO2-+2H2O6. NaAlO2+HCl(少量)+H2O==Al(OH)3↓+NaCl离:AlO2-+H++H2O==Al(OH)3↓NaAlO2+CO2(少量)+2H2O==Al(OH)3↓+NaHCO3离:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-2NaAlO2+CO2(过量)+3H2O==2Al(OH)3↓+Na2CO3离:2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-附:Al2O3+6HCl==AlCl3+3H20Al2O3+2NaOH==2NaAlO2+H2O 铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑二、“铝三角”转化关系中的图象问题①向AlCl3溶液中滴加NaOH溶液直到过量涉及到的离子方程式:②向NaOH溶液中滴加AlCl3溶液直至过量涉及到的离子方程式:③向AlCl3溶液中滴加稀氨水直至过量涉及到的离子方程式:④向NaAlO2溶液中滴加稀盐酸直至过量涉及到的离子方程式:⑤向稀盐酸中滴加NaAlO2溶液直至过量涉及到的离子方程式:⑥向NaAlO2溶液中通入气体直至过量涉及到的离子方程式:例:准确称取6g 铝土矿(含)样品放入盛有100mL溶液的烧杯中,充分反应后过滤,再后滤液中加入10mol /L NaOH 溶液,产生沉淀质量m(g)与所加NaOH 溶液的体积V(mL)关系如下图所示,试求1.溶液的物质的量浓度。
高考过关知识点4铝三角的转化关系及图像分析

高考过关知识点4“铝三角”的转化关系及图像分析命题点1“铝三角”转化与应用1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]-与H+、HCO-3以及弱碱阳离子Al3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量共存。
(2)鉴别(利用滴加顺序不同,现象不同)。
①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
[对点训练1](2017·青岛模拟)下列说法不正确的是()A.铝箔插入稀硝酸中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜B. 如右图所示,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成C.Al2O3――→NaOH(aq)△Na[Al(OH)4](aq)――→CO2Al(OH)3D.AlCl3溶液中滴加NaOH溶液后铝的存在形式:A[铝与稀HNO3发生反应有NO生成,不能形成氧化膜,A不正确;浓氨水挥发出的NH3被AlCl3溶液吸收生成白色沉淀Al(OH)3,B正确;Al2O3为两性氧化物与NaOH反应生成Na[Al(OH)4],Na[Al(OH)4]溶液遇CO2生成Al(OH)3,C正确;当n(NaOH)∶n(AlCl3)=3时,恰好生成Al(OH)3,当n(NaOH)∶n(AlCl3)=4时,恰好生成Na[Al(OH)4],D正确。
][对点训练2](2017·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是()A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
高中化学铝三角

铝是高中化学重要的金属,主要有铝、氧化铝、氢氧化铝。
高考化学中铝的考点主要集中的铝及其化合物的两性,即既可以与酸反应,也可以与碱反应。
铝三角主要体现了铝及其化合物的两性一、单质铝(Al)铝是一种活泼金属,具有金属的共性,能够与非金属、酸、某些盐反应,同时具有自己特有的性质,可以与碱反应。
铝极易失去最外层3个电子形成铝离子:Al -3e -=Al 3+。
1.铝与非金属反应铝可以与大多数非金属单质反应,如氧气、氯气、硫、溴等,生成相应的氧化物或盐。
4Al +3O 2 Δ → 2Al 2O 3;2Al +3S Δ → Al 2S 3;2Al +3Cl 2 点燃→ 2AlCl 3;2.铝与酸反应这里所说的酸,主要指稀硫酸和稀盐酸,常温常压下,铝遇浓硫酸或浓硝酸会发生钝化,所以可用铝制容器盛装浓硫酸或浓硝酸。
注意钝化也属于化学变化。
2Al +6HCl → 2AlCl 3+3H 2↑;2Al +3H 2SO 4 → Al 2(SO 4)3+3H 2↑;3.铝与强碱反应大多数金属不与碱反应,与强碱反应,是铝特有的性质,(锌也可以发生类似的反应,了解即可)2Al +2NaOH +2H 2O → 2NaAlO 2+3H 2↑;该反应的本质是铝首先与水反应,生成氢氧化铝与氢气,2Al+6H2O=2Al(OH)3+3H2↑;然后,氢氧化铝与氢氧化钠反应,2Al(OH)3+2NaOH=2NaAlO2+4H2O。
在整个过程中,水是氧化剂,而氢氧化钠不是氧化剂。
在解答电子转移和电线桥双线桥法的题目中要注意。
4.铝热反应铝热反应是指铝在高温条件下还原金属氧化物,置换金属单质的一种反应,不是特指与铝与氧化铁的反应。
2Al+Fe2O3高温→ 2Fe+Al2O3,铝具有较强的还原性,可以还原一些金属氧化物,如氧化钨,二氧化锰等等。
二、氧化铝(Al2O3)氧化铝熔点较高,硬度较大,可以与酸碱反应。
1.氧化铝与酸反应Al2O3+6HCl→2AlCl3+3H2O;对应离子方程式:Al2O3+6H+→2Al3++3H2O;2.氧化铝与碱反应Al2 O 3+2 N a O H 3.电解氧化铝生成金属铝2Al2O34Al+3O2↑;加入冰晶石可以降低电解温度。
铝三角的化学方程式以及离子方程式

铝三角的化学方程式以及离子方程式铝三角是一种常见的实验室制备铝的方法。
它的化学方程式可以表示为:2 Al + 6 HCl → 2 AlCl3 + 3 H2↑这个化学方程式描述了铝与盐酸反应生成氯化铝和氢气的过程。
在这个方程式中,铝是还原剂,它失去了电子并被氯化成氯化铝。
盐酸是氧化剂,它接受了电子并被还原成氢气。
这个反应是一种氧化还原反应,也称为单纯的金属与酸反应。
离子方程式是化学方程式的一种扩展形式,用于描述反应中参与的离子的转化。
离子方程式可以写成:2 Al(s) + 6 H+(aq) + 6 Cl-(aq) → 2 Al3+(aq) + 6 Cl-(aq) +3 H2(g)在这个离子方程式中,固体铝被写成了离子形式的铝离子(Al3+)。
HCl被写成了盐酸中的离子形式,即氢离子(H+)和氯离子(Cl-)。
通过写出离子方程式,我们可以更清楚地看到反应中发生的离子转化过程。
铝三角实验中,铝片被放入盐酸溶液中。
在反应过程中,铝片逐渐溶解,生成了氯化铝和氢气。
氯离子和铝离子在溶液中存在,并随着反应进行而增加。
同时,氢离子和氯离子也存在于溶液中,但它们的浓度没有发生变化。
铝三角实验是一个常见的实验室制备铝的方法,因为它简单易行,产生的产物纯度高。
通过控制反应条件,可以调节铝的产量和反应速率。
这个实验也可以用于教学目的,让学生了解金属与酸的反应及氧化还原反应的原理。
在描述铝三角的化学方程式和离子方程式时,我们要注意一些细节。
首先,化学方程式中的反应物和产物要使用正确的化学式表示。
其次,方程式中的系数要符合质量守恒和电荷守恒原则。
最后,离子方程式中要标明溶液中的离子和相应的电荷。
总结起来,铝三角的化学方程式和离子方程式描述了铝与盐酸反应生成氯化铝和氢气的过程。
通过这个实验,我们可以了解金属与酸的反应及氧化还原反应的原理。
这个实验简单易行,适合用于教学和实验室制备铝。
