候氏制碱法的实验原理(6张)
侯氏制碱法

侯氏制碱法NH3与H20和CO2反应生成一分子的NH4HCC3,这是第一步。
第二步是:NH4HCQ与NaCI 反应生成一分子的NH4CI和NaHCQ沉淀。
根据NH4CI在常温时的溶解度比NaCI大,而在低温下却比NaCI 溶解度小的原理,在278K〜283K(5 C〜10 C )时,向母液中加入食盐细粉,而使NH4CI单独结晶析出供做氮肥。
侯氏制碱法化学原理总反应方程式:NaCI + CO +NH3+H20=NaHCO J +NH4CI (可作氮肥)2NaHC03=Na2C03+H20+CQ f (C02循环使用)(以加热作为反应条件)(在反应中NaHCQ沉淀,所以这里有沉淀符号,这也正是这个方法的便捷之处)即:①NaCI(饱和溶液)+NH3 (先加)+H20 (溶液中)+C02 (后加)=NH4CI+NaHCQ J (NaHCQ 能溶于水,但是侯氏制碱法向饱和氯化钠溶液中通入氨气,由于氯化钠溶液饱和,生成的碳酸氢钠溶解度小于氯化钠,所以碳酸氢钠以沉淀析出)(先添加NH3而不是CC2:CC2在NaCI中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CC2气体,产生高浓度的HCC3-,才能析出NaHCC3晶体。
)2NaHCC3 (加热)=Na2CO3+H2O+CQ f侯氏制碱法优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %; NH4CI可做氮肥(氮肥不可与碱性物质混用,但可用草木灰检验其纯度)[2];可与合成氨厂联合,使合成氨的原料气CO转化成CQ,革除了CaCO制CC2这一工序,减少可能造成的环境污染。
两个循环:一: 2NaHCO s=Na2CQ+H2O+CQ f (CQ循环使用)(以加热作为反应条件)二:向母液中加入食盐细粉,从而使NH4CI单独结晶析出供做氮肥。
第二个循环的具体操作:①通入氨气,冷却后,加入NaCI,使得NH4CI沉淀。
过滤后,得到较纯净的NH4CI晶体(产物),滤液为饱和食盐水(含有氨气分子),经处理后方可回到第一步循环利用;②不通氨气,冷却后,加入NaCI,使得NH4CI沉淀。
侯氏制碱反应原理

侯氏制碱反应原理我呀,就跟你唠唠这侯氏制碱反应原理。
你知道吗?这侯氏制碱法啊,那可是化学里一个特别了不起的事儿。
我先给你说说这制碱法里的那些个物质啊,就像那碳酸氢铵,这东西啊,白白的,小小的颗粒,看着不起眼儿。
还有氯化钠,咱平常吃的盐就是这东西,那是白花花的,一粒一粒的,晶莹剔透的。
这反应原理呢,就是把这些个物质搁一块儿,让它们起反应。
这反应的时候啊,就像是一群小蚂蚁在搬家似的,碳酸氢铵里的铵根离子啊,就像个调皮的小鬼,到处乱窜。
它碰到氯化钠里的氯离子啊,就开始捣鼓事儿了。
我给你形容一下那反应的环境啊。
那反应的容器里啊,就像一个小小的世界。
周围的空气啊,静悄悄的,就等着这些物质在里面开始表演呢。
那些化学物质在溶液里,溶液是清澈透明的,但是又感觉里面暗流涌动,就像平静的湖面下藏着好多要跃出水面的鱼一样。
这时候啊,我就想起我以前上学的时候,看化学老师在讲台上讲这个原理。
老师啊,戴着个厚厚的眼镜,眼睛在镜片后面瞪得大大的,手在空中比划着,说:“同学们,这个反应啊,就是这么神奇,就像魔法一样。
”我们就坐在下面,眼睛一眨不眨地看着老师,就像听一个特别神秘的故事。
这个侯氏制碱反应啊,主要就是利用了物质之间的溶解度的差别。
碳酸氢钠的溶解度比较小,就像一个不合群的家伙,在溶液里待不住,就一点点地析出来了。
这析出来的时候啊,就像下雪一样,那些白色的小颗粒啊,慢慢就从溶液里冒出来了,看着可有意思了。
我有时候就琢磨啊,这化学世界真是奇妙。
就这么简单的几个物质,放在一起就能有这么奇妙的反应。
这侯氏制碱法啊,给咱的工业生产可带来了大好处。
这就好比是一群普通的小工匠,凑在一起就盖出了一个特别宏伟的大楼一样,让人不得不佩服啊。
侯式制碱法原理和简单流程

侯式制碱法原理和简单流程【知识梳理】实验背景:无水碳酸钠,俗名纯碱、苏打。
它是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料,还常用作硬水的软化剂,也用于制造钠的化合物。
它的工业制法主要有氨碱法和联合制碱法两种。
一、实验原理化学反应原理: 32243NH CO H O NH HCO ++→4334()NaCl NH HCO NaHCO NH Cl +→↓+饱和总反应 : 32234()NaCl NH CO H O NaHCO NH Cl +++→↓+饱和 将经过滤、洗涤得到的NaHCO 3微小晶体再加热,制得纯碱产品:323222NaHCO Na CO CO H O ∆−−→+↑+二、氨碱法(又称索尔维法) 1.原料:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气 2.步骤:先把氨气通入饱和食盐水中而成氨盐水, 32243NH CO H O NH HCO ++→ 再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,4334()NaCl NH HCO NaHCO NH Cl +→↓+饱和将经过滤、洗涤得到的NaHCO 3微小晶体,再加热煅烧制得纯碱产品。
323222NaHCO Na CO CO H O ∆−−→+↑+(放出的二氧化碳气体可回收循环使用)含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用。
CaO +H 2O → Ca(OH)2,2NH 4Cl +Ca(OH)2 → CaCl 2+2NH 3↑+2H 2O 其工业流程图为:3.氨碱法的优点是:(1)原料(食盐和石灰石)便宜;(2)产品纯碱的纯度高;(3)副产品氨和二氧化碳都可以回收循环使用;(4)制造步骤简单,适合于大规模生产。
4.氨碱法的缺点是:(1)产生大量无用的副产品CaCl 2(2)NaCl 利用率只有70%,约有30%的NaCl 留在母液中。
(3)设备多,耗能大。
CO 2Na 2CO 3X 食盐水循环II循环I 母液NH 4Cl煅烧炉 合成氨厂 沉淀池NH 3NH 3 食盐细粉Z冷却至10℃以下,过滤联碱法(候氏制碱法)生产流程示意图CO 2Na 2CO 3X 食盐水,NH 3母液煅烧炉煅烧沉淀池CaOY排出液W循环II循环I氨碱法生产流程示意图石灰石三、联合制碱法(又称侯氏制碱法) 1.原料:食盐、氨气和二氧化碳——合成氨厂用水煤气制取氢气时的废气。
侯氏制碱法

侯氏制碱法侯氏制碱法氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃ ) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
索氏制碱法原理NH3+CO2+H2O=NH4HCO3NH4HCO3+NaCl=NaHCO3↓+NH4Cl总反应方程式:NaCl + CO2 + H2O + NH3= NaHCO3 ↓ + NH4Cl2NaHCO3====Na2CO3+H2O+CO2↑(CO2循环使用)侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序注:纯碱就是碳酸钠侯德榜1890年8月9日出生于福建省闽侯县自幼半耕半读,勤奋好学,有“挂车攻读”美名。
1903—1906年得姑妈资助在福州英华书院学习。
他目睹外国工头蛮横欺凌我码头工人,耳闻美国的旧金山种族主义者大规模迫害华侨、驱逐华工等令人发指的消息,使之产生了强烈的爱国心。
他曾积极参加反帝爱国的罢课示威1907—1910年就读于上海闽皖铁路学院。
毕业后,在英资津浦铁路当实习生。
侯氏制碱法

侯氏制碱法NH3与H2O和CO2反应生成一分子的NH4HCO3,这是第一步。
第二步是:NH4HCO3与NaCl反应生成一分子的NH4Cl和NaHCO3沉淀。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
侯氏制碱法化学原理总反应方程式:NaCl + CO2 +NH3+H2O=NaHCO3↓+NH4Cl(可作氮肥)2NaHCO3=Na2CO3+H2O+CO2↑(CO2循环使用)(以加热作为反应条件)(在反应中NaHCO3沉淀,所以这里有沉淀符号,这也正是这个方法的便捷之处)即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (NaHCO3能溶于水,但是侯氏制碱法向饱和氯化钠溶液中通入氨气,由于氯化钠溶液饱和,生成的碳酸氢钠溶解度小于氯化钠,所以碳酸氢钠以沉淀析出)(先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体,产生高浓度的HCO3—,才能析出NaHCO3晶体.)2NaHCO3(加热)=Na2CO3+H2O+CO2↑侯氏制碱法优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥(氮肥不可与碱性物质混用,但可用草木灰检验其纯度)[2];可与合成氨厂联合,使合成氨的原料气CO 转化成CO2,革除了CaCO3制CO2这一工序,减少可能造成的环境污染。
两个循环:一:2NaHCO3=Na2CO3+H2O+CO2↑(CO2循环使用)(以加热作为反应条件)二:向母液中加入食盐细粉,从而使NH4Cl 单独结晶析出供做氮肥。
第二个循环的具体操作:①通入氨气,冷却后,加入NaCl,使得NH4Cl沉淀。
实验室模拟侯氏制碱甲乙丁丙

实验室模拟侯氏制碱甲乙丁丙1. 介绍在化学实验室中,侯氏制碱是一种常见的化学反应方法。
通过该方法,甲乙丁丙等碱剂可以制备出氢氧化钠等碱性溶液。
2. 实验原理侯氏制碱反应是一种通过酸碱中和反应制备碱性溶液的方法。
在实验室中,我们常用的碱剂包括甲乙丁丙等物质。
这些碱剂可以与酸反应生成相应的盐和水。
以甲为例,其与盐酸反应可以产生甲盐和水的反应方程式为:CH3OH + HCl → CH3Cl + H2O将甲、乙、丙、丁等碱剂与盐酸等酸性物质反应后,反应生成的盐会与酸溶液中的氢氧化物离子发生中和反应,生成氯化物和水:HCl + NaOH → NaCl + H2O由此,我们可以利用侯氏制碱反应来制备出氢氧化钠等碱性溶液。
3. 实验步骤3.1 准备实验室设备和试剂在进行实验前,首先需要准备实验室所需的设备和试剂。
主要包括:•烧杯•搅拌棒•物质称量器具(如天平、量筒等)•石膏烧杯支架•温度计•甲乙丁丙等碱剂•盐酸溶液3.2 按照比例准确称取碱剂和酸溶液根据实验所需,按照一定的比例准确称取甲乙丁丙等碱剂和盐酸溶液。
在称取过程中需要保持准确和精确。
3.3 将碱剂加入烧杯中将准确称取的碱剂依次加入烧杯中,搅拌均匀。
3.4 缓慢加入盐酸溶液缓慢地将盐酸溶液倒入烧杯中,同时搅拌。
需要注意的是,加入盐酸溶液时要小心,以避免反应过程产生的溅出现象。
3.5 保持搅拌和温度控制在反应过程中,需要保持搅拌和适当的温度控制,以促进反应的进行和均匀性。
3.6 反应结束后收集产物当反应完成后,停止搅拌,并将产生的溶液倒入容器中。
4. 实验注意事项•在操作中要佩戴实验手套、护目镜和实验室白大褂等防护设备。
•注意安全,避免溅溶液等事故的发生。
•严格按照实验步骤操作,避免操作失误。
•注意控制温度和搅拌均匀性,以确保反应的进行和产物质量的稳定性。
5. 实验结果和讨论通过侯氏制碱反应,我们成功制备了氢氧化钠溶液。
实验中需要注意的是,反应过程中需要控制温度和搅拌均匀性,以保证制备的溶液的质量稳定。
高中化学实验篇(一)侯氏制碱法

高中化学实验篇(一)侯氏制碱法作为一个化学没考过的高三狗,我会通过这个平台整理一些化学小知识,夯实自己的基础。
今天来谈谈侯氏制碱法。
侯氏制碱法?是猴子吗!不不,侯氏制碱法是他!侯德榜先生研究出来的!好了,事不宜迟,我们来看看这位伟大的化学家创造的制碱方法。
一.原理第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵第二步:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小注:根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在278K ~283K(5℃~10℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
其相关化学方程式有①NH3+H2O+CO2=NH4HCO3②NH4HCO3+NaCl=NH4Cl+NaHCO3↓③2NaHCO3=加热=Na2CO3+H2O+CO2↑二.实验步骤及其化学反应方程式①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)注:先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性,能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体②2NaHCO3(加热)=Na2CO3+H2O+CO2↑(过滤、洗涤、灼烧)三..优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序。
注:纯碱就是碳酸钠(Na2CO3)在制碱过程中向滤出NaHCO3晶体后的NH4Cl溶液中加熟石灰以回收氨,使之循环使用:2NH4Cl+Ca(OH)2(加热)= CaCl2+2NH3↑+2H2O注:以下添加一些实验图:其中甲装置的作用:防倒吸,(气球的作用)缓冲装置内气体压强变化由于NH3及易溶于水,故尾气处理装置应为C装置(倒扣防倒吸装置)。
侯氏制碱法的原理及应用

侯氏制碱法的原理及应用小结:工业制纯碱的方法:1.氨碱法(索尔维制碱法)向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO 2(由CaCO 3煅烧而得),因NaHCO 3溶解度较小,故反应有:NH 3+CO 2+H 2O =NH 4HCO 3 NaCl +NH 4HCO 3=NaHCO 3↓+NH 4Cl 将析出的NaHCO 3晶体煅烧,即得Na 2CO 3: 2NaHCO 3∆====Na 2CO 3+CO 2↑+H 2O 母液中的NH 4Cl 加消石灰可回收氨,以便循环使用2NH 4Cl +Ca(OH)2∆====CaCl 2+2NH 3↑+2H 2O 此法优点:原料经济,能连续生产,CO 2和NH 3能回收使用.缺点:大量CaCl 2用途不大,NaCl 利用率只有70%,约有30%的NaCl 留在母液中。
2.联合制碱法(侯氏制碱法)根据NH 4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH 4Cl 单独结晶析出供做氮肥.此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH 4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO 2,革除了CaCO 3制CO 2这一工序。
例1 1892年,比利时人索尔维以NaCl 、CO 2、H 2O 、NH 3为原料生产Na 2CO 3,叫索尔维法.其主要步骤是:(1)在NH 3饱和的NaCl 溶液中通入CO 2制得NaHCO 3;(2)再将NaHCO 3焙烧制得纯碱,CO 2循环使用;(3)在析出小苏打的母液中加入生石灰,NH 3循环使用.1940年,我国著名化工专家侯德榜先生,冲破了“索尔维”法的技术封锁,并加以改进,用NaCl 固体代替生石灰,加入母液使NH 4Cl 晶体析出,生产出纯碱和氯化铵.这便是举世闻名的“侯氏制碱法”.试回答:(1)在氨饱和NaCl 溶液中通入CO 2的两步反应方程式为 。
侯氏制碱法的原理及应用带答案

1 侯氏制碱法的原理及应用小结:工业制纯碱的方法:小结:工业制纯碱的方法: 1.氨碱法(索尔维制碱法) 向饱和食盐水中通入足量氨气至饱和,然后在加压下通入CO 2(由CaCO 3煅烧而得),因NaHCO 3溶解度较小,故有下列反应发生:溶解度较小,故有下列反应发生: NH 3+CO 2+H 2O =NH 4HCO 3 NaCl +NH 4HCO 3=NaHCO 3↓+NH 4Cl 将析出的NaHCO 3晶体煅烧,即得Na 2CO 3:2NaHCO 3D====Na 2CO 3+CO 2↑+H 2O 母液中的NH 4Cl 加消石灰可回收氨,以便循环使用:2NH 4Cl +Ca(OH)2D====CaCl 2+2NH 3↑+2H 2O 此法优点:原料经济,能连续生产,CO 2和NH 3能回收使用.缺点:大量CaCl 2用途不大,NaCl 利用率只有70%,约有30%的NaCl 留在母液中。
留在母液中。
2.联合制碱法(侯氏制碱法) 根据NH 4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5℃~10℃)时,向母液中加入食盐细粉,而使NH 4Cl 单独结晶析出供做氮肥. 此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH 4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO 2,革除了CaCO 3制CO 2这一工序。
例1 1892年,比利时人索尔维以NaCl 、CO 2、H 2O 、NH 3为原料生产Na 2CO 3,叫索尔维法.其主要步骤是:(1)在NH 3饱和的NaCl 溶液中通入CO 2制得NaHCO 3;(2)再将NaHCO 3焙烧制得纯碱,CO 2循环使用;(3)在析出小苏打的母液中加入生石灰,NH 3循环使用.1940年,我国著名化工专家侯德榜先生,冲破了“索尔维”法的技术封锁,并加以改进,用NaCl 固体代替生石灰,加入母液使NH 4Cl 晶体析出,晶体析出,生产出纯碱和氯化铵.生产出纯碱和氯化铵.生产出纯碱和氯化铵.这便是举世闻名的这便是举世闻名的“侯氏制碱法”.试回答: (1)在氨饱和NaCl 溶液中通入CO 2的两步反应方程式为的两步反应方程式为。
侯氏制碱法的化学方程式原理
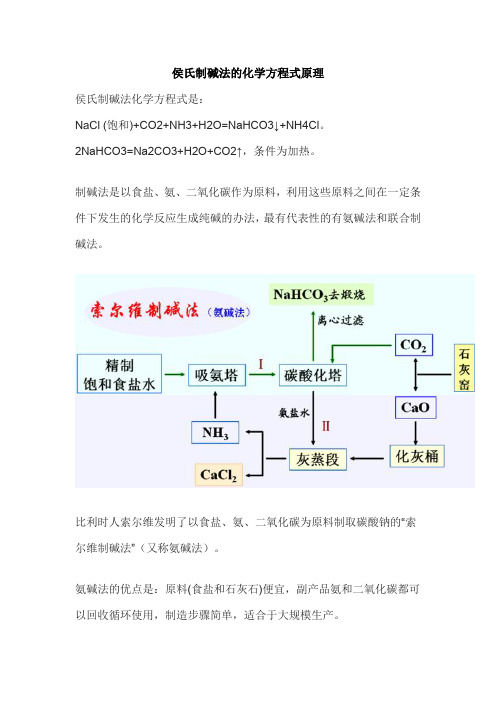
侯氏制碱法的化学方程式原理
侯氏制碱法化学方程式是:
NaCl (饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl。
2NaHCO3=Na2CO3+H2O+CO2↑,条件为加热。
制碱法是以食盐、氨、二氧化碳作为原料,利用这些原料之间在一定条件下发生的化学反应生成纯碱的办法,最有代表性的有氨碱法和联合制碱法。
比利时人索尔维发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。
氨碱法的优点是:原料(食盐和石灰石)便宜,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产。
侯氏制碱法,是氨碱法和合成氨两种工艺的联合,所以也叫联合制碱法。
这种方法提高了生产率,打破了外国垄断,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本。
为世界制碱工业作出了突出贡献,在学术界获得了相当高的评价。
侯氏制碱法使食盐的利用率提高到96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO2 ,革除了CaCO3 制CO2 这一工序。
在侯氏制碱法中,先通氨气的目的是为了使水碱化,增大二氧化碳在水中的溶解度,这样可以提高原材料利用率。
侯氏制碱法在利用碳酸氢铵与氯化钠形成碳酸氢钠沉淀时,需要控制一定的温度。
碳酸氢钠在水中的溶解度随着温度的降低而减少,而较高的温度有利于碳酸氢钠晶体的生长。
侯氏制解法的过程和反应原理

侯氏制解法的过程和反应原理今天来聊聊侯氏制碱法的过程和反应原理吧。
我最开始接触这个侯氏制碱法,是在化学课上。
当时就觉得,哇,这是个超级神奇的方法,可以制造出纯碱,也就是碳酸钠这种在生活里超有用的东西。
咱们先从生活现象说起哈。
就像咱们平常做家务,想要去油污的时候会发现,用碱性的东西特别好使,纯碱就是那么一种碱性物质。
那这个纯碱是怎么制造出来的呢?这就要说到侯氏制碱法的原理啦。
侯氏制碱法有个关键反应,它的基本原料是氯化钠(就是咱们平常吃的盐)、氨气和二氧化碳。
打个比方吧,这就像是一场接力比赛。
首先把氨气通入饱和的食盐水里,这氨气啊,就像一个矫健的运动员,一头扎进溶液里,使溶液呈碱性了。
这时候,二氧化碳这个“选手”登场了,二氧化碳在碱性环境里就发生了神奇的反应,反应生成了碳酸氢钠,这个碳酸氢钠就像一个调皮的娃娃,特别容易就结晶出来了,因为它在这种溶液里的溶解度比较小。
这就像在糖水里放多了糖,糖就会析出来一样。
化学方程式呢就是NaCl + NH₃+ CO₂+ H₂O = NaHCO₃↓+ NH₄Cl。
你看着这个方程式好像比较复杂,但是你想啊,就像咱们做汉堡包,盐、氨气、二氧化碳还有水,这些就是做汉堡的材料,按照这个特制的“配方”,就能做出像碳酸氢钠这个特殊的“汉堡”。
碳酸氢钠接下来经过加热就可以变成碳酸钠(也就是纯碱)了,这个过程就像是把这个调皮的娃娃打扮一下,变成另外一种有用的东西啦,化学方程式2NaHCO₃= Na₂CO₃+ H₂O + CO₂↑。
说到这里,你可能会问,那这个余下的氯化铵又怎么办呢?这其中的氯化铵又可以作为肥料使用。
你看这整个流程,是不是就像一个环保又高效的小工厂一样,原材料和产生的东西都能被合理地利用。
有意思的是,侯氏制碱法最大的实用价值就在于它能在比较温和的条件下高效地生产纯碱,而且充分利用了原料,几乎没什么浪费。
还有啊,在实际应用里,纯碱在玻璃制造、造纸、纺织好多工业里都有用途。
侯氏制碱法碳酸氢钠沉淀的原因

侯氏制碱法碳酸氢钠沉淀的原因1. 侯氏制碱法简介说到侯氏制碱法,大家可能会想:这是什么神秘的化学法门?其实,这个方法就是用来生产碱的,特别是碳酸氢钠。
没错,咱们平时在厨房里用的“小苏打”就是这个东西。
哎呀,想想都让人嘴角上扬!你知道的,这种方法最早是由一个名叫侯氏的老兄发明的,得说他真是个厉害角色,连小苏打的生产都能搞得这么有模有样的。
这个过程可不是一蹴而就的,咱们需要用到氨水、二氧化碳,还有盐水。
听起来是不是像在做一道复杂的菜?不过别担心,搞明白了这个沉淀的原因,简直就像烤蛋糕,步骤虽多,但只要耐心一点儿,最终的成果一定会让你惊喜连连。
2. 碳酸氢钠沉淀的基本原理2.1 沉淀的形成那么,碳酸氢钠为什么会沉淀下来呢?这就得说到水中的离子反应了。
我们知道,水是个神奇的地方,各种离子在里面像跳舞一样。
首先,氨水溶解后释放出氨气,这氨气和水里的二氧化碳一碰面,就开始产生一连串的反应。
反应过后,水中出现了碳酸氢根离子。
大家知道,化学反应有时候就像恋爱,两个对的人碰到一起,自然而然就产生化学反应了!接下来,碳酸氢根离子和钠离子相遇,恰如爱在空气中弥漫。
它们结合在一起,形成了碳酸氢钠。
于是乎,碳酸氢钠就开始沉淀了。
就像是把不喜欢的东西丢到一边,最终留下的是纯粹的精华,简直让人心里美滋滋。
2.2 影响沉淀的因素不过,沉淀可不是随随便便就能形成的,环境条件也很重要。
咱们得考虑温度和浓度。
你想啊,天气热的时候,水蒸气多,水分蒸发得快,反应可能会变得不太活跃。
换句话说,反应就像人一样,热情不高的时候,东西自然不容易沉淀下来。
还有,离子的浓度也是关键。
如果你加的氨水或者盐水不够浓,反应就是像人在沙滩上打水漂,想要成功却总是没碰到水。
哈哈,所以说,化学反应和生活其实是有很多相似之处的。
3. 碳酸氢钠的应用3.1 日常生活中的“英雄”说到碳酸氢钠,它可不是个默默无闻的角色,实际上它在我们日常生活中可是大显身手。
比如,咱们做饭的时候,它可以帮助发酵,让面团蓬松可口;清洁的时候,它又像个小超人,去油去污,效果杠杠的。
侯氏制碱法

侯氏制碱法NH3与H2O和CO2反应生成一分子的NH4HCO3,这是第一步。
第二步是:NH4HCO3与NaCl 反应生成一分子的NH4Cl和NaHCO3沉淀。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
侯氏制碱法化学原理总反应方程式:NaCl + CO2 +NH3+H2O=NaHCO3↓+NH4Cl(可作氮肥)2NaHCO3=Na2CO3+H2O+CO2↑(CO2循环使用)(以加热作为反应条件)(在反应中NaHCO3沉淀,所以这里有沉淀符号,这也正是这个方法的便捷之处)即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (NaHCO3能溶于水,但是侯氏制碱法向饱和氯化钠溶液中通入氨气,由于氯化钠溶液饱和,生成的碳酸氢钠溶解度小于氯化钠,所以碳酸氢钠以沉淀析出)(先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体。
)2NaHCO3(加热)=Na2CO3+H2O+CO2↑侯氏制碱法优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥(氮肥不可与碱性物质混用,但可用草木灰检验其纯度)[2];可与合成氨厂联合,使合成氨的原料气CO 转化成CO2,革除了CaCO3制CO2这一工序,减少可能造成的环境污染。
两个循环:一:2NaHCO3=Na2CO3+H2O+CO2↑(CO2循环使用)(以加热作为反应条件)二:向母液中加入食盐细粉,从而使NH4Cl 单独结晶析出供做氮肥。
第二个循环的具体操作:①通入氨气,冷却后,加入NaCl,使得NH4Cl沉淀。
侯氏联合制碱法解读

侯氏制碱法解读氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。
第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据NH4Cl 在常温时的溶解度比NaCl 大,而在低温下却比NaCl 溶解度小的原理,在278K ~283K(5 ℃~10 ℃) 时,向母液中加入食盐细粉,而使NH4Cl 单独结晶析出供做氮肥。
化学原理侯氏制碱法又名联合制碱法(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓②2NaHCO3(加热)=Na2CO3+H2O+CO2↑优点保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气CO 转化成CO2,革除了CaCO3制CO2这一工序。
注:纯碱就是碳酸钠国外研究情况(1862年至一战前)碳酸钠用途非常广泛。
虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要。
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法)。
此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁。
第一次世界大战期间,欧亚交通梗塞。
由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存。
1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱。
他聘请正在美国留学的侯德榜先生出任总工程师。
侯氏制碱法的产生和发展1920年,侯德榜先生毅然回国任职。
他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ⅰ.原理分析
碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶 体的原因是 a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解 c.碳酸氢钠的溶解度相对较小,在溶液中首先结 晶 析出 。
Ⅱ.实验探究 (1)一位同学将二氧化碳气体通入含氨的饱和食 盐水中制备碳酸氢钠,实验装置如下图所示(图 中夹持、固定用的仪器未画出)。
解析
(2)①甲装置是CO2的发生装置,由于盐
酸易挥发,故生成的CO2气体中会含有HCl气体, 乙装置的作用是除去CO2中的HCl气体,所以乙装 置中的试剂是饱和碳酸氢钠溶液。丙是制备碳酸 氢钠的发生装置,丁是吸收多余的NH3,防止其污 染环境。从溶液中分离出NaHCO3晶体的方法是过 滤。
②实验时必须先制取含氨的饱和NaCl溶液,然后
实验探究
候氏制碱法的实验原理
我国化工专家侯德榜的“侯氏制碱法”曾为世界
制碱工业作出了突出贡献。以NaCl、NH3、CO2等
为原料先制得NaHCO3,进而生产出纯碱。有关反 应的化学方程式为:NH3+CO2+H2O NH4HCO3+NaCl 2NaHCO3 Na2CO3+CO2↑+H2O。 NH4HCO3; NaHCO3↓+NH4Cl;
回答下列有关问题: a.乙装置中的试剂是 b.丁装置中稀硫酸的作用 是 ; (填分离操作的名 称)。 ;
c.实验结束后,分他装置未画出)
进行实验。 a.实验时,须先从 管通入 气体。
气体,再
从 管中通入 b.有同学建议在戊装置的b导管下端连接己装置,
入过量CO2等。
答案 过滤 (2)a NH3 b CO2 增大CO2气体与溶液接 Ⅰ.c 吸收未反应的NH3 Ⅱ.(1)饱和碳酸氢钠溶液
触的面积,提高CO2在溶液中的吸收率
(3)往烧碱溶液中通入过量CO2(或往饱和Na2CO3 溶液中通入过量CO2等)
返回
使之与CO2反应。因为NH3极易溶于水,CO2在水中 的溶解度不大,故先从a导管通入NH3,后从b导管 通入CO2。己装置中有多孔球泡,增大CO2气体与溶 液接触面积,提高了CO2在溶液中的吸收率。
(3)此题是开放性试题,制备少量碳酸氢钠方法: ①用碳酸氢铵与适量的饱和食盐水反应;②往烧 碱溶液中通入过量CO2;③往饱和Na2CO3溶液中通
