2021年一、常见酸碱盐的性质和用途
酸碱盐的性质及其用途

酸的化学性质 酸的化学性质 1.与指示剂的反应:使紫色石蕊试液 .与指示剂的反应 使紫色石蕊试液 变红色,无色酚酞试液不变色 变红色, 2、酸+金属(排在H的前面)→盐+H2↑ 、 金属(排在H的前面) 盐 Zn+H2S04==ZnS04+H2↑ Fe+2HCl==FeCl2+H2↑ 3、酸+金属氧化物→盐+H20 金属氧化物 盐 H Fe203+6HCl==2FeCl3+3H20——除铁锈 除铁锈 Fe203+3H2S04==Fe2(S04)3+3H20——除铁锈 除铁锈
2、碳酸钠 Na2CO3 、 纯碱, 俗名 :纯碱,苏打 物理性质:白色粉末, 物理性质:白色粉末,能溶于水 广泛用于玻璃,造纸, 用途 :广泛用于玻璃,造纸,纺织和洗 涤剂的生产(工业原料) 涤剂的生产(工业原料) 3、碳酸氢钠 NaHCO3 、 俗名 :小苏打 物理性质:白色粉末, 物理性质:白色粉末,能溶于水 发酵粉, 用途 :发酵粉,治疗胃酸过多症
新盐+新碱 3、碱溶液+盐溶液→新盐 新碱(产物至少 碱溶液+盐溶液 新盐 新碱( 有一种是沉淀) 有一种是沉淀) ☻Ca(OH)2+Na2C03==CaC03↓+2NaOH Ca(OH) ☻FeCl3+3Na0H==Fe(0H)3↓+3NaCl FeCl 4、碱+酸→盐+H20 盐 H 2NaOH+H2S04==Na2S04+2H20 Ca(0H)2+2HCl==CaCl2+2H20
另一种盐+另一种酸 5、酸+某一些盐→另一种盐 另一种酸 某一些盐 另一种盐 ☻CaC03+2HCl==CaCl2+ CO2↑+H20——实验室 CaC0 实验室 制取CO 和检验C0 制取CO2和检验C032☻Na ☻Na2CO3+2HCl =2NaCl+CO2↑+ H20——CO2灭 ——CO 火器原理 ☻HCl+AgNO3==AgCl +HNO3——检验ClHCl+AgNO ==AgCl↓+HNO 检验Cl 检验 ☻H2SO4+BaCl2==BaSO4↓+HCl—检验 42检验SO 检验
酸碱和盐的性质和应用

酸碱和盐的性质和应用酸碱和盐是化学中常见的物质,它们具有特定的性质和广泛的应用。
下面将从酸、碱和盐的性质及其应用方面进行论述。
一、酸的性质和应用酸是指具有酸性质的物质,具有以下特点:1. 酸的酸味:酸具有酸味,例如醋、柠檬汁等常见的酸性物质都有明显的酸味。
2. 酸的酸腐蚀性:酸具有强烈的腐蚀性,可以与金属产生化学反应,腐蚀非金属物质。
3. 酸的电离性:酸在水中可以电离产生氢离子(H+),使溶液呈酸性。
酸有许多应用,下面介绍几个常见的应用:1. 工业应用:酸在许多工业生产过程中起着重要作用。
例如,硫酸广泛用于制造肥料、纸张和染料等;盐酸用于制备氯化氢和酒精、清洗金属表面等。
2. 医药应用:酸在医药领域有广泛的应用。
例如,某些酸可以用作药物的成分,用于治疗胃病、消炎等。
3. 食品工业应用:酸是许多食品的必要组成部分。
例如,柠檬酸常用于饮料和果汁中作为酸味剂,苹果酸用于某些食品的防腐剂等。
二、碱的性质和应用碱是指具有碱性质的物质,具有以下特点:1. 碱的苦味:碱具有苦味,例如氢氧化钠(烧碱)、氢氧化钾(氨水)等常见碱性物质都有明显的苦味。
2. 碱的碱性:碱能够接受氢离子(H+),使溶液呈碱性。
碱的应用如下:1. 工业应用:碱在工业生产中有广泛的应用。
例如,氢氧化钠用于制造肥皂、玻璃等;氨水用于冶金、纺织等行业。
2. 化妆品应用:碱性物质可作为化妆品的成分之一,例如某些洗发水、肥皂等。
三、盐的性质和应用盐是由酸和碱反应生成的化合物,具有以下特点:1. 盐的结晶性:盐在一定条件下可结晶形成晶体,如食盐就是氯化钠晶体。
2. 盐的熔点和沸点:不同的盐具有不同的熔点和沸点,可根据需要进行利用。
盐的应用如下:1. 食品调味:盐是常见的食品调味品,它能够增加食物的口感和味道。
2. 化学实验:盐可以用于进行化学实验,如常见的硫酸铜(蓝石)可用于进行化学反应的观察。
3. 工业应用:盐在许多工业生产中起着重要作用。
例如,氯化钠广泛用作农业、化肥、制冷剂等。
酸碱盐的性质及其在生活中的应用

酸碱盐的性质及其在生活中的应用酸碱盐是化学中非常重要的物质,它们具有特定的性质和在各个领域的广泛应用。
本文将介绍酸碱盐的性质以及它们在生活中的应用。
一、酸碱盐的性质酸碱盐是由酸和碱反应生成的化合物,它们具有以下几个重要的性质。
1. 酸碱性:酸碱盐中的阳离子或阴离子具有酸性或碱性。
当阳离子为氢离子(H+)时,该盐为酸性盐;当阴离子为氢氧根离子(OH-)时,该盐为碱性盐;当阳离子和阴离子均不是氢离子或氢氧根离子时,该盐为中性盐。
2. 溶解性:酸碱盐的溶解性与其阳离子和阴离子的大小和电荷有关。
一般来说,阳离子或阴离子的电荷越大,其溶解性越差。
此外,一些酸碱盐在不同温度下的溶解性也会有所变化。
3. 颜色和气味:酸碱盐的颜色和气味可以因其成分的不同而有所差异。
例如,镁盐呈白色晶体,铁盐可以呈现不同的颜色,氯化铵有特殊的氨气味。
二、酸碱盐在生活中的应用酸碱盐广泛应用于生活的各个方面,下面将介绍一些常见的应用。
1. 食品加工:酸碱盐在食品加工中起到酸化、调味、脱水、防腐等作用。
例如,柠檬酸和醋酸常用于调味和腌制食品,磷酸盐可以作为食品添加剂用于调整酸碱度。
2. 清洁用品:酸碱盐在清洁用品中有着重要的应用。
例如,氯化钠和磷酸盐可用于制作洗衣粉、洗洁精、洗手液等,用以去除衣物或物体表面的污垢和油脂。
3. 医药制剂:酸碱盐在医药领域被广泛使用。
例如,酸性盐如柠檬酸和草酸钙可作为药物的酸性成分,碱性盐如氢氧化钠可用于中和酸性药物,中性盐如硫酸镁则可用于治疗便秘。
4. 农业领域:酸碱盐在农业中的应用主要涉及土壤调理和肥料。
例如,磷酸盐肥料可以提供植物所需的磷元素,硫酸铵肥料则可以提供植物所需的氮和硫元素。
5. 环境保护:酸碱盐在环境保护中具有重要作用。
例如,氢氧化钠被用于调节废水的酸碱度,能够中和酸性废水;磷酸盐可用于去除水体中的磷污染物等。
总结:本文介绍了酸碱盐的性质及其在生活中的应用。
酸碱盐具有酸碱性、溶解性、颜色和气味等特性,广泛应用于食品加工、清洁用品、医药制剂、农业和环境保护等领域。
常见酸碱盐的性质和用途

常见酸碱盐的性质和用途酸碱盐是化学中常见的一类化合物,它们具有各自的性质和用途。
下面,我将就常见的酸碱盐进行一一阐述。
酸是一类具有酸性质的物质,它可以释放出H+离子。
碱是具有碱性质的物质,它可以释放出OH-离子。
当酸与碱反应时,会生成相应的盐和水。
常见的酸盐有硫酸盐、磷酸盐等。
硫酸盐具有一些重要的性质和用途。
首先,硫酸盐具有很强的腐蚀性,可以腐蚀金属和有机物。
其次,硫酸盐在矿物加工、药品制造和冶金工业中有广泛的应用。
例如,硫酸盐可用于制造肥料、玻璃、洗涤剂和染料等产品。
此外,硫酸盐还可用作杀菌剂、阻垢剂和表面活性剂等。
磷酸盐也是常见的一类酸盐。
磷酸盐具有一些特殊的性质和用途。
首先,磷酸盐在生物体中起着重要的作用,如DNA和RNA中的磷酸二酯键就是磷酸盐的一种。
其次,磷酸盐在农业中有着广泛的应用,如肥料中的磷肥就是磷酸盐的一种。
此外,磷酸盐还可用于制造清洁剂、食品添加剂和阻燃剂等。
常见的碱盐有氢氧化盐、碳酸盐等。
氢氧化盐是碱性很强的化合物,可以释放出氢氧化物离子。
氢氧化盐具有一些重要的性质和用途。
首先,氢氧化盐具有很强的碱性,可用于调节pH值和中和酸性物质。
其次,氢氧化盐在工业中有广泛的应用,如制造肥料、清洁剂和药品等。
此外,氢氧化钠是制造肥皂的主要原料。
碳酸盐是一类含有碳酸根离子的化合物。
常见的碳酸盐有碳酸氢钠、碳酸氢铵等。
碳酸盐具有一些特殊的性质和用途。
首先,碳酸盐在生活中有许多应用。
例如,碳酸氢钠可以用作食品添加剂和面粉膨发剂。
其次,碳酸盐在工业中也有广泛的应用。
例如,碳酸盐可用于制造玻璃、洗涤剂和阻燃剂等产品。
此外,碳酸氢铵还可用作氨气源和发泡剂等。
在实际应用中,酸碱盐还可以用来进行酸碱滴定分析、中和反应和红外光谱等实验。
此外,酸碱盐还可以用于调节土壤酸碱性、用作电解质和阻燃剂等。
总之,酸碱盐在化学中具有广泛的应用。
通过研究酸碱盐的性质和用途,可以更好地理解化学物质的本质和相互作用。
同时,合理应用酸碱盐也有助于推动工业、农业和生活的发展。
一、常见酸碱盐的性质和用途

(5)盐+酸t另一种盐+另一种酸
(4)盐+碱t另种盐+另种碱
①其它常见酸:CHCOOH H2CG、HPQ
①氢氧化钠溶液沾皮肤:用大量水冲洗,再涂
①粗盐提纯:溶解、过滤、蒸发、计算产率。粗盐中由于含有氯化镁、氯化钙
其
/、
②浓硫酸沾皮肤:用大量水冲洗,再涂上3%--5%碳酸氢
上硼酸溶液②可溶性碱:NaQHKQHBa(QH)2、
等杂质,易吸收空气中的水分而潮解。海水晒盐米用烝发溶剂结晶法
钠溶液。
Ca(QH)2、,不溶性碱大部为白色(氢氧化铜为蓝
②硫酸铜晶体(俗称胆矶、蓝矶):,蓝色能溶于水固体,有毒
③稀释浓硫酸一定要把浓硫酸沿杯壁慢慢注入盛水的
色、氢氧化铁为红褐色)③制取
受热易分解:△
匕
CuSG?5H2Q====CuS(+5HQ
烧杯中,并不断用玻璃
NaQH:Ca(QH>+Na2CQ== CaCQj+2NaQH密
(蓝色)(白色)
封保存:因吸水易潮解,与CQ反应而变质
③碳酸钠晶体:N@CQ・10HQ(纯净物),俗称天然碱、石碱、口碱。风化:常
④制取Ca(QH)2:CaQ+HQ= Ca(QH)2(放热),生
温时在空气中放置一段时间后,失去结晶水而变成粉末。(化学变化)
料
剂
制NaQH
作防腐剂(3)融雪
纸、纺织、洗
酵粉
补钙剂
③人体中含有少量盐
剂
制化肥
②化工原料:制肥皂、
②农业:改良酸性土
齐((降低雪的熔点)
涤、食品工业
医疗上,治疗胃
酸碱盐的性质及应用

酸碱盐的性质及应用酸碱盐是日常生活和工业中非常常见的化合物,具有重要的物理和化学性质。
下面将详细介绍酸碱盐的性质及应用。
一、酸碱盐的性质:1. pH值:酸碱盐的水溶液中含有H+或OH-离子,其溶液的pH值能够反映其酸性或碱性的强弱。
当pH值小于7时,溶液呈酸性;当pH值大于7时,溶液呈碱性。
2. 电离度:酸碱盐在水中能够电离生成离子,形成带电荷的离子溶液。
酸盐和碱盐会产生正离子和负离子,可与水分子或其他离子进行反应。
3. 水合性:酸碱盐分子中的阳离子和阴离子能够与水分子形成水合物,从而增加了酸碱盐在水中的溶解度。
4. 产热性:酸碱盐在与水或其他物质反应时,常常会伴随着放热反应,能够产生热量。
5. 腐蚀性:酸碱盐对一些金属具有腐蚀作用,能够与金属表面产生化学反应,导致金属的腐蚀和损坏。
二、酸碱盐的应用:1. 酸碱中和反应:酸碱盐具有中和酸碱的性质,能够在一定条件下与酸或碱反应,形成中性物质。
例如:氢氧化钠与盐酸反应生成氯化钠和水。
2. 食品加工:酸碱盐在食品加工中扮演着重要角色,能够调整食品的味道和pH 值,增加食品的保质期。
例如:酸类的食品添加剂可使食品味道酸味更浓郁。
3. 制药工业:酸碱盐在药物的制备和研究中起着重要作用,能够调节药物的pH 值,并与其他成分发生反应,产生药效。
例如:某些药物的碱性部分与酸性药物互相中和,提高了药物的稳定性和吸收性。
4. 化学实验:酸碱盐是化学实验中常用的试剂,用于酸碱中和反应、沉淀反应等。
例如:盐酸、硫酸等常用于实验室中。
5. 清洁剂制造:酸碱盐可用于制造各种清洁剂、消毒剂和洗涤剂,能够去除油污、杀菌和除臭。
例如:柠檬酸可用于清洁厨房表面和清洁器具。
6. 冶金工业:酸碱盐在冶金工业中广泛应用,能够用于金属的腐蚀、清洗和处理。
例如:盐酸可用于清洗金属表面和去除氧化层。
7. 环保领域:酸碱盐能够用于调节水体的酸碱度和净化废水。
例如:石灰可用于中和酸性废水中的酸碱度。
常见酸碱盐的性质和用途

常见酸碱盐的性质和用途酸碱盐是化学中常见的三种类型化合物之一,它是由酸和碱反应生成的。
酸碱盐在生活中有着广泛的应用,下面我们将介绍常见酸碱盐的性质和用途。
1.硫酸盐硫酸盐是由硫酸和金属离子或阳离子组成的盐类。
它具有很强的酸性和腐蚀性。
硫酸盐广泛用作肥料、溶剂和工业原料。
例如,硫酸铁常用于水处理、纸浆漂白和媒染剂。
硫酸铜可用于制备农药和木材防腐剂。
硫酸铅用于制备电池的正极材料。
2.硝酸盐硝酸盐是由硝酸和金属离子或阳离子组成的盐类。
它的溶液具有强氧化性,易于与其它物质发生反应。
硝酸盐广泛用作肥料、火药和爆炸物的成分。
硝酸铵和硝酸钾是常见的肥料,它们富含氮元素,有利于植物生长。
硝酸甘油是一种重要的爆炸物。
3.氯化物氯化物是由盐酸和金属离子或阳离子组成的盐类。
氯化物具有广泛的应用。
氯化钠是常见的食盐,用于调味和防腐。
氯化铁广泛用于水处理和去重金属物质。
氯化钙是除冰剂和融雪剂的重要成分。
氯化铵是一种常见的氮肥。
4.碳酸盐碳酸盐是由碳酸和金属离子或阳离子组成的盐类。
碳酸盐具有一定的酸碱性,能够与酸和强碱反应生成盐和水。
碳酸钠是一种重要的化工原料,在玻璃工业、造纸工业和洗涤剂生产中得到广泛应用。
碳酸钙是石灰石的主要成分,广泛用于建筑材料、化妆品、食品和医药工业。
5.亚硫酸盐亚硫酸盐是由亚硫酸和金属离子或阳离子组成的盐类。
亚硫酸盐具有还原性和抗氧化性。
亚硫酸钠是常见的还原剂,可用于染料工业、食品工业和药品工业。
亚硫酸氢钠是饮料和食品的抗氧化剂。
6.磷酸盐磷酸盐是由磷酸和金属离子或阳离子组成的盐类。
磷酸盐具有很强的潮解性和溶解性。
磷酸盐广泛用作肥料、洗涤剂和食品添加剂。
磷酸二氢钾和磷酸二氢铵是常见的食品酸度调节剂,用于调味品、碳酸饮料和面包等食品中。
磷酸三钠是一种常用的洗涤剂成分。
总的来说,酸碱盐具有广泛的应用。
它们被广泛用于农业、化工、食品、医药、环保等各个领域。
了解酸碱盐的性质和用途,有助于我们更好地理解和利用这些化合物。
酸碱盐的性质与实际应用

酸碱盐的性质与实际应用酸碱盐是我们日常生活中经常接触到的化学物质,它们不仅具有特殊的性质,还有广泛的实际应用。
在本文中,我们将探讨酸碱盐的性质以及它们在实际生活中的应用。
首先,让我们来了解一下酸碱盐的性质。
酸是指具有酸性的物质,它们通常呈酸味,可以腐蚀金属,变红蓝色的酸碱指示剂等。
酸的特点是在水中产生氢离子(H+),并且能与碱反应生成盐和水。
碱是指具有碱性的物质,它们通常呈苦味,可以腐蚀皮肤,变红蓝色的酸碱指示剂等。
碱的特点是在水中产生氢氧根离子(OH-),并且能与酸反应生成盐和水。
盐是指由酸和碱反应生成的化合物,它们通常是晶体状固体,具有特定的结构和性质。
酸碱盐的性质使它们在许多实际应用中发挥重要作用。
首先,酸碱盐在食品加工中起着关键的作用。
例如,醋是一种常见的酸,它可以用于调味和腌制食物。
柠檬汁也是一种酸,它可以用于调味和提鲜。
此外,碳酸氢钠是一种常见的碱,它可以用于烘焙中的发酵剂。
酸碱盐的使用不仅可以改善食物的口感和味道,还可以延长食物的保质期。
其次,酸碱盐在清洁和消毒中也有重要的应用。
例如,酸性清洁剂可以用于清洁厨房和浴室中的水垢和油渍。
碱性清洁剂可以用于清洁地板和玻璃等表面。
此外,酸碱盐还可以用于消毒剂的制备,用于杀灭细菌和病毒,保持环境的清洁和卫生。
另外,酸碱盐在农业和园艺中也有广泛的应用。
例如,硝酸铵是一种常见的氮肥,它可以提供植物所需的氮元素,促进植物的生长。
磷酸二铵是一种常见的磷肥,它可以提供植物所需的磷元素,促进植物的根系发育。
此外,酸碱盐还可以调节土壤的酸碱度,改善土壤的肥力和适应性,提高农作物的产量和质量。
最后,酸碱盐在医药和化妆品中也有重要的应用。
例如,酸性药物可以用于治疗消化系统疾病,如胃溃疡和胃酸过多。
碱性药物可以用于治疗酸中毒和酸碱平衡失调。
此外,酸碱盐还可以用于化妆品的制备,例如酸性洗面奶可以帮助去除皮肤上的油脂和污垢,碱性护发素可以帮助改善头发的光泽和柔软度。
酸碱盐的性质与应用

酸碱盐的性质与应用酸碱盐是化学中常见的一类物质,它们具有特定的性质和广泛的应用。
本文将介绍酸碱盐的性质以及它们在日常生活和工业中的应用。
一、酸碱盐的性质1. 酸的性质:酸是指在水溶液中呈酸性的化合物,常见的酸有硫酸、盐酸等。
酸的特性包括:酸味、酸腐蚀性、酸与金属反应产生气体等。
酸性溶液中含有H+离子,可以中和碱溶液。
2. 碱的性质:碱是指在水溶液中呈碱性的化合物,常见的碱有氢氧化钠、氢氧化钙等。
碱的特性包括:碱性味、碱腐蚀性、碱与酸反应产生盐和水等。
碱性溶液中含有OH-离子,可以中和酸溶液。
3. 盐的性质:盐是指由酸和碱反应生成的化合物,常见的盐有氯化钠、硫酸钙等。
盐的特性包括:无味、晶体形态、可以导电等。
盐在水中可以分解成带正负电荷的离子。
二、酸碱盐的应用1. 酸的应用:(1)工业应用:酸可以作为催化剂用于化学反应;酸可以用于金属的腐蚀除锈等。
(2)生活应用:柠檬汁中富含柠檬酸,可以用来去除铁锈;醋中含有乙酸,可以用来清洗厨房的油渍。
2. 碱的应用:(1)工业应用:氢氧化钠常用于清洁剂生产,可以用于酸性物质的除垢;氢氧化钠也可以用于制取肥皂等。
(2)生活应用:苏打水(碳酸氢钠溶液)可以用来中和胃酸,缓解消化不良;氢氧化钠可以用于调节家庭清洁剂的酸碱度。
3. 盐的应用:(1)工业应用:氯化钠可以用于制取氯气、氢气,还可以用于食盐的生产;硫酸钙在建筑材料中被广泛使用。
(2)生活应用:氯化钠可以用于调味,是常见的食盐;碘化钾可以用作紫外线照相的感光材料。
三、总结酸碱盐是化学中重要的概念,它们具有不同的性质和应用。
酸可以用于催化剂、除锈等;碱可以用于清洁剂、调节酸碱度等;盐具有调味、生产等多种应用。
了解酸碱盐的性质和应用,有助于我们更好地理解化学世界并应用于日常生活和工业生产中。
初中化学知识点归纳常见酸碱盐的性质和应用

初中化学知识点归纳常见酸碱盐的性质和应用酸、碱和盐是初中化学中重要的概念,它们在我们日常生活中起着重要的作用。
本文将对常见酸碱盐的性质和应用进行归纳总结,帮助初中生更好地理解和掌握这些知识点。
一、酸的性质和应用1. 酸的性质:(1)酸味:酸溶液有酸味,比如柠檬汁和醋。
(2)蓝石蕊试纸变红:酸溶液可以使蓝石蕊试纸变红。
(3)电离产生氢离子:酸溶液中的酸分子能够电离产生氢离子。
2. 酸的应用:(1)酸用于清洁和消毒:例如,柠檬汁可以用于清洁蔬菜和水果。
(2)酸用于制备肥料:硫酸和磷酸可以用于制备植物肥料。
(3)酸用于食品加工:例如,柠檬酸可以用于食品加工中的调味品。
二、碱的性质和应用1. 碱的性质:(1)碱味:碱溶液有碱味,比如肥皂水。
(2)红石蕊试纸变蓝:碱溶液可以使红石蕊试纸变蓝。
(3)电离产生氢氧根离子:碱溶液中的碱分子可以电离产生氢氧根离子。
2. 碱的应用:(1)碱用于清洁剂:例如,肥皂可以用于洗涤衣物和清洁物体。
(2)碱用于制备肥料:氢氧化钠可以用于制备植物肥料。
(3)碱用于调节酸碱度:氨水常用于调节酸碱度,例如在实验室中。
三、盐的性质和应用1. 盐的性质:(1)无特殊味道:大部分盐是无味或稍微咸的。
(2)电解能产生阳离子和阴离子:盐在水中可以电解产生阳离子和阴离子。
2. 盐的应用:(1)盐用于调味:食盐是我们餐桌上常见的调味品。
(2)盐用于化学实验:氯化钠和硫酸铜等盐常用于化学实验中。
(3)盐用于制备其他化合物:例如,氯化钠可以用于制备氯气和氢氧化钠。
以上是对常见酸碱盐的性质和应用进行的归纳总结。
通过对这些知识点的学习和理解,我们可以更好地认识和运用酸碱盐,进一步扩展我们在日常生活中的化学知识应用。
初中化学知识的掌握不仅有助于我们的学业提升,也能帮助我们更好地理解和应用化学在日常生活中的重要性。
常见酸碱盐的性质和用途
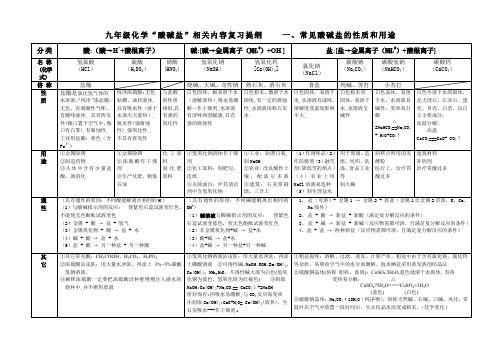
分类
酸:(酸→H++酸根离子)
碱:[碱→金属离子(NH4+)+OH-]
盐:[盐→金属离子(NH4+)+酸根离子]
名称
(化学式)
氢氯酸
(HCl)
硫酸
(H2SO4)
硝酸
(HNO3)氢氧化钠(NaOH)源自氢氧化钙[Ca(OH)2]
氯化钠
(NaCl)
△
2NaHCO3==Na2CO3+ H2O+CO2↑
白色不溶于水的固体,是大理石、石灰石、蛋壳、贝壳、白垩、汉白玉主要成分;
高温分解:
高温
CaCO3===CaO+ CO2↑
用
途
金属除锈
制造药物
人体中含有少量盐酸,助消化
金属除锈
浓硫酸作干燥剂
生产化肥、精炼石油
化工原料
制化肥原料
氢氧化钠固体作干燥剂
化工原料:制肥皂、造纸
建筑材料
补钙剂
治疗胃酸过多
通
性
(具有通性的原因:不同酸能解离出相同的H+)
(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属+酸→盐+氢气
(3)金属氧化物+酸→盐+水
(4)碱+酸→盐+水
(5)盐+酸→另一种盐+另一种酸
(具有通性的原因:不同碱能解离出相同的OH-)
(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色
去除油污:炉具清洁剂中含氢氧化钠
工业:制漂白粉,制NaOH
酸碱盐的性质与应用

酸碱盐的性质与应用酸碱盐是化学中常见的一类化合物,其性质和应用覆盖了广泛的领域,包括工业、农业、医学等。
本文将详细介绍酸碱盐的性质以及它们在实际应用中的重要作用。
一、酸碱盐的性质酸碱盐是由酸和碱中和反应产生的盐类化合物。
它们具有以下几个基本的性质。
1.酸性:酸碱盐能够在水中溶解,并释放出酸性的氢离子(H+)。
这些氢离子能够与水分子发生反应,形成酸性溶液。
常见的酸性酸碱盐包括硫酸盐、硝酸盐等。
2.碱性:除了具有酸性反应外,酸碱盐还可以表现出碱性的性质。
碱性酸碱盐可以释放出氢氧根离子(OH-),并与水分子反应生成碱性溶液。
氢氧化钠、氢氧化钾等都是常见的碱性酸碱盐。
3.中性:除了酸性和碱性酸碱盐外,还有一些酸碱盐是中性的,既不具有明显的酸性也不具有碱性。
这种中性酸碱盐包括氯化银、硫酸钙等。
二、酸碱盐的应用酸碱盐由于其多样的性质,被广泛应用于不同的领域。
以下是一些重要的应用范围。
1.工业应用:酸碱盐在工业生产中起着重要作用。
例如,硫酸盐广泛用于制造化肥和硫酸等化学品;氢氧化钠被用于制造肥皂和清洁剂;氯化钠是生产食盐的主要原料等。
2.农业应用:酸碱盐在农业生产中有着重要的应用。
例如,磷酸盐被用作植物的磷肥,在土壤中提供营养;硝酸盐作为农药,用于保护农作物免受害虫的侵害等。
3.医药应用:酸碱盐在医药领域也有广泛的应用。
例如,碳酸氢钠作为一种碱性酸碱盐,可以用来调节人体酸碱平衡,改善胃肠道健康;硫酸镁被用作轻泻剂,可以帮助消化系统排毒等。
4.环境应用:酸碱盐还可以应用于环境保护领域。
例如,氢氧化钙被用于中和工业废水中的酸性物质,从而减少对水环境的污染;硫酸铁可以用来去除水中的磷酸盐,防止富营养化。
5.教育研究:酸碱盐的性质和应用也是化学教育和研究的重要内容。
通过对酸碱盐的实验和研究,可以加深对化学原理的理解,并为开展更深入的科学研究奠定基础。
综上所述,酸碱盐是化学中一类重要的化合物,具有多种性质和广泛的应用。
一、常见酸碱盐的性质和用途

2NaHCO3==Na2CO3+ H2O+CO2↑
白色不溶于水的固体,是大理石、石灰石、蛋壳、贝壳、白垩、汉白玉主要成分;
高温分解:
高温
CaCO3===CaO+ CO2↑
用
途
金属除锈
制造药物
人体中含有少量盐酸,助消化
金属除锈
浓硫酸作干燥剂
生产化肥、精炼石油
化工原料
制化肥原料
氢氧化钠固体作干燥→H++酸根离子)
碱:[碱→金属离子(NH4+)+OH-]
盐:[盐→金属离子(NH4+)+酸根离子]
名称
(化学式)
氢氯酸
(HCl)
硫酸
(H2SO4)
硝酸
(HNO3)
氢氧化钠
(NaOH)
氢氧化钙[Ca(OH)2]
氯化钠
(NaCl)
碳酸钠
(Na2CO3)
碳酸氢钠(NaHCO3)
碳酸钙
(CaCO3)
与盐酸的性质相似,具有强的氧化性
白色固体,极易溶于水(溶解放热),吸水易潮解—作干燥剂,水溶液有涩味和滑腻感,具有强的腐蚀性
白色粉末,微溶于水固体,有一定的腐蚀性,水溶液俗称石灰水
白色固体,易溶于水,水溶液有咸味,溶解度受温度影响不大,
白色粉末状固体,易溶于水,水溶液呈碱性
白色晶体,易溶于水,水溶液显碱性,受热易分解
①氢氧化钠溶液沾皮肤:用大量水冲洗,再涂上硼酸溶液②可溶性碱:NaOH、KOH、Ba(OH)2、Ca(OH)2、,不溶性碱大部为白色(氢氧化铜为蓝色、氢氧化铁为红褐色)③制取NaOH:Ca(OH)2+Na2CO3== CaCO3↓+2NaOH密封保存:因吸水易潮解,与CO2反应而变质
酸碱盐的性质及用途
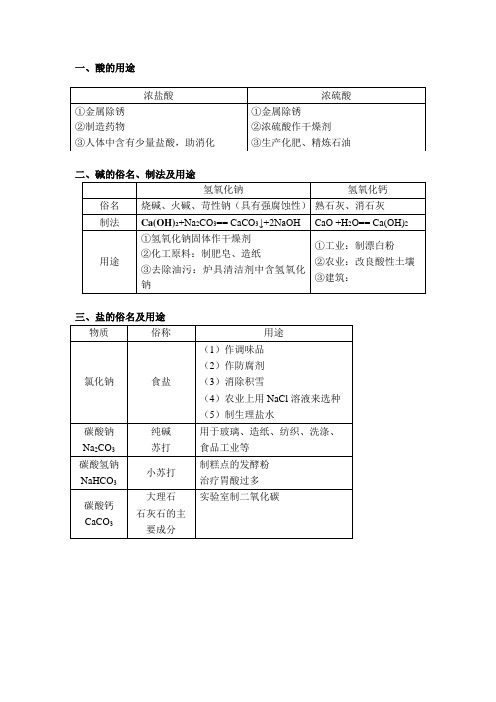
碳酸氢钠
NaHCO3
小苏打
制糕点的发酵粉
治疗胃酸过多
碳酸钙
CaCO3
大理石
石灰石的主要成分
实验室制二氧化碳
一、酸的化学性质
盐酸(HCl)、稀硫酸(H2SO4)
1.与酸碱指示剂作用
2.与活泼金属(Fe Cu)
3. 与金属氧化物(Fe2O3CuO)
4. 与碱(Ca(OH)2NaOH)
5. 与盐(CaCO3Na2CO3NaHCO3)
一、酸的用途
浓盐酸
浓硫酸
①金属除锈
②制造药物
③人体中含有少量盐酸,助消化
①金属除锈
②浓硫酸作干燥剂
③生产化肥、精炼石油
二、碱的俗名、制法及用途
氢氧化钠
氢氧化钙
俗名
烧碱、火碱、苛性钠(具有强腐蚀性)
熟石灰、消石灰
制法
Ca(OH)2+Na2CO3== CaCO3↓+2NaOH
CaO +H2O== Ca(OH)2
用途
①氢氧化钠固体作干燥剂
②化工原料:制肥皂、造纸
③去除油污:炉具清洁剂中含氢氧化钠
①工业:制漂白粉
②农业:改良酸性土壤
③建筑:
三、盐的俗名及用途
物质
俗称
用途
氯化钠
食盐
(1)作调味品
(2)作溶液来选种
(5)制生理盐水
碳酸钠
Na2CO3
纯碱
苏打
用于玻璃、造纸、纺织、洗涤、
二、 碱的化学性质Ca(OH)2NaOH
1.与酸碱指示剂
2.与非金属氧化物(CO2SO2SO3)
3. 与酸(HClH2SO4)
4.与盐(CuSO4或Na2CO3)
高中化学常见的酸碱盐总结

高中化学常见的酸碱盐总结高中化学中常见的酸碱盐总结如下:
一、酸
1. 盐酸(HCl):无色液体,有刺激性气味,易挥发,能与水任意比互溶,主要用于实验室制取气体(HCl和H2)。
2. 硫酸(H2SO4):无色粘稠油状液体,有强烈的腐蚀性和氧化性,需密封保存。
3. 硝酸(HNO3):无色液体,有挥发性,与水任意比互溶,是一种强酸,常用于实验室制取气体(NO和NO2)。
二、碱
1. 氢氧化钠(NaOH):白色固体,易潮解,有强烈的腐蚀性和碱性,能与酸发生中和反应,主要用于实验室中制取气体(如H2)和某些有机物的制备。
2. 氢氧化钙(Ca(OH)2):白色粉末,微溶于水,主要用于建筑业中制备石灰浆和改良酸性土壤。
3. 氢氧化钾(KOH):白色固体,易潮解,有强烈的腐蚀性和碱性,能与酸发生中和反应,主要用于实验室中制取气体和某些有机物的制备。
三、盐
1. 氯化钠(NaCl):白色晶体,易溶于水,是食盐的主要成分,也是生活中常见的调味品。
2. 硫酸铜(CuSO4):蓝色晶体,溶于水后呈蓝色,常用作游泳池消毒剂和制备波尔多液。
3. 碳酸钠(Na2CO3):白色晶体,易溶于水,用于制备肥皂、玻璃、纸张等。
4. 硝酸银(AgNO3):白色晶体,溶于水后呈无色,常用于实验室中检验氯离子。
以上是高中化学中常见的酸碱盐总结,希望对你有所帮助。
酸碱盐的性质及应用

酸碱盐的性质及应用酸碱盐是化学中重要的物质之一,它们具有特殊的性质和广泛的应用。
本文将就酸碱盐的性质以及其在不同领域中的应用展开讨论。
一、酸碱盐的性质酸碱盐是由酸和碱中和反应形成的化合物,在化学式中往往以"盐"结尾。
酸碱盐的性质可由其化学式和离子组成来体现。
1. 酸碱盐的化学式:酸碱盐的化学式通常由离子组成,其中阳离子可以是金属离子或氨基离子,而阴离子则来自酸或碱的残基。
例如,氯化钠(NaCl)中,Na+为金属钠离子,Cl-为氯化物离子,是一种常见的酸碱盐。
2. 酸碱盐的酸碱性质:酸碱盐既不具有酸的酸性质,也不具有碱的碱性质。
但是,当酸碱盐溶解在水中时,会产生酸性溶液、碱性溶液或中性溶液,取决于酸和碱的性质。
3. 酸碱盐的溶解度:酸碱盐的溶解度取决于其离子在水中的溶解度以及其母酸和母碱的溶解度。
一些酸碱盐易溶于水,例如氯化钠;而另一些则不溶于水,例如氧化铝。
二、酸碱盐的应用酸碱盐的广泛应用涉及到多个领域,下面将重点介绍其在工业、农业和日常生活中的应用。
1. 工业应用酸碱盐在工业生产中具有重要的地位。
例如,氯化钠在冶金工业中被广泛用于焊接和金属表面处理;硫酸铜用于电池制造和染料工业;硫酸铁则是生产染料和催化剂的重要原料之一。
2. 农业应用酸碱盐在农业领域中有着广泛的应用。
例如,磷酸盐肥料(如磷酸二铵)是促进作物生长和增加产量的重要营养源;硝酸铵则是常见的氮肥,具有提高农作物产量的作用;石灰是调节土壤酸碱性的重要添加剂之一。
3. 日常生活应用除了在工业和农业中的应用,酸碱盐也在日常生活中发挥着重要作用。
例如,柠檬汁中的柠檬酸是食品酸味剂的常见来源;小苏打(碳酸氢钠)是烹饪中常用的发酵剂,用于蛋糕的发酵;紫葡萄酒中的酒石酸可用于食品添加剂和膳食补充剂。
结论酸碱盐作为一类重要的化合物,具有多样化的性质和广泛的应用领域。
了解酸碱盐的性质并善加应用,能够为人类的工业生产、农业发展和日常生活带来巨大的好处。
一常见酸碱盐的性质和用途

一常见酸碱盐的性质和用途酸、碱和盐是化学反应中常见的化合物,它们具有不同的性质和用途。
下面将就常见的酸、碱和盐的性质和用途进行详细介绍。
一、酸酸是含有氢离子(H+)的化合物,具有以下性质:1.酸味:常见的酸如盐酸、硫酸等有酸味。
2.蓝红酸碱指示剂转红:在溶液中加入蓝红酸碱指示剂后,酸性溶液会使其颜色转变为红色。
3.与金属反应:酸可以与金属反应,生成氢气和相应的盐。
例如,盐酸可以与锌反应生成氯化锌和氢气。
4.与碱反应生成盐和水:酸可以与碱反应生成相应的盐和水。
例如,硫酸可以与氢氧化钠反应生成硫酸钠和水。
酸的用途:1.工业中的酸性清洗剂:酸可以用于去除金属表面的氧化物,清洁设备和设施。
2.食品工业:酸可以用作食品添加剂,蛋糕、苹果汁等食品中的柠檬酸就是一种常用的食品酸味剂。
3.医药:一些酸可以用于药物的制备,例如乙酸、水杨酸等。
4.颜料工业:一些酸可以用于颜料的制备,例如稀硝酸可以用于制备金松石碧绿色。
二、碱碱是含有氢氧根离子(OH-)的化合物,具有以下性质:1.有碱味:常见的碱如氢氧化钠、氢氧化钡等有碱味。
2.蓝红酸碱指示剂转蓝:在溶液中加入蓝红酸碱指示剂后,碱性溶液会使其颜色转变为蓝色。
3.与酸反应生成盐和水:碱可以与酸反应生成相应的盐和水。
例如,氢氧化钠可以与盐酸反应生成氯化钠和水。
4.对胃液具有中和作用:碱可以中和胃酸,减轻胃酸对胃壁的腐蚀。
碱的用途:1.工业中的碱液:氢氧化钠可以用于脱脂、碱洗和除污等工业过程。
2.化妆品和清洁剂的配方:碱可以用于调整化妆品和清洁剂的酸碱性质,使其更加温和。
3.食品加工:碱可以用于调味剂的制备,例如食盐、碱面等。
4.医药:碳酸氢钠是抗酸药物和抗胃酸反流药物的成分。
三、盐盐是酸和碱反应生成的化合物,具有以下性质:1.盐味:常见的盐如食盐、硝酸铵等有盐味。
2.不对蓝红酸碱指示剂有影响:盐的溶液对蓝红酸碱指示剂没有影响,呈中性。
3.熔点高:盐的熔点一般较高,可以用于高温的熔融和熔炼。
一、常见酸碱盐的性质和用途
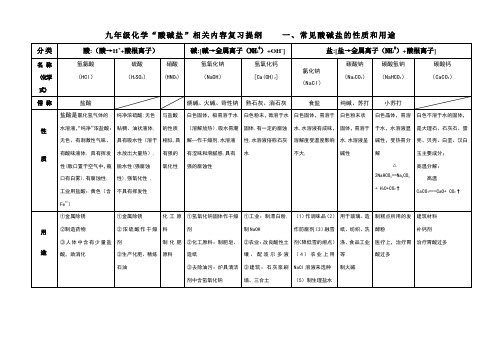
2NaHCO3==Na2CO3+ H2O+CO2↑
白色不溶于水的固体,是大理石、石灰石、蛋壳、贝壳、白垩、汉白玉主要成分;
高温分解:
高温
CaCO3===CaO+ CO2↑
用
途
金属除锈
制造药物
人体中含有少量盐酸,助消化
金属除锈
浓硫酸作干燥剂
生产化肥、精炼石油
化工原料
制化肥原料
氢氧化钠固体作干燥剂
化工原料:制肥皂、造纸
3、盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)
4、盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)
其
它
①其它常见酸:CH3COOH、H2CO3、H3PO4
②浓硫酸沾皮肤:用大量水冲洗,再涂上3%--5%碳酸氢钠溶液。
③稀释浓硫酸一定要把浓硫酸沿杯壁慢慢注入盛水的烧杯中,并不断用玻璃
建筑材料
补钙剂
治疗胃酸过多
通
性
(具有通性的原因:不同酸能解离出相同的H+)
(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属 + 酸 → 盐 + 氢气
(3)金属氧化物 + 酸 → 盐 + 水
(4)碱 + 酸 → 盐 + 水
(5)盐 + 酸 → 另一种盐 + 另一种酸
(具有通性的原因:不同碱能解离出相同的OH-)
与盐酸的性质相似,具有强的氧化性
白色固体,极易溶于水(溶解放热),吸水易潮解—作干燥剂,水溶液有涩味和滑腻感,具有强的腐蚀性
白色粉末,微溶于水固体,有一定的腐蚀性,水溶液俗称石灰水
酸碱盐的性质与应用

酸碱盐的性质与应用酸碱盐是化学中常见的物质,具有多种性质和广泛的应用。
本文将就酸碱盐的性质以及其在日常生活和工业中的应用展开探讨。
一、酸碱盐的性质1. 酸的性质:酸是一类能够产生H+离子的化合物,其常见特征包括酸味、导电、与碱反应产生盐和水等。
酸一般能够腐蚀金属,变红蓝石蕊试纸等。
2. 碱的性质:碱是一类能够产生OH-离子的化合物,其特征包括苦味、导电、与酸反应产生盐和水等。
碱能够中和酸,使酸碱溶液的pH值趋于中性。
3. 盐的性质:盐是酸碱反应生成的化合物,由阳离子和阴离子组成。
盐既可以是固体、液体也可以是气体,具有晶体结构。
一般来说,碱金属和碱土金属与酸反应生成的盐是无机盐,有机酸与无机碱反应生成的盐是有机盐。
二、酸碱盐的应用1. 酸的应用:(1)酸的腐蚀性质使其在冶金工业中被广泛应用,如酸性浸出法从金矿中提取金属。
(2)酸可以用于制备各种化合物,例如硫酸用于生产化肥。
(3)酸常用于日常生活中的清洁和消毒,如柠檬汁中的柠檬酸可以用于清洁厨房的油渍。
2. 碱的应用:(1)碱用作肥皂、洗衣粉等清洁用品的主要成分,它可以使油脂变为胺基酸盐,从而起到清洁的作用。
(2)碱的强碱性能使其在化学工业中被广泛应用,如氢氧化钠用于制备纤维素纤维。
3. 盐的应用:(1)氯化钠是最常见的盐之一,被广泛应用于调味品、食品加工以及食盐生产等领域。
(2)硝酸钠可用作化肥和火药的原料。
(3)柠檬酸盐可用于食品饮料的调味和防腐剂。
由于酸碱盐的性质多样且应用广泛,本文只对其性质和应用进行了初步介绍。
酸碱盐在医药、冶金、化工、食品等领域都起着重要的作用,对人类生活和工业生产都具有重要意义。
希望本文的介绍能够增加对酸碱盐的了解,促进其进一步的研究和应用。
总结:本文对酸碱盐的性质和应用进行了探讨。
酸碱盐是化学中常见的物质,具有明显的性质特征和广泛的应用价值。
酸的性质包括酸味、导电和与碱反应产生盐和水等;碱的性质包括苦味、导电和与酸反应产生盐和水等;盐作为酸碱反应生成的产物,具有特定的组成和结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学“酸碱盐”相关内容复习提纲一、常见酸碱盐的性质和用途
欧阳光
明
(2021
.03.07
)
分类
酸:(酸→H++酸根离子)碱:[碱→金属离子(NH4+)+OH-] 盐:[盐→金属离子(NH4+)+酸根离子]
名称(化学式)
氢氯酸
(HCl)
硫酸
(H2SO4)
硝酸
(HNO3)
氢氧化钠
(NaOH)
氢氧化钙
[Ca(OH)2]
氯化钠
(NaCl)
碳酸钠
(Na2CO3)
碳酸氢钠
(NaHCO3)
碳酸钙
(CaCO3)
俗称盐酸烧碱、火碱、苛性
钠
熟石灰、消石灰食盐纯碱、苏打小苏打
性质盐酸是氯化氢气体的
水溶液,“纯净”浓盐
酸:无色、有刺激性气
味、有酸味液体, 具有
挥发性(敞口置于空气
中,瓶口有白雾),有腐
蚀性,工业用盐酸:黄
色(含Fe3+)
纯净浓硫酸:无色
粘稠、油状液体,
具有吸水性(溶
于水放出大量
热),脱水性(强
腐蚀性),强氧化
性 ,不具有挥发
性
与盐酸
的性质
相似,具
有强的
氧化性
白色固体,极易溶于水
(溶解放热),吸水易
潮解—作干燥剂,水溶
液有涩味和滑腻感,具
有强的腐蚀性
白色粉末,微溶于
水固体,有一定的腐
蚀性,水溶液俗称石
灰水
白色固体,易溶于
水,水溶液有咸
味,溶解度受温度
影响不大,
白色粉末状
固体,易溶
于水,水溶液
呈碱性
白色晶体,易溶
于水,水溶液显
碱性,受热易分
解
△
2NaHCO3==Na2CO3
+ H2O+CO2↑
白色不溶于水的固体,
是大理石、石灰石、蛋
壳、贝壳、白垩、汉白
玉主要成分;
高温分解:
高温
CaCO3===CaO+ CO2↑
用途①金属除锈
②制造药物
③人体中含有少量盐
酸,助消化
①金属除锈
②浓硫酸作干燥
剂
③生产化肥、精
炼石油
化工原
料
制化肥
原料
①氢氧化钠固体作干燥
剂
②化工原料:制肥皂、
造纸
③去除油污:炉具清洁
剂中含氢氧化钠
①工业:制漂白粉,
制NaOH
②农业:改良酸性
土壤、配波尔多液
③建筑:石灰浆刷
墙、三合土
(1)作调味品
(2)作防腐剂
(3)融雪剂(降
低雪的熔点)
(4)农业上用
NaCl溶液来选种
(5)制生理盐水
用于玻璃、
造纸、纺
织、洗涤、
食品工业等
制火碱
制糕点所用的发
酵粉
医疗上,治疗胃
酸过多
建筑材料
补钙剂
治疗胃酸过多
通性(具有通性的原因:不同酸能解离出相同的H+)
(1)与酸碱指示剂的反应:使紫色石蕊试液变红
色,不能使无色酚酞试液变色
(2)金属 + 酸→盐 + 氢气
(3)金属氧化物 + 酸→盐 + 水
(4)碱 + 酸→盐 + 水
(5)盐 + 酸→另一种盐 + 另一种酸
(具有通性的原因:不同碱能解离出相同的
OH-)
(1)碱溶液与酸碱指示剂的反应:使紫色
石蕊试液变蓝色,使无色酚酞试液变红色
(2)非金属氧化物+碱→盐+水
(3)酸+碱→盐+水
(4)盐+碱→另一种盐+另一种碱
1、盐(可溶)+ 金属 1 →金属 2 + 新盐(金属1比金属2活泼,K、
Ca、Na除外)
2、盐 + 酸→新盐 + 新酸(满足复分解反应的条件)
3、盐 + 碱→新盐 + 新碱(反应物需都可溶,且满足复分解反应的条
件)
4、盐 + 盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)
其它①其它常见酸:CH3COOH、H2CO3、H3PO4
②浓硫酸沾皮肤:用大量水冲洗,再涂上3%--5%碳酸
氢钠溶液。
③稀释浓硫酸一定要把浓硫酸沿杯壁慢慢注入盛水的
烧杯中,并不断用玻璃
①氢氧化钠溶液沾皮肤:用大量水冲洗,再
涂上硼酸溶液②可溶性碱:NaOH、KOH、
Ba(OH)2、Ca(OH)2、NH3.H2O,不溶性碱大部为
白色(氢氧化铜为蓝色、氢氧化铁为红褐色)③
制取NaOH:Ca(OH)2+Na2CO3== CaCO3↓+2NaOH
密封保存:因吸水易潮解,与CO2反应而变质
④制取Ca(OH)2:CaO+H2O= Ca(OH)2(放热),生
石灰吸水---作干燥剂2
①粗盐提纯:溶解、过滤、蒸发、计算产率。
粗盐中由于含有氯化镁、氯化钙
等杂质,易吸收空气中的水分而潮解。
海水晒盐采用蒸发溶剂结晶法
②硫酸铜晶体(俗称胆矾、蓝矾):CuSO4.5H2O,蓝色能溶于水固体,有毒
受热易分解:△
CuSO4•5H2O====CuSO4+5H2O
(蓝色) (白色)
③碳酸钠晶体:Na2CO3·10H2O(纯净物),俗称天然碱、石碱、口碱。
风化:
常温时在空气中放置一段时间后,失去结晶水而变成粉末。
(化学变化)。
