出口欧盟原料药证明文件申请书
国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知

国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2013.05.07•【文号】食药监[2013]10号•【施行日期】2013.05.07•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知(食药监〔2013〕10号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):2011年6月欧盟发布了原料药新指令2011/62/EU,要求对进口到欧盟成员国的原料药,自2013年7月2日起,其生产企业必须取得出口国药品监管机构签发的证明文件。
总局对该指令予以高度关注,通过多种途径与欧盟有关方面进行了沟通协商,研究确定了证明文件出具方式和格式。
经征求商务部意见并报国务院同意,现将有关事项通知如下:一、认真负责地做好证明文件的出具工作出口欧盟原料药证明文件由原料药生产企业所在地省级食品药品监督管理部门负责出具。
为欧盟出具原料药证明文件,既是加强国际合作,参与国际竞争的需要,也为我国加强原料药监管提供了机遇。
各省级食品药品监督管理部门要对该项工作予以高度重视,建立健全相关工作制度,制定工作程序,明确工作要求,指定专门处室和人员负责,认真负责地做好出证工作,并为今后加强原料药监管积累数据和经验。
具体工作人员要熟悉药品GMP监管工作并具有一定的英语基础。
请各省级食品药品监督管理部门将相关联系人信息按附件1要求于2013年5月20日前传真给总局。
二、出具证明文件的原料药品种范围以下两种情况可以出具出口欧盟原料药证明文件:第一种是取得我国《药品生产许可证》企业生产的具有药品批准文号的原料药;第二种是取得我国《药品生产许可证》企业生产的尚未取得药品批准文号的原料药。
三、证明文件的申请与核发程序原料药生产企业申请出口欧盟原料药证明文件,应向企业所在地省级食品药品监督管理部门提交申请,填报《出口欧盟原料药证明文件申请书》,并附申报资料。
出口申请书

出口申请书
尊敬的领导:
我是公司XXX的员工,现在向您提交一份出口申请书。
我所在的部门近期开发了一款新产品,经过市场调研和测试,我们相信这款产品具有很大的出口潜力,能够在国际市场上取得良好的销售业绩。
为了拓展公司的国际业务,我特向您申请准许出口这款产品。
我们已经对目标国家的市场进行了充分的调研,制定了相应的营销策略和销售计划。
我们相信,通过公司的努力和支持,这款产品能够在国际市场上取得成功。
在此,我郑重承诺,如果获得出口许可,我会全力以赴,确保产品的质量和服务的满意度,为公司争取更多的国际业务机会,为公司创造更多的收益。
最后,我再次请求领导批准出口这款产品,让我们共同努力,开拓国际市场,为公司的发展做出更大的贡献。
谢谢您的审阅和支持!
此致。
敬礼。
XXX 敬上。
海关开具证明申请书模板(3篇)

第1篇尊敬的海关管理部门:尊敬的领导:您好!我单位/个人(以下称“申请人”)因(具体原因,如:办理出口退税、证明商品原产地、参与国际招标等)需要,特向贵海关申请开具相关证明。
为确保申请书的完整性和准确性,现将申请书模板如下:一、封面【申请书名称】海关开具证明申请书二、申请人基本信息1. 申请人名称:(单位名称或个人姓名)2. 申请人地址:(详细地址)3. 申请人联系方式:(电话、邮箱等)4. 申请人统一社会信用代码/身份证号码:(单位或个人)5. 申请人法定代表人/负责人姓名:(单位或个人)6. 申请人法定代表人/负责人联系方式:(电话、邮箱等)三、证明事项1. 证明事项名称:(如:出口货物原产地证明、货物通关证明等)2. 证明事项编号:(如有)3. 证明事项内容:(详细描述需要证明的具体事项)四、证明依据1. 证明依据名称:(如:合同、发票、装箱单等)2. 证明依据编号:(如有)3. 证明依据内容:(详细描述证明依据的具体内容)五、申请证明的目的和用途1. 申请证明的目的:(如:办理出口退税、参与国际招标等)2. 申请证明的用途:(详细说明申请证明将如何使用)六、申请证明的相关附件1. 附件名称:(如:合同、发票、装箱单等)2. 附件内容:(详细描述附件的具体内容)七、申请人承诺1. 申请人承诺遵守国家法律法规,保证所提供的信息真实、准确、完整。
2. 申请人承诺对申请证明的相关事项负有全部责任,如有虚假、误导等行为,愿承担相应法律责任。
八、其他需要说明的事项(如有其他需要说明的事项,请在此处详细说明)九、申请书签署申请人:(单位名称或个人姓名)日期:(年/月/日)附件:1. 申请人身份证复印件(个人申请时提供)2. 申请人营业执照复印件(单位申请时提供)3. 其他相关证明材料特此申请,请贵海关予以审批。
敬请审批!申请人:(单位名称或个人姓名)日期:(年/月/日)注:以下为申请书模板的详细说明,请根据实际情况进行修改和补充。
海关出口申请书模板电子版

尊敬的海关领导:您好!我司现向您提交一份出口申请书,请予以审批。
以下是申请书的具体内容:一、企业基本情况1. 我司全称为:×××有限公司,成立于××××年,注册地为××××。
2. 我司主要从事××××行业的业务,拥有多年的出口经验,产品远销海内外。
3. 我司已取得外贸经营者备案登记表、自理报关登记证书等相关进出口资质。
二、出口商品信息1. 商品名称:××××2. 商品型号:××××3. 商品数量:××××4. 商品单价:××××5. 出口目的地:××××6. 出口方式:海运/空运/陆运三、出口合同及付款方式1. 我司与买家已签订出口合同,合同编号为××××。
2. 付款方式为:信用证/预付款/付款交单。
四、出口商品的检验检疫情况1. 我司已按照相关法律法规,对出口商品进行了检验检疫。
2. 检验检疫证书编号为××××,有效期至××××。
五、出口商品的申报要素1. 商品编码:××××2. 商品名称:××××3. 计量单位:××××4. 单价:××××5. 总价:××××6. 出口日期:××××七、申请事项1. 请海关审批我司的出口申请,并为货物办理出口手续。
出口欧盟原料药证明文件审批操作规范

◆简述企业的质量风险管理方针;
◆质量风险管理活动的范围和重点,以及在质量风险 管理体系下进行风险识别、评价、控制、沟通和审核的过程。
是否建立风险管理程序,风险管理方针是什么?
风险管理的应用范围如何确定,重点是什么,何时启用风险评估措施。
风险评估的方式有哪些?
3. 人员
3.1包含质量保证、生产和质量控制的组织机构图(包括高层管理者),以及质量保证、生产和质量控制部 门各自的组织机构图;
七、办理时限:
根据《中华人民共和国行政许可法》第四十二条、第四十五条:
1.法定办结时限:20个工作日(不含转外专家评审时间)。
2.承诺办结时限:15个工作日(不含转外专家评审时间)。
八、办理地点
广西壮族自治区政务服务中心自治区食品药品监督管理局政务服务窗口
地址:南宁市怡宾路6号
九、收费项目
不收费。
十、咨询、投诉电话
◆简述与药品生产质量相关的关键的计算机化系统的设计、使用验证情况。
应写明有无计算机化管理系统(如物料管理系统、称量系统、生产控制系统等)
主要系统设计、使用情况描述(系统控制图)
主要系统验证情况描述
5. 文件
◆描述企业的文件系统;
◆简要描述文件的起草、修订、批准、发放、控制和存档系统。
文件系统结构层次描述
生产企
业名称
中文:
英文:
生产
地址
中文:
英文:
《药品生产许可证》号:
有效期至:
《药品生产许可证》原料药生产范围:
《药品GMP证书》号:
有效期至:
原料药通用名
我国药品批准文号
是否通过我国GMP认证
加工方法
出口申请书

出口申请书
尊敬的相关部门:
我是某某公司的负责人,现函申请向贵部门申请出口许可证,以便我公司可以合法出口我们的产品到国外市场。
我公司生产的产品具有高质量、良好的口碑和竞争力,经过多年的努力和发展,我们已经在国内市场取得了一定的成绩。
为了进一步拓展市场,提升公司的竞争力,我们计划将产品出口到国外市场,开拓海外销售渠道。
我们的产品符合国际标准,且经过了相关的质量检验和认证,具备了出口的条件。
出口产品不仅可以带动我公司的发展,还可以为国家的对外贸易做出贡献。
我们将严格按照国家相关法律法规和质量标准进行生产和出口,确保产品的质量和安全。
我们诚恳希望贵部门能够审慎考虑我们的申请,尽快批准我们的出口许可证申请,以便我们能够顺利进行出口业务。
我们将严格遵守相关法规,履行出口手续,确保出口业务的合法合规。
最后,再次感谢贵部门对我们申请的关注和支持,期待能够得到贵部门的批准。
谢谢!
此致。
敬礼。
某某公司。
日期,XXXX年XX月XX日。
CE申请书

CE申请书1. 引言CE申请书是用于申请CE认证的重要文件,本文档将详细介绍如何撰写一份完整的CE申请书。
CE认证是欧洲市场上对于产品的安全和质量方面的认可标准,通过CE认证可以使产品更容易进入欧洲市场,因此编写一份合格的CE申请书非常重要。
2. 申请人信息在CE申请书中首先需要提供申请人的相关信息,包括申请人的姓名、联系方式、地址等。
同时还需要提供申请人的公司或组织的信息,包括公司名称、注册地址、注册号码等。
3. 产品信息在CE申请书中需要详细描述待申请CE认证的产品的相关信息。
包括产品的名称、型号、规格、功能等。
同时需要提供产品的制造商和供应商的信息,包括公司名称、联系方式等。
4. 产品符合性声明CE申请书中需要包含一份产品符合性声明。
在声明中,申请人需要明确表示该产品符合欧洲相关的安全和质量标准。
声明中应该陈述产品符合的具体标准,并使用相应的法规文件和测试报告来支持这一声明。
5. 技术文档在CE申请书中需要提供详细的技术文档,以证明产品符合相关的安全和质量标准。
技术文档应该包含以下内容:•产品设计和制造的详细描述,包括产品的材料、构造、组件等。
•产品的性能测试报告,包括产品的电气性能、机械性能等。
•产品的安全测试报告,包括产品的电气安全、机械安全等。
•产品的环境测试报告,包括产品在各种环境条件下的适应性和耐久性。
•产品的用户手册和安装指南等使用说明文档。
6. 标识和包装CE申请书中需要提供产品的标识和包装的相关信息。
标识和包装应该符合欧洲相关的标准和要求,以便于消费者正确使用产品并了解产品的相关信息。
7. 合规证书在CE申请书中需要提供产品的合规证书。
合规证书是由认证机构或者第三方实验室进行评估和测试后颁发的,用于证明产品符合欧洲相关标准的文件。
申请人需要提供合规证书的副本或者相关证明文件。
8. 申请流程和费用在CE申请书中需要提供申请的流程和相关费用的说明。
申请人需要清楚了解整个申请过程,并了解申请的费用,以便做好准备。
出口欧洲的API将需要获得出口国药政部门的书面声明文件

Ref. Ares(2012)836360 - 10/07/2012参考文件号(2012)836360 - 10/07/2012EUROPEAN COMMISSION欧洲委员会HEALTH AND CONSUMERS DIRECTORATE-GENERAL健康与消费者保护总司Health systems and products健康体系与产品Medicinal products – quality, safety and efficacy药品–质量、安全性、有效性Brussels, 10/07/2012布鲁塞尔,2012年7月10日SANCO/SF/sl/ddg1.d.6(2012)997444Template for the 'written confirmation' for active substances exported to the European Union for medicinal products for human use, in accordance with Article46b(2)(b) of Directive 2001/83/EC根据第2001/83/EC号法令的第46b(2)(b)条,出口欧盟人用药品使用原料药“书面确认”模板1. Directive 2011/62/EU of the European Parliament and of the Council of 8 June 2011 amending Directive 2001/83/EC on the Community code relating to medicinal products for human use, as regards the prevention of the entry into the legal supply chain of falsified medicinal products (OJ L 174, 1.7.2011, p. 74) introduces EU-wide rules for the importation of active substances: According to Article 46b(2) of Directive 2001/83/EC, active substances shall only be imported if, inter alia, the active substances are accompanied by a written confirmation from the competent authority of the exporting third country which, as regards the plant manufacturing the exported active substance, confirms that the standards of good manufacturing practice and control of the plant are equivalent to those in the Union.欧洲议会以及欧洲理事会于2011年6月8日对第2001/83/EC号有关人用药品共同法规进行了修订,为防止伪造药品进入合法供应链(《欧盟官方公告》L174,1.7.2011,第74页),在欧盟范围对进口原料药采取如下规定:除非另有规定,根据第2001/83/EC号法令的第46b(2)条,仅可进口附有出口第三国药监机构出具的出口原料药生产厂符合等同于欧盟所使用的药品生产质量管理规范标准及对工厂控制的书面确认的原料药。
出口证明模板

出口证明模板尊敬的领事馆官员:我是(申请人姓名),持有中国国籍,现居(申请人现居所在地)。
我特此申请办理出口证明,以便将我的货物出口至(目的地国家/地区)。
我计划将以下货物出口至(目的地国家/地区):1.商品名称:(商品1名称),规格型号:(规格型号),数量:(数量),单价:(单价)。
2.商品名称:(商品2名称),规格型号:(规格型号),数量:(数量),单价:(单价)。
3.商品名称:(商品3名称),规格型号:(规格型号),数量:(数量),单价:(单价)。
在此,我列出以下原因说明我需要向目的地国家/地区出口这些货物:1.经市场调研发现,目的地国家/地区的需求与我所出售的货物相匹配,我的产品在当地市场有很大的市场潜力。
2.通过出口这些货物,我将能够拓展我的业务范围,并在目的地国家/地区建立更多合作伙伴关系。
3.进行国际贸易不仅有助于我个人经济收入的增加,更可以增加国际间的合作和交流,提升我所在行业的竞争力。
我已经了解并满足了目的地国家/地区的出口要求,并准备了以下材料:1.货物详细清单,包含商品名称、规格型号、数量和单价。
2.有效的商业合同/采购订单,证明我与目的地国家/地区的客户已经达成销售协议。
3.装箱清单,证明货物已经按照出口标准进行正确包装。
4.完整的税务清单,证明我已按照目的地国家/地区的税务要求缴纳了相关税费。
5.商业发票,确认货物的真实价值和价格。
我对于被允许出口我的产品到目的地国家/地区感到非常兴奋,并希望能够开展互利共赢的业务合作。
我相信这次出口将为我带来更多的商业机会,同时也为目的地国家/地区带来优质的产品和服务。
此致敬礼(申请人姓名)。
出口欧盟原料药证明文件申请书-(空白模板)
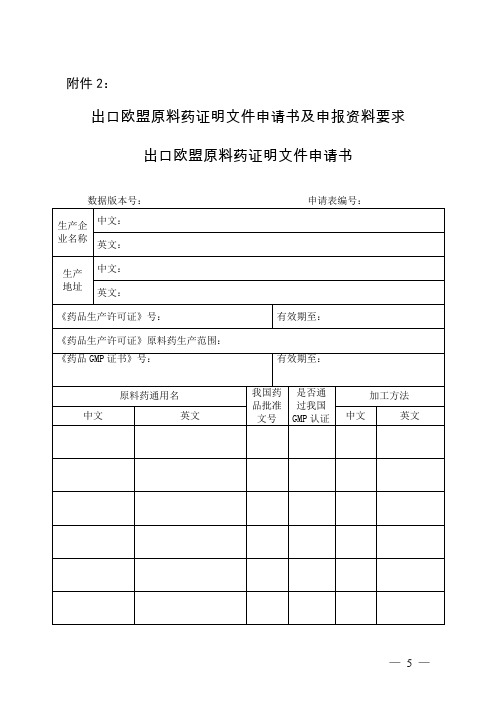
附件2:
出口欧盟原料药证明文件申请书及申报资料要求
出口欧盟原料药证明文件申请书
—5—
注:1.使用国家食品药品监督管理总局出口欧盟原料药证明文件管理系统在线填写本表时,每次成功保存申请表页面后由系统自动生成新的“数据版本号”,用于确保系统识别与申请人提交的打印表版本相一致的电子表数据。
2.申请表编号由省级食品药品监督管理局办理人员填写。
3.本表应打印在一张A4纸的正反两面。
4.表内各项内容可参考《出口欧盟原料药证明文件》填写说明进行填写。
5.本表格式由国家食品药品监督管理总局制定。
—6—。
FORM E出口货物原产地证明书填制说明

FORM E出口货物原产地证明书填制说明1. 简介出口货物原产地证明书(以下简称FORM E)是国际货物贸易中常见的一种证明文件,用于证明货物的原产地,以便享受相关优惠关税待遇。
本文档将详细介绍FORM E的填制说明,以便顺利完成证明书的申请。
2. 填写要求在填写FORM E之前,需要了解以下填写要求:•表格必须使用国际贸易通用的英文填写。
•所有信息必须准确无误,包括货物描述、数量、价值等。
•所有附件必须按照要求提供,并提供英文翻译件(如适用)。
•表格必须由合格的经办人签署和盖章。
3. 填写步骤以下是填写FORM E的详细步骤:步骤 1: 申请人信息在证明书的开头,需要填写申请人的相关信息,包括:•公司名称•公司地址•公司电话和传真号码•申请人姓名和职务步骤 2: 贸易情况在这一部分,需要提供与贸易有关的详细信息,包括:•受益国/地区:填写货物出口目的地国家或地区。
•出口国/地区:填写货物出口所在的国家或地区。
•运输方式:填写货物的运输方式,如海运、空运、铁路运输等。
•海关编码:填写货物的海关编码(HS Code)。
•贸易条款:填写适用的贸易条款(如FOB、CIF等)。
步骤 3: 货物信息在这一部分,需要提供有关货物的详细信息,包括:•货物描述:准确描述货物的名称、规格、型号等信息。
•数量:填写货物的数量和单位。
•单价:填写每个货物单位的单价。
•总价值:计算货物的总价值,即数量乘以单价的结果。
步骤 4: 原产地证明在这一部分,需要提供有关货物原产地的证明信息,包括:•原产地证明方式:填写原产地证明的方式,如自证声明、进口商证明等。
•原产地证明号码:填写由进口国/地区颁发的原产地证明号码(如适用)。
•原产地证明附件:附上由相关当局签发的原产地证明文件,如产地证书、出口商声明等。
•原产地证明日期:填写原产地证明的签发日期。
步骤 5: 经办人签署最后,由经办人签署FORM E,并在表格上盖章和日期,以确认表格的真实性和准确性。
欧盟植物药原料药进出口的相关法律法规

欧盟植物药的管理法规欧共体对植物药的态度不同于美国,有的欧洲国家使用植物药有700年以上的历史。
欧共体法律65/65/EEC法令明文规定植物药是药,虽然目前欧共体各成员国对此认识并不完全统一,我们在本章节中将详尽叙述他们之间差别,但总的来说欧共体整个法律将植物药已提到一定高度。
第一、植物药定义根据65/65/EEC对药品定义:任何作为对人和动物具有治疗作用或预防疾病的物品或复合物都称为药品。
后来又作了进一步明确“任何用于人体或动物作为医学上诊断疾病或康复、纠正或改善生理功能的物品或复合物都作为药品"。
表2—6列出各成员国依据65/65/EEC 法令而制定相应法律。
作为药品,如要在欧共体国家销售,必须获得当局许可。
植物药制剂被大多数欧共体成员国的法律规定为药品(除了葡萄牙外)。
在葡萄牙,对于植物药制剂(除少数几个被定为药品)大多列入非药品,被列入健康用品、化妆品、医用植物和减肥产品作为在辅助治疗或顺势疗法中运用。
根据各国相应法律,对植物药制品的认识在下节讨论。
表2—6欧共体各成员国依据65/65/EEC所制定相应法律国名执行65/65/EEC法令,各成员国制定相应法律奥地利药法1994,修正第2版(2nd ament to Medicines Law l994)比利时皇家法令3。
1969,7(Royal Decree of 3 July l969)丹麦药法l975,7(Medicines Law of July l975)芬兰第395号,药法l987,4,10(Medicines Act N0.3950f 10 April l987)法国公共健康法规(Public Health Code)德国药法l976(Medicines Law of l976J希腊药法l985(Medicines Law of l985)爱尔兰 1991年5月29日法令(Legislative Decree of 29 May l991)卢森堡无相应法律荷兰医药法(Medicines Law)葡萄牙 353/93法令(Law—decree N0.353/93)西班牙医药法l990(Medicines Law of l990)瑞典药品法(SFS l992:859)(Medicines Products Act SFS l992:859)英国医药法1968(Medicines Act l968)第二、欧共体各成员国对植物药的定义及认识根据欧共体65/65/EEC法令对药的定义,植物药制剂归于药物范畴,这个认识无疑与中国人认识在相同的水平,所以欧共体对植物药认识比美国现认识(指FDA)要高一点.欧共体各成员国在执行65/65/EEC中,又根据各自一贯的观点,对植物药认识、审批,现在没有完全统一.1997年成立的Ad Hoc草药组工作目的就是统一各成员国的认识和法规,尤其在运用植物药制剂上对欧洲各国进行统一标准。
商务部申请出口许可证范文

商务部申请出口许可证范文尊敬的商务部领导:您好!我是[公司名称]的[你的职位],今天怀着一颗既激动又有点小紧张的心来给您递上我们公司的出口许可证申请。
您就像我们走向国际市场这个大舞台的“守门人”,而这张许可证就是我们的“入场券”呢。
我们公司成立于[成立年份],在国内市场摸爬滚打了这么多年,也算是闯出了一片小天地。
现在呢,我们瞅准了国际市场这个大蛋糕,特别是[目标出口国家或地区]那边,感觉就像发现了宝藏一样。
那里有好多潜在的客户,他们对我们的[产品名称]表现出了浓厚的兴趣,就像小蜜蜂看到了盛开的花朵一样。
咱们这个[产品名称]啊,那可是有不少亮点的。
就说质量吧,那是经过我们精心打磨的。
从原材料的挑选开始,我们就像选美比赛的评委一样严格,只选最好的。
生产过程中呢,每一道工序都有专人把关,就像一群忠诚的卫士守护着宝藏。
而且,我们的产品在功能上也很有特色,[简单描述产品功能特色],这在国际市场上也是很有竞争力的,就像一把独特的宝剑在一堆普通刀剑里闪闪发光。
我们之所以想出口到[目标出口国家或地区],除了那边有市场需求,还因为我们觉得可以把我们中国的好东西带出去,让世界更多地方的人体验到中国制造的魅力。
这就像文化交流的使者一样,我们的产品就是“文化大使”,走到哪里就把中国的好印象带到哪里。
为了这次出口计划,我们公司可是做了不少准备工作的。
我们组建了专门的外贸团队,这些小伙伴们就像一群勇敢的探险家,他们熟悉国际贸易的规则和流程,就像熟悉自己家的小路一样。
而且,我们还和当地的一些合作伙伴建立了联系,他们会在那边为我们的产品做推广,就像啦啦队为运动员加油助威一样。
我们预估在未来[具体时间段]内,出口的数量大概是[X]个(或者根据产品单位填写)。
这个数量是我们根据市场调研和目前收到的潜在订单估算出来的,就像厨师根据客人的数量预估食材的用量一样,希望能比较精准地满足市场需求。
我们也知道,出口许可证不仅仅是一张纸,它代表着责任和规范。
欧盟草药良好应用申请的申报要求

欧盟草药良好应用申请的申报要求英文版The European Union has strict regulations in place for the approval of herbal medicinal products. Any company looking to market herbal products within the EU must adhere to these guidelines in order to ensure the safety and efficacy of their products.One of the key requirements for applying for approval of herbal medicinal products in the EU is the submission of a detailed dossier outlining the quality, safety, and efficacy of the product. This dossier must include information on the composition of the product, the manufacturing process, and any relevant clinical studies that have been conducted.In addition to the dossier, companies must also provide evidence of the traditional use of the herbal product in question. This can include historical evidence of the product's use as a medicinal remedy, as well as any other relevant information that supports its safety and efficacy.Once the dossier has been submitted, it will be reviewed by the European Medicines Agency (EMA) and the Committee on Herbal Medicinal Products (HMPC). If the product meets all of the necessary criteria, it will be granted approval for marketing within the EU.In conclusion, the application process for approval of herbal medicinal products in the EU is thorough and rigorous. Companies must provide detailed information on the quality, safety, and efficacy of their products in order to ensure that they meet the necessary standards for approval.欧盟草药良好应用申请的申报要求欧盟对草药药品的批准制定了严格的规定。
原料药欧盟认证申请流程

原料药欧盟认证申请流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!原料药欧盟认证申请流程。
1. 确定适用法规及申请类型。
适用法规,欧盟药品管理局(EMA)第 2309/93 号指令。
出口产品申请书模板范文

尊敬的出口产品审查委员会:您好!我司现向您提交一份出口产品申请书,希望能获得您的审批。
以下是申请书的具体内容:一、产品基本信息1. 产品名称:(请填写产品名称)2. 产品型号:(请填写产品型号)3. 产品规格:(请填写产品规格)4. 产品材质:(请填写产品材质)5. 产品用途:(请填写产品用途)6. 产品生产地:(请填写产品生产地)二、产品出口目的地1. 出口国家:(请填写出口国家)2. 出口地区:(请填写出口地区)三、产品出口数量1. 总出口数量:(请填写总出口数量)2. 出口批次:(请填写出口批次)四、产品出口价格1. 出口单价:(请填写出口单价)2. 出口总价:(请填写出口总价)五、产品出口方式1. 出口运输方式:(请填写出口运输方式)2. 出口清关方式:(请填写出口清关方式)六、产品出口时间表1. 出口起始日期:(请填写出口起始日期)2. 出口结束日期:(请填写出口结束日期)七、申请单位信息1. 单位名称:(请填写单位名称)2. 单位地址:(请填写单位地址)3. 联系人:(请填写联系人)4. 联系电话:(请填写联系电话)5. 电子邮箱:(请填写电子邮箱)八、产品认证及质量保证1. 产品是否已获得相关认证:(请填写是否获得认证)2. 产品质量保证措施:(请填写产品质量保证措施)九、其他需要说明的事项1. 产品出口对目的国的市场需求及竞争力分析:(请填写市场需求及竞争力分析)2. 产品出口对我国外贸政策及产业政策的影响:(请填写影响分析)3. 产品出口是否存在潜在风险:(请填写是否存在潜在风险)请您仔细阅读以上内容,并给予审批。
如有任何疑问,请随时与我们联系。
感谢您的关注与支持!此致敬礼!(申请单位名称)(申请日期)。
出口欧盟原料药证明文件办理程序(试行)

各县(市、区)市场监管局,市局各相关处室,直属单位、分局:为有序推进我市出口欧盟原料药证明文件办理工作,根据国家食品药品监管总局、省食品药品监管局有关规定,借鉴欧盟监管法规,在工作实践的基础上,我们制定了《出口欧盟原料药证明文件办理程序(试行)》,自2015年9月25日起实施。
现印发给你们,请转发辖区各相关药品生产企业,督促企业按要求申报,并做好日常监管等工作。
市食品药品监管局《转发国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知》(台食药监安注〔2013〕14号)、《关于进一步规范出口欧盟原料药证明文件申报资料的通知》(台食药监安注〔2013〕17号)自本文件执行之日起同时废止。
台州市市场监督管理局2015年8月25日出口欧盟原料药证明文件办理程序(试行)一、办事依据1.国家食品药品监督管理总局《关于出口欧盟原料药证明文件有关事项的通知》(食药监〔2013〕10号)2.浙江省食品药品监督管理局《转发国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知》(浙食药监安〔2013〕4号)二、办事对象已取得《药品生产许可证》,经欧盟或其成员国药品监管机构批准供欧盟制剂厂商用于生产人用药物,且重大变更(如有)按规定经欧盟或其成员国批准的原料药生产企业。
三、申报资料及现场检查的类型(一)首次申请证明文件的原料药需提交的资料1.《药品生产许可证》(正、副本)、营业执照(正、副本)复印件。
2.我国药品监管部门发给的药品批准证明文件复印件(根据申报品种取得批准文号情况提供)。
3.申报品种的中国《药品GMP证书》复印件(根据申报品种取得GMP证书的情况提供)。
4.申报品种近3年通过其他国家或组织药品GMP检查的证明文件的复印件(根据申报品种通过国外GMP检查的情况提供)。
5.申报品种与国外采购企业的销售合同复印件,以及欧盟制剂厂商出具的《需要中国药监部门出具〈出口欧盟原料药证明文件〉的声明》(格式见附件1,签署日期至少应在申报之日前12个月内)。
欧盟草药良好应用申请的申报要求

欧盟草药良好应用申请的申报要求欧盟草药良好应用申请(THMPD)是欧盟对传统草药产品的注册法规。
欧盟委员会要求在欧盟市场销售传统植物药品的申请人必须根据THMPD的相关规定提交一份详细的注册申请。
本文将通过对THMPD申请要求的解读,为读者详细介绍欧盟草药良好应用申请的具体要求。
一、申请人资格根据THMPD的规定,申请人必须是在欧盟经营的法人或者个体经营者。
并且申请人必须有相应的生产和/或销售传统植物药品的经验和技术。
二、申请材料1.申请表格:申请人必须填写完整的申请表格,包括产品名称、成分、适应症、用法用量等相关信息。
2.产品说明书:申请人需要提交产品的详细说明书,包括产品的成分、药理学特性、生产工艺、药物相互作用等信息。
3.质量控制文件:申请人需要提供包括原料和成品的质量控制文件,以证明产品符合欧盟药品质量标准。
4.临床资料:如果产品已经在欧盟某些国家上市,申请人需要提供相关的临床资料,以证明产品的安全性和有效性。
5.制造工艺文件:申请人需要提供产品的制造工艺文件,以证明产品的生产过程符合欧盟标准。
6.用药安全监测计划:申请人需要提供用药安全监测计划,以保证产品在市场上的安全使用。
7.申请费用:申请人需要支付相应的申请费用,费用标准由欧盟委员会规定。
以上所列申请材料是THMPD要求的基本要求,但具体要求还需要根据产品的特殊性和申请国家的不同而有所调整。
三、审批流程一旦申请人提交了完整的申请材料,欧盟委员会将对申请进行审查。
审查结果将在210天内通知申请人,如果申请通过审批,产品将获得欧盟市场销售的许可。
如果申请不通过,申请人可以对审批结果提出上诉并提供更多的资料来支持申请。
总结欧盟草药良好应用申请的申报要求是相对严格的,申请人需要提供完整的申请材料,并且要符合欧盟的药品质量标准。
只有通过了审批的产品才能在欧盟市场销售。
因此,对于想要进入欧盟市场的传统植物药品生产者来说,了解和遵守THMPD的申报要求是非常重要的。
安徽省食品药品监督管理局转发国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知

安徽省食品药品监督管理局转发国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知文章属性•【制定机关】安徽省食品药品监督管理局•【公布日期】2013.06.26•【字号】皖食药监安秘[2013]30号•【施行日期】2013.06.26•【效力等级】地方规范性文件•【时效性】失效•【主题分类】药政管理正文安徽省食品药品监督管理局转发国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知(皖食药监安秘〔2013〕30号)各市食品药品监督管理局,广德、宿松县食品药品监督管理局:现将《国家食品药品监督管理总局关于出口欧盟原料药证明文件有关事项的通知》(食药监〔2013〕10号)转发给你们,同时就开具出口欧盟原料药证明文件事宜提出如下要求,请一并贯彻执行。
一、出具证明文件的原料药品种范围以下两种情况可以出具出口欧盟原料药证明文件:一是取得我国《药品生产许可证》企业生产的具有药品批准文号的原料药(通过GMP认证);二是取得我国《药品生产许可证》企业生产的尚未取得药品批准文号的原料药(包括有原料药批准文号,但尚未通过GMP认证的品种)。
二、证明文件的申请与出具(一)受理申请。
原料药生产企业填报《出口欧盟原料药证明文件申请书》(在国家食品药品监督管理总局出口欧盟原料药证明文件管理系统在线填写),并附相关申报资料报送省局药品安监处。
其中本通知规定的第一种品种,附以下资料:1、《药品生产许可证》、企业《营业执照》复印件;2、我国药品监管部门发给的药品批准证明文件复印件;3、该品种的中国《药品GMP证书》复印件;4、该品种近3年获得其他国家或组织的药品GMP证书复印件;5、该品种与国外采购企业的销售合同复印件;6、监管部门最近一次对其药品GMP认证检查意见及整改情况;7、所在地市局既往对其跟踪(飞行)检查、日常监管等情况的审核意见。
(第4项资料如不具备可不提供)第二种品种,附以下资料:1、《药品生产许可证》、企业营业执照复印件;2、该品种近3年获得其他国家或组织的药品GMP证书复印件;3.该品种与国外采购企业的销售合同复印件;4.药品生产工艺;5.药品质量标准;6.三批样品自检报告复印件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
数据版本号: 申请表编号:
生产企
业名称
中文:
英文:
生产
地址
中文:
英文:
《药品生产许可证》号:
有效期至:
《药品生产许可证》原料药生产范围:
《药品GMP证书》号:
有效期至:
原料药通用名
我国药品批准文号
是否通过我国GMP认证
加工方法
中文
英文
ห้องสมุดไป่ตู้中文
英文
最近一次接受我国药品监管部门GMP检查时间、机构名称、范围和结果:
5.本表格式由国家食品药品监督管理总局制定。
注:1.使用国家食品药品监督管理总局出口欧盟原料药证明文件管理系统在线填写本表时,每次成功保存申请表页面后由系统自动生成新的“数据版本号”,用于确保系统识别与申请人提交的打印表版本相一致的电子表数据。
2.申请表编号由省级食品药品监督管理局办理人员填写。
3.本表应打印在一张A4纸的正反两面。
4.表内各项内容可参考《出口欧盟原料药证明文件》填写说明进行填写。
最近一次接受其他国家或国际组织GMP检查时间、机构名称、范围和结果:
出口企业名称:
出口欧盟目的国家:
出口企业地址:
进口企业名称:
国家:
填报联系人:
部门:
职务:
固定电话:
手机:
电子信箱:
本企业保证,生产上述原料药的过程始终遵守中国和欧盟药品GMP相关要求,产品经检验符合出口合同约定的质量标准。
企业负责人签名并加盖公章: 年 月 日
