2020高中化学图解法讨论电极电势
(精品)浅谈标准电极电势的图示法(整理)

浅谈标准电极电势的图示法康祎璠西北大学化学系05级化学专业西安710069摘要标准电极电势是氧化还原反应很好的定量标度有时为了直观和便利起见可用图示法对电势数值作以表示本文就几种常用的图示形式作一讨论。
关键词标准电极电势电对氧化态歧化反应标准电极电势是氧化还原反应很好的定量标度通常在教材和手册中都以“标准电极电势表”的形式给出。
但是列表的方式是依电极电势数值从小到大自上而下排列的这就使得要集中而全面地了解某一种元素的相关氧化态遇到了困难。
而用图示法讨论与某元素相关的电极电势不仅克服了上述的不便而且会提供元素及其化合物更多的信息。
本文将详细的对图示法作一介绍。
一拉蒂麦尔图Latimer diagram 拉蒂麦尔图又称元素电势图是用图形表示标准电极电势数据中最简单的一种。
在特定的pH条件下将元素各种氧化数的存在形式依氧化数降低的顺序从左向右排成一行用线段将各种氧化态连接起来在线段上写出其两端的氧化态所组成的电对O??值便得到该pH下该元素的元素电势图。
下例为碘在酸性和碱性条件下的元素电势图经常以pH 0和pH 14两种条件作图OA??/V OA??/V 在元素图的绘制过程中我们应该注意到1.写法氧化态由高至低从左向右排列短线上电位是电对的O?? 2.OA?? OB??分别指在酸性介质和碱性介质条件下的值。
元素电势图作为用图形表示标准电极电势数据中最简单最常用的一种它的用途也是很广泛的首先可以通过它来判断物质酸性的强弱。
从元素电势图上可以看出某些酸的强弱以及非强酸在给定的pH条件下的解离方式。
如上例中高碘酸在酸性1介质中以分子态H5IO6存在故而可以判断高碘酸不是强酸。
再看碘元素的碱式图从该图可以看出在pH14的条件下H5IO6将解离出两个氢原子以??263IOH形式存在。
其次可以已知电对的O??求某电对未知的O??如下例所示 D C B A 3θ32θ21θ1nEnEnE FEnG EnFEnG En FEnG En FEnG Enxxxxxθθmrθ θ33θm3rθ33θ22θm2rθ22θ11θm1rθ11 DeA D e C C e B B eA??Δ→??Δ→??Δ→??Δ→xxxxxxxn En EnEnE En EnEnEnFEn FEnFEnFEnGGGGnnnnθ33θ22θ11θθ33θ22θ11θθ33θ22θ11θθm3rθm2rθm1rθmr321ΔΔΔΔ 另外元素电势图的另一个重要应用就是判断歧化反应能否发生。
高中化学电极电势的电气化学解释

高中化学电极电势的电气化学解释在高中化学学习中,电极电势是一个重要的概念。
它涉及到电化学反应中电子的转移和化学能量的转化,对于理解电化学反应的原理和应用具有重要意义。
本文将从电气化学的角度解释电极电势,并通过具体的例子来说明电极电势的考点和解题技巧。
首先,我们来了解一下电极电势的定义。
电极电势是指电化学反应中电子在电极上的转移所产生的电势差。
在电化学反应中,通常会涉及两个电极,即氧化电极和还原电极。
氧化电极是电子的供应者,它发生氧化反应,将电子释放到电解质溶液中;还原电极则是电子的接受者,它发生还原反应,从电解质溶液中接收电子。
两个电极之间的电势差就是电极电势。
接下来,我们通过一个具体的例子来说明电极电势的考点和解题技巧。
假设我们要计算铜电极和铁电极之间的电势差。
首先,我们需要了解铜电极和铁电极的反应类型。
铜电极发生氧化反应,将电子释放到电解质溶液中,而铁电极则发生还原反应,从电解质溶液中接收电子。
根据电极反应的类型,我们可以确定铜电极是氧化电极,铁电极是还原电极。
接下来,我们需要找到铜电极和铁电极的标准电极电势值。
标准电极电势是指在标准状态下,电极反应的电势差。
通过查阅相关资料,我们可以找到铜电极和铁电极的标准电极电势值分别为0.34V和-0.44V。
注意,标准电极电势值是相对于标准氢电极而言的,标准氢电极的电势被定义为0V。
最后,我们可以计算铜电极和铁电极之间的电势差。
根据电极电势的定义,电势差等于还原电极的电势减去氧化电极的电势。
在这个例子中,还原电极是铁电极,其电势为-0.44V;氧化电极是铜电极,其电势为0.34V。
因此,铜电极和铁电极之间的电势差为-0.44V-0.34V=-0.78V。
通过这个例子,我们可以总结出解题的一般步骤。
首先,确定电极反应的类型,分别找到氧化电极和还原电极。
然后,查阅相关资料,找到电极的标准电极电势值。
最后,根据电势差的定义,计算电极之间的电势差。
除了以上的例子,电极电势还可以应用于其他方面。
电极电势
这个重要概念,用来解释沉淀反应。他用量子理论的观点 研究低温下固体的比热;提出光化学的“原子链式反应”理 论。1906年,根据对低温现象的研究,得出了热力学第三 定律,人们称之为“能斯特热定理”,这个定理有效地解决 了计算平衡常数问题和许多工业生产难题。因此获得1920
lg
[c(Red) / cP ]b [c(Ox) / cP ]a
25℃时,
E (Ox/Red )
注意:
=
E P (Ox/Red ) +
0.0592 n
lg
[c(Ox ) / cP ]a [c(Red ) / cP ]b
(1) 反应体系中是固体或纯液体时,其浓度视为1。对于气体组 分,用分压代替浓度,并要将分压作标准化处理
E = EP − 2.303RT lg Q nF
25℃时,
E = E P − 0.0592 lg Q n
4.2.3 影响电极电势的因素——能斯特方程
电极电势的能斯特方程式:
对于 a Ox + ne → bRed E P(Ox/Red)
E (Ox/Red)
=
E P (Ox/Red) −
2.303 RT nF
正值意味着标准铜电极
负值意味着标准锌电极
的电势比标准氢电极高
的电势比标准氢电极低
参
比
甘汞电极
电
KCl溶液 Pt Hg
Cl -(c) | Hg2Cl2(s)|Hg(l) 电极反应:
极
Hg2Cl2
Hg2Cl2(s) + 2e → 2Hg(l)+2Cl-(c)
素瓷头
甘汞电极的电极电势与KCl浓度的关系
高中化学电极电势的求解技巧与应用

高中化学电极电势的求解技巧与应用电极电势是高中化学中一个重要的概念,它是描述电化学反应中电子转移的能力的物理量。
在化学学习中,我们经常需要根据给定的条件求解电极电势,以便分析电化学反应的方向和速率。
本文将介绍一些求解电极电势的技巧,并结合具体题目进行分析和说明,帮助高中学生掌握这一重要概念。
一、标准电极电势的求解标准电极电势是指在标准状态下,相对于标准氢电极的电势差。
求解标准电极电势时,我们可以利用标准电极电势表,根据反应的标准电极电势进行计算。
例如,对于下面的反应:Cu2+(aq) + 2e- → Cu(s)我们可以在标准电极电势表中找到Cu2+/Cu的标准电极电势为0.34 V。
因此,这个反应的标准电极电势为0.34 V。
需要注意的是,标准电极电势表中的数值是相对于标准氢电极的,所以在实际计算中,我们需要将反应中的物质与标准氢电极进行比较,确定氧化剂和还原剂,以保证计算的准确性。
二、非标准电极电势的求解在实际情况中,电极电势往往不是在标准状态下进行测量的,而是在非标准条件下。
这时,我们需要利用涉及到的浓度和温度等因素进行修正。
对于非标准电极电势的求解,我们可以利用奈尔定律和温度修正公式进行计算。
例如,对于下面的反应:Fe2+(aq) + 2e- → Fe(s)我们需要求解Fe2+/Fe的电极电势。
根据奈尔定律,非标准电极电势可以表示为:E = E° - (RT/nF)lnQ其中,E为非标准电极电势,E°为标准电极电势,R为气体常数,T为温度,n 为电子转移的个数,F为法拉第常数,Q为反应物浓度的乘积。
通过测量反应物浓度和温度,我们可以将上述公式中的各个参数代入,求解出非标准电极电势。
三、电极电势的应用电极电势在化学中有着广泛的应用。
其中一个重要的应用是判断电化学反应的方向和速率。
根据电极电势的正负可以判断反应的方向。
当电极电势为正时,反应是自发进行的,即产生电流;当电极电势为负时,反应是非自发进行的,即需要外加电流才能进行。
高中化学电极电势的大小比较与应用

高中化学电极电势的大小比较与应用电极电势是化学反应中电子转移的驱动力,也是判断电池电势大小的重要指标。
在高中化学学习中,电极电势的大小比较与应用是一个重要的考点。
本文将通过具体的题目举例,分析不同类型的电极电势问题,并给出解题技巧和应用指导,以帮助高中学生和他们的父母更好地理解和应用电极电势。
一、电极电势的大小比较1. 比较标准氢电极与其他电极的电势差标准氢电极是电极电势的参比电极,其电势被定义为0V。
因此,与标准氢电极相比,电势较高的电极具有正的电势值,电势较低的电极则具有负的电势值。
例如,对于以下两个反应:反应1:Zn2+ + 2e- → Zn反应2:Cu2+ + 2e- → Cu根据标准电极电势表,反应1的标准电极电势为-0.76V,反应2的标准电极电势为0.34V。
因此,可以得出结论:Cu2+/Cu电极的电势高于Zn2+/Zn电极。
2. 比较不同离子间的电势差除了与标准氢电极比较,我们还可以通过比较不同离子间的电势差来判断电极电势的大小。
以下列反应为例:反应3:2Ag+ + 2e- → 2Ag反应4:Cu2+ + 2e- → Cu根据标准电极电势表,反应3的标准电极电势为0.80V,反应4的标准电极电势为0.34V。
可以发现,Ag+/Ag电极的电势高于Cu2+/Cu电极。
因此,我们可以得出结论:Ag+离子比Cu2+离子更容易还原为金属。
二、电极电势的应用1. 预测反应的进行方向根据电极电势的大小比较,我们可以预测反应的进行方向。
当两个反应的电极电势差为正值时,反应将自发进行;当电势差为负值时,反应将不自发进行。
例如,对于以下两个反应:反应5:2H+ + 2e- → H2反应6:Pb2+ + 2e- → Pb根据标准电极电势表,反应5的标准电极电势为0V,反应6的标准电极电势为-0.13V。
由于电势差为负值,我们可以得出结论:在标准状态下,Pb2+离子会还原为Pb金属,反应6将自发进行。
2. 计算电池的电动势电动势是电池输出电能的能力,可以通过电极电势的差值来计算。
课件:电极电势

2
• (ii) 电极电势是如何产生的---双电层模型 • 金属表面的两过程:
• 金属溶解, 阳离子进入溶液, 电子留在金 属表面, 形成金属表面带负电荷、邻近溶 液带正电荷的“双电层”,金属还原性强、 Mn+(aq)浓度小,这种倾向大
它电极的电极电势的。 H2(g) (1 p )
(i)〔标准氢电极〕
• Pt|H2(100 kPa)|H+(1 mol·dm-3),
Pt H+(aq) (a = 1)
H2气泡
• IUPAC 规 定 , 以 标 准 氢 电 极 (Pt),
H2(1pө)H+(1mol·dm-3) 的 电 势 作 为 电 极 电 势的相对标准,规定其电极电势φө =0 V
20
• 298 K, [H+] = 10.0 mol·dm-3时, 电对Cr2O72- / Cr3+的电极电势
[解]电极反应:
Cr2O72- + 14 H+ + 6 e- = 2 Cr3+ + 7 H2O
E (Cr2O72-
/
Cr3 )
E O (Cr2O72-
/
Cr3 )
0.059 6
V
lg
(Cr2O72- )(H )14 (Cr3 )2
φө (Zn2+/Zn)=-0.76 18 V,
当Zn2+浓度c=0.001 M时,
φ(Zn2+/Zn)=φө(Zn2+/Zn)+(0.05917/2)×lgc
= -0.76 18 - (0.05917/2)×3=-0.8506 V
电极电势 (2)

电极电势什么是电极电势?电极电势是电化学体系中的一个重要概念,用来描述电化学反应中电极的电位差。
电势可以简单理解为电荷在电场中的势能,是电化学反应过程中电位变化的度量。
在电化学中,每个电池或电解槽都由两个电极组成,即阳极和阴极。
电极是与电解质溶液接触的导电体,能够在电解质溶液和电极之间传递电荷。
电极电势(E)是描述电极是否具有还原(正)性或氧化(负)性的重要参数。
电极电势的单位是伏特(V)。
如何测量电极电势?测量电极电势的一种常用方法是使用标准电极电势。
标准电极电势是指在一定条件下(通常是1摩尔/L的溶液浓度和1大气压),某个物质的电极与标准氢电极(SHE)之间的电位差。
标准氢电极被定义为0伏特,是电极电势的基准。
通过与标准电极进行比较,可以确定其他电极的电势。
标准电极电势的测量通常使用电动势计或电位计进行,这些仪器可以测量电势的差异。
电阻应该尽量减小以确保准确测量电电位差。
影响电极电势的因素温度温度是影响电极电势的重要因素。
随着温度的改变,电解质溶液中的离子活性也会发生变化,导致电极电势的变化。
因此,在实验测量中应控制好温度以获得准确的电极电势测量结果。
浓度电极电势还受电解质溶液中的离子浓度影响。
在非标准条件下,离子浓度的变化也会导致电极电势的改变。
根据液体相对电势测量理论,浓度改变与电位的变化之间存在线性关系。
因此,在进行电极电势测量时,应确保电解质溶液的浓度是恒定的。
气体压强电解质溶液中存在有气体的电化学反应也会受到气体压强的影响。
在气体电极中,常常使用来自气体的压强作为参考。
因此,控制气体压强对于准确测量电极电势非常重要。
应用领域电极电势在电化学研究和实际应用中具有广泛的应用。
以下是几个常见领域的例子:锂离子电池在锂离子电池中,电极电势起着关键作用。
锂离子电池中的正极和负极通过电化学反应来储存和释放能量。
测量电极电势可以评估电势差,进而了解电池的性能和稳定性。
腐蚀研究电极电势对于腐蚀研究也非常重要。
电极电势课件

电极电势课件1、电极电势的产生——双电层理论德国化学家能斯特提出了双电层理论解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electrondoublelayer),双电层的厚度虽然很小(约为10-8厘米数量级),但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势,并以此描述电极得失电子能力的相对强弱。
电极电势以符号EMn+/M表示,单位为V(伏)。
如锌的电极电势以EZn2+/Zn表示,铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
2、标准电极电势为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势,而确定各种不同电极的相对电极电势E值。
20xx年国际纯粹化学与应用化学联合会的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。
标准氢电极电极符号:Pt|H2(101.3kPa)|H+(1mol.L-1)电极反应:2H++2e=H2EφH+/H2=0V右上角的符号“φ”代表标准态。
标准态要求电极处于标准压力下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为101.325kPa;组成电对的有关离子的浓度为1mol.L-1。
通常测定的温度为298K。
(2)标准电极电势用标准氢电极和待测电极在标准状态下组成电池,测得该电池的电动势值,并通过直流电压表确定电池的正负极,即可根据E 池=E-E计算各种电极的标准电极电势的相对数值。
高中化学电极电势的标准电极电势推导

高中化学电极电势的标准电极电势推导在高中化学学习中,电极电势是一个重要的概念,它与化学反应的进行密切相关。
了解电极电势的推导过程,可以帮助我们更好地理解化学反应的特性和规律。
本文将介绍高中化学中电极电势的标准电极电势推导,并通过具体的例子加以说明。
首先,我们需要了解什么是电极电势。
电极电势是指电极上发生的半反应与标准氢电极之间的电势差。
标准氢电极是一种特殊的电极,规定其电极电势为0V。
通过比较其他电极与标准氢电极的电势差,我们可以推导出不同电极的标准电极电势。
以铜电极为例,我们可以通过以下步骤推导出其标准电极电势:步骤一:确定半反应首先,我们需要确定铜电极上发生的半反应。
铜电极上的半反应可以表示为Cu2+ + 2e- → Cu。
在半反应中,Cu2+被还原成Cu,同时电子被释放出来。
步骤二:确定标准氢电极上的半反应标准氢电极上的半反应可以表示为2H+ + 2e- → H2。
在半反应中,H+被还原成H2,同时电子被接受。
步骤三:写出电极电势的表达式根据电极电势的定义,我们可以写出铜电极的电势表达式为E(Cu2+/Cu) =E°(Cu2+/Cu) + 0.0591/n * log([Cu2+]/[Cu]),其中E°(Cu2+/Cu)表示标准电极电势,[Cu2+]表示铜离子的浓度,[Cu]表示铜的浓度,n表示电子的个数。
步骤四:计算标准电极电势根据实验数据,我们可以得知标准电极电势E°(Cu2+/Cu)为0.34V。
假设铜离子的浓度为1mol/L,铜的浓度为1mol/L,代入上述表达式,可以计算出铜电极的标准电极电势为E(Cu2+/Cu) = 0.34 + 0.0591/2 * log(1/1) = 0.34V。
通过以上推导过程,我们得到了铜电极的标准电极电势为0.34V。
这个结果告诉我们,在标准条件下,铜电极与标准氢电极之间存在0.34V的电势差。
这意味着在化学反应中,如果铜电极参与反应,其电势会影响反应的进行。
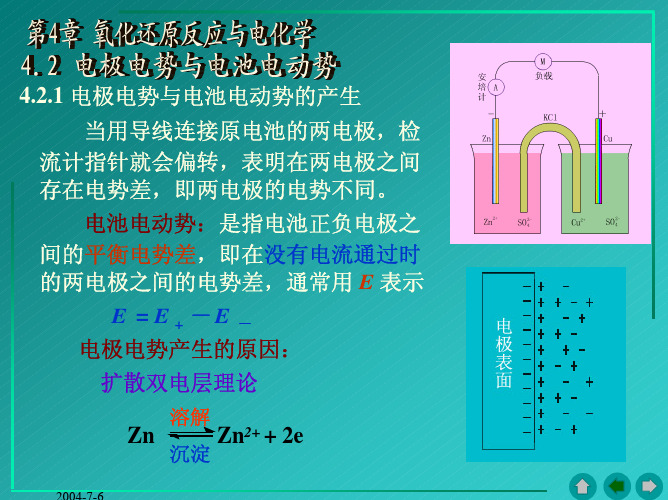
第二节 电极电势

第二节电极电势知识要点一、电极电势和电池电动势1.电极电势(金属-金属离子电极)在铜锌原电池中,为什么电子从Zn原子转移给Cu2+离子而不是从Cu原子转移给Zn2+离子?这与金属在溶液中的情况有关,一方面金属M表面构成晶格的金属离子和极性大的水分子互相吸引,有一种使金属棒上留下电子而自身以水合离子M n+(aq)的形式进入溶液的倾向,金属越活泼,溶液越稀,这种倾向越大,另一方面,盐溶液中的M n+(aq)离子又有一种从金属M表面获得电子而沉积在金属表面上的倾向,金属越不活泼,溶液越浓,这种倾向越大.这两种对立着的倾向在某种条件下达到暂时的平衡:M n+(aq)+ne-M在某一给定浓度的溶液中,若失去电子的倾向大于获得电子的倾向,到达平衡时的最后结果将是金属离子M n+进入溶液,使金属棒上带负电,靠近金属棒附近的溶液带正电,如右图所示,这时在金属和盐溶液之间产生电位差,这种产生在金属定于温度.在铜锌原电池中,Zn片与Cu片分别插在它们各自的盐溶液中,构成Zn2+/Zn电极与Cu2+/Cu电极.实验告诉我们,如将两电极连以导线,电子流将由锌电极流向铜电极,这说明Zn片上留下的电子要比Cu片上多,也就是Zn2+/Zn电极的上述平衡比Cu2+/Cu电极的平衡更偏于右方,或Zn2+/Zn电对与Cu2+/Cu电对两者具有不同的电极电势,Zn2+/Zn 电对的电极电势比Cu2+/Cu电对要负一些.由于两极电势不同,连以导线,电子流(或电流)得以通过.2.原电池的电动势电极电势φ表示电极中极板与溶液之间的电势差.当用盐桥将两个电极的溶液连通时,若认为两溶液之间等电势,则两极板之间的电势差即两电极的电极电势之差,就是电池的电动势.用 E 表示电动势,则有E=φ+-φ-若两电极的各物质均处于标准状态,则其电动势为电池的标准电动势,E○—=φ○—(+)-φ○—(-)电池中电极电势φ大的电极为正极,故电池的电动势 E 的值为正.有时计算的结果 E 为负值,这说明计算之前对于正负极的判断有误.E > 0 是氧化还原反应可以自发进行的判据.3.标准氢电极(气体-离子电极)电极电势的绝对值无法测量,只能选定某种电极作为标准,其他电极与之比较,求得电极电势的相对值,通常选定的是标准氢电极.标准氢电极是这样构成的:将镀有铂黑的铂片置于H+浓度(严格的说应为活度a)为 1.0mol·kg-1的硫酸溶液(近似为1.0mol·dm-3)中,如右图.然后不断地通入压力为1.013×105Pa的纯H2,使铂黑吸附H2达到饱和,形成一个氢电极.在这个电极的周围发生了如下的平衡:2H+ +2e-H2氢电极属于气体-离子电极.标准氢电极作为负极时,可以表示为Pt | H2(1.013×105Pa) | H+(1mol·dm-3)这时产生在标准氢电极和硫酸溶液之间的电势,叫做氢的标准电极电势,将它作为电极电势的相对标准,令其为零.在任何温度下都规定标准氢电极的电极电势为零(实际上电极电势同温度有关).所以很难制得上述那种标准氢电极,它只是一种理想电极.用标准氢电极与其他各种标准状态下的电极组成原电池,测得这些电池的电动势,从而计算各种电极的标准电极电势,通常测定时的温度为298K.所谓标准状态是指组成电极的离子其浓度为1mol·dm-3(对于氧化还原电极来讲,为氧化型离子和还原型离子浓度比为1),气体的分压为1.013×105Pa,液体或固体都是纯净物质.标准电极电势用符号φ○—表示.例如:标准氢电极与标准铜电极组成的电池,用电池符号表示为(-)Pt | H2(p○—) | H+(1mol·dm-3)‖Cu2+(1mol·dm-3) | Cu(+)在298K,用电位计测得该电池的电动势E○—= 0.34VE○—=φ○—(+)-φ○—(-),得φ○—(+) = E○—+φ○—(-),故φ○—( Cu2+/Cu)= E○—+φ○—(H+/H2)2-1=0.34V +0V=0.34V为测锌电极的电极电势,组成电池(-)Zn | Zn 2+(1mol·dm -3)‖H +(1mol·dm -3) | H 2(p ○—) | Pt(+) 用同样的的方法可测得该电池的电势为0.7628VE ○—=φ○—(+)-φ○—(-),得φ○— (-) =φ○— (+)-E ○—,故φ○— (Zn 2+/Zn)=φ○— (H +/H 2) – E ○—= 0V – 0.7629V= – 0.7628V 则Cu -Zn 电池(-)Zn | Zn 2+(1mol·dm -3)‖Cu 2+(1mol·dm -3) | Cu(+) 的电动势E ○—=φ○—Cu 2+/Cu- φ○—Zn 2+/Zn=0.34V -(-0.76V)=1.1V上述原电池装置不仅可以用来测定金属的标准电极电势,它同样可以用来测定非金属离子和气体的标准电极电势,对某些剧烈与水反应而不能直接测定的电极,例如Na +/Na,F 2/2F -等的电极则可以通过热力学数据用间接方法来计算标准电极电势.应当指出:所测得的标准电极电势φ○—是表示在标准条件下,某电极的电极电势.所谓标准条件是指以氢标准电极的电极电势φ○—H +/H2=0,电对的[氧化型]/[还原型]=1或[M n+]=1mol ·dm -3;T=298K.因此标准电极电势φ○—是相对值,实际上是该电极同氢电极组成电池的电动势,而不是电极与相应溶液间电位差的绝对值.二、 电极的类型及符号(四种电极) 1.金属-金属离子电极如 Zn 2+/Zn Cu 2+/Cu 等电极符号 Zn|Zn 2+ (c) Cu|Cu 2+ (c) 2.气体-离子电极如H +/H 2Cl 2/Cl -需用一个惰性固体导体如铂(Pt)或石墨. 电极符号 Pt,H 2(p)|H +(c) Pt,Cl 2(p)|Cl -(c) Pt 与H 2之间用逗号隔开,p 为气体的压力. 3.离子电极如 Fe 3+/Fe 2+ 等体系将惰性电极插入到同一种元素不同氧化态的两种离子的溶液中所组成的电极.电极符号 Pt|Fe 2+(c 1), Fe 3+(c 2)4.金属-金属难溶盐电极如 Hg 2Cl 2/Hg由金属及其难溶盐浸在含有难溶盐负离子溶液中组成的电极.电极符号 Pt,Hg,Hg 2Cl 2(s)|Cl -(c) 三、标准电极电势的应用 1. 标准电极电势表注意 ①标准电极电势的符号是正还是负,不因电极反应的写法而改变.如ZnZn 2+ + 2e -或ZnZn 2+ + 2e -对应的φ○—都是电对Zn 2+/Zn的标准电极电势.② 标准电极电势和得失电子数多少无关,即与半反应中的系数无关,例如C12+2e -2C1-,φ○—=1.358V .也可以书写为1/2C12+e-C1-,其φ○— 值(1.358V)不变.2. 判断判断氧化剂和还原剂的强弱标准电极电势高的电极,其氧化型的氧化能力强;标准电极电势低的电极,其还原型的还原能力强.于是根据标准电极电势表,原则上可以判断一种氧化还原反应进行的可能性.3.判断反应方向氧化还原反应进行的方向判断反应方向氧化还原反应进行的方向与多种因素有关,例如,反应物的性质,浓度、介质的酸度和温度等.但是多种因素存在时,内因是事物变化的根据,外因是变化的条件.当外界条件一定时,如皆取标准状态,反应的方向就取决于氧化剂或还原剂的本性.氧化还原反应发生的方向:强氧化型1+强还原型2 = 弱还原型1+弱氧化型2在标准状态下,标准电极电势较大的电对的氧化型能氧化标准电极电势数值较小的电对的还原型.这样判断氧化还原反应方向的根据是什么?将电池反应分解为两个电极反应,反应物中还原剂的电对作负极,反应物中氧化剂的电对作正极.当负极的电势更负,正极的电势更正,电子就可以自动地由负极流向正极.或者说,电流能自动地由正极流向负极.负极的还原型能将电子自动地给予正极的氧化型,电池电动势必须为正,即E>0,反应就能自动向右进行.例如:判断Zn+Cu2+=Zn2++Cu反应是否向右进行?分析将反应物中还原型和它的产物的电对作负极(-): Zn2++2e-=Zn,φ○— =-0.7628V将反应物中氧化型和它的产物的电对作正极(+): Cu2++2e-=Cuφ○—=0.337V查出标准电势,求出电池电动势:E○—=φ○—(+)-φ○—(-)=φ○—(Cu2+/Cu)-φ○—(Zn2+/Zn)=1.10V >0故反应向右进行.☆利用标准电极电势定量地判断氧化还原方向的具体步骤可总结如下:①首先,求出反应物和生成物中元素的氧化数,根据氧化数的变确定氧化剂和还原剂;②分别查出氧化剂电对的标准电极电势和还原剂电对的标准电极电势;③以反应物中还原型作还原剂,它的电对为负极,以反应物中氧化型作氧化剂,它的电对为正极,求出电池标准状态的电动势:E○—=φ○—(+)-φ○—(-)若E○—>0,则反应自发正向(向右)进行,以符号→表示;若E○—<0,则反应逆向(向左)进行,以符号←表示.五、元素电势图及其应用大多数非金属元素和过渡元素可以存在几种氧化态,各氧化态之间都有相应的标准电极电势,拉提默(Latimer)提出将它们的标准电极电势以图解方式表示,这种图称为元素电势图或拉提默图.比较简单的元素电势图是把同一种元素的各种氧化态按照高低顺序排成横列.关于氧化态的高低顺序有两种书写方式:一种是从左至右,氧化态由高到低排列(氧化型在左边,还原型在右边),另一种是从左到右,氧化态由低到高排列.两者的排列顺序恰好相反,所以使用时应加以注意.在两种氧化态之间若构成一个电对,就用一条直线把它们联接起来,并在上方标出这个电对所对应的标准电极电势.根据溶液的pH值不同,又可以分为两大类:φ○—A (A表示酸性溶液Acid solution)表示溶液的pH=0;φ○—B(B 表示碱性溶液Basic solution)表示溶液的pH=14.书写某一元素的元素电势图时,既可以将全部氧化态列出,也可以根据需要列出其中的一部分.例如碘的元素电势图:也可以列出其中的一部分,例如:从元素电势图不仅可以全面地看出一种元素各氧化态之间的电极电势高低和相互关系,而且可以判断哪些氧化态在酸性或碱性溶液中能稳定存在.现介绍以下几方面的应用.1.利用元素电势图求算某电对的未知的标准电极电势.若已知两个或两个以上的相邻电对的标准电极电势,即可求算出另一个电对的未知标准电极电势.例如某元素电势图为B Cφ○—1φ○—2Aφ○—高中化学竞赛辅导系列——电化学基础根据标准自由能变化和电对的标准电极电势关系,经过一系列变化,可得φ○—=n1φ○—1+ n2φ○—2n1+n2 (其中n1,n2分别为电对的电子转移数)2.判断歧化反应是否能够进行由某元素不同氧化态的三种物质所组成两个电对,按其氧化态由高到低排列如下:假设B能发生歧化反应,那么这两个电对所组成的电池电动势:E○—=φ○—正-φ○—负=φ○—右-φ○—左假设B能发生歧化反应,那么这两个电对所组成的电池电动势:E○—=φ○—右-φ○—左>0,即φ○—右>φ○—左根据以上原则,来看一看Cu+是否能够发生歧化反应?有关的电势图为:因为φ○—右>φ○—左,所以在酸性溶液中,Cu+离子不稳定,它将发生下列歧化反应:2Cu+=Cu+Cu2+又如铁的电势图因为φ○—右<φ○—左,Fe2+不能发生歧化反应.但是由于φ○—左>φ○—右,Fe3+/Fe2+电对中的Fe3+离子可氧化Fe生成Fe2+离子:Fe3++Fe=2Fe2+可将上面讨论的内容推广为一般规律:在元素电势图A —B —C中,若φ○—右>φ○—左,物质B将自发发生歧化反应,产物为A和C.若φ○—左>φ○—右,当溶液中有A 和C存在时,将自发地发生睦化反应的逆反应,产物为B.六、影响电极电势的因素1.定性的讨论如前所述,电极电势是电极和溶液间的电势差.这种电势差产生的原因,对于金属电极来讲,是由于在电极上存在M n++ne-M电极反应的缘故.对于氧化还原电极采讲(如Fe3+/Fe2+电极),是由于在惰性电极上存在Fe3++e-Fe2+电极反应的结果.因此,从平衡的角度上看,凡是影响上述平衡的因素都将影响电极电势的大小.显然,电极的本质、溶液中离子的浓度、气体的压强和温度等都是影响电极电势的重要因素,当然电极的种类是最根本的因素.对于一定的电极来讲,对电极电势影响较大的是离子的浓度,温度的影响较小.定性的看,在金属电极反应中,金属离子的浓度越大,则M n++ne-M 平衡向右移动,减少电极上的负电荷,使电极电势增大. M n+离子浓度越小,有更多的M失去电子变成M n+离子,从而增多电极上的负电荷,使电极电势减小.在Fe3++e-Fe2+电极反应中,增大Fe3+离子浓度或减小Fe2+离子浓度,都将使平衡向右移动,结果减少了电极上的负电荷,使电极电势增大.反之, 减少Fe3+离子浓度或增大Fe2+离子浓度,会使电极电势降低.总之,高氧化数(氧化型)离子的浓度越大,则电极电势越高;低氧化数(还原型)离子的浓度越大,则电极电势越低.换句话说, [氧化型]/[还原型] 越大,则电极电势越高.氧化型]或[还原型]表示氧化型物质(如Fe3+)或还原型物质(如Fe2+)的物质的量的浓度(严格的说应该是活度).2. 能斯特(Nernst)方程由热力学的关系式导,可得出电极电势同离子的浓度、温度等因素之间的定量关系——Nernst 方程:对电极反应氧化型+ne-=还原型有φ=φ○—+RTnF ln[氧化型][还原型]应用这个方程时应注意:①方程式中的[氧化型]和[还原型]并非专指氧化数有变化的物质,而是包括了参加电极反应的所有物质.②在电对中,如果氧化型或还原型物质的系数不是1,则[氧化型]或[还原型]要乘以与系数相同的方次.③如果电对中的某一物质是固体或液体,则它们A B Cφ○—左φ○—右氧化态降低Cu2++0.163+0.521φ○—A/v Cu+CuFe3++0.77+0.521φ○—A/v Fe2+Feφ左φ右φ○—左φ○—右的浓度均为常数,常认为是1.④如果电对中的某一物质是气体,它的浓度用气体分压来表示.典型例题例1 在稀H2SO4溶液中,KMnO4和FeSO4发生以下反应:MnO-4+H++Fe2+ Mn2++Fe3+如将此反应设计为原电池,写出正、负极的反应,电池反应和电池符号.解电极为离子电极,即将一金属铂片插入到含有Fe2+、Fe3+溶液中,另一铂片插入到含有MnO-4、Mn2+及H+ 的溶液中,分别组成负极和正极:负极反应: Fe2+=Fe3++ e-正极反应: MnO-4+8H++5e-=Mn2++4H2O电池反应:MnO-4+8H++5Fe2+=Mn2++5Fe3++ 4H2O 电池符号:(-)Pt|Fe2+(c1),Fe3+(c2)||MnO-4(c3),H+(c4),Mn2+(c5)|Pt (+)例2已知反应:AsO3-4+ I-→AsO3-3+ I2+H2O(未配平),现设计成如图的实验装置,进行下述操作:(Ⅰ)向(B)烧杯中逐滴加入浓盐酸发现微安表指针偏转;(Ⅱ)若改向(B)烧杯中滴加40%NaOH溶液,发现微安表指针向相反的方向偏转,试回答下列问题:⑴两次操作过程中指针为什么会发生偏转?⑵两次操作过程中指针偏转方向为什么相反?试用化学平衡移动的原理加以解释(3)(Ⅰ)操作中C1上发生的反应为,C2上发生的反应为 .(4)(Ⅱ)操作中C1上发生的反应为,C2上发生的反应为.分析(1)指针发生偏转表示有电流通过,说明形成了原电池,将化学能转化为电能.(2)在原电池中指针向负极一边偏转,两种操作指针偏转方向相反,说明总反应是一个可逆反应.加HCl与加NaOH时,发生的反应刚好相反即为可逆反应.从题给反应来看,加盐酸时,增大反应物H+浓度,平衡向正反应方向进行,加氢氧化钠时中和H+,减小反应物H+的浓度,平衡向逆反应方向进行,故两种操作刚好使得电子转移方向相反,故检流计的指针偏转方向相反.(3)加盐酸时,总反应向右进行,故C1上I-失电子生成I2,C2上AsO3-4得电子生成AsO3-3.(4)加氢氧化钠时,总反应向左进行,故I2得电子生成I-, AsO3-3失电子生成AsO3-4.解(1)形成了原电池,将化学能转化为电能.(2)该反应是一个可逆反应,加盐酸时,增大反应物H+浓度,平衡向正反应方向进行;加氢氧化钠时中和H+,减小反应物H+的浓度,平衡向逆反应方向进行.(3)C1:2I--2e-=I2,C2:AsO3-4+2e-+2H+= AsO3-3+H2O(4)C1:I2 +2e-=2I-,C2:AsO3-3-2e-+H2O= AsO3-4+2H+例3实验室制备氯气的方法之一是常用MnO2和浓度为12mol·L-1的浓HCl反应,而不用MnO2和浓度为1mol·L-1的稀HCl反应?请用电极电位说明理由.分析不仅酸、碱、盐之间进行离子互换反应是有条件的,同样地,氧化剂与还原剂之间的反应也是有条件的.条件是:⑴φ氧-φ还>0 反应向右进行⑵φ氧-φ还<0 反应向左进行⑶φ氧-φ还=0 反应达到平衡若氧化剂与还原剂的电位相差较大(一般大于0.2V)的情况下,可以用标准电极电位直接来判断.但是如果氧化剂与还原剂的电位相差较小(一般小于0.2V)时,由于溶液的浓度或酸度改变,均可引起电位的变化,从而可使反应方向改变.在这种情况下,必须算出非标准情况下的电位,然后才能进行判断.解MnO2与HCl的反应MnO2+4HCl=MnCl2+Cl2↑+2H2O 当HCl浓度为lmol·L-1时,按标准电极电位判断反应方向:MnO2+4H++2e-Mn2++2H2O φ○—=1.23VCl 2+2e-2Cl-φ○— =1.36V因为E ○— =φ○— (MnO 2/Mn 2+) -φ○—( Cl 2/ Cl -)=1.23V -1.36V=-0.13V<0,故MnO 2与lmol·l -1的稀HCl 不会发生反应. 当HCI 浓度为12mol·L-1的浓HCl时,[H +]=12mol·L -1.若 [Mn 2+]=lmol·L -1,此时氧化剂的电位为 φ(MnO 2/Mn 2+)=φ○—(MnO2/Mn 2+)+0.05912 lg [H +]4[Mn 2+]=1.23V+0.05912V lg124=1.38V当用12mol·L-1盐酸时,其[Cl -]=12mol·L -1.若p Cl 2=101.3kPa,此时还原剂的电位为 φ(Cl 2/Cl -)=φ○—(Cl 2/Cl -)+0.05912 lg p Cl 2[Cl -]2=1.36V+0.05912 Vlg 1122 =1.296V因为E=φ(MnO 2/Mn 2+)-φ(Cl 2/Cl -)=1.38V -1.296V=0.084V>0,所以MnO 2与浓HCl 反应就变成可以进行. 注意:①只有当两个电对的E ○— 值相差较小时,才能比较容易地通过改变溶液的酸度来改变反应的方向.受溶解度的限制,酸度的变化也是有限制的,不能认为酸度改变时一定能使原来不能进行的反应变得可以实现.②当用MnO 2与12mol·L -1浓盐酸反应时,不能利用标准电极电位来直接判断反应进行的方向,否则会得出相反的结论.用E ○— 判断结果与实际反应方向发生矛盾的原因在于:盐酸不是1mol·L -1,Cl 2分压也不一定是101.3kPa,加热也会改变电极电势的数值.由于化学反应常在非标准状态下进行,所以就应算出非标准状态下的电极电位,然后才能进行判断.例4 (2002) 镅(Am)是一种用途广泛的锕系元素.241Am 的放射性强度是镭的3倍,在我国各地商场里常常可见到241Am 骨密度测定仪,检测人体是否缺钙:用241Am 制作的烟雾监测元件已广泛用于我国各地建筑物的火警报警器(制作火警报警器的1片241Am 我国批发价仅10元左右).镅在酸性水溶液里的氧化态和标准电极电势(E/V)如下,图中2.62是Am 4+/Am 3+的标准电极电势,-2.07是Am 3+/Am 的标准电极电势,等等.一般而言,发生自发的氧化还原反应的条件是氧化剂的标准电极电势大于还原剂的标准电极电势.试判断金属镅溶于过量稀盐酸溶液后将以什么离子形态存在.简述理由.附:E (H +/H 2)=0V;E (Cl 2/Cl -)=1.36V ;E (O 2/H 2O)=1.23V . 【答案】要点1:E (Am n +/Am)<0, 因此Am 可与稀盐酸反应放出氢气转化为Am n +,n =2,3,4;但E (Am 3+/Am 2+)<0,Am 2+一旦生成可继续与H +反应转化为Am 3+.(1分)(或答:E (Am 3+/Am)<0,n =3)要点2:E (Am 4+/Am 3+)>E (AmO 2+/Am 4+), 因此一旦生成的Am 4+会自发歧化为AmO 2+和Am 3+.(2分)要点3:AmO 2+是强氧化剂,一旦生成足以将水氧化为O 2, 或将Cl -氧化为Cl 2,转化为Am 3+, 也不能稳定存在.(1分)相反AmO 2+是弱还原剂, 在此条件下不能被氧化为AmO 22+.要点4:Am 3+不会发生歧化(原理同上),可稳定存在.(1分)结论:镅溶于稀盐酸得到的稳定形态为Am 3+.练习题1.阿波罗宇宙飞船上,使用的是氢氧燃料电池,其电池反应为: 2H 2+ O 2→2H 2O,介质为75%的KOH 溶液.请用方程式填充.(1)电池的正极反应: ; (2)电池的负极反应: . 2.(1995江苏浙江)已知蓄电池在放电时起原电池的作用,充电时起电解他的作用.铅蓄电池在放电和充电时发生的化学反应可用下式表示:Pb +PbO 2+2H 2SO 42PbSO 4+2H 2O据此判断下列叙述中正确的是A. 放电时铅蓄电池负极的电极反应为: PbO 2+4H ++SO 42-十2e =PbSO 4+2H 2OB. 充电时铅蓄电池阴极的电极反应为;PbSO 4+2e -=Pb 2++SO 42-C. 用铅蓄电池来电解CuSO 4溶液,要生成1.6克Cu,电池内部要消耗0.05摩H2SO4D. 铅蓄电池充电时,若要使3.03千克PbSO4转变为Pb和PbO2,需通过20摩电子3.(2001北京)镍镉充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是: Cd+2OH--2e=Cd(OH)22NiO(OH)+2H2O+2e=2Ni(OH)2+2OH-下列说法不正确的是A. 电池放电时,负极周围溶液的pH不断增大B. 电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2C. 电池充电时,镉元素被还原D. 电池充电时,电池的正极和电源的正极相连接4.(2003)下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被隔开的电解质为Na2S2和NaBr3,放电后,分别为Na2S4和NaBr.①左、右储罐中的电解质分别是________.②写出电池充电时,阳极和阴极的电极反应.③写出电池充、放电的反应方程式.④指出在充电过程中钠离子通过膜的流向.5.(2001)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.回答如下问题:①以丁烷代表汽油,这个电池放电时发生的化学反应的化学方程式是____________________.②这个电池的正极发生的反应是_________;负极发生的反应是__________________;固体电解质里的O2-的移动方向是___________________;向外电路释放电子的电极是_________________.③人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是___________.④你认为ZrO2晶体里掺杂Y2O3用Y3+代替晶体里部分Zr4+对提高固体电解质的导电能力起什么作用?其可能的原因是什么?⑤汽油燃料电池最大的障碍是氧化反应不完全产生__________堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命.6.(1992)金属纳和金属铅的2︰5(摩尔比)的合金可以部分地溶解于液态氨,得到深绿色的溶液A,残留的固体是铅,溶解的成分和残留的成分的质量比为9.44︰1,溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+和NH2-)外只存在一种阳离子和一种阴离子(不考虑溶剂合,即氨合的成分),而且它们的个数比是4︰1,阳离子只带一个电荷.通电电解,在阳极上析出铅,在阴极上析出钠.用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2的液氨溶液来滴定溶液A,达到等当点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出.回答下列问题:(1)写出溶液A中的电解质的化学式;(2)写出上述滴定反应的配平的离子方程式;(3)已知用于滴定的碘化铅的浓度为0.009854mol/L,达到等当点时消耗掉碘化铅溶液21.03毫升,问共析出金属铅多少克?附:铅的原子量207.2;钠的原子量22.99.练习题答案1. (1)正极反应:O2+2H2O+4e-=4OH-(2)负极反应:2H2+4OH--4e-=4H2O2. B C3. A4.解析:蓄电池的放电、充电过程就是电解质的氧化还原反应过程.氧化还原反应的实质是电子的转移,表现形式则是元素化合价的变化:化合价升高,发生氧化反应,该反应发生在电池的负极;相反化合价降低,发生还原反应,发生这一反应的是电池的正极.因此,只要找出电池放电前后元素化合价的变化,该题所有设问都会得以解答.由题给信息可知:电池放电时,电解质Na 2S 2→Na 2S 4,NaBr 3→NaBr ,其中S 元素的平均化合价由-1→-1/2, Br 元素的平均化合价由 -1/3→-1.由此可见,电池放电时,S 元素化合价升高,被氧化,是电池的负极;Br 元素化合价降低,被还原,是电池的正极.故第1问答案左边储罐(跟正极相连)中的电解质是NaBr 3和NaBr,右边储罐(跟负极相连)中的电解质是Na 2S 2和Na 2S 4.充电是放电的逆过程,是将放电时的还原产物NaBr 重新氧化为NaBr 3,将氧化产物Na 2S 4还原为Na 2S 2的过程.故第2问中阳极反应为:3NaBr -2e -= NaBr 3+2Na +, 阴极反应为:Na 2S 4+2Na ++2e -=2Na 2S 2. 第3问的充、放电反应方程式是第2问中两电极反应的和:2Na 2S 2+NaBr 3=Na 2S 4+3NaBr.从第2问的电极反应可知,充电时,阳极(左边)反应产生了“多余”的Na +,而阴极(右边)反应中则需要Na +,所以第4问中Na +的流动方向是从离子选择性膜的左边流向右边.第4问也可以这样理解:充电过程中,电池在外加电场的作用下,左边的电压高于右边,而Na +带正电荷,必然要从高电势的位置流向低电势的位置.答案 ①左:NaBr 3/NaBr(1分;只写一种也可)右:Na 2S 2/Na 2S 4(1分;只写一种也可)②阳极:3NaBr -2e -=NaBr 3+2Na +(1分) 阴极:Na 2S 4+2Na ++2e -=2Na 2S 2(1分)③2Na 2S 2+NaBr 3Na 2S 2+ NaBr 3Na 2S 4+NaBr 3Na 2S 4+3NaBr(1分) ④Na +的流向为从左到右.(1分)5. 解析:该题以燃料电池为载体,考查电池反应方程式和电极反应式的书写,电池内部电解质中离子的移动方向和外电路中电子移动方向的判断,燃料电池的优点和汽油燃料电池的工艺缺点等.第1问要求写出汽油燃料电池放电时的化学反应方程式,燃料电池的制作原理就是燃料气体被氧化剂氧化而发生了氧化还原反应,故该问化学反应方程式为:2C 4H 10+13O 2====8CO 2+10H 2O.第2问要求写出电池正负极的反应式.因为放电时,电池正极发生还原反应(元素化合价降低),负极发生氧化反应.所以正极反应式是:O 2+4e-===2O 2-(或13O 2+52e -===26O 2-),负极反应式是:C 4H 10+13O 2-—26e -===4CO 2+5H 2O(或2C 4H 10+26O 2-—52e -===8CO 2+10H 2O).由上述电池正、负极反应式可以看出:正极反应“源源不断”地产生O 2-,负极反应要持续进行,则需要“持续不断”的O 2-供应,故电池内O 2-的移动方向是由正极流向负极.电池的负极发生氧化反应,失掉电子,故外电路电子从负极流出.第3问考查了燃料电池的优点.燃料电池是将燃料燃烧反应所产生的化学能直接转化为电能的“能量转化器”,其能量转化率很高,可达70%以上,而内燃机的能量转化率较低.故该问答案为“燃料电池具有较高的能量转化率”.第4问要求参赛选手依据电荷守恒原理,得出掺有Y 2O 3的ZrO 2晶体中O 2-减少了,致使晶体中O 2-缺陷,从而使其在电场作用下向负极移动.故该问答案为:“为维持电荷平衡,晶体中的O 2-将减少,从而使O 2-得以在电场作用下向负极(或阳极)移动.”第5问的答案在题中已给出暗示,“氧化反应不完全”即汽油不完全燃烧.含碳化合物不完全燃烧的固体产物是碳,故第5问是“碳”堵塞了电极的气体通道. 答案① 2C 4H 10+13O 2=8 CO 2+10H 2O (1分) (必须配平;所有系数除2等方程式均应按正确论.) ② O 2+4e -=2 O 2– (2分)(O 2取其他系数且方程式配平也给满分.)C 4H 10+13O 2– –26e -=4 CO 2+5 H 2O(2分)(系数加倍也满分.)向负极移动;(1分;答向阳极移动或向通入汽油蒸气的电极移动也得满分.)负极.(1分;答阳极或通入汽油蒸气的电极也得满分)。
高中化学电极电势计算方法与原理

高中化学电极电势计算方法与原理化学电势是化学反应发生时产生的电能与电荷之间的关系。
在化学反应中,电子的转移会引起电势的变化,而电极电势则是用来描述这种变化的物理量。
在高中化学学习中,电极电势的计算是一个重要的考点。
本文将介绍电极电势的计算方法与原理,并通过具体的例子来说明。
一、电极电势的计算方法电极电势的计算方法主要有两种:标准电极电势法和Nernst方程法。
1. 标准电极电势法标准电极电势是指在标准状态下,电极与溶液中的氢离子浓度为1mol/L时的电极电势。
标准电极电势可以通过测量电池的电动势来确定。
在标准电极电势法中,电极电势的计算公式为:E°cell = E°cathode - E°anode其中,E°cell为电池的标准电动势,E°cathode为还原电极的标准电极电势,E°anode为氧化电极的标准电极电势。
举例说明:计算以下电池的标准电动势。
Cu(s) | Cu2+(aq, 0.1M) || Ag+(aq, 0.01M) | Ag(s)根据标准电极电势表,Cu2+/Cu的标准电极电势为0.34V,Ag+/Ag的标准电极电势为0.80V。
代入计算公式:E°cell = 0.80V - 0.34V = 0.46V因此,该电池的标准电动势为0.46V。
2. Nernst方程法Nernst方程是用来计算非标准电极电势的方法。
根据Nernst方程,非标准电极电势的计算公式为:Ecell = E°cell - (RT/nF) * ln(Q)其中,Ecell为非标准电极电势,E°cell为标准电极电势,R为理想气体常数,T为温度(单位为开尔文),n为电子转移数,F为法拉第常数,Q为反应物浓度的乘积与生成物浓度的乘积的比值。
举例说明:计算以下电池在25°C下的电动势。
Zn(s) | Zn2+(aq, 0.1M) || Cu2+(aq, 0.01M) | Cu(s)根据标准电极电势表,Zn2+/Zn的标准电极电势为-0.76V,Cu2+/Cu的标准电极电势为0.34V。
基础化学教学课件:9.3 电极电势

原电池及电极电势
结合具体案例和实验数据
电极电势的计算方法 电池设计的基本原则 电极电势在实际应用中的运用
原电池在能源领域中的应用
能源转换和环保技术
通过对其原理的深入理解,我们可 不断探索和优化能源利用方式,为 环保事业贡献力量。
原电池的基本概念
电极电势的应用也涉及社会责任意识。 科技的发展 不仅要追求经济效益,更要考虑其对环境 和社会的影响。
1. 电极电势的产生 把金属浸入其盐溶液时,会出现两种倾向: ① 金属表面的原子以离子形式进入溶液; ② 溶液中的金属离子沉积在金属表面上。
金属的电极电势
电极电势
1. 电极电势的产生 金属表面带电
靠近金属附近的溶液带相反电荷 产生在金属和它的盐溶液之间的电势就 叫做金属的电极电势。
金属的电极电势
标准氢电极
电极电势
电极电势
原电池的工作原理
氧化反应
电子传递
离子迁移
原电池将化学能转化为电能,为我们提供 了便捷的能量来源。
电极电势的概念
电极电势
• 描述电极上发生的 氧化还原反应趋势 的物理量。
反映了电极上电子的活动能力,即电子从电 极上逸出的难易程度。
电极材料的性质
电极电势的大小
电解质溶液的组成
温度
电极电势
在298.15 K
用标准氢电极与其他各种标准状态下的电极组 成原电池,从而得到各种电极的标准电极电势。
实际应用中的重要作用
电极电势应用
电极电势在判断氧化还原反应的方向和程度方面具有重要意义。
电极电势的大小
判断一个氧化还原反应是否能够自发进行 反应的速率和程度
理解化学反应的本质和预测反应结果具有重要意义
正负电极电势高低高中化学

正负电极电势高低高中化学
正极电势高,电场线由正极指向负极,沿电场线方向电势是降低的。
电场线是为了直观形象地描述电场分布而在电场中引入的一些
假想的曲线。
曲线上每一点的切线方向和该点电场强度的方向一致;曲线密集的地方场强,稀疏的地方场强弱。
电池正极比电池负极的电势要高,高出的数值就是电池的电压通过什么判断的啊。
可是电源内电流是从负极到正极,如果电势随电流方向逐渐减弱,负极岂不是比正极高。
电源内电流是从负极到正极,是由于电池中的化学能的作用,发电机的话,是机械能的作用,是有别的能量参与进来了,别的能量对电势产生了提升作用,所以,电池两端,正极比负极的电势高假设地球存在一个大磁场。
而天上飞机切割磁导线,如果电流是从左机翼到右机翼,电势是哪一边高,什么原因啊。
根据右手定则判断,切割磁力线导致电势不一样呀,这个跟发电机是一样的。
高中化学电极电势的Nernst方程解析

高中化学电极电势的Nernst方程解析在高中化学学习中,电极电势是一个重要的概念。
了解电极电势的计算方法对于理解电化学反应、电解质溶液的性质以及电池的工作原理都非常有帮助。
在这篇文章中,我们将重点解析电极电势的计算方法,即Nernst方程,并通过具体的题目来说明其应用。
Nernst方程是描述电极电势与溶液中物质浓度之间关系的数学公式。
它的一般形式为:E = E0 - (RT/nF) * ln(Q)其中,E表示电极电势,E0表示标准电极电势,R表示气体常数,T表示温度(单位为开尔文),n表示电子转移数,F表示法拉第常数,Q表示反应物浓度的乘积与生成物浓度的乘积的比值。
下面我们通过几个具体的题目来说明Nernst方程的应用。
题目1:计算在25℃下,铁电极的电势,已知标准电极电势为0.44V,铁离子浓度为0.1mol/L,铁离子的还原反应为Fe3+ + 3e- -> Fe。
解析:根据Nernst方程,我们可以得到:E = E0 - (RT/nF) * ln(Q)代入已知条件,可以得到:E = 0.44V - (8.314 J/(mol·K) * 298 K / (3 * 96485 C/mol) * ln(0.1) ≈ 0.44V -0.059V * ln(0.1) ≈ 0.44V - 0.059V * (-2.303) ≈ 0.44V + 0.136V ≈ 0.576V所以,在25℃下,铁电极的电势约为0.576V。
通过这个例题,我们可以看到Nernst方程的计算步骤:首先根据已知条件确定各个参数的值,然后代入公式进行计算。
题目2:在298K下,已知氢电极的标准电极电势为0V,氢离子浓度为1.0mol/L,求氢电极的电势。
解析:同样地,我们可以利用Nernst方程来计算氢电极的电势:E = E0 - (RT/nF) * ln(Q)代入已知条件,可以得到:E = 0V - (8.314 J/(mol·K) * 298 K / (2 * 96485 C/mol) * ln(1.0) ≈ 0V - 0.059V *ln(1.0) ≈ 0V - 0 ≈ 0V所以,在298K下,氢电极的电势为0V。
电化学热力学一——电极电势与电化学势

(1) : n1S1 (2) : nl Sl
ni Si ne nm Sm
njS j njS j
nk S k
n p S p ne
因此将各种各样的氧化还原反应拆成这种形式后, 我们可以发现有许多的半反应 都是重复的, 因此我们希望对这些经常出现的半反应进行总结,这样再出现新的 氧化还原反应时, 我们就可以利用原来的结果来预期一些事情了。那么如何做到 这一点呢?物理化学家们想到了一个绝妙的办法,那就是——化学势。 先说说什么是化学势。有一个非常大的体系,它的 total gibbs free energy 为 G。当在其中新添加其中的一个物种时,G 单位变化的量。用数学公式标出来可 能更清楚一些:
r Gm 2 f Gm ( HCl ) f Gm ( H 2 ) f Gm (Cl2 ) ( HCl ) 为 HCl 的生成 Gibbs free energy。在各类化学手册当中都可以查 其中 f Gm
阅得到。根据热力学,体系对外界做的最大功就是 Gibbs free energy,而由于反
应转移 2 电子,因此根据热力学,有: r Gm nFE 。而这个 E 就称为反应的
“标准电极电势”。 当反应不是在标准情况下发生时, 那么 r Gm nFE 一样成立。 不过这时就称为反应的“电极电势”。 我们都知道电化学反应实际上就是氧化还原反应,有电子的实际得失。因此 我们可以将任何一个电化学反应分成两个半反应: (1)生成电子的(2)消耗电 子的。通式为:
i ( I ) i (II ) 。和原来的形式一样了。
我们得到了电化学势之后, 下面我们就给出半电极的电极电势表达式。下面 以 Cu(M )
Cu 2 (aq) 2e (M ) 为例。根据上面给出的反应的电极电势,我们先
新课标高中化学人教版选择性必修123册化学天地〖电极电势的测定〗

电极电势的测定我们现在还无法测定金属与盐溶液之间电极电势的绝对值,只能选用某种电极作为标准,其他电极与之比较,求得电极电势的相对值。
通常采用标准氢电极作为比较的标准。
标准氢电极(如图4-8)是这样构成的:在铂片上镀一层蓬松的铂黑,把它放入c(H+)为1 mo/g的硫酸中,在25℃时,不断地通入压强为100 o/g的硫酸之间所产生的电势差叫做标准氢电极的电极电势,规定它为零。
图4-8 标准氢电极示意图为了测定金属的标准电极电势,可以把某种金属放入它的离子浓度为1 mo/g的盐溶液中,并跟标准氢电极构成原电池。
测定这个原电池的电动势,就可以求得这种金属的标准电极电势,常用φ错误!表示。
几种常见电极的标准电极电势列于表4-1中。
表4-1 常见电极的标准电极电势(25 ℃)电极(氧化态/还原态)电极过程φ错误!/VLi+/Li Li++e-Li-3045K+/K K++e-K-2924Ca2+/Ca Ca2++2e-Ca-276Na+/Na Na++e-Na-27109Mg2+/Mg Mg2++2e-Mg-2375φ错误!值的大小标志着还原态物质在溶液中失去电子转变为氧化态物质的难易程度。
φ错误!值越负,说明该电对中还原态物质失电子的能力越强,是强还原剂,其对应的氧化态物质氧化能力越弱;φ错误!值越正,说明该电对中氧化态物质得电子的能力越强,是强氧化剂,其对应的还原态物质还原能力越弱。
表中物质Li是最强的还原剂,F2是最强的氧化剂。
氧化还原反应总是在得电子本领强的氧化剂和失电子本领强的还原剂间发生,换言之,较强的氧化剂和较强的还原剂相互反应而生成较弱的还原剂和较弱的氧化剂。
因此,利用电极电势可以判断氧化还原反应进行的方向。
从在标准电极电势表上的位置来看,右上方的还原剂跟左下方的氧化剂能自发地发生氧化还原反应。
例如,判断Sn2++2Fe3+=Sn4++2Fe2+的反应能否自发地向右进行时,我们发现Sn2+是还原剂,Fe3+是氧化剂,查表得:Sn4++2e-Sn2+φ错误!=+015 VFe3++e-Fe2+φ错误!=+0770 V电极电势代数值小的电对中的还原态物质是较强的还原剂,而电极电势代数值大的电对中的氧化态物质是较强的氧化剂,所以反应可以进行。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例: E Ө B / V
0.88 O2 ———— HO2- ———— OH-
0.40
( 1 )计算说明 H2O2 在酸性介质中氧化性的强弱, 在碱性介质中还原性的强弱。
( 2 )计算说明 H2O2 在酸性介质中和碱性介质中的 稳定性的强弱。
( 3 )计算 H2O 的离子积常数 Kw 。 ( 0.86 10-14 )
从碘元素的碱式图中,可以进一步看出在 pH = 14 的条件下,将电离出两个氢离子,以 H3IO62- 形式存在。
2 电对的电极电势
例如,下图是酸性体系中碘元素电势图的一部分:
+ 1.14 V
+ 1.45 V
IO3 - ——— HIO ——— I2
可以从图中直接得到 IO3-/ HIO 和 HIO / I2 两个 已知电对的电极电势。现在的问题是,如何求得不相邻的
二 自由能 — 氧化数图
1 自由能 - 氧化数图的做法
在某 pH 下某种元素作图。横坐标为各种氧化数;
纵坐标为由单质分别氧化或还原成各种氧化态时的自由能
rG
Ө m
。 经常用到的是
pH =
0
或
pH =
14 ,它们
对应的分别是 [ H+ ] = 1 moldm-3 和
[OH-] = 1 moldm-3 ,正对应于在酸介质和碱介质中讨
电对 H3IO62 - / I2 EӨ = 0.34 V H3IO62-+ 3 H2O + 7e -=1/2 I2 + 9OH - (1)
rGӨm (1) = - 230 kJ·mol-1
2) 横坐标,氧化数 = 5 ,
电对 IO3 - / I2
EӨ = 0.20 V
IO3 -+3 H2O + 5e-=1/2 I2 + 6 OH -
第5节 图解法讨论电极电势
一 元素电势图
在特定的 pH 条件下,将元素各种氧化数的存在形 式依氧化数降低的顺序从左向右排成一行。用线段将各种 氧化态连接起来,在线段上写出其两端的氧化态所组成的 电对的 EӨ 值。便得到该 pH 下该元素的元素电势图。
经常以 pH = 0 和 pH = 14 两种条件作图,横线 上的 E 值分别表示 EAӨ 和 EBӨ 。
原成各种氧化态时的自由能 rGӨm 。电对中单质为氧化 型时,如横坐标氧化数 = - 1 ,纵坐标为
1/2 I2 + e- = I -
ห้องสมุดไป่ตู้
的
rG
Ө m
,即由单质还原成-1
氧化态时的自由能。电
对中单质为还原型时,如横坐标氧化数 = 5 ,纵坐标为
IO3- + 3 H2O + 5 e- = 1/2 I2 + 6 OH -
IO3-+ 2 H2O
+
4 e-= IO-+ 4 OH-
(a)
rG
Ө m
(a)
rG Өm(a) = rG Өm(2)- rG Өm(3)
斜率的分子为 - [ rGӨm (2)- rGӨm (3)] , 斜率的分子为 - rGӨm (a) 斜率的分母为 5 - 1 = 4 正是 (a) 的电子转移数 z 。
Fe 3 + ———— Fe 2 + ———— Fe
EӨ (右) < EӨ (左) ,将发生逆歧化反应 2 Fe 3 + + Fe = 3 Fe 2 +
0.153 V
0.521 V
Cu2 + ———— Cu+ ———— Cu
EӨ (右) > EӨ(左) ,将有歧化反应发生 2 Cu+ = Cu2 + + Cu
以上关于强弱的结论是相对而言的。真正强的还原
剂,与其氧化型的连线的斜率多是负值。在学习各族元 素的性质时,我们会加深对上述观点的理解。
3 歧化反应
元素电势图中 IO- —+—0—.45—V I2 —+—0—.5—4 VI - EӨ (右) > EӨ (左),即 I 2 将发生歧化反应。
歧化反应和逆歧化反应
的
rG
Ө m
的负值,即由单质氧化成+5
氧化态时的自由
能。
于是得到 5 个坐标点
(-1,-52) (0,0 ) (1,43) (5,97) (7,230)
做出自由能 — 氧化数图。
ΔrGmӨ
碱性介质中碘体系的自由能 —— 氧化数图
2 判断氧化还原性质
图中几条线段的斜率不同,其物理意义不同。考察 线段 IO3 - —— IO - 的斜率 k 。根据对横坐标和纵 坐标的定义及斜率的意义,可以得到斜率 k 的表示式:
考察碘的元素电势图
EAӨ
H5IO6
+1.70
+ 1.14 + 1.45
——— IO3 - ——— HIO ———
V
I2
+ 0.54 ———
I-
EBӨ
+ 0.70
+ 0.14 + 0.45
H3IO62- ——— IO3- ——— IO - ———
V
I2 —+—0.5—4 I -
可以看出:酸中 HIO 不稳定,将发生歧化反应; 碱中 IO - 和 I2 都将发生歧化反应。
I2 + 2 e - = 2 I- ½ I2 + e - = I-
E Ө = 0.54 V E Ө = 0.54 V
不论电极反应的化学计量数是怎样的倍数关系,其电
极电势 EӨ 的值是不变的。但是上面两个电极反应的
ΔrG
Ө m
是不同的,且具有一定的倍数关系。
这种倍数关系可由公式 ΔrG
Ө m
=
zEӨ F
下面是溴的元素电势图
EAӨ /V
BrO4-
—+1.7—6 —
BrO3 - —+1.—49—
+ 1.59 HBrO ———
Br2 —+—1.—07 Br-
EBӨ /V
BrO4 -
+ —0.9—3 —
BrO3-
+ —0.5—4 —
BrO
-
+ —0—.45—
Br2 —1—.07— Br - + 0.52
由于反应 ( 3 ) =( 1 )+ ( 2 ) , 故有
ΔrG mӨ(3)= ΔrG mӨ(1) + ΔrG mӨ(2)
E3Ө =
ΔrG
Ө m
=
zEӨ
F
5E3Ө F = 4E1Ө F E2Ө F
4 E1Ө +E2Ө =
4×1.14 + 1×1.45 = 1.20V
5
5
结论:对于电势图中一般的三种氧化态 A ,B ,C
故,线段 IO3 - —— IO - 的斜率 k 可以表示为
rGӨm (a)
k=
z
= EӨ F
线段的斜率越大,电对的氧化型的氧化性越强;线
段的斜率越小,电对的还原型的还原性越强。
从碘的自由能 — 氧化数图中可以看出,H3 IO6 2 - — — IO3 - 连线的斜率最大,所以电 对 H3IO6 2- / IO3- 的 氧化型 H3IO6 2 - 的氧化性最强;线段 IO3- —— IO - 的斜率最小,所以电对 IO3 - / IO - 的还原型 IO - 的还 原性最强。
EӨ = 0 V
1/2 I2 = 1/2 I2
(4)
rG
Ө m
(4)
=
0
kJ·mol -1
5) 横坐标,氧化数 = - 1 ,
电对 I2 / I -
EӨ = 0.54 V
1/2 I2 + e- = I -
(5)
rG
Ө m
(5)
=
- 52
kJ·mol -1
注意关于纵坐标的规定,纵坐标为由单质分别氧化或还
从下面碘元素电势图中,可以判断高碘酸不是强酸, 因为它在酸介质中以分子态 H5IO6 存在,不发生电离。
1.70
1.14
1.45 0.54
EAӨ /V H5IO6 —— IO3 - —— HIO —— I2 —— I-
0.70
0.14
0.45 0.54
EBӨ /V H3IO62- —— IO3- —— IO - —— I2 —— I -
A ——zE1 —eӨ -1———EӨ 3 B —z—2 e—E-Ө—2 —— C [ z3=( z1 + z2 ) ]e -
有关系式
E Ө = z1E1 Ө + z2E2 Ө z1 + z2
对于若干相关电对,则应有
E Ө = z1E1 Ө + z2E2 Ө + ···+znEn Ө z1+z2+ ···+zn
中的 z 值
来确定。
3 判断某种氧化态的稳定性
考察氯元素的 EBӨ /V 图的一部分:
ClO -
0.40 ——— Cl2
1.36 ———
Cl -
它意味着
ClO-+ H2 O + e - = 1/2 Cl2 +2 OH - EӨ 1 = 0.40 V (1)
1/2 Cl2 + e - = Cl -
EӨ2 = 1.36 V (2)
rGӨm (2) = - 97 kJ·mol-1
(2)
3) 横坐标,氧化数 = 1 ,
电对 IO - / I2
E Ө = 0.45 V
IO-+ H2O+ e- = 1/2 I2 +2OH -
rGӨm (3) = - 43 kJ·mol-1
(3)
4) 横坐标,氧化数 = 0 ,
电对 I2 / I2
IO3 - 和 I2 组成的未知电对的电极电势。
写出两个已知电对和一个未知电对的电极反应 ( 1 ) IO3 -+5 H+ +4 e - = HIO+2 H2 O EӨ1=1.14 V ( 2 ) HIO+ H+ + e - = 1 /2 I2 + H2 O EӨ 2 = 1.45 V ( 3 ) IO3 - +6 H+ +5e - =1 /2 I2 + 3 H2 O EӨ 3 = ?
