SOP-QA-000-R06 审计追踪系统检查记录
操作系统审计检查表

操作系统审计检查表
操作系统审计检查表是用于进行操作系统审计的一种工具,用于记录和检查操作系统的安全性和合规性。
以下是一个操作系统审计检查表的示例,包括一些常见的检查项目:
1. 系统设置和配置:
- 操作系统版本和补丁是否是最新的?
- 是否使用合适的账户和密码策略?
- 是否启用了必要的安全功能,如防火墙、安全日志等?
2. 用户权限和访问控制:
- 是否有强制的身份验证机制?
- 是否限制了用户的访问权限?
- 是否及时删除不再需要的用户账户?
3. 安全日志和事件监控:
- 是否启用了安全日志记录?
- 安全日志是否进行定期审查和监控?
- 是否实施了事件响应和应急处理机制?
4. 文件和目录权限控制:
- 文件和目录的访问权限是否正确设置?
- 关键系统文件是否受到适当的保护?
5. 网络安全配置:
- 是否实施了网络隔离和流量监测?
- 是否对网络通信进行加密和认证?
6. 病毒和恶意软件防护:
- 是否安装了有效的防病毒软件并及时更新?
- 是否有病毒扫描日志和恶意软件检测报告?
以上仅是一个示例,实际的操作系统审计检查表应根据具体的操作系统类型和安全要求进行调整和定制。
重要的是根据组织的需求和相关的法规标准,制定出适合自己的检查项目和操作系统审计控制目标。
SOP支持过程--内审检查表
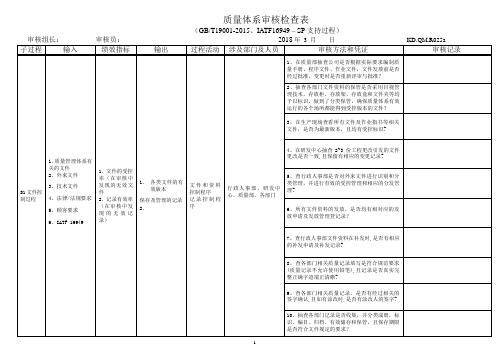
6、检查生产部仓库所有物资是否标识清楚,对有期限规定的物资是否做好了到期记录?
7、在采购部抽查是否对供应商进行选择、评审,填写《供应商基本情况调查评价表》,编制《合格供应商目录》?
8、在采购部查是否对供方进行监视.供应商业绩主要通过以下指标进行监视:交付产品合格率、准时交货率、超额运费、服务(包含处理质量、交货期等问题的及时性)?
1、在质量部抽查公司是否根据实际要求编制质量手册、程序文件、作业文件,文件发放前是否经过批准,变更时是否重新评审与批准?
2、抽查各部门文件资料的保管是否采用目视管理技术,存放柜、存放架、存放盒和文件夹等均予以标识,做到了分类保管,确保质量体系有效运行的各个场所都能得到受控版本的文件?
3。在生产现场查看所有文件及作业指书等相关文件,是否为最新版本,且均有受控标识?
1。监视和测量装置
2.适宜的监视和测量装置
3.校准记录
4。MSA结果
1。监视和测量装置控制程序
2.实验室管理规定
质量部、研发中心、
1。查质量部是:是否建立“监视和测量装置”台帐?针对这些测量装置是否建立“周期检定计划"?且有按计划执行,并保存相关检定记录?
5、经营计划
6、岗位描述
7、法律法规及相关要求
1、培训计划完成率
2、员工流失率
3、员工满意度
1、满足各种岗位需求的员工
2、年度培训计划
行政人事部控制程序
行政人事部、各部门
1、查行政人事部有无公司组织机构图?
2、查行政人事部是否有《岗位说明书》,《岗位说明书》中是否明确工作职责、权限、任职条件、工作关系?
QSA内部品质稽核查核总表

评定人记录 – 实施证据
在工装和量具的设计、制造和全部尺寸测量过程中, 是否 可得到适当的技术资源
如果工装的某些工作被分包, 是否建立了跟踪和监控系 统
供方是否有其它质量体系要求需要在现场进行审核
要素 合同评审
评定人记录
结果
评审
问
题
供方是否对标书、合同或订单进行评审, 以确保所有要求 已被理解并能够满足, 任何出现误解和不一致的情况在 合同或订单接受前已得到解决
克莱斯勒特殊要求
评定人记录
结果
问
题
在产品初始阶段是否使用了克莱斯勒公司产品保证计划 PAP 或
产品质量先期策划和控制计划 APQP
评定人记录 – 实施证据
特殊特性是否用 S、N 、T 和 H 符号进行标识, 并且使用必要的 测量系统进行分析
如果产品制造需要, 供方是否能证明已掌握以下标准的有关知 识 SPF—安全; EPF—排放; NPF—噪音; T—PF 防盗; HPS—9336
评定人记录
结果
4.2.2
问
题
质量体系程序
质量手册的每个要素是否都有足够的程序文件第二层次
支持
评定人记录 – 实施证据
质量策划
质量策划过程是否与质量体系的所有其它要求相一致, 并以适当的型式形成文件, 是否适当考虑了与下列活动 有关的质量体系要素: - 确定并配备所有检验和生产/服务所需的资源
- 承担设计和过程可行性的研究
对于确定为高风显或难于生产的所有产品是否在 12 月或更长时 间进行一次过程认定
对于所有中、低风险的零件, 供方是否执行了过程认定 在建立 C1 之前, 过程认定 PSO 是否完成
是否有证据证明在提交生产件批准程序 PPAP 前, 过程认定 PSO 已得到批准
QM-842-审计记录的管理

目的:建立一个审计记录的管理制度,为公司执行GMP的符合性,找出改进机会,实现持续改进提供依据。
范围:适用于审计记录。
责任:质量管理部经理、QA对本标准的实施负责。
规定:
1审计记录的内容:公司实施GMP审计后,QA负责收集如下资料
1.1《GMP审计的审计年度计划》、《GMP审计实施计划》、《审计记录模板》、《GMP 审计报告》、《GMP审计不符合项报告》、《GMP缺陷项目整改报告》。
1.2审计记录必须按次整理。
2审计记录的管理
2.1 审计记录须按年保存,至少三年。
2.2批检验记录由质量管理部留档保存,不得随意外借和复印,如因需要,需在QA处登记后,提供复印件。
酒店各部门标准与程序文件SOP - 21- 巡查记录程序

1.登记本保持干净,状态完好。
2.当班保安人员一个按照巡逻岗为要求,确保按时巡查酒店各项消防安全设施和重点部位并做好相关记录,对于发现的安全消防隐患应做好记录,立即上报当班保安主管处置解决。
操作程序
一、检查项目
二、巡查楼层次数
三、抽查楼层次数
四、焦糊味
五、浓烟雾
六、灭火器泄露
七、灭火器被动用八、消防栓水九、应急灯不亮十、紧急出口灯熄
十一、防火门不闭合
十二、温感、烟感报警系统
十三、电梯
十四、客房门
十五、员工违纪
药品色谱检测中的数据完整性问题探讨

·医药论坛·药品色谱检测中的数据完整性问题探讨沈丽欢(上海华测品创医学检测有限公司 上海 201112)摘要 当前药品色谱检测中的数据完整性问题主要包括计算机化系统的访问管理、非合规测试(如单针进样、中止序列)、数据的再处理和手动积分、元数据和审计追踪、超标结果管理等,这些问题可能会影响公司产品质量的可信度,严重的可能导致上市药品的频繁召回。
本文回顾国家药品监督管理局食品药品审核查验中心发布的2017年度、2021年度药品检查工作报告和美国食品药品管理局(FDA)官网近2年公布的警告信中关于药品色谱检测中的数据完整性问题,并讨论了规避上述问题的措施。
关键词 数据完整性计算机化系统色谱检测中图分类号:R951 文献标志码:C 文章编号:1006-1533(2024)03-0059-05引用本文沈丽欢. 药品色谱检测中的数据完整性问题探讨[J]. 上海医药, 2024, 45(3): 59-63.Discussion of data integrity issues in chromatography laboratorySHEN Lihuan[Centre Testing International Pinchuang (Shanghai) Co., Ltd., Shanghai 201112, China] ABSTRACT Currently, data integrity issues in drug chromatography laboratory were mainly classified as access management of computerized systems, testing into non-compliance (such as single needle injection, aborted runs), data reprocessing and manual integration, metadata and audit trail, and managing out of specification results, and so on. The reputationof company’s product quality may suffer significantly, and may cause frequent marketed drugs recalls in serious cases. This article reviews the 2017 and 2021 annual drug inspection work report issued by Center for Food and Drug Inspection of NMPA, and the warning letter published on the official website of the United States Food and Drug Administration (FDA) in the past 2 years pertaining to majority of data integrity issues in drug chromatography laboratory, and discusses measures to avoid these troubles.KEY WORDS data integrity; computerized system; chromatography laboratory在德国工业4.0和我国《中国制造2025》背景下,智能化生产设施、检测设备和与之配套的计算机化系统被逐步应用到制药行业中[1]。
质量管理全新体系内审检查及记录表范本

质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:
质量管理体系内审检查及登记表
编号:BG-8.2-? 页码:。
6-MI0703R06_检查清单
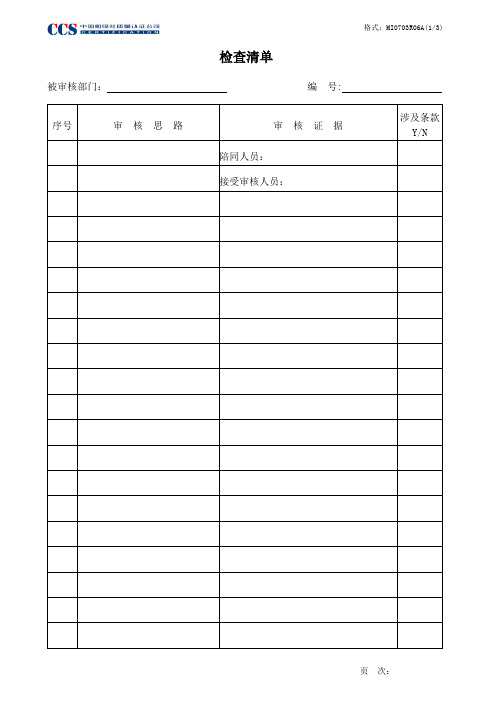
检查清单
被审核部门:编号:
审核员:_____________ 审核组长:
日期:_____________ 日期:
填表说明:
1.该检查清单在审核前由负责审核的审核员编写,审核思路主要反映对某过程或部门如何审核及审核什么,可反映过程的流程包括涉及的活动、职能、相应的质量、环境、职业安全健康控制要求等。
2.编写时应考虑组织的手册和程序文件。
审核环境和职业安全健康管理体系时,重点应明确对过程控制中的重大环境因素的评估及控制的基本过程和方法,危险源辩识/风险评价及不可接受风险的控制计划进行审核的要求,并应考虑法规/法律的要求。
3.审核证据栏主要记录按审核思路收集的客观证据,如抽查的某一名称/日期的记录或观察的某一活动等,记录不必太细,有一定的可追溯性即可,一般不要求将组织的作业参数记录下来,除非存在不合格。
4.根据审核证据在本表右边栏注明涉及的标准条款并作出符合与否的判定。
最新ISO9001、ISO14001、ISO45001三体系管理层内审检查记录(带记录)
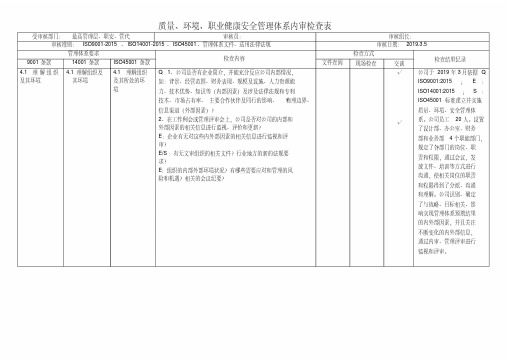
质量、环境、职业健康安全管理体系内审检查表受审核部门:最高管理层、职安、管代审核员:审核组长:审核准则: ISO9001-2015、ISO14001-2015、ISO45001、管理体系文件、适用法律法规审核日期:2019.3.5管理体系要求检查内容检查方式检查结果记录9001条款14001条款ISO45001条款文件查阅现场检查交谈4.1 理解组织及其环境4.1理解组织及其环境4.1 理解组织及其所处的环境Q:1、公司是否有企业简介,并能充分反应公司内部情况,如:背景、经营范围、财务表现、规模及设施、人力资源能力、技术优势、知识等(内部因素)及涉及法律法规和专利技术、市场占有率、主要合作伙伴及同行的影响、物理边界、信息渠道(外部因素)?2、在工作例会或管理评审会上,公司是否对公司的内部和外部因素的相关信息进行监视、评价和更新?E:企业有无对这些内外部因素的相关信息进行监视和评审?E/S:有无文审组织的相关文件?行业地方的新的法规要求?E:组织的内部外部环境状况?有哪些需要应对和管理的风险和机遇?相关的会议纪要?√√公司于2019年3月依据Q:ISO9001:2015;E:ISO14001:2015;S:ISO45001标准建立并实施质量、环境、安全管理体系。
公司员工20人。
设置了设计部、办公室、财务部和业务部4个职能部门,规定了各部门的岗位、职责和权限,通过会议,发放文件、培训等方式进行沟通,使相关岗位的职责和权限得到了分派、沟通和理解。
公司识别、确定了与战略、目标相关、影响实现管理体系预期结果的内外部因素,并且关注不断变化的内外部信息,通过内审、管理评审进行监视和评审。
管理体系要求检查内容检查方式检查结果记录9001条款14001条款ISO45001条款文件查阅现场检查交谈4.2 理解相关方的需求和期望4.2理解相关方的需求和期望4.2 理解员工及其他相关方的需求和期望Q:公司是否收集相关方需求及期望(上级及主要供方及客户) 包括:?顾客对事物的要求,如符合性,价格,安全性?已与顾客或外部供应商达成的合同?行业规范及标准?和社区团体或非政府组织的协议?法规法案?备忘录?许可,执照或其他授权形式?监管机构发布的制度?条约,公约及草案?和公共机构及顾客的协议?组织要求?自愿原则或行为规范?自愿标示或环境承诺?组织契约合同的承担义务E:与QEOH有关的相关方是谁?这些相关方的有关需求和期望有哪些?这些需求和期望中哪些是合规义务?是否具备相关的知识严格执行?有无对这些相关方及其要求的相关信息进行监视和评审?√√通过走访、网络等形式了解相关方的需求,提供了相关方的需求和期望清单:顾客的需求和期望:检测质量符合顾客要求;及时交付;价格合理。
(完整)SAP电子记录审计追踪

审计追踪实现方式1.change document-系统标准自带(1)SD模块举例:查询销售订单的修改记录,通过事务码:VA03进入销售订单界面。
选择订单编号,点击环境>-更改,进入显示凭证更改界面。
位置路径:环境-更改点击按钮,进入订单的更改日志界面,点击记录可查看具体修改信息。
具体修改信息(2)MM模块举例:查询采购订单的修改记录,通过事务码:me23n进入采购订单界面。
点击环境〉—表头更改,进入表头更改记录界面。
选择项目,点击环境>—项目更改,进入项目更改记录界面。
(3)QM模块举例:查询供应商目录更改历史:通过事务码QI03进入供应商目录查询界面。
输入物料,点击确定点击更改凭证,查询更改记录。
点击查看明细.(4)PP模块举例:查询生产版本通过事务码C223进入生产版本查询界面.显示物料更改进入显示更改界面,输入物料编号,点击按钮.进入显示更改—物料概览界面.点击每一行,查看更改明细。
(5)SAP提供标准的报表查看修改记录:通过事务码rsscd100,进入更改查询界面。
输入最后更改人,可以查到相应更改动作。
2。
Change master record –关于主数据变更的记录以PP模块的生产版本为例:(1)申请变更:申请修改主数据,通过事务码CC01进入创建更改主配方界面。
点击按钮或者按回车键,进入下一屏幕,输入更改描述,选择更改起始日,更改原因和更改编号状态。
点击按钮或者按回车键,进入下一屏幕,勾选修改对象。
在任务清单项处打钩,点击对象,选择要修改的物料。
点击按钮,生成变更号.(2)变更执行:通过事务码C202进入更改主配方的界面,输入物料和更改编号.点击按钮,进入变更界面。
变更主配方。
(3)查询变更:通过事务码C261进入查血更改的界面。
点击确定查看变更。
点击查看明细。
3.后台配置-Log Data Change PP模块资源主数据:(1)通过spro进入后台配置界面点击红色框开始配置.选择生产>—基本数据>-物料清单〉-工作中心>—通用数据>-定义工作中心类别。
审计追踪,你需要这样做!

审计追踪,你需要这样做!Audit Trails审计追踪An audit trail is a chronology of the “who, what, when, and why” of a record. It ensures a secure, computer-generated, time-stamped electronic record is available that allows for reconstruction of the course of events relating to the creation, modification, or deletion of an electronic record. For example, the audit trail for an HPLC run could include the user name, date and time of the run, integration parameters used, and details of reprocessing, if any, including the change justification. In addition, as part of reconciliation, the injection log can be included, but this injection log does not include audit trail injection information (blank/system suitability/Lot#) (2).审计跟踪是记录“谁、做什么、何时、为什么”的表,能确保安全受控计算机所⽣成的,时间戳的电⼦记录是能够⽤于重建与电⼦记录的创建、修改或删除有关的事件过程。
例如,HPLC运⾏的审计追踪可以包括,⽤户名,运⾏⽇期以及时间,使⽤的完整的参数记录,再处理过程细节,或,修改理由。
质量体系各部门内审检查表及审核记录

编号:JF—9.2—03序号:
受审部门
管理层
审核时间
2017.6.6
标准
条款
审核内容及方法
审核记录
合格Y
/不合格N
Q:4.1
1)组织在策划管理体系时有无考虑内外部环境的影响?
2)有无对管理体系进行评估?
组织进行了内外部各方面环境因素的识别考虑,并进行了综合评估,确定了体系建设的基本框架和发展策略。
9、公司与外部供方沟通之前是否对相关要求进行了确认?包括采购信息的批准?
10、采购信息是否充分?
11、公司与外部供方沟通信息是否包括:所提供的过程、产品和服务;有无批准:产品和服务;方法、过程和设备;产品和服务的放行等;
12、采购的信息有无能力的要求,包括所要求的人员资质?
13、外部供方与公司的接口是否确定?
管理评审未到计划节点待实施。
Y
Q:10.1
组织有无确定并选择改进机会,是否包括纠正、纠正措施、持续改进、突变、创新和重组。是否用以确定采取措施,以满足顾客要求和增强顾客满意。
策划中的改进是否以满足要求并关注未来的需求和期望?策划是否满足纠正、预防或减少不利影响?是否能改进质量管理体系的绩效和有效性?
Y
Q:9.1.3
1)有无建立数据分析和评价的要求?
2)使用了哪些分析和评价方法?
3)分析和评价的内容包括哪些?是否包括标准和规定的要求?
4)抽查几份分析和评价情况,检查是否完整、充分?
5)能否对持续改进起到作用?
公司制定有数据分析控制程序并按规定进行分析,为质量改进提供依据,如对客户反馈质量问题分析整改,并通过日常过程监控和相关过程目标统计来进行分析和评价,但多数有关记录保存不善,建议后续改进。
内审查检追踪表
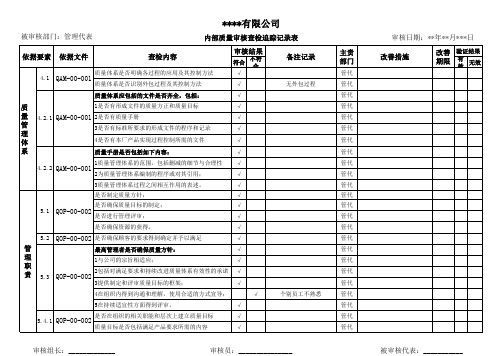
3提供制定和评审质量目标的框架;
√
4在组织内得到沟通和理解,使用合适的方式宣导;
√
5在持续适宜性方面得到评审。
√
是否在组织的相关职能和层次上建立质量目标
√
5.4.1 QOP-00-002
质量目标是否包括满足产品要求所需的内容
√
备注记录
无外包过程
个别员工不熟悉
主责 部门
管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代 管代
√
5.6.3 QOP-00-011
管理评审决议是否被有效执行
√
测
是否策划定期实施内审
√
量 分
8.2.2 QOP-00-011 是否编制内审管理之程序文件
√
析
是否规定了内审的准则、范围、频次和方法
√
备注记录
个别通知无高层审批
主责 部门
管代 管代 管代 管代 管代 管代 管理层 管理层 管代 管代 管代 管代 管代 管代 管代
管代
管代 管代 管代 管代 管代 管代 管代
审核组长:_____________
审核员:_______________
审核日期:2*0*0年9年**1月2月**1*8日日
改善措施
改善 验证结果
期限
有 效
无效
被审核代表:___________
****有限公司
被审核部门:管理代表
内部质量审核查检追踪记录表
依据Байду номын сангаас素 依据文件
查检内容
测
选择的内部审核员是否有资格,且客观和公正
量
内审是否客观公正的实施
质量、环境、职业健康安全管理体系三标一体化内审检查记录

不合格输出的控制
8.7
询问负责人,了解不合格品的控制流程,不合格品的处置方式有哪些?在什么情况下使用?检查不合格品的处理记录,现场检查不合格品的标识和摆放,确认不合格品的控制是否符合要求?
41
应急准备和响应
8.2
8.2
询问负责人,识别的紧急情况有哪些?建立了哪些应急预案?是否充分?现场观察,确认进行了哪些应急准备?配备了哪些应急资源?检查应急演练的相关记录,确认应急演练是否定期实施?应急预案是否得到及时评价和更新?询问现场人员(包括外包方和进入工作场所的人员)是否清楚应急准备和响应的要求?
6
以顾客为关注焦点
5.1.2
询问领导层,确认其通过哪些活动证实其以顾客为关注焦点的领导作用和承诺?
7
方针
5.2
5.2
5.2
检查质量/环境/职业健康安全方针,确认是否得到文件化。询问领导层,管理方针的含义,方针如何在内部外部得到沟通?
8
组织的岗位、职责和权限
5.3
5.3
5.3
查看公司组织架构图,询问管理层,了解公司的部门、岗位设置如何?职责和权限如何得到分派、沟通和理解?询问管理者代表,确认其是否清楚自身的职责。
2
理解员工及相关方需求和期望
4.2
4.2
4.2
询问领导层,与本公司管理体系有关的相关方有哪些?员工和相关方分别有哪些要求?对相关方及其要求的信息是如何监视和评审的?
3
确定管理体系的范围
4.3
4.3
4.3
查看管理体系文件,确认管理体系的边界和范围是否形成文件?是否考虑了各种内外部因素、相关方要求及其产品或服务、与所策划或实施的工作相关的活动等?针对质量管理体系是否存在不适用的条款?若有是否说明理由?是否合理?
数据完整性和可靠性(四):审计追踪

数据完整性和可靠性(四):审计追踪审计追踪(Audit Trail)是这几年很火的一个关键词。
和数据完整性有关的警告信,大多数是因为检查员在审计追踪发现的问题导致。
审计追踪是系统自动记录下来的,电子数据生命周期的脉络,包括系统的建立和变更、方法的建立和变更、数据的产生和变更。
也就是说,审计追踪是电子记录的“观察者”。
打印出来的书面记录(图谱),是电子记录生命周期中,某个时间点的一个“快照”,把信息从电子数据中提取出来,转变为审核人方便的格式和书面形式。
这种提取方法,就是“报告方法”。
报告方法的代表性,是需要确认的。
既然书面记录只是电子记录的一个“快照”,我们就有必要建立电子记录和审核追踪的审核程序,检查那些无法在“快照”中反映的信息。
例如数据安全、重复检测、数据版本、报警信息等等。
因此,数据审核事实上包括三个部分:书面记录的审核、电子记录的审核、审计追踪的审核。
这三个部分,共同满足用户的审核需求。
从审核的方便性而言,目前审核书面记录是最方便的。
书面记录能够提供的信息越多,电子记录和审计追踪需要审核的内容就越少。
企业应当建立数据审核的需求。
例如:审核需求描述 审核方式 审核部门QA 检查频率 检测是否使用正确的仪器参数?书面记录(图谱)QC每季度 积分参数是否正确? 书面记录(图谱)QC每季度 有无重复检测?电子记录 QC每季度 审计追踪是否总是开启?审计追踪 IT ,QC每季度 数据备份是否及时执行?备份时间 IT每季度 …… …… …… ……明确了需求,才有可能建立合适的流程,随后确认流程是否满足需求,对风险进行归类,并定期评价流程性能。
这篇文章,讨论如何统合书面记录审核和电子记录/审计追踪审核、如何对电子记录和审计追踪进行审核,以及审计追踪对于法规当局和企业的意义。
1 合理设定图谱的报告方法减少电子记录和审计追踪的审核需求• 实际仪器参数(温度、流速、流动相比例,等等)和实际积分参数,应当打印出来。
数据完整性之电子记录和审计追踪审核

数据完整性之电子记录和审计追踪审核1. 目的本程序的目的,是建立质量保证(QA)为确保电子记录完整性及原始记录管理而进行的审核。
2. 范围本程序适用于QC实验室仪器产生的电子记录与书面记录一致性和审计追踪的评价。
3. 定义审计追踪:安全的、计算机产生的、有时间印记的电子记录,依据该记录,可以重建作业者进行创建、修订或删除电子记录等活动的事件过程。
计算机化系统:包含硬件、软件、外围装置、人员及文件化。
数据完整性:所有数据在数据生命周期中,完整、一致和准确的程度。
电子原始数据:计算机化系统产生的记录,包含随后处理并随后保存在数字媒介的任何数字编码数据。
电子数据:指文字、图、数据、声音、图标或其他数字形式信息的任何组合,其创建、修订、保存、归档、撷取或分发由计算机系统管制。
原始数据:任何原始记录和文件,以原始产生的格式保存,作为真实复本。
4. 责任4.1. 质量保证(QA)经理4.1.1. 分配QA审查人执行审计追踪的审查。
4.1.2. 在检查结束时,最终审查完成的审计追踪审查检查表单。
4.1.3. 审查第2部分的所有缺失或不一致处,依据SOP,评价整改行动。
4.1.4. 完成最终审查后,在审计追踪审查检查表单上签名和注明日期。
4.2. 质量保证(QA)审查人4.2.1. 每月执行一次电子记录和审计追踪审查。
4.2.2. 依据本程序,完成电子记录和审计追踪的审查。
4.2.3. 检查期间,在电子记录和审计追踪审查检查表单上记录所有发现。
4.2.4. 在第2部分,记录所有缺失或不一致处。
4.2.5. 完成检查后,在电子记录和审计追踪审查检查表单上签名和注明日期。
4.3. IT/系统管理员4.3.1. 依据核准的SOP,为QA审查员分配执行电子记录和审计追踪审查活动所需要的权限。
4.4. QC经理4.4.1. 根据需要,协助QA审查人完成检查。
包括协助在档案夹/下级档案夹和/或计算机系统其它区域查找/获取审计追踪。
