氨基酸的结构与分类氨基酸与多肽
第十七章 氨基酸 多肽和核酸(2hr)

应用:
N N H N NH2 脱羧酶 CH2CHCOOH
NH2 NaOH + H2O 成盐反应 RCHCOONa
OH /Δ RCH2NH2 + CO2 脱羧反应
组氨酸
组胺 (血管舒张剂)
N H
CH2CH2NH2
(二)-NH2的反应:
NH3+ClHCl 成盐反应 RCHCOOH
结构特点: (1)自然界中肽多为链状; (2)在体内,肽以两性离子形式存在; (与氨基酸一样) n≤10 寡肽 (3)n个氨基酸构成n肽 n>10 多肽 (4)肽= N-端 + 氨基酸残基 + C-端 (5)n肽含(n-1)个肽键 (6)氨基酸连接次序不同,有n!个异构体
二、肽的命名
命名原则: N-端
第三节
一、核酸的分类:
1、DNA: 脱氧核糖核酸
核酸
特点: (1)是生物遗传的主要物质基础,承 担体内遗传信息的存贮和发布; (2)主要存在于细胞核染色体内。 2、RNA: 核糖核酸 特点: (1)负责生物体内遗传信息的表达, 直接参与体内蛋白质的合成; (2)主要存在于细胞质中。 (3)有r-RNA、 m-RNA、 t-RNA三种。 (核蛋白) (信使) (转运)
H
N
O
O H
N
H
H OH OH
OH
OH
腺苷酸
O H2N N HO-P-O-CH2 O OH H H
H OH OH
胞苷酸
O
N N
O
HN
O HO-P-O-CH2 OH H
H
HN
O
O H
N
H
H OH OH
鸟苷酸
蛋白质的构件-氨基酸及多肽

氮、碳的运输
氨基酸可作为氮、碳的运输工具,将 氮、碳从细胞质运至线粒体、叶绿体 等细胞器。
多肽在生物体内的功能
激素和生长因子
多肽可以作为激素和生长因子的 活性分子,调节机体的生长发育
、代谢和免疫等生理过程。
细胞间通讯
多肽可以作为神经递质、激素 等细胞间通讯的分子,影响细 胞间的信息交流。
酶抑制剂和激活剂
多肽可以作为酶抑制剂或激活 剂,调节酶的活性,进而影响 代谢过程。
抗病原体和肿瘤
多肽可以作为免疫调节剂,具 有抗病原体和肿瘤的作用。
氨基酸与多肽相互影响在生物体内的功能
合成与分解
蛋白质的构件-氨基 酸及多肽
目 录
• 氨基酸 • 多肽 • 氨基酸与多肽的关系 • 氨基酸与多肽在生物体内的作用
01
CATALOGUE
氨基酸
氨基酸的种类
二十种氨基酸
在生物体内,存在二十种不同种 类的氨基酸,它们是蛋白质的基
本组成单位。
非标准氨基酸
除了二十种标准氨基酸外,还有一 些非标准氨基酸在某些生物体中存 在,如鸟氨酸、同型半胱氨酸等。
不同种类的氨基酸在多肽中的排列顺序和空间构象,决定了多肽的生物活性和功能 。
氨基酸与多肽的功能关系
氨基酸是构成人体组织和器官的 基本物质,参与生命活动的调节
和代谢。
多肽具有多种生物活性,可以作 为信号分子、生长因子、激素等 ,参与细胞生长、分化、代谢等
过程。
某些多肽具有抑制或促进酶活性 、调节免疫反应、抗肿瘤等作用 ,在医药、保健品等领域具有广
THANKS
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
有机化学氨基酸、多肽、蛋白质

6 种异构体 24种异构体
许多种氨基酸按照不同的排列顺序, 构成了自 然界中种类繁多的多肽和蛋白质。
命名多肽时以C-末端的氨基酸残基为母体, 由 N-端叫起, 依次称为某氨酰(基)某氨酸。
O
O
O
H2N CHC NH CH2C NH CHC OH
N-端
CH3
CH2
C-端
丙氨酸残基 甘氨酸残基 苯丙氨酸残基
利用蛋白质分子胶体颗粒大不能透过半透膜 的性质可将蛋白质分离提纯,这种方法称为透析 法(dialysis)。
(三)蛋白质的沉淀和变性
调节蛋白质溶液的pH值至等电点, 再加入适当的脱水剂除去蛋白质分子表 面的水化膜, 可使蛋白质分子聚集而从溶液中沉淀析出。
根据生成紫色化合物颜色的深浅程度,或根据放出
CO2气体的体积,可对 α-氨基酸 进行定量分析。 也常用于层析实验中氨基酸的显色。
第二节 肽肽ຫໍສະໝຸດ 氨基酸残基之间彼此通过酰胺键 (肽键)连 接而成的一类化合物。其通式为:
RO
R’ O
H2N C-C-OH + H N C-C-OH
H
HH
A氨m基ino酸acid
第十四章 氨基酸、蛋白质
第一节 氨基酸
一、氨基酸的分类、命名和构型
氨基酸的结构特点
①都是α-氨基酸(脯氨酸是
α–亚氨基酸); H N
COOH H
R CH COO- 内盐
NH3+
偶极离子
②除甘氨酸外,都是L-氨基酸(左旋);
③各氨基酸侧链R基团不同,氨基酸结构和性质有差异
1、分类
据化学结构:
任何一种蛋白质分子在天然状态下均具有独特 而稳定的构象,这是蛋白质分子在结构上最显著的 特点。为了表示蛋白质分子不同层次的结构,常将 蛋白质分子结构分为一级、二级、三级和四级。一 级结构又称为初级结构或基本结构,二级结构以上 属于构象范畴,称为高级结构。
氨基酸和多肽的关系

氨基酸和多肽的关系氨基酸和多肽是生物体内重要的有机分子,它们之间有着密切的关系。
首先,让我们来了解一下氨基酸的基本结构和功能。
氨基酸是构成蛋白质的基本单元,由氨基基团、羧基、氢原子和一个侧链组成。
氨基酸是生命体的必需物质,通过蛋白质的合成和降解参与了生物体内的各种生化过程。
氨基酸的侧链决定了其特定的性质,使得不同氨基酸在生物体内扮演不同的角色,如赖氨酸、苯丙氨酸等。
多肽是由多个氨基酸残基通过肽键连接而成的生物分子。
当氨基酸通过脱水缩合反应形成肽键时,就形成了多肽。
多肽的长度可以从几个氨基酸残基到几十个甚至上百个氨基酸残基不等。
多肽在生物体内具有多种功能,如携带信号、参与免疫反应、调节生长发育等。
氨基酸和多肽之间的关系主要体现在以下几个方面:氨基酸是构成多肽的基本单元。
多肽是由氨基酸通过肽键连接而成,因此氨基酸是构成多肽的必需物质。
没有氨基酸,就无法形成多肽。
而多肽的结构和性质又取决于构成它的氨基酸种类和顺序。
氨基酸的序列决定了多肽的结构和功能。
在多肽分子中,氨基酸残基的排列顺序是非常重要的。
不同的氨基酸序列可以形成不同的结构,从而决定了多肽的功能。
例如,胰岛素是一种由氨基酸残基组成的多肽激素,其特定的氨基酸序列决定了其在调节血糖水平中的作用。
氨基酸和多肽在生物体内具有重要的生理功能。
氨基酸通过构成蛋白质参与了生物体内的各种生化过程,而多肽则在细胞信号传导、免疫调节、激素作用等方面发挥着重要的作用。
例如,多肽激素如生长激素、胰岛素等对生长发育和代谢有着重要的调节作用。
氨基酸和多肽之间存在着密切的关系。
氨基酸是构成多肽的基本单元,多肽的结构和功能取决于氨基酸的序列。
氨基酸和多肽在生物体内发挥着重要的生理功能,参与了各种生化过程和生命活动。
深入研究氨基酸和多肽之间的关系,有助于我们更好地理解生物体内的生化过程和调节机制,为疾病的治疗和预防提供理论依据。
希望本文能够帮助读者更好地理解氨基酸和多肽在生物体内的重要作用。
第十六章 氨基酸、多肽和蛋白质

OH R CH COOH +N2
+ H2O
若定量测定反应中所释放的N2的体积,即可计算出 氨基酸的含量,此方法称为van Slyke氨基氮测定法,常
用于氨基酸和多肽的定量分析。
第二节 肽
一、肽的结构和命名
肽是氨基酸残基之间彼此通过酰胺键相连而成的一 类化合物。 肽分子中的酰胺键又称为肽键(peptide bond)。 二肽可视为一分子氨基酸中的-COO―与另一分子氨基 酸中的NH3+脱水二成的。肽也是以两性离子的形式存在。
OH
H+
等电点 脱水
OH
H+
- - 带负电荷 脱水
OH
H
+
- - - -
(五)蛋白质的颜色反应 蛋白质分子内含有许多肽键和某些带有特殊基团的 氨基酸残基,可以与不同试剂产生特有的颜色反应,利 用此性质可鉴别蛋白质。
反应名称 试剂 颜色 作用基团 缩二脲反应 强碱、稀硫酸铜溶液 紫色或紫红色 肽键 茚三酮反应 稀茚三酮溶液 蓝紫色 氨基 蛋白黄反应 浓硝酸、再加碱 深黄色或橙红色 苯环 亚硝酰铁氢化钠 亚硝酰铁氢化钠溶液 红色 巯基
(五)氧化脱氨反应 氨基酸中的氨基能被 H2O2 或 KMnO4 等强氧化剂所氧 化,脱氨而生成α―酮酸。
[O]
R CH COOH NH2
R CH COOH + H2O NH
R C COOH + NH3 O
(六)氨基酸与亚硝酸的反应 氨基酸与亚硝酸作用,可定量释放氮气
+ NH3 R CH COO
+ H2NO2
使蛋白质发生沉淀的现象称为盐析(saltingout)。常用
的盐析剂有(NH4)2SO4、Na2SO4、NaCl和MgSO4等。
有机化学氨基酸
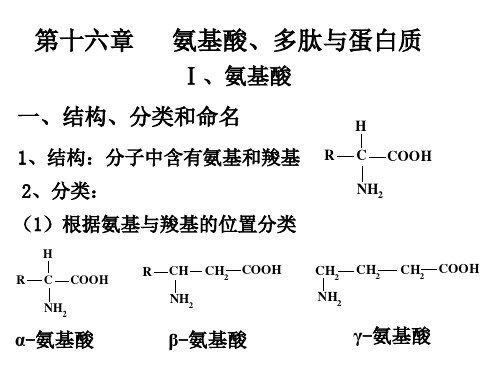
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
氨基酸与多肽

第一节氨基酸与多肽一、氨基酸的结构与分类1.氨基酸是蛋白质的基本单位2.构成人体蛋白质的氨基酸是L-α-氨基酸3.L-α-氨基酸含有不对称碳原子,甘氨酸除外记忆小窍门:甘氨酸,即甜味氨基酸4.氨基酸的分类(1)酸性氨基酸:谷氨酸和天冬氨酸(2)碱性氨基酸:赖、精和组氨酸(3)极性中性氨基酸:丝、苏、谷氨酰胺、天冬酰胺、半胱氨酸(4)非极性疏水性氨基酸:甘、丙、缬、亮、异亮、脯氨酸(5)芳香族氨基酸:苯丙、色、酪二、肽键与肽链肽键:氨基酸的氨基和羧基形成的酰胺键(1)氨基和羧基形成(2)一定程度的双键性质(3)维系蛋白质一级结构的主要力量第二节蛋白质的结构一、一级结构1.一级结构是氨基酸的排列顺序2.肽键是维系一级结构的主要力量。
除此以外,还有二硫键(两个半胱氨酸之间形成二硫键)。
3.蛋白酶水解是使蛋白质的肽键被水解,变成氨基酸残基。
二、二级结构1.二级结构是多肽链主链的空间结构,不涉及侧链2.氢键是维系二级结构的主要力量。
3.代表性结构:α-螺旋,β-折叠,β-转角4.α-螺旋:右手螺旋、3.6个氨基酸一圈、螺距是0.54nm三、三级结构1.三级结构是多肽链所有原子的空间排布2.疏水键、盐键、二硫键、氢键和范德华力量是维系三级结构的主要力量。
四、四级结构1.具有四级结构的蛋白质是有两条或者以上的肽链构成2.每一条肽链都有自己的一、二、三级结构,这条肽链叫做亚基。
3.亚基可以相同,也可以不同4.亚基的立体排布和相互关系叫做四级结构5.由亚基构成的蛋白叫做寡聚蛋白6.独立的亚基没有生物学活性第三节蛋白质的结构和功能的关系一、一级结构与功能的关系1.一级结构是空间构象的基础2.一级结构是功能的基础3.一级结构并不是决定空间构象的唯一因素4.蛋白质的一级结构与分子病镰刀红细胞贫血:一个氨基酸(谷→缬)的差异二、高级结构与功能的关系2.血红蛋白的空间构象变化与结合氧O2与Hb结合后引起Hb构象变化,进而引起蛋白质分子功能改变的现象,称为别构效应。
氨基酸,多肽,蛋白质的关系

氨基酸,多肽,蛋白质的关系
氨基酸是构成蛋白质的基本单元,是一类含有羧基(-COOH)和氨
基(-NH2)的有机分子。
它们通过共价键结合形成多肽,多个多肽之
间再形成蛋白质。
氨基酸在蛋白质中的序列是非常重要的,因为它们决定了蛋白质
的结构和功能。
蛋白质的结构包含着四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是氨基酸序列的线性排列;二级结构
包括α螺旋和β折叠;三级结构是主链的三维摆动,使得氨基酸侧
链在空间上排列成为蛋白质的特定形状;四级结构是由两个或多个链
相互作用而形成的复杂蛋白质结构。
蛋白质的功能非常广泛,包括结构支持、酶催化、信号传导和免
疫保护等。
每个蛋白质的功能都与它的结构密切相关,因此对于蛋白
质的结构和功能的研究非常关键。
一种具有特定功能的蛋白质的序列通常由数百个甚至上千个氨基
酸组成。
不同的氨基酸组成不同的序列,则产生不同的蛋白质结构和
功能。
在人体中,氨基酸可以由体内合成或外源性摄取获得。
不同种类
的氨基酸在人体中的相对含量不同,因此也影响了蛋白质的合成和功能。
总之,氨基酸、多肽和蛋白质之间是密不可分的关系。
氨基酸是
构成蛋白质的基本单元,而多个氨基酸结合形成多肽,多个多肽之间
再形成蛋白质。
蛋白质的序列和结构决定了其功能,因此研究氨基酸、多肽和蛋白质的相互关系对于解决人类健康问题具有重要意义。
“氨基酸+蛋白质”知识总结

致其失活,这是一个不可逆的过程。
(2)盐析:蛋白质溶液中加入某些无机盐溶液,可使蛋
白质析出,形成白色絮状物。兑水稀释后,絮状物消失,在
这个过程中蛋白质结构、理化性质和生物活性不变。
19
Copyright©博看网 . All Rights Reserved.
4. 多种功能:蛋白质是生命活动的主要承担者
功能
举例
结构
肌肉中的肌球蛋白和肌动蛋白等;组蛋白构成染色体
①血红蛋白运输O2和CO2 ②载体蛋白在协助扩散和主动运输中协助物质通过膜
③水通道蛋白与人体体液平衡有关,如肾小球的滤过作用和肾小管的重
吸收作用,都与水通道的结构和功能相关
运输
④离子通道由蛋白质复合物构成,一种离子通道只允许一种离子通过,
二、蛋白质 1. 合成与水解
氨基酸
脱水缩合
肽酶 (彻底水解)
多肽
盘曲折叠
蛋白酶 (初步水解)
蛋白质
(1)合成场所:核糖体 ①游离核糖体合成胞内蛋白; ②附着于内质网上的核糖体合成分泌蛋白。 (2)脱水缩合:相邻氨基酸脱水缩合形成肽键和水。
2. 数量计算
(1)直链肽中肽键数 = 失水数 = 氨基酸数-肽链数
能够调节机体的生命活动
有些蛋白质有免疫功能,如抗体是一种免疫球蛋白,淋巴因子如白介素 免疫
等,可以帮助人体抵御病菌和病毒的侵害
贮藏
种子子叶或胚乳中的贮藏蛋白,主要作用是贮存氨基酸
调节渗透压 血浆蛋白可以维持胶体渗透压
5. 变性与盐析
(1)变性:强酸、强碱、高温、重金属盐等会破坏蛋白
质的空间结构,使蛋白质的空间结构变得伸展、松散,导
(6)氨基酸排列与多肽种类计算:由甲、乙、丙三种氨
氨基酸和多肽的关系

氨基酸和多肽的关系氨基酸是构成蛋白质的基本组成单位,而多肽则是由多个氨基酸残基通过肽键连接而成的链状分子。
它们之间存在着密不可分的关系,氨基酸是多肽的构成要素,而多肽则是蛋白质的组成单元。
氨基酸是有机化合物,它由一个氨基基团、一个羧基基团和一个侧链组成。
在天然氨基酸中,氨基基团和羧基基团都与碳原子结合,形成一个碳骨架。
氨基酸的侧链决定了其特定的物化性质和生物活性。
在自然界中,已经发现了20种常见的氨基酸,它们分别是丙氨酸、甘氨酸、丝氨酸、脯氨酸、酪氨酸、色氨酸、赖氨酸、亮氨酸、异亮氨酸、苏氨酸、酸性氨基酸谷氨酸和天冬氨酸、碱性氨基酸赖氨酸和精氨酸、无极性氨基酸酮氨酸和甲硫氨酸、极性氨基酸谷氨酰胺和天冬酰胺。
这些氨基酸的不同组合和顺序决定了多肽或蛋白质的结构和功能。
多肽是由氨基酸通过肽键连接而成的链状分子。
肽键是由氨基基团和羧基基团之间的反应产生的化学键。
当两个氨基酸通过肽键连接时,其中一个氨基酸的羧基基团与另一个氨基酸的氨基基团反应,释放出一个水分子。
这个反应可以在蛋白质合成过程中重复进行,形成不同长度的多肽链。
多肽的长度可以从几个氨基酸残基到几百个氨基酸残基不等。
当多肽链中的氨基酸数目较少时,多肽通常被称为寡肽,而当氨基酸数目较多时,则被称为多肽。
当多肽的氨基酸残基数目超过100个时,就被称为蛋白质。
多肽的结构和功能取决于其氨基酸序列和空间构象。
氨基酸序列决定了多肽链的线性顺序,而空间构象则决定了多肽的立体结构。
多肽的立体结构可以分为四个级别:一级结构是指多肽链的线性序列,二级结构是指多肽链的局部折叠形式,如α-螺旋和β-折叠,三级结构是指多肽链的整体立体结构,包括各种非共价相互作用,如氢键、离子键和疏水效应,四级结构是指多个多肽链之间的相互作用,形成复合物或聚集体。
多肽具有多种生物活性和功能。
它们可以作为激素、抗体、酶、受体和传递子等生物活性分子。
例如,胰岛素是一种由两个多肽链组成的激素,它调节血糖水平;多肽抗体可以识别和结合特定的抗原,从而参与免疫反应;酶是一种具有催化作用的多肽分子,它可以加速化学反应的速率。
蛋白质的表现形式:小分子肽、多肽与氨基酸

蛋白质的表现形式:小分子肽、多肽与氨基酸小分子肽与多肽都是蛋白质的一种表现形式,肽,就是小分子的蛋白质,无论小分子肽还是多肽,只是是分子量和肽键的组合方式不同.多肽的一种分类.分子量段一般在180--1000之间,也称作小肽,寡肽,低聚肽,或称为活性小分子肽,一般由2--6个氨基酸组成,超过的就称为多肽,氨基酸为50多个以上的多肽称为蛋白质。
与其他肽的区别是,在人体不需消化,即可直接吸收。
氨基酸是蛋白质最小组成单位,由二个氨基酸组成的肽称为二肽,以次类推。
10肽以下称为寡肽,11肽以上称为多肽。
小分子活性肽是介于氨基酸与蛋白质之间一种生化物质,它比蛋白质分子量小,又比氨基酸分子量大,是一个蛋白质的片段。
1、两个以上的氨基酸之间以肽键相连,形成的“氨基酸链”或“氨基酸串”就叫做肽。
其中,10个以上氨基酸组成的肽被称为多肽,而由2至9个氨基酸组成的就叫做寡肽,由2至4个氨基酸组成的就叫做小分子肽或小肽。
多肽与氨基酸的区别与联系结构:氨基酸是组成多肽和蛋白质的基本单位,两个或则两个以上氨基酸组成一个肽链,因此多肽的分子比氨基酸分子大。
什么是多肽多肽是氨基酸以肽键连接在一起而形成的化合物,它也是蛋白质水解的中间产物。
由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。
通常由三个或三个以上氨基酸分子脱水缩合而成的化合物都可以成为叫多肽。
一般人们将多于100个肽键相联接的氨基酸称作蛋白质,3个以上100个以下肽键相联接的氨基酸称作多肽。
由此可见,多肽的本质仍是氨基酸,仍具有氨基酸的一系列作用。
普通的蛋白质材料,如大豆蛋白,如动物蛋白以及类似的有机肥料,在施用后仍要降解为小分子如多肽和氨基酸才能被植物吸收利用。
多肽的分子结构大于氨基酸,这就决定了多肽在吸收时,每次吸收的不仅仅是一个而是多个氨基酸,其吸收利用率大大提高,二是分子结构小于蛋白质,可以不降解而直接吸收。
多肽有什么特点1、多肽的吸收速度很快有人说,多肽的吸收速度像火箭一样快,这是由于其本身的结构所决定的。
剖析氨基酸和多肽的结构与性质

剖析氨基酸和多肽的结构与性质氨基酸和多肽是生物体内重要的有机化合物,它们在生物体内发挥着重要的功能。
本文将剖析氨基酸和多肽的结构与性质,以帮助读者更好地理解它们的作用和重要性。
一、氨基酸的结构与性质氨基酸是构成蛋白质的基本单位,它由氨基(NH2)、羧基(COOH)、一个氢原子和一个侧链组成。
氨基酸的结构可以分为α-氨基酸和β-氨基酸两种。
其中,α-氨基酸是最常见的一种,其氨基和羧基都连接在同一个碳原子上。
氨基酸的性质主要取决于其侧链的性质。
不同的氨基酸具有不同的侧链,因此它们的性质也各不相同。
例如,甘氨酸的侧链是一个甲基(CH3),使其具有疏水性;而赖氨酸的侧链含有五个碳原子,具有亲水性。
这些不同的侧链性质决定了氨基酸在生物体内的功能和作用。
氨基酸可以通过肽键连接形成多肽。
肽键是由氨基酸的羧基与下一个氨基酸的氨基之间的共价键连接而成。
多肽的结构可以分为原生结构、二级结构、三级结构和四级结构。
其中,原生结构是指多肽链上氨基酸的线性排列方式;二级结构是指多肽链上氨基酸的局部空间排列方式;三级结构是指整个多肽链的空间结构;四级结构是指多肽链与其他分子之间的相互作用。
二、多肽的结构与性质多肽是由多个氨基酸通过肽键连接而成的化合物。
多肽的结构和性质与氨基酸有着密切的关系。
多肽的结构可以分为线性结构、环状结构和二级结构。
线性结构是指多肽链上氨基酸的线性排列方式。
线性结构的多肽具有一定的生物活性,如抗菌、抗炎等。
例如,多肽链上的氨基酸序列决定了多肽的生物活性。
在设计新的药物时,可以通过改变多肽链上的氨基酸序列来调节药物的活性。
环状结构是指多肽链上的某些氨基酸通过内部肽键形成环状结构。
环状结构的多肽具有较强的稳定性和生物活性。
例如,环肽是一类具有环状结构的多肽,其稳定性较高,可以在胃酸等恶劣环境中保持其生物活性。
二级结构是指多肽链上氨基酸的局部空间排列方式。
多肽的二级结构主要有α-螺旋和β-折叠两种形式。
α-螺旋是指多肽链上的氨基酸通过氢键形成螺旋状结构;β-折叠是指多肽链上的氨基酸通过氢键形成平行或反平行的折叠结构。
多肽氨基酸知识

多肽氨基酸知识(一)基本氨基酸组成蛋白质的20种氨基酸称为基本氨基酸。
它们中除脯氨酸外都是α-氨基酸,即在α-碳原子上有一个氨基。
基本氨基酸都符合通式,都有单字母和三字母缩写符号。
按照氨基酸的侧链结构,可分为三类:脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
1.脂肪族氨基酸共15种。
侧链只是烃链:Gly, Ala, Val, Leu, Ile后三种带有支链,人体不能合成,是必需氨基酸。
侧链含有羟基:Ser, Thr许多蛋白酶的活性中心含有丝氨酸,它还在蛋白质与糖类及磷酸的结合中起重要作用。
侧链含硫原子:Cys,Met两个半胱氨酸可通过形成二硫键结合成一个胱氨酸。
二硫键对维持蛋白质的高级结构有重要意义。
半胱氨酸也经常出现在蛋白质的活性中心里。
甲硫氨酸的硫原子有时参与形成配位键。
甲硫氨酸可作为通用甲基供体,参与多种分子的甲基化反应。
侧链含有羧基:Asp(D), Glu(E)侧链含酰胺基:Asn(N), Gln(Q)侧链显碱性:Arg(R), Lys(K)2.芳香族氨基酸包括苯丙氨酸(Phe,F)和酪氨酸(Tyr,Y)两种。
酪氨酸是合成甲状腺素的原料。
3.杂环氨基酸包括色氨酸(Trp,W)、组氨酸(His)和脯氨酸(Pro)三种。
其中的色氨酸与芳香族氨基酸都含苯环,都有紫外吸收(280nm)。
所以可通过测量蛋白质的紫外吸收来测定蛋白质的含量。
组氨酸也是碱性氨基酸,但碱性较弱,在生理条件下是否带电与周围内环境有关。
它在活性中心常起传递电荷的作用。
组氨酸能与铁等金属离子配位。
脯氨酸是唯一的仲氨基酸,是α-螺旋的破坏者。
B是指Asx,即Asp或Asn;Z是指Glx,即Glu或Gln。
基本氨基酸也可按侧链极性分类:非极性氨基酸:Ala, Val, Leu, Ile, Met, Phe, Trp, Pro共八种极性不带电荷:Gly, Ser, Thr, Cys, Asn, Gln, Tyr共七种带正电荷:Arg, Lys, His带负电荷:Asp, Glu(二)不常见的蛋白质氨基酸某些蛋白质中含有一些不常见的氨基酸,它们是基本氨基酸在蛋白质合成以后经羟化、羧化、甲基化等修饰衍生而来的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
导机制
作用机制
(1)重组 DNA 技术相关的
1.重组 DNA 技术的概述 概念
(2)基因工程的基本原理
十三、重组 DNA 技术
(1)疾病相关基因的发现
2.基因工程与医学
(2)生物制药 (3)基因诊断
(4)基因治疗
1.癌基因与抑癌基因 十四、癌基因与抑癌基因
2.生长因子
(1)癌基因的概念 (2)抑癌基因的概念 (1)生长因子的概念 (2)生长因子的作用机制
生化机制
1.遗传信息传递概述 中心法则
(1)DNA 生物合成的概念
2.DNA 的生物合成
(2)DNA 的复制过程 (3)逆转录
(4)DNA 的损伤与修复
(1)RNA 生物合成的概念
3.RNA 的生物合成
(2)转录体系的组成及转 录过程
(3)转录后加工过程
(1)蛋白质生物合成的概
念
(2)蛋白质生物合成体系
十六、肝胆生化
1.肝的生物转化作用
(2)生物转化的反应类型 及酶系
(3)影响肝生物转化作用
的因素
2.胆汁酸代谢
(1)胆汁酸的化学
十七、维生素
3.胆色素代谢 1.脂溶性维生素 2.水溶性维生素
(2)胆汁酸的代谢 (3)胆汁酸代谢的调节 (1)游离胆红素和结合胆 红素的性质 (2)胆色素代谢与黄疸 脂溶性维生素的生理功能 及缺乏症 水溶性维生素的生理功能 及缺乏症
——核苷酸
(2)核酸(DNA 和 RNA)
(1)DNA 碱基组成规律
(2)DNA 的一级结构
2.DNA 的结构与功能
(3)DNA 双螺旋结构
(4)DNA 高级结构
二、核酸的结构与功能
(5)DNA 的功能 (1)DNA 变性和复性
3.DNA 理化性质及其应用 (2)核酸杂交
(3)核酸的紫外线吸收
(1)mRNA
和遗传密码 蛋白质生物合成的概述
(3)蛋白质生物合成的基
本过程
(4)蛋白质生物合成与医
学的关系
(1)基因表达及调控的概
念和意义
(2)基因表达的时空性
(3)基因的组成性表达、 1.基因表达调控的概述
诱导与阻遏
(4)基因表达的多级调控
(5)基因表达调控的基本
要素
(1)原核基因表达调控
2.基因表达调控的基本原 (乳糖操纵子)
(4)苯丙氨酸和酪氨酸代
八、核苷酸代谢 九、遗传信息的传递 十、蛋白质生物合成 十一、基因表达调控
谢
(1)两条嘌呤核苷酸合成
途径的原料
(2)嘌呤核苷酸的分解代
1.核苷酸代谢
谢产物 (3)两条嘧啶核苷酸合成
途径的原料
(4)嘧啶核苷酸的分解代
谢产物
(1)核苷酸合成途径的主
2.核苷酸代谢的调节
要调节酶 (2)抗核苷酸代谢药物的
4.RNA 结构与功能
(2)tRNA (3)rRNA
(4)其他 RNA
(1)酶的分子结构与催化
1.酶的催化作用
作用 (2)酶促反应的特点
(3)酶-底物复合物
(1)维生素与辅酶的关系
2.辅酶与酶辅助因子 (2)辅酶作用
三、酶
(3)金属离子作用
(1)Km 和 Vmax 的概念
3.酶促反应动力学
(2)最适 pH 值、最适温
(1)氧化磷酸化的概念
(2)两条呼吸链的组成和
2.氧化磷酸化
排列顺序
(3)ATP 合酶
(4)氧化磷酸化的调节
(1)储能和供能
(2)生物膜的组成成分
1.脂类的生理功能
(3)脂类衍生物的调节作
用
(4)营养必需脂酸
(1)脂肪乳化及消化所需
2.脂类的消化与吸收
酶 (2)甘油一酯合成途径及
乳糜微粒
3.脂肪的合成代谢
(1)水和无机盐
1.血液的化学成分
(2)血浆蛋白质 (3)非蛋白质含氮物质
(4)不含氮的有机化合物
(1)血浆蛋白质的分类
十五、血液生化
2.血浆蛋白质
(2)血浆蛋白质的来源
(3)血浆蛋白质的功能
(1)血红素合成的原料、
3.红细胞的代谢
部位和关键酶 (2)成熟红细胞的代谢特
点
(1)肝生物转化的概念和
特点
7.胆固醇代谢
原料和关键酶 (2)胆固醇合成的调节
(3)胆固醇的转化及去路
(1)血脂及其组成
8.血浆脂蛋白代谢
(2)血浆脂蛋白的分类及 功能
(3)高脂蛋白血症
(1)氨基酸和蛋白质的生
理功能 1.蛋白质的生理功能及营
(2)营养必需氨基酸的概 养作用
念和种类
(3)氮平衡
(1)蛋白酶在消化中的作
2.蛋白质在肠道的消化、 用
(1)合成的部位
七、氨基酸代谢
(2)合成的原料
(3)合成的基本途径
4.脂酸的合成代谢
(1)合成的部位 (2)合成的原料
(1)脂肪动员
(2)脂酸β-氧化的基本
5.脂肪的分解代谢
过程
(3)酮体的生成、利用和
生理意义
(1)甘油磷脂的基本结构
6.甘油磷脂代谢
与分类
(2)合成部位理
(2)真核基因表达调控
(顺式作用元件、反式作
用因子)
1.信号分子
(1)概念 (2)分类
(1)受体分类和作用特点
(2)G 蛋白 2.受体和信号转导分子
(3)蛋白激酶和蛋白磷酸
十二、信号转导
酶
(1)蛋白激酶 A 通路 3.膜受体介导的信号转导
(2)蛋白激酶 C 通路 机制
(3)蛋白酪氨酸激酶通路
4.胞内受体介导的信号转 类固醇激素和甲状腺素的
度和酶浓度
(1)不可逆性抑制
4.抑制剂与激活剂
(2)可逆性抑制
(3)激活剂
5.酶活性的调节 6.核酶
(1)别构调节 (2)共价修饰 (3)酶原激活 (4)同工酶 核酶的概念
五、生物氧化 六、脂类代谢
(1)ATP 循环与高能磷酸
键 1.ATP 与其他高能化合物
(2)ATP 的利用
(3)其他高能磷酸化合物
吸收及腐败作用
(2)氨基酸的吸收
(3)蛋白质的腐败作用
(1)转氨基作用
3.氨基酸的一般代谢 (2)脱氨基作用
(3)α-酮酸的代谢
(1)氨的来源
4.氨的代谢
(2)氨的转运
(3)氨的去路
(1)氨基酸的脱羧基作用
(2)一碳单位的概念、来
5.个别氨基酸的代谢
源、载体和意义 (3)甲硫氨酸循环、SAM、
PAPS
单元
细目
要点
1.氨基酸与多肽
(1)氨基酸的结构与分类 (2)肽键与肽链
(1)一级结构
2.蛋白质的结构
(2)二级结构
一、蛋白质的结构与功能
(3)三级和四级结构 (1)蛋白质一级结构与功
3.蛋白质结构与功能的关 能的关系
系
(2)蛋白质高级结构与功
能的关系
4.蛋白质的理化性质
蛋白质的等电点、沉淀和 变性
1.核酸的基本组成单位 (1)核苷酸分子组成
